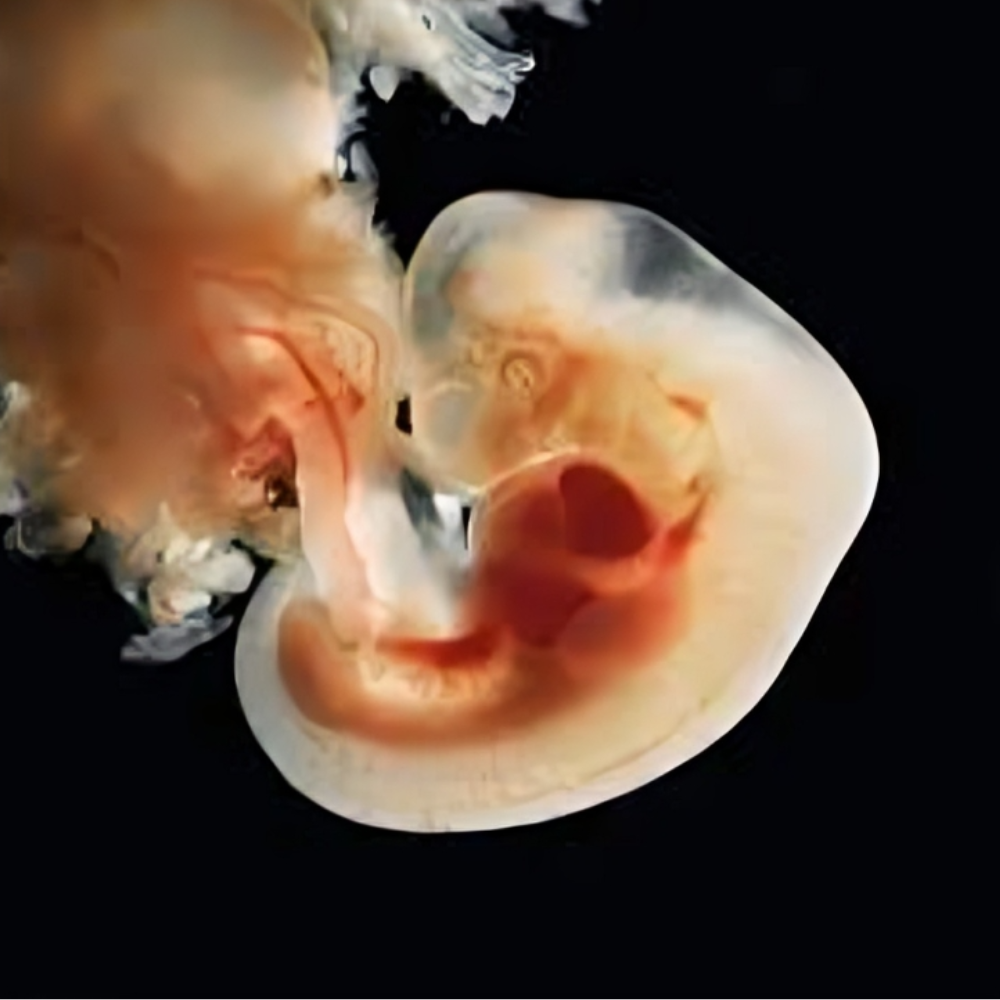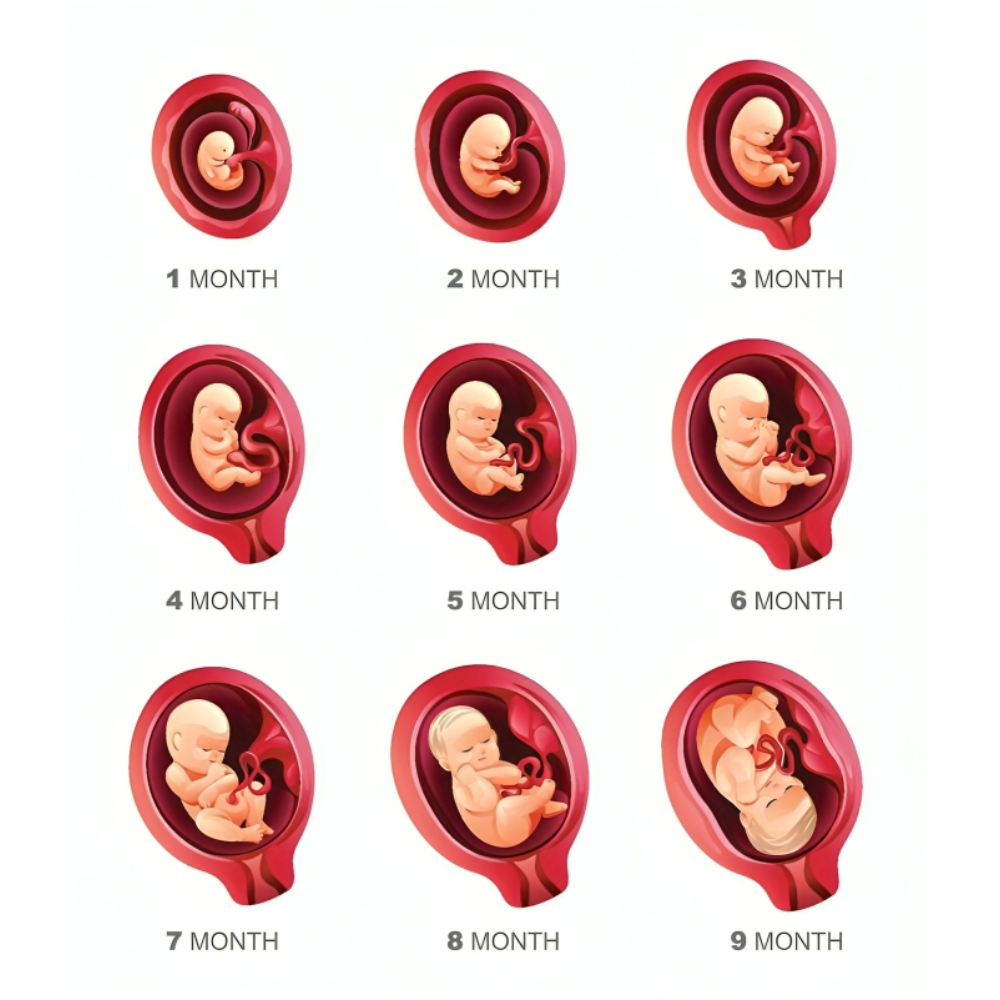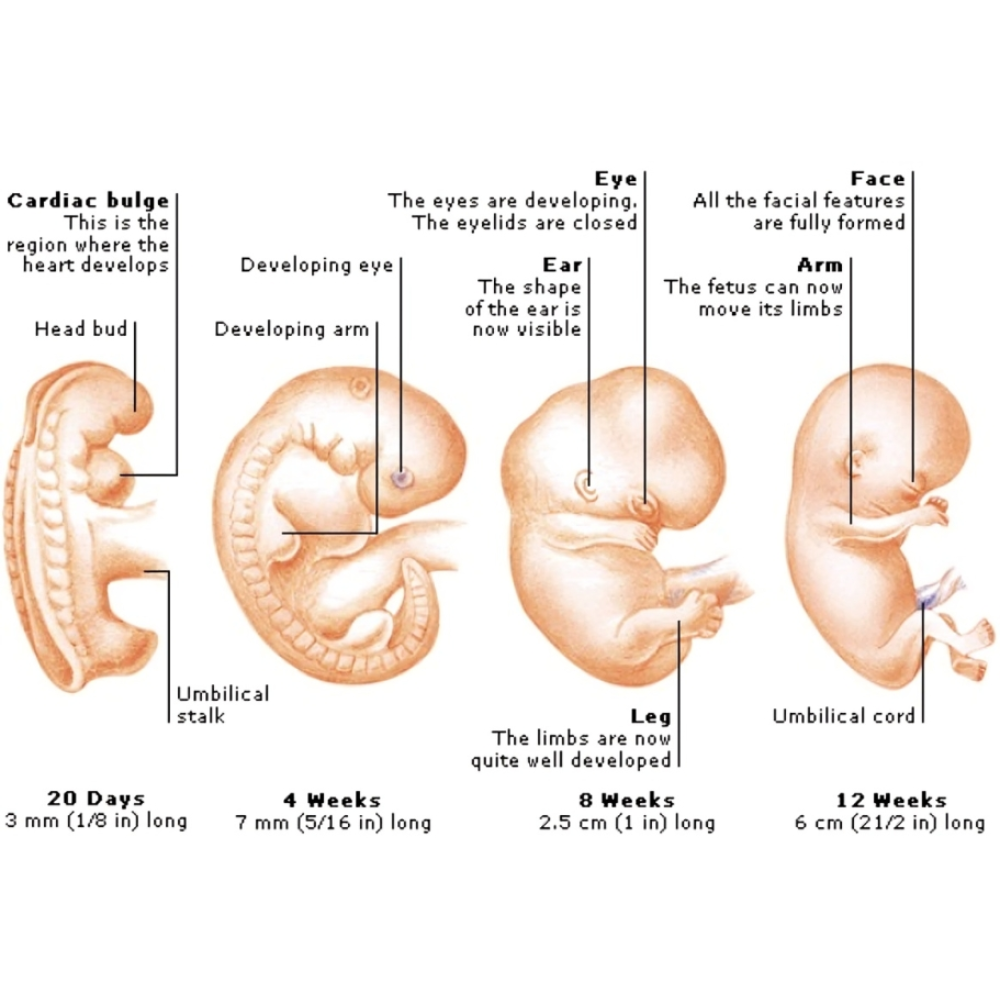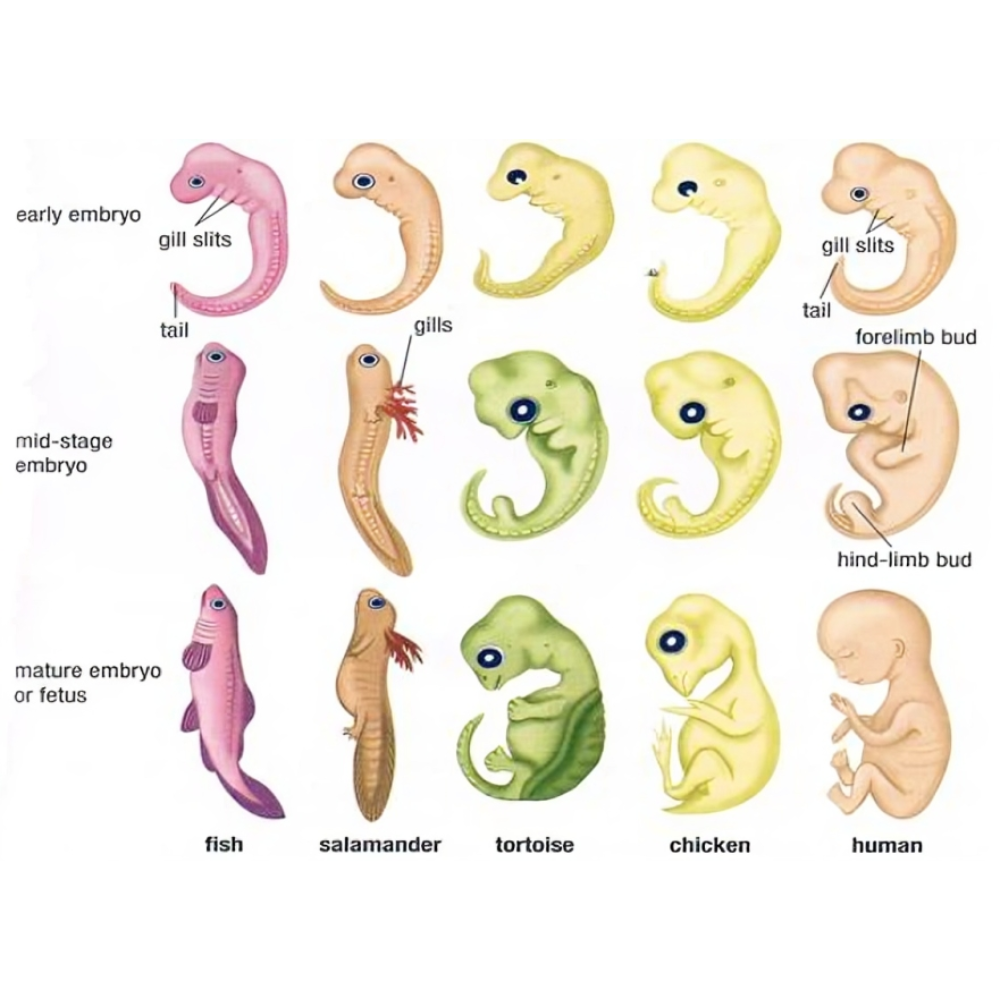
جنین انسان و حیوانات
مقدمه
مطالعه تکوین جنین در انسان و حیوانات یکی از پایهایترین و در عین حال پیچیدهترین زمینههای علوم زیستی و پزشکی به شمار میرود. جنینشناسی نه تنها درک ما از رشد و توسعه موجودات زنده را عمیقتر میکند، بلکه پایهای برای بسیاری از نوآوریهای درمانی، دارویی و پژوهشهای زیستپزشکی فراهم میآورد. فهم دقیق فرآیندهای زیستی که از لقاح آغاز شده و تا تولد ادامه پیدا میکنند، به محققان کمک میکند تا مکانیسمهای بنیادی سلولی، مولکولی و ژنتیکی رشد را شناسایی کنند و اثرات عوامل محیطی، دارویی و تغذیهای را بر کیفیت جنین بررسی کنند.
یکی از جنبههای برجسته و جذاب مطالعه جنین، مقایسه بین جنین انسان و حیوانات مدل است. حیوانات مدل، مانند موش، خوک، گاو، گوسفند و حتی ماهی زبرا، نقش حیاتی در تحقیقات پایه و پیشبالینی دارند. این مدلها امکان بررسی مراحل حساس رشد جنین، تأثیر ژنتیک و اپیژنتیک، و پاسخ به تنشها و مداخلات آزمایشگاهی را فراهم میکنند. هر گونه حیوانی ویژگیها و محدودیتهای خاص خود را دارد که انتخاب مناسب آن برای مطالعه یک موضوع خاص، کلید موفقیت تحقیقات محسوب میشود. به عنوان مثال، موش به دلیل چرخه زندگی کوتاه و شباهتهای ژنتیکی قابل توجه با انسان، یکی از پرکاربردترین مدلها در جنینشناسی محسوب میشود، در حالی که خوک به دلیل شباهتهای فیزیولوژیک با انسان، برای مطالعات ایمپلنتاسیون و تکوین اندامها انتخاب میشود.
اهمیت این مطالعات تنها محدود به تحقیقات پایه نیست؛ بلکه پیامدهای بالینی گستردهای دارند. از فهم بهتر مشکلات ناباروری و بهبود روشهای لقاح آزمایشگاهی، تا تولید جنینهای سالم و کاهش اختلالات اپیژنتیک در نتیجه تکنیکهای پیشرفته مانند IVF و CRISPR، همه از مزایای مطالعه دقیق جنینها و مدلهای حیوانی ناشی میشوند. همچنین، این مطالعات به درک اثرات بلندمدت محیط، تغذیه و سلامت متابولیک مادر بر کیفیت جنین و سلامت نسل بعد کمک میکنند که مستقیماً با مفهوم DOHaD (Developmental Origins of Health and Disease) مرتبط است.
یکی دیگر از جنبههای قابل توجه در این حوزه، توسعه فناوریهای نوین آزمایشگاهی است. فناوریهایی مانند کشت جنین طولانیمدت، تولید ارگانویدها و مدلهای سلول بنیادی، و حتی ایجاد کیمراهای انسان-حیوان، توانایی محققان را در مطالعه مراحل اولیه رشد جنین به شکل بیسابقهای افزایش داده است. با این حال، این پیشرفتها همراه با چالشهای اخلاقی، قانونی و بیولوژیکی هستند که بررسی آنها برای تحقیقات مسئولانه ضروری است.
هدف اصلی این مقاله، ارائه یک مرور جامع و دقیق بر جنین انسان و حیوانات است. در این مقاله، تلاش شده است تا تمامی ابعاد مهم از مراحل اولیه تکوین، مقایسه مدلهای حیوانی، تأثیر محیط و تغذیه، فناوریهای آزمایشگاهی، کریوپرزرویشن، اثرات اپیژنتیک، تا ملاحظات اخلاقی و آینده پژوهش، به صورت یکپارچه و علمی پوشش داده شود. خواننده پس از مطالعه این مقاله، دیدگاهی کامل از چالشها، فرصتها و پیشرفتهای موجود در حوزه جنینشناسی انسان و حیوانات خواهد داشت و پاسخ بسیاری از سوالات تخصصی مرتبط با این موضوع را دریافت خواهد کرد.
در ادامه، مقاله به مراحل اولیه تکوین جنین، از لقاح تا گاسترولاسیون، و تفاوتهای بین گونهها خواهد پرداخت و به تدریج به موضوعات پیچیدهتر مانند تأثیر تکنیکهای آزمایشگاهی و مسائل اخلاقی ورود خواهد کرد. این ساختار باعث میشود که خواننده همزمان با کسب اطلاعات علمی، درکی عملی و کاربردی از موضوع داشته باشد و ارتباط بین تحقیقات پایه و بالینی را به وضوح مشاهده کند.
مروری بر مراحل اولیه تکوین جنین در انسان و حیوانات
تکوین جنین فرآیندی پیچیده و هماهنگ است که از لقاح و تشکیل زیگوت آغاز میشود و شامل مجموعهای از مراحل سلولی، مولکولی و فیزیولوژیک است که در نهایت منجر به شکلگیری یک موجود زنده کامل میشود. این فرآیند در انسان و حیوانات، با وجود شباهتهای اساسی، تفاوتهای قابل توجهی نیز دارد که درک آنها برای تحقیقات پایه و بالینی ضروری است.
لقاح و تشکیل زیگوت
مرحله اولیه تکوین با لقاح آغاز میشود، هنگامی که اسپرم و اووسیت با هم ترکیب میشوند و زیگوت یا سلول تخم تشکیل میشود. این مرحله نه تنها ترکیب ژنتیکی والدین را تضمین میکند، بلکه پایهای برای تمام مراحل بعدی رشد جنین ایجاد میکند. در انسان، لقاح معمولاً در لوله فالوپ رخ میدهد، در حالی که در بسیاری از حیوانات مدل مانند موش، گاو و خوک نیز مکان مشابهی برای وقوع لقاح وجود دارد. با این حال، زمانبندی و مکانیسمهای مولکولی میتوانند متفاوت باشند. به عنوان مثال، در موش تقسیمات سلولی اولیه بسیار سریعتر رخ میدهد و این ویژگی آن را به یک مدل مناسب برای بررسی مراحل ابتدایی تکوین تبدیل میکند.
پس از تشکیل زیگوت، انتقال از مادری به زیگوت (Maternal-to-Zygotic Transition, MZT) رخ میدهد. این فرآیند شامل خاموش شدن موقت پیامرسانهای مادر و فعال شدن ژنوم زیگوت است. در انسان، این انتقال معمولاً در مرحله ۴–۸ سلولی اتفاق میافتد، در حالی که در موش، زبرا فیش و سایر گونهها زمان و ویژگیهای این انتقال متفاوت است. مطالعه MZT اهمیت بالینی و تحقیقاتی بالایی دارد، زیرا اختلال در این مرحله میتواند منجر به توقف رشد جنین یا ایجاد ناهنجاریهای توسعهای شود.
تقسیمات سلولی اولیه و مورفوژنز اولیه
بعد از فعال شدن ژنوم زیگوت، جنین وارد مرحله تقسیمات سلولی سریع و متوالی میشود که به آن کلومیراسیون یا cleavage گفته میشود. این مرحله در انسان به طور معمول شامل تقسیمات سلولی نامتقارن و با نرخ مشخص است که منجر به تشکیل مورولا میشود، یک توده سلولی توپر. در حیوانات مدل مانند موش و خوک، تقسیمات سلولی اولیه نیز مشابه است اما تفاوتهایی در سرعت و نحوه سازماندهی سلولها مشاهده میشود. به طور مثال، در خوک و گاو، سلولها تمایل دارند به شکل دستههای بزرگتر با الگوی تقسیم چندقطبی شکل بگیرند، در حالی که در موش تقسیمات سلولی بسیار منظم و هماهنگ رخ میدهد.
در مرحله بعد، سلولها شروع به سازماندهی و تفکیک به تروپوبلاست و ماس سلولی داخلی (Inner Cell Mass, ICM) میکنند. تروپوبلاست مسئول ایجاد جفت و حمایت تغذیهای جنین است، در حالی که ICM به جنین و اندامهای آن تبدیل میشود. این مرحله در انسان و حیوانات پستاندار اهمیت بالایی دارد، زیرا هرگونه اختلال میتواند منجر به نقص در کاشت جنین یا توسعه غیرطبیعی شود.
گاسترولاسیون و تشکیل سه لایه جنینی
پس از تشکیل بلاستوسیت، جنین وارد مرحله گاسترولاسیون میشود که طی آن سه لایه جنینی اصلی شامل اکتودرم، مزودرم و اندودرم شکل میگیرد. این مرحله، پایه تمامی اندامها و بافتهای بدن را ایجاد میکند و از نظر ژنتیکی و مولکولی بسیار حساس است. در انسان، گاسترولاسیون معمولاً حدود روز ۱۴ پس از لقاح آغاز میشود، در حالی که در موش این فرآیند در روز پنجم رخ میدهد.
مطالعات حیوانی نشان دادهاند که گاسترولاسیون تحت تأثیر عوامل محیطی، تغذیهای و تنشهای اکسیداتیو قرار میگیرد. به عنوان مثال، در مدلهای گاوی و خوکی، کمبود مواد مغذی یا استرس اکسیداتیو میتواند منجر به تشکیل ناقص لایههای جنینی شود، که این یافتهها به درک بهتر اختلالات رشد انسانی کمک میکنند. علاوه بر این، برخی حیوانات مدل مانند ماهی زبرا و شترمرغ، به دلیل شفافیت جنین و دسترسی آسان به مراحل اولیه رشد، امکان مشاهده زنده و آنالیز دقیق فرآیند گاسترولاسیون را فراهم میکنند.
تفاوتهای گونهای و اهمیت مدلهای حیوانی
با وجود شباهتهای ساختاری و فرآیندی، تفاوتهای کلیدی بین جنین انسان و حیوانات مدل وجود دارد که هر محقق باید آنها را مد نظر قرار دهد. سرعت تقسیمات سلولی، زمانبندی انتقال MZT، الگوی تشکیل تروپوبلاست و ICM، و فرآیند گاسترولاسیون از جمله مواردی هستند که بین گونهها متفاوتند. این تفاوتها باعث میشود که انتخاب مدل مناسب برای هر تحقیق، به دقت انجام شود. به عنوان مثال، برای مطالعه اثرات ژنتیکی و اپیژنتیکی، موش به دلیل شباهت ژنتیکی و سرعت تقسیمات سلولی مناسب است، در حالی که برای مطالعات ایمپلنتاسیون و تکوین اندامها، خوک و گاو انتخاب بهتری محسوب میشوند.
همچنین، درک این تفاوتها به توسعه تکنیکهای لقاح آزمایشگاهی، کریوپرزرویشن و کشت جنین کمک میکند. مطالعه مراحل اولیه تکوین در حیوانات، امکان پیشبینی مشکلات بالقوه در جنین انسان و طراحی روشهای بهینه برای حمایت از رشد طبیعی جنین را فراهم میآورد.
جمعبندی مروری بر مراحل اولیه
در مجموع، مراحل اولیه تکوین جنین شامل لقاح، انتقال از مادری به زیگوت، تقسیمات سلولی اولیه، تشکیل بلاستوسیت و گاسترولاسیون است. هر مرحله ویژگیهای خاص خود را دارد و تحت تأثیر عوامل ژنتیکی، محیطی و تغذیهای قرار میگیرد. مقایسه جنین انسان با حیوانات مدل نشان میدهد که در حالی که بسیاری از مکانیسمهای بنیادی مشترک هستند، تفاوتهای گونهای میتوانند نتایج تحقیقات را تحت تأثیر قرار دهند. این شناخت، پایهای برای توسعه روشهای آزمایشگاهی پیشرفته و تحقیقات کاربردی در حوزه جنینشناسی محسوب میشود.
مقایسه جنین انسان با مدلهای حیوانی
مطالعه جنین انسان به دلیل محدودیتهای اخلاقی و قانونی، همواره با چالشهای خاص خود مواجه است. به همین دلیل، حیوانات مدل به عنوان ابزارهای حیاتی برای درک فرآیندهای اولیه تکوین، بررسی اثرات عوامل محیطی و دارویی، و توسعه روشهای درمانی و آزمایشگاهی مورد استفاده قرار میگیرند. با این حال، درک تفاوتها و شباهتهای بین انسان و حیوانات مدل برای طراحی مطالعات دقیق و تفسیر نتایج ضروری است.
موش به عنوان مدل استاندارد
موش یکی از پرکاربردترین مدلهای حیوانی در جنینشناسی و بیولوژی تولیدمثلی است. چرخه زندگی کوتاه، تعداد بالای زاد و شباهتهای ژنتیکی با انسان از جمله دلایل اصلی انتخاب موش برای تحقیقات بنیادی است. مراحل اولیه تکوین در موش، شامل لقاح، تقسیمات سلولی اولیه و گاسترولاسیون، مشابه انسان است، اما سرعت و زمانبندی آنها متفاوت است. به عنوان مثال، انتقال از مادری به زیگوت در موش در مرحله دو سلولی رخ میدهد، در حالی که در انسان در مرحله ۴–۸ سلولی اتفاق میافتد.
مزیت دیگر استفاده از موش، امکان دستکاری ژنتیکی و اپیژنتیکی آن است. تکنیکهای CRISPR و سایر ابزارهای ویرایش ژنوم به محققان اجازه میدهند که نقش ژنهای خاص در تکوین جنین را به دقت بررسی کنند. با این حال، محدودیت موش در تطبیق کامل با ویژگیهای فیزیولوژیک انسان، به ویژه در زمینه اندازه اندامها و زمان توسعه، باعث شده است که مدلهای دیگر نیز مورد استفاده قرار گیرند.
خوک، گاو و گوسفند: مزایا و محدودیتها
حیوانات بزرگتر مانند خوک، گاو و گوسفند به دلیل شباهتهای فیزیولوژیک و آناتومیک با انسان، برای مطالعات مرتبط با ایمپلنتاسیون، تکوین اندامها و تولید مثل استفاده میشوند. جنینهای خوک و گاو از نظر ابعاد، زمانبندی مراحل اولیه و ساختار بلاستوسیت به انسان نزدیکتر هستند، بنابراین مطالعه آنها امکان پیشبینی بهتر اثرات تکنیکهای لقاح آزمایشگاهی و کشت جنین را فراهم میکند.
با این حال، این مدلها محدودیتهایی نیز دارند. چرخه زندگی طولانی، هزینه بالا و نیاز به مراقبت ویژه، انجام آزمایشهای گسترده و طولانیمدت را دشوار میکند. همچنین، برخی تفاوتهای ژنتیکی و مولکولی بین انسان و این گونهها ممکن است نتایج را محدود کند، به ویژه در مطالعه مکانیسمهای مولکولی دقیق تکوین.
ماهی زبرا و شترمرغ به عنوان مدلهای جایگزین
ماهی زبرا به دلیل شفافیت جنین و دسترسی آسان به مراحل اولیه رشد، به یک مدل محبوب برای بررسی فرآیندهای سلولی و مورفولوژیک جنین تبدیل شده است. این ویژگی اجازه میدهد تا تقسیمات سلولی، مهاجرت سلولها و تشکیل بافتها در زمان واقعی مشاهده شود. علاوه بر این، ماهی زبرا برای آزمایش سمیت دارویی و اثرات محیطی، مدل اقتصادی و سریع ارائه میدهد.
شترمرغ نیز به دلیل اندازه بزرگ جنین و دسترسی راحت به تخم، به عنوان یک مدل مناسب برای بررسی فرآیندهای اولیه تکوین، تشکیل اندام و اثرات محیطی مورد استفاده قرار میگیرد. هرچند شترمرغ به انسان نزدیک نیست، اما امکان مشاهده مستقیم مراحل سلولی و دستکاریهای آزمایشگاهی را فراهم میکند.
شباهتها و تفاوتهای کلیدی در تکوین
با وجود شباهتهای کلی، تفاوتهای مهمی بین جنین انسان و حیوانات مدل وجود دارد که باید در تحقیقات در نظر گرفته شود. سرعت تقسیمات سلولی، زمانبندی انتقال از مادری به زیگوت، الگوی تشکیل تروپوبلاست و ماس سلولی داخلی، فرآیند گاسترولاسیون و پاسخ به استرسهای محیطی، از جمله مواردی هستند که بین گونهها متفاوتند. این تفاوتها میتوانند تأثیر مستقیمی بر طراحی مطالعات، انتخاب مدل مناسب و تفسیر نتایج داشته باشند.
به عنوان مثال، در موش، تقسیمات سلولی اولیه بسیار سریع است و تعداد سلولهای بلاستوسیت کمتر از انسان است، در حالی که در خوک و گاو، تعداد سلولها و زمان بلوغ جنینی شبیه انسان است اما دسترسی و مراقبت آنها پیچیدهتر است. ماهی زبرا و شترمرغ، امکان بررسی زنده و مستقیم مراحل اولیه را فراهم میکنند اما از نظر فیزیولوژیک و ژنتیکی به انسان نزدیک نیستند.
اهمیت انتخاب مدل مناسب برای تحقیقات بالینی و پایه
انتخاب مدل حیوانی مناسب بستگی به هدف تحقیق دارد. برای مطالعه مکانیسمهای مولکولی و ژنتیکی، موش به دلیل قابلیت دستکاری ژنوم و سرعت تقسیمات سلولی ایدهآل است. برای بررسی ایمپلنتاسیون، تکوین اندامها و اثرات دارویی طولانیمدت، خوک و گاو گزینههای بهتری هستند. برای مطالعات بیولوژی سلولی و بررسی اثرات محیطی یا دارویی در زمان واقعی، ماهی زبرا و شترمرغ مزیت دارند.
استفاده ترکیبی از مدلهای مختلف، امکان دسترسی به دادههای جامع و قابل اعتماد را فراهم میکند و به محققان اجازه میدهد که مکانیسمهای بنیادی تکوین جنین انسان را با دقت بیشتری شناسایی کنند و در عین حال محدودیتهای هر مدل را نیز در نظر داشته باشند. این رویکرد چندگونهای، پایهای برای توسعه تکنیکهای پیشرفته آزمایشگاهی، بهبود روشهای IVF و درک بهتر اثرات محیطی و اپیژنتیک بر جنین است.
جمعبندی مقایسه جنین انسان با مدلهای حیوانی
در کل، مطالعه جنین انسان بدون استفاده از مدلهای حیوانی تقریباً غیرممکن است. هر مدل حیوانی مزایا و محدودیتهای خاص خود را دارد که باید در طراحی مطالعات و تفسیر نتایج در نظر گرفته شود. موش، خوک، گاو، گوسفند، ماهی زبرا و شترمرغ هر یک ابزارهای ارزشمندی برای بررسی مراحل اولیه تکوین، اثرات ژنتیکی و اپیژنتیکی، پاسخ به استرسهای محیطی و توسعه روشهای درمانی و آزمایشگاهی فراهم میکنند. شناخت دقیق تفاوتها و شباهتها بین گونهها، کلید موفقیت در تحقیقات جنینشناسی و کاربردهای بالینی مرتبط با سلامت نسل بعد و تولید مثل است.
تکنولوژیها و روشهای آزمایشگاهی مرتبط با جنین
پیشرفتهای علمی و فناوری در حوزه جنینشناسی، به ویژه در انسان و حیوانات مدل، امکان بررسی دقیق و کنترلشده مراحل اولیه تکوین را فراهم کرده است. این تکنولوژیها شامل مجموعهای از روشهای پیشرفته آزمایشگاهی هستند که نه تنها به درک بهتر فرآیندهای بنیادی رشد جنین کمک میکنند، بلکه اثرات عوامل محیطی، تغذیهای و دارویی را نیز قابل ارزیابی میسازند.
لقاح آزمایشگاهی و اثرات اپیژنتیک
یکی از مهمترین دستاوردهای علم جنینشناسی، توسعه لقاح آزمایشگاهی (In Vitro Fertilization, IVF) است. این روش شامل استخراج اووسیت از تخمدان، ترکیب آن با اسپرم در شرایط کنترلشده و کشت جنین تا مراحل اولیه است. IVF به محققان و پزشکان اجازه میدهد تا مشکلات ناباروری را بررسی کنند و در بسیاری از موارد منجر به تولد نوزادان سالم شود.
با این حال، مطالعات نشان دادهاند که IVF میتواند باعث تغییرات اپیژنتیک و مولکولی در جنین شود. این تغییرات ممکن است ناشی از شرایط کشت، زمانبندی لقاح، یا حتی دستکاری سلولها باشد. تحقیقات حیوانی، به ویژه در موش و گاو، نشان دادهاند که برخی ژنها در جنینهای کشتشده نسبت به جنینهای طبیعی دچار تغییر بیان میشوند، و این تغییرات میتوانند بر رشد و سلامت طولانیمدت جنین اثرگذار باشند.
کشت طولانیمدت جنین و بهینهسازی شرایط آزمایشگاهی
پس از لقاح، جنین نیاز به محیط کشت مناسب و کنترلشده دارد تا بتواند مراحل اولیه تقسیم و سازماندهی سلولی را با موفقیت پشت سر بگذارد. تکنیکهای کشت طولانیمدت، امکان رشد جنین تا مرحله بلاستوسیت و حتی گاسترولاسیون را در شرایط آزمایشگاهی فراهم میکنند.
شرایط کشت شامل کنترل دقیق دما، pH، اکسیژن، دیاکسیدکربن، و ترکیبات محیطی است. مطالعات نشان دادهاند که حتی تغییرات جزئی در این شرایط میتواند منجر به تغییرات مورفولوژیک و ژنتیکی در جنین شود. به عنوان مثال، محیط کشت با سطح اکسیژن پایینتر، شباهت بیشتری به شرایط طبیعی لوله فالوپ ایجاد میکند و باعث افزایش کیفیت جنین میشود.
تولید جنین پیشکاشتی (Preimplantation) در حیوانات
در حیوانات مدل مانند خوک، گاو و گوسفند، تولید جنین پیشکاشتی یک ابزار مهم برای بررسی مراحل اولیه تکوین است. این تکنیک شامل لقاح در شرایط آزمایشگاهی و کشت جنین تا مرحلهای است که قابلیت ایمپلنت شدن در رحم را پیدا کند. تولید جنین پیشکاشتی نه تنها امکان مطالعه تقسیمات سلولی، تشکیل تروپوبلاست و ماس سلولی داخلی را فراهم میکند، بلکه به بررسی اثرات دارویی و تغذیهای بر کیفیت جنین کمک میکند.
مزیت دیگر استفاده از این تکنیک، امکان ذخیره و انتقال جنینها است که به بررسی طولانیمدت تکوین و اثرات محیطی و ژنتیکی کمک میکند. تحقیقات اخیر نشان دادهاند که جنینهای پیشکاشتی خوک و گاو میتوانند به عنوان مدلهای بسیار نزدیک به انسان در مطالعات ایمپلنتاسیون و اثرات اپیژنتیک استفاده شوند.
روشهای غیرتهاجمی برای ارزیابی کیفیت جنین
در کنار تولید و کشت جنین، ارزیابی کیفیت آن برای افزایش موفقیت لقاح و کاهش خطرات، اهمیت بالایی دارد. تکنیکهای غیرتهاجمی شامل بررسی مورفولوژی، زمانبندی تقسیمات سلولی، فعالیتهای متابولیک و حتی تجزیه و تحلیل مواد خارج سلولی (Extracellular Vesicles) است.
استفاده از این روشها امکان تشخیص جنینهای سالم بدون وارد کردن آسیب فیزیکی یا شیمیایی به آنها را فراهم میکند. تحقیقات نشان دادهاند که جنینهایی که دارای ریتم طبیعی تقسیم سلولی و فعالیت متابولیک مناسب هستند، شانس بیشتری برای ایمپلنت موفق و رشد سالم دارند.
تکنولوژیهای پیشرفته و دستکاری سلولی
در سالهای اخیر، استفاده از مدلهای جنینی سلول بنیادی و ارگانویدها به عنوان ابزار مطالعه تکوین جنین انسان و حیوانات، پیشرفت چشمگیری داشته است. این مدلها امکان بررسی مراحل اولیه بدون نیاز به جنین کامل را فراهم میکنند و میتوانند برای آزمایش اثرات دارویی، استرس اکسیداتیو و تغییرات ژنتیکی استفاده شوند.
علاوه بر این، تکنیکهای ویرایش ژنوم با CRISPR در جنینهای حیوانی و مدلهای سلولی، امکان بررسی نقش ژنها در تقسیم سلولی، گاسترولاسیون و تکوین اندامها را فراهم کرده است. این فناوریها اگرچه همراه با چالشهای اخلاقی و قانونی هستند، پتانسیل تغییر بنیادین در درک ما از جنینشناسی و درمان اختلالات توسعهای را دارند.
جمعبندی تکنولوژیها و روشهای آزمایشگاهی
به طور کلی، پیشرفتهای تکنولوژیک در زمینه جنینشناسی، شامل لقاح آزمایشگاهی، کشت طولانیمدت، تولید جنین پیشکاشتی، ارزیابی غیرتهاجمی کیفیت جنین و استفاده از مدلهای سلول بنیادی و ویرایش ژنوم، امکان بررسی دقیق مراحل اولیه تکوین را فراهم کرده است. این تکنیکها، در کنار مطالعات حیوانی، پایهای برای درک بهتر مکانیسمهای مولکولی و اپیژنتیکی، پیشبینی مشکلات بالقوه در جنین انسان، و توسعه روشهای درمانی و پیشگیری از اختلالات رشد ایجاد میکنند.
چالشهای زیستی و محیطی در تکوین جنین
تکوین جنین فرآیندی بسیار حساس و پیچیده است که تحت تأثیر مجموعهای از عوامل زیستی و محیطی قرار میگیرد. حتی تغییرات کوچک در شرایط داخلی بدن مادر یا محیط کشت آزمایشگاهی میتواند باعث تغییرات ساختاری و عملکردی در جنین شود. درک این چالشها برای پیشبینی مشکلات بالقوه و بهبود سلامت جنین، اهمیت حیاتی دارد.
استرس اکسیداتیو و اثرات آن بر جنین
یکی از مهمترین چالشهای زیستی در طول تکوین، استرس اکسیداتیو است. این وضعیت ناشی از تولید بیش از حد رادیکالهای آزاد و عدم تعادل بین عوامل اکسیدان و آنتیاکسیدانها است. تحقیقات نشان دادهاند که استرس اکسیداتیو میتواند عملکرد اسپرم و اووسیت را کاهش دهد و کیفیت جنین را تحت تأثیر قرار دهد.
در انسان و حیوانات مدل، افزایش سطح رادیکالهای آزاد در محیط کشت یا بدن مادر باعث آسیب به DNA و اختلال در تقسیمات سلولی جنین میشود. برای مقابله با این چالش، استفاده از آنتیاکسیدانها مانند ملاتونین در کشت جنین پیشنهاد شده است. این ماده میتواند اثرات اکسیداتیو را کاهش دهد و شانس بقای جنین را افزایش دهد.
تغذیه مادر و وضعیت متابولیک
وضعیت تغذیهای مادر و سلامت متابولیک نقش مهمی در کیفیت اووسیت و جنین دارد. کمبود مواد مغذی ضروری مانند ویتامینها، اسیدهای چرب و پروتئینها میتواند منجر به کاهش کیفیت سلولهای جنینی و افزایش خطر نقصهای تکوینی شود. مطالعات انجامشده بر روی مدلهای گاو و موش نشان دادهاند که تغذیه نامناسب مادر باعث تغییرات اپیژنتیک در جنین و حتی اثرات بلندمدت بر سلامت نسل بعد میشود، پدیدهای که در چارچوب نظریه DOHaD (Developmental Origins of Health and Disease) توضیح داده میشود.
تنشهای محیطی و دما
شرایط محیطی، از جمله دما و رطوبت، میتوانند بر تکوین جنین تأثیرگذار باشند. افزایش دما یا استرس حرارتی در حیوانات و انسانها باعث اختلال در تقسیمات سلولی و کاهش کیفیت بلاستوسیت میشود. تحقیقات حیوانی نشان دادهاند که حتی تغییرات کوتاهمدت دما در مراحل اولیه میتواند منجر به کاهش نرخ بقا و افزایش اختلالات رشد شود.
مواد شیمیایی و دارویی
تماس با مواد شیمیایی و دارویی میتواند اثرات مهمی بر تکوین جنین داشته باشد. مطالعه بر روی حیوانات مدل مانند موش و ماهی زبرا نشان دادهاند که برخی داروها و سموم محیطی میتوانند منجر به تغییرات ژنتیکی، اپیژنتیکی و مورفولوژیک در جنین شوند. برای مثال، زئارالنون، یک سم طبیعی، اثرات مخربی بر روی گامتها و جنینها داشته است و منجر به اختلالات باروری و رشد ناقص جنین میشود.
استرس فیزیولوژیک و هورمونی مادر
سطح هورمونها و وضعیت استرس فیزیولوژیک مادر نقش کلیدی در موفقیت تکوین جنین دارد. افزایش هورمونهای استرس مانند کورتیزول میتواند باعث کاهش کیفیت اووسیت و اختلال در کاشت جنین شود. همچنین، اختلالات هورمونی در حیوانات مدل و انسان، تأثیرات بلندمدتی بر رشد و سلامت جنین به جا میگذارند.
تأثیر روشهای آزمایشگاهی و کشت جنین
اگرچه تکنیکهای آزمایشگاهی مانند IVF و تولید جنین پیشکاشتی امکانات بیسابقهای برای مطالعه جنین فراهم میکنند، اما خود این روشها نیز چالشهای محیطی ایجاد میکنند. شرایط کشت، نور، اکسیژن، pH و ترکیبات محیطی میتوانند باعث ایجاد استرس در جنین شوند و منجر به تغییرات مورفولوژیک، ژنتیکی و اپیژنتیک شوند. تحقیقات نشان دادهاند که بهینهسازی شرایط کشت، استفاده از سیستمهای بسته و کنترل دقیق پارامترهای محیطی، نقش مهمی در کاهش این استرسها دارد.
اکوسیستم محیطی و ترکیب عوامل متعدد
در واقع، اکثر چالشهای زیستی و محیطی اثرات خود را به صورت ترکیبی و همزمان بر جنین اعمال میکنند. به عنوان مثال، تغذیه نامناسب مادر میتواند استرس اکسیداتیو را افزایش دهد، یا تماس با مواد شیمیایی و تغییرات دما میتواند اثرات اپیژنتیک طولانیمدتی ایجاد کند. بررسی این تعاملات در مدلهای حیوانی، به ویژه موش، گاو و ماهی زبرا، امکان پیشبینی بهتر اثرات محیطی بر جنین انسان را فراهم میکند.
جمعبندی چالشهای زیستی و محیطی
به طور خلاصه، تکوین جنین تحت تأثیر مجموعهای از چالشهای زیستی و محیطی قرار دارد که شامل استرس اکسیداتیو، وضعیت تغذیهای و متابولیک مادر، استرسهای دمایی و محیطی، مواد شیمیایی و دارویی و شرایط کشت آزمایشگاهی میشود. شناخت دقیق این عوامل و تعامل آنها با فرآیندهای تکوینی، پایهای برای بهبود کیفیت جنین، موفقیت روشهای لقاح آزمایشگاهی و پیشگیری از اختلالات رشد در نسل بعد است. استفاده از مدلهای حیوانی و تکنولوژیهای پیشرفته آزمایشگاهی، امکان شناسایی مکانیسمهای بنیادی این چالشها و طراحی راهکارهای عملی برای کاهش اثرات منفی آنها را فراهم میکند.
کریوپرزرویشن و ذخیره جنین و گامتها
کریوپرزرویشن یا ذخیرهسازی منجمد گامتها و جنینها، یکی از پیشرفتهترین تکنیکهای پزشکی و زیستفناوری در حوزه تولیدمثل و تحقیقات جنینشناسی است. این تکنیک به محققان و پزشکان اجازه میدهد تا سلولها و جنینها را برای مدت طولانی حفظ کرده و در زمان مناسب از آنها استفاده کنند، بدون آنکه کیفیت یا توانایی تکثیر آنها به طور قابل توجهی کاهش یابد.
اهمیت کریوپرزرویشن
ذخیرهسازی گامتها و جنینها در پزشکی انسان، مزایای متعددی دارد. برای مثال، در درمان ناباروری با استفاده از IVF، امکان ذخیره اووسیتهای بازیابیشده به بیماران امکان میدهد تا چرخههای بعدی درمان را با موفقیت بیشتری انجام دهند. همچنین، ذخیره جنینها و اسپرمها قبل از درمانهای شیمیدرمانی یا پرتودرمانی، فرصت حفظ باروری برای بیماران سرطانی را فراهم میکند.
در حیوانات، کریوپرزرویشن به حفظ تنوع ژنتیکی، نگهداری نژادهای ارزشمند و تولید مثل برنامهریزیشده کمک میکند. برای مثال، ذخیره اسپرم و جنین در گاو، گوسفند و خوک امکان انتقال ژنها و حفظ نژادهای مرغوب را فراهم میسازد. همچنین، این تکنیک پایهای برای تولید جنین پیشکاشتی و تحقیقات در زمینه اصلاح ژنتیکی و دستکاری ژنوم است.
روشهای کریوپرزرویشن
روشهای اصلی کریوپرزرویشن شامل تدریجی (Slow Freezing) و ویتریفیکاسیون (Vitrification) هستند.
-
تدریجی (Slow Freezing) : در این روش، دما به آرامی کاهش مییابد تا از تشکیل کریستالهای یخ در داخل سلول جلوگیری شود. این تکنیک معمولاً برای جنینها و اووسیتها استفاده میشود و مزیت آن کنترل دقیق بر دما و کاهش آسیب مکانیکی سلول است. با این حال، سرعت پایین فرآیند ممکن است باعث آسیبهای جزئی به غشا و ساختار داخلی سلول شود.
-
ویتریفیکاسیون (Vitrification) : این روش به معنای انجماد سریع سلولها در حضور مواد کریوپروتکتانت است، به گونهای که سلولها بدون تشکیل کریستال یخ به حالت شیشهای تبدیل میشوند. ویتریفیکاسیون در چند سال اخیر به دلیل حفظ بهتر ساختار سلولی، افزایش نرخ بقای جنین و اووسیت و کاهش آسیب DNA، در انسان و حیوانات مدل بسیار مورد توجه قرار گرفته است.
اثرات کریوپرزرویشن بر جنین و گامتها
مطالعات نشان دادهاند که هرچند کریوپرزرویشن امکان ذخیره طولانیمدت را فراهم میکند، اما میتواند برخی اثرات زیستی و مولکولی بر جنین و گامتها داشته باشد. این اثرات شامل تغییرات در ساختار غشای سلولی، استرس اکسیداتیو، آسیب DNA و تغییرات اپیژنتیک هستند.
در انسان و حیوانات، تحقیقات نشان دادهاند که استفاده از ویتریفیکاسیون نسبت به روش تدریجی، باعث کاهش استرس سلولی و حفظ بهتر توانایی تقسیم جنین میشود. با این حال، ترکیبات کریوپروتکتانت و سرعت انجماد و ذوب، نقش مهمی در کاهش آسیبها دارند.
ریسکهای آلودگی و ایمنی
یکی از چالشهای کریوپرزرویشن، خطر آلودگی متقاطع سلولها و جنینها است. استفاده از ظروف باز میتواند باعث انتقال میکروارگانیسمها و آلودگی نمونهها شود. برای کاهش این ریسک، استفاده از سیستمهای بسته و محیطهای کنترلشده توصیه میشود. مطالعات بر روی انسان و حیوانات نشان دادهاند که رعایت پروتکلهای استریل و استفاده از کریوپروتکتانتهای استاندارد، احتمال آلودگی و اثرات منفی بر جنین را به حداقل میرساند.
کاربردهای پیشرفته کریوپرزرویشن
کریوپرزرویشن نه تنها در حفظ باروری و نگهداری ژنها اهمیت دارد، بلکه در تحقیقات علمی نیز کاربرد گسترده دارد. برای مثال، امکان ذخیرهسازی ژنوتایپهای خاص در مدلهای حیوانی، تولید بانکهای جنین و اسپرم برای مطالعات اپیژنتیک و دارویی، و بررسی اثرات طولانیمدت تکنیکهای IVF فراهم میشود.
همچنین، پیشرفتهای اخیر در زمینه ذخیرهسازی سلولهای بنیادی جنینی و مدلهای ارگانویدی امکان بررسی فرآیندهای تکوینی در شرایط طولانیمدت را بدون استفاده مداوم از جنین کامل فراهم کرده است. این پیشرفتها میتوانند نقش مهمی در کاهش نیاز به استفاده مستقیم از جنین انسان و حیوانات داشته باشند و از نظر اخلاقی نیز مزیتهای قابل توجهی ارائه دهند.
جمعبندی کریوپرزرویشن و ذخیره جنین و گامتها
به طور کلی، کریوپرزرویشن یک ابزار کلیدی در حفظ باروری، نگهداری تنوع ژنتیکی و انجام تحقیقات جنینشناسی است. روشهای تدریجی و ویتریفیکاسیون هر یک مزایا و محدودیتهای خاص خود را دارند، و انتخاب روش مناسب بستگی به نوع سلول، مرحله تکوینی و هدف استفاده دارد. رعایت پروتکلهای دقیق، استفاده از سیستمهای بسته و کنترل شرایط محیطی، نقش مهمی در موفقیت ذخیرهسازی و حفظ کیفیت جنین و گامتها دارد. این تکنیکها، پایهای برای توسعه روشهای درمانی، تحقیقات اپیژنتیک و حفظ ژنوم انسانی و حیوانی فراهم میکنند.
پژوهشهای پیشرفته و فناوریهای نوین در حوزه جنین
در سالهای اخیر، پیشرفتهای چشمگیر در علوم زیستی و پزشکی، امکان مطالعه تکوین جنین را با دقت و جزئیات بیسابقه فراهم کرده است. فناوریهای نوین به محققان این امکان را میدهند که نه تنها مراحل اولیه تکوین را در شرایط آزمایشگاهی شبیهسازی کنند، بلکه اثرات عوامل محیطی، ژنتیکی و اپیژنتیکی را نیز بررسی نمایند.
مدلهای حیوانی پیشرفته
استفاده از مدلهای حیوانی همچنان یکی از مهمترین ابزارهای تحقیق در جنینشناسی است. حیواناتی مانند موش، خوک، گاو و ماهی زبرا، ویژگیهای منحصر به فردی برای بررسی جنبههای مختلف تکوین ارائه میدهند.
-
موش: مدل موش به دلیل قابلیت دستکاری ژنتیکی و داشتن چرخه تولیدمثل کوتاه، امکان مطالعه دقیق ژنها و مسیرهای سیگنالینگ در تکوین جنین را فراهم میکند. مطالعات CRISPR و سایر روشهای ویرایش ژنوم، به محققان امکان میدهد که نقش ژنهای مشخص در مراحل اولیه جنین، گاسترولاسیون و ایمپلنتاسیون را شناسایی کنند.
-
خوک و گاو: این مدلها به دلیل شباهت بالای فیزیولوژیک به انسان، به ویژه در مراحل پیشکاشتی و ایمپلنتاسیون، برای مطالعات باروری و اثرات اپیژنتیک استفاده میشوند. تولید جنین پیشکاشتی در خوک و گاو امکان بررسی اثرات محیط کشت و تکنیکهای IVF بر کیفیت جنین را فراهم میکند.
-
ماهی زبرا: ماهی زبرا یک مدل ایدهآل برای بررسی مراحل اولیه جنین و اثرات دارویی و سمشناسی است. ویژگیهای برجسته این مدل شامل شفافیت جنین، سرعت تقسیم سلولی بالا و قابلیت مشاهده مستقیم فرآیندهای تکوینی است. این مدل به ویژه در تحقیقات سمشناسی، تأثیر تغذیه و بررسی اختلالات استخوانی و عصبی کاربرد دارد.
فناوری سلولهای بنیادی و ارگانویدها
پیشرفتهای اخیر در زمینه سلولهای بنیادی انسانی و حیوانی، امکان ایجاد مدلهای جنینی مشتق از سلولهای بنیادی را فراهم کرده است. این مدلها، شامل ارگانویدهای سهبعدی و ساختارهای شبیه جنین، به محققان اجازه میدهند که مراحل اولیه تکوین را بدون نیاز به جنین کامل بررسی کنند.
استفاده از این مدلها مزایای متعددی دارد:
-
امکان بررسی تأثیر داروها، سموم و شرایط محیطی بر مراحل حیاتی جنین
-
شناسایی مسیرهای سیگنالینگ و ژنتیکی کلیدی در تکوین
-
کاهش نیاز به استفاده مستقیم از جنین انسان و حیوانات، که از نظر اخلاقی مزیت بزرگی محسوب میشود
ویرایش ژنوم و فناوریهای CRISPR
یکی دیگر از دستاوردهای برجسته در تحقیقات جنین، استفاده از ویرایش ژنوم با تکنولوژی CRISPR/Cas9 است. این فناوری امکان اصلاح یا غیرفعالسازی ژنهای مشخص در مراحل اولیه جنین را فراهم میکند و به بررسی نقش ژنها در تقسیم سلولی، تمایز بافتها و تشکیل اندامها کمک میکند.
با استفاده از CRISPR در مدلهای حیوانی، پژوهشگران توانستهاند اثرات ژنهای خاص را در رشد و توسعه جنین بررسی کنند و همچنین زمینه مطالعات درمان اختلالات ژنتیکی قبل از تولد را فراهم نمایند. البته، کاربرد این فناوری در جنین انسانی با چالشهای اخلاقی و قانونی همراه است و نیاز به چارچوبهای دقیق قانونی دارد.
مدلهای ارگانویدی و شبیهسازی سهبعدی جنین
مدلهای ارگانویدی، که از سلولهای بنیادی مشتق میشوند، امکان شبیهسازی سهبعدی مراحل اولیه جنین را فراهم میکنند. این مدلها، شبیهسازی دقیق از بافتها و ساختارهای جنینی ارائه میدهند و به محققان امکان مطالعه فرآیندهای توسعه، تکوین اندام و تعامل سلولی را میدهند.
مزیت این مدلها شامل:
-
مشاهده مستقیم فرآیندهای تقسیم، تمایز و مهاجرت سلولی
-
بررسی اثرات استرس محیطی و دارویی بدون ایجاد آسیب به جنین کامل
-
استفاده به عنوان ابزار جایگزین برای مطالعات آزمایشگاهی و کاهش استفاده از حیوانات مدل
پیشرفتها در تکنولوژیهای کشت و ایمپلنتاسیون
فناوریهای نوین کشت جنین، شامل محیطهای کشت پیشرفته، کنترل دقیق اکسیژن، pH و ترکیبات محیطی، امکان رشد طولانیمدت جنین و شبیهسازی مراحل پیشکاشتی و ایمپلنتاسیون را فراهم کردهاند.
علاوه بر این، مطالعات غیرتهاجمی کیفیت جنین با استفاده از تصویربرداری زمان-واقعی، آنالیز متابولیک و بررسی مواد خارج سلولی، بهبود یافته است. این فناوریها باعث شدهاند که شانس موفقیت IVF و دیگر روشهای تولیدمثل افزایش یابد و اثرات منفی تکنیکهای آزمایشگاهی بر جنین کاهش پیدا کند.
تلفیق دادههای زیستی و فناوریهای محاسباتی
پیشرفتهای محاسباتی و بیوانفورماتیک امکان تجزیه و تحلیل دادههای پیچیده ژنتیکی، اپیژنتیکی و متابولیک جنین را فراهم کردهاند. با استفاده از الگوریتمهای یادگیری ماشینی و مدلسازی سهبعدی، پژوهشگران میتوانند مسیرهای تکوینی را پیشبینی کرده و اثرات شرایط محیطی و تکنیکهای آزمایشگاهی بر رشد جنین را شناسایی کنند.
جمعبندی پژوهشهای پیشرفته و فناوریهای نوین
در مجموع، پیشرفتهای علمی و فناوریهای نوین شامل استفاده از مدلهای حیوانی پیشرفته، سلولهای بنیادی، ارگانویدها، ویرایش ژنوم، تکنیکهای پیشرفته کشت و شبیهسازی و تجزیه و تحلیل دادههای زیستی، امکان مطالعه جامع و دقیق تکوین جنین انسان و حیوانات را فراهم کردهاند. این فناوریها، علاوه بر ارتقای درک ما از مراحل اولیه جنین، به توسعه روشهای درمانی، حفظ باروری و پیشگیری از اختلالات ژنتیکی و محیطی کمک میکنند و پایهای برای تحقیقات آینده در این حوزه هستند.
ایمنی، اخلاق و مسائل قانونی در حوزه جنین انسان و حیوانات
مطالعه و دستکاری جنین انسان و حیوانات، همواره با مجموعهای از چالشهای اخلاقی، قانونی و ایمنی همراه بوده است. با پیشرفت فناوریها و امکان ویرایش ژنوم، تولید جنین پیشکاشتی و استفاده از مدلهای ارگانویدی، ضرورت توجه به این جنبهها بیش از پیش احساس میشود.
ایمنی علمی و زیستی
یکی از اصول اولیه در پژوهشهای جنینی، ایمنی علمی و زیستی است. این شامل تضمین سلامت جنین و گامتها، کنترل شرایط آزمایشگاهی و پیشگیری از آلودگی میشود. استفاده از محیطهای کشت کنترلشده، سیستمهای بسته برای کریوپرزرویشن و نظارت دقیق بر شرایط رشد جنین، از مهمترین اقدامات برای کاهش ریسکهای زیستی محسوب میشوند.
همچنین، بررسی اثرات طولانیمدت تکنیکهای آزمایشگاهی، مانند IVF و کریوپرزرویشن، بر کیفیت ژنوم و اپیژنتیک جنین، به پیشگیری از مشکلات احتمالی نسلهای آینده کمک میکند. مطالعات حیوانی نشان دادهاند که حتی تغییرات جزئی در محیط کشت یا شرایط متابولیک میتواند باعث اختلالات رشد، نقصهای ساختاری و تغییرات اپیژنتیک شود. بنابراین، رعایت دقیق استانداردهای علمی و ایمنی، پایهای برای تحقیق مسئولانه است.
مسائل اخلاقی در تحقیقات جنینی
تحقیقات بر روی جنین انسان و استفاده از مدلهای حیوانی، با مسائل اخلاقی خاصی همراه است. جنبههای اخلاقی شامل احترام به حیات جنینی، جلوگیری از آسیب غیرضروری، و محدودیت استفاده از جنین انسانی است.
-
استفاده از جنین انسانی: دستکاری ژنوم، ایجاد ارگانویدهای جنینی و مطالعات پیشکاشتی، همواره نیازمند چارچوبهای اخلاقی مشخص هستند. دستورالعملهای بینالمللی، مانند راهنمای ISSCR برای تحقیقات جنینی و سلولهای بنیادی، محدودیتهایی برای مدت زمان رشد جنین و شرایط استفاده تعیین میکنند.
-
پژوهشهای روی حیوانات: استفاده از حیوانات مدل برای شبیهسازی فرآیندهای جنینی باید بر اساس اصول سه R باشد: Replacement (جایگزینی)، Reduction (کاهش تعداد حیوانات) و Refinement (بهبود شرایط رفاهی). این اصول تضمین میکنند که حیوانات با کمترین آسیب و بیشترین بهرهوری علمی مورد استفاده قرار گیرند.
-
جنینهای ترکیبی و کایمریک: پژوهش بر روی چنین جنینهایی که دارای ترکیبی از سلولهای انسانی و حیوانی هستند، مسائل اخلاقی پیچیدهتری ایجاد میکند. از جمله نگرانیها میتوان به هویت سلولی، احتمال رشد مغز یا اندامهای انسانی در حیوانات، و پیامدهای اجتماعی و اخلاقی این تحقیقات اشاره کرد.
مسائل قانونی و مقررات بینالمللی
تجربه جهانی نشان داده است که بدون چارچوب قانونی مناسب، پیشرفت علمی میتواند با خطرات جدی همراه شود. کشورها قوانین مختلفی برای تحقیقات جنینی، تولید مثل کمکی و ذخیرهسازی گامتها و جنینها وضع کردهاند.
-
مدت زمان رشد جنین: در بسیاری از کشورها، رشد جنین انسانی در آزمایشگاه محدود به ۱۴ روز است، که به عنوان مرز قانونی و اخلاقی شناخته میشود. این محدودیت به دلیل تشکیل نوتوچورد و آغاز شکلگیری سیستم عصبی مرکزی تعیین شده است.
-
مجوزها و کنترلهای آزمایشگاهی: پژوهشگران ملزم به دریافت مجوزهای خاص از نهادهای قانونی و اخلاقی هستند و استفاده از جنین انسانی یا حیوانی بدون رعایت این مجوزها غیرقانونی است.
-
حفظ حریم خصوصی و اطلاعات ژنتیکی: ذخیرهسازی ژنوم و دادههای جنینی باید با رعایت اصول حفظ حریم خصوصی و اخلاق زیستی انجام شود، به ویژه زمانی که اطلاعات ژنتیکی فرد یا خانواده در معرض قرار میگیرد.
تکنولوژیهای نوین و چالشهای اخلاقی و قانونی
با ورود فناوریهای نوینی مانند ویرایش ژنوم، ارگانویدهای جنینی و مدلهای سهبعدی مشتق از سلولهای بنیادی، مسائل اخلاقی و قانونی پیچیدهتر شدهاند. این فناوریها مزایای علمی فراوان دارند، اما ممکن است سوالات حقوقی و اجتماعی جدی ایجاد کنند، از جمله:
-
امکان ایجاد تغییرات ژنتیکی دائمی در نسلهای بعد
-
احتمال استفاده تجاری یا نظامی از فناوریهای جنینی
-
ایجاد تعارض بین پیشرفت علمی و اصول اخلاقی
بنابراین، همکاری میان پژوهشگران، نهادهای قانونی، bioethicists و جامعه عمومی، برای توسعه چارچوبهای اخلاقی و قانونی منعطف و جامع ضروری است.
جمعبندی ایمنی، اخلاق و مسائل قانونی
مطالعه جنین انسان و حیوانات با فرصتهای علمی بینظیری همراه است، اما بدون رعایت اصول ایمنی، اخلاقی و قانونی، میتواند پیامدهای جدی به دنبال داشته باشد. رعایت استانداردهای آزمایشگاهی، استفاده از مدلهای جایگزین، نظارت دقیق بر تکنیکهای نوین و تدوین چارچوبهای قانونی شفاف، پایهای برای پیشرفت مسئولانه در این حوزه است. توجه همزمان به سلامت جنین، رفاه حیوانات و احترام به حیات انسانی، تضمین میکند که تحقیقات علمی در مسیر درست و پایدار حرکت کند.
نتایج و پیامدهای پژوهشی و بالینی مرتبط با جنین انسان و حیوانات
تحقیقات گسترده در حوزه جنین انسان و حیوانات، دستاوردهای علمی چشمگیری داشتهاند که نه تنها درک ما از فرآیندهای تکوینی را افزایش دادهاند، بلکه کاربردهای بالینی متعددی در حوزه باروری، درمان اختلالات ژنتیکی و پیشگیری از بیماریهای مادرزادی ایجاد کردهاند.
نتایج پژوهشی
مطالعات پیشرفته بر روی جنین انسان و حیوانات مدل، اطلاعات گستردهای درباره مراحل اولیه تکوین، تمایز سلولی، سیگنالینگ مولکولی و تعامل بافتها فراهم کردهاند. به طور مشخص، تحقیقات نشان دادهاند که:
-
تکوین پیشکاشتی و گاسترولاسیون: مدلهای حیوانی مانند موش و خوک، به فهم فرآیندهای پیشکاشتی، تقسیم سلولی و آغاز گاسترولاسیون کمک کردهاند. این یافتهها امکان بررسی اثرات عوامل محیطی، متابولیک و ژنتیکی بر مراحل اولیه جنین را فراهم کردهاند.
-
اپیژنتیک و اثرات محیطی: پژوهشها نشان دادهاند که شرایط محیط کشت، تکنیکهای IVF و فاکتورهای تغذیهای میتوانند بر الگوهای اپیژنتیک جنین تأثیر بگذارند و این تغییرات ممکن است تا نسلهای بعدی باقی بمانند. مطالعات حیوانی، مانند مدل گاو و موش، نقش استرس اکسیداتیو، سوپراوولاسیون و سن مادر را در تغییرات اپیژنتیک بررسی کردهاند.
-
تعامل جنین و رحم: تحقیقات در مدلهای حیوانی و انسان، فرآیند ایمپلنتاسیون و تعامل بین جنین و اندومتر را روشن کردهاند. نتایج نشان دادهاند که همگامسازی زمانی بین جنین و رحم برای موفقیت کاشت و رشد جنین حیاتی است و عدم تطابق میتواند منجر به شکست ایمپلنتاسیون شود.
نتایج بالینی و کاربردهای درمانی
یافتههای پژوهشی، تاثیر مستقیمی بر بهبود روشهای درمان ناباروری و تکنیکهای تولیدمثل کمکی داشتهاند:
-
افزایش موفقیت IVF : استفاده از تکنیکهای پیشرفته کشت، ارزیابی غیرتهاجمی جنین و ویتریفیکاسیون، نرخ بقای جنین و موفقیت انتقال را به طور قابل توجهی افزایش داده است. این پیشرفتها به بیماران نابارور فرصت بیشتری برای بارداری موفق میدهند.
-
حفظ باروری و ذخیره ژنتیکی: کریوپرزرویشن اسپرم، اووسیت و جنین امکان حفظ باروری قبل از درمانهای سرطان و سایر شرایط پزشکی آسیبزا را فراهم کرده و به عنوان یک ابزار پیشگیری بالینی مورد استفاده قرار میگیرد.
-
پیشگیری و درمان اختلالات ژنتیکی: فناوریهای ویرایش ژنوم و مدلهای ارگانویدی، زمینه مطالعات بالینی برای شناسایی و اصلاح اختلالات ژنتیکی قبل از تولد را فراهم کردهاند. اگرچه کاربرد مستقیم در انسان با محدودیتهای قانونی و اخلاقی همراه است، اما یافتهها در مدلهای حیوانی مسیر تحقیقات آینده را روشن کردهاند.
-
تغییرات اپیژنتیک و اثرات بلندمدت: شواهد نشان میدهند که شرایط محیط کشت، تکنیکهای IVF و ذخیرهسازی طولانیمدت میتوانند اثرات طولانیمدت بر سلامتی نسلهای بعدی داشته باشند. این یافتهها بر اهمیت پایش طولانیمدت و ارزیابی اپیژنتیک جنین تأکید میکنند.
پیامدهای پژوهشی بین رشتهای
تحقیقات جنینی باعث توسعه و ادغام رشتههای مختلف علمی شده است:
-
زیستفناوری و مهندسی ژنتیک: امکان ایجاد مدلهای حیوانی دستکاریشده و ارگانویدهای جنینی باعث شده است که علوم ژنتیک، بیوتکنولوژی و علوم سلولی به صورت یکپارچه عمل کنند.
-
سمشناسی و داروسازی: مدلهای حیوانی و ارگانویدی به عنوان ابزارهای دقیق برای بررسی اثر داروها و سموم در مراحل اولیه جنین استفاده میشوند و جایگزینی برای آزمایشهای غیرانسانی ارائه میکنند.
-
پزشکی بازساختی: یافتههای جنینی به توسعه فناوریهای سلولهای بنیادی و ارگانویدها کمک کردهاند که میتوانند در درمان بیماریها و تولید بافتها و اندامهای مصنوعی به کار گرفته شوند.
پیامدهای اجتماعی و بالینی
علاوه بر کاربردهای علمی، یافتههای جنینی پیامدهای مهمی برای جامعه و سیستمهای بهداشتی دارند:
-
افزایش دسترسی به درمان ناباروری: توسعه تکنیکهای ذخیرهسازی و IVF باعث شده است که تعداد بیشتری از بیماران نابارور بتوانند شانس بارداری موفق داشته باشند.
-
آگاهی از اثرات محیطی و سبک زندگی: پژوهشهای اپیژنتیک و محیطی بر جنین، اهمیت تغذیه مادر، سلامت متابولیک و سبک زندگی پدر و مادر را در رشد جنین و سلامت نسلهای آینده برجسته کرده است.
-
چالشهای اخلاقی و قانونی: پیشرفت فناوریهای نوین، نیاز به قوانین و چارچوبهای اخلاقی دقیق برای محافظت از جنین انسان و رفاه حیوانات را افزایش داده است. این یافتهها باعث شده است که تصمیمگیری بالینی و پژوهشی با رعایت اصول اخلاقی و قانونی انجام شود.
جمعبندی نتایج و پیامدهای پژوهشی و بالینی
به طور خلاصه، پژوهشهای جنینی در انسان و حیوانات، بینشهای ارزشمندی درباره مراحل تکوینی، تعامل ژنتیک و محیط، و اثرات تکنیکهای آزمایشگاهی فراهم کردهاند. این یافتهها باعث بهبود روشهای تولیدمثل کمکی، حفظ باروری، پیشگیری از اختلالات ژنتیکی و توسعه فناوریهای پزشکی شدهاند. همزمان، پیامدهای اخلاقی و قانونی، اهمیت رعایت استانداردهای علمی و ایمنی را بیش از پیش آشکار میکنند.
جمعبندی و چشمانداز آینده در مطالعات جنین انسان و حیوانات
مطالعه جنین انسان و حیوانات، یکی از شاخههای کلیدی علوم زیستی و پزشکی است که با پیشرفت فناوریها و روشهای نوین، مسیرهای تحقیقاتی و کاربردهای بالینی جدیدی را پیش روی محققان قرار داده است. از بررسی مراحل اولیه تکوین تا تکنولوژیهای پیشرفته سلولهای بنیادی و ویرایش ژنوم، این حوزه به یکی از مهمترین زمینههای تحقیقاتی در فهم رشد، سلامت و بیماریهای انسانی و حیوانی تبدیل شده است.
جمعبندی یافتههای علمی و پژوهشی
تحقیقات گسترده در مدلهای حیوانی و جنین انسان، فهم ما از مراحل مختلف تکوین را به شکل چشمگیری افزایش داده است. یافتهها نشان میدهند که:
-
مراحل اولیه تکوین و تمایز سلولی، تحت تأثیر پیچیدهای از ژنها، فاکتورهای محیطی و مسیرهای سیگنالینگ قرار دارند. مدلهای حیوانی مانند موش و خوک، نقش این مسیرها را در فرآیندهای پیشکاشتی، گاسترولاسیون و ایمپلنتاسیون روشن کردهاند.
-
تأثیر محیط و اپیژنتیک، نه تنها بر کیفیت جنین و توسعه بافتها بلکه بر سلامت نسلهای بعدی تأثیرگذار است. مطالعات نشان دادهاند که تغییرات متابولیک، استرس اکسیداتیو، سوپراوولاسیون و شرایط کشت میتوانند اثرات بلندمدت اپیژنتیک ایجاد کنند.
-
فناوریهای نوین سلولهای بنیادی و ارگانویدها، امکان شبیهسازی مراحل اولیه جنین را بدون استفاده مستقیم از جنین انسان فراهم کرده و ابزارهای جدیدی برای مطالعه بیماریها و داروها ارائه دادهاند.
-
ویرایش ژنوم با CRISPR و فناوریهای مشابه، امکان بررسی نقش ژنها در تکوین، اصلاح اختلالات ژنتیکی و توسعه مدلهای بیماری را فراهم کرده، اگرچه کاربرد بالینی آن در انسان محدودیتهای اخلاقی و قانونی دارد.
پیامدهای بالینی و کاربردهای درمانی
یافتههای پژوهشی، پیامدهای مهمی برای پزشکی باروری، حفظ باروری و درمان بیماریهای ژنتیکی داشتهاند:
-
ارتقای موفقیت روشهای IVF و تکنیکهای تولیدمثل کمکی از طریق بهبود شرایط کشت، ارزیابی غیرتهاجمی کیفیت جنین و استفاده از محیطهای پیشرفته کشت و ویتریفیکاسیون.
-
حفظ باروری در بیماران نیازمند، شامل ذخیرهسازی اسپرم، اووسیت و جنین قبل از درمانهای سرطان یا شرایط پزشکی آسیبزا.
-
امکان پیشگیری و درمان اختلالات ژنتیکی قبل از تولد، با استفاده از مدلهای حیوانی و ارگانویدها، که پایهای برای تحقیقات آینده در زمینه ژنتیک پیشگیرانه و درمانهای هدفمند فراهم میکند.
-
شناخت اثرات بلندمدت محیط و سبک زندگی والدین بر جنین و نسلهای بعدی، که اهمیت تغذیه، سلامت متابولیک و سبک زندگی مادر و پدر را برجسته کرده است.
چشمانداز آینده و مسیرهای تحقیقاتی
با وجود پیشرفتهای چشمگیر، هنوز بسیاری از پرسشها در زمینه تکوین جنین انسان و حیوانات باقی ماندهاند. چشمانداز آینده شامل چند محور اصلی است:
-
توسعه مدلهای پیشرفته انسانی و حیوانی: به ویژه استفاده از ارگانویدها، سیستمهای سهبعدی و شبیهسازیهای دیجیتال برای درک بهتر فرآیندهای تکوینی و بیماریهای ژنتیکی.
-
ادغام فناوریهای مولکولی، سلولی و محاسباتی: استفاده همزمان از ویرایش ژنوم، ارزیابی اپیژنتیک، تصویربرداری سهبعدی و الگوریتمهای یادگیری ماشینی برای مدلسازی دقیقتر رشد جنین و پیشبینی اثرات محیطی و دارویی.
-
مطالعات طولانیمدت اپیژنتیک و نسلهای بعدی: بررسی اثرات محیط کشت، تکنیکهای IVF، و سبک زندگی والدین بر سلامت نسلهای آینده و شناسایی عوامل پیشگیرانه یا درمانی.
-
تقویت چارچوبهای اخلاقی و قانونی: با ورود فناوریهای نوین، نیاز به قوانین و دستورالعملهای جهانی شفاف برای محافظت از جنین انسان و رفاه حیوانات، افزایش یافته است. همکاری میان پژوهشگران، bioethicists، نهادهای قانونی و جامعه، برای تعیین حد و مرزهای مسئولانه در تحقیقات ضروری است.
-
کاربردهای بالینی و پزشکی بازساختی: استفاده از یافتهها در تولید بافت و اندام مصنوعی، توسعه داروهای هدفمند، پیشگیری از بیماریهای مادرزادی و ارائه درمانهای فردی مبتنی بر ژنتیک و اپیژنتیک.
نتیجهگیری کلی
مطالعه جنین انسان و حیوانات، یک حوزه چندبعدی و پیشرفته علمی است که از تکوین سلولی تا فناوریهای ویرایش ژنوم و ارگانویدها را در بر میگیرد. این تحقیقات نه تنها درک ما از فرآیندهای زیستی را افزایش داده، بلکه کاربردهای بالینی مهمی در درمان ناباروری، پیشگیری از اختلالات ژنتیکی و توسعه فناوریهای پزشکی بازساختی فراهم کرده است.
با ادامه پیشرفت فناوریها، چشمانداز آینده نویدبخش توسعه مدلهای پیشرفتهتر، تحقیقات اخلاقی و قانونی دقیقتر و کاربردهای بالینی مؤثرتر است. رعایت اصول علمی، اخلاقی و قانونی، کلید بهرهبرداری مسئولانه و پایدار از یافتههای این حوزه است.
تاکید بر اهمیت یکپارچگی علم، اخلاق و بالینی
برای دستیابی به نتایج بهینه و مسئولانه در تحقیقات جنینی، ضروری است که:
-
پژوهشهای پایه و بالینی با همکاری نزدیک انجام شوند
-
چارچوبهای اخلاقی و قانونی بهروز و منطبق با فناوریهای نوین طراحی شوند
-
آموزش و آگاهی عمومی نسبت به دستاوردها و محدودیتهای تحقیقات جنینی تقویت شود
این رویکرد جامع، اطمینان میدهد که پیشرفتهای علمی نه تنها موجب ارتقای سلامت و رفاه انسان و حیوانات میشوند، بلکه با رعایت اصول اخلاقی و ایمنی، مسیر توسعه پایدار علمی را نیز تضمین میکنند.