جنین انسان چگونه تشکیل می شود؟
مقدمه
فهم اینکه جنین انسان چگونه تشکیل میشود، یکی از بنیادیترین و در عین حال پیچیدهترین مسائل در زیستشناسی تکاملی، علوم تولیدمثل و پزشکی بالینی است. این دانش نه تنها پایهای برای درک منشأ حیات و نحوه شکلگیری یک موجود جدید است، بلکه زیربنای تصمیمگیریهای بالینی در حوزههای درمان ناباروری، تشخیص پیش از لانهگزینی، پیشگیری از ناهنجاریهای مادرزادی و توسعه فناوریهای نوین مانند پزشکی بازساختی و مدلسازی بیماریها محسوب میشود. همچنین، پیشرفت در این حوزه پیامدهای اخلاقی، قانونی و اجتماعی عمیقی دارد که توجه متخصصان و سیاستگذاران را میطلبد.
بهطور خلاصه، تشکیل جنین انسان یک فرآیند پیوسته و چندمرحلهای است که از لحظهٔ برخورد دو گامت (اسپرم و اووسیت) آغاز میشود و از طریق مراحل تقسیمات سلولی سریع، بازالتیشدن ساختارها، تشکیل بلاستوسیست، لانهگزینی در اندومتر، گاسترولاسیون و سپس ارگانزایی ادامه مییابد تا یک جنین قابل شناسایی شکل بگیرد. در هر یک از این مراحل، مجموعهای پیچیده از عوامل مولکولی—از جمله ژنها، مسیرهای سیگنالدهی (مانند Wnt، BMP، FGF و غیره)، وضعیت اپیژنتیک، و عوامل محیطی—تعامل میکنند تا سرنوشت سلولی و شکلگیری بافتها را هدایت نمایند. از سوی دیگر، عوامل مکانیکی و بیوفیزیکی مانند تغییرات کششی، تفاوتهای چسبندگی بین سلولی و فشارهای محیطی نیز نقش مهمی در شکلگیری هندسه بافتها ایفا میکنند.
یکی از تحولات علمی مهم در چند دههٔ اخیر، آگاهی از این نکته است که نه تنها اطلاعات ژنتیکی، بلکه بازبرنامهریزی اپیژنتیک و محتوای سیتوپلاسمی اووسیت و اسپرم در تعیین کیفیت و مسیر تکوینی جنین نقش دارد. مطالعات نشان دادهاند که ترکیب پروتئینها و RNAهای مادری، اثرات پدری بر اپیژنتیک زایشی و وقوع پدیدههایی مانند موزائیسم کروموزومی یا ناپایداری ژنومی در مراحل پیشلانهگزینی میتواند پیامدهای بزرگی برای توان بقای جنین و احتمال بروز ناهنجاریها داشته باشد. این موضوع اهمیت بررسی همزمان «ژنوم» و «اُمیکس» (transcriptome، epigenome، proteome و غیره) را در ارزیابی سلامت جنین و پیشبینی موفقیت کاشت برجسته میسازد.
از منظر کاربردی، آگاهی دقیق از روندهای تکوینی، اساس روشهای درمان ناباروری مانند آیویاف (IVF)، استراتژیهای انتخاب جنین (مقایسهٔ روشهای مبتنی بر مورفولوژی، تایملپس و الگوریتمهای هوش مصنوعی)، و تکنیکهای کرایوپرزرویشن (خصوصاً ویترفیکاسیون) را شکل میدهد. همزمان، ظهور مدلهای نوین مبتنی بر سلولهای بنیادی—مانند امبریوئیدها، گاسترولوئیدها و ارگانوئیدها—پنجرهای جدید برای مطالعهٔ مکانیسمهای اولیه جنینشناسی فراهم کرده است؛ با این همه، این مدلها با چالشهای فنی و ملاحظات اخلاقی همراهاند که نیازمند بحث دقیق و قانونگذاری هوشمند هستند.
این مقاله مروری با هدف ارائهٔ یک بررسی جامع، چندلایهای و بهروز از فرآیند تشکیل جنین انسان تدوین شده است. در این مرور، سعی خواهد شد تا با پیوند دادن بین نتایج پژوهشهای مولکولی، یافتههای سلولی-بافتشناختی و کاربردهای بالینی، پاسخ به سؤالات کلیدی مورد علاقهٔ متخصصان ارائه شود؛ از جمله: چه مولفههایی کیفیت یک جنین پیشلانهگزینی را تعیین میکنند؟ چه مکانیسمهایی سرنوشت سلولی را در بلاستوسیست مشخص میکنند؟ چگونه جفت شکل مییابد و چه عواملی در موفقیت یا ناکامی لانهگزینی نقش دارند؟ چه جایگاهی برای مدلهای سلولی و ابزارهای اُمیکس در تشخیص و درمان وجود دارد؟ پاسخ به این پرسشها با اتکا به منابع مرجع علمی که در اختیارم قرار دادید و سایر مطالعات کلیدی انجام میشود، و نکات بالینی و فنیِ عملی نیز شمرده و تحلیل خواهند شد.
محتوای این مقاله برای طیف وسیعی از خوانندگان مناسب خواهد بود: متخصصان تولیدمثل و جنینشناسی، پژوهشگران علوم زیستی و پزشکی بازساختی، پزشکان زنان و زایمان، تکنولوژیستهای آزمایشگاهی و نیز خوانندگان عمومی علاقهمند به دانش بهروز در زمینهٔ تولیدمثل و سلامت جنین. متن بهگونهای نوشته میشود که هم از نظر علمی دقیق باشد و هم برای خوانندگان غیرتخصصی فاقد اصطلاحات پیچیدهٔ بیمورد قابلفهم باشد؛ در عین حال، بخشهای تخصصی شامل جزییات مولکولی و روششناسی برای کسانی که به دنبال اطلاعات عمیقتر هستند فراهم خواهد شد.
در ادامه، مباحثی که بهتفصیل بررسی خواهند شد عبارتاند از: لقاح و آغاز حیات، تقسیمات اولیه و پدیدههای مرتبط با آنها، تشکیل مورولا و بلاستوسیست، فرآیند لانهگزینی و محیط مادری، گاسترولاسیون و تعیین سرنوشت لایههای زاینده، مکانیسمهای تشکیل جفت، تکامل اولیه اندامها و سیستمهای حیاتی، نقش سلولهای بنیادی و حالت پرتوانی، تأثیر عوامل محیطی و پدری بر کیفیت جنین، فنآوریهای نوین در ارزیابی جنین (شامل هوش مصنوعی و اُمیکس)، روشهای کرایوپرزرویشن و نگرانیهای اخلاقی و ایمنی. هر بخش با مرور شواهد تجربی، بحث در مورد تناقضها و نقاط مبهم علمی و اشاره به کاربردهای بالینی و پژوهشی پایان مییابد.
از منظر سئو و انتشار در سایت «آریا طب»، این متن به شکل یونیک و متمرکز بر کلیدواژههای مرتبط نگاشته خواهد شد تا هم خوانایی بالا داشته باشد و هم کمک کند مقاله در جستجوهای تخصصی و عمومی بازدید مناسبی جذب نماید. بهعنوان راهنمای کوتاه برای متا دیتا که میتواند در انتشار صفحه کمک کند، پیشنهادهایی آماده کردهام که در پایان این بخش میآورم؛ اما جزئیات فنی سئو، همچون عنوانهای متا و تگهای H1/H2، در زمان تکمیل کل مقاله با توجه به ساختار نهایی قابل تنظیم هستند.
در پایان این مقدمه لازم است تأکید کنم که این مقاله بر پایهٔ منابع معتبر علمی فراهمشده توسط شما و سایر مراجع کلیدی تهیه میشود؛ هدف، تولید یک مرجع قابلاعتماد، علمی و کاربردی برای خوانندگان سایت «آریا طب» است که هم به نیازهای پژوهشی پاسخ دهد و هم برای مخاطبان بالینی و عمومی قابل استفاده باشد. در ادامه، بخش مربوط به لقاح و شروع حیات را با جزئیات مولکولی، سلولی و بالینی خواهم نوشت و مسیرهای تحقیقاتی و نکات کاربردی را یکبهیک بررسی خواهیم کرد.
لقاح و شروع حیات
لحظهای که دو سلول جنسی یعنی اسپرم و اووسیت با یکدیگر ادغام میشوند، نقطهٔ آغاز شکلگیری حیات انسانی است. این فرایند به ظاهر ساده، در واقع یکی از پیچیدهترین و ظریفترین وقایع زیستی به شمار میآید که حاصل میلیونها سال تکامل در سیستمهای تولیدمثل است. لقاح نه تنها ترکیب ژنتیکی پدر و مادر را در یک سلول واحد به نام زیگوت فراهم میکند، بلکه نقطهٔ شروع بازبرنامهریزی ژنتیکی و اپیژنتیکی است که سرنوشت جنین آینده را مشخص میسازد. درک دقیق این فرایند برای دانشهای تولیدمثل، جنینشناسی، درمان ناباروری و همچنین فناوریهای نوینی مانند مهندسی ژنتیک و پزشکی بازساختی اهمیتی بیبدیل دارد.
فرآیند لقاح با آزاد شدن اووسیت در جریان تخمکگذاری آغاز میشود. اووسیت بالغ که در مرحلهٔ متافاز دوم میوز قرار دارد، توسط لولههای فالوپ دریافت میشود و تنها در صورت ورود اسپرم میتواند چرخهٔ تقسیم را تکمیل کند. در این مرحله، اسپرمها پس از انزال در دستگاه تناسلی زنانه، سفری دشوار را برای رسیدن به محل لقاح در لوله فالوپ طی میکنند. از میلیونها اسپرم واردشده، تنها تعداد اندکی به نزدیکی اووسیت میرسند و این خود نشاندهندهٔ وجود مکانیسمهای طبیعی انتخاب اسپرم است که تضمین میکند تنها قویترین و سالمترین آنها به مقصد برسند.
زمانی که اسپرم به اووسیت میرسد، نخستین مانع، منطقه شفاف (Zona Pellucida) است؛ لایهای پروتئینی-گلیکوپروتئینی که مانند سپری محافظ عمل میکند. اسپرم با کمک آنزیمهای موجود در آکروزوم (بخش سر اسپرم) این لایه را نفوذ میکند. این فرایند که به آن واکنش آکروزومی گفته میشود، نیازمند هماهنگی دقیق مولکولی میان گیرندههای سطحی اسپرم و پروتئینهای منطقه شفاف است. یکی از پروتئینهای کلیدی در این مرحله، ZP3 است که اتصال اختصاصی اسپرم به اووسیت را امکانپذیر میسازد.
پس از نفوذ اسپرم به داخل اووسیت، تغییرات سریعی در غشای تخمک رخ میدهد تا از ورود اسپرمهای دیگر جلوگیری شود؛ این پدیده تحت عنوان بلوک به پلیاسپرمی شناخته میشود. این مکانیسم حیاتی است، زیرا ورود چند اسپرم میتواند منجر به ناهنجاریهای کروموزومی و شکست در تکوین جنین شود. در ادامه، هستهٔ اسپرم و اووسیت با یکدیگر ادغام میشوند و ترکیب کامل کروموزومی (۴۶ کروموزوم) را تشکیل میدهند. این لحظه، در واقع شروع هویت ژنتیکی منحصر به فرد یک انسان جدید است.
اما لقاح تنها ادغام سادهٔ DNA نیست. در این مرحله، تغییرات عمیق اپیژنتیکی رخ میدهد. DNA اسپرم که بهطور متراکم توسط پروتئینهای هیستونی و پروتامین بستهبندی شده است، باید دوباره بازآرایی شود تا قابل دسترسی برای ماشینهای رونویسی سلولی باشد. همزمان، اووسیت فاکتورهای پروتئینی و RNAهای غیرکدکنندهٔ خود را برای فعالسازی ژنوم جنینی فراهم میکند. این تعامل بین اطلاعات ژنتیکی پدری و محتوای سیتوپلاسمی مادری، بستر آغاز برنامهٔ تکوینی را فراهم میسازد.
مطالعات نشان دادهاند که کیفیت اسپرم نه تنها به محتوای DNA، بلکه به بار اپیژنتیک آن نیز بستگی دارد. تغییرات متیلاسیون DNA، حضور RNAهای کوچک مانند microRNA و همچنین عوامل اکسیداتیو میتوانند نقش مهمی در سرنوشت اولیهٔ جنین داشته باشند. از سوی دیگر، کیفیت اووسیت نیز وابسته به سن مادر، وضعیت تغذیهای، شرایط محیطی و حتی فاکتورهای هورمونی است. این یافتهها نشان میدهند که لقاح یک واقعه صرفاً ژنتیکی نیست، بلکه بازتابی از وضعیت سلامت کلی والدین است.
از دیدگاه بالینی، لحظهٔ لقاح در روشهای لقاح آزمایشگاهی (IVF) بهطور مستقیم قابل مشاهده و ثبت است. جنینشناسان از طریق بررسی نحوهٔ ادغام اسپرم و اووسیت و تشکیل پیشهستهها، میتوانند دربارهٔ کیفیت جنین قضاوت کنند. همچنین، مطالعات بالینی نشان دادهاند که برخی اختلالات در اسپرم یا اووسیت، مانند آنئوپلوئیدی یا مشکلات اپیژنتیکی، در همین مراحل اولیه میتواند منجر به شکست لقاح یا توقف رشد جنین شود.
یکی از نکات مهم در بحث لقاح، مفهوم فعالسازی اووسیت است. اسپرم هنگام ورود، مجموعهای از سیگنالهای شیمیایی را آزاد میکند که موجب افزایش موقت غلظت کلسیم در سیتوپلاسم اووسیت میشود. این نوسانات کلسیمی، فرایندهای متعددی از جمله خروج گرانولهای قشری (برای جلوگیری از پلیاسپرمی)، تکمیل تقسیم میوز دوم و تشکیل پیشهستهها را کنترل میکنند. بدون این سیگنالینگ دقیق، حتی در صورت ورود اسپرم، تشکیل زیگوت موفقیتآمیز نخواهد بود.
لقاح همچنین سرآغاز مرحلهای است که به آن بازبرنامهریزی ژنومی گفته میشود. در این مرحله، تنظیمات اپیژنتیک موجود بر روی DNA پدری و مادری پاکسازی و مجدداً برنامهریزی میشوند تا یک ژنوم تازه و توانا برای کنترل مراحل بعدی رشد ایجاد شود. این بازبرنامهریزی اهمیت زیادی دارد، زیرا خطا در آن میتواند منجر به بیماریهای تکاملی یا ناباروری شود.
در نهایت، نتیجهٔ این فرآیند پیچیده و چندمرحلهای، تشکیل یک سلول واحد به نام زیگوت است که قابلیت آغاز یک موجود انسانی کامل را دارد. زیگوت نه تنها حامل نقشهٔ ژنتیکی یکتا است، بلکه توانایی خودسازماندهی، تقسیم مکرر و تمایز به انواع سلولها و بافتها را نیز دارا میباشد. از این نقطه به بعد، مسیر پرماجرای تقسیمات سلولی و شکلگیری ساختارهای پیچیده آغاز میشود که در بخشهای بعدی به تفصیل مورد بررسی قرار خواهد گرفت.
بخش تقسیمات اولیه و بلاستومرها
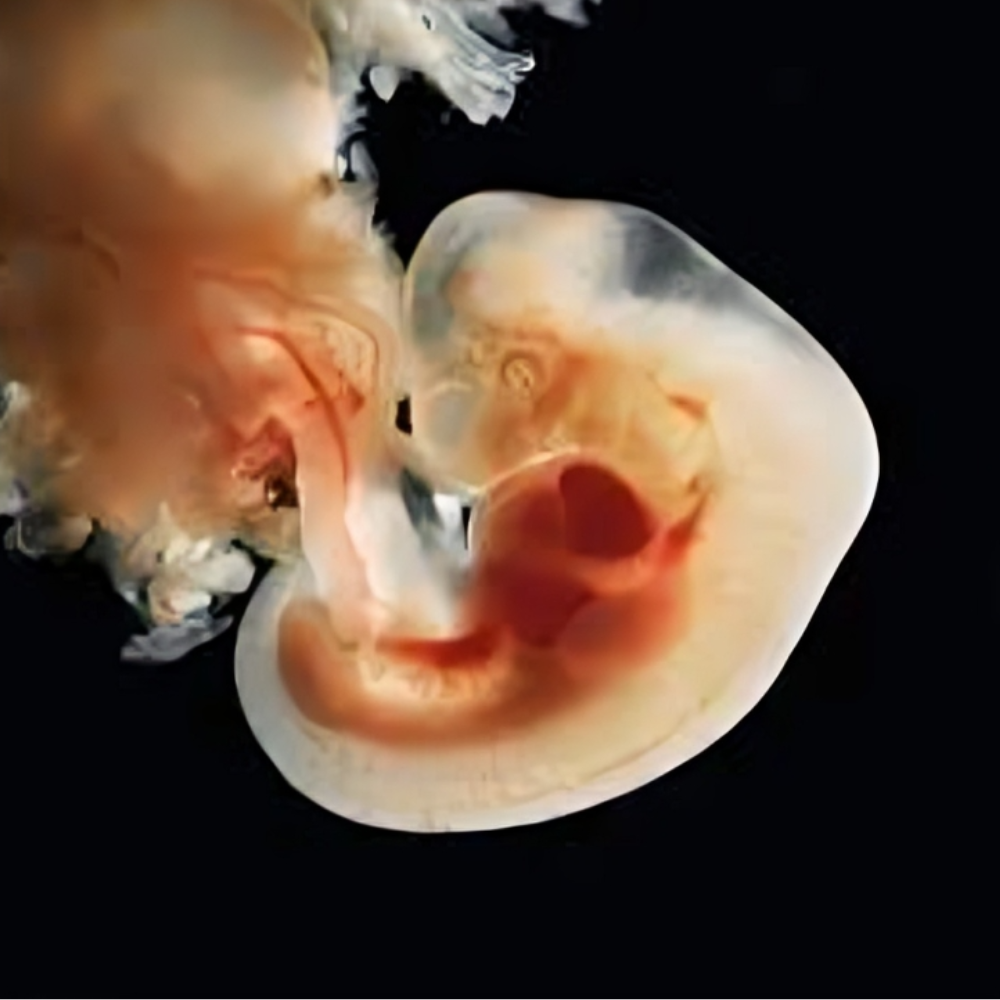
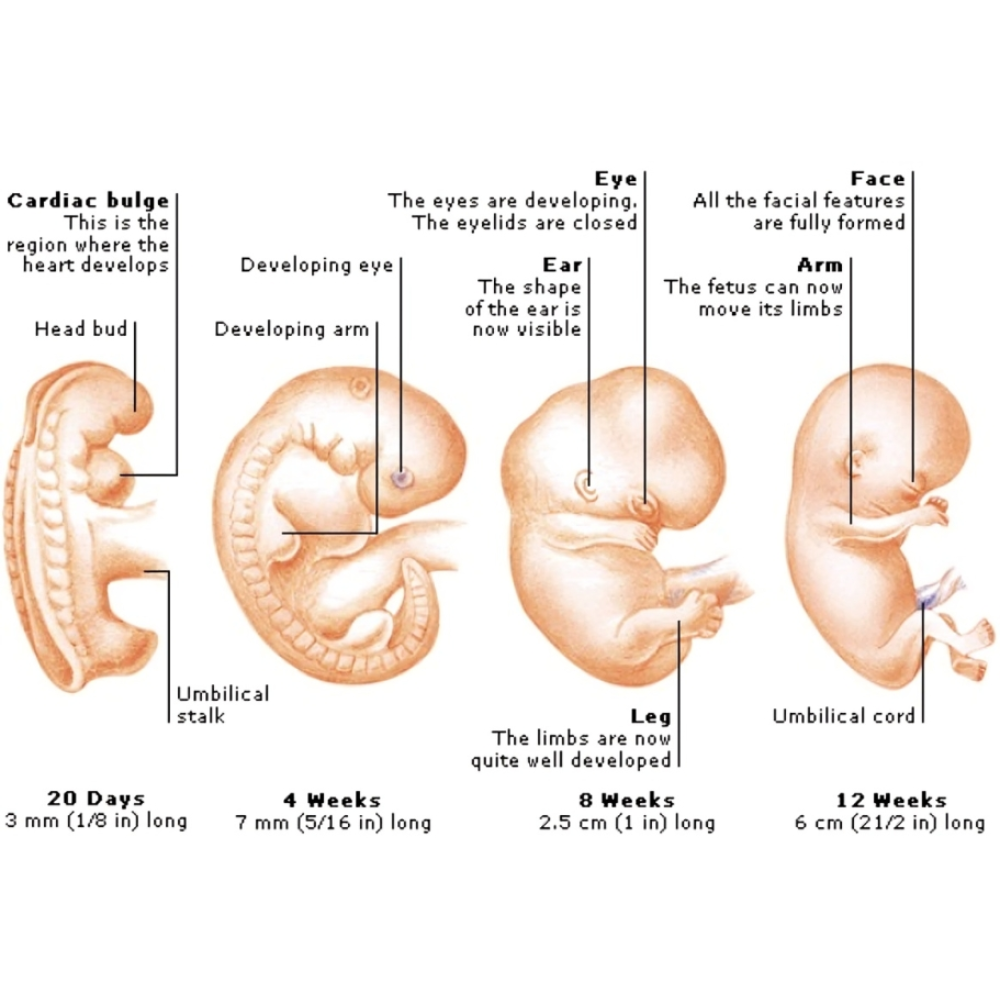
پس از آنکه لقاح بهعنوان نخستین گام در آغاز حیات موفقیتآمیز انجام میشود، تخمک بارور شده یا زیگوت وارد مرحلهای بسیار حساس و بنیادین از رشد میگردد که به آن تقسیمات اولیه یا کلیواژ گفته میشود. این مرحله در واقع آغاز تقسیمات سلولی سریع، متوالی و بدون رشد محسوس سیتوپلاسمی است که به شکلگیری ساختارهای چندسلولی ابتدایی، یعنی بلاستومرها، منجر میشود. اهمیت این مرحله از آن جهت است که پایههای سازمانیافتگی جنین آینده را فراهم میکند و در عین حال از همان ابتدا شرایط لازم برای تمایز سلولها و شکلگیری لایههای جنینی را پدید میآورد.
ویژگی بارز تقسیمات اولیه این است که برخلاف تقسیمات معمول سلولهای سوماتیک در بدن، سلولهای حاصل از کلیواژ افزایش اندازهای ندارند، بلکه حجم سیتوپلاسم اولیه زیگوت به اجزای کوچکتری تقسیم میشود. در نتیجه، هر بلاستومر کوچکتر از سلول مادر خود است و با گذشت زمان تعداد آنها بیشتر و بیشتر میشود، بدون آنکه تغییر چشمگیری در اندازه کلی جنین روی دهد. این امر موجب میشود که جنین بتواند در فضای محدود و محصور دستگاه تناسلی و در شرایط تغذیهای اولیه به حیات خود ادامه دهد.
از دیدگاه زمانی، نخستین تقسیم معمولاً ظرف ۲۴ تا ۳۰ ساعت پس از لقاح اتفاق میافتد. تقسیمات بعدی با فاصلههای نسبتاً کوتاه صورت میگیرند و الگوی آنها در گونههای مختلف اندکی متفاوت است. در انسان، تقسیمات اولیه به شکل نامتقارن رخ میدهند و از همان ابتدا نوعی تفاوت در موقعیت و پتانسیل بلاستومرها مشاهده میشود. این تفاوتهای ظریف مقدمهای برای پدیدار شدن پدیده تمایز سلولی در مراحل بعدی خواهد بود.
بلاستومرها بهعنوان سلولهای حاصل از تقسیمات اولیه زیگوت، ماهیت ویژهای دارند. آنها هنوز تمایز نیافتهاند و از قابلیت توتیپتانسی (totipotency) برخوردارند؛ بدین معنا که هر یک از آنها در شرایط مناسب میتواند یک جنین کامل را به وجود آورد. همین ویژگی است که امکان انجام فناوریهای نوین مانند انتقال هسته و تولید حیوانات شبیهسازیشده را فراهم کرده است. البته این توانایی در مراحل بعدی و با پیشرفت تقسیمات بهتدریج محدودتر میشود و سلولها وارد مسیرهای خاص تمایزی میگردند.
در طی مراحل تقسیم، موقعیت مکانی بلاستومرها و نحوه چیدمان آنها نیز اهمیت دارد. در ابتدا سلولها بهصورت تودهای گرد و نسبتاً شل کنار یکدیگر قرار میگیرند، اما با پیشرفت تقسیمات و افزایش تعداد آنها، پدیده کمپکشن یا فشردهسازی پدید میآید. در این مرحله بلاستومرها بهوسیله اتصالات محکم بین سلولی، بهویژه اتصالات محکم (tight junctions) و دسموزومها، به هم متصل میشوند و ساختاری فشردهتر و منسجمتر ایجاد میکنند. کمپکشن آغاز تمایز بین سلولهای داخلی و خارجی جنین اولیه را مشخص میسازد و زمینهساز تشکیل بلاستوسیست خواهد شد.
از منظر فیزیولوژیکی، تقسیمات اولیه نیازمند هماهنگی دقیق میان چرخههای سلولی، فعالیت متابولیک و تنظیمات ژنتیکی است. تا چند تقسیم نخست، جنین عمدتاً از ذخایر RNA و پروتئینهای مادری موجود در سیتوپلاسم تخمک استفاده میکند. اما پس از چندین دور تقسیم، انتقال کنترل ژنومی از مادر به جنین صورت میگیرد و از این لحظه ژنوم خود جنین فعال شده و نقش اصلی را در تنظیم رشد بر عهده میگیرد. این تغییر بنیادین که به آن فعالسازی ژنومی جنین گفته میشود، مرحلهای حیاتی در موفقیت تکوین محسوب میشود.
از نظر کاربردهای علمی و بالینی، مطالعه تقسیمات اولیه و بلاستومرها در درک علل ناباروری، سقطهای خودبهخودی و نیز در حوزههای آزمایشگاههای جنینشناسی و روشهای کمکباروری اهمیت زیادی دارد. متخصصان ناباروری با بررسی کیفیت بلاستومرها، میزان تقارن آنها، میزان قطعهقطعه شدن سیتوپلاسم و الگوهای تقسیم، میتوانند احتمال موفقیت یک جنین در کاشتهشدن و ادامه رشد را ارزیابی کنند. کیفیت بلاستومرها شاخصی کلیدی برای انتخاب جنین مناسب در روشهایی مانند IVF است.
از نگاه تکاملی نیز، تقسیمات اولیه نشاندهنده راهبردی هوشمندانه برای بقا و رشد جنین در شرایط ابتدایی حیات است. با تقسیم شدن حجم بزرگ زیگوت به سلولهای کوچکتر و افزایش سطح نسبت به حجم، مبادله مواد غذایی و گازی برای سلولها آسانتر میشود و جنین میتواند بدون نیاز فوری به سیستمهای تغذیهای پیچیده زنده بماند. همچنین این تقسیمات مقدمهای برای شکلگیری ساختارهای چندسلولی و ورود به مراحل بالاتر تکوین است.
بهطور خلاصه، مرحله تقسیمات اولیه و تشکیل بلاستومرها نهتنها آغاز فرایند پیچیده تکوین جنینی را رقم میزند، بلکه با فراهم آوردن بستری برای تمایز سلولی، فعالسازی ژنوم جنین و ایجاد ساختارهای اولیه، اساس ادامه حیات را بنا میگذارد. شناخت دقیق این مرحله به ما امکان میدهد تا بهتر درک کنیم چگونه از یک سلول منفرد، سازمانی شگفتانگیز و پیچیده به نام انسان پدید میآید.
مرحله مورولا و بلاستوسیست
پس از آنکه زیگوت طی مراحل تقسیم اولیه به مجموعهای چندسلولی تبدیل شد، جنین وارد مرحلهای به نام مورولا میگردد. این مرحله حدود روز سوم تا چهارم پس از لقاح اتفاق میافتد و اهمیت آن در این است که اولین ساختار منسجم جنینی شکل میگیرد و زمینهٔ تمایز سلولی برای مراحل بعدی فراهم میشود.
مورولا از واژه لاتین به معنی توت (mulberry) گرفته شده است، زیرا در این مرحله جنین ظاهری شبیه توت فشرده دارد. در این ساختار، سلولهای حاصل از تقسیمهای اولیه به نام بلاستومرها با یکدیگر بسیار نزدیک و فشرده شدهاند و با ایجاد اتصالات بین سلولی محکم، یک توده سلولی گرد و منسجم را تشکیل میدهند. این پدیده که به آن کمپکشن گفته میشود، به واسطه فعالیت پروتئینهای چسبندگی مانند E-cadherin رخ میدهد و اهمیت بالینی آن در پیشبینی کیفیت جنین و موفقیت کاشت قابل توجه است. کمپکشن همچنین آغاز تمایز اولیه میان سلولهای داخلی و خارجی را مشخص میکند؛ سلولهای داخلی بعدها به توده سلولی داخلی (Inner Cell Mass) تبدیل میشوند و سرنوشتشان ایجاد جنین واقعی است، در حالی که سلولهای خارجی به تروفکتودرم (Trophoectoderm) تبدیل میشوند و نقش حمایتی و ساخت جفت را بر عهده خواهند داشت.
با گذشت زمان، مورولا تبدیل به بلاستوسیست میشود، مرحلهای کلیدی که حدود روز پنجم پس از لقاح رخ میدهد. در بلاستوسیست، یک حفره مرکزی به نام بلاستوسل تشکیل میشود و موجب میگردد ساختار جنین از یک توده فشرده به یک ساختار توخالی و منظم تبدیل شود. این تغییر شکل هندسی، علاوه بر اهمیت فیزیکی، نقش مهمی در الگوگیری سلولی و تعیین محل لانهگزینی در اندومتر دارد.
تروفکتودرم که سلولهای خارجی بلاستوسیست را تشکیل میدهد، مسئول تعامل با محیط مادری و آمادهسازی محل لانهگزینی است. این سلولها بعداً با اندومتر ارتباط برقرار کرده و در تشکیل جفت اولیه و مرکز جفت نقش حیاتی دارند. فعالیت مولکولی در این سلولها شامل بیان ژنهای مرتبط با سیگنالینگ رشد، اتصال سلولی و تولید پروتئینهای برونسلولی است که قابلیت نفوذ به دیواره رحم و تسهیل لانهگزینی را فراهم میکنند.
توده سلولی داخلی (ICM)، از سوی دیگر، منبع اصلی جنین واقعی است و در ادامه وارد مراحل تمایز به لایههای جنینی میشود. این سلولها در حالت اولیه خود پرتوان (Pluripotent) هستند و توانایی تمایز به تمامی بافتهای بدن انسان را دارند. مطالعات روی ICM باعث توسعه فناوریهای سلولهای بنیادی و ارگانوئیدها شده و امکان مدلسازی بیماریهای انسانی و پژوهشهای بازساختی را فراهم آورده است.
تشکیل بلاستوسیست با فعالسازی ژنوم جنینی همزمان است؛ در این مرحله، ژنهای خود جنین به طور گسترده فعال میشوند و بسیاری از پروتئینها و RNAهای مورد نیاز برای تقسیمات بعدی و تمایز تولید میشوند. همزمان، الگوهای اپیژنتیک نیز شکل میگیرند و نقش مهمی در سرنوشت سلولها ایفا میکنند. هر گونه اختلال در این مرحله میتواند منجر به توقف رشد جنین یا ناهنجاریهای ژنتیکی و کروموزومی شود.
از منظر بالینی، ارزیابی بلاستوسیست از اهمیت ویژهای برخوردار است. تکنیکهای مورفولوژی کلاسیک و تایملپس امکان مشاهده ساختار داخلی، اندازه حفره بلاستوسل، تراکم ICM و یکپارچگی تروفکتودرم را فراهم میکنند. این اطلاعات در انتخاب بهترین جنین برای انتقال در IVF کاربرد دارند و میتوانند موفقیت لانهگزینی و بارداری را پیشبینی کنند. همچنین، مطالعات اخیر نشان دادهاند که ترکیب ارزیابی مورفولوژیک با هوش مصنوعی و الگوریتمهای اُمیکس میتواند دقت پیشبینی را به میزان قابل توجهی افزایش دهد.
یکی دیگر از نکات مهم در مرحله بلاستوسیست، تعامل جنین با محیط آبی و شیمیایی لوله فالوپ و رحم است. ترکیب یونها، مواد مغذی، فاکتورهای رشد و هورمونها در محیط اطراف بلاستوسیست میتواند روی توان لانهگزینی، تقسیمات سلولی و تمایز ICM و تروفکتودرم تأثیرگذار باشد. بنابراین، در آزمایشگاههای کمک باروری، فراهم کردن شرایط کشت مشابه محیط طبیعی اهمیت بالایی دارد.
در مجموع، مرحله مورولا و بلاستوسیست نقطهٔ عطفی در تکوین جنین انسان است؛ جایی که سلولها از حالت ابتدایی و نامنظم به یک ساختار سازمانیافته، با دو نوع سلول متمایز و یک حفره مرکزی تبدیل میشوند. این مرحله نه تنها به پیشرفت مراحل بعدی مانند گاسترولاسیون و شکلگیری لایههای جنینی کمک میکند، بلکه پایهای برای موفقیت بالینی در درمانهای باروری و پژوهشهای سلول بنیادی ایجاد مینماید.
کاشت جنین در رحم
پس از رسیدن جنین به مرحله بلاستوسیست، یکی از حیاتیترین و تعیینکنندهترین مراحل تکوین آغاز میشود که به آن کاشت جنین در رحم یا ایمپلنتاسیون گفته میشود. موفقیت در این مرحله، کلید آغاز بارداری طبیعی و ادامهٔ رشد جنین است و از نظر بالینی اهمیت ویژهای دارد، چرا که بسیاری از شکستهای اولیه بارداری در این مرحله رخ میدهد.
ایمپلنتاسیون فرایندی پیچیده است که نیازمند هماهنگی دقیق بین جنین و محیط مادری است. این هماهنگی شامل سه بعد اصلی میشود: آماده بودن جنین، وضعیت اندومتر (لایه داخلی رحم) و تعامل مولکولی بین سلولهای جنین و مادری. در صورتی که هر یک از این عناصر به درستی عمل نکند، کاشت موفق رخ نخواهد داد و بارداری ممکن است متوقف شود.
جنین در این مرحله توسط تروفکتودرم، یعنی سلولهای خارجی بلاستوسیست، عمل میکند. تروفکتودرم با اندومتر ارتباط برقرار کرده و ترکیبی از سیگنالهای شیمیایی و مکانیکی را به محیط اطراف ارسال میکند. سلولهای تروفکتودرم پروتئینها و فاکتورهای رشد متعددی تولید میکنند، از جمله VEGF (Vascular Endothelial Growth Factor) که نقش مهمی در تحریک رشد رگهای خونی جدید و تأمین تغذیه جنین دارد. این فرایند موجب شکلگیری اولیه جفت و اتصال پایدار جنین به رحم میشود.
از سوی دیگر، اندومتر در طول چرخه قاعدگی تحت تأثیر هورمونهای استروژن و پروژسترون تغییرات ساختمانی و مولکولی پیدا میکند تا شرایط مناسب برای پذیرش جنین فراهم شود. در روزهای مناسب چرخه، سلولهای استرومال دیسیدوا (Decidual Stromal Cells) تغییر شکل داده و محیط پذیرندهای برای جنین ایجاد میکنند. این سلولها علاوه بر فراهم آوردن بستر فیزیکی، نقش مهمی در تنظیم ایمنی مادرانه دارند تا از پس زدن جنین که حاوی نیمه ژنتیک پدر است، جلوگیری شود.
مرحله کاشت به دو بخش اصلی تقسیم میشود: جداشدن اولیه (Apposition) و تثبیت یا نفوذ (Adhesion and Invasion). در مرحله جداشدن اولیه، بلاستوسیست در نزدیکی اندومتر قرار میگیرد و با تغییر شکل سطح تروفکتودرم و تعامل با گلیکولیپیدها و گیرندههای سطح سلولی اندومتر، تماس اولیه برقرار میشود. سپس در مرحله تثبیت، سلولهای تروفکتودرم به داخل لایه استرومال اندومتر نفوذ میکنند و با انتشار آنزیمها و سیگنالهای مولکولی، اتصال پایدار ایجاد میشود.
یکی از نکات مهم در این مرحله، سیگنالهای مولکولی و مسیرهای سیگنالینگ هستند که تعیین میکنند کدام سلولهای تروفکتودرم در نفوذ و شکلگیری جفت مشارکت کنند. مسیرهای Wnt، BMP، FGF و Notch از جمله مسیرهای حیاتی هستند که هم رشد سلولی و هم جهتگیری مهاجرت سلولی را کنترل میکنند. تغییرات در این مسیرها میتواند منجر به اختلالات کاشت، سقط زودرس یا مشکلات جفتی شود.
همچنین، تعامل ایمنی بین جنین و مادر بسیار حساس است. سیستم ایمنی مادری باید بین دفاع در برابر عوامل بیماریزا و پذیرش جنین تمایز قائل شود. سلولهای تی و ماکروفاژهای اندومتر با ترشح سیتوکینها و فاکتورهای ایمنی، محیطی حمایتی برای نفوذ تروفکتودرم فراهم میکنند. نقص در این تعامل ایمنی میتواند منجر به رد جنین و ناباروری شود.
از منظر بالینی، در روشهای کمکباروری مانند IVF، موفقیت کاشت به عوامل متعددی بستگی دارد: کیفیت بلاستوسیست، زمان انتقال به رحم، وضعیت هورمونی اندومتر و عوامل ایمنی مادر. مطالعات نشان دادهاند که انتقال بلاستوسیستهای مرحله پنجم پس از لقاح، شانس موفقیت بالاتری نسبت به مراحل اولیه دارد، زیرا در این مرحله جنین توانایی بیشتری برای تعامل با اندومتر و نفوذ دارد.
علاوه بر این، بررسی مولکولی محیط رحم، میزان VEGF، بیان گیرندههای سطحی و فعالیت آنزیمها میتواند در پیشبینی موفقیت کاشت مفید باشد. استفاده از فناوریهای نوین مانند هوش مصنوعی، تایملپس و آنالیز اُمیکس اندومتر به متخصصان امکان میدهد محیط پذیرنده بهینه برای هر جنین را انتخاب کنند و شانس موفقیت بارداری را افزایش دهند.
در مجموع، کاشت جنین در رحم نقطهای است که جنین از حالت آزاد و مستقل به تعامل مستقیم با محیط مادری وارد میشود و بقای جنین تا مراحل بعدی به موفقیت این فرایند بستگی دارد. این مرحله نه تنها کلید آغاز بارداری طبیعی است، بلکه در درمانهای کمکباروری، تحقیقات روی جفت و سلولهای بنیادی و درک اختلالات اولیه رشد جنینی اهمیت حیاتی دارد.
گاسترولاسیون و تشکیل لایههای زاینده
پس از کاشت موفقیتآمیز جنین در رحم، مرحلهای کلیدی و بنیادین در تکوین جنین انسان آغاز میشود که به آن گاسترولاسیون گفته میشود. این مرحله معمولاً در روزهای ۱۴ تا ۱۸ پس از لقاح رخ میدهد و نقش حیاتی در تعیین سرنوشت سلولی و شکلگیری ساختارهای بدن جنین دارد. گاسترولاسیون نقطهٔ عطفی است که در آن جنین از یک توده سلولی ساده به ساختاری سازمانیافته با لایههای زاینده مشخص تبدیل میشود.
گاسترولاسیون فرایندی است که طی آن سلولهای توده داخلی بلاستوسیست (ICM) تمایز یافته و سه لایه زاینده اصلی یا ژرم لایهها (Germ Layers) را تشکیل میدهند: اِکتودرم، مزودرم و اندودرم. هر یک از این لایهها در ادامه مسئول شکلگیری بافتها و ارگانهای خاص بدن انسان هستند.
-
اِکتودرم: این لایه بیرونی نقش اساسی در شکلگیری سیستم عصبی مرکزی و محیطی، پوست و ساختارهای اپیتلیالی خارجی بدن را ایفا میکند. سلولهای اکتودرم با روندهای مهاجرت و تمایز دقیق، نواحی سر و اندامها را تعیین میکنند.
-
مزودرم: لایه میانی که عضلات، استخوانها، سیستم قلبی-عروقی، کلیهها و بافت همبند را تشکیل میدهد. مزودرم با تعامل دقیق با سایر لایهها و بافتهای محیطی، ساختمان سهبعدی بدن جنین را پایهریزی میکند.
-
اندودرم: لایه داخلی که جدار دستگاه گوارش، ریهها و بسیاری از غدد داخلی بدن را شکل میدهد. این لایه با مهاجرت سلولهای اولیه و تغییرات سیگنالینگ مولکولی، مسیر تکامل اندامهای داخلی را تعیین میکند.
فرایند گاسترولاسیون با تشکیل خط اولیه (Primitive Streak) آغاز میشود. خط اولیه ناحیهای از سلولها است که در قسمت پشتی جنین و در امتداد محور قدامی-خلفی تشکیل میشود. این خط نه تنها مسیر مهاجرت سلولی را مشخص میکند، بلکه قطبیت جنین و تعیین جهت جلویی و پشتی را ممکن میسازد. سلولهای ICM از طریق حرکتهای اپیتلیال به مزانشیمی (EMT) به داخل خط اولیه مهاجرت میکنند و بسته به موقعیت و سیگنالهای محیطی، تمایز به لایههای مزودرم و اندودرم پیدا میکنند، در حالی که سلولهایی که مهاجرت نمیکنند، اکتودرم را تشکیل میدهند.
در طول گاسترولاسیون، سیگنالهای مولکولی پیچیده مسیر سرنوشت سلولها را تعیین میکنند. مسیرهای Wnt، BMP، FGF و Nodal نقش حیاتی در تعیین قطبیت و تمایز سلولها دارند. برای مثال، افزایش فعالیت Nodal در سلولهای میانی باعث تمایز آنها به مزودرم میشود، در حالی که عدم فعالیت آن سلولها را به اکتودرم هدایت میکند. همین شبکههای سیگنالینگ هستند که عدم تقارن و سازماندهی سهبعدی جنین را ایجاد میکنند.
مهاجرت سلولی در گاسترولاسیون یکی از پیچیدهترین فرآیندهای تکوینی است. سلولها نه تنها به صورت دستهای حرکت میکنند، بلکه با تغییر شکل و اتصال بین سلولی، الگوهای سهبعدی مشخصی ایجاد میکنند. این مهاجرت، پایهای برای شکلگیری محورهای بدن، توسعه جفت و لوله عصبی و ایجاد فضای بدن جنین است.
گاسترولاسیون همچنین زمینه را برای تعامل میان جنین و جفت فراهم میآورد. تغییرات سلولی و تولید فاکتورهای رشد توسط لایههای مزودرم و اندودرم، موجب تقویت رگزایی و رشد جفت میشود. این تعامل، بهویژه از طریق VEGF و فاکتورهای سیتوکینی، جریان خون و تغذیه جنین را تضمین میکند.
از دیدگاه بالینی، اختلالات در گاسترولاسیون میتوانند منجر به نقایص مادرزادی شدید، سقط زودرس یا ناهنجاریهای ارگانها شوند. بنابراین، مطالعه مولکولی و سلولی این مرحله در زمینههای پزشکی بازساختی، تشخیص پیش از تولد و درمانهای کمکباروری اهمیت حیاتی دارد. تکنولوژیهای مدرن مانند ارگانوئیدها و مدلهای مبتنی بر سلولهای بنیادی امکان بررسی جزئیات مهاجرت سلولی و تعیین سرنوشت ژرم لایهها را فراهم کردهاند.
به طور خلاصه، گاسترولاسیون مرحلهای است که پایهریزی بدن جنین را انجام میدهد. تشکیل سه لایه زاینده، ایجاد محورهای جنینی و آغاز تمایز سلولی در این مرحله، سرنوشت تمامی ارگانها و بافتهای جنین را تعیین میکند. موفقیت در این مرحله برای ادامه رشد طبیعی و شکلگیری یک موجود انسانی سالم ضروری است.
تشکیل جفت و نقش آن در بارداری
پس از مرحله گاسترولاسیون و شکلگیری لایههای زاینده، یکی از حیاتیترین مراحل در تکوین جنین انسان آغاز میشود که تشکیل جفت (Placenta Formation) نامیده میشود. جفت نه تنها به عنوان پل حیاتی میان مادر و جنین عمل میکند، بلکه نقشهای متعدد فیزیولوژیک، ایمنی و هورمونی در حفظ بارداری ایفا میکند. بدون تشکیل مناسب جفت، رشد سالم جنین غیرممکن است و بسیاری از اختلالات بارداری مانند سقط خودبهخودی، رشد محدود داخل رحمی و نارسایی جفت رخ میدهند.
تشکیل جفت از سلولهای تروفکتودرم بلاستوسیست آغاز میشود. این سلولها با مهاجرت به داخل لایه استرومای اندومتر و تعامل با محیط مادری، ساختار اولیه جفت را شکل میدهند. فرآیند جفتزایی شامل سه مرحله اصلی است: اپیتلیالسازی اولیه، نفوذ تروفکتودرم و شکلگیری شبکه رگهای جفتی. در مرحله نخست، سلولهای تروفکتودرم با اندومتر تماس برقرار کرده و با تولید آنزیمهای ماتریکس و فاکتورهای رشد، مسیر خود را برای نفوذ به بافت مادری آماده میکنند.
یکی از فاکتورهای کلیدی در این مرحله VEGF (Vascular Endothelial Growth Factor) است که موجب تحریک رگزایی و شکلگیری شبکههای خونی جنینی میشود. بدون فعالیت مناسب VEGF و سایر فاکتورهای مرتبط با رگزایی، جریان خون کافی به جفت تأمین نمیشود و جنین با مشکلات تغذیه و اکسیژنرسانی مواجه خواهد شد.
تروفوبلاستها، سلولهای تخصصی جفت، به دو نوع عمده تقسیم میشوند: سیتوتروفوبلاست (Cytotrophoblast) و سینسیتیوتروفوبلاست (Syncytiotrophoblast). سیتوتروفوبلاست سلولهای پایهای است که توانایی تقسیم و تکثیر دارند، در حالی که سینسیتیوتروفوبلاست با ادغام چندین سلول، پوشش نهایی جفت را تشکیل میدهد و مسئول تبادل مواد مغذی و گازی بین مادر و جنین است. سینسیتیوتروفوبلاست همچنین هورمونهای حیاتی مانند hCG را ترشح میکند که حفظ بارداری و فعالیت جسم زرد را تضمین مینماید.
علاوه بر عملکرد تغذیهای، جفت نقش حیاتی در تنظیم ایمنی مادرانه دارد. جنین دارای نیمه ژنتیک پدری است و میتواند به عنوان یک “غریبه” توسط سیستم ایمنی مادری شناسایی شود. سلولهای جفت با تولید سیتوکینها و بیان مولکولهای مهارگر ایمنی، پاسخ ایمنی مادری را تنظیم میکنند تا جنین پذیرفته شود. همچنین تعامل میان سلولهای ایمنی اندومتر و تروفوبلاست، مهاجرت و استقرار جنین را تسهیل میکند.
تشکیل جفت همچنین در تنظیم هورمونهای بارداری نقش دارد. جفت هورمونهایی مانند hCG، پروژسترون و استروژن ترشح میکند که رشد اندومتر، توسعه سینهها و حفظ محیط مناسب برای جنین را تضمین مینمایند. هرگونه اختلال در عملکرد جفت، مانند کمکاری یا انسداد رگهای جفتی، میتواند موجب سقط، تأخیر رشد داخل رحمی یا پرهاکلامپسی شود.
از دیدگاه بالینی، بررسی جفت در مراحل اولیه بارداری اهمیت بالایی دارد. تصویربرداریهای سونوگرافی و بررسی جریان خون جفت میتوانند وضعیت رشد و تغذیه جنین را پیشبینی کنند. همچنین، تحقیقات روی سلولهای جفت و مسیرهای سیگنالینگ تروفوبلاست، امکان توسعه درمانهای پیشگیرانه برای مشکلات جفتی را فراهم کرده است.
در نهایت، تشکیل جفت نقطهای است که جنین را از مرحله مستقل بودن به وابستگی کامل به محیط مادری میرساند. جفت به عنوان پل تغذیهای، هورمونی و ایمنی، پایه بقای جنین را شکل میدهد و بدون عملکرد صحیح آن، بارداری سالم امکانپذیر نیست. این مرحله همچنین در درک بیماریهای مرتبط با بارداری، توسعه فناوریهای کمکباروری و مطالعات سلولهای بنیادی اهمیت ویژهای دارد.
تکامل سیستمهای حیاتی جنین
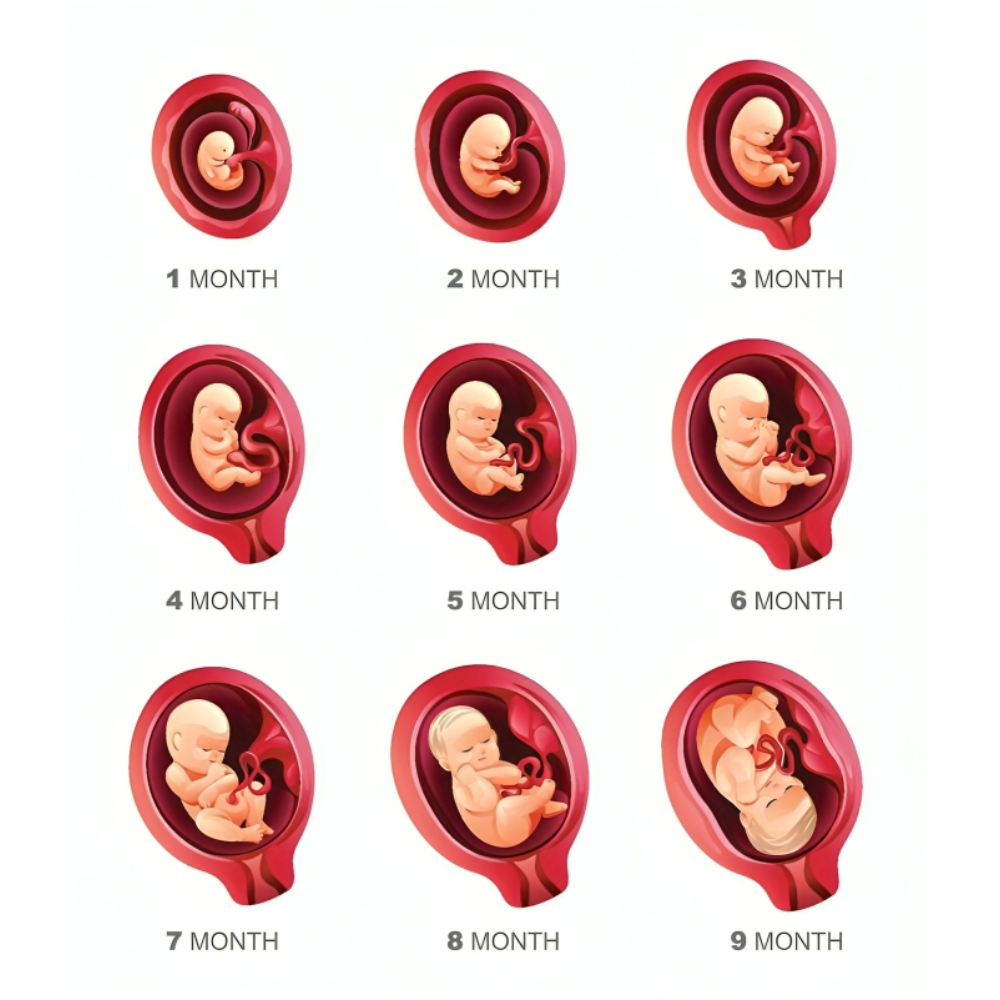
پس از مراحل اولیه تکوین، شامل گاسترولاسیون و تشکیل لایههای زاینده، جنین وارد مرحلهای میشود که در آن سیستمهای حیاتی و ارگانها به تدریج شکل میگیرند. این مرحله، که اغلب به آن ارگانوژنز گفته میشود، از هفته سوم تا هشتم بارداری ادامه دارد و پایهای برای سلامت جسمی و عملکرد صحیح جنین در طول زندگی فراهم میآورد.
تکامل سیستمهای حیاتی بر اساس الگوی سه لایه زاینده انجام میشود و هر لایه نقش خاصی در شکلگیری بافتها و ارگانها دارد:
-
سیستم عصبی و لوله عصبی: این سیستم از اکتودرم شکل میگیرد. لوله عصبی، ساختاری است که در نهایت به مغز و نخاع تبدیل میشود. تشکیل لوله عصبی با رشد و خمیدگی نواحی اکتودرم و اتصال لبههای آن انجام میشود. اختلال در بسته شدن لوله عصبی میتواند به ناهنجاریهایی مانند اسپینا بیفیدا یا آنانسفالی منجر شود. همچنین سلولهای عصبی اولیه مهاجرت کرده و مناطق مغزی خاص، نخاع و سلولهای عصبی محیطی را ایجاد میکنند.
-
سیستم قلبی-عروقی و خونساز: مزودرم نقش اصلی در شکلگیری قلب، عروق خونی و سلولهای خونی دارد. قلب جنین ابتدا به صورت یک لوله ساده شروع به تپش میکند و سپس با خم شدن و تقسیمبندی به چهار حفره و ساختارهای عروقی پیچیده تبدیل میشود. شبکه رگهای اولیه با کمک فاکتورهای رشد مانند VEGF و سیگنالینگ Notch و FGF توسعه مییابد. در همین مرحله، سلولهای مزودرمی به سلولهای خونساز اولیه تبدیل میشوند که منبع سلولهای خونی جنین در اوایل تکوین است.
-
سیستم تنفسی و گوارشی: اندودرم لایه داخلی این ارگانها را شکل میدهد. سلولهای اندودرم با مهاجرت و تعامل با مزودرم، لایههای مخاطی ریهها و دستگاه گوارش را ایجاد میکنند. همزمان، مزودرم اطراف این اندامها بافت همبند و عضلانی آنها را تشکیل میدهد. تعامل بین اندودرم و مزودرم برای رشد صحیح اندامها و پیشگیری از نقصهای مادرزادی حیاتی است.
-
سیستم ادراری و تناسلی: مزودرم جانبی و میانی منشاء کلیهها، مجاری ادراری و سلولهای جنسی اولیه هستند. این سلولها با رشد تدریجی و تمایز به ساختارهای پیچیده، کارکرد ادراری و تولید مثل جنین را پایهریزی میکنند. نقص در مراحل اولیه میتواند موجب آژنزی کلیه یا اختلالات سیستم تناسلی شود.
-
سیستم اسکلتی و عضلانی: مزودرم پاراکسیال منبع بافت استخوانی و عضلانی است. سلولها ابتدا به میوزوبلاستها تبدیل میشوند و سپس با تمایز و تعامل با سیگنالهای مکانیکی و شیمیایی، استخوانها، غضروفها و عضلات اسکلت محوری و اندامها را تشکیل میدهند. این روند برای ایجاد ساختار بدن و توانایی حرکت در مراحل بعدی حیاتی است.
در این مرحله، سیستم گردش خون جفت و جنین به هم متصل میشوند. خون جنین از طریق بند ناف به جفت منتقل میشود و تبادل اکسیژن، مواد مغذی و دفع محصولات متابولیک از طریق سینسیتیوتروفوبلاست انجام میگیرد. این سیستم اهمیت حیاتی در رشد و تکامل ارگانها دارد و هر گونه نقص در جریان خون جفت میتواند منجر به محدودیت رشد داخل رحمی شود.
سیستم ایمنی اولیه جنین نیز در این مرحله شکل میگیرد. سلولهای مزودرم و اکتودرم با تولید مولکولهای سیگنالدهنده، پایههای سیستم ایمنی اولیه را ایجاد میکنند و تعامل با سلولهای ایمنی جفت موجب تنظیم پاسخهای ایمنی مادری و پیشگیری از پس زدن جنین میشود.
همزمان، سیگنالهای مولکولی و مسیرهای اپیژنتیک در کنترل تمایز سلولها و شکلگیری ارگانها نقش دارند. مسیرهای Hedgehog، Wnt، BMP و Notch با تعیین سرنوشت سلولها، الگوی رشد و جهتگیری بافتها، ساختار سهبعدی بدن را شکل میدهند. اختلالات در این مسیرها میتواند منجر به ناهنجاریهای مادرزادی پیچیده شود.
از دیدگاه بالینی، ارزیابی تکامل سیستمهای حیاتی جنین در مراحل اولیه اهمیت بالایی دارد. تصویربرداریهای سونوگرافی، ارزیابی جریان خون جفت، تستهای ژنتیکی و بررسی مولکولی، امکان تشخیص زودهنگام ناهنجاریها و برنامهریزی مداخلات درمانی را فراهم میکنند. در درمانهای کمکباروری نیز، کیفیت جنین و انتخاب مرحله مناسب انتقال برای موفقیت بارداری ارتباط مستقیم با تکامل سیستمهای حیاتی دارد.
در مجموع، تکامل سیستمهای حیاتی جنین، مرحلهای است که پایههای زندگی انسان شکل میگیرند. سیستم عصبی، قلب و عروق، دستگاههای تنفسی و گوارشی، اسکلتی و عضلانی، ادراری و تناسلی و سیستم ایمنی، همه در تعامل پیچیده با یکدیگر و محیط مادری به صورت هماهنگ تکامل مییابند. موفقیت در این مرحله تضمینکننده رشد سالم جنین و پیشگیری از بسیاری از ناهنجاریهای مادرزادی است.
سلولهای بنیادی و حالت پرتوانی
در مراحل اولیه تکوین جنین انسان، سلولهای بنیادی پرتوان نقش حیاتی و مرکزی در شکلگیری تمامی بافتها و ارگانها ایفا میکنند. این سلولها، که عمدتاً از توده داخلی بلاستوسیست (ICM) مشتق میشوند، توانایی تمایز به تمامی انواع سلولی بدن را دارند و به همین دلیل پایه و اساس تکامل جنین محسوب میشوند.
حالت پرتوانی یا Pluripotency مشخصهای است که امکان میدهد سلولهای بنیادی به هر سه لایه زاینده (اِکتودرم، مزودرم و اندودرم) تبدیل شوند. این توانایی سلولها، نقطه عطفی در تکامل اولیه است، زیرا بدون وجود چنین سلولهایی، تشکیل لایههای زاینده و در نتیجه تکامل سیستمهای حیاتی جنین ممکن نخواهد بود. حالت پرتوانی با بیان مجموعهای از ژنهای کلیدی مانند Oct4, Sox2 و Nanog حفظ میشود. این ژنها نه تنها تمایز سلولی را کنترل میکنند بلکه تقسیم و بقا سلولی را نیز تضمین میکنند.
در طول گاسترولاسیون و مراحل بعدی، سلولهای پرتوان تحت تأثیر سیگنالهای محیطی و مسیرهای مولکولی مختلفی مانند Wnt, BMP, FGF و Nodal قرار میگیرند. این سیگنالها تعیین میکنند که کدام سلولها به کدام ژرم لایه و در نهایت به کدام نوع بافت یا ارگان تبدیل شوند. به عبارت دیگر، حالت پرتوانی سلولها به آنها اجازه میدهد که با توجه به نیاز جنین و موقعیت مکانی، مسیر تمایزی خود را انتخاب کنند.
یکی از نکات مهم، تفاوت بین سلولهای بنیادی جنینی و سلولهای بنیادی بالغ است. سلولهای بنیادی جنینی در مرحله بلاستوسیست کاملاً پرتوان هستند و میتوانند به تمام سلولهای بدن تبدیل شوند، در حالی که سلولهای بنیادی بالغ (Adult Stem Cells) محدودیت تمایز دارند و عمدتاً در ترمیم بافتهای مشخص فعالیت میکنند. این ویژگی سلولهای پرتوان، امکان مطالعات گسترده در زمینه زیستشناسی تکاملی، بیماریهای مادرزادی و درمانهای بازساختی را فراهم کرده است.
سلولهای بنیادی جنینی در مراحل اولیه، مسئول بازسازی و جایگزینی سلولهای مرده و ایجاد بافتهای جدید هستند. به عنوان مثال، در تکوین سیستم عصبی، سلولهای بنیادی عصبی ابتدا پرتوان هستند و سپس با مهاجرت و تمایز به نواحی مشخص، نورونها، گلیا و ساختارهای مغزی را تشکیل میدهند. همین روند در تشکیل قلب، کلیه، کبد و سایر اندامها نیز رخ میدهد.
از دیدگاه تحقیقات بالینی و کاربردهای پزشکی، سلولهای بنیادی پرتوان منبع ارزشمندی برای مدلسازی بیماریها، داروسازی و درمانهای سلولی محسوب میشوند. استفاده از سلولهای بنیادی جنینی یا سلولهای بنیادی پرتوان القایی (iPSCs) امکان مطالعه مسیرهای تمایزی و شناسایی مولکولهای کلیدی در تکامل ارگانها را فراهم میکند. این اطلاعات برای درک ناهنجاریهای مادرزادی، توسعه روشهای پیشگیری و طراحی درمانهای بازساختی حیاتی هستند.
یکی از نکات جالب، خودسازماندهی سلولهای بنیادی است. پژوهشهای اخیر نشان دادهاند که سلولهای بنیادی میتوانند بدون دستور خارجی به ساختارهای سهبعدی پیچیده شبیه جنین اولیه، به نام Embroyids و Gastruloids تبدیل شوند. این خودسازماندهی نشاندهنده ظرفیت ذاتی سلولهای پرتوان در ایجاد بافتها و الگوهای سهبعدی بدن است و پنجرهای برای درک دقیق تکوین اولیه انسان فراهم میآورد.
حفظ حالت پرتوانی تا زمان مناسب و آغاز تمایز دقیق، حیاتی است. اختلال در بیان ژنهای پرتوانی یا مسیرهای سیگنالینگ مرتبط میتواند منجر به نقص در شکلگیری لایههای زاینده، اختلال در تکامل ارگانها یا حتی مرگ جنین شود. بنابراین، مطالعه سلولهای بنیادی و حالت پرتوانی آنها نه تنها برای درک زیستشناسی جنین ضروری است، بلکه کاربرد مستقیم در پزشکی بازساختی، تشخیص پیش از تولد و درمانهای نوین دارد.
در مجموع، سلولهای بنیادی پرتوان ستون فقرات تکوین جنین هستند. آنها توانایی تبدیل به تمامی سلولها و بافتها را دارند، مسیرهای تمایزی را تحت تأثیر سیگنالهای مولکولی هدایت میکنند و پایه رشد سیستمهای حیاتی، شکلگیری اندامها و تکامل کامل انسان را فراهم میسازند. بدون این سلولها، مراحل بعدی تکامل جنین و سلامت بارداری ممکن نمیشد.
عوامل محیطی و فرهنگی در تکوین جنین
تکوین جنین انسان تنها به فرآیندهای ژنتیکی و سلولی محدود نمیشود، بلکه عوامل محیطی و فرهنگی نقش بسیار مهمی در شکلگیری سلامت و رشد جنین دارند. این عوامل از لحظه لقاح تا پایان دوران بارداری بر جنین تأثیر میگذارند و میتوانند مسیر تکامل، سلامت ارگانها و حتی ویژگیهای رفتاری و شناختی کودک را تحت تأثیر قرار دهند.
عوامل محیطی شامل تمام شرایط فیزیکی، شیمیایی و زیستی هستند که جنین در رحم با آنها مواجه میشود. تغذیه مادر یکی از مهمترین این عوامل است. کمبود ویتامینها و مواد معدنی حیاتی مانند فولیک اسید، آهن، ید و کلسیم میتواند موجب ناهنجاریهای مادرزادی، مشکلات عصبی و اختلالات رشد جنین شود. بهویژه، فولیک اسید نقش حیاتی در جلوگیری از نقصهای لوله عصبی و حمایت از تکامل مغزی و نخاع دارد.
آلودگیهای محیطی نیز اثر مستقیم بر جنین دارند. قرارگیری مادر در معرض فلزات سنگین، سموم شیمیایی، آلایندههای هوا و مواد مخدر میتواند باعث کاهش رشد جنین، مشکلات قلبی-عروقی، نقصهای مادرزادی و حتی سقط شود. مطالعات متعدد نشان دادهاند که حتی تماس کوتاهمدت با برخی سموم میتواند الگوهای اپیژنتیک سلولهای بنیادی جنین را تغییر دهد و اثرات بلندمدتی بر سلامت کودک داشته باشد.
سطح استرس و سلامت روان مادر از دیگر عوامل حیاتی در تکوین جنین است. هورمونهایی مانند کورتیزول در پاسخ به استرس افزایش مییابند و میتوانند به جنین منتقل شده و رشد مغزی، سیستم ایمنی و پاسخهای رفتاری را تحت تأثیر قرار دهند. بارداری با استرس مزمن میتواند ریسک اختلالات عصبی و رفتاری در کودکان را افزایش دهد. بنابراین، مدیریت استرس و حمایت روانی مادر در دوران بارداری اهمیت بالایی دارد.
عوامل فرهنگی و اجتماعی نیز به طور غیرمستقیم بر تکوین جنین تأثیر میگذارند. الگوهای تغذیهای فرهنگی، باورها و سنتهای مرتبط با بارداری، دسترسی به مراقبتهای بهداشتی و حمایت خانواده همگی در تعیین وضعیت سلامت جنین نقش دارند. برای مثال، در جوامعی که تغذیه مادر به اندازه کافی متنوع و غنی از مواد مغذی نیست، خطر مشکلات رشد و ناهنجاریهای ارگانها افزایش مییابد. علاوه بر این، فرهنگهای مختلف میتوانند رفتارهای مادر را در مواجهه با مصرف داروها، ورزش و مراجعه به پزشک هدایت کنند، که این نیز بر کیفیت تکوین جنین اثرگذار است.
عوامل پزشکی و دارویی نیز جزء محیط جنینی محسوب میشوند. مصرف داروهای خاص، مواجهه با اشعه و انجام برخی اقدامات پزشکی بدون نظارت میتواند منجر به اختلالات رشد یا نقصهای مادرزادی شود. پزشکان تاکید دارند که حتی داروهایی که در بزرگسالان بیخطر هستند، ممکن است در دوران بارداری اثرات مضری بر جنین داشته باشند.
یکی از نکات مهم، تعامل بین عوامل محیطی و ژنتیکی است. جنین ممکن است ژنهای سالم داشته باشد، اما قرارگیری در محیط نامناسب باعث اختلال در بیان ژنها و مسیرهای مولکولی میشود؛ این پدیده تحت عنوان اپیژنتیک محیطی شناخته میشود. به طور مشابه، برخی شرایط محیطی میتوانند اثرات بلندمدت بر سلامت جنین داشته باشند، حتی پس از تولد، و ریسک بیماریهایی مانند دیابت، بیماریهای قلبی و اختلالات رفتاری را افزایش دهند.
تغییرات هورمونی و فیزیولوژیک مادر نیز تحت تأثیر محیط قرار دارند. کمبود خواب، تغذیه نامناسب یا فعالیت بدنی غیرمتوازن میتواند موجب تغییر در سطوح هورمونی مانند پروژسترون، استروژن و هورمونهای تیروئیدی شود و روند رشد اندامها، جفت و سیستم عصبی را تحت تأثیر قرار دهد.
در مجموع، تکوین جنین انسان یک فرآیند پویا و حساس به محیط و فرهنگ است. سلامت مادر، تغذیه، استرس، تماس با آلایندهها، دسترسی به مراقبتهای پزشکی و باورهای فرهنگی همگی میتوانند مسیر رشد جنین را تغییر دهند. بنابراین، برای اطمینان از تکامل سالم جنین، نیاز است که عوامل محیطی و فرهنگی به دقت مدیریت شوند و مادر در شرایط حمایتشده و سالم دوران بارداری را طی کند.
فناوریهای نوین در ارزیابی جنین
با پیشرفت علم و تکنولوژی، ارزیابی جنین انسان از مرحله پیش از تولد به صورت چشمگیری توسعه یافته است. فناوریهای نوین امکان مشاهده، تحلیل و پیشبینی کیفیت و سلامت جنین را با دقت بسیار بالا فراهم کردهاند. این ابزارها نه تنها در حوزه درمانهای کمکباروری کاربرد دارند، بلکه در تشخیص ناهنجاریهای ژنتیکی و جلوگیری از مشکلات مادرزادی نیز نقش حیاتی ایفا میکنند.
یکی از پیشرفتهای کلیدی، استفاده از فناوری تصویربرداری و Time-lapse است. در گذشته، بررسی جنین در آزمایشگاه تنها بر اساس ظاهر و مورفولوژی سلولها انجام میشد. اما با سیستمهای Time-lapse، امکان مشاهده رشد جنین در طول زمان و ثبت تغییرات سلولی فراهم شده است. این فناوری به متخصصان اجازه میدهد تا سرعت تقسیم سلولی، نظم بلاستومرها و مراحل کلیدی مانند تشکیل مورولا و بلاستوسیست را به دقت ارزیابی کنند. تحلیل این دادهها با الگوریتمهای پیشرفته، پیشبینی موفقیت جنین در مرحله انتقال به رحم را بسیار دقیقتر کرده است.
یکی دیگر از فناوریهای نوین، استفاده از الگوریتمهای هوش مصنوعی و یادگیری ماشین برای ارزیابی کیفیت جنین است. الگوریتمها قادرند میلیونها داده تصویری و مولکولی را پردازش کرده و الگوهای رشد و خطرات احتمالی را تشخیص دهند. این سیستمها میتوانند جنینهای با کیفیت بالاتر را برای انتقال انتخاب کنند و احتمال بارداری موفق و کاهش سقطهای خودبهخودی را افزایش دهند. استفاده از AI همچنین امکان تحلیل ترکیبی دادههای مورفولوژیک، ژنتیکی و فیزیولوژیک جنین را فراهم میکند و دید جامعتری از سلامت جنین ارائه میدهد.
تستهای ژنتیکی پیش از لانهگزینی (PGT) نیز بخش مهمی از فناوریهای ارزیابی جنین هستند. این تستها امکان تشخیص اختلالات کروموزومی، اختلالات تکژنی و حتی برخی تغییرات اپیژنتیک را قبل از انتقال جنین به رحم فراهم میکنند. PGT به پزشکان کمک میکند تا جنین سالمتر و با ریسک کمتر برای مشکلات مادرزادی انتخاب شود. علاوه بر این، ترکیب PGT با روشهای Time-lapse و هوش مصنوعی، به پیشبینی دقیقتر کیفیت جنین کمک میکند و بهینهسازی درمانهای کمکباروری را امکانپذیر میسازد.
ارزیابی مولکولی جنین نیز در سالهای اخیر به عنوان یک ابزار مکمل اهمیت یافته است. با بررسی RNA و پروتئینهای جنین، مسیرهای سیگنالینگ، وضعیت سلولهای بنیادی و فعالیت ژنهای پرتوانی قابل بررسی هستند. این اطلاعات به متخصصان کمک میکند تا نه تنها ظاهر جنین بلکه وضعیت عملکردی و بیولوژیک آن را نیز ارزیابی کنند. برای مثال، سطح بیان ژنهای مرتبط با رشد و بقا یا مسیرهای اپیژنتیک، نشاندهنده سلامت و توانایی جنین در ادامه رشد است.
یکی دیگر از فناوریهای مدرن، مدلسازی جنین با سلولهای بنیادی و ساخت Embryoids است. این مدلها امکان مطالعه تکوین اولیه جنین، تشکیل لایههای زاینده، مهاجرت سلولی و تعامل با محیط را در شرایط آزمایشگاهی فراهم میکنند. این روشها به درک دقیقتر مکانیسمهای رشد و مسیرهای اختلالات مادرزادی کمک میکنند و میتوانند به طراحی داروها و مداخلات درمانی کمک کنند بدون اینکه جنین واقعی در معرض خطر قرار گیرد.
از سوی دیگر، فناوریهای پیشرفته در زمینه فریز و ویتریفیکیشن جنین نیز نقش حیاتی در درمانهای کمکباروری دارند. ویتریفیکیشن امکان ذخیره طولانیمدت جنین با حفظ حداکثر کیفیت و بقا را فراهم میکند. این فناوری با کاهش آسیب سلولی و حفظ حالت پرتوانی سلولهای بنیادی، نرخ موفقیت بارداری پس از انتقال جنین را بهبود میبخشد. مطالعات نشان دادهاند که ویتریفیکیشن به مراتب ایمنتر و کارآمدتر از روشهای سنتی فریز آهسته است و امکان نگهداری جنین برای دورههای طولانی بدون افت کیفیت را فراهم میکند.
بررسی ترکیبی چند فناوری، یعنی استفاده همزمان از تصویربرداری Time-lapse، هوش مصنوعی، تستهای ژنتیکی و ارزیابی مولکولی، به متخصصان امکان میدهد تا جنین را به صورت کامل و چندبعدی تحلیل کنند. این رویکرد جامع، نه تنها شانس موفقیت بارداری را افزایش میدهد بلکه ریسک مشکلات دوران بارداری و اختلالات مادرزادی را کاهش میدهد.
در نهایت، فناوریهای نوین در ارزیابی جنین، با ترکیب ابزارهای تصویربرداری، هوش مصنوعی، تحلیل ژنتیکی و مولکولی و مدلسازی سلولی، چشماندازی کاملاً جدید در زیستشناسی و پزشکی تولید مثل ایجاد کردهاند. این فناوریها نه تنها کیفیت و سلامت جنین را پیشبینی میکنند، بلکه مسیر تحقیقات پایه در زمینه تکوین انسان، سلولهای بنیادی و پیشگیری از بیماریها را نیز متحول کردهاند.
چالشهای اخلاقی و ایمنی
تکوین جنین انسان علاوه بر پیچیدگیهای زیستشناختی، با چالشهای اخلاقی و ایمنی قابل توجهی همراه است که دانشمندان، پزشکان و سیاستگذاران در حوزه تولید مثل و تحقیقات جنینی باید به آنها توجه کنند. این مسائل از مرحله پیش از لقاح تا مراحل پیشرفته تکامل جنین، جنبههای حقوقی، اخلاقی، اجتماعی و پزشکی را در بر میگیرند.
یکی از مهمترین جنبههای اخلاقی، استفاده از جنین انسان در تحقیقات علمی است. پژوهش روی جنینهای انسانی، به ویژه در مراحل اولیه، امکان درک بهتر تکوین، اختلالات ژنتیکی و فرآیندهای سلولی را فراهم میکند. با این حال، این نوع تحقیقات با سوالات اخلاقی اساسی روبهرو است: آیا جنین انسان به عنوان یک موجود زنده و با ارزش باید محدودیتهایی در استفاده پژوهشی داشته باشد؟ چه حدی از آزمایش و دستکاری سلولی قابل قبول است؟ پاسخ به این پرسشها بسته به فرهنگ، مذهب و قوانین کشوری متفاوت است، اما اصل احترام به حیات و جلوگیری از آسیب به جنین یک معیار اساسی در تدوین دستورالعملهای اخلاقی محسوب میشود.
ایمنی مادر و جنین یکی دیگر از نگرانیهای مهم است. روشهای کمکباروری مانند IVF و ICSI، استفاده از فناوریهای ویتریفیکیشن و ارزیابی ژنتیکی پیش از لانهگزینی، مزایای زیادی دارند، اما خطرات بالقوهای نیز دارند. برای مثال، انتقال چندین جنین میتواند خطر بارداری چندقلویی و عوارض مرتبط با آن را افزایش دهد. همچنین، آزمایشهای ژنتیکی و مداخلات مولکولی باید با دقت انجام شوند تا آسیبی به جنین وارد نشود. رعایت استانداردهای ایمنی و پایش دقیق مراحل درمان برای جلوگیری از خطرات غیرضروری، یک الزام اخلاقی و پزشکی است.
یکی از بحثهای کلیدی، حقوق جنین در برابر حقوق والدین است. والدین حق دارند بهترین گزینهها را برای سلامت و موفقیت بارداری انتخاب کنند، اما جنین نیز دارای حقوقی است که باید در نظر گرفته شود. این تعارض گاهی در تصمیمگیریهای پزشکی مانند انتخاب جنین سالم، آزمایشهای ژنتیکی و روشهای پیشگیری از بیماریها به وضوح مشاهده میشود. ایجاد چارچوبهای قانونی و اخلاقی برای تعادل بین حقوق والدین و احترام به جنین، امری ضروری است.
کاربرد سلولهای بنیادی و فناوریهای بازساختی نیز با نگرانیهای اخلاقی همراه است. ایجاد Embryoids یا مدلهای شبیه جنین برای مطالعه تکوین، اگرچه مزایای علمی فراوانی دارد، اما سوالاتی در مورد حد و مرز دستکاریهای ژنتیکی و امکان تبدیل این مدلها به موجود زنده واقعی مطرح میکند. همچنین، استفاده از سلولهای بنیادی پرتوان القایی (iPSCs) باید تحت کنترل باشد تا خطر تشکیل تومورها یا اختلالات سلولی کاهش یابد.
پیشگیری از بروز ناهنجاریهای مادرزادی از طریق فناوریهای ژنتیکی، مانند ویرایش ژن با CRISPR، یکی دیگر از حوزههای حساس است. اگرچه ویرایش ژنتیکی میتواند بیماریهای تکژنی را اصلاح کند، اما نگرانیهای اخلاقی شامل احتمال تغییرات نسلبهنسل، نابرابری اجتماعی در دسترسی به این فناوری و ریسکهای ناشناخته برای سلامت جنین را به همراه دارد. بحث در مورد محدودیتها و مجوزهای قانونی برای این نوع فناوریها، یکی از موضوعات داغ در جامعه علمی و عمومی است.
از منظر اجتماعی و فرهنگی، پذیرش روشهای کمکباروری و دستکاری جنینی متفاوت است. در برخی جوامع، نگرانیهای مذهبی و فرهنگی میتواند استفاده از فناوریها را محدود کند، در حالی که در جوامع دیگر، تاکید بر سلامت و پیشگیری از بیماریها ممکن است محدودیتهای اخلاقی را کاهش دهد. بنابراین، تدوین سیاستها و راهنماهای اخلاقی باید با توجه به زمینههای فرهنگی، اجتماعی و مذهبی انجام شود.
در نهایت، شفافیت، آموزش و نظارت دقیق از عناصر حیاتی در مواجهه با چالشهای اخلاقی و ایمنی است. متخصصان و والدین باید از ریسکها، مزایا و محدودیتهای روشهای نوین تکوین آگاه باشند. قوانین ملی و بینالمللی، مانند محدودیتهای زمانی بر پژوهش روی جنین و مقررات مربوط به ویرایش ژن، نقش مهمی در تضمین رعایت اصول اخلاقی و ایمنی دارند.
به طور خلاصه، چالشهای اخلاقی و ایمنی در تکوین جنین شامل احترام به حیات جنین، ایمنی مادر و جنین، حقوق والدین و جنین، محدودیتهای دستکاری ژنتیکی و سلولی و ملاحظات فرهنگی و اجتماعی است. رعایت این اصول و توسعه فناوریها در چارچوب اخلاقی و ایمنی، پایهای برای پیشرفت علمی مسئولانه و حفظ سلامت نسلهای آینده است.
جمعبندی و نتیجهگیری
تکوین جنین انسان یک فرآیند پیچیده، دقیق و شگفتانگیز است که از لحظه لقاح آغاز شده و با تکامل سیستمهای حیاتی، شکلگیری اندامها و آمادهسازی برای تولد ادامه مییابد. در این مقاله، مسیر کامل تشکیل جنین انسان از مراحل اولیه سلولی تا توسعه سیستمهای حیاتی و نقش عوامل محیطی، فرهنگی و فناوریهای نوین بررسی شد.
در مراحل ابتدایی، لقاح و تشکیل زیگوت نقطه آغاز حیات است. این لحظه، جایی که اسپرم و تخمک با هم ترکیب میشوند و ژنوم جدیدی را شکل میدهند، اساس همه مراحل بعدی را تعیین میکند. پس از لقاح، تقسیمات اولیه و تشکیل بلاستومرها آغاز میشود، سلولها به سرعت تقسیم میشوند و قابلیت تمایز در مسیرهای مختلف را پیدا میکنند. این تقسیمات، پایه شکلگیری مورولا و بلاستوسیست را ایجاد کرده و زمینه لازم برای مهاجرت سلولی و ایجاد لایههای زاینده فراهم میکنند.
کاشت جنین در رحم و تعامل آن با محیط رحم، از اهمیت ویژهای برخوردار است. موفقیت کاشت تحت تاثیر سلامت مخاط رحم، سیگنالهای مولکولی، جریان خون و شرایط ایمنی و تغذیهای مادر است. پس از کاشت، گاسترولاسیون و تشکیل لایههای زاینده رخ میدهد، که در آن سلولها به لایههای اکتودرم، مزودرم و اندودرم تمایز یافته و مسیر تشکیل اندامها و بافتهای مختلف را مشخص میکنند.
تشکیل جفت و نقش آن در بارداری، پشتیبانی از جنین و تبادل مواد غذایی و اکسیژن را تضمین میکند. جفت، به عنوان یک عضو موقت اما حیاتی، همواره با تنظیم هورمونها و سیگنالهای مولکولی، سلامت و رشد جنین را تحت کنترل دارد. در ادامه، تکامل سیستمهای حیاتی جنین، شامل سیستم عصبی، قلبی-عروقی، کلیوی و سایر ارگانها، بر اساس تعامل بین ژنتیک، سیگنالهای محیطی و سلولهای بنیادی پرتوان انجام میشود.
سلولهای بنیادی و حالت پرتوانی پایه و اساس تکامل جنین هستند و توانایی تبدیل به تمامی سلولها و بافتها را دارند. این سلولها تحت تأثیر مسیرهای مولکولی دقیق و سیگنالهای محیطی، به سلولهای تخصصی تبدیل شده و تشکیل سیستمهای عصبی، قلبی، کلیوی و دیگر ارگانها را امکانپذیر میسازند.
عوامل محیطی و فرهنگی نیز نقش تعیینکنندهای در رشد و سلامت جنین دارند. تغذیه، استرس مادر، آلودگیها، دسترسی به مراقبتهای پزشکی و باورهای فرهنگی، مسیر تکوین جنین را تحت تأثیر قرار میدهند. این عوامل میتوانند به شکل مستقیم بر سلامت ارگانها و سیستمها اثر گذاشته و حتی در بعد اپیژنتیک، الگوهای بیان ژنی را تغییر دهند.
در دهههای اخیر، فناوریهای نوین در ارزیابی جنین، از Time-lapse و هوش مصنوعی تا تستهای ژنتیکی و مدلسازی سلولهای بنیادی، امکان انتخاب جنین سالم و پیشبینی موفقیت بارداری را با دقت بیسابقه فراهم کردهاند. این ابزارها هم به بهبود درمانهای کمکباروری کمک میکنند و هم امکان مطالعه فرآیندهای پایهای تکوین انسان را بدون آسیب به جنین واقعی فراهم میآورند.
با این حال، چالشهای اخلاقی و ایمنی در زمینه پژوهش و مداخلات جنینی همواره وجود دارند. استفاده از جنین در تحقیقات، ویرایش ژنتیکی، دستکاری سلولهای بنیادی و انتخاب جنین، نیازمند رعایت اصول اخلاقی، احترام به حیات و نظارت دقیق است. همچنین، تعادل بین حقوق والدین و حقوق جنین، یکی از دغدغههای اساسی در حوزه پزشکی تولید مثل محسوب میشود.
در نهایت، میتوان گفت که تکوین جنین انسان نتیجه تعامل پیچیده بین ژنتیک، سلولهای بنیادی، سیگنالهای مولکولی، محیط و فناوریهای نوین است. شناخت این فرآیندها نه تنها برای درک زیستشناسی پایه و سلامت جنین ضروری است، بلکه پایهای برای توسعه درمانهای بازساختی، پیشگیری از بیماریهای مادرزادی و بهبود موفقیت درمانهای کمکباروری فراهم میکند.
نتیجهگیری کلیدی این است که حیات انسان از همان لحظه لقاح فرآیندی پویا، حساس و تحت تأثیر چندین عامل متقابل است. هر مرحله از تقسیمات سلولی، تمایز، کاشت جنین، گاسترولاسیون، تکامل سیستمها و تعامل با محیط، اهمیت حیاتی دارد. ترکیب دانش زیستشناسی، فناوریهای نوین و رعایت اصول اخلاقی و ایمنی، مسیر رشد و تکامل سالم جنین را تضمین میکند و آینده سلامت انسانها را شکل میدهد.