جنینشناسی و تکوین
مقدمه
جنینشناسی و زیستشناسی تکوینی یکی از شاخههای بنیادین علوم زیستی و پزشکی است که به مطالعه فرآیند شکلگیری و تحول یک موجود زنده از مرحله لقاح تا تکامل اندامها و بافتها میپردازد. این حوزه نه تنها درک ما را از سازوکارهای حیات و قوانین زیستی عمیقتر میکند، بلکه کلید اصلی برای فهم بسیاری از بیماریها، ناهنجاریهای مادرزادی، و حتی سرطان به شمار میآید. در حقیقت، اگر بتوانیم بفهمیم چگونه یک سلول منفرد به مجموعهای پیچیده از بافتها و اندامها تبدیل میشود، آنگاه میتوانیم پاسخ بسیاری از پرسشهای پزشکی و زیستی را بیابیم.
جنینشناسی بهعنوان علمی که تاریخچهای طولانی دارد، از زمان ارسطو و مشاهدههای اولیه او بر تخمگذاری پرندگان آغاز شد و تا امروز با بهرهگیری از ابزارهای مدرن مانند میکروسکوپهای نوری پیشرفته، ژنومیکس تکسلولی، اپتوژنتیک و مدلسازی رایانهای به یکی از پویاترین شاخههای زیستشناسی تبدیل شده است. در گذشته نگاه دانشمندان بیشتر بر توصیف ظاهر جنین و مراحل شکلی آن متمرکز بود، اما در دوران معاصر این علم به سطحی رسیده که قادر است مکانیسمهای مولکولی، مسیرهای سیگنالینگ و حتی نقش انرژی و متابولیسم در تکوین را بررسی کند.
از سوی دیگر، اهمیت این دانش تنها به حوزه زیستشناسی پایه محدود نمیشود. کاربردهای بالینی و فناورانه جنینشناسی در دهههای اخیر جهشی چشمگیر داشته است. امروزه پزشکان و پژوهشگران از دانش تکوین برای توسعه روشهای جدید درمانی در زمینههای گوناگون مانند پزشکی بازساختی، مهندسی بافت، تولید اندامهای آزمایشگاهی (ارگانوئیدها)، و اصلاح ژنتیکی (CRISPR/Cas9) بهره میگیرند. به همین دلیل، زیستشناسی تکوینی دیگر صرفاً علمی برای شناخت رشد جنین نیست، بلکه به پلی میان زیستشناسی پایه، فناوریهای نوین و درمانهای کلینیکی تبدیل شده است.
یکی دیگر از جنبههای جذاب این حوزه، ارتباط تنگاتنگ میان جنینشناسی و تکامل است. مطالعه مراحل رشد جنین در گونههای مختلف، مانند قورباغه، ماهی زبرا، موش و انسان، نه تنها درک ما را از تفاوتهای گونهای روشن میکند، بلکه به ما نشان میدهد چگونه طی میلیونها سال، مکانیسمهای تکوینی تغییر یافته و موجب پدید آمدن تنوع زیستی عظیم امروزی شدهاند. از این رو، زیستشناسی تکوینی را میتوان پلی میان ژنتیک، تکامل و پزشکی دانست.
علاوه بر این، این دانش به یکی از مهمترین حوزهها در مطالعه سلامت نسل آینده تبدیل شده است. پژوهشهای اخیر نشان دادهاند که شرایط محیطی، تغذیه، وضعیت جسمی و روانی والدین و حتی کیفیت اسپرم و اووسیت، میتوانند بهطور مستقیم یا غیرمستقیم بر رشد جنین، بروز بیماریهای مزمن در بزرگسالی و حتی امید به زندگی نسل بعدی اثر بگذارند. این نظریه که با عنوان “Developmental Origins of Health and Disease (DOHaD)” شناخته میشود، اهمیت جنینشناسی را فراتر از آزمایشگاه و در سطح جامعه و بهداشت عمومی نشان میدهد.
امروزه با ظهور فناوریهای نوین مانند توالییابی RNA تکسلولی، تصویربرداری سهبعدی زنده، و هوش مصنوعی در تحلیل دادههای تکوینی، درک ما از فرآیندهای پیچیده رشد به شکل بیسابقهای گسترش یافته است. ایجاد اطلس سلولی تکوین انسان (Human Developmental Cell Atlas) یکی از پروژههای بزرگ علمی است که تلاش دارد تمام سلولهای بدن انسان را از نخستین روزهای حیات تا مراحل بلوغ شناسایی و طبقهبندی کند. چنین پروژههایی نه تنها به درک بهتر رشد طبیعی کمک میکنند، بلکه دریچهای نو به سوی تشخیص زودهنگام بیماریها، درمانهای شخصیسازیشده و طراحی داروهای هدفمند میگشایند.
از منظر بالینی، دانش جنینشناسی نقش تعیینکنندهای در زمینههایی همچون درمان ناباروری، درک مکانیسمهای بروز سقط مکرر، مطالعه بیماریهای مادرزادی قلب، نقائص لوله عصبی، و اختلالات کلیوی و اسکلتی دارد. همچنین با استفاده از مدلهای آزمایشگاهی مانند ارگانوئیدها و جنینوارههای مصنوعی، میتوان مراحل حساس تکوین را بازسازی و مطالعه کرد، بدون آنکه نیاز به مداخله مستقیم در جنین انسانی باشد.
در کنار همه اینها، جنینشناسی با پرسشهای فلسفی و اخلاقی عمیقی نیز همراه است. مباحثی مانند زمان آغاز حیات، حدود اخلاقی استفاده از جنین انسانی در پژوهشها، و دستکاری ژنتیکی در مراحل اولیه رشد از جمله چالشهایی هستند که این دانش را با حوزه اخلاق زیستی و حقوق بینالملل گره میزنند. بنابراین، این علم نهتنها از منظر زیستی، بلکه از دیدگاه اجتماعی و اخلاقی نیز اهمیت دارد.
به طور خلاصه، جنینشناسی و زیستشناسی تکوینی در قلب بسیاری از پرسشهای اساسی علم و پزشکی قرار دارند. این حوزه به ما میآموزد که چگونه از یک سلول ساده، ساختاری بهغایت پیچیده و هماهنگ به وجود میآید، چگونه اختلال در این فرآیند میتواند منجر به بیماری شود، و چگونه میتوانیم با بهرهگیری از این دانش راههای نوینی برای درمان و بهبود کیفیت زندگی انسانها بیابیم. در ادامه این مقاله، با مرور تاریخچه، مفاهیم بنیادین، ابزارها و فناوریهای نوین، کاربردهای بالینی و چشمانداز آینده، تلاش میکنیم تصویری جامع و کامل از این حوزه پویای علمی ارائه دهیم.
تاریخچه و سیر تحول جنینشناسی
مطالعه جنین و مراحل رشد موجودات زنده از دیرزمان مورد توجه دانشمندان بوده است. جنینشناسی به عنوان یک علم مستقل، ریشههای عمیقی در تاریخ تفکر انسانی دارد و میتوان آن را پلی میان مشاهده طبیعی و کشف قوانین بنیادین زیستشناسی دانست. در دوران باستان، فلاسفهای مانند ارسطو نخستین کسی بود که به مطالعه مراحل رشد جنین پرندگان و مقایسه آن با انسان پرداخت. ارسطو در آثار خود مانند «تاریخ حیوانات» و «نسل و تولید مثل» به توصیف دقیق مراحل رشد جنین و تأثیر عوامل محیطی بر شکلگیری آنها پرداخت و نخستین فرضیات درباره تعیین سرنوشت سلولی و لایههای جنینی را ارائه داد. او معتقد بود که رشد جنین یک فرآیند تدریجی و پیوسته است که از ساده به پیچیده حرکت میکند.
با ورود به دوران رنسانس، توسعه میکروسکوپهای اولیه، انقلابی در جنینشناسی ایجاد کرد. دانشمندانی مانند مارچلو مالپیگی و رابرت هوک توانستند با مشاهده بافتها و سلولها، ساختارهای جنینی و لایههای زاینده را شناسایی کنند. این دوره نقطه عطفی در انتقال جنینشناسی از یک علم توصیفی و فلسفی به یک علم تجربی بود. مالپیگی با بررسی تخم پرندگان و پستانداران، نشان داد که هر اندام و بافتی در جنین از سلولها و لایههای مشخصی شکل میگیرد، و هوک نیز با کشف سلول و مفهوم سلول به عنوان واحد بنیادی حیات، زمینه را برای درک مدرن جنینشناسی فراهم کرد.
در قرن نوزدهم، پیشرفتهای چشمگیری در میکروسکوپی و رنگآمیزی بافتها حاصل شد. این فناوریها به دانشمندان امکان داد تا جزئیات دقیقتر مراحل تقسیم سلولی، گاسترولاسیون و مهاجرت سلولها را مشاهده کنند. کارل فون بائر با کشف سیستمهای لایهبندی و منشأ اندامها، و همچنین هانس درش و ادواردس با مطالعات بر روی تخم قورباغه و پرندگان، توانستند قوانین عمومی رشد و توسعه جنین را استخراج کنند. از این دوران به بعد، دو نظریه مهم در جنینشناسی شکل گرفت: نظریه Epigenesis که بر تدریجی بودن رشد و تغییرات مرحلهای تأکید دارد و نظریه Preformation که معتقد بود موجود زنده از ابتدا به صورت کامل وجود دارد و فقط بزرگ میشود. تجربه و شواهد علمی به مرور نظریه Epigenesis را به عنوان مدل صحیح رشد جنین تأیید کرد، چرا که مشاهده میشد اندامها و بافتها به صورت تدریجی و مرحلهای شکل میگیرند.
با ورود به قرن بیستم، جنینشناسی مدرن و زیستشناسی مولکولی تکوینی شکل گرفت. کشف DNA، RNA و ساختار ژنها، به دانشمندان امکان داد تا مکانیسمهای مولکولی کنترل رشد جنین، مسیرهای سیگنالینگ و نقش ژنها در تعیین سرنوشت سلولی را مطالعه کنند. در این دوره، مدلهای آزمایشگاهی متنوعی مانند موشهای آزمایشگاهی، قورباغه، ماهی زبرا و حتی گیاهان مدل به کار گرفته شدند تا بتوان فرآیندهای تکوینی را در محیط کنترل شده بررسی کرد. مطالعه مهاجرت سلولهای Neural crest، شکلگیری اندامها، و تکامل اسکلت مهرهداران از جمله پیشرفتهای کلیدی این دوران بودند.
دهههای اخیر با ظهور فناوریهای نوین مانند ژنتیک تکسلولی، ارگانوئیدها، تصویربرداری سهبعدی زنده و اپتوژنتیک، تحول عظیمی در جنینشناسی ایجاد کردهاند. این ابزارها به پژوهشگران امکان دادهاند تا مراحل اولیه تکوین انسان و سایر گونهها را با دقت بیسابقه بررسی کنند و حتی نحوه تأثیر محیط و سیگنالهای مولکولی بر رشد را بازسازی کنند. به عنوان مثال، پروژه Human Developmental Cell Atlas در تلاش است تا تمام سلولهای بدن انسان را در مراحل مختلف تکوین شناسایی و نقشهبرداری کند، و این خود نقطه عطفی در ادغام دانش پایه با فناوریهای بالینی و پزشکی بازساختی محسوب میشود.
همچنین، جنینشناسی تاریخی عمیق در درک بیماریهای مادرزادی، اختلالات ژنتیکی و حتی سرطان داشته است. مشاهده اینکه برخی مکانیسمهای رشد جنین مشابه فرآیندهای مهاجرت و تکثیر سلولهای سرطانی است، به شکلگیری مفاهیم جدید در پژوهشهای سرطانشناسی تکوینی کمک کرده است. در این مسیر، نظریههای کلاسیک با فناوریهای مدرن ترکیب شدهاند تا بینشهای نوینی در مورد تکامل، بیماری و بازسازی بافت ارائه دهند.
درک سیر تاریخی جنینشناسی نه تنها اهمیت این علم را در مطالعه رشد طبیعی و تکامل اندامها روشن میکند، بلکه به ما نشان میدهد که چگونه پیشرفتهای فناوری و روششناسی، باعث شکلگیری نسل جدیدی از پژوهشگران تکوینی شدهاند که قادرند پیچیدهترین سوالات زیستشناسی و پزشکی را پاسخ دهند. مطالعه تاریخچه این علم به ما این امکان را میدهد که روند تحول ایدهها، از مشاهده اولیه تا کشف قوانین مولکولی، و در نهایت کاربردهای بالینی آن را درک کنیم و بدانیم که چگونه دانش جنینشناسی توانسته است مسیر پزشکی نوین و علوم زیستی را متحول سازد.
به طور خلاصه، تاریخچه جنینشناسی نشاندهنده یک مسیر پیوسته از مشاهده و تفسیر تجربی به سمت درک مولکولی و کاربرد بالینی است. این مسیر نه تنها درک ما از سازوکارهای بنیادین رشد را بهبود بخشیده، بلکه توانسته است ارتباط میان ژنتیک، تکامل، بیماری و فناوریهای درمانی را به روشنی نشان دهد و مسیر روشنی برای پژوهشهای آینده فراهم آورد.
اصول و مفاهیم بنیادین در تکوین
درک فرآیندهای تکوین مستلزم آشنایی با مفاهیم بنیادین زیستشناسی سلولی و مولکولی است که نحوه تبدیل یک سلول منفرد به یک موجود پیچیده چندسلولی را توضیح میدهند. تکوین یا دِولُپمنتال بیولوژی شامل مجموعهای از مراحل هماهنگ است که طی آن، سلولها تقسیم میشوند، تمایز پیدا میکنند، مهاجرت میکنند و در نهایت بافتها و اندامهای منسجم را تشکیل میدهند. فهم این اصول نه تنها برای دانشمندان پایهای اهمیت دارد، بلکه پزشکان نیز میتوانند از آن برای تشخیص و درمان بیماریهای مادرزادی، نقصهای اسکلتی و عصبی، و اختلالات قلبی–عروقی بهره ببرند.
یکی از نخستین مفاهیم بنیادین در تکوین، لقاح و آغاز حیات است. لقاح فرایندی است که طی آن اسپرم و اووسیت با یکدیگر ترکیب میشوند و زیگوت یکسلولی شکل میگیرد. این سلول تنها حاوی ژنهای والدین است و مسیر رشد تمام سلولها و بافتهای آینده را تعیین میکند. پس از لقاح، تقسیمات سلولی متوالی یا میتوز آغاز میشود و زیگوت به مجموعهای از سلولهای کوچکتر به نام بلاستومرها تبدیل میشود. این مرحله از اهمیت بالایی برخوردار است، زیرا تعداد سلولها، اندازه و نوع تقسیم سلولی، مسیرهای تکوینی بعدی را مشخص میکند و هر گونه اختلال میتواند به ناهنجاریهای شدید منجر شود.
پس از تقسیمات اولیه، زیگوت وارد مرحله بلاستوسیست میشود. بلاستوسیست شامل دو بخش اصلی است: تروفکتودرما که در نهایت جفت را شکل میدهد و ماس سلولی داخلی (Inner Cell Mass) که جنین واقعی از آن منشأ میگیرد. در این مرحله، تعیین محورهای بدن جنین (سر–دم، چپ–راست، پشتی–شکمی) آغاز میشود. این محورهای بدن، به کمک سیگنالهای مولکولی و توزیع مورفوژنها شکل میگیرند و نقش کلیدی در سازماندهی فضایی سلولها دارند.
یکی دیگر از مفاهیم مهم در تکوین، گاسترولاسیون است. گاسترولاسیون فرایندی است که طی آن بلاستومرها به سه لایه زاینده اصلی یعنی اِکتودرم، مزودرم و اندودرم تمایز مییابند. این لایهها پایه و اساس همه بافتها و اندامها را تشکیل میدهند. برای مثال، اکتودرم منجر به تشکیل سیستم عصبی و اپیدرم پوست میشود، مزودرم اسکلت، عضلات، قلب و کلیهها را شکل میدهد، و اندودرم مسئول ایجاد دستگاه گوارش و تنفسی است. در این مرحله، مفهوم تعیین سرنوشت سلولی اهمیت فراوان دارد؛ سلولها تحت تأثیر سیگنالهای محیطی و ژنتیکی مسیر تمایز خود را انتخاب میکنند و اختلال در این سیگنالها میتواند موجب اختلالات مادرزادی شود.
در کنار گاسترولاسیون، مهاجرت سلولی و چسبندگی بافتها از اصول کلیدی دیگر تکوین هستند. سلولها نه تنها تقسیم میشوند بلکه مکان خود را تغییر میدهند و با دیگر سلولها و ماتریکس خارج سلولی تعامل برقرار میکنند. این تعاملات برای تشکیل بافتهای سهبعدی و اندامها ضروری هستند. مطالعات اخیر نشان دادهاند که مکانیک بافت و نیروهای سلولی نقش اساسی در تعیین شکل نهایی اندامها دارند و هر گونه اختلال در این فرایند میتواند منجر به ناهنجاریهای ساختاری شود.
سیگنالهای مولکولی و مسیرهای ژنتیکی نیز جزء اصول بنیادین تکوین هستند. مسیرهایی مانند Wnt، BMP، Notch و Hedgehog نقش حیاتی در تعیین سرنوشت سلولها، قطببندی بدن و ایجاد الگوهای فضایی دارند. این مسیرها اغلب با مکانیسمهای بازخورد و تنظیم مثبت و منفی کنترل میشوند تا اطمینان حاصل شود که سلولها در زمان و مکان مناسب تقسیم و تمایز پیدا کنند. علاوه بر این، microRNAها و اپیژنتیک نیز در تنظیم بیان ژنها نقش دارند و میتوانند اثرات محیطی را بر رشد جنین ثبت کنند، که این موضوع اهمیت ویژهای در مطالعه تأثیر محیط والدین بر نسل آینده دارد.
مفهوم دیگر درک شده از تکوین، نقش سلولهای بنیادی و توانایی پرتوانی آنها است. سلولهای بنیادی پرتوان قادرند به هر نوع سلول تمایز پیدا کنند و این ویژگی، پایهای برای مهندسی بافت، تولید ارگانوئیدها و درمانهای بازساختی فراهم کرده است. پژوهشهای مدرن نشان دادهاند که حتی سلولهای بالغ میتوانند با بازبرنامهریزی ژنتیکی به حالت پرتوان بازگردند و این مسیر فرصتهای نوینی در پزشکی و پژوهش فراهم میکند.
تعیین سرنوشت سلولی و اطلاعات مکانی نیز از اصول کلیدی در تکوین به شمار میآید. سلولها با توجه به محیط خود، همسایگی با سلولهای دیگر و توزیع مورفوژنها مسیر تمایز خود را انتخاب میکنند. مدلهای نظری مانند مدل واکنش–انتشار و نقشهبرداری پوزیشنی سلولها توضیح میدهند که چگونه الگوهای پیچیده اندامها و بافتها از تعاملات ساده سلولی و سیگنالهای مولکولی ایجاد میشوند. این مدلها توانستهاند حتی فرآیندهای تکاملی و تغییر شکل اندامها در گونههای مختلف را پیشبینی کنند.
در نهایت، اصول بنیادین تکوین شامل تعامل میان تقسیم سلولی، مهاجرت سلولی، تمایز، تعیین سرنوشت و سازماندهی فضایی است که همگی تحت تأثیر ژنتیک و محیط قرار دارند. فهم این اصول، پایهای برای درک مراحل پیچیده بعدی مانند تکوین سیستم عصبی، قلبی–عروقی، اسکلتی و اندامهای تناسلی فراهم میآورد و به ما امکان میدهد که پیامدهای اختلال در این فرآیندها را در بیماریها و ناهنجاریهای مادرزادی تحلیل کنیم.
به طور خلاصه، اصول و مفاهیم بنیادین در تکوین پایه و ستون اصلی جنینشناسی مدرن هستند. از لقاح و تقسیم سلولی اولیه تا گاسترولاسیون، تعیین سرنوشت سلولی، مهاجرت و سازماندهی فضایی، هر مرحله نشاندهنده هماهنگی شگفتانگیز میان ژنتیک، محیط و مکانیک سلولی است. این اصول نه تنها درک علمی ما از رشد طبیعی را بهبود میبخشند، بلکه مبنایی برای پژوهشهای بالینی، درمانهای بازساختی و مطالعات تکاملی فراهم میآورند و مسیر روشنی برای پژوهشهای آینده ایجاد میکنند.
تکنیکها و ابزارهای نوین در زیستشناسی تکوینی
پیشرفتهای اخیر در زیستشناسی تکوینی عمدتاً مرهون توسعه تکنیکهای مدرن تصویربرداری، ژنتیک مولکولی، مهندسی سلولی و مدلسازی کامپیوتری است. این ابزارها به پژوهشگران اجازه دادهاند که مراحل رشد جنین و مکانیسمهای سلولی و مولکولی را با دقت بیسابقهای مطالعه کنند. در دهههای گذشته، استفاده از میکروسکوپهای نوری و فلورسانس به همراه روشهای رنگآمیزی اختصاصی، امکان مشاهده دقیق ساختارهای سلولی و بافتی را فراهم کرده است. تکنیکهایی مانند Light-Sheet Microscopy امکان تصویربرداری سهبعدی از بافتهای زنده را با حداقل آسیب سلولی فراهم میکنند و اجازه میدهند که فرآیندهای پویا مانند مهاجرت سلولی، تقسیم و تمایز سلولها در زمان واقعی بررسی شوند.
یکی دیگر از حوزههای مهم، ژنتیک تکسلولی و توالییابی RNA است. این تکنیکها امکان تحلیل بیان ژنها در سطح تک سلول را فراهم میکنند و به پژوهشگران اجازه میدهند تا نقش دقیق هر ژن در مراحل مختلف تکوین و در مسیرهای تمایزی خاص را بررسی کنند. به کمک این فناوری، توانستهاند نقشه سلولی جنین انسان و سایر گونهها را ایجاد کنند و تغییرات زمانی و مکانی ژنها را در طول رشد مطالعه کنند. این ابزارها همچنین نقش محیط، سیگنالهای سلولی و تغییرات اپیژنتیک را در تعیین سرنوشت سلولی روشن میکنند.
مدلسازی کامپیوتری و شبیهسازیهای ریاضی نیز نقش بسیار مهمی در زیستشناسی تکوینی پیدا کردهاند. مدلهای محاسباتی میتوانند الگوهای پیچیده رشد، مهاجرت سلولی، واکنشهای شیمیایی و توزیع مورفوژنها را پیشبینی کنند. این شبیهسازیها نه تنها موجب صرفهجویی در زمان و هزینه آزمایشها میشوند، بلکه امکان بررسی سناریوهای غیرممکن در آزمایشگاه را فراهم میآورند و بینش عمیقتری درباره تعاملات مولکولی و سلولی ارائه میدهند.
از دیگر پیشرفتهای کلیدی میتوان به ارگانوئیدها و جنینوارههای مصنوعی اشاره کرد. این سیستمها از سلولهای بنیادی پرتوان انسانی یا حیوانی مشتق میشوند و توانایی ایجاد ساختارهای سهبعدی مشابه بافتها و اندامهای جنینی را دارند. ارگانوئیدها به پژوهشگران این امکان را میدهند که تکوین اندامها، مسیرهای تمایز سلولی، و تأثیر عوامل محیطی و دارویی بر رشد را در محیط آزمایشگاهی شبیهسازی کنند. این فناوری به ویژه در مطالعه بیماریهای مادرزادی، سرطان و تولید داروهای هدفمند کاربرد دارد.
یکی دیگر از ابزارهای پیشرفته، اپتوژنتیک و فتوکیمیای سلولی است. این تکنیکها با استفاده از نور، فعالیت ژنها یا مسیرهای سیگنالینگ را در سلولها به صورت دقیق و قابل کنترل فعال یا مهار میکنند. استفاده از اپتوژنتیک در جنینشناسی امکان بررسی نقش مسیرهای سیگنالینگ در زمان و مکان دقیق را فراهم کرده و به پژوهشگران اجازه میدهد تا نحوه تأثیر این مسیرها بر تعیین سرنوشت سلولها و شکلگیری اندامها را مطالعه کنند.
میکروفلوئیدیک نیز به عنوان یک ابزار نوین در زیستشناسی تکوینی مطرح شده است. این فناوری اجازه میدهد سلولها و بافتها در کانالهای کوچک و تحت شرایط محیطی کنترل شده رشد کنند و تعاملات سلولی، جریان سیالات و توزیع مواد شیمیایی به دقت بررسی شوند. میکروفلوئیدیک به ویژه در شبیهسازی محیطهای درونتنی، مهاجرت سلولی و تشکیل الگوهای فضایی کاربرد دارد و امکان انجام آزمایشهای دقیق و بازتولیدپذیر را فراهم میکند.
یکی دیگر از پیشرفتهای مهم، مهندسی ژنوم و CRISPR/Cas9 است. این ابزار به پژوهشگران امکان دستکاری ژنها در سلولهای جنینی و بررسی اثرات آنها بر مراحل مختلف رشد را میدهد. کاربرد CRISPR در مدلهای حیوانی و ارگانوئیدها، امکان مطالعه بیماریهای ژنتیکی، مسیرهای تمایزی و نقش ژنهای کلیدی در تکامل اندامها را فراهم کرده است. به کمک این فناوری، پژوهشگران میتوانند حتی تغییرات ژنتیکی انسانی را در محیط آزمایشگاهی شبیهسازی کنند و اثرات آنها را بررسی نمایند.
تصویربرداری مولکولی پیشرفته و روشهای رنگآمیزی فلورسانس چندکاناله نیز به مطالعه دقیق سازماندهی سلولی و مکانیسمهای تکوین کمک میکنند. این تکنیکها اجازه میدهند تا چندین پروتئین و مسیر سیگنالینگ به صورت همزمان در سلولها و بافتها مشاهده شود و تعاملات پیچیده میان سلولها تحلیل گردد. استفاده از این روشها در ترکیب با تصویربرداری زنده و سهبعدی، دانشمندان را قادر میسازد تا رفتار سلولها و مهاجرت جمعی سلولها، مانند حرکت سلولهای Neural crest و تشکیل اندامها را در زمان واقعی مشاهده کنند.
همچنین، پروتئومیکس، متابولومیکس و روشهای مولکولی چنداُمی به درک تعامل میان مسیرهای سلولی و انرژی مورد نیاز برای رشد کمک میکنند. پژوهشهای اخیر نشان دادهاند که مصرف انرژی سلولها و متابولیسم آنها در مراحل مختلف تکوین نقش تعیینکنندهای دارد و اختلال در این فرآیند میتواند منجر به ناهنجاریهای ساختاری و عملکردی شود. ترکیب این روشها با دادههای تکسلولی، تصویربرداری و مدلسازی کامپیوتری یک تصویر کامل از مراحل تکوین ارائه میدهد که تا چند دهه پیش غیرممکن بود.
در نهایت، ادغام همه این ابزارها با هوش مصنوعی و یادگیری ماشین مسیر جدیدی در تحلیل دادههای پیچیده تکوینی ایجاد کرده است. این فناوریها امکان شناسایی الگوهای غیرقابل مشاهده با چشم انسان، پیشبینی مسیرهای رشد و تحلیل نتایج آزمایشهای حجیم را فراهم میآورند. به کمک هوش مصنوعی، پژوهشگران میتوانند روندهای تکوینی طبیعی، اثرات محیطی و تغییرات بیماریزا را به دقت بررسی کنند و مدلهای پیشبینیکنندهای برای مراحل مختلف رشد ایجاد نمایند.
به طور خلاصه، تکنیکها و ابزارهای نوین در زیستشناسی تکوینی شامل تصویربرداری پیشرفته، ژنتیک تکسلولی، ارگانوئیدها، اپتوژنتیک، میکروفلوئیدیک، مهندسی ژنوم و مدلسازی کامپیوتری هستند. هر یک از این ابزارها امکان بررسی دقیقتر مراحل رشد، تعیین سرنوشت سلولی، مهاجرت و سازماندهی بافتها، و بررسی تأثیر عوامل محیطی و ژنتیکی را فراهم کردهاند. این پیشرفتها باعث شدهاند که زیستشناسی تکوینی از یک علم توصیفی به یک علم پیشبینیکننده و کاربردی تبدیل شود و مسیر تحقیقات بنیادی و کاربردی در پزشکی بازساختی، درمان بیماریها و درک فرآیندهای تکاملی را هموار سازد.
تکنیکها و ابزارهای نوین در زیستشناسی تکوینی
زیستشناسی تکوینی، به عنوان علمی که مطالعه رشد و توسعه موجودات زنده را هدف دارد، در دهههای اخیر تحولات چشمگیری را تجربه کرده است. این تحولات عمدتاً ناشی از توسعه تکنولوژیهای نوین آزمایشگاهی، تصویربرداری پیشرفته، مهندسی ژنوم، مدلسازی کامپیوتری و ابزارهای مولکولی است. این تکنیکها به دانشمندان اجازه دادهاند تا مراحل پیچیده رشد جنین و مکانیسمهای سلولی و مولکولی را با دقت بیسابقه مطالعه کنند و حتی فرآیندهای تکوینی انسان را در محیط آزمایشگاهی شبیهسازی نمایند.
یکی از بنیادیترین ابزارها در این حوزه، میکروسکوپی پیشرفته و تصویربرداری زنده است. ابزارهایی مانند Light-Sheet Microscopy امکان مشاهده سهبعدی بافتها و جنینهای زنده را فراهم میکنند بدون آن که سلولها دچار آسیب شوند. این تکنیکها اجازه میدهند که پژوهشگران رفتار سلولها، مهاجرت، تقسیم و تمایز آنها را در زمان واقعی مشاهده کنند. علاوه بر آن، فلورسانس چندکاناله و رنگآمیزی اختصاصی پروتئینها و ساختارهای سلولی امکان بررسی همزمان چندین مسیر سیگنالینگ و پروتئین را میدهد، که برای درک تعاملات پیچیده بین سلولها و تعیین سرنوشت آنها ضروری است.
تکنیکهای ژنتیک تکسلولی و توالییابی RNA تکسلولی تحول بزرگی در زیستشناسی تکوینی ایجاد کردهاند. این روشها به پژوهشگران اجازه میدهند تا بیان ژنها در سطح تکسلول را تحلیل کنند و نقش دقیق هر ژن را در مراحل مختلف رشد بررسی کنند. با این تکنیکها، میتوان نقشه سلولی جنین انسان و سایر گونهها را در طول زمان و مکان مشخص ایجاد کرد و فرآیندهای تعیین سرنوشت سلولی، تمایز، و مسیرهای سیگنالینگ را دقیقاً شناسایی نمود. همچنین، این ابزارها در بررسی تأثیر عوامل محیطی و اپیژنتیک بر رشد جنین و نسلهای آینده کاربرد دارند و اطلاعات ارزشمندی درباره اختلالات ژنتیکی و بیماریهای مادرزادی فراهم میکنند.
یکی دیگر از پیشرفتهای کلیدی، مدلسازی کامپیوتری و شبیهسازی ریاضی است. مدلهای محاسباتی قادرند الگوهای پیچیده رشد، مهاجرت سلولی و توزیع مورفوژنها را شبیهسازی کنند. این روشها نه تنها امکان پیشبینی الگوهای رشد را میدهند، بلکه شرایطی را فراهم میآورند که آزمایشهای واقعی نمیتوانند انجام دهند. مدلسازی کامپیوتری همچنین به پژوهشگران کمک میکند تا رفتار جمعی سلولها، تاثیر تغییرات ژنتیکی و مسیرهای سیگنالینگ پیچیده را در مراحل مختلف تکوین پیشبینی کنند.
ارگانوئیدها و جنینوارههای مصنوعی یکی دیگر از ابزارهای نوین هستند که تحولی در مطالعه تکوین ایجاد کردهاند. این سیستمها از سلولهای بنیادی پرتوان انسانی یا حیوانی مشتق میشوند و توانایی ایجاد ساختارهای سهبعدی مشابه بافتها و اندامهای جنینی را دارند. ارگانوئیدها امکان مطالعه تکوین اندامها، مسیرهای تمایز سلولی، و تأثیر داروها و عوامل محیطی را در شرایط کنترل شده فراهم میکنند. به عنوان مثال، ارگانوئیدهای قلب و مغز برای بررسی اختلالات قلبی–عروقی و اختلالات عصبی کاربرد دارند و میتوانند جایگزین مدلهای حیوانی در بسیاری از مطالعات شوند.
یکی از نوآوریهای دیگر، اپتوژنتیک و فتوکیمیای سلولی است که امکان کنترل فعالیت ژنها و مسیرهای سیگنالینگ با نور را فراهم میکند. این ابزارها به پژوهشگران اجازه میدهند تا فعالیت مسیرهای مولکولی را در زمان و مکان دقیق تغییر دهند و اثر آن بر تمایز سلولی، مهاجرت و شکلگیری اندامها را بررسی کنند. اپتوژنتیک، همراه با تصویربرداری زنده، امکان مشاهده پاسخ سلولها به سیگنالها در شرایط واقعی را فراهم میآورد.
میکروفلوئیدیک نیز یکی از فناوریهای پیشرفته است که شرایط محیطی سلولها و بافتها را به صورت دقیق شبیهسازی میکند. با استفاده از کانالهای کوچک و کنترل جریان سیالات، پژوهشگران میتوانند تعاملات سلولی، توزیع مواد شیمیایی و مهاجرت سلولها را به دقت مطالعه کنند. این فناوری به ویژه برای مطالعه الگوهای فضایی و مکانیکی در تکوین اندامها کاربرد دارد و امکان آزمایشهای کنترلشده و بازتولیدپذیر را فراهم میکند.
یکی از مهمترین ابزارهای مدرن، مهندسی ژنوم و CRISPR/Cas9 است. این فناوری امکان دستکاری دقیق ژنها در سلولهای جنینی و بررسی اثرات آنها بر مراحل مختلف رشد را فراهم میکند. CRISPR نه تنها در مدلهای حیوانی، بلکه در ارگانوئیدها و سیستمهای سلولی انسانی کاربرد دارد و امکان مطالعه بیماریهای ژنتیکی، مسیرهای تمایزی و نقش ژنهای کلیدی در تکامل اندامها را میدهد. این ابزار به پژوهشگران کمک میکند تا مکانیزمهای مولکولی اختلالات مادرزادی را شناسایی و بررسی کنند و راهکارهای درمانی نوین طراحی نمایند.
تصویربرداری مولکولی پیشرفته و فلورسانس چندکاناله نیز امکان بررسی همزمان چندین مسیر سیگنالینگ و پروتئین در سلولها و بافتها را فراهم میآورد. ترکیب این روشها با تصویربرداری زنده و سهبعدی، مشاهده مهاجرت جمعی سلولها و شکلگیری اندامها را ممکن میسازد. برای مثال، مهاجرت سلولهای Neural crest و تشکیل اندامهای پیچیده، بدون این فناوریها قابل تحلیل نبود.
از دیگر ابزارهای حیاتی میتوان به پروتئومیکس، متابولومیکس و روشهای مولکولی چنداُمی اشاره کرد. این روشها امکان بررسی تعامل میان مسیرهای سلولی، انرژی مصرفی و متابولیسم سلولها در مراحل مختلف تکوین را فراهم میکنند. مطالعات اخیر نشان دادهاند که مصرف انرژی و متابولیسم سلولی نقش تعیینکنندهای در رشد طبیعی و جلوگیری از اختلالات دارد و ترکیب این دادهها با دادههای تکسلولی و تصویربرداری، تصویری کامل از مراحل تکوین ارائه میدهد.
نهایتاً، هوش مصنوعی و یادگیری ماشین توانستهاند مسیر جدیدی در تحلیل دادههای پیچیده تکوینی ایجاد کنند. این فناوریها میتوانند الگوهای غیرقابل مشاهده، مسیرهای رشد و تأثیرات محیطی را پیشبینی کنند و مدلهای پیشبینیکنندهای برای مراحل مختلف رشد ارائه دهند. ترکیب هوش مصنوعی با ارگانوئیدها، تصویربرداری زنده و دادههای تکسلولی، امکان تحلیل جامع فرآیندهای تکوینی و طراحی درمانهای بازساختی را فراهم میآورد.
به طور خلاصه، تکنیکها و ابزارهای نوین در زیستشناسی تکوینی شامل تصویربرداری پیشرفته، ژنتیک تکسلولی، ارگانوئیدها، اپتوژنتیک، میکروفلوئیدیک، مهندسی ژنوم، مدلسازی کامپیوتری و هوش مصنوعی هستند. هر یک از این ابزارها امکان بررسی دقیق مراحل رشد، تعیین سرنوشت سلولی، مهاجرت، سازماندهی بافتها و تأثیر عوامل محیطی و ژنتیکی را فراهم میکنند و باعث شدهاند زیستشناسی تکوینی از یک علم توصیفی به یک علم پیشبینیکننده و کاربردی تبدیل شود. این پیشرفتها مسیر تحقیقات بنیادی و بالینی، پزشکی بازساختی، درمان بیماریها و درک فرآیندهای تکاملی را به شکل قابل توجهی متحول کردهاند.
ژنتیک و تنظیم مولکولی در تکوین
تکوین موجودات زنده بر پایه کنترل ژنتیکی دقیق و تنظیم مولکولی پیچیده شکل میگیرد. ژنها، به عنوان بلوکهای ساختمانی اساسی، برنامه رشد و تمایز سلولها را هدایت میکنند و تعیین میکنند که هر سلول چه نوع بافتی خواهد شد، چه زمانی تقسیم میشود و در کجا قرار میگیرد. فرآیندهای ژنتیکی تکوین، نه تنها شامل بیان ژنها، بلکه شامل تنظیم اپیژنتیک، شبکههای سیگنالینگ و تعاملات مولکولی سلولها است.
یکی از بنیادیترین مفاهیم در این حوزه، ژنهای تعیینکننده سرنوشت سلولی (Master Regulatory Genes) هستند. این ژنها، مانند Hox genes، الگوهای مکانی و محورهای بدن را در مراحل اولیه جنین تعیین میکنند. بیان این ژنها به شدت زمانبندی شده و مکانی مشخص دارد و اختلال در آنها میتواند منجر به ناهنجاریهای ساختاری شدید شود. برای مثال، تغییر در بیان ژنهای Hox میتواند موجب جابجایی اندامها یا تغییر شکل ستون فقرات شود، که نشاندهنده اهمیت دقیق تنظیم ژنها در تکوین است.
شبکههای سیگنالینگ بین سلولی نقش حیاتی در تعیین سرنوشت سلولها دارند. مسیرهای سیگنالینگ مانند Wnt، BMP، Notch، Hedgehog و FGF، فرآیندهای تمایز، مهاجرت و رشد سلولها را کنترل میکنند. این مسیرها با یکدیگر تعامل دارند و به سلولها اطلاعات مکانی و زمانی میدهند تا الگوهای بافتی منظم و عملکردی ایجاد شود. به عنوان مثال، مسیر Wnt در تعیین محورهای بدن و تمایز سلولهای عصبی و ماهیچهای نقش دارد، در حالی که مسیر BMP در تمایز سلولهای استخوانی و ایجاد لایههای اپیتلیالی اهمیت دارد.
یکی دیگر از عناصر کلیدی، تنظیم اپیژنتیک است. این مکانیسم شامل متیلاسیون DNA، اصلاح هیستونها و RNAهای غیرکدکننده میشود و تعیین میکند که کدام ژنها فعال یا خاموش شوند، بدون تغییر توالی DNA. تنظیم اپیژنتیک در مراحل اولیه تکوین به ویژه برای حفظ هویت سلولی، تمایز و تنظیم پاسخ سلولها به سیگنالهای محیطی حیاتی است. مطالعات نشان دادهاند که اختلالات اپیژنتیک میتواند منجر به بیماریهای مادرزادی، اختلالات عصبی و ناهنجاریهای رشد شود.
RNAهای غیرکدکننده، به ویژه میکروRNAها و lncRNAها، به عنوان اجزای کلیدی تنظیم ژنی شناخته شدهاند. این مولکولها توانایی مهار یا تقویت بیان ژنها را دارند و نقش مهمی در کنترل تمایز سلولی، تقسیم و مهاجرت سلولها ایفا میکنند. برای مثال، میکروRNAها در تکوین ماهیچهها و مغز نقش حیاتی دارند و تغییرات در آنها میتواند به ناهنجاریهای عضلانی یا عصبی منجر شود.
کنترل زمانی و مکانی بیان ژنها یکی از پیچیدهترین جنبههای ژنتیک تکوین است. این کنترل با آرایش کروماتین، فعالسازی پروموترها و انهانسرها و شبکههای بازخورد منفی و مثبت انجام میشود. پژوهشهای اخیر نشان دادهاند که حتی تغییرات جزئی در زمانبندی بیان ژنها میتواند به تغییرات اساسی در الگوهای رشد منجر شود. به همین دلیل، تکوین به شدت حساس به خطاهای ژنتیکی و محیطی است.
یکی از حوزههای پیشرفته در ژنتیک تکوینی، تحلیل تکسلولی و توالییابی RNA تکسلولی است. این روشها به پژوهشگران اجازه میدهند که بیان ژنها را در سطح هر سلول بررسی کنند و مسیرهای تمایزی و تغییرات زمانی را دقیقاً مشخص کنند. ترکیب این دادهها با تصویربرداری زنده و مدلسازی کامپیوتری امکان شبیهسازی مراحل رشد و بررسی اثرات جهشها و اختلالات ژنتیکی را فراهم میکند.
مهندسی ژنوم و CRISPR/Cas9 به پژوهشگران اجازه دادهاند تا ژنهای خاص را در مدلهای حیوانی و ارگانوئیدها دستکاری کنند و اثرات آنها بر تکوین را بررسی نمایند. این ابزارها امکان مطالعه بیماریهای ژنتیکی، مسیرهای تمایز سلولی و نقش ژنهای کلیدی در شکلگیری اندامها را فراهم کردهاند. به کمک این فناوری، میتوان حتی تغییرات ژنتیکی انسانی را در محیط آزمایشگاهی شبیهسازی کرد و تأثیر آنها را بر رشد جنین بررسی نمود.
تعامل ژنها و محیط سلولی نیز یکی دیگر از محورهای مهم در ژنتیک تکوینی است. سلولها نه تنها به برنامه ژنتیکی خود متکی هستند، بلکه به سیگنالهای مکانیکی، شیمیایی و انرژی محیطی پاسخ میدهند. این تعامل باعث میشود که رشد و تمایز سلولها بافتی منظم و کارآمد شکل بگیرد و حتی اختلالات محیطی بتوانند اثرات طولانیمدتی بر الگوی رشد و سلامت نسلهای بعدی داشته باشند.
در نهایت، ژنتیک و تنظیم مولکولی در تکوین به صورت یک شبکه پیچیده و چندلایه عمل میکند. این شبکه شامل ژنهای اصلی، مسیرهای سیگنالینگ، تنظیم اپیژنتیک، RNAهای غیرکدکننده، تعاملات محیطی و بازخوردهای مولکولی است. هماهنگی این عناصر برای تکوین سالم، شکلگیری اندامها و حفظ هویت سلولی ضروری است. اختلال در هر یک از این اجزا میتواند منجر به بیماریهای مادرزادی، اختلالات عصبی، ناهنجاریهای اسکلتی و عملکردی شود.
به طور خلاصه، ژنتیک و تنظیم مولکولی در تکوین شامل ژنهای تعیینکننده، مسیرهای سیگنالینگ، تنظیم اپیژنتیک، RNAهای غیرکدکننده، کنترل زمانی و مکانی بیان ژنها، مهندسی ژنوم و تعامل با محیط سلولی است. این ساختار پیچیده و هماهنگ، اساس رشد طبیعی و شکلگیری صحیح بافتها و اندامها را فراهم میآورد و فهم دقیق آن مسیر توسعه درمانهای نوین و پیشگیری از بیماریها را هموار میکند.
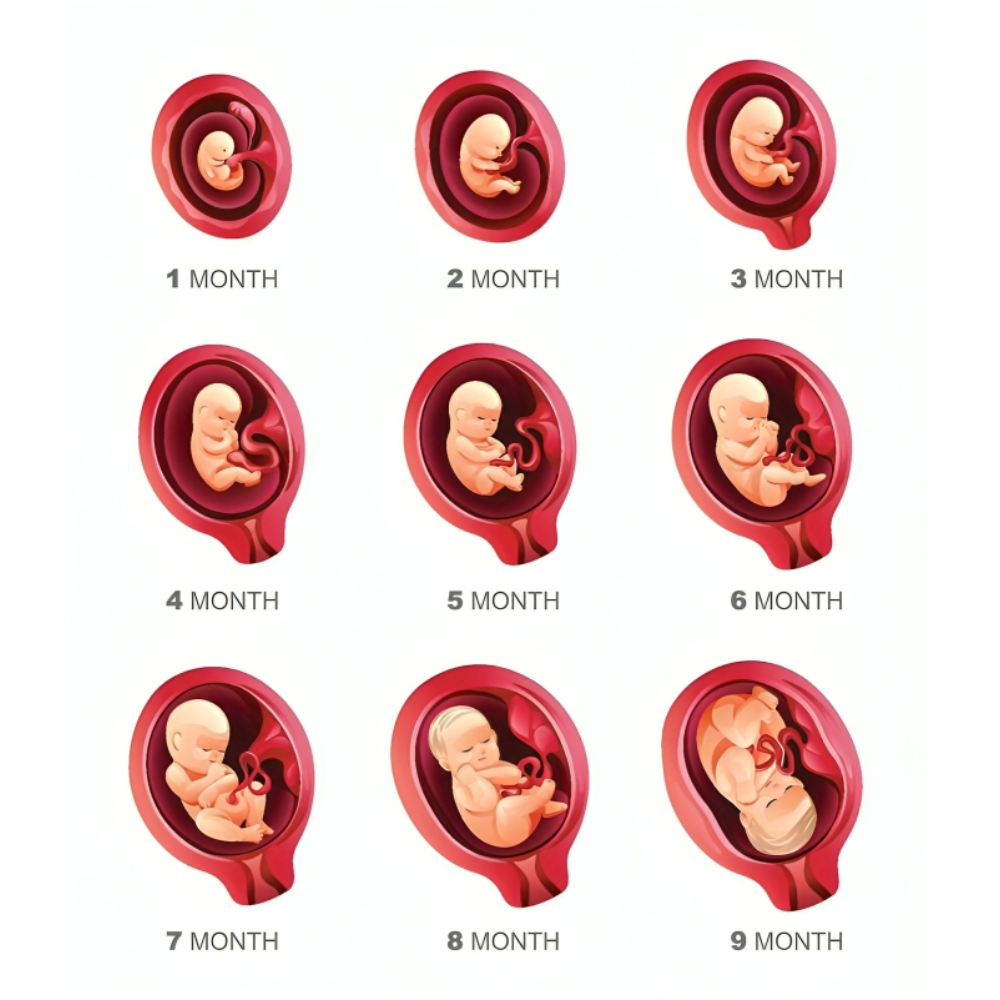
مراحل کلیدی رشد انسان
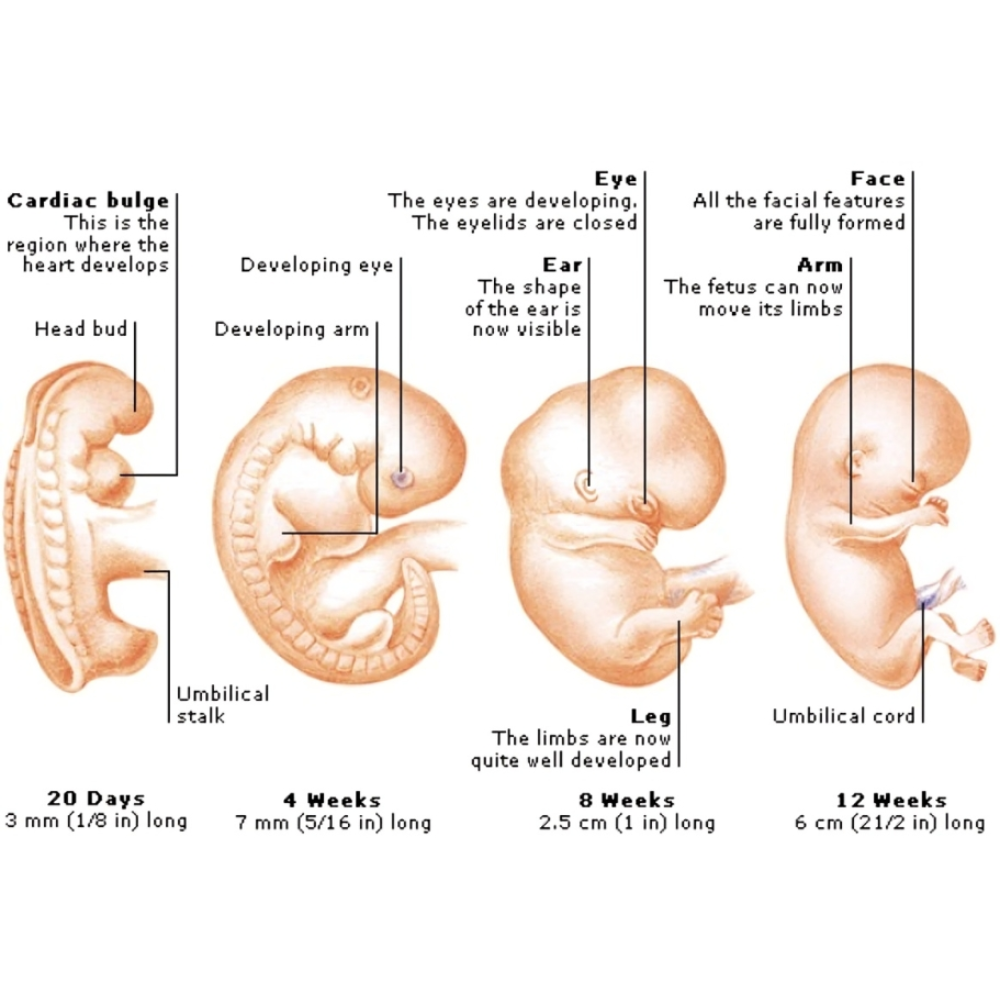
رشد و تکوین انسان یک فرآیند پیچیده و چندلایه است که از لقاح تخمک آغاز میشود و تا بلوغ و تکامل کامل اندامها ادامه مییابد. این فرآیند شامل مرحله پیش از لانهگزینی، لانهگزینی، گاسترولاسیون، تمایز اندامها و نمو جنین تا زمان تولد است. هر یک از این مراحل به شدت تحت کنترل ژنتیکی و محیطی قرار دارند و هر گونه اختلال میتواند منجر به نقصهای مادرزادی و اختلالات رشد شود.
پس از لقاح، زیگوت شکل میگیرد، که اولین سلول جنینی انسان محسوب میشود. این سلول دارای برنامه ژنتیکی کامل برای رشد و توسعه است. زیگوت به سرعت وارد مرحله تقسیمهای سلولی متوالی یا کلونینگ سلولی میشود و به یک توپ سلولی به نام مورولا تبدیل میشود. در این مرحله، سلولها هنوز توانایی تمایز به انواع بافتها را دارند و به صورت پلاستیک رفتار میکنند.
پس از آن، مرحله بلاستوسیست آغاز میشود. بلاستوسیست شامل یک جرم داخلی سلولی (Inner Cell Mass) است که آینده جنین را شکل میدهد و تروفوبلاست که مسئول ایجاد جفت و ارتباط با رحم مادر است. لانهگزینی در رحم، نقطه عطفی در رشد جنین است و شرایط محیطی، ترشح هورمونها و سیگنالهای سلولی برای موفقیت آن حیاتی هستند. اختلال در این مرحله میتواند منجر به سقط زودرس شود.
مرحله بعدی، گاسترولاسیون است که در آن سه لایه سلولی اصلی یعنی اکتودرم، مزودرم و اندودرم شکل میگیرند. این لایهها اساس ایجاد تمام بافتها و اندامهای بدن را فراهم میکنند. اکتودرم منجر به تشکیل سیستم عصبی و پوست میشود، مزودرم اسکلت، ماهیچهها و سیستم قلبی–عروقی را ایجاد میکند و اندودرم مسئول شکلگیری دستگاه گوارش، تنفسی و برخی غدد است. گاسترولاسیون یکی از مراحل حساس است که توسط ژنهای Hox، مسیرهای Wnt و BMP و تعاملات سلول–سلولی تنظیم میشود.
پس از گاسترولاسیون، فرآیند نئورولاسیون آغاز میشود که منجر به شکلگیری لوله عصبی و در نهایت مغز و نخاع میگردد. در این مرحله، سلولهای عصبی از لایه اکتودرم بیرون میآیند و مهاجرت میکنند تا ساختارهای مغزی و نخاعی شکل بگیرد. مسیرهای سیگنالینگ مانند Notch، Shh و FGF نقش مهمی در تعیین محل و نوع سلولهای عصبی دارند. اختلال در نئورولاسیون میتواند به نقصهای لوله عصبی مانند اسپینا بیفیدا یا آنانسفالی منجر شود.
همزمان با این مراحل، تشکیل اندامها (Organogenesis) شروع میشود. قلب یکی از اولین اندامهایی است که شکل میگیرد و از هفته سوم به بعد شروع به تپش میکند. مسیرهای ژنتیکی و سیگنالینگ پیچیده مانند BMP، Wnt و FGF نقش حیاتی در شکلگیری اندامها دارند. اندامها به صورت مجموعهای از پینهها و جوانهها شکل میگیرند و سلولها با مهاجرت، تقسیم و تمایز دقیق، ساختارهای عملکردی را ایجاد میکنند.
سیستم اسکلتی و عضلانی در این دوره از مزودرم مشتق میشود. سلولهای مزودرمی به میوزین و سلولهای استخوانی تمایز مییابند و اسکلت اولیه را تشکیل میدهند. ژنهای Myogenic Regulatory Factors (MRFs) در تمایز سلولهای ماهیچهای نقش اساسی دارند. همزمان، فرآیند مندوژنز و استخوانسازی توسط مسیرهای BMP و Hedgehog هدایت میشود.
سیستم قلبی–عروقی و عروقی نیز از مزودرم شکل میگیرد. قلب اولیه به صورت یک لوله ساده تشکیل میشود و با رشد و خم شدن، ساختار نهایی قلب و عروق بزرگ شکل میگیرد. مسیرهای سیگنالینگ و ژنهای اختصاصی مانند Nkx2.5 و GATA4 برای هدایت تمایز سلولهای قلبی حیاتی هستند. اختلال در این مسیرها میتواند منجر به نقصهای قلبی مادرزادی شود.
سیستم گوارشی و تنفسی از اندودرم شکل میگیرد. سلولهای اندودرم لولههای گوارشی اولیه را تشکیل میدهند و سپس با تکامل پیچیده، اندامهای مربوط به هضم و تنفس ایجاد میشوند. سیگنالینگ FGF و Hedgehog نقش حیاتی در تعیین محل و تمایز سلولها در این سیستمها دارند.
در مراحل بعدی رشد، مهاجرت و تمایز سلولهای Neural crest نقش کلیدی در ایجاد بافتهای محیطی، صورت، سیستم قلبی–عروقی و سلولهای عصبی محیطی ایفا میکنند. Neural crest یکی از منابع حیاتی برای تشکیل سلولهای رنگدانهای، غضروفی و عصبی محیطی است و اختلال در آن میتواند به ناهنجاریهای متعدد از جمله نقصهای صورت و قلبی–عروقی منجر شود.
همزمان با شکلگیری اندامها، فرآیند اپیتلیوم–مزنشیم (Epithelial–Mesenchymal Transition) و مهاجرت سلولی، رشد بافتها و ایجاد ارتباطات سهبعدی را هدایت میکند. این فرآیندها تحت کنترل مسیرهای سیگنالینگ و شبکههای ژنی پیچیده هستند و برای رشد طبیعی و ایجاد ساختارهای دقیق اندامها حیاتی هستند.
در مراحل پایانی جنینی، نمو و تکامل عملکردی اندامها آغاز میشود. مغز، ریهها، کبد، کلیه و سایر اندامها به تدریج ساختارهای عملکردی خود را به دست میآورند. این مراحل با فعالیت ژنهای متابولیکی، مسیرهای رشد و تعامل با محیط رحم مادر هماهنگ میشوند. عوامل محیطی مانند تغذیه، هورمونها و اکسیژن، رشد نهایی و سلامت اندامها را تعیین میکنند.
به طور خلاصه، مراحل کلیدی رشد انسان شامل لقاح و تشکیل زیگوت، بلاستوسیست و لانهگزینی، گاسترولاسیون، نئورولاسیون، شکلگیری اندامها و نمو نهایی است. هر یک از این مراحل به شدت تحت کنترل ژنها، مسیرهای سیگنالینگ، تعاملات سلول–سلولی و عوامل محیطی هستند و هماهنگی دقیق آنها برای رشد سالم و عملکرد کامل اندامها حیاتی است.
ارتباط جنینشناسی با بیماریها
جنینشناسی به ما کمک میکند تا ریشههای بسیاری از بیماریها و ناهنجاریها را درک کنیم. رشد طبیعی انسان، فرآیندی دقیق و پیچیده است که تحت تأثیر ژنها، مسیرهای سیگنالینگ، تعاملات سلول–سلولی و عوامل محیطی قرار دارد. هرگونه اختلال در این فرآیند میتواند به شکلگیری بیماریهای مختلف منجر شود.
یکی از مهمترین زمینههای ارتباط جنینشناسی با بیماری، نقصهای مادرزادی است. این نقصها میتوانند شامل نقصهای قلبی، عصبی، اسکلتی و اندامهای داخلی باشند. به عنوان مثال، اختلال در مراحل گاسترولاسیون یا نئورولاسیون میتواند باعث نقص لوله عصبی، آنانسفالی یا اسپینا بیفیدا شود. این اختلالات معمولاً ناشی از تغییر در مسیرهای سیگنالینگ مانند Shh، BMP و Wnt یا نقص در ژنهای تنظیمکننده رشد هستند.
نقصهای قلبی مادرزادی یکی از شایعترین اختلالات در انسان هستند و معمولاً ناشی از اختلال در تشکیل قلب اولیه و مهاجرت سلولهای Neural crest است. سلولهای Neural crest نقش حیاتی در ایجاد ساختارهای قلبی–عروقی، دریچهها و عروق بزرگ دارند. تغییرات ژنتیکی یا اختلالات محیطی در این سلولها میتواند منجر به تترالوژی فالوت، نقص دیواره بین بطنی یا مشکلات دریچهای شود.
بیماریهای اسکلتی و ماهیچهای نیز با دانش جنینشناسی قابل بررسی هستند. اختلال در ژنهای Myogenic Regulatory Factors یا مسیرهای BMP میتواند منجر به هیپوپلازی عضلانی، نقصهای استخوانی یا سندرمهای اسکلتی مادرزادی شود. این اختلالات نشاندهنده اهمیت دقیق تنظیم ژنتیکی و مولکولی در تکوین اسکلت و ماهیچهها هستند.
اختلالات سیستم عصبی مرکزی و محیطی نیز ارتباط مستقیم با مراحل اولیه تکوین دارند. مراحل نئورولاسیون و مهاجرت سلولهای عصبی حساسیت بالایی دارند و حتی تغییرات جزئی در بیان ژنها یا مسیرهای سیگنالینگ میتواند باعث اختلالات طیف اوتیسم، فلج مغزی یا نقصهای شناختی شود. مسیرهای مهم در این زمینه شامل Notch، FGF و Shh هستند که برای تعیین نوع سلول، محل و زمان مهاجرت سلولهای عصبی حیاتیاند.
بیماریهای ارگانهای داخلی نیز میتوانند ریشه در جنینشناسی داشته باشند. اختلال در تمایز اندودرم میتواند منجر به نقصهای گوارشی، کبدی و ریوی شود، در حالی که اختلال در تمایز مزودرم به نقص در کلیهها، قلب و سیستم عروقی منجر میشود. مطالعه این مسیرها به پزشکان و پژوهشگران کمک میکند تا پیشبینی ریسک و تشخیص زودهنگام بیماریها را بهبود دهند.
اختلالات متابولیک و هورمونی نیز میتوانند جنبه جنینشناسی داشته باشند. برای مثال، اختلال در رشد پانکراس یا سلولهای تولیدکننده انسولین در جنین میتواند به دیابت مادرزادی یا مشکلات متابولیک در طول عمر منجر شود. این ارتباط نشان میدهد که بسیاری از بیماریهای مزمن بزرگسالان ممکن است ریشه در دوره جنینی و تنظیم ژنتیکی و مولکولی داشته باشند.
یکی از زمینههای نوین و جذاب، تأثیر عوامل محیطی و اپیژنتیک بر سلامت نسلهای بعدی است. مطالعات نشان دادهاند که قرارگیری در معرض سموم، تغذیه نامناسب، استرس و کمبود اکسیژن در دوره جنینی میتواند موجب تغییرات اپیژنتیک شود و منجر به چاقی، بیماریهای قلبی–عروقی و اختلالات متابولیک در طول زندگی فرد شود. این یافتهها اهمیت جنینشناسی در پیشگیری و مدیریت سلامت نسلهای بعدی را نشان میدهد.
سرطان و ارتباط آن با فرآیندهای تکوین نیز یکی از حوزههای مهم پژوهشی است. بسیاری از مسیرهای سیگنالینگ فعال در جنین مانند Wnt، Notch و Hedgehog، در شکلگیری سرطان دوباره فعال میشوند. این امر نشان میدهد که درک فرآیندهای طبیعی تکوین میتواند در کشف مکانیسمهای سرطان و توسعه درمانهای هدفمند نقش کلیدی داشته باشد.
از سوی دیگر، اختلال در مهاجرت سلولها و EMT (Epithelial–Mesenchymal Transition) که در جنینشناسی برای شکلگیری اندامها حیاتی است، میتواند موجب متاستاز سرطان و ناهنجاریهای بافتی شود. بنابراین، پژوهش در زمینه جنینشناسی نه تنها برای درک رشد طبیعی، بلکه برای درمان و پیشگیری از بیماریهای مزمن و سرطان نیز حیاتی است.
در نهایت، مطالعه جنینشناسی برای شناسایی ژنهای بیماریزا، مسیرهای تنظیمی و مکانیسمهای مولکولی اختلالات ضروری است. این دانش امکان پیشبینی و تشخیص زودهنگام نقصهای مادرزادی، بیماریهای عصبی، اختلالات قلبی و متابولیک را فراهم میکند و همچنین راهبردهای درمانی مبتنی بر سلولهای بنیادی، مهندسی ژنوم و داروهای هدفمند را توسعه میدهد.
به طور خلاصه، ارتباط جنینشناسی با بیماریها شامل نقصهای مادرزادی، بیماریهای عصبی، اسکلتی، متابولیک، قلبی و سرطان است و فهم دقیق مراحل رشد، تنظیم ژنی و مسیرهای سیگنالینگ به پیشگیری، تشخیص و درمان این بیماریها کمک میکند.
جنینشناسی مقایسهای و تکاملی
جنینشناسی مقایسهای و تکاملی مطالعه رشد و تکوین موجودات مختلف با هدف درک تشابهات و تفاوتهای بنیادین در مراحل اولیه رشد است. این حوزه علمی، پلی میان زیستشناسی تکاملی، ژنتیک و زیستشناسی سلولی ایجاد میکند و به ما امکان میدهد که چگونگی شکلگیری ویژگیهای مشترک و اختصاصی را در گونههای مختلف بررسی کنیم.
مطالعات نشان دادهاند که بسیاری از مراحل اولیه جنینی در گونههای مختلف حفظ شدهاند (Conserved) و تنها در مراحل بعدی، تمایزات اختصاصی گونهای ظاهر میشوند. به عنوان مثال، مراحل گاسترولاسیون، نئورولاسیون و تشکیل لوله عصبی در مهرهداران مشابه هستند، هرچند ساختار نهایی مغز و سیستم عصبی ممکن است بین انسان، موش و سایر مهرهداران تفاوت داشته باشد. این شباهتهای ابتدایی، پایهای برای نظریه تکاملی و همولوژی اندامها فراهم میکنند.
تکوین اسکلت و اندامها نمونهای برجسته از ارتباط جنینشناسی و تکامل است. مطالعه جنین مهرهداران نشان میدهد که سلولهای مزودرم و مزانشیم مسیرهای مشابهی برای شکلگیری اسکلت دارند، حتی اگر شکل نهایی استخوانها و اندامها متفاوت باشد. این یافتهها نشان میدهند که الگوهای ژنتیکی اولیه مانند ژنهای Hox و مسیرهای BMP در طول تکامل حفظ شدهاند و تنها با تغییرات در بیان زمانی و مکانی، ساختارهای متنوع ایجاد میشوند.
یکی دیگر از جنبههای مهم، تکوین سیستم عصبی و مغز در گونههای مختلف است. مطالعات مقایسهای بین انسان و موش نشان دادهاند که مراحل اولیه نئورولاسیون و مهاجرت سلولهای Neural crest مشابه هستند، اما در انسان، دوره رشد مغز طولانیتر است و مناطق پیشانی و قشر مغز توسعه بیشتری دارند. این تفاوتها با تغییرات در بیان ژنها، مسیرهای سیگنالینگ و زمانبندی تقسیم سلولی توضیح داده میشوند.
جنینشناسی مقایسهای در اندامهای حسی و حرکتی نیز نکات مهمی دارد. به عنوان مثال، تحول باله در ماهیان و اندامهای جلویی در مهرهداران خشکیزی نشان میدهد که اندامهای جدید معمولاً از ساختارهای اولیه مشترک تکامل مییابند. مطالعات روی زرافه، موش و ماهیها نشان دادهاند که تغییرات در زمان و شدت سیگنالهای FGF و BMP میتواند باعث ایجاد طول متفاوت اندامها، تعداد استخوانها و شکلگیری مفصلها شود.
مطالعات روی Neural crest نیز اهمیت تکاملی دارد. این سلولها مسئول ایجاد بخشهای محیطی سیستم عصبی، صورت و قلب هستند و اختلال در آنها میتواند منجر به نقصهای مشترک در گونههای مختلف شود. بررسی مهاجرت و تمایز Neural crest در گونههای مختلف، نشان میدهد که تغییرات کوچک در مسیرهای ژنتیکی و سیگنالینگ میتوانند منجر به تنوع گسترده در ساختار صورت و سیستم قلبی–عروقی شوند.
یکی دیگر از حوزههای پیشرفته، جنینشناسی تکاملی و اپیژنتیک است. پژوهشها نشان دادهاند که بسیاری از تغییرات تکاملی ناشی از تنظیم اپیژنتیک ژنها و تعامل با محیط هستند و نه تغییر در توالی DNA. به عنوان مثال، الگوهای بیان ژنهای Hox و BMP میتوانند بدون تغییر توالی ژن، باعث ایجاد اندامهای متفاوت و ساختارهای جدید شوند. این یافتهها اهمیت مطالعه جنینشناسی درک تکامل میکروسکوپی و ماکروسکوپی را نشان میدهند.
جنینشناسی مقایسهای در سیستم قلبی–عروقی و عروقی نیز نشان میدهد که مسیرهای ایجاد قلب اولیه و عروق بزرگ در مهرهداران مشابه هستند، اما تغییرات جزئی در زمانبندی و شدت سیگنالها باعث ایجاد تنوع گسترده در ساختار قلب و عروق میشود. این مطالعات به فهم ریشههای تکاملی بیماریهای قلبی–عروقی کمک میکنند و نشان میدهند که برخی نقصهای مادرزادی ممکن است بازتابی از تغییرات تکاملی طبیعی باشند.
مطالعه جفت و اندامهای تولیدمثلی نیز اهمیت زیادی دارد. جفت در پستانداران به شکلهای مختلف وجود دارد و مقایسه ساختارهای جفتی نشان میدهد که تغییرات در سیگنالینگ جنینی و تعامل با اندومتر مادر منجر به تکامل انواع مختلف جفت شده است. این مطالعات به فهم ناباروری، سقط جنین و مشکلات حاملگی کمک میکنند و نشان میدهند که بسیاری از مشکلات تولیدمثلی ریشه در فرآیندهای تکاملی و تکوینی دارند.
جنینشناسی مقایسهای در چشم و سیستم بینایی نیز مثال جالبی است. ساختار اولیه چشم در مهرهداران مشابه است، اما تغییرات در تمایز لایههای شبکیه و طول رشد سلولها منجر به تفاوتهای دیداری گسترده بین گونهها میشود. این یافتهها اهمیت مطالعه جنینشناسی برای درک سیر تکاملی و عملکرد حسی را نشان میدهد.
به طور کلی، جنینشناسی مقایسهای و تکاملی نه تنها نشاندهنده تشابهها و تمایزهای زیستی بین گونهها است، بلکه درک ما از تکامل اندامها، ساختارهای بدن و منشأ بیماریها را عمیقتر میکند. این شاخه علمی به پژوهشگران اجازه میدهد که ارتباط بین ژنتیک، رشد و تکامل و پیامدهای بالینی را بررسی کنند و راهکارهای پیشگیری و درمان را توسعه دهند.
کاربردهای بالینی و فناوریهای نوین در جنینشناسی
جنینشناسی تنها به مطالعه مراحل رشد جنین محدود نمیشود؛ بلکه در پزشکی مدرن و فناوریهای نوین کاربردهای وسیعی دارد. درک دقیق مراحل تکوین و مسیرهای مولکولی، ابزارهای جدیدی برای تشخیص زودهنگام بیماریها، درمان نقصهای مادرزادی و بازسازی بافتها فراهم کرده است.
یکی از برجستهترین حوزهها، استفاده از سلولهای بنیادی جنینی و پرتوان است. سلولهای بنیادی جنینی قادرند به تمامی سلولهای تخصصی بدن تمایز یابند و این ویژگی، زمینهای برای توسعه درمانهای بازساختی و مهندسی بافت فراهم میکند. برای مثال، تولید کاردیومیوسیتها از سلولهای پرتوان انسانی امکان مطالعه اختلالات قلبی مادرزادی و توسعه داروهای هدفمند را فراهم کرده است. همچنین، مهندسی بافتهای کبد، کلیه و مغز در قالب ارگانویدها (Organoids)، امکان بررسی تکوین طبیعی، پاسخ به دارو و مکانیسم بیماریها را بدون نیاز به مدلهای حیوانی فراهم میکند.
تشخیص پیش از تولد و پزشکی پیشگیرانه یکی دیگر از کاربردهای عملی جنینشناسی است. با استفاده از تصویربرداری پیشرفته، تکنیکهای ژنتیک مولکولی و بررسی DNA جنینی در خون مادر (cffDNA)، امکان شناسایی نقصهای ژنتیکی و مادرزادی پیش از تولد فراهم شده است. این فناوریها به خانوادهها و پزشکان کمک میکنند تا تصمیمگیری آگاهانه و مدیریت بهینه حاملگی داشته باشند.
مهندسی ژنوم و ویرایش ژنتیکی (CRISPR/Cas9) نیز یکی از فناوریهای نوین در جنینشناسی است. این تکنیک امکان اصلاح ژنهای معیوب در سلولهای جنینی یا سلولهای بنیادی را فراهم میکند و زمینهای برای پیشگیری از بیماریهای ژنتیکی و درمانهای هدفمند ایجاد میکند. تحقیقات نشان دادهاند که حتی تکنیکهای ویرایش ژنوم به صورت موزاییکی میتوانند به توسعه درمانهای اختصاصی برای بیماریهای نادر ژنتیکی کمک کنند، هرچند چالشهای اخلاقی و ایمنی هنوز باید حل شوند.
فناوریهای تصویربرداری پیشرفته مانند Light-Sheet Microscopy، میکروسکوپهای دو فوتونی و تصویربرداری سهبعدی سلولی امکان مشاهده رشد و تکوین سلولها در زمان واقعی را فراهم میکنند. این فناوریها به پژوهشگران اجازه میدهند تا مهاجرت سلولها، تمایز و تعاملات سلولی–مولکولی را با دقت بالا بررسی کنند و مدلهای دقیقتری از بیماریها و نقصهای تکوینی بسازند.
مدلسازی رایانهای و شبیهسازی سلولی نیز به سرعت در جنینشناسی کاربرد پیدا کرده است. با استفاده از مدلهای Reaction-Diffusion، مکانیک بافت و مهاجرت جمعی سلولها، پژوهشگران میتوانند پیشبینی کنند که چگونه تغییرات ژنتیکی یا محیطی بر تکوین اندامها و بافتها اثر میگذارد. این روشها در طراحی درمانهای پیشگیرانه، داروهای هدفمند و بازسازی بافت کاربرد دارند و سرعت تحقیقات را به طور چشمگیری افزایش دادهاند.
اپتوژنتیک و کنترل نور–حساس سلولها نیز در جنینشناسی نوین مورد استفاده قرار میگیرد. این فناوری امکان فعال یا غیرفعال کردن مسیرهای سیگنالینگ سلولی با نور را فراهم میکند و پژوهشگران میتوانند تاثیر دقیق مسیرهای ژنتیکی و مولکولی بر رشد اندامها را در مدلهای آزمایشگاهی بررسی کنند. این فناوریها، درک ما از تکوین پویا و فرآیندهای سلولی حساس به زمان را به طور چشمگیری افزایش دادهاند.
فناوری میکروفلوئیدیک و ارگانویدها یکی دیگر از ابزارهای پیشرفته است که امکان شبیهسازی محیط جنینی و رشد سلولها در شرایط کنترل شده را فراهم میکند. این ابزارها به بررسی تاثیر دارو، مواد شیمیایی و فاکتورهای محیطی بر تکوین انسان کمک میکنند و جایگزین مناسبی برای مدلهای حیوانی ایجاد میکنند.
در حوزه کاربردهای بالینی مستقیم، دانش جنینشناسی به توسعه پزشکی بازساختی و ترمیمی کمک کرده است. برای مثال، مهندسی بافت قلب، کلیه و مغز میتواند جایگزین آسیبهای مادرزادی یا ناشی از بیماری شود. همچنین، تولید سلولهای عصبی و عضلانی پرتوان امکان درمان آسیبهای نخاعی، فلج مغزی و نقصهای عضلانی را فراهم کرده است.
استفاده از مدلهای جانوری مانند موش، زبرا فیش و Xenopus نیز به توسعه درمانهای بالینی کمک کرده است. این مدلها امکان بررسی اثر ژنهای خاص، مسیرهای سیگنالینگ و مکانیسمهای بیماریها را فراهم میکنند و در نهایت به طراحی داروهای جدید و درمانهای ژنتیکی منجر میشوند.
یکی دیگر از زمینههای مهم، ارتباط بین جنینشناسی و سرطان است. بسیاری از مسیرهای سیگنالینگ فعال در مراحل اولیه تکوین مانند Wnt، Hedgehog و Notch در رشد تومورها دوباره فعال میشوند. مطالعه این مسیرها با استفاده از ارگانویدها، مدلهای سلولی و تصویربرداری زنده امکان توسعه درمانهای هدفمند و جلوگیری از متاستاز را فراهم میکند.
جنینشناسی بالینی و پیشگیری از بیماریها نیز اهمیت دارد. فهم دقیق مسیرهای تکوین و پنجرههای حساس دوران جنینی به پزشکان اجازه میدهد تا مداخلات تغذیهای، دارویی یا محیطی را برای کاهش ریسک بیماریهای مادرزادی، متابولیک و عصبی طراحی کنند. این رویکردها نمونهای از پزشکی پیشگیرانه و دقیق مبتنی بر تکوین هستند.
به طور خلاصه، کاربردهای بالینی و فناوریهای نوین در جنینشناسی شامل:
-
استفاده از سلولهای بنیادی و ارگانویدها برای بازسازی و مطالعه بافتها
-
تشخیص پیش از تولد و پزشکی پیشگیرانه
-
مهندسی ژنوم و ویرایش ژنهای بیماریزا
-
تصویربرداری پیشرفته و شبیهسازی رایانهای
-
اپتوژنتیک و کنترل دقیق مسیرهای سیگنالینگ
-
مهندسی بافت و پزشکی بازساختی
-
ارتباط با سرطان و توسعه درمانهای هدفمند
این فناوریها نه تنها امکان درک دقیق فرآیندهای تکوین را فراهم میکنند، بلکه افقهای نوینی برای پیشگیری، تشخیص و درمان بیماریها ایجاد کردهاند و به توسعه پزشکی شخصیسازیشده و بازساختی کمک میکنند.
آینده پژوهش در جنینشناسی و زیستشناسی تکوینی
آینده پژوهش در جنینشناسی به واسطه پیشرفتهای اخیر در ژنتیک مولکولی، سلولهای بنیادی، فناوری تصویربرداری و شبیهسازیهای رایانهای بسیار روشن و گسترده است. این حوزه علمی در حال حرکت به سمت درک دقیقتر مکانیسمهای تکوینی، شناسایی عوامل محیطی و ژنتیکی موثر بر رشد و ایجاد مدلهای پیشرفته برای مطالعه بیماریها است.
یکی از چالشهای اصلی آینده، ترکیب دادههای چندلایه سلولی و مولکولی با مدلهای سیستمیک است. با پیشرفت تکنیکهای تکسلولی و ژنومیک، امکان بررسی بیان ژنها، مسیرهای سیگنالینگ و اپیژنتیک در هر سلول جنینی فراهم شده است. این دادهها میتوانند برای ساخت نقشههای دقیق از رشد انسان (Human Developmental Cell Atlas) مورد استفاده قرار گیرند و به پژوهشگران اجازه دهند که تکوین اندامها و بافتها را با جزئیات بیسابقه مشاهده و مدلسازی کنند.
فناوری ارگانویدها و میکروفلوئیدیک به یکی دیگر از مسیرهای آینده پژوهش تبدیل شده است. ارگانویدها امکان شبیهسازی محیط جنینی و تعامل بین سلولها و بافتها را فراهم میکنند. این ابزارها نه تنها جایگزین مدلهای حیوانی میشوند، بلکه امکان مطالعه بیماریهای انسانی، واکنش به داروها و فرآیندهای بازساختی بافتها را در شرایط نزدیک به واقعیت فراهم میآورند.
اپتوژنتیک و کنترل دقیق مسیرهای سلولی با نور از دیگر فناوریهای نوین است که آینده پژوهش را شکل میدهد. با استفاده از این روش، پژوهشگران میتوانند فعال یا غیرفعال کردن مسیرهای ژنتیکی و سیگنالینگ سلولی در زمان واقعی را بررسی کنند و اثرات آن بر رشد و تمایز سلولها را به دقت بسنجند. این قابلیت، درک ما از پویا بودن فرآیندهای تکوین و پاسخ سلولها به محرکهای محیطی را بسیار افزایش میدهد.
یکی از حوزههای نوظهور و هیجانانگیز، توسعه مدلهای رایانهای و شبیهسازیهای مکانیک بافت است. این مدلها به پژوهشگران اجازه میدهند که تغییرات ژنتیکی یا محیطی را در سطح سلولی و بافتی پیشبینی کنند و اثر آنها بر تشکیل اندامها، مهاجرت سلولها و تعاملات بینبافتی را بررسی نمایند. این روشها در طراحی داروهای جدید، بازسازی بافت و درمانهای ژنتیکی کاربردهای گسترده خواهند داشت.
ویرایش ژنوم و مهندسی سلولهای بنیادی از دیگر مسیرهای آینده است. با پیشرفت تکنیکهای CRISPR/Cas9 و Prime Editing، امکان اصلاح ژنهای معیوب در سلولهای جنینی یا سلولهای بنیادی فراهم شده است. این فناوریها میتوانند به پیشگیری از بیماریهای ژنتیکی، درمان نقصهای مادرزادی و توسعه پزشکی شخصیسازیشده کمک کنند، هرچند مسائل اخلاقی و ایمنی هنوز نیازمند بررسی عمیق هستند.
جنبههای تکاملی و اپیژنتیک نیز در آینده پژوهش اهمیت خواهند داشت. درک چگونگی تاثیر محیط، تغذیه و فاکتورهای مادر بر اپیژنوم جنینی میتواند اطلاعات ارزشمندی برای پیشگیری از بیماریهای دوران کودکی و بزرگسالی فراهم کند. پژوهشهای آینده احتمالاً بر پنجرههای حساس جنینی و اثرات طولانیمدت بر سلامت انسان متمرکز خواهند شد.
هوش مصنوعی و یادگیری ماشین نیز به ابزار قدرتمندی برای آینده پژوهش در جنینشناسی تبدیل شدهاند. با تجزیه و تحلیل حجم عظیم دادههای ژنتیکی، سلولی و تصویربرداری، این فناوریها میتوانند الگوهای پیچیده رشد و تمایز سلولی، پیشبینی نقصهای مادرزادی و طراحی مداخلات درمانی را شناسایی کنند. ترکیب AI با مدلهای ارگانویدی و شبیهسازیهای رایانهای میتواند تحقیقات زیستشناسی تکوینی را با سرعت و دقت بیسابقهای پیش ببرد.
یکی دیگر از مسیرهای آینده، کاربرد جنینشناسی در درمان بیماریهای مزمن و بازساختی است. پژوهشها نشان دادهاند که سلولهای پرتوان و ارگانویدها میتوانند جایگزین بافتهای آسیبدیده شوند. برای مثال، توسعه سلولهای عصبی و عضلانی پرتوان امکان درمان آسیبهای نخاعی، فلج مغزی و بیماریهای عضلانی را فراهم میکند. همچنین، درک بهتر فرآیندهای تکوینی قلب، کلیه و کبد میتواند به طراحی درمانهای بازساختی برای نقصهای مادرزادی و بیماریهای پیشرونده کمک کند.
چالشهای اخلاقی و قانونی نیز بخش جداییناپذیر آینده پژوهش در جنینشناسی هستند. با پیشرفتهای فناوری، نیاز به چارچوبهای قانونی و اخلاقی برای استفاده از سلولهای بنیادی، ویرایش ژنوم و مدلهای جنینی پیشرفته افزایش یافته است. این مسائل شامل حفظ حریم انسانی، جلوگیری از استفاده غیرقانونی و مدیریت ریسکهای بالقوه است. پژوهشگران و قانونگذاران باید با همکاری یکدیگر، مسیر تحقیقاتی ایمن و اخلاقی ایجاد کنند.
چشمانداز پژوهشی آینده شامل موارد زیر است:
-
توسعه نقشههای تکاملی و سلولی انسان برای درک بهتر تکوین و بیماریها
-
استفاده گسترده از ارگانویدها و مدلهای میکروفلوئیدیک برای شبیهسازی محیط جنینی
-
ترکیب اپتوژنتیک و شبیهسازیهای مکانیک بافت برای درک فرآیندهای پویا و پیچیده
-
توسعه ویرایش ژنوم ایمن و دقیق برای پیشگیری و درمان بیماریها
-
بهرهگیری از هوش مصنوعی و یادگیری ماشین برای تجزیه و تحلیل دادههای تکوینی و پیشبینی نقصها
-
بررسی اثر اپیژنتیک و محیطی بر رشد و سلامت طولانیمدت
-
مدیریت چالشهای اخلاقی و قانونی و ایجاد چارچوبهای تحقیقاتی مسئولانه
به طور کلی، آینده پژوهش در جنینشناسی و زیستشناسی تکوینی به درک جامعتر از مکانیسمهای رشد، پیشگیری از بیماریها و توسعه درمانهای نوین منجر خواهد شد. این حوزه علمی با همگرایی ژنتیک، سلولهای بنیادی، فناوری تصویربرداری، مدلسازی رایانهای و هوش مصنوعی، در حال شکلدهی به پزشکی فردمحور و بازساختی نسل آینده است.
جمعبندی و نتیجهگیری
جنینشناسی و زیستشناسی تکوینی یکی از مهمترین شاخههای علوم زیستی است که به درک مراحل آغازین شکلگیری حیات و فرآیندهای پیچیده رشد و تمایز سلولی میپردازد. این حوزه نهتنها جنبهای بنیادی از زیستشناسی را نمایان میسازد، بلکه پلی میان علم پایه و کاربردهای بالینی ایجاد میکند و به همین دلیل نقش بیبدیلی در ارتقای دانش پزشکی و توسعه فناوریهای نوین ایفا کرده است.
در طول این مقاله تلاش شد تا جنبههای مختلف این دانش گسترده و چندلایه بررسی شود؛ از تاریخچه و مبانی نظری گرفته تا مکانیسمهای مولکولی، مراحل کلیدی رشد، مقایسه میان گونههای مختلف، ارتباط با بیماریها و همچنین کاربردهای نوین آن در پزشکی بازساختی و فناوریهای نوظهور. چنین گستردگیای نشان میدهد که جنینشناسی نه یک علم ایستا، بلکه دانشی پویا و همواره در حال تحول است که هر کشف تازه در آن میتواند مسیرهای جدیدی در علم و فناوری بگشاید.
یکی از نتایج کلیدی در بررسی جنینشناسی این است که شناخت مراحل تکوینی انسان و دیگر موجودات زنده، بستری برای فهم بهتر بیماریها و توسعه درمانهای نوین فراهم میکند. بسیاری از بیماریهای مادرزادی و اختلالات رشدی در واقع حاصل نقص در همین فرآیندهای بنیادین تکوین هستند. بنابراین، دانش جنینشناسی صرفاً جنبه نظری ندارد، بلکه دانشی حیاتی برای پیشگیری، تشخیص و درمان بیماریها به شمار میرود.
از سوی دیگر، بررسی جنینشناسی مقایسهای و تکاملی اهمیت ویژهای در درک مسیر تکامل حیات و کشف الگوهای مشترک میان گونهها دارد. چنین رویکردی نهتنها در سطح علمی بلکه در حوزههای فلسفی و زیستمحیطی نیز پیامدهای عمیقی دارد، زیرا نشان میدهد که حیات بر پایه اصول مشترک و الگوهای تکوینی مشابه شکل گرفته است. این درک میتواند به بازنگری در جایگاه انسان در طبیعت و مسئولیت او نسبت به حفاظت از زیستبوم کمک کند.
در بخش دیگری از بحث، توجه به فناوریهای نوین همچون ویرایش ژنوم، تصویربرداری پیشرفته و پزشکی بازساختی نشان داد که آینده جنینشناسی به شدت با نوآوریهای فناورانه گره خورده است. ترکیب این دانش با علوم میانرشتهای همچون هوش مصنوعی و بیوانفورماتیک نویدبخش عصری تازه در درک و کنترل فرآیندهای تکوینی است؛ عصری که در آن امکان بازآفرینی بافتها، درمان بیماریهای لاعلاج و حتی پیشبینی و اصلاح نقصهای رشدی پیش از تولد فراهم خواهد شد.
در نهایت، میتوان نتیجه گرفت که جنینشناسی دانشی است که از سطح مولکول تا کل ارگانیسم گسترده شده و به مثابه پلی میان زیستشناسی، پزشکی، فناوری و حتی اخلاق عمل میکند. آینده این علم وابسته به تعامل میان پژوهشگران رشتههای گوناگون و بهکارگیری رویکردهای میانرشتهای است. چالشهای اخلاقی و فلسفی همچون حد و مرز مداخلات در تکوین حیات، چگونگی استفاده از فناوریهای اصلاح ژنتیکی و پیامدهای اجتماعی آن نیز باید همزمان با پیشرفتهای علمی مورد توجه قرار گیرد.
به طور کلی، این مقاله نشان داد که جنینشناسی فراتر از یک دانش تخصصی، دریچهای به شناخت بنیادین حیات است؛ دانشی که نهتنها میتواند به درک عمیقتر از گذشته و حال ما کمک کند، بلکه در شکلدهی به آینده سلامت، فناوری و حتی فرهنگ انسانی نقشی تعیینکننده خواهد داشت. بنابراین، سرمایهگذاری بر پژوهشهای این حوزه، نه یک انتخاب بلکه ضرورتی برای پیشرفت پایدار در قرن بیستویکم محسوب میشود.