مادرزادی و مکانیسمهای ایجاد آنها
مقدمه
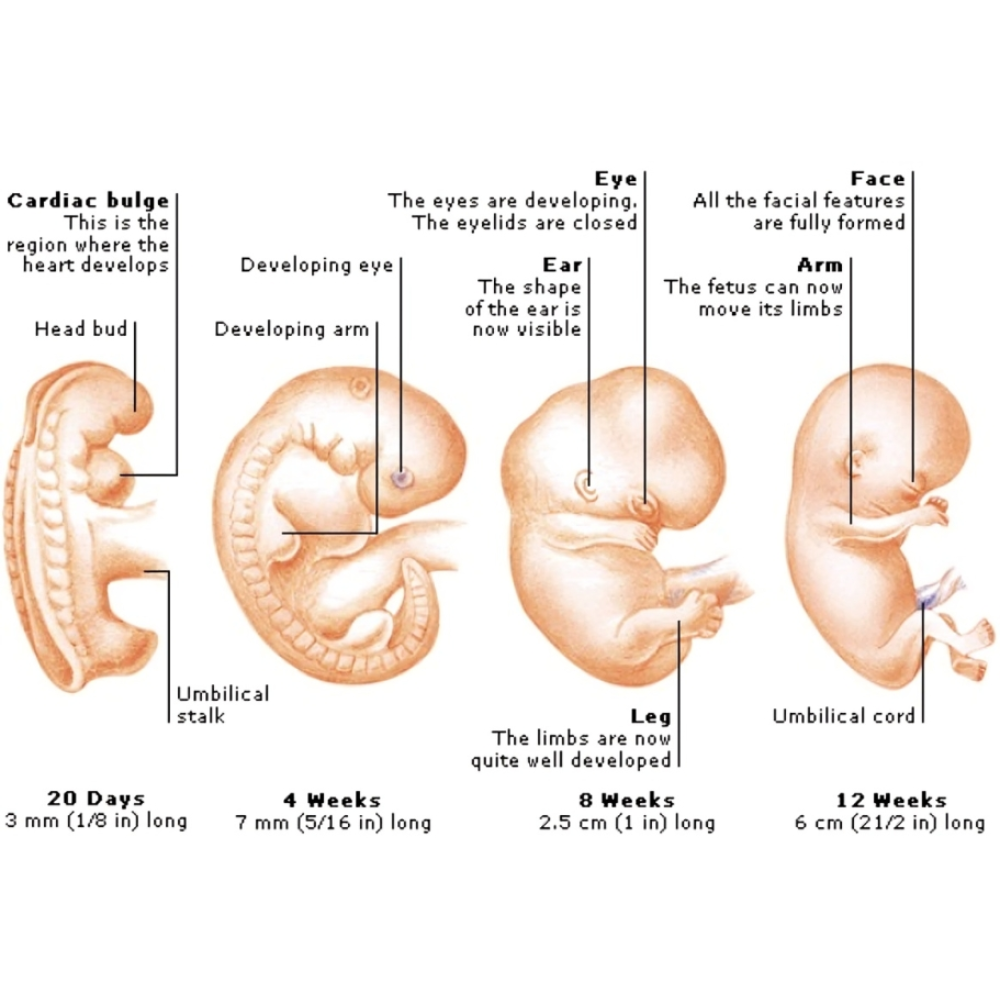
اختلالات مادرزادی یکی از مهمترین مسائل بهداشتی و پزشکی در سطح جهان محسوب میشوند که تأثیرات گستردهای بر سلامت فرد، خانواده و جامعه دارند. این اختلالات به معنای هر نوع ناهنجاری ساختاری، عملکردی یا متابولیکی هستند که از زمان تولد وجود دارند و میتوانند شامل تغییرات ژنتیکی، کروموزومی، سلولی یا محیطی باشند. اهمیت بررسی این اختلالات نه تنها در پیشگیری و درمان آنها، بلکه در درک عمیق مکانیسمهای مولکولی و سلولی تکوین جنین نهفته است.
شیوع اختلالات مادرزادی در سطح جهان متفاوت است و بسته به نوع اختلال، منطقه جغرافیایی، سطح بهداشت و عوامل محیطی متغیر است. براساس گزارشهای جهانی، تقریباً ۳ تا ۵ درصد نوزادان با اختلالات مادرزادی متولد میشوند که سهم عمده آنها مربوط به اختلالات قلبی، عصبی، کلیوی و اندامی است. این اختلالات نه تنها موجب مرگومیر نوزادان در سالهای ابتدایی زندگی میشوند، بلکه میتوانند پیامدهای طولانیمدتی بر سلامت جسمی، روانی و اجتماعی فرد داشته باشند. به همین دلیل، درک علتها و مکانیسمهای ایجاد اختلالات مادرزادی، اهمیت بسزایی در پزشکی پیشگیرانه، تشخیص زودهنگام و برنامههای درمانی دارد.
یکی از چالشهای اصلی در مطالعات اختلالات مادرزادی، پیچیدگی و تنوع مکانیسمهای مولکولی و ژنتیکی است. این اختلالات میتوانند ناشی از جهشهای تکژنی، تغییرات کروموزومی، اختلالات اپیژنتیک، آسیبهای DNA، اختلالات در مسیرهای سیگنالینگ سلولی و یا ترکیبی از عوامل ژنتیکی و محیطی باشند. علاوه بر این، تعامل بین ژنتیک و محیط، مانند تأثیر تغذیه مادر، قرارگیری در معرض سموم یا عفونتها، میتواند ریسک بروز این اختلالات را افزایش دهد. در سالهای اخیر، پیشرفتهای فناوری در حوزه ژنتیک مولکولی، اپیژنتیک و مدلسازی سلولی و ارگانوئیدها، امکان بررسی دقیقتر این مکانیسمها را فراهم کرده است.
اهمیت این مقاله در این است که نه تنها یک مرور علمی جامع بر انواع اختلالات مادرزادی ارائه میدهد، بلکه تمامی مکانیسمهای مولکولی، سلولی و ژنتیکی مرتبط را با زبانی تخصصی و در عین حال قابل فهم برای مخاطب عمومی توضیح میدهد. این مقاله تلاش میکند تمام ابعاد موضوع را پوشش دهد و پاسخگوی سوالات یک متخصص در زمینه ژنتیک، جنینشناسی و بالین باشد. همچنین، با تمرکز بر مکانیسمها و عوامل مولکولی، زمینهای برای شناخت بهتر راهکارهای پیشگیری، تشخیص و درمان این اختلالات فراهم میآورد.
در نهایت، این مرور علمی با هدف ارائه یک تصویر کامل و سیستماتیک از اختلالات مادرزادی و مکانیسمهای ایجاد آنها تدوین شده است. این مقاله میتواند به عنوان یک مرجع جامع برای متخصصان بالینی، پژوهشگران ژنتیک، پزشکان جنینشناس و دانشجویان علوم پزشکی مورد استفاده قرار گیرد. با بررسی دقیق تعامل بین ژنتیک، اپیژنتیک و عوامل محیطی، امید است که بتوان راهکارهای بهینه برای کاهش شیوع و پیامدهای اختلالات مادرزادی ارائه کرد و در ارتقای سلامت نوزادان و کاهش بار اقتصادی و اجتماعی این بیماریها نقش موثری ایفا نمود.
تعریف و طبقهبندی اختلالات مادرزادی
اختلالات مادرزادی به هرگونه ناهنجاری ساختاری، عملکردی یا متابولیکی گفته میشود که از بدو تولد وجود دارد و ممکن است در طول زندگی فرد پیامدهای بالینی قابل توجهی داشته باشد. این اختلالات میتوانند ناشی از عوامل ژنتیکی، محیطی یا ترکیبی از هر دو باشند و دامنه آنها از تغییرات جزئی تا نقصهای شدید که تهدیدکننده حیات هستند، گسترده است. تعریف جامع اختلالات مادرزادی شامل ناهنجاریهای ساختاری (Structural anomalies)، که به شکلهای غیرطبیعی اندامها و سیستمهای بدن ظاهر میشوند، و ناهنجاریهای عملکردی یا متابولیکی (Functional or Metabolic anomalies) است که اغلب با اختلالات سوختوساز، فعالیت آنزیمی یا عملکرد سیستمهای حیاتی بدن همراه هستند.
از دیدگاه بالینی، شناسایی و طبقهبندی اختلالات مادرزادی نقش بسیار مهمی در پیشگیری، تشخیص و مدیریت درمانی دارد. یکی از شیوههای رایج طبقهبندی، دستهبندی بر اساس سیستمهای بدن است. این روش به متخصصان اجازه میدهد تا بر اساس علائم بالینی، ارزیابیهای تشخیصی و مداخلات درمانی به شکل هدفمند عمل کنند. برای مثال، اختلالات قلبی مادرزادی، اختلالات مغزی و عصبی، ناهنجاریهای کلیوی و دستگاه ادراری، نقصهای اندامی و اسکلتی، و اختلالات گوارشی و متابولیکی، هر کدام دارای مکانیسمهای مولکولی، ژنتیکی و محیطی خاص خود هستند و نیاز به بررسی جامع دارند.
اختلالات قلبی مادرزادی از شایعترین ناهنجاریها هستند که میتوانند شامل نقصهای ساختاری در دهلیزها، بطنها، دریچهها و عروق بزرگ قلب باشند. این اختلالات اغلب با سندرمهای ژنتیکی مرتبط هستند و میتوانند پیامدهایی مانند نارسایی قلبی، اختلال در گردش خون و مرگ زودرس نوزادان را ایجاد کنند. اختلالات مغزی و عصبی نیز یکی دیگر از دستههای مهم هستند که شامل نقصهای نورودولوپمنتال، اسپاینال و مغزی، اوتیسم، فلج مغزی و اختلالات شناختی و رفتاری میشوند. این اختلالات معمولاً با جهشهای ژنتیکی، تغییرات اپیژنتیک و اختلالات مسیرهای سیگنالینگ سلولی مرتبط هستند.
در زمینه دستگاه ادراری و کلیهها، اختلالات مادرزادی مانند CAKUT (Congenital Anomalies of the Kidney and Urinary Tract) شامل نقص در ساختار و عملکرد کلیهها و مجاری ادراری است و میتواند پیامدهایی از جمله نارسایی کلیوی و افزایش ریسک عفونتهای ادراری را ایجاد کند. نقصهای اندامی و اسکلتی نیز طیف وسیعی از اختلالات از جمله کوتاهی یا فقدان اندامها، نقص در رشد استخوانها و اختلالات مفصلی را شامل میشوند و به شدت به مسیرهای سیگنالینگ رشد و عوامل محیطی وابسته هستند.
یک شیوه دیگر طبقهبندی، بر اساس نوع اختلال است که میتواند ژنتیکی، محیطی یا ترکیبی باشد. اختلالات ژنتیکی ناشی از جهشهای تکژنی یا چندژنی، ناهنجاریهای کروموزومی عددی یا ساختاری و اختلالات اپیژنتیک هستند. اختلالات محیطی معمولاً ناشی از عفونتها، تغذیه نامناسب، داروها یا قرارگیری در معرض سموم در دوران بارداری هستند و میتوانند با اثرگذاری بر جفت، رشد جنین و مسیرهای تکوینی، منجر به ناهنجاریهای مادرزادی شوند. علاوه بر این، بسیاری از اختلالات مادرزادی دارای مکانیزم ترکیبی هستند، به این معنی که هم عوامل ژنتیکی و هم محیطی در بروز آنها نقش دارند. تعامل پیچیده این عوامل باعث میشود که پیشبینی و پیشگیری از بسیاری از اختلالات، نیازمند بررسیهای دقیق و چندبعدی باشد.
طبقهبندی جامع اختلالات مادرزادی علاوه بر تقسیمبندی بر اساس سیستم بدن و نوع اختلال، شامل شدت بالینی و پیامدهای طولانیمدت نیز میشود. برخی از این اختلالات ممکن است تنها تغییرات جزئی و قابل اصلاح ایجاد کنند، در حالی که برخی دیگر تهدیدکننده حیات هستند یا نیازمند مداخلات جراحی و درمانی پیچیده از بدو تولد تا بزرگسالی میباشند. همچنین، در برخی موارد اختلالات مادرزادی میتوانند با سندرمهای شناخته شده مرتبط باشند که شامل مجموعهای از ناهنجاریها با یک ریشه ژنتیکی یا مولکولی مشترک هستند. این دستهبندیها به پزشکان و متخصصان امکان میدهد تا بر اساس علت و مسیر مولکولی اختلال، برنامههای درمانی و پیشگیری مناسب طراحی کنند.
در مجموع، درک تعریف دقیق و طبقهبندی اختلالات مادرزادی پایهای اساسی برای مطالعه مکانیسمهای مولکولی، ژنتیکی و محیطی آنها فراهم میکند. این دانش نه تنها برای تشخیص زودهنگام و پیشگیری اهمیت دارد، بلکه زمینه را برای طراحی تحقیقات پیشرفته در حوزه ژنتیک مولکولی، اپیژنتیک و مسیرهای سلولی فراهم میآورد. در ادامه مقاله، با توجه به این طبقهبندی، به بررسی عمیق عوامل ژنتیکی، مکانیسمهای مولکولی و مسیرهای سلولی که منجر به بروز اختلالات مادرزادی میشوند، پرداخته خواهد شد تا تصویر جامع و کاملی از این اختلالات ارائه شود.
عوامل ژنتیکی در ایجاد اختلالات مادرزادی
ژنتیک نقش محوری و بنیادین در ایجاد اختلالات مادرزادی دارد و میتواند به عنوان یکی از مهمترین عوامل تعیینکننده سلامت جنین و رشد طبیعی آن در نظر گرفته شود. اختلالات ژنتیکی معمولاً ناشی از تغییرات در ساختار یا عملکرد ژنها و کروموزومها هستند که میتوانند مسیرهای تکوینی طبیعی را مختل کنند. این تغییرات ممکن است به شکل جهشهای تکژنی، جهشهای چندژنی، اختلالات کروموزومی یا تغییرات اپیژنتیک ظاهر شوند و در نتیجه طیف وسیعی از ناهنجاریها را ایجاد کنند.
جهشهای تکژنی و چندژنی یکی از شناختهشدهترین مکانیسمهای ژنتیکی ایجاد اختلالات مادرزادی هستند. جهشهای تکژنی معمولاً در یک ژن مشخص رخ میدهند و میتوانند الگوی توارث اتووزومال غالب، اتووزومال مغلوب یا وابسته به X داشته باشند. نمونههایی از این اختلالات شامل سندرم مارفان، فیبروز کیستیک و برخی اختلالات متابولیک مادرزادی هستند که هر یک با اختلال در یک مسیر مولکولی مشخص مرتبطند. در مقابل، جهشهای چندژنی، که شامل تغییرات همزمان در چندین ژن هستند، اغلب به شکل اختلالات پیچیده و چندعاملی ظاهر میشوند. این اختلالات معمولاً با تعامل ژنتیک و محیط همراه هستند و نمونههای آن شامل بسیاری از اختلالات قلبی مادرزادی و نورودولوپمنتال هستند.
سندرمها و ناهنجاریهای کروموزومی یکی دیگر از عوامل ژنتیکی بسیار مهم در اختلالات مادرزادی هستند. این دسته شامل تغییرات عددی کروموزومها، مانند تریزومی 21 (سندرم داون)، تریزومی 18 (سندرم ادواردز) و تغییرات ساختاری مانند دیستروفیهای کروموزومی، حذف یا تکرار بخشی از کروموزومها میشود. اختلالات کروموزومی میتوانند منجر به تغییر در بیان ژنهای حیاتی شوند و فرآیندهای تکوینی طبیعی را مختل کنند، که در نهایت به نقصهای چندسیستمی و شدید مادرزادی منجر میشود.
یکی از محورهای کلیدی در اختلالات ژنتیکی، نقش ژنهای تنظیمکننده رشد و تمایز سلولی است. ژنهایی که به عنوان ترنسکریپشن فاکتورها، سیگنالهای رشد و مسیرهای کنترل سلولی عمل میکنند، به دقت باید در زمان و مکان مناسب فعال شوند تا تمایز سلولها و شکلگیری اندامها به درستی انجام شود. اختلال در عملکرد این ژنها میتواند منجر به ناهنجاریهای قلبی، مغزی، اندامی و اسکلتی شود. به عنوان مثال، جهش در ژنهای خانواده HOX که نقش حیاتی در تعیین محورهای بدن و توسعه اندامها دارند، میتواند موجب نقصهای اندامی مادرزادی شود.
علاوه بر این، RNA-binding proteins و فرآیند اسپایسینگ ژنی نیز به عنوان مکانیسمهای مولکولی بسیار مهم در ایجاد اختلالات ژنتیکی شناخته شدهاند. این پروتئینها و مسیرهای مرتبط، مسئول پردازش صحیح RNA پیشپیامرسان (pre-mRNA) و تولید پروتئینهای عملکردی هستند. جهشها یا اختلال در عملکرد RNA-binding proteins میتواند منجر به تولید پروتئینهای ناقص یا حذف شده شود و پیامدهای نورودولوپمنتال، عضلانی و قلبی ایجاد کند. مطالعات اخیر نشان دادهاند که بسیاری از اختلالات مادرزادی عصبی و قلبی با نقص در اسپایسینگ ژنی یا عملکرد RNA-binding proteins مرتبط هستند.
اپیژنتیک و تغییرات در DNA methylation یکی دیگر از مکانیسمهای ژنتیکی است که نقش مهمی در اختلالات مادرزادی دارد. DNA methylation، به عنوان یک مکانیسم خاموشکننده ژن، تعیین میکند که کدام ژنها در طول تکوین فعال یا غیرفعال شوند. اختلال در این فرآیند میتواند باعث بیتنظیمی بیان ژنها شود و در نتیجه ناهنجاریهای قلبی، عصبی و متابولیک ایجاد گردد. همچنین، ایمپرینتینگ ژنتیکی (Genomic Imprinting) که به صورت تکآللی و وابسته به والدین بیان ژنها را کنترل میکند، نقش مهمی در رشد و تمایز جنین دارد و اختلال در آن با سندرمهایی مانند پراد و ویلی مرتبط است.
از سوی دیگر، جهشها و اختلالات در مسیرهای تعمیر DNA و نگهداری ژنوم میتوانند منجر به آسیبهای گسترده کروموزومی و اختلالات نورودولوپمنتال شوند. مکانیسمهای طبیعی ترمیم DNA، در صورت نقص، باعث تجمع جهشها در ژنهای حیاتی رشد و توسعه میشوند و این جهشها میتوانند از یک نسل به نسل بعد منتقل شوند. مطالعات اخیر نشان دادهاند که بسیاری از نقصهای مغزی و اختلالات نورودولوپمنتال با اختلال در مسیرهای ترمیم DNA مرتبط هستند.
در نهایت، نمیتوان نقش تعامل بین ژنتیک و محیط را در ایجاد اختلالات مادرزادی نادیده گرفت. برخی اختلالات ژنتیکی فقط در حضور محرکهای محیطی مانند داروها، تغذیه نامناسب، عفونتها و استرسهای اکسیداتیو ظاهر میشوند. این تعامل پیچیده باعث میشود که پیشبینی ریسک اختلالات مادرزادی نیازمند بررسیهای جامع ژنتیکی، اپیژنتیکی و محیطی باشد و هرگونه تحلیل تکبعدی ممکن است تصویر ناقص ارائه دهد.
در این بخش، تمرکز بر پایههای ژنتیکی اختلالات مادرزادی بود و توضیح داده شد که چگونه جهشهای تکژنی، جهشهای چندژنی، اختلالات کروموزومی، تغییرات اپیژنتیک، نقص در اسپایسینگ ژنی و آسیب DNA میتوانند مسیرهای تکوینی طبیعی را مختل کنند. این دانش پایهای برای بررسی دقیقتر مکانیسمهای مولکولی و سلولی اختلالات مادرزادی فراهم میکند که در بخش بعدی مقاله به آن پرداخته خواهد شد.
مکانیسمهای مولکولی و سلولی اختلالات مادرزادی
درک مکانیسمهای مولکولی و سلولی اختلالات مادرزادی، کلید اصلی برای شناسایی علتهای بنیادین و طراحی راهکارهای پیشگیری و درمان است. اختلالات مادرزادی نه تنها حاصل جهشهای ژنتیکی هستند، بلکه ناشی از اختلالات در مسیرهای سیگنالینگ سلولی، تمایز و تکثیر سلولها، فرآیندهای اپیژنتیک و متابولیک نیز میباشند. بررسی این مکانیسمها نشان میدهد که رشد جنین یک فرآیند پیچیده، دقیق و وابسته به تعامل متقابل بین عوامل ژنتیکی و محیطی است.
یکی از مهمترین مکانیسمها در ایجاد اختلالات مادرزادی، آسیب DNA و نقص در مسیرهای ترمیم آن است. DNA آسیبدیده میتواند ناشی از جهشهای ارثی، عوامل محیطی یا فرآیندهای طبیعی متابولیک باشد. در حالت طبیعی، سلولها با استفاده از مکانیسمهای ترمیم DNA مانند NER (Nucleotide Excision Repair)، BER (Base Excision Repair) و MMR (Mismatch Repair) قادر به اصلاح آسیبها هستند. اما در صورت نقص در این مسیرها، جهشها در ژنهای حیاتی تجمع مییابند و میتوانند موجب اختلال در تکثیر سلولها، تمایز بافتی و تکوین اندامها شوند. به طور مثال، اختلالات نورودولوپمنتال و برخی سندرمهای قلبی مادرزادی با آسیب DNA و نقص در ترمیم آن ارتباط مستقیم دارند.
اپیژنتیک یکی دیگر از مکانیسمهای کلیدی است که بر ایجاد اختلالات مادرزادی اثر میگذارد. اپیژنتیک شامل تغییراتی در بیان ژنها است که بدون تغییر در توالی DNA رخ میدهد و شامل DNA methylation، تغییرات هیستونی و RNAهای تنظیمکننده غیرکدکننده میشود. این تغییرات میتوانند فعالیت ژنهای رشد و تمایز را تغییر دهند و در نتیجه موجب ناهنجاریهای ساختاری و عملکردی شوند. به عنوان مثال، اختلال در DNA methylation میتواند منجر به بیتنظیمی ژنهای قلبی، عصبی و متابولیک شود و سندرمهای ایمپرینتینگ مانند پراد و ویلی نمونههای شناختهشده این مکانیسم هستند.
نقش مسیرهای سیگنالینگ سلولی نیز در تکوین جنین و اختلالات مادرزادی بسیار برجسته است. مسیرهایی مانند Notch، Wnt، Hedgehog و FGF در تعیین سرنوشت سلولها، تقسیم سلولی و شکلگیری اندامها حیاتی هستند. اختلال در هر یک از این مسیرها میتواند باعث ناهنجاریهای ساختاری متعدد شود؛ برای مثال، نقص در مسیر Wnt با اختلالات قلبی و نقص در مسیر Hedgehog با اختلالات مغزی و اندامی مرتبط است. این مسیرها به صورت شبکهای با یکدیگر تعامل دارند و تغییرات کوچک در عملکرد آنها میتواند اثرات گستردهای بر تکوین جنین داشته باشد.
نقش میتوکندری و متابولیسم سلولی در اختلالات مادرزادی نیز قابل توجه است. میتوکندری نه تنها انرژی لازم برای رشد و تقسیم سلولی را فراهم میکند، بلکه نقش مهمی در مسیرهای سیگنالینگ و آپوپتوز دارد. اختلالات میتوکندریایی میتوانند منجر به کمبود انرژی در سلولهای در حال تمایز و تکثیر شوند و در نهایت موجب نارسایی اندامها، اختلالات عصبی و قلبی و دیگر ناهنجاریهای مادرزادی شوند. برای مثال، اختلال در β-oxidation اسیدهای چرب میتوکندریایی با اختلالات متابولیک و قلبی مادرزادی مرتبط است.
یکی دیگر از مکانیسمهای مهم، تنظیم صحیح اسپایسینگ و عملکرد RNA-binding proteins است. این پروتئینها مسئول پردازش دقیق RNA پیشپیامرسان (pre-mRNA) هستند و جهش یا نقص عملکرد آنها میتواند تولید پروتئینهای ناقص یا حذف شده را به دنبال داشته باشد. بسیاری از اختلالات نورودولوپمنتال، عضلانی و قلبی به دلیل نقص در اسپایسینگ ژنی ایجاد میشوند، که نشاندهنده اهمیت این مکانیسم در تکوین طبیعی جنین است.
علاوه بر مکانیسمهای ژنتیکی و سلولی، پاسخهای التهابی و استرس اکسیداتیو نیز میتوانند نقش مهمی در اختلالات مادرزادی داشته باشند. فعال شدن مسیرهای التهابی در جنین، ناشی از عفونتها یا استرسهای محیطی مادر، میتواند باعث مرگ سلولی، اختلال در تمایز بافتی و ناهنجاریهای قلبی و مغزی شود. همچنین، ترکیب آسیب DNA، تغییرات اپیژنتیک و پاسخ التهابی میتواند به شکل همزمان مسیرهای رشد را مختل کرده و پیامدهای شدیدتر ایجاد کند.
در نهایت، تعامل بین مکانیسمهای مولکولی و سلولی با عوامل محیطی و مادری نقش تعیینکنندهای در بروز اختلالات مادرزادی دارد. تغذیه نامناسب، داروهای مصرفی، قرارگیری در معرض سموم و عفونتها میتوانند با اختلال در مسیرهای سیگنالینگ، DNA، اپیژنتیک و متابولیسم، ریسک اختلالات مادرزادی را به شدت افزایش دهند. این تعامل پیچیده نشان میدهد که درک اختلالات مادرزادی نیازمند یک رویکرد بینرشتهای است که ژنتیک، سلولی، مولکولی و محیطی را در نظر بگیرد.
در این بخش، مکانیسمهای اصلی مولکولی و سلولی شامل آسیب DNA، اختلالات اپیژنتیک، نقص در مسیرهای سیگنالینگ، عملکرد میتوکندری، اسپایسینگ ژنی و پاسخهای التهابی بررسی شد. این بخش پایهای برای ورود به بررسی اختلالات تخصصی در اندامها و سیستمهای مختلف بدن فراهم میکند و زمینه را برای مطالعه اختلالات قلبی، عصبی، کلیوی و اندامی در بخشهای بعدی آماده میسازد.
اختلالات قلبی مادرزادی
اختلالات قلبی مادرزادی یکی از شایعترین ناهنجاریهای ساختاری در نوزادان محسوب میشوند و حدود ۳۰ درصد از کل اختلالات مادرزادی را تشکیل میدهند. این ناهنجاریها شامل نقصهای ساختمانی قلب، دریچهها، عروق بزرگ و مسیرهای ارتباطی بین حفرهها هستند و میتوانند منجر به پیامدهای کوتاهمدت و بلندمدت شدید برای سلامت نوزاد شوند. از دیدگاه بالینی، این اختلالات طیف وسیعی دارند؛ از نقصهای جزئی که بدون نیاز به مداخله درمانی بهبود مییابند تا نقصهای پیچیدهای که نیازمند جراحی قلب باز و مراقبتهای مادامالعمر هستند.
علل ژنتیکی اختلالات قلبی مادرزادی به طور گسترده مورد بررسی قرار گرفتهاند و نشان میدهند که ترکیبی از جهشهای تکژنی، اختلالات چندژنی و ناهنجاریهای کروموزومی نقش اساسی در بروز آنها دارند. به عنوان مثال، جهش در ژنهای NKX2-5، GATA4 و TBX5 با نقصهای ساختاری دهلیز و بطن مرتبط هستند و این ژنها نقش حیاتی در تنظیم مسیرهای سیگنالینگ و تمایز سلولهای قلبی دارند. همچنین، بسیاری از اختلالات قلبی مادرزادی در قالب سندرمهای ژنتیکی شناختهشده مانند سندرم داون، سندرم دی جورج و سندرم Noonan ظاهر میشوند که مجموعهای از ناهنجاریهای قلبی و سایر اختلالات سیستمیک را به همراه دارند.
از منظر مولکولی، مسیرهای سیگنالینگ قلبی مانند Notch، Wnt و BMP (Bone Morphogenetic Protein) نقش کلیدی در شکلگیری ساختارهای قلبی ایفا میکنند. اختلال در هر یک از این مسیرها میتواند منجر به نقص در تمایز سلولهای قلبی، تشکیل غیرطبیعی دریچهها و حفرهها، و نارسایی عملکرد قلب شود. برای مثال، اختلال در مسیر Notch با نقص در تکامل دریچهها و Septation قلب مرتبط است، در حالی که تغییرات در مسیر BMP میتواند منجر به نقص در شکلگیری عضله قلب و عروق کرونری شود.
نقش اپیژنتیک و تنظیم بیان ژنها نیز در بروز اختلالات قلبی مادرزادی غیرقابل انکار است. تغییرات در DNA methylation و هیستونها میتوانند بیان ژنهای کلیدی قلبی را مختل کنند و باعث بیتنظیمی در رشد و توسعه قلب شوند. مطالعات نشان دادهاند که اختلال در اپیژنتیک ژنهای مسیر GATA و TBX میتواند سبب نقصهای قلبی مادرزادی پیچیده شود. علاوه بر این، تعامل بین ژنتیک و عوامل محیطی مادر مانند تغذیه، استرس، مصرف دارو و قرارگیری در معرض سموم، میتواند شدت و نوع نقصهای قلبی را تحت تأثیر قرار دهد.
نقش میتوکندری و متابولیسم سلولی نیز در سلامت قلبی جنین بسیار مهم است. میتوکندریها با تولید ATP، انرژی لازم برای تکثیر و تمایز سلولهای قلبی را تأمین میکنند. اختلال در مسیرهای میتوکندریایی و β-oxidation اسیدهای چرب میتواند منجر به کمبود انرژی در سلولهای قلبی و ایجاد نقصهای عملکردی و ساختاری شود. این مکانیسمها به ویژه در قلبهای در حال رشد و پرتقاضا از نظر متابولیک، اهمیت حیاتی دارند.
اختلالات ساختاری شایع قلبی مادرزادی شامل نقصهای دیواره بین دهلیزی (ASD)، نقصهای دیواره بین بطنی (VSD)، تترالوژی فالوت، آترزی دریچهها و اختلالات شریانهای بزرگ هستند. هر یک از این اختلالات با مسیرهای ژنتیکی، مولکولی و سلولی خاص مرتبطند. به عنوان مثال، نقص دیواره بین دهلیزی اغلب با جهش در ژن NKX2-5 و اختلال در مسیر Notch همراه است، در حالی که تترالوژی فالوت با ترکیبی از جهشهای چندژنی و نقصهای محیطی ایجاد میشود.
پاتوفیزیولوژی اختلالات قلبی مادرزادی شامل پیامدهایی مانند اختلال در گردش خون سیستمیک و ریوی، نارسایی قلبی، هیپوکسی مزمن و افزایش فشار در حفرههای قلبی است. این اختلالات میتوانند در طولانیمدت باعث اختلال رشد، مشکلات شناختی و نارسایی اندامها شوند. همچنین، بسیاری از اختلالات قلبی مادرزادی با اختلالات متابولیک و نورودولوپمنتال همراه هستند، که نشاندهنده تعامل پیچیده بین مسیرهای ژنتیکی و سلولی در اندامهای مختلف است.
پیشرفتهای اخیر در حوزه ژنتیک و مدلهای ارگانوئید قلبی امکان بررسی دقیقتر مکانیسمهای اختلالات قلبی مادرزادی را فراهم کرده است. با استفاده از مدلهای سلولی انسانی و ارگانوئیدها، پژوهشگران قادر شدهاند نحوه تأثیر جهشهای ژنتیکی، تغییرات اپیژنتیک و اختلال در مسیرهای سیگنالینگ را بر توسعه قلب به صورت زمانبندیشده و قابل مشاهده بررسی کنند. این مدلها همچنین پتانسیل توسعه درمانهای هدفمند ژنتیکی و مولکولی را فراهم کردهاند، که میتواند راهی برای پیشگیری یا اصلاح اختلالات قلبی مادرزادی در آینده باشد.
در این بخش، اختلالات قلبی مادرزادی از منظر ژنتیکی، مولکولی، سلولی و بالینی بررسی شد. مکانیسمهای کلیدی شامل جهشهای ژنتیکی، اختلال مسیرهای سیگنالینگ، تغییرات اپیژنتیک، نقص میتوکندریایی و تعامل ژنتیک با محیط بودند. این بخش زمینه را برای ورود به بررسی اختلالات عصبی و مغزی مادرزادی فراهم میکند، جایی که پیچیدگی مسیرهای ژنتیکی و سلولی در ایجاد ناهنجاریها بسیار بیشتر و چندلایه است.
اختلالات مغزی و عصبی مادرزادی
اختلالات مغزی و عصبی مادرزادی یکی از پیچیدهترین و پرچالشترین دستههای ناهنجاریهای مادرزادی به شمار میآیند و تأثیرات گستردهای بر رشد شناختی، حرکتی و عملکرد سیستم عصبی دارند. این اختلالات میتوانند ناشی از جهشهای ژنتیکی، نقص در مسیرهای سلولی و مولکولی، عوامل محیطی و اختلالات اپیژنتیک باشند. شدت و نوع آنها میتواند از اختلالات جزئی شناختی تا نقصهای شدید نورودولوپمنتال و نقصهای ساختاری مغزی متغیر باشد.
نقش ژنتیک در اختلالات مغزی و عصبی مادرزادی بسیار مهم است. بسیاری از اختلالات نورودولوپمنتال ناشی از جهشهای تکژنی یا چندژنی هستند که مسیرهای کلیدی در تمایز و رشد سلولهای عصبی را تحت تأثیر قرار میدهند. برای مثال، جهش در ژنهای خانواده MECP2 با اختلالات طیف اتیسم و سندرم رِت مرتبط است، در حالی که جهش در ژنهای SHANK، FMR1 و TSC1/TSC2 میتواند به اختلالات شناختی، اختلالات رفتاری و رشد مغزی غیرطبیعی منجر شود. علاوه بر جهشهای تکژنی، اختلالات چندژنی و ترکیبی که با عوامل محیطی و اپیژنتیک تعامل دارند، در بسیاری از سندرمهای نورودولوپمنتال پیچیده نقش دارند.
مکانیسمهای مولکولی و سلولی که منجر به اختلالات مغزی میشوند، شامل نقص در مسیرهای سیگنالینگ نوروتروفیک، اختلال در اسپایسینگ ژنی و عملکرد RNA-binding proteins، آسیب DNA و نقص در ترمیم آن، تغییرات اپیژنتیک و اختلالات میتوکندریایی هستند. مسیرهای سیگنالینگ مانند Notch، Wnt، BMP و FGF در تمایز نورونها و شکلگیری شبکههای عصبی حیاتی هستند و اختلال در هر یک میتواند منجر به ناهنجاریهای ساختاری مغز، نقص در تشکیل قشر مغزی و اختلال در ارتباطات سیناپسی شود.
اسپایسینگ ژنی و RNA-binding proteins نقش مهمی در تولید پروتئینهای عملکردی نورونها دارند. اختلال در این فرآیندها باعث تولید پروتئینهای ناقص یا حذف شده میشود که میتواند منجر به نقص در مهاجرت نورونی، تمایز سلولی و شکلگیری شبکههای عصبی گردد. مطالعات نشان دادهاند که بسیاری از اختلالات طیف اتیسم و فلج مغزی با نقص در اسپایسینگ و عملکرد RNA-binding proteins ارتباط دارند.
آسیب DNA و نقص در مسیرهای ترمیم یکی دیگر از عوامل مهم است. سلولهای عصبی در حال تکثیر و تمایز به شدت نسبت به جهشهای ژنتیکی حساس هستند و اختلال در ترمیم DNA میتواند باعث مرگ سلولی، اختلال در رشد مغزی و نقصهای ساختاری شود. برای مثال، اختلال در مسیرهای NER و BER با برخی سندرمهای نورودولوپمنتال و اختلالات شناختی شدید مرتبط است.
اپیژنتیک نیز نقش کلیدی در اختلالات مغزی دارد. تغییرات در DNA methylation و هیستونها میتواند بیان ژنهای حیاتی نورودولوپمنتال را مختل کند. اختلال در این مکانیسمها با سندرمهای طیف اتیسم، اختلالات شناختی و نقصهای مغزی ساختاری مرتبط است. همچنین، ایمپرینتینگ ژنتیکی در نورودولوپمنتال و رشد مغز نقش مهمی دارد و اختلال در آن میتواند منجر به مشکلات شناختی و رفتاری شود.
نقش میتوکندری و متابولیسم سلولی نیز در توسعه مغز حیاتی است. مغز یک بافت با مصرف انرژی بالا است و اختلالات میتوکندریایی میتواند کمبود انرژی سلولی و مرگ سلولی را افزایش دهد و موجب اختلالات نورودولوپمنتال، فلج مغزی و ناتوانیهای شناختی شود. اختلال در مسیرهای β-oxidation و تولید ATP میتواند عملکرد نورونها و شکلگیری شبکههای عصبی را مختل کند.
عوامل محیطی و مادری نیز به شدت بر اختلالات مغزی و عصبی تأثیر میگذارند. عفونتها، کمبودهای تغذیهای، داروها، سموم محیطی و استرسهای اکسیداتیو میتوانند مسیرهای ژنتیکی و مولکولی را تحت تأثیر قرار دهند و شدت اختلالات نورودولوپمنتال را افزایش دهند. این تعامل بین ژنتیک و محیط باعث میشود که پیشگیری و مدیریت اختلالات مغزی نیازمند یک رویکرد چندبعدی و بینرشتهای باشد.
اختلالات مغزی و عصبی مادرزادی شایع شامل فلج مغزی، اختلالات طیف اتیسم، نقص لوله عصبی، میکروسفالی و اختلالات شناختی و حرکتی است. هر یک از این اختلالات با مکانیسمهای مولکولی، ژنتیکی و سلولی خاص مرتبط است و درک دقیق این مسیرها امکان تشخیص زودهنگام، مداخلات درمانی هدفمند و پیشگیری را فراهم میکند.
مطالعات اخیر با استفاده از ارگانوئیدهای مغزی انسانی و مدلهای حیوانی امکان بررسی دقیقتر مکانیسمهای نورودولوپمنتال را فراهم کردهاند. این مدلها نشان دادهاند که چگونه جهشهای ژنتیکی، اختلالات اسپایسینگ، تغییرات اپیژنتیک و نقص میتوکندریایی با یکدیگر تعامل دارند تا منجر به اختلالات مغزی و عصبی شوند. علاوه بر این، این ابزارها مسیر را برای توسعه درمانهای مولکولی و ژنتیکی هدفمند باز میکنند که میتواند در آینده پیشگیری و اصلاح برخی از اختلالات نورودولوپمنتال را ممکن سازد.
در این بخش، اختلالات مغزی و عصبی مادرزادی با تمرکز بر مکانیسمهای ژنتیکی، مولکولی، سلولی و تعامل با عوامل محیطی بررسی شد. مکانیسمهای کلیدی شامل جهشهای ژنتیکی، نقص در اسپایسینگ ژنی، آسیب DNA، تغییرات اپیژنتیک، اختلالات میتوکندریایی و عوامل محیطی هستند. این بخش زمینه را برای ورود به بررسی اختلالات دستگاه ادراری و کلیوی مادرزادی فراهم میکند که در آن نیز تعامل ژنتیک، اپیژنتیک و محیطی اهمیت بالایی دارد.
اختلالات کلیوی و دستگاه ادراری مادرزادی (CAKUT)
اختلالات کلیوی و دستگاه ادراری مادرزادی (Congenital Anomalies of the Kidney and Urinary Tract - CAKUT) یکی از شایعترین ناهنجاریهای ساختاری در دوران جنینی است و تقریباً ۲۰ تا ۳۰ درصد از ناهنجاریهای مادرزادی کلیه و دستگاه ادراری را تشکیل میدهد. این اختلالات طیف وسیعی از ناهنجاریهای ساختاری از جمله آژنزی کلیوی، هیپوپلازی، دو کلیهای بودن یا تودهای بودن، ناهنجاریهای حالب و مثانه را در بر میگیرند و میتوانند منجر به مشکلات عملکردی مزمن مانند نارسایی کلیوی، عفونتهای مکرر ادراری و فشار خون بالا شوند.
علل ژنتیکی CAKUT بسیار متنوع است و شامل جهشهای تکژنی، ناهنجاریهای کروموزومی و اختلالات چندژنی میشود. ژنهایی که در مسیرهای سیگنالینگ کلیه نقش دارند، مانند PAX2، HNF1B، EYA1، RET و GDNF، در شکلگیری ساختارهای کلیه و مجاری ادراری حیاتی هستند. جهش در این ژنها میتواند منجر به نقص در تمایز اپیتلیال، اختلال در متراکم شدن میزنشینها و مهاجرت سلولی، و در نهایت ایجاد ناهنجاریهای ساختاری شود. به عنوان مثال، جهش در PAX2 با آژنزی یا هیپوپلازی کلیه همراه است و جهش در HNF1B میتواند سبب نقصهای متنوع کلیوی و دیابت نوزادی شود.
مکانیسمهای مولکولی و سلولی CAKUT شامل اختلال در مسیرهای سیگنالینگ GDNF-RET، BMP، Wnt و FGF است که در تکوین کلیه و حالب نقش اساسی دارند. مسیر GDNF-RET مسئول تحریک رشد و تکوین جوانه کلیوی (ureteric bud) است و نقص در این مسیر منجر به نارسایی در اتصال حالب و کلیه میشود. مسیر Wnt نیز نقش مهمی در تمایز اپیتلیال و تکثیر سلولهای کلیه ایفا میکند و اختلال آن میتواند منجر به هیپوپلازی یا نقص ساختاری کلیه شود. BMP و FGF نیز در شکلگیری ساختارهای پیچیده کلیه و مجاری ادراری، از جمله تقسیمبندی لوبها و توسعه حالبها، حیاتی هستند.
نقش اپیژنتیک و تغییرات بیان ژنها در CAKUT اخیراً مورد توجه قرار گرفته است. تغییرات در DNA methylation و هیستونها میتواند بیان ژنهای کلیدی تکوین کلیه و حالب را تغییر دهد و منجر به ناهنجاریهای ساختاری شود. تعامل بین تغییرات اپیژنتیک و جهشهای ژنتیکی میتواند شدت و گستردگی CAKUT را تعیین کند، به طوری که دو جنین با همان جهش ژنتیکی ممکن است با شدت متفاوتی اختلالات کلیوی را نشان دهند.
اختلالات میتوکندری و متابولیسم سلولی نیز در تکوین کلیه نقش دارند. کلیهها به دلیل نیاز بالای انرژی در فرآیندهای فیلتراسیون و تمایز سلولی، حساس به اختلالات متابولیک هستند. نقص در عملکرد میتوکندری، تولید ATP و مسیرهای β-oxidation میتواند باعث اختلال در تمایز نئوپلاسم سلولی و رشد لوبها شود و در نهایت منجر به هیپوپلازی یا آژنزی کلیه گردد.
عوامل محیطی و مادری نیز نقش تعیینکنندهای در CAKUT دارند. قرارگیری در معرض سموم محیطی، داروهای خاص، کمبود ویتامینها (مانند اسید فولیک)، عفونتها و دیابت مادر میتواند مسیرهای ژنتیکی و سلولی کلیه را تحت تأثیر قرار دهد. این عوامل محیطی به ویژه در دورههای بحرانی شکلگیری کلیه، بین هفتههای سوم تا هشتم جنینی، اثرات مخربی دارند.
اختلالات ساختاری شایع CAKUT شامل هیپوپلازی یا آژنزی یک یا دو کلیه، دو کلیهای بودن، حالب دوشاخه، برگشت ادرار (VUR)، سندرمهای پیچیده مانند سندرم Potter و اختلالات عملکردی مثانه است. هر یک از این اختلالات با مسیرهای ژنتیکی و سلولی خاص مرتبط هستند و میتوانند منجر به نارسایی کلیوی و پیامدهای طولانیمدت سلامت شوند.
پیشرفتهای علمی در مدلهای انسانی و حیوانی به بررسی دقیقتر مکانیسمهای CAKUT کمک کرده است. استفاده از ارگانوئیدهای کلیوی و مدلهای موشهای ژنتیکی امکان شناسایی نقش جهشهای ژنتیکی، اختلالات اپیژنتیک و اثرات محیطی بر تکوین کلیه و مجاری ادراری را فراهم کرده است. این مدلها علاوه بر درک مکانیسمها، پتانسیل توسعه درمانهای هدفمند ژنتیکی و مولکولی و پیشگیری از نارساییهای کلیوی را نیز فراهم میکنند.
در این بخش، اختلالات کلیوی و دستگاه ادراری مادرزادی (CAKUT) از منظر ژنتیکی، مولکولی، سلولی و اثرات محیطی بررسی شد. مکانیسمهای کلیدی شامل جهشهای ژنتیکی، اختلال در مسیرهای سیگنالینگ، تغییرات اپیژنتیک، نقص میتوکندریایی و عوامل محیطی مادر بودند. این بخش زمینه را برای ورود به بررسی اختلالات متابولیک و غدد درونریز مادرزادی فراهم میکند، جایی که مسیرهای ژنتیکی و سلولی نقش مهمی در تنظیم متابولیسم و رشد اندامها ایفا میکنند.
اختلالات اندامی و اسکلتی مادرزادی
اختلالات اندامی و اسکلتی مادرزادی شامل ناهنجاریهای شکل و رشد استخوانها، اندامها و مفاصل هستند که میتوانند اثرات قابل توجهی بر رشد، حرکت و عملکرد سیستم اسکلتی-عضلانی کودک داشته باشند. این اختلالات طیفی گسترده دارند و از نقصهای جزئی مانند کوتولگی انگشتان تا ناهنجاریهای شدید و پیچیده مانند اختلالات چندمجموعهای اندام، همیمیکروزومی و عدم تشکیل استخوانهای طولی را شامل میشوند. شیوع این اختلالات در نوزادان حدود ۲ تا ۳ درصد گزارش شده و بسیاری از آنها نیازمند مداخلات جراحی و فیزیوتراپی طولانیمدت هستند.
علل ژنتیکی اختلالات اسکلتی بسیار متنوع است و شامل جهشهای تکژنی، اختلالات چندژنی و کروموزومی میشود. ژنهایی که در مسیرهای سیگنالینگ استخوانی و غضروفی نقش دارند، مانند FGFR1-3، SOX9، COL1A1/COL1A2 و RUNX2، در تکوین اندامها و استخوانها حیاتی هستند. جهش در FGFR3 منجر به آکندروپلازی میشود که نوعی کوتولگی رایج است، در حالی که جهش در COL1A1 و COL1A2 میتواند سبب استئوژنز ایمپرفکتا و شکنندگی استخوانها شود. جهش در SOX9 نیز با ناهنجاریهای غضروفی و اسکلتی متعدد مرتبط است، زیرا این ژن نقش کلیدی در تمایز سلولهای کندروسیت و شکلگیری غضروفهای اولیه دارد.
مکانیسمهای مولکولی و سلولی اختلالات اسکلتی شامل نقص در مسیرهای سیگنالینگ FGF، BMP، Wnt و Hedgehog است که برای تمایز غضروفها، استخوانسازی اندامها و شکلگیری اسکلت محوری ضروری هستند. مسیر BMP در القای تمایز سلولهای غضروفی و استخوانی نقش دارد و اختلال آن میتواند منجر به ناهنجاریهای استخوانی طولی و تغییرات شکل استخوانها شود. مسیر Wnt نیز در مهاجرت و تکثیر سلولهای استئوبلاست و کندروسیت مؤثر است و اختلال آن میتواند موجب نقص در تراکم استخوان و رشد اندامها گردد. مسیر Hedgehog به ویژه در شکلگیری اسکلت مرکزی و اندامها نقش حیاتی دارد و اختلال در آن با ناهنجاریهای پیچیده دست و پا و مهرهها همراه است.
نقش اپیژنتیک و تنظیم بیان ژنها در اختلالات اندامی و اسکلتی اخیراً مورد توجه قرار گرفته است. تغییرات در DNA methylation و هیستونها میتواند بیان ژنهای کلیدی در مسیر استخوانسازی و غضروفسازی را مختل کند و منجر به اختلالات رشد و شکلگیری اندامها شود. همچنین، تغییرات اپیژنتیک میتوانند شدت و گستردگی اختلالات را تحت تأثیر قرار دهند و تعامل با عوامل محیطی مادر نقش تعیینکنندهای در بروز ناهنجاریها دارد.
اختلالات میتوکندری و متابولیسم سلولی نیز در رشد استخوانها و اندامها اهمیت دارند. فرآیند استخوانسازی و غضروفسازی نیازمند انرژی فراوان برای تکثیر و تمایز سلولها است و نقص در عملکرد میتوکندری و مسیرهای β-oxidation اسیدهای چرب میتواند باعث کاهش رشد، اختلال در تراکم استخوان و شکلگیری ناقص اندامها شود.
عوامل محیطی و مادرزادی نقش قابل توجهی در اختلالات اسکلتی دارند. قرارگیری جنین در معرض داروهای خاص، سموم محیطی، کمبود ویتامین D یا کلسیم، دیابت مادر و اختلالات متابولیک میتواند مسیرهای ژنتیکی و مولکولی را تحت تأثیر قرار دهد و باعث شدت و پیچیدگی بیشتر ناهنجاریها شود.
اختلالات شایع اندامی و اسکلتی شامل آکندروپلازی، استئوژنز ایمپرفکتا، نقصهای انگشتان و اندامها، اختلالات طولی اندامها، همیمیکروزومی و اختلالات پیچیده اسکلت محوری هستند. این اختلالات میتوانند همراه با سایر ناهنجاریهای سیستمیک مانند قلبی، کلیوی یا عصبی رخ دهند و نشاندهنده تعامل پیچیده مسیرهای ژنتیکی و سلولی در تکامل اندامها است.
پیشرفتهای علمی با استفاده از مدلهای انسانی و حیوانی، از جمله مدلهای موشی و ارگانوئیدهای غضروفی و استخوانی، امکان بررسی دقیق مکانیسمهای ژنتیکی و مولکولی اختلالات اندامی را فراهم کرده است. این مدلها نقش جهشهای ژنتیکی، تغییرات اپیژنتیک و تأثیر عوامل محیطی را بر تکوین استخوان و اندام نشان میدهند و مسیر را برای توسعه درمانهای مولکولی، ژنتیکی و جراحی هدفمند باز میکنند.
در این بخش، اختلالات اندامی و اسکلتی مادرزادی از منظر ژنتیکی، مولکولی، سلولی و محیطی بررسی شد. مکانیسمهای کلیدی شامل جهشهای ژنتیکی، اختلال مسیرهای سیگنالینگ استخوانی، تغییرات اپیژنتیک، نقص میتوکندریایی و عوامل محیطی مادر بودند. این بخش زمینه را برای ورود به بررسی اختلالات متابولیک و غدد درونریز مادرزادی فراهم میکند که نقش کلیدی در رشد، متابولیسم و عملکرد سیستمهای مختلف بدن ایفا میکنند.
اختلالات گوارشی و متابولیک مادرزادی
اختلالات گوارشی و متابولیک مادرزادی شامل ناهنجاریهایی هستند که در عملکرد دستگاه گوارش، جذب مواد مغذی و متابولیسم انرژی در جنین و نوزادان تأثیر میگذارند. این اختلالات میتوانند از مشکلات نسبی گوارشی مانند سوء جذب جزئی تا بیماریهای شدید متابولیک تهدیدکننده حیات مانند اختلالات اسیدآمینه، اختلالات اکسیداسیون اسیدهای چرب و اختلالات چرخه اوره متغیر باشند. شیوع این اختلالات در جمعیت عمومی حدود ۱ تا ۳ درصد گزارش شده و بسیاری از آنها نیازمند تشخیص زودهنگام و مداخلات درمانی تخصصی هستند.
علل ژنتیکی اختلالات گوارشی و متابولیک بسیار متنوع است و شامل جهشهای تکژنی، اختلالات چندژنی و ناهنجاریهای کروموزومی میشود. ژنهای کلیدی در متابولیسم پروتئینها، چربیها و کربوهیدراتها نقش دارند و جهش در آنها میتواند منجر به کمبود آنزیمها، نقص مسیرهای متابولیک و تجمع محصولات سمی شود. برای مثال، جهش در ژنهای مرتبط با چرخه اوره (OTC، ASS1)، متابولیسم اسیدهای چرب میتوکندریایی (ACAD، CPT1/CPT2) و متابولیسم آمینواسیدها (PAH برای فنیلکتونوری) میتواند اختلالات شدید متابولیک ایجاد کند که بدون مدیریت مناسب به اختلالات عصبی و نارسایی ارگانها منجر میشوند.
مکانیسمهای مولکولی و سلولی اختلالات متابولیک شامل نقص در آنزیمهای کلیدی، مسیرهای انتقال متابولیتها، عملکرد میتوکندری و شبکههای سیگنالینگ مرتبط با متابولیسم سلولی است. نقص در مسیرهای β-oxidation اسیدهای چرب میتوکندریایی باعث کاهش تولید ATP و تجمع اسیدهای چرب میشود که سلولهای حساس مانند نورونها و سلولهای قلبی را تهدید میکند. اختلال در چرخه اوره موجب تجمع آمونیاک در خون میشود که با سمیت عصبی و نارسایی مغزی همراه است. همچنین، تغییرات در مسیرهای AMPK، mTOR و PPAR میتوانند پاسخ سلولی به استرس متابولیک و تنظیم رشد جنین را تحت تأثیر قرار دهند.
نقش اپیژنتیک و تنظیم بیان ژنها در اختلالات متابولیک و گوارشی اهمیت فراوانی دارد. تغییرات در DNA methylation و هیستونها میتواند بیان آنزیمهای متابولیک کلیدی را کاهش داده و باعث نقص در مسیرهای انرژی و متابولیسم سلولی شود. علاوه بر آن، ایمپرینتینگ ژنتیکی در برخی اختلالات متابولیک، مانند سندرم پرادر-ویلی، تأثیر مستقیم بر تعادل انرژی، اشتها و رشد جنین دارد.
اختلالات گوارشی مادرزادی نیز شامل ناهنجاریهایی در معده، روده، کبد و پانکراس هستند که میتوانند عملکرد گوارشی و جذب مواد مغذی را مختل کنند. برای مثال، آتزی یا استنوز پیلوریک، نقص در شکلگیری روده و انسداد رودهای، ناهنجاریهای کبد و مجاری صفراوی و اختلالات پانکراس میتوانند باعث سوء تغذیه و مشکلات رشد شوند. بسیاری از این اختلالات با اختلالات متابولیک ترکیب میشوند و اثرات متقابل ژنتیکی و محیطی دارند.
عوامل محیطی و مادری نقش تعیینکنندهای در اختلالات متابولیک و گوارشی دارند. تغذیه ناکافی مادر، دیابت بارداری، کمبود ویتامینها و مواد معدنی، داروها و سموم محیطی میتوانند مسیرهای ژنتیکی و متابولیک جنین را تحت تأثیر قرار دهند. تعامل بین ژنتیک و محیط باعث میشود شدت و نوع اختلالات متابولیک متغیر باشد و پیشگیری و درمان نیازمند یک رویکرد جامع باشد.
پیشرفتهای علمی در مدلهای حیوانی و ارگانوئیدهای انسانی امکان بررسی دقیق مکانیسمهای متابولیک و گوارشی را فراهم کرده است. استفاده از مدلهای میکروارگانوئید روده و کبد و مدلهای ژنتیکی موش، نشان داده است که چگونه جهشهای ژنتیکی، نقصهای آنزیمی و اختلالات اپیژنتیک با هم تعامل میکنند تا اختلالات متابولیک و گوارشی شکل گیرد. این مدلها علاوه بر فهم بهتر مکانیسمها، مسیر را برای توسعه درمانهای ژنتیکی و دارویی هدفمند باز کردهاند.
در این بخش، اختلالات گوارشی و متابولیک مادرزادی با تمرکز بر مکانیسمهای ژنتیکی، مولکولی، سلولی و اثرات محیطی بررسی شد. مکانیسمهای کلیدی شامل جهشهای ژنتیکی، نقص مسیرهای آنزیمی، اختلالات میتوکندریایی، تغییرات اپیژنتیک و عوامل محیطی مادر بودند. این بخش زمینه را برای ورود به بخش پایانی مقاله یعنی جمعبندی، چشماندازهای آینده و رویکردهای پیشگیرانه و درمانی فراهم میکند.
عوامل محیطی و تأثیرات مادری در اختلالات مادرزادی
اختلالات مادرزادی تنها نتیجه جهشهای ژنتیکی نیستند؛ تعامل پیچیده بین ژنها و عوامل محیطی و مادری نقش تعیینکنندهای در شکلگیری این ناهنجاریها ایفا میکند. محیط درون رحمی، تغذیه مادر، سلامت متابولیک و مواجهه با عوامل زیستی و شیمیایی میتواند مسیرهای ژنتیکی و مولکولی جنین را تحت تأثیر قرار دهد و شدت و گستردگی اختلالات مادرزادی را تغییر دهد.
تغذیه مادر یکی از مهمترین عوامل محیطی است که بر تکامل جنین تأثیر میگذارد. کمبود ویتامینها و مواد معدنی حیاتی مانند اسید فولیک، ویتامین D، کلسیم و ید میتواند منجر به اختلالات عصبی، قلبی و اسکلتی شود. به عنوان مثال، کمبود اسید فولیک با افزایش خطر نقصهای لوله عصبی مانند اسپینا بیفیدا و آنانسفالی همراه است. همچنین، سوء تغذیه مادر میتواند باعث اختلال در مسیرهای متابولیک و رشد سلولی جنین شود و استعداد ژنتیکی را به ناهنجاریهای بالینی تبدیل کند.
بیماریهای مادری مانند دیابت، فشار خون بالا و بیماریهای خودایمنی نقش مهمی در اختلالات مادرزادی دارند. دیابت مادر میتواند سطح گلوکز جنین را افزایش دهد و باعث سایر ناهنجاریها مانند قلبی و اسکلتی شود. بیماریهای خودایمنی نیز با تولید آنتیبادیها یا فعالسازی مسیرهای التهابی میتوانند روند تکامل اندامها و بافتها را مختل کنند. عفونتهای مادرزادی نیز، از جمله عفونت با ویروسهای روبلا، سیتومگالوویروس یا توکسوپلاسما، میتوانند آسیب مستقیم به سلولهای جنینی وارد کنند و باعث اختلالات قلبی، عصبی یا شنوایی شوند.
قرارگیری در معرض سموم و داروها یکی دیگر از عوامل محیطی مؤثر است. داروهای خاص، الکل، دخانیات و مواد شیمیایی صنعتی میتوانند مسیرهای ژنتیکی و سیگنالینگ سلولی جنین را تغییر دهند. برای مثال، مصرف الکل در دوران بارداری منجر به سندرم الکل جنینی میشود که طیف گستردهای از اختلالات عصبی، رفتاری و صورتشناسی را در بر میگیرد. همچنین، مواجهه با داروهای تراتوژن مانند تالیدومید یا داروهای ضد تشنج میتواند باعث نقص اندامی یا اسکلتی شود.
استرس و سلامت روان مادر نیز میتواند اثرات قابل توجهی بر جنین داشته باشد. استرس مزمن، اضطراب و افسردگی مادر با تغییر سطح هورمونها، افزایش کورتیزول و فعالسازی مسیرهای التهابی، میتواند رشد مغزی و قلبی-عروقی جنین را مختل کند. تحقیقات نشان داده است که این عوامل محیطی میتوانند تغییرات اپیژنتیک پایدار ایجاد کنند که تا بزرگسالی اثرات متابولیک و عصبی داشته باشند.
آلودگی محیطی و مواجهه با فلزات سنگین نیز به طور مستقیم یا غیرمستقیم باعث اختلالات مادرزادی میشوند. آلودگی هوا، سرب، جیوه و سایر فلزات سنگین میتوانند باعث آسیب DNA، اختلال در مسیرهای سیگنالینگ و نقص در تکامل اندامها شوند. اثرات این مواجههها ممکن است با ژنوتیپ جنین تعامل کنند و خطر ناهنجاریها را افزایش دهند.
تعامل بین ژنتیک و محیط یک اصل کلیدی در شکلگیری اختلالات مادرزادی است. همان جهش ژنتیکی ممکن است در حضور محیط مناسب کمترین اثر را داشته باشد، اما در شرایط محیطی نامطلوب شدت اختلال را افزایش دهد. این تعاملات ژن-محیط شامل تغییرات اپیژنتیک، تعدیل بیان ژنها و فعالسازی مسیرهای التهابی و متابولیک است که نشان میدهد کنترل محیطی و مراقبت مادری میتواند تأثیرات پیشگیرانه قوی داشته باشد.
اهمیت پیشگیری و مدیریت عوامل محیطی بسیار بالاست. ارائه مشاوره قبل از بارداری، اصلاح تغذیه و سطح ویتامینها، کنترل بیماریهای مزمن مادر، پرهیز از داروهای تراتوژن و مواجهه با سموم، و مدیریت استرس و سلامت روان مادر از جمله اقدامات کلیدی هستند. این اقدامات میتوانند نقش مهمی در کاهش شیوع اختلالات مادرزادی و بهبود سلامت جنین و نوزاد داشته باشند.
در این بخش، نقش عوامل محیطی و تأثیرات مادری بر اختلالات مادرزادی بررسی شد. این عوامل شامل تغذیه مادر، بیماریهای مزمن، عفونتها، مواجهه با سموم و داروها، استرس و سلامت روان، و آلودگی محیطی هستند و از طریق مکانیسمهای ژنتیکی، مولکولی و اپیژنتیک بر جنین اثر میگذارند. این بخش زمینه را برای جمعبندی کامل مقاله و ارائه چشماندازهای آینده، راهکارهای پیشگیری و درمان فراهم میکند.
روشهای تشخیص و پیشگیری اختلالات مادرزادی
تشخیص اختلالات مادرزادی از اهمیت حیاتی برخوردار است، زیرا تشخیص زودهنگام نه تنها به مدیریت درمانی مؤثر کمک میکند بلکه امکان پیشگیری از پیشرفت ناهنجاریها و کاهش پیامدهای طولانیمدت را فراهم میآورد. ابزارها و روشهای تشخیصی مدرن شامل ارزیابیهای ژنتیکی، تصویربرداری پیشرفته، آزمایشهای بیوشیمیایی و ارزیابیهای پیشرفته اپیژنتیک هستند که میتوانند انواع اختلالات مادرزادی را در مراحل مختلف بارداری و حتی قبل از بارداری شناسایی کنند.
تشخیص ژنتیکی پیش از تولد از طریق روشهایی مانند آمنیوسنتز، نمونهبرداری از پرزهای جفتی (CVS) و بررسی DNA آزاد جنینی در خون مادر (cfDNA) انجام میشود. این روشها امکان شناسایی اختلالات کروموزومی، جهشهای تکژنی و تغییرات ژنتیکی پیچیده را فراهم میکنند. برای مثال، بررسی DNA آزاد جنینی میتواند نقصهای کروموزومی رایج مانند سندرم داون، تریزومی ۱۸ و تریزومی ۱۳ را با دقت بالا شناسایی کند، در حالی که آمنیوسنتز و CVS امکان تحلیل ژنهای خاص و تشخیص بیماریهای تکژنی مانند فنیلکتونوری یا آکندروپلازی را میدهد.
تشخیص پیش از تولد با استفاده از تصویربرداری نیز نقش کلیدی دارد. سونوگرافی پیشرفته، امآرآی جنینی و تصویربرداری سهبعدی و چهاربعدی امکان مشاهده دقیق ساختارهای اندامی، قلبی، مغزی و اسکلتی جنین را فراهم میکنند. این روشها میتوانند ناهنجاریهایی مانند اختلالات قلبی مادرزادی، نقصهای لوله عصبی، کوتولگی، ناهنجاریهای کلیوی و گوارشی را در سهماهه دوم بارداری تشخیص دهند و به تیم پزشکی و خانواده اطلاعات لازم برای تصمیمگیری ارائه کنند.
آزمایشهای بیوشیمیایی و متابولیک نیز برای تشخیص اختلالات متابولیک و گوارشی ضروری هستند. بررسی سطح آمینواسیدها، اسیدهای آلی، کتونها و آنزیمهای کلیدی در خون و ادرار جنین یا نوزاد میتواند اختلالات متابولیک مادرزادی مانند اختلالات چرخه اوره، اختلالات اکسیداسیون اسیدهای چرب و فنیلکتونوری را شناسایی کند. این روشها امکان شروع درمانهای پیشگیرانه مانند تغذیه تخصصی، داروهای مکمل آنزیمی و مدیریت رژیم غذایی را فراهم میکنند و از بروز آسیبهای عصبی و ارگانیک جلوگیری میکنند.
روشهای پیشگیری اختلالات مادرزادی شامل استراتژیهای قبل از بارداری و حین بارداری است. مشاوره ژنتیک قبل از بارداری، بررسی سابقه خانوادگی و انجام تستهای ژنتیکی پیش از لقاح میتواند زوجها را در انتخاب مسیرهای پیشگیرانه یاری دهد. همچنین، اصلاح تغذیه، تامین ویتامینها و مواد معدنی ضروری، کنترل بیماریهای مزمن مادر، اجتناب از داروهای تراتوژن و مدیریت استرس و سلامت روان از عوامل مؤثر در کاهش ریسک اختلالات مادرزادی هستند.
پیشگیری دارویی و مکملها نیز نقش مهمی در کاهش اختلالات مادرزادی دارند. مصرف اسید فولیک پیش از لقاح و در سهماهه اول بارداری به طور قابل توجهی خطر نقص لوله عصبی را کاهش میدهد. همچنین، مدیریت دقیق سطح گلوکز و متابولیتها در مادران دیابتی میتواند خطر اختلالات قلبی، متابولیک و عصبی را کاهش دهد. در برخی اختلالات ژنتیکی شناختهشده، استفاده از درمانهای هدفمند قبل از بارداری یا در اوایل حاملگی ممکن است پیشرفت بیماری را محدود کند.
تشخیص و پیشگیری ترکیبی و شخصیسازی شده بر اساس پروفایل ژنتیکی، اپیژنتیک و محیطی مادر و جنین بهترین رویکرد برای مدیریت ریسک اختلالات مادرزادی است. با پیشرفت تکنولوژیهای توالییابی نسل جدید، ارگانوئیدهای انسانی و مدلهای حیوانی، امکان شناسایی مسیرهای مولکولی آسیبپذیر و طراحی مداخلات هدفمند فراهم شده است. این رویکردها نه تنها تشخیص دقیق و سریع را امکانپذیر میکنند، بلکه مسیر را برای درمانهای پیشگیرانه، دارویی و جراحی هموار میسازند.
اهمیت آموزش و آگاهی والدین نیز نمیتواند نادیده گرفته شود. اطلاعرسانی درباره عوامل خطر، تغذیه مناسب، اجتناب از مواد مضر و اهمیت پیگیری مراقبتهای قبل و حین بارداری میتواند به کاهش شیوع اختلالات مادرزادی و بهبود نتایج سلامت نوزاد کمک کند. در نهایت، ترکیب روشهای ژنتیکی، مولکولی، تصویربرداری و پیشگیری محیطی، یک استراتژی جامع و مؤثر برای کاهش اختلالات مادرزادی ارائه میدهد.
پیشرفتهای درمانی و مداخلات نوین در اختلالات مادرزادی
درمان اختلالات مادرزادی از چالشهای پیچیده پزشکی محسوب میشود زیرا این اختلالات معمولاً چندسیستمی بوده و مکانیسمهای مولکولی و ژنتیکی متنوعی دارند. در گذشته، مدیریت این اختلالات عمدتاً حمایتی و سمپتوممحور بود، اما پیشرفتهای اخیر در ژنتیک، بیولوژی سلولی و مهندسی بافت افقهای جدیدی برای درمان هدفمند و پیشگیرانه ایجاد کرده است.
مداخلات جراحی پیش از تولد و پس از تولد یکی از حوزههای اصلی درمان اختلالات مادرزادی هستند. جراحیهای پیش از تولد، مانند اصلاح نقص لوله عصبی یا درمان برخی ناهنجاریهای قلبی، امکان بهبود نتایج نوزاد را فراهم میکنند. پس از تولد نیز، جراحیهای تخصصی قلب، کلیه، روده و اندامهای اسکلتی میتوانند عملکرد طبیعی را بازگردانند و زندگی کودک را بهبود دهند. پیشرفتهای تکنولوژی تصویربرداری و میکروسکوپهای جراحی امکان انجام مداخلات دقیق با حداقل آسیب به بافتهای اطراف را فراهم کرده است.
درمانهای دارویی هدفمند به سرعت در حال توسعه هستند و شامل استفاده از آنزیمهای جایگزین، داروهای اصلاحکننده مسیرهای متابولیک و مولکولی، و داروهای تنظیمکننده ژن میشوند. برای مثال، در اختلالات متابولیک مانند فنیلکتونوری، رژیم غذایی تخصصی همراه با مکملهای آنزیمی و داروهایی که مسیرهای جایگزین متابولیک را فعال میکنند، توانستهاند نتایج طولانیمدت مطلوب ایجاد کنند. همچنین، استفاده از داروهای هورمونی و عوامل رشد در اختلالات اندامی و هورمونی مادرزادی، باعث افزایش طول عمر و بهبود کیفیت زندگی بیماران شده است.
درمانهای ژنتیکی و ویرایش ژن یکی از بزرگترین پیشرفتهای دهه اخیر هستند. تکنولوژیهای CRISPR-Cas9، TALEN و base editing امکان اصلاح جهشهای تکژنی در سلولهای جنینی یا نمونههای پیش از تولد را فراهم کردهاند. این رویکردها میتوانند نقصهای ژنتیکی تهدیدکننده زندگی را پیش از بروز کامل بیماری اصلاح کنند و مسیر را برای درمانهای پیشگیرانه واقعی باز کنند. علاوه بر این، ژندرمانی سلولی و استفاده از ویروسهای ناقل بیضرر امکان اصلاح دائمی مسیرهای ژنتیکی را فراهم میآورد.
استفاده از سلولهای بنیادی و ارگانوئیدها به عنوان ابزار درمانی و تحقیقاتی پیشرفت چشمگیری داشته است. سلولهای بنیادی جنینی یا القایی (iPSCs) میتوانند برای بازسازی بافتهای آسیبدیده یا تولید اندامهای مصنوعی استفاده شوند. ارگانوئیدهای روده، کبد و مغز، علاوه بر مدلسازی بیماری، امکان آزمایش داروهای جدید و بررسی مکانیسمهای مولکولی اختلالات مادرزادی را فراهم میکنند. این فناوریها به خصوص برای بیماریهای چندسیستمی و پیچیده که درمان سنتی محدود است، بسیار ارزشمند هستند.
مداخلات تغذیهای و متابولیک پیشرفته نیز جزو راهکارهای نوین محسوب میشوند. برای اختلالات متابولیک مادرزادی، استفاده از رژیمهای تغذیهای دقیق و مکملهای خاص، همراه با پایش مداوم بیوشیمیایی، میتواند سمیت متابولیتها را کاهش داده و رشد و تکامل نورولوژیک جنین و نوزاد را بهبود بخشد. ترکیب این رویکرد با داروهای هدفمند مسیرهای متابولیک، به یک درمان چندبعدی تبدیل شده است.
فناوریهای پیشرفته تشخیصی و پایش طولانیمدت نیز بخشی از مداخلات نوین هستند. پایش ژنومی، اپیژنتیکی و متابولیکی مادامالعمر بیماران، امکان پیشبینی بحرانهای متابولیک، اختلالات قلبی یا عصبی و سایر مشکلات را فراهم میکند و درمانهای پیشگیرانه و مداخلات سریع را ممکن میسازد. همچنین، هوش مصنوعی و الگوریتمهای پیشبینی خطر در حال ورود به این حوزه هستند و به شخصیسازی درمان کمک میکنند.
چالشها و محدودیتهای فعلی شامل دسترسی محدود به تکنولوژیهای ویرایش ژن، هزینه بالای درمانهای پیشرفته، پیچیدگیهای اخلاقی و نظارتی و نیاز به مطالعات طولانیمدت درباره ایمنی و کارایی هستند. با این حال، ترکیب چندین رویکرد درمانی – از جراحی و دارو درمانی گرفته تا ژندرمانی و سلولهای بنیادی – افق امیدوارکنندهای برای کاهش اثرات اختلالات مادرزادی ایجاد کرده است.
در این بخش، پیشرفتهای درمانی و مداخلات نوین از جنبههای جراحی، دارویی، ژنتیکی، سلولی و تغذیهای بررسی شد. تاکید شد که ترکیب روشهای سنتی و مدرن، شخصیسازی درمان و استفاده از فناوریهای نوین مسیر را برای بهبود کیفیت زندگی بیماران و کاهش عوارض اختلالات مادرزادی هموار کرده است. این بخش زمینه را برای ورود به بخش پایانی مقاله یعنی جمعبندی و چشمانداز آینده فراهم میکند.
چشمانداز آینده و تحقیقات در حال توسعه در اختلالات مادرزادی
آینده تحقیقات و درمان اختلالات مادرزادی بر پایه ترکیبی از ژنتیک، سلولهای بنیادی، بیولوژی مولکولی و فناوریهای پیشرفته محاسباتی شکل میگیرد. پیشرفتهای علمی در دهههای اخیر نه تنها درک ما از مکانیسمهای ژنتیکی و مولکولی را گسترش داده است، بلکه امکان طراحی مداخلات هدفمند و پیشگیرانه را نیز فراهم کرده است.
یکی از زمینههای امیدوارکننده، توسعه درمانهای ژنتیکی پیشرفته است. فناوریهای ویرایش ژن مانند CRISPR-Cas9، base editing و prime editing امکان اصلاح جهشهای مضر را در سلولهای جنینی و حتی پیش از لقاح فراهم میکنند. این فناوریها نه تنها درمان بیماریهای تکژنی را امکانپذیر کردهاند، بلکه چشمانداز درمان اختلالات چندسیستمی و پیچیده که تحت تأثیر چندین ژن و مسیر اپیژنتیک قرار دارند را نیز ایجاد کردهاند. تحقیقات در حال توسعه نشان میدهد که ترکیب ویرایش ژن با مدلهای ارگانوئیدی انسانی میتواند اثرات جانبی و ایمنی این مداخلات را پیشبینی و بهینهسازی کند.
بیولوژی سلولی و استفاده از سلولهای بنیادی نیز در حال تغییر چشمانداز درمانی است. استفاده از سلولهای بنیادی القایی (iPSCs) و سلولهای بنیادی جنینی برای تولید بافتهای آسیبدیده، مدلسازی اختلالات مادرزادی و آزمایش داروهای جدید به صورت شخصیسازی شده، امکان پیشرفت درمانهای دقیق و مؤثر را فراهم کرده است. ارگانوئیدهای پیچیده میتوانند مسیرهای سیگنالینگ سلولی و تعامل بین سلولها را شبیهسازی کنند و بهترین داروها و مداخلات را قبل از استفاده بالینی شناسایی کنند.
تحقیقات اپیژنتیک و نقش محیط در بیان ژنها یکی دیگر از حوزههای در حال توسعه است. مطالعات اخیر نشان دادهاند که تغییرات اپیژنتیک مانند متیلاسیون DNA، اصلاح هیستونها و RNA غیرکدکننده میتوانند اثرات عوامل محیطی را بر جنین تثبیت کنند. این یافتهها امکان طراحی مداخلات محیطی و دارویی هدفمند برای پیشگیری از اختلالات مادرزادی را فراهم میکنند. به عنوان مثال، مداخلات تغذیهای یا دارویی قبل از لقاح یا در سهماهه اول بارداری میتواند مسیرهای اپیژنتیک آسیبپذیر را تعدیل کند و خطر ناهنجاریها را کاهش دهد.
هوش مصنوعی و یادگیری ماشینی نیز در حال ورود به این حوزه هستند و میتوانند با تحلیل دادههای ژنومی، اپیژنتیکی و بالینی، پیشبینی ریسک اختلالات مادرزادی و شخصیسازی مراقبتهای پیشگیرانه را ممکن سازند. این فناوریها میتوانند ترکیب پیچیدهای از عوامل ژنتیکی و محیطی را در قالب الگوریتمهای قابل استفاده برای پزشکان و مشاوران ژنتیک ارائه دهند.
تحقیقات بینرشتهای و استفاده از ارگانوئیدها و مدلهای حیوانی نیز آینده روشنی را نوید میدهد. مدلهای حیوانی پیشرفته مانند موشهای ژنمهندسیشده، همراه با ارگانوئیدهای انسانی، امکان بررسی مکانیسمهای سلولی، مسیرهای سیگنالینگ و پاسخ به داروها را به صورت دقیق فراهم میکنند. این ترکیب، شکاف بین تحقیقات پایه و کاربردهای بالینی را پر میکند و زمینه را برای توسعه درمانهای ایمن و مؤثر فراهم میسازد.
چشمانداز پیشگیری و سلامت عمومی نیز همزمان با تحقیقات علمی در حال تحول است. استفاده از مشاوره ژنتیک پیش از بارداری، پایش محیطی، آموزش سلامت مادر و ارزیابی جامع عوامل ژن-محیط میتواند به کاهش شیوع اختلالات مادرزادی کمک کند. ترکیب این رویکردها با تکنولوژیهای نوین درمانی، یک استراتژی جامع و پیشگیرانه ایجاد میکند که نه تنها از بروز اختلالات جلوگیری میکند، بلکه کیفیت زندگی بیماران را بهبود میبخشد.
چالشهای پیشروی تحقیقات آینده شامل مسائل اخلاقی و قانونی مرتبط با ویرایش ژن، ایمنی درمانهای نوین، هزینههای بالا و نیاز به مطالعات طولانیمدت برای اثبات اثرات بالینی است. با این حال، پیشرفت مداوم فناوری، همگرایی رشتههای پزشکی و بیولوژی، و تمرکز بر شخصیسازی درمان و پیشگیری، آیندهای روشن و امیدوارکننده برای کاهش اثرات اختلالات مادرزادی نوید میدهد.
جمعبندی: تحقیقات در حال توسعه و چشمانداز آینده نشان میدهد که ترکیبی از درمانهای ژنتیکی، سلولهای بنیادی، فناوریهای پیشرفته تصویربرداری، مداخلات اپیژنتیک و هوش مصنوعی میتواند مسیر پیشگیری و درمان اختلالات مادرزادی را دگرگون کند. این پیشرفتها نه تنها توانایی تشخیص زودهنگام و درمان هدفمند را فراهم میکنند، بلکه امکان ایجاد استراتژیهای پیشگیرانه جامع و شخصیسازی شده را برای هر فرد و خانواده ایجاد مینمایند.
نتیجهگیری
اختلالات مادرزادی به عنوان یکی از مهمترین چالشهای سلامت عمومی و پزشکی پیش از تولد، شامل طیف گستردهای از ناهنجاریها و بیماریها میشوند که میتوانند قلب، مغز و دستگاه عصبی، کلیه و دستگاه ادراری، اندامها و سیستم اسکلتی، و همچنین متابولیسم و گوارش جنین و نوزاد را تحت تأثیر قرار دهند. بررسی مکانیسمهای ایجاد این اختلالات نشان میدهد که ترکیبی از عوامل ژنتیکی، اپیژنتیک و محیطی مسئول بروز این بیماریها هستند و تعامل پیچیده بین این عوامل نقش تعیینکنندهای در شدت و نوع اختلال دارد.
عوامل ژنتیکی شامل اختلالات کروموزومی، جهشهای تکژنی، و تغییرات پیچیده ژنومی هستند که میتوانند به طور مستقیم یا غیرمستقیم مسیرهای توسعه جنین را دچار اختلال کنند. تحقیقات اخیر نشان دادهاند که اختلالات در RNA، پروتئینهای متصل به RNA و فرآیندهای اسپایسیگینگ میتوانند باعث بروز بیماریهای عصبی و متابولیک شوند، در حالی که تغییرات اپیژنتیک مانند متیلاسیون DNA و اصلاح هیستونها نقش مهمی در مدولاسیون بیان ژن و پاسخ به محیط دارند.
عوامل محیطی و تأثیرات مادری نیز به شدت در ایجاد اختلالات مادرزادی موثر هستند. مواردی مانند سوءتغذیه، مصرف داروهای تراتوژن، عفونتهای مادری، بیماریهای مزمن و حتی شرایط متابولیک مادر میتوانند مسیرهای طبیعی رشد جنین را مختل کنند. مطالعات جدید نشان میدهند که کنترل محیطی، تغذیه مناسب، مدیریت بیماریهای مزمن و پایش دقیق مادر میتواند به کاهش قابل توجهی در بروز ناهنجاریها منجر شود.
تشخیص و پیشگیری از اختلالات مادرزادی با استفاده از ترکیبی از روشهای ژنتیکی، تصویربرداری پیشرفته، ارزیابیهای متابولیک و مشاوره ژنتیک امکانپذیر است. آزمایشهای ژنومی پیش از تولد، نمونهبرداری پرز جفتی، آمنیوسنتز و بررسی DNA آزاد جنینی امکان شناسایی اختلالات کروموزومی و تکژنی را با دقت بالا فراهم میکنند. همچنین، سونوگرافی سهبعدی و چهاربعدی، MRI جنینی و پایش دقیق عملکرد اندامها و سیستمهای بدن ابزارهای کلیدی در ارزیابی سلامت جنین محسوب میشوند.
پیشرفتهای درمانی و مداخلات نوین نشاندهنده افقهای امیدبخش در مدیریت اختلالات مادرزادی هستند. جراحیهای پیش از تولد و پس از تولد، درمانهای دارویی هدفمند، ژندرمانی و ویرایش ژن، سلولهای بنیادی و ارگانوئیدها همگی به ایجاد رویکردهای شخصیسازی شده و مؤثر برای بیماران کمک کردهاند. همچنین، ترکیب مداخلات محیطی، تغذیهای و متابولیک با درمانهای نوین، به شکل یک استراتژی چندبعدی، توانسته است نتایج بالینی را بهبود بخشد و پیامدهای طولانیمدت را کاهش دهد.
چشمانداز آینده تحقیقات در این حوزه روشن و امیدوارکننده است. توسعه فناوریهای ویرایش ژن، مدلهای ارگانوئیدی انسانی، هوش مصنوعی در پیشبینی ریسک، و پایش طولانیمدت بیماران مسیر را برای پیشگیری و درمان هدفمند و دقیق هموار میکند. تحقیقات بینرشتهای و شخصیسازی درمان، به همراه تمرکز بر عوامل ژن-محیط و اپیژنتیک، میتواند سطح کیفیت زندگی بیماران را به طرز چشمگیری افزایش دهد و از بروز اختلالات مادرزادی در نسلهای آینده جلوگیری کند.
در نهایت، ترکیب پیشگیری، تشخیص زودهنگام و مداخلات نوین به همراه تحقیقات پیشرفته علمی، یک چارچوب جامع برای مدیریت اختلالات مادرزادی ایجاد کرده است. این چارچوب میتواند هم به پزشکان و متخصصان برای ارائه مراقبتهای مؤثر کمک کند و هم به خانوادهها امکان تصمیمگیری آگاهانه و کاهش خطرات را بدهد. اهمیت آموزش، آگاهی والدین و دسترسی به خدمات پیشرفته پزشکی در کنار فناوریهای نوین، کلید کاهش بار اجتماعی و اقتصادی اختلالات مادرزادی و بهبود سلامت نسلهای آینده است.