مراحل رشد جنین انسان
مقدمه
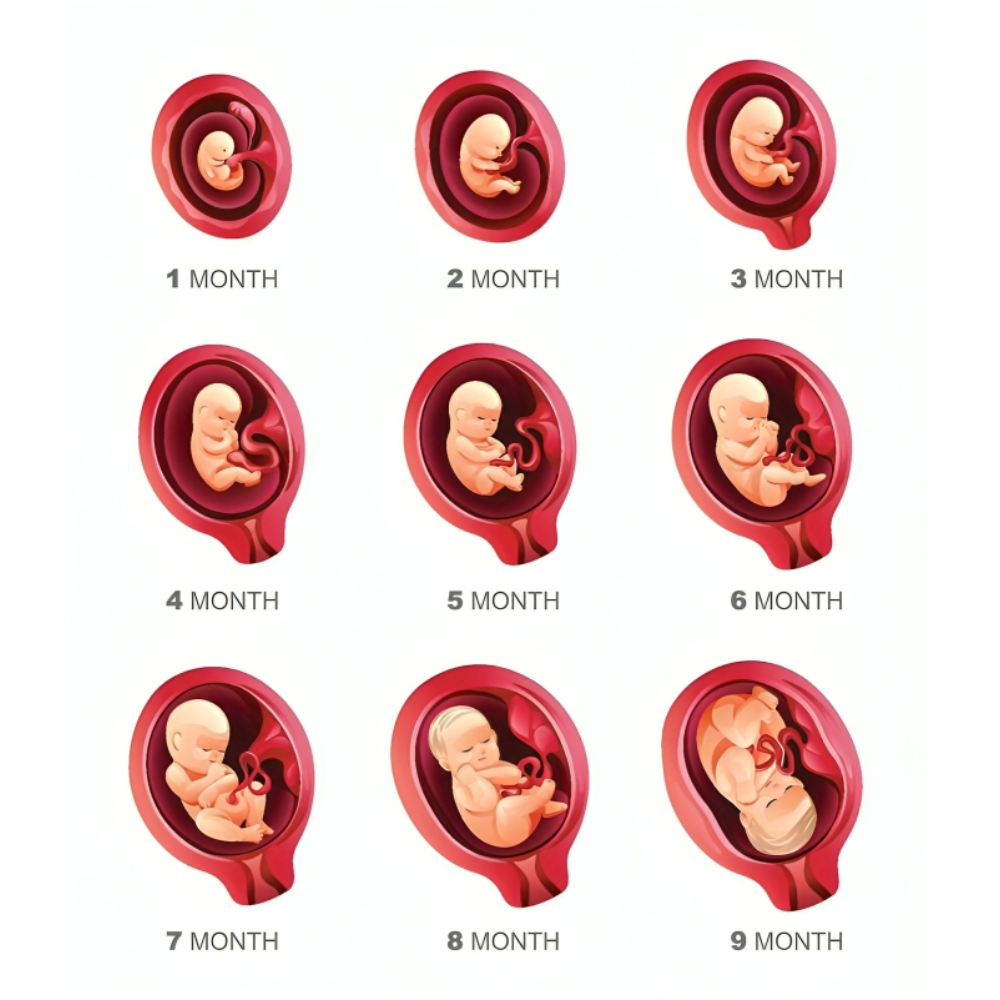
رشد جنین انسان یکی از پیچیدهترین و شگفتانگیزترین فرآیندهای زیستشناسی است که از لحظه لقاح تا تولد ادامه دارد و شامل مجموعهای از تغییرات سلولی، مولکولی، ژنتیکی و محیطی میشود. این فرآیند نه تنها برای درک اصول بنیادی زیستشناسی اهمیت دارد، بلکه کاربردهای بالینی گستردهای در حوزه باروری، تشخیص قبل از تولد، مراقبتهای پیش از زایمان و پژوهشهای سلولهای بنیادی دارد. مطالعات دقیق روی جنین انسان توانسته است بینشهای ارزشمندی درباره تعیین سرنوشت سلولی، سیگنالینگ مولکولی، اپیژنتیک و تکوین اندامها ارائه دهد که میتواند مسیرهای نوینی برای درمان ناباروری و پیشگیری از بیماریهای ژنتیکی ایجاد کند.
یکی از ویژگیهای منحصر به فرد رشد جنین انسان، پیچیدگی زمانبندی و هماهنگی دقیق مراحل سلولی و بافتی است. از تقسیم سلولی اولیه تا تشکیل بلاستوسیت، از لانهگزینی در اندومتر تا گاسترولاسیون و شکلگیری سه لایه جنینی، همه این مراحل نیازمند تعامل دقیق بین ژنها، فاکتورهای محیطی و سیگنالهای مولکولی هستند. هر گونه اختلال در این فرآیندها میتواند منجر به ناباروری، سقط خودبهخودی یا مشکلات رشد و تکامل جنین شود.
با پیشرفت تکنولوژی، ابزارهای مدرن مانند زمانسنجهای تصویربرداری (time-lapse imaging)، الگوریتمهای هوش مصنوعی، فناوریهای «-omics» و مدلهای سلولهای بنیادی، امکان بررسی و پیشبینی کیفیت جنین در مراحل اولیه را فراهم کردهاند. این ابزارها به متخصصان امکان میدهند تا انتخاب جنین برای روشهای کمک باروری مانند IVF را بهینه کنند و درک بهتری از فاکتورهای حیاتی موفقیت رشد جنین به دست آورند.
همچنین، مطالعات اپیژنتیک و ژنتیکی نشان دادهاند که علاوه بر عوامل ژنتیکی مادرزادی، عوامل محیطی و سبک زندگی والدین میتوانند تأثیرات بلندمدتی بر سلامت و عملکرد جنین داشته باشند. تغییرات اپیژنتیکی مانند متیلاسیون DNA، بیان میکروRNA و فعالسازی یا غیرفعالسازی ژنها نقش مهمی در تعیین سرنوشت سلولها و تکوین بافتها دارند و میتوانند اثرات مادامالعمر بر سلامت نوزاد داشته باشند.
هدف این مقاله، ارائه یک مرور جامع و دقیق از تمام مراحل رشد جنین انسان است، به گونهای که پاسخگوی تمامی سوالات تخصصی پزشکان، محققان و دانشجویان باشد. مقاله سعی دارد تا علاوه بر شرح علمی، به نکات بالینی و کاربردی نیز پرداخته و نقش عوامل ژنتیکی، محیطی و تکنولوژیکی در موفقیت فرآیندهای رشد جنین را روشن کند.
با مطالعه این مقاله، خواننده میتواند یک درک کامل از مسیرهای سلولی و مولکولی رشد جنین انسان، نقاط بحرانی در تکوین اندامها، اثرات محیطی و فاکتورهای پیشبینیکننده موفقیت باروری به دست آورد و اطلاعاتی جامع برای استفاده در بالین و تحقیق کسب کند. در ادامه، مقاله به صورت مرحله به مرحله و با جزئیات کامل تمامی فرآیندهای حیاتی رشد جنین را بررسی خواهد کرد.
فرایند باروری و مراحل ابتدایی قبل از جنینی
فرایند باروری انسان نقطه آغاز زندگی است و مجموعهای از رویدادهای دقیق سلولی و مولکولی را شامل میشود که پایه و اساس تکوین جنین را شکل میدهند. این مسیر از بلوغ اووسیت و تخمکگذاری شروع میشود و با لقاح و تقسیمهای سلولی اولیه ادامه مییابد. هر مرحله از این مسیر نقش حیاتی در تضمین سلامت و پتانسیل رشد جنین دارد و اختلال در هر کدام میتواند پیامدهای بلندمدتی ایجاد کند.
بلوغ اووسیت و تخمکگذاری
یکی از نخستین مراحل باروری، بلوغ اووسیت در تخمدان است. اووسیتها در دوران جنینی مادر شکل میگیرند و تا زمان بلوغ در فازهای توقف میمانند. با رسیدن به بلوغ جنسی، تحت تأثیر هورمونهای FSH و LH، برخی از اووسیتها رشد خود را از سر میگیرند و در نهایت یک اووسیت بالغ برای تخمکگذاری آماده میشود. بلوغ اووسیت شامل تغییرات هستهای و سیتوپلاسمی است که توانایی پذیرش اسپرم و شروع تقسیمهای جنینی را ممکن میسازد. کیفیت اووسیت یکی از مهمترین عوامل تعیینکننده پتانسیل جنین است و مطالعات نشان دادهاند که اووسیتهای با کیفیت بالا احتمال موفقیت لقاح و رشد بلاستوسیت را به طور قابل توجهی افزایش میدهند.
لقاح و تعامل اسپرم و تخمک
لقاح زمانی رخ میدهد که اسپرم و اووسیت بالغ در محیط مناسب، معمولاً در لوله فالوپ، با یکدیگر ترکیب شوند. این فرآیند شامل چندین مرحله مهم است: تماس اسپرم با زونا پلوسیدا، ورود به داخل اووسیت، و ادغام هستهها. در این مرحله، هر دو هسته والدین شامل ژنهای مادری و پدری ترکیب میشوند و زیگوت دوپلوییدی شکل میگیرد. این ترکیب ژنتیکی، بنیاد ویژگیهای جنین و تعیین سرنوشت سلولی آینده را فراهم میکند. همچنین، وقایع اولیه لقاح شامل فعالسازی تخمک، تغییرات سیتوپلاسمی و آغاز سنتز پروتئینها است که برای ادامه تقسیمهای سلولی حیاتی میباشند.
تقسیمهای سلولی اولیه و انتقال ژنومی
پس از لقاح، زیگوت وارد مرحله تقسیم سلولی میشود. این تقسیمها به صورت متوالی و بدون افزایش حجم سلولی رخ میدهند، که منجر به تشکیل سلولهای کوچکتر به نام بلوستومرها میشود. یکی از نقاط مهم در این مرحله، فعالسازی ژنومی جنینی (Embryonic Genome Activation) است که در انسان معمولاً در مرحله ۴–۸ سلولی رخ میدهد. پیش از این مرحله، جنین به RNA و پروتئینهای ذخیره شده در اووسیت وابسته است. فعالسازی ژنومی نقطهای حیاتی است که تعیین میکند جنین میتواند مستقل از اووسیت به رشد خود ادامه دهد و مراحل بعدی توسعه را طی کند.
تشکیل مورولا و آمادهسازی برای بلاستوسیت
تقسیمهای سلولی اولیه منجر به شکلگیری مورولا میشود؛ توده سلولی کروی که هنوز حفره مرکزی ندارد. در این مرحله، سلولها شروع به تفاوتگیری اولیه میکنند و ارتباط بین سلولها به تدریج مستحکمتر میشود. سلولهای داخلی مورولا، که در نهایت جنین واقعی را تشکیل میدهند، از سلولهای خارجی که نقش تروفوبلاست و حمایت از لانهگزینی را بر عهده دارند، تمایز مییابند. این تفاوتگیری اولیه پایهای برای تشکیل بلاستوسیت و طبقهبندی سلولی در مراحل بعدی است.
عوامل مؤثر بر مراحل ابتدایی قبل از جنینی
کیفیت جنین در این مراحل ابتدایی تحت تأثیر عوامل ژنتیکی، اپیژنتیکی و محیطی قرار دارد. تغییرات ژنتیکی یا اختلالات کروموزومی میتوانند منجر به سقط خودبهخودی یا عدم لانهگزینی شوند. علاوه بر این، محیط رحم و فاکتورهای تغذیهای و هورمونی مادر نقش تعیینکنندهای در پشتیبانی از رشد جنین اولیه دارند. در روشهای کمک باروری مانند IVF، شرایط کشت جنین، دما، غلظت اکسیژن و pH محیط نیز تأثیر مستقیم بر موفقیت تقسیمهای سلولی اولیه و بلوغ بلاستوسیت دارند.
اهمیت بالینی و تحقیقاتی مراحل ابتدایی
درک دقیق مراحل قبل از جنینی از نظر بالینی اهمیت فراوانی دارد. تشخیص جنینهای با کیفیت بالا، پیشبینی موفقیت لانهگزینی، و کاهش ریسک اختلالات ژنتیکی از جمله کاربردهای مستقیم این دانش است. همچنین، این مراحل پایهای برای تحقیقات سلولهای بنیادی و مدلسازی جنینی فراهم میکنند، به طوری که دانش به دست آمده از بررسی تقسیمهای سلولی و تعیین سرنوشت سلولی میتواند به توسعه درمانهای نوین ناباروری و بهبود سلامت نسلهای آینده کمک کند.
نتیجهگیری بخش فرایند باروری و مراحل ابتدایی
مراحل ابتدایی قبل از جنینی، شامل بلوغ اووسیت، لقاح، تقسیمهای سلولی اولیه و تشکیل مورولا، اساس تمام مراحل بعدی رشد جنین را شکل میدهند. موفقیت این مراحل وابسته به هماهنگی دقیق بین عوامل ژنتیکی، سیگنالهای مولکولی، کیفیت سلولی و شرایط محیطی است. هرگونه اختلال در این مراحل میتواند پیامدهای بلندمدتی برای جنین و سلامت نوزاد داشته باشد، بنابراین درک علمی و بالینی این مراحل از اهمیت بالایی برخوردار است و پایهای برای تمامی پژوهشها و مداخلات در حوزه باروری و تکوین جنین محسوب میشود.
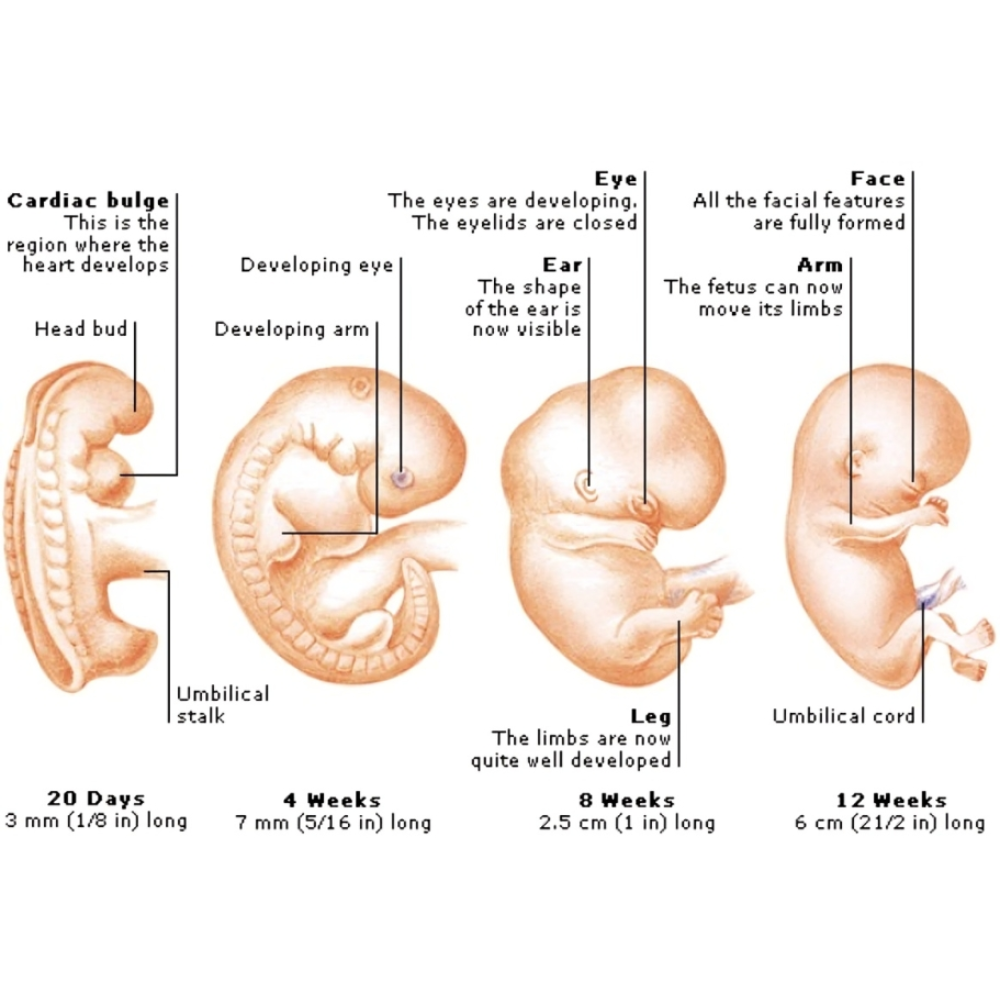
مرحله پیشنشوی (Preimplantation Stage)
مرحله پیشنشوی یکی از مهمترین مراحل تکوین جنین انسان است که از تقسیمهای سلولی اولیه پس از لقاح تا آمادهسازی جنین برای لانهگزینی در رحم ادامه دارد. این مرحله نقشی حیاتی در تعیین پتانسیل رشد جنین و موفقیت بارداری دارد و شامل تغییرات ساختاری، سلولی و مولکولی متعددی است که پایه و اساس تشکیل بافتها و اندامهای جنینی را فراهم میکند.
تقسیمهای سلولی اولیه و تشکیل مورولا
پس از لقاح، زیگوت شروع به تقسیمهای سلولی متوالی میکند که به آن کلونینگ سلولی بدون افزایش حجم میگویند. این تقسیمها منجر به تشکیل بلوستومرها میشود که در نهایت توده سلولی مورولا را ایجاد میکنند. مورولا یک ساختار کروی متراکم است که سلولهای داخلی آن در آینده جنین واقعی را تشکیل میدهند و سلولهای خارجی یا تروفوبلاست نقش حمایت و تعامل با اندومتر را بر عهده دارند.
در این مرحله، فعالسازی ژنومی جنینی (Embryonic Genome Activation) رخ میدهد که نقطهای بحرانی در رشد جنین محسوب میشود. قبل از فعالسازی ژنومی، جنین به RNA و پروتئینهای ذخیره شده در اووسیت وابسته است. فعالسازی ژنومی در انسان معمولاً در مرحله ۴–۸ سلولی اتفاق میافتد و شروع سنتز پروتئینهای مورد نیاز برای ادامه تقسیمها و تفاوتگیری سلولی را ممکن میسازد. هرگونه اختلال در این فرآیند میتواند منجر به توقف رشد جنین یا ناهنجاریهای ژنتیکی شود.
تشکیل بلاستوسیت و طبقهبندی سلولی
پس از مرحله مورولا، جنین وارد مرحله بلاستوسیت میشود. در این مرحله، یک حفره مایع به نام بلاستوسل شکل میگیرد و سلولها به دو گروه اصلی تقسیم میشوند: سلولهای داخلی (Inner Cell Mass) که آینده جنین را شکل میدهند و تروفوبلاست (Trophectoderm) که مسئول تعامل با اندومتر و لانهگزینی است. این طبقهبندی سلولی نشاندهنده نخستین مرحله از تفاوتگیری مشخص سلولها است و پایهای برای تمامی مراحل بعدی توسعه بافتها و اندامها فراهم میکند.
ارزیابی مورفولوژیک و تکنولوژیهای نوین
در دوران مدرن، ارزیابی کیفیت جنین پیشنشوی با استفاده از مشاهده مورفولوژیک، زمانسنجهای تصویربرداری (Time-Lapse Imaging)، الگوریتمهای هوش مصنوعی و فناوریهای «-omics» به شدت پیشرفت کرده است. این ابزارها امکان بررسی رفتار جنین، سرعت تقسیم سلولی، الگوهای حرکت سلولها و تغییرات ژنتیکی و اپیژنتیکی را فراهم میکنند. استفاده از این فناوریها نه تنها انتخاب جنین با پتانسیل بالای لانهگزینی را بهبود میبخشد بلکه امکان پیشبینی مشکلات ژنتیکی و بیولوژیکی احتمالی را نیز فراهم میسازد.
تأثیرات محیطی و روشهای IVF
کیفیت جنین در مرحله پیشنشوی به شدت تحت تأثیر شرایط محیطی، تغذیه اووسیت و اسپرم، دما، pH، غلظت اکسیژن و ترکیبات محلول کشت قرار دارد. در روشهای لقاح مصنوعی (IVF)، کنترل دقیق این عوامل اهمیت بالایی دارد تا جنین بتواند تقسیمهای سلولی منظم داشته باشد و به مرحله بلاستوسیت برسد. مطالعات نشان دادهاند که استرس سلولی، مواد شیمیایی، و حتی بیوپسی ژنتیکی قبل از لانهگزینی میتوانند پتانسیل جنین را کاهش دهند، بنابراین رعایت دقیق شرایط کشت و پایش مداوم حیاتی است.
نقش سیگنالهای مولکولی و تعیین سرنوشت سلولی
در طول مرحله پیشنشوی، مجموعهای از سیگنالهای مولکولی، مسیرهای Wnt، میکروRNA و فاکتورهای رشد، سلولها را به مسیرهای مختلف تمایز هدایت میکنند. این سیگنالها باعث میشوند که سلولهای داخلی توانایی تشکیل جنین و سلولهای خارجی توانایی تعامل با اندومتر را پیدا کنند. اختلال در این سیگنالها میتواند منجر به عدم تفاوتگیری مناسب، ناهنجاریهای ژنتیکی و شکست لانهگزینی شود.
اهمیت بالینی و تحقیقاتی مرحله پیشنشوی
درک کامل مرحله پیشنشوی برای پزشکان و محققان اهمیت بسیاری دارد، زیرا:
-
انتخاب جنین با بالاترین پتانسیل لانهگزینی برای IVF امکانپذیر میشود.
-
تشخیص ناهنجاریهای ژنتیکی قبل از لانهگزینی میتواند ریسک سقط و اختلالات رشد را کاهش دهد.
-
مطالعات سلولهای بنیادی و مدلهای جنینی بر پایه این مرحله، امکان بررسی مکانیسمهای تکوینی و توسعه درمانهای نوین ناباروری را فراهم میکند.
نتیجهگیری بخش پیشنشوی
مرحله پیشنشوی، از تقسیمهای سلولی اولیه تا شکلگیری بلاستوسیت، پایه و اساس تمام مراحل بعدی رشد جنین انسان را تشکیل میدهد. موفقیت این مرحله وابسته به هماهنگی دقیق بین تقسیمهای سلولی، فعالسازی ژنومی، سیگنالهای مولکولی و شرایط محیطی است. هر گونه اختلال در این فرآیند میتواند پیامدهای طولانیمدتی برای لانهگزینی و توسعه اندامها داشته باشد، بنابراین درک علمی و بالینی این مرحله برای تضمین موفقیت باروری و سلامت جنین ضروری است.
مرحله لانهگزینی (Implantation)
مرحله لانهگزینی، یکی از حیاتیترین مراحل تکوین جنین انسان است که در آن بلاستوسیت وارد اندومتر رحم میشود و تعامل پیچیدهای بین جنین و بافتهای مادری شکل میگیرد. موفقیت این مرحله، پایه موفقیت بارداری و رشد کامل جنین را تشکیل میدهد و تحت تأثیر مجموعهای از عوامل ژنتیکی، مولکولی و محیطی قرار دارد.
آمادهسازی اندومتر و تعامل جنین-رحم
برای لانهگزینی موفق، اندومتر رحم باید در حالت پنجره پذیرش (Window of Implantation) باشد؛ این بازه زمانی کوتاه شامل تغییرات هورمونی و سلولی است که محیطی مناسب برای پذیرش بلاستوسیت فراهم میکند. در این مرحله، سلولهای تروفوبلاست بلاستوسیت با اندومتر تعامل میکنند و از طریق سیگنالهای مولکولی، پروستاگلاندینها و فاکتورهای رشد، جایگاه مناسب برای نفوذ و اتصال جنین را شناسایی میکنند.
مکانیزمهای مولکولی و سیگنالینگ
لانهگزینی با مجموعهای پیچیده از سیگنالهای مولکولی و مسیرهای سلولی تنظیم میشود. مسیرهای Wnt و Notch نقش مهمی در تعیین محل اتصال و تمایز سلولهای تروفوبلاست دارند. همچنین Prostaglandin E2 در تحریک اندومتر و آمادهسازی سطح رحم برای نفوذ بلاستوسیت نقش حیاتی ایفا میکند. میکروRNAها و فاکتورهای اپیژنتیک نیز با تنظیم بیان ژنها، سرنوشت سلولها را مشخص میکنند و باعث میشوند که سلولهای داخلی توانایی حفظ و تکامل جنین را داشته باشند.
نفوذ و تثبیت بلاستوسیت
هنگامی که بلاستوسیت به سطح اندومتر میرسد، سلولهای تروفوبلاست شروع به تولید آنزیمهای متالوپروتئیناز و پروتئازها میکنند که به نفوذ بلاستوسیت در لایه اپیتلیال رحم کمک میکند. این نفوذ دقیق و کنترلشده، پایهای برای تشکیل جفت اولیه و جریان خون جنینی ایجاد میکند و امکان تبادل مواد مغذی و اکسیژن را فراهم میسازد. هرگونه اختلال در این مرحله میتواند منجر به سقط خودبهخودی، بارداری خارج رحمی یا مشکلات رشد جفت شود.
تأثیر بیوپسی و تشخیص ژنتیکی پیش از لانهگزینی
در روشهای کمک باروری (Assisted Reproductive Technologies)، گاهی بیوپسی جنین برای بررسی ژنتیکی قبل از لانهگزینی انجام میشود. مطالعات نشان دادهاند که اگرچه این روش میتواند اختلالات کروموزومی و ژنتیکی را شناسایی کند، ولی در صورت انجام نادرست ممکن است بر پتانسیل لانهگزینی جنین تأثیر منفی داشته باشد. بنابراین، انتخاب روشها و شرایط مناسب بسیار حیاتی است.
عوامل محیطی و بالینی مؤثر بر لانهگزینی
علاوه بر عوامل ژنتیکی و مولکولی، شرایط اندومتر، سطح هورمونها، تغذیه، سبک زندگی مادر و سلامت کلی بر موفقیت لانهگزینی تأثیرگذار هستند. اختلالات فیزیکی مانند مشکلات ساختاری رحم یا عفونتها نیز میتوانند مانع موفقیت لانهگزینی شوند. از سوی دیگر، تنظیم دقیق شرایط کشت جنین در IVF و پایش اندومتر میتواند شانس موفقیت بارداری را به شکل قابل توجهی افزایش دهد.
اهمیت بالینی و تحقیقاتی مرحله لانهگزینی
درک دقیق فرآیند لانهگزینی، نه تنها برای پیشگیری از سقط و مشکلات رشد جنین اهمیت دارد، بلکه پایهای برای توسعه درمانهای نوین ناباروری، مدلهای جنینی مبتنی بر سلولهای بنیادی و تحقیقات بالینی فراهم میکند. مطالعات اخیر نشان دادهاند که تداخل بین سیگنالهای ژنتیکی و محیطی، پتانسیل جنین برای ادامه رشد و توسعه اندامها را تعیین میکند و هرگونه اختلال کوچک میتواند پیامدهای بلندمدتی داشته باشد.
نتیجهگیری بخش لانهگزینی
مرحله لانهگزینی، نقطهای حساس و حیاتی در مسیر رشد جنین است که موفقیت آن بستگی به هماهنگی دقیق بین جنین و اندومتر، سیگنالهای مولکولی، عوامل محیطی و شرایط بالینی دارد. این مرحله پایه و اساس توسعه جفت، تامین مواد مغذی و اکسیژن و پیشرفت مراحل بعدی تکوین اندامها را فراهم میکند. بنابراین، درک علمی و بالینی این مرحله برای تضمین سلامت جنین و موفقیت بارداری ضروری است و یکی از کلیدیترین مباحث در مطالعات جنینشناسی و باروری به شمار میرود.
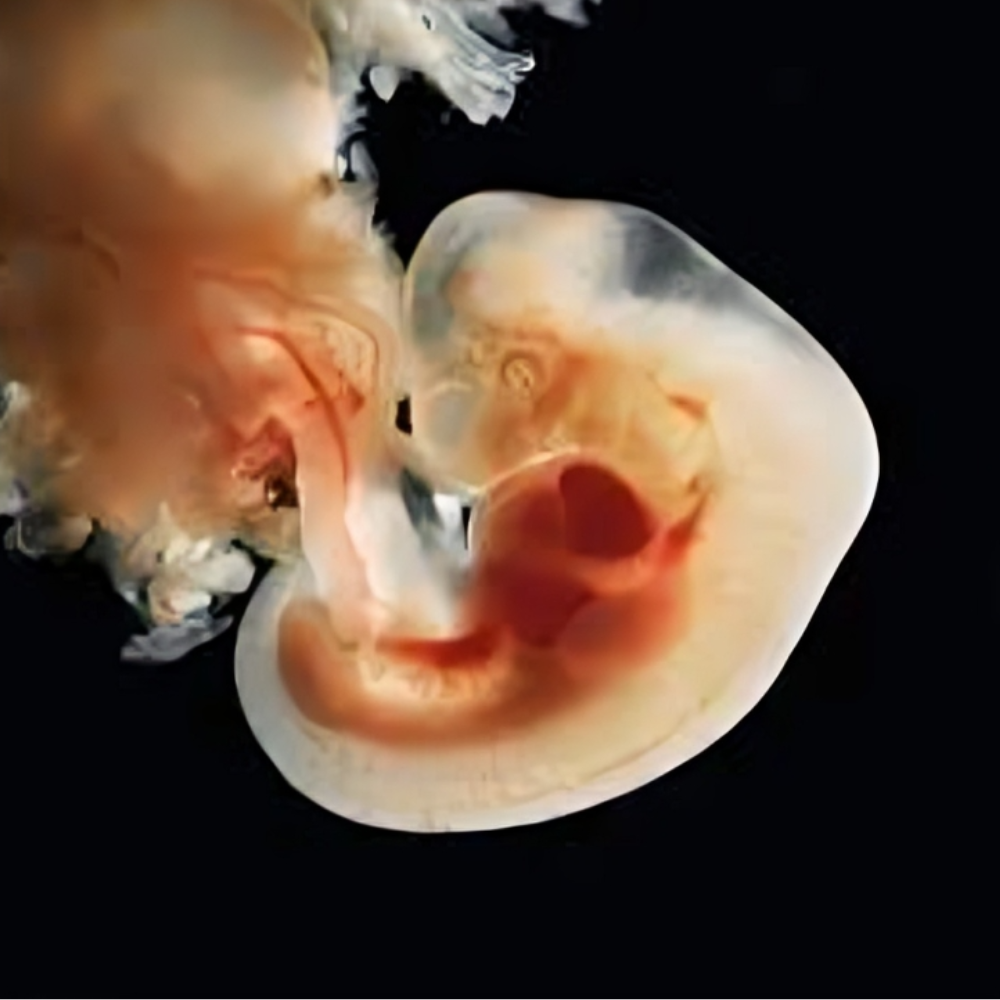
مرحله گاسترولاسیون (Gastrulation)
مرحله گاسترولاسیون یکی از مهمترین و پیچیدهترین مراحل رشد جنین انسان است که طی آن جنین اولیه به یک ساختار سهلایهای متمایز تبدیل میشود و پایه تکوین تمام اندامها و بافتها شکل میگیرد. این مرحله، پس از لانهگزینی و در حدود هفته دوم تا سوم بارداری آغاز میشود و شامل مجموعهای از تغییرات سلولی، مولکولی و مکانی است که به تعیین سرنوشت سلولها و شکلگیری بافتها منجر میشود.
تشکیل سه لایه جنینی و تعیین سرنوشت سلولی
در طول گاسترولاسیون، سلولهای جنین به سه لایه بنیادی تقسیم میشوند: اکتودرم، مزودرم و اندودرم. هر یک از این لایهها نقش خاصی در تکوین اندامها دارند.
-
اکتودرم: مسئول تشکیل سیستم عصبی مرکزی و محیطی، پوست، دندانها و بخشهایی از چشم و گوش است.
-
مزودرم: پایه شکلگیری قلب، سیستم گردش خون، کلیهها، ماهیچهها و استخوانها را فراهم میکند.
-
اندودرم: مسئول تشکیل لایههای داخلی اندامهای داخلی مانند ریه، کبد، پانکراس و دستگاه گوارش است.
این تقسیمبندی و تمایز سلولی از طریق سیگنالهای مولکولی دقیق و مسیرهای ژنتیکی پیچیده تنظیم میشود. مسیرهای Wnt، BMP و Notch نقش مهمی در تعیین مسیر تمایز سلولها و حفظ تعادل بین تقسیم و تمایز دارند. اختلال در این مسیرها میتواند منجر به نواقص شدید در تکوین اندامها و اختلالات ژنتیکی شود.
مکانیزمهای مولکولی و نقش میکروRNA
گاسترولاسیون نه تنها شامل تغییرات مکانیکی و حرکتی سلولها است، بلکه تنظیم بیان ژنها و مسیرهای سیگنالینگ سلولی نیز نقش حیاتی دارد. میکروRNAها به عنوان تنظیمکنندههای پس از رونویسی ژنها، سرنوشت سلولها، سرعت تقسیم و تمایز آنها را کنترل میکنند. این مولکولها از طریق تعدیل مسیرهای سیگنالینگ و ژنهای کلیدی تکوینی، توسعه منظم لایههای جنینی و پیشرفت مرحله ارگانوژنز را تضمین میکنند.
تفاوتگیری سلولی و مهاجرت سلولی
یکی از ویژگیهای مهم گاسترولاسیون، مهاجرت سلولها و تغییر شکل آنها است. سلولهای لایه داخلی جنین با حرکتهای کنترلشده به مکانهای مشخص میروند تا لایههای بافتی آینده را شکل دهند. این فرآیند شامل فرآیندهای اپیتلیوم-مزوچیمال (Epithelial-Mesenchymal Transition) است که باعث میشود سلولها انعطافپذیری لازم برای مهاجرت و تمایز را پیدا کنند. این حرکتهای سلولی پایهای برای تشکیل سیستم عصبی، قلب و اندامهای حیاتی محسوب میشوند.
نقش اپیژنتیک و الگوهای متیلاسیون DNA
گاسترولاسیون همچنین شامل تغییرات اپیژنتیکی گسترده است. الگوهای متیلاسیون DNA و تغییرات هیستونی، بیان ژنهای مرتبط با تعیین سرنوشت سلولها را تنظیم میکنند. این فرآیندها نه تنها برای تمایز مناسب سلولها ضروری هستند، بلکه اثرات مادامالعمر بر سلامت جنین و کودک آینده دارند. اختلال در این الگوهای اپیژنتیکی میتواند به نقایص مادرزادی، اختلالات رشد و مشکلات متابولیک منجر شود.
اهمیت بالینی و پژوهشی گاسترولاسیون
درک کامل فرآیند گاسترولاسیون برای متخصصان بالینی و پژوهشگران اهمیت ویژهای دارد. بسیاری از نقایص مادرزادی و مشکلات تکوینی ناشی از اختلالات این مرحله هستند. همچنین، دانش حاصل از گاسترولاسیون برای توسعه مدلهای سلولهای بنیادی و جنینی کاربرد دارد و میتواند مسیرهای جدید درمان ناباروری و پیشگیری از بیماریهای ژنتیکی را ارائه دهد.
نتیجهگیری بخش گاسترولاسیون
مرحله گاسترولاسیون، نقطه عطفی در رشد جنین انسان است که طی آن سه لایه بنیادی جنینی شکل میگیرند، سلولها تمایز پیدا میکنند و مسیر اندامزایی آغاز میشود. موفقیت این مرحله وابسته به هماهنگی دقیق بین تقسیم و مهاجرت سلولها، سیگنالینگ مولکولی، میکروRNAها و الگوهای اپیژنتیکی است. هر گونه اختلال در این فرآیند میتواند پیامدهای جدی برای سلامت نوزاد و تکوین اندامها داشته باشد. بنابراین، مطالعه و درک علمی این مرحله، پایهای برای پژوهشهای تکوینی، سلولهای بنیادی و کاربردهای بالینی در حوزه باروری و سلامت جنین محسوب میشود.
تکوین اندامها و بافتها (Organogenesis)
مرحله تکوین اندامها و بافتها یکی از حساسترین و حیاتیترین مراحل رشد جنین انسان است که از پایان گاسترولاسیون آغاز شده و تا هفتههای ابتدایی پس از لانهگزینی ادامه مییابد. در این مرحله، سه لایه بنیادی جنینی (اکتودرم، مزودرم و اندودرم) مسیر مشخصی برای تشکیل تمام اندامها و بافتهای بدن پیدا میکنند و ساختارهای پیچیده بدن انسان به تدریج شکل میگیرند. موفقیت این مرحله وابسته به هماهنگی دقیق بین تقسیم سلولی، سیگنالهای مولکولی، مسیرهای اپیژنتیکی و عوامل محیطی است.
تشکیل سیستم عصبی
سیستم عصبی نخستین اندامی است که در طی تکوین اندامها شکل میگیرد. این فرآیند از نوار عصبی (Neural Plate) آغاز میشود که از اکتودرم جنینی منشأ میگیرد. نوار عصبی با فرآیندهای پیچیده خم شدن و تجمع سلولی به لوله عصبی تبدیل میشود و پایه سیستم عصبی مرکزی، شامل مغز و نخاع، را تشکیل میدهد. مسیرهای سیگنالینگ مانند BMP، Wnt و Sonic Hedgehog (Shh) نقش حیاتی در تعیین طول و جهتگیری لوله عصبی دارند. اختلال در این مسیرها میتواند منجر به نواقص لوله عصبی مانند اسپینا بیفیدا یا آننسفالی شود.
تشکیل قلب و سیستم گردش خون
قلب از مزودرم میانی شکل میگیرد و نخستین اندامی است که عملکرد حیاتی آن در جنین آغاز میشود. سلولهای مزودرمی تخصصیافته به شکل تیغههای اولیه قلبی درمیآیند و پس از همجوشی و تشکیل لوله قلبی، ریتم اولیه ضربان قلب ایجاد میشود. مسیرهای سیگنالینگ FGF، BMP و Notch به تنظیم تقسیم سلولی، تمایز و شکلگیری محفظههای قلبی کمک میکنند. همچنین تشکیل عروق خونی از طریق فرآیندهای آنژیوژنز و واسکولوژنز، مواد مغذی و اکسیژن لازم برای رشد اندامها را فراهم میآورد.
تکوین ریه و سیستم تنفسی
سیستم تنفسی از اندودرم جنینی منشأ میگیرد. نخستین شاخهها به شکل کیسههای اولیه هوایی و شاخههای برونکوآلوئولار ایجاد میشوند. مسیرهای مولکولی مانند FGF، Shh و Wnt در تعیین طول، قطر و پیچیدگی شاخههای تنفسی نقش دارند. اختلال در این مسیرها میتواند باعث نواقص مادرزادی مانند آژنزی ریوی یا هیپوپلازی ریه شود.
تشکیل کبد و پانکراس
اندامهای گوارشی مانند کبد و پانکراس از اندودرم جنینی منشأ میگیرند. کبد اولیه با تعامل بین اندودرم و مزودرم احاطهکننده ایجاد میشود و سلولهای کبدی، صفراوی و استرومال شکل میگیرند. پانکراس نیز از اندودرم انتهایی روده منشأ میگیرد و مسیرهای سیگنالینگ Notch، BMP و FGF در تمایز سلولهای لوزالمعده، تولید انسولین و گلوکاگون و تشکیل ساختارهای مجاری مهم هستند.
تکوین دندانها و ساختارهای دهان
دندانها و بافتهای دهانی از اکتودرم سطحی و مزودرم فکها منشأ میگیرند. فرآیند تکوین شامل تشکیل غده دندان، مرحله گلولهای، مرحله کلاهکی و مرحله زنگی است. مسیرهای سیگنالینگ Wnt، BMP و FGF در تنظیم شکل، تعداد و جایگاه دندانها نقش دارند. اختلال در این مسیرها میتواند باعث آژنزی دندانها یا ناهنجاریهای شکل دندان شود.
نقش مسیرهای مولکولی و سیگنالینگ سلولی
در طول تکوین اندامها، مسیرهای مولکولی مانند Wnt، Notch، BMP، FGF و Shh به دقت سلولها را هدایت میکنند تا در مکان و زمان مناسب تمایز یابند. این مسیرها، ارتباط بین سلولها و محیط اطراف را برقرار کرده و تعادل بین تقسیم، مهاجرت و تمایز سلولی را حفظ میکنند. اختلال در هر یک از این مسیرها میتواند باعث نواقص ساختاری، اختلال عملکردی و بیماریهای ژنتیکی شود.
نقش اپیژنتیک و تنظیم ژنی
در تکوین اندامها، اپیژنتیک از طریق تغییرات هیستونی و متیلاسیون DNA بیان ژنها را تنظیم میکند. این تغییرات به سلولها اجازه میدهد تا بر اساس سیگنالهای محیطی و مولکولی، مسیر تمایز مناسب را انتخاب کنند. همچنین، اختلالات اپیژنتیکی میتوانند اثرات مادامالعمر بر رشد اندامها، متابولیسم و سلامت کودک آینده داشته باشند.
اهمیت بالینی و پژوهشی مرحله تکوین اندامها
درک کامل فرآیند تکوین اندامها و بافتها برای تشخیص و پیشگیری از نقایص مادرزادی، اختلالات قلبی، ریوی و گوارشی اهمیت دارد. این دانش همچنین پایهای برای مدلسازی اندامها با سلولهای بنیادی، توسعه درمانهای بازسازی بافت و تحقیقات ژنتیکی فراهم میکند. مطالعات اخیر نشان دادهاند که ترکیب سیگنالهای مولکولی، محیط اپیژنتیک و شرایط تغذیهای مادر، اثر مستقیم بر رشد و عملکرد نهایی اندامها دارد.
نتیجهگیری بخش تکوین اندامها و بافتها
مرحله تکوین اندامها و بافتها، مرحلهای است که در آن سه لایه بنیادی جنینی به اندامها و بافتهای پیچیده تبدیل میشوند. موفقیت این مرحله وابسته به هماهنگی دقیق بین سیگنالهای مولکولی، مسیرهای اپیژنتیکی، مهاجرت و تمایز سلولی است. هرگونه اختلال در این فرآیند میتواند پیامدهای جدی برای سلامت نوزاد و عملکرد اندامها داشته باشد. درک علمی این مرحله، پایهای برای پیشگیری از نقایص مادرزادی، توسعه درمانهای نوین و تحقیقات بنیادی در جنینشناسی و باروری محسوب میشود.
رشد و توسعه جفت و حمایت از جنین
یکی از حیاتیترین مراحل در تکوین جنین انسان، شکلگیری و توسعه جفت است که نقش کلیدی در تأمین مواد مغذی، اکسیژن و حمایت ایمنی از جنین ایفا میکند. جفت، اندامی موقت اما بسیار پیچیده است که از تعامل نزدیک بین بلاستوسیت و اندومتر رحم شکل میگیرد و عملکرد آن مستقیماً بر سلامت جنین و موفقیت بارداری تأثیر میگذارد.
تشکیل اولیه جفت
پس از لانهگزینی، سلولهای تروفوبلاست بلاستوسیت به دو لایه تمایز مییابند: سینسیتیوتروفوبلاست و سیتوتروفوبلاست. سیتوتروفوبلاست سلولهای بنیادی تروفوبلاست را تشکیل میدهد و سینسیتیوتروفوبلاست، لایهای چندهستهای است که به نفوذ و تعامل با اندومتر رحم کمک میکند. این لایهها از طریق تولید آنزیمهای متالوپروتئیناز، هورمونها و فاکتورهای رشد، اتصال جنین به دیواره رحم و شکلگیری جفت اولیه را تسهیل میکنند.
تشکیل سیستم عروقی جفت
یکی از حیاتیترین وظایف جفت، ایجاد شبکه عروقی پیچیده است که تبادل مواد مغذی، گازها و متابولیتها بین مادر و جنین را ممکن میسازد. سلولهای تروفوبلاست و مزودرم جنینی با همکاری سلولهای اندومتر، لولههای عروقی و سینوزوئیدها را شکل میدهند. مسیرهای سیگنالینگ VEGF، FGF و Notch در ایجاد و تمایز سلولهای اندوتلیال نقش دارند. اختلال در این فرآیند میتواند منجر به اختلالات رشد جفت، پرهاکلامپسی و محدودیت رشد جنین (IUGR) شود.
تولید هورمونها و فاکتورهای حمایتکننده
جفت، هورمونهای حیاتی مانند hCG، پروژسترون و استروژن را تولید میکند که نقش کلیدی در حفظ اندومتر، پیشگیری از سقط و تنظیم رشد جنین دارند. hCG با حفظ جسم زرد، تولید پروژسترون را تضمین میکند و به تنظیم ایمنی مادری و جلوگیری از پاسخ ایمنی علیه جنین کمک مینماید. همچنین، فاکتورهای رشد مانند EGF و IGF مسیرهای رشد جنین و تکوین اندامها را تقویت میکنند.
حمایت ایمنی و تبادل مواد مغذی
جفت نقش حیاتی در محافظت ایمنی جنین دارد. سلولهای سینسیتیوتروفوبلاست به صورت مستقیم با سیستم ایمنی مادر تعامل دارند و با تولید سیتوکینها و عوامل مهاری از پاسخهای ایمنی مخرب جلوگیری میکنند. علاوه بر این، جفت به عنوان واسطه تبادل مواد مغذی و اکسیژن عمل میکند و مواد زائد جنین را به خون مادر منتقل میسازد. این عملکرد حیاتی، تداوم رشد و سلامت جنین را تضمین میکند.
نقش سیگنالینگ مولکولی و ژنتیکی
رشد و توسعه جفت تحت کنترل مجموعهای از مسیرهای مولکولی، ژنهای اپیژنتیک و سیگنالهای محیطی است. مسیرهای Wnt، Notch و Hippo نه تنها تمایز سلولهای تروفوبلاست را هدایت میکنند، بلکه با تنظیم تمایز سلولهای اندومتر، محیط مناسبی برای نفوذ و عملکرد جفت فراهم میآورند. اختلال در این مسیرها میتواند باعث نارسایی جفت، سقط یا اختلالات رشد جنین شود.
عوامل محیطی و بالینی مؤثر بر توسعه جفت
سلامت جفت تحت تأثیر عوامل محیطی، سبک زندگی مادر، تغذیه، سطح اکسیژن و فشار خون قرار دارد. قرارگیری جنین در معرض مواد سمی، داروها یا فلزات سنگین میتواند عملکرد جفت را مختل کند و رشد جنین را محدود نماید. در روشهای کمک باروری، پایش دقیق جنین و شرایط اندومتر اهمیت ویژهای دارد تا توسعه جفت به شکل طبیعی و سالم انجام شود.
اهمیت بالینی و پژوهشی مرحله توسعه جفت
درک کامل فرآیند رشد و توسعه جفت برای متخصصان باروری، پژوهشگران جنینشناسی و پزشکان زنان اهمیت دارد، زیرا اختلالات جفت علت اصلی مشکلاتی مانند سقط، پرهاکلامپسی و IUGR هستند. همچنین، تحقیقات بر روی مدلهای سلولهای بنیادی و جفت، مسیرهای جدید درمانی برای اختلالات بارداری و حمایت از رشد جنین ارائه میدهد.
نتیجهگیری بخش رشد و توسعه جفت و حمایت از جنین
جفت نه تنها ساختار فیزیکی اتصال جنین به رحم را فراهم میکند، بلکه با تولید هورمونها، حمایت ایمنی و تبادل مواد مغذی، بقای جنین و رشد صحیح اندامها را تضمین میکند. موفقیت این مرحله وابسته به هماهنگی دقیق بین جنین و اندومتر، مسیرهای مولکولی و سیگنالهای محیطی است و هرگونه اختلال میتواند پیامدهای جدی برای سلامت نوزاد و بارداری داشته باشد. بنابراین، مطالعه علمی و بالینی این مرحله پایهای برای تضمین سلامت جنین و موفقیت باروری محسوب میشود.
عوامل ژنتیکی و اپیژنتیکی در توسعه جنین
رشد و تکوین جنین انسان یک فرآیند فوقالعاده پیچیده است که تحت تأثیر تعامل نزدیک بین عوامل ژنتیکی و اپیژنتیکی قرار دارد. ژنها، برنامهریز اصلی مسیرهای رشد و تمایز سلولی هستند، در حالی که عوامل اپیژنتیکی با تنظیم بیان ژنها بدون تغییر توالی DNA، امکان پاسخ دقیق سلولها به محیط و سیگنالهای مولکولی را فراهم میکنند. هماهنگی بین این دو سیستم، تضمینکننده رشد سالم و تکامل مناسب اندامها و بافتها است.
نقش عوامل ژنتیکی در توسعه جنین
ژنها در تمامی مراحل تکوین جنین نقش محوری دارند. از جمله مهمترین عملکردهای ژنها میتوان به موارد زیر اشاره کرد:
-
تعیین سرنوشت سلولی: ژنهای کلیدی مانند Oct4، Sox2 و Nanog در حفظ حالت بنیادی سلولهای جنینی و تمایز به لایههای جنینی نقش دارند. این ژنها تعیین میکنند که سلولها به کدام مسیر تمایز بروند و پایه تکوین اندامها را فراهم میکنند.
-
تکوین اندامها و بافتها: ژنهای Hox و Pax با ایجاد الگوهای مکانی و زمانی، محل دقیق شکلگیری اندامها، تعداد و نوع سلولها را مشخص میکنند. اختلال در این ژنها میتواند منجر به نقص اندامی یا اختلالات ساختاری شود.
-
ایجاد سیستم عصبی و قلبی-عروقی: ژنهایی مانند Shh، FGF و BMP مسیرهای تمایز نورونها، شکلگیری لوله عصبی و تشکیل قلب و عروق را هدایت میکنند.
نقش اپیژنتیک در توسعه جنین
اپیژنتیک شامل مجموعهای از تغییرات غیر توالیای در DNA است که بیان ژنها را کنترل میکند. این تغییرات شامل متیلاسیون DNA، تغییرات هیستونی و فعالیت RNAهای غیرکدکننده مانند میکروRNAها هستند. اپیژنتیک به جنین اجازه میدهد تا:
-
پاسخ مناسب به محیط داخلی رحم: تغییرات اپیژنتیکی در سلولهای جنینی به آنها امکان میدهد تا به سطح هورمونها، مواد مغذی و سیگنالهای جفت واکنش نشان دهند.
-
تعیین مسیر تمایز سلولی: سلولها با تنظیم اپیژنتیکی ژنها، مسیرهای مشخصی برای تبدیل به اکتودرم، مزودرم یا اندودرم پیدا میکنند.
-
حفظ ثبات ژنتیکی و جلوگیری از جهشها: اپیژنتیک با تنظیم بیان ژنهای ترانسپوزونی، از بروز جهشها و ناپایداری ژنومی جلوگیری میکند و سلامت سلولهای جنینی را تضمین میکند.
تعامل ژنتیک و اپیژنتیک
توسعه جنین نتیجه تعامل دقیق بین ژنها و اپیژنتیک است. ژنها برنامه اولیه را ارائه میدهند، اما اپیژنتیک تعیین میکند که چه ژنهایی در چه زمان و مکانی فعال شوند. به عنوان مثال، در تشکیل سیستم عصبی، ژنهای Hox نقش الگوهای مکانی را بازی میکنند، در حالی که الگوهای متیلاسیون DNA و هیستونی، فعال شدن این ژنها در سلولهای خاص را تضمین میکنند. اختلال در هر یک از این سیستمها میتواند پیامدهای جدی مانند نقصهای مادرزادی، اختلالات رشد و بیماریهای متابولیک طولانیمدت داشته باشد.
تأثیر عوامل محیطی بر اپیژنتیک جنینی
شرایط محیطی مادر مانند تغذیه، استرس، داروها، فلزات سنگین و مواد سمی میتوانند الگوهای اپیژنتیکی جنین را تغییر دهند. این تغییرات میتوانند نه تنها بر سلامت جنین بلکه بر سلامت فرد در طول عمر، خطر ابتلا به بیماریهای مزمن و رفتارهای متابولیک تأثیر بگذارند. مطالعات نشان دادهاند که قرارگیری جنین در معرض اختلالات محیطی در مراحل اولیه بارداری بیشترین تأثیر را بر اپیژنتیک و توسعه سالم دارد.
میکروRNAها و تنظیم بیان ژنی
میکروRNAها، RNAهای کوتاه غیرکدکننده هستند که سطح پروتئینها را پس از رونویسی ژنها تنظیم میکنند. این مولکولها در مراحل اولیه تکوین، از جمله تمایز سلولها، مهاجرت و تشکیل اندامها نقش حیاتی دارند. به عنوان مثال، میکروRNAهای خاص میتوانند مسیرهای Wnt و BMP را تعدیل کنند و بدین ترتیب توسعه قلب، مغز و سیستم عصبی محیطی را هدایت کنند.
اهمیت بالینی و پژوهشی عوامل ژنتیکی و اپیژنتیکی
درک عمیق ژنتیک و اپیژنتیک جنینی، پایهای برای:
-
تشخیص اختلالات ژنتیکی پیش از تولد
-
پیشگیری از نقایص مادرزادی
-
توسعه درمانهای مبتنی بر سلولهای بنیادی و ژن درمانی
است. همچنین، تحقیقات در این حوزه نشان دادهاند که تعامل ژنتیک و اپیژنتیک در طول IVF و باروری کمکشده تأثیر قابل توجهی بر کیفیت جنین و موفقیت بارداری دارد.
نتیجهگیری بخش عوامل ژنتیکی و اپیژنتیکی
عوامل ژنتیکی و اپیژنتیکی با همکاری دقیق یکدیگر، نقش برنامهریز و تنظیمکننده توسعه جنین را ایفا میکنند. ژنها مسیرهای رشد و تمایز را تعیین میکنند، در حالی که اپیژنتیک بیان آنها را تنظیم و پاسخ سلولها به محیط را هدایت میکند. اختلال در این سیستمها میتواند پیامدهای جدی برای سلامت جنین، رشد اندامها و زندگی آینده فرد داشته باشد. از این رو، درک علمی این عوامل، پایهای برای پیشگیری، تشخیص و درمان اختلالات رشد و توسعه جنین به شمار میرود.
عوامل محیطی و سمشناسی در توسعه جنین
توسعه جنین انسان نه تنها تحت کنترل دقیق ژنتیک و اپیژنتیک است، بلکه شرایط محیطی و مواجهه با مواد سمی نقش بسیار مهمی در رشد و سلامت جنین دارند. جنین در طول بارداری نسبت به عوامل محیطی حساسیت بالایی دارد، زیرا فرآیندهای تمایز سلولی، تکوین اندامها و شکلگیری سیستمهای حیاتی در مراحل ابتدایی بسیار آسیبپذیر هستند. اختلال در این عوامل میتواند منجر به نواقص مادرزادی، اختلالات عملکردی و بیماریهای طولانیمدت در زندگی کودک شود.
اثرات مواد شیمیایی و دارویی
قرارگیری جنین در معرض مواد شیمیایی، داروها و عوامل درمانی میتواند فرآیند رشد را مختل کند. داروهایی مانند تتراسیکلین، ایزوترتینوئین و برخی داروهای ضدصرع شناخته شدهاند که میتوانند باعث نواقص اندامها، اختلالات سیستم عصبی و قلبی-عروقی شوند. مکانیسم اثر این داروها اغلب از طریق تداخل با مسیرهای سیگنالینگ، القای استرس سلولی و تغییرات اپیژنتیک صورت میگیرد.
فلزات سنگین و سموم محیطی
فلزات سنگین مانند کادمیم، سرب و جیوه میتوانند به جنین آسیب جدی برسانند. مطالعات نشان دادهاند که کادمیم با ایجاد استرس اندوپلاسمی، اختلال در تقسیم و تمایز سلولی و اختلال در عملکرد جفت، رشد جنین را محدود میکند. همچنین، قرارگیری جنین در معرض آلایندههای صنعتی و آفتکشها میتواند باعث نقصهای ساختاری، اختلالات متابولیک و کاهش وزن هنگام تولد شود.
تأثیر اشعه و عوامل فیزیکی
اشعههای یونیزان، میدانهای مغناطیسی و حرارت بالا نیز میتوانند به سلولهای جنینی آسیب برسانند. اشعههای رادیولوژیک و CT scan بدون محافظت مناسب میتوانند باعث جهشهای ژنتیکی و نقایص رشد مغز و اندامها شوند. به همین دلیل، محدود کردن مواجهه مادر با منابع اشعه در دوران بارداری اهمیت ویژهای دارد.
استرس، تغذیه و سبک زندگی مادر
شرایط روانی و تغذیه مادر نیز نقش تعیینکنندهای در سلامت جنین دارند. استرس مزمن مادر میتواند با افزایش کورتیزول و تغییر مسیرهای هورمونی بر توسعه جنین تأثیر بگذارد و خطر نقصهای عصبی و رشد نامطلوب را افزایش دهد. تغذیه ناکافی یا کمبود ویتامینها و مواد معدنی مانند فولات، آهن و ید نیز میتواند باعث اختلال در تقسیم سلولی، تشکیل سیستم عصبی و رشد اندامها شود.
مکانیسمهای مولکولی تأثیر عوامل محیطی
عوامل محیطی با تأثیر بر استرس اکسیداتیو، پاسخ اندوپلاسمی و مسیرهای سیگنالینگ حیاتی، مسیرهای تمایز سلولی و رشد اندامها را مختل میکنند. همچنین، بسیاری از این عوامل میتوانند الگوهای اپیژنتیک را تغییر داده و بیان ژنها را تنظیم کنند، که این تغییرات ممکن است اثرات مادامالعمر بر سلامت فرد داشته باشند.
اهمیت بالینی و پیشگیری
آگاهی از عوامل محیطی و سمشناسی برای متخصصان زنان، باروری و جنینشناسی اهمیت دارد. اقدامات پیشگیرانه شامل:
-
محدود کردن مواجهه با داروها و مواد سمی
-
حفظ تغذیه مناسب و مصرف مکملها
-
کنترل استرس و شرایط روانی مادر
-
پایش و مراقبت دقیق محیط کار و منزل
میتواند به کاهش خطر نقایص مادرزادی و اختلالات رشد کمک کند. همچنین، این دانش پایهای برای تحقیقات سمشناسی و توسعه داروهای ایمن برای بارداری فراهم میآورد.
نتیجهگیری بخش عوامل محیطی و سمشناسی
عوامل محیطی و سمشناسی میتوانند توسعه جنین را به شدت تحت تأثیر قرار دهند. مواجهه با داروهای خاص، فلزات سنگین، استرس یا تغذیه ناکافی میتواند منجر به نواقص ساختاری، اختلالات عملکردی و حتی بیماریهای مادامالعمر شود. بنابراین، آگاهی، پیشگیری و مدیریت شرایط محیطی مادر از اهمیت حیاتی برخوردار است تا سلامت جنین و موفقیت بارداری تضمین شود.
تحقیقات و فناوریهای نوین در جنینشناسی
علم جنینشناسی طی چند دهه اخیر با تحولات تکنولوژیک و نوآوریهای پژوهشی به طرز چشمگیری پیشرفت کرده است. این پیشرفتها نه تنها درک ما از مراحل رشد و تکوین جنین را ارتقا دادهاند، بلکه راهکارهای تشخیصی، درمانی و باروری کمکشده را متحول کردهاند. فناوریهای نوین امکان مطالعه جنین انسان را در مراحل اولیه و با دقت بالا فراهم کردهاند، بدون اینکه نیاز به تخریب گسترده بافت جنینی باشد.
تصویربرداری و سیستمهای تایملپس
یکی از پیشرفتهای مهم در جنینشناسی، استفاده از سیستمهای تصویربرداری تایملپس (time-lapse imaging) است. این فناوری امکان مشاهده پیوسته تقسیم سلولی، رشد بلاستوسیت و حرکات سلولی را فراهم میکند و به متخصصان امکان میدهد که کیفیت جنین و پتانسیل لانهگزینی را به طور دقیق ارزیابی کنند. سیستمهای تایملپس به ویژه در IVF کاربرد دارند و با کاهش نیاز به دستکاری مکرر جنین، احتمال آسیب به سلولها را کاهش میدهند.
هوش مصنوعی و الگوریتمهای پیشبینی
ترکیب دادههای تصویربرداری با هوش مصنوعی (AI) و الگوریتمهای یادگیری ماشین، امکان پیشبینی موفقیت لانهگزینی و تکوین جنین را فراهم کرده است. این فناوریها قادرند الگوهای پیچیده تقسیم سلولی، نرخ رشد و ویژگیهای مورفولوژیکی را تحلیل کنند و پیشبینی دقیقی از کیفیت جنین ارائه دهند. هوش مصنوعی همچنین به بهینهسازی شرایط کشت جنین و انتخاب بهترین جنین برای انتقال کمک میکند و احتمال موفقیت IVF را افزایش میدهد.
مدلهای مبتنی بر سلولهای بنیادی و ارگانوئیدها
یکی دیگر از دستاوردهای کلیدی، استفاده از سلولهای بنیادی جنینی و مدلهای ارگانوئیدی است. این مدلها امکان مطالعه تکوین اندامها و بافتها بدون نیاز به جنین انسانی واقعی را فراهم میکنند. به کمک این فناوری، مسیرهای سیگنالینگ، تعاملات سلولی و اختلالات ژنتیکی قابل بررسی هستند. مدلهای ارگانوئیدی همچنین پایهای برای توسعه داروها و روشهای درمانی نوین برای اختلالات جنینی و نقصهای مادرزادی ایجاد میکنند.
بیوپسی و تشخیص ژنتیکی پیش از کاشت
فناوریهای مدرن تشخیص ژنتیکی پیش از کاشت (PGD و PGT)، امکان شناسایی اختلالات کروموزومی و ژنتیکی جنین قبل از انتقال به رحم را فراهم کردهاند. با استفاده از بیوپسی سلول تروفوبلاست و تحلیل مولکولی، میتوان جنینهای سالم با کمترین خطر نقایص ژنتیکی را انتخاب کرد. این فناوریها به ویژه در زوجهایی که ریسک بالای انتقال بیماریهای ژنتیکی دارند، اهمیت حیاتی دارند.
تحقیقات اپیژنتیک و RNA غیرکدکننده
مطالعات نوین در زمینه اپیژنتیک و RNAهای غیرکدکننده مانند میکروRNAها، اطلاعات بیسابقهای درباره تنظیم بیان ژنی در مراحل اولیه جنین فراهم کردهاند. این یافتهها نشان میدهند که تغییرات اپیژنتیک نه تنها بر تمایز سلولی و رشد اندامها تأثیر میگذارند، بلکه میتوانند اثرات مادامالعمر بر سلامت متابولیک و رفتاری فرد داشته باشند.
ویترریفیکاسیون و تکنیکهای حفظ جنین
فناوریهای نوین در زمینه ویترریفیکاسیون (vitrification) امکان ذخیره طولانیمدت جنینها بدون کاهش کیفیت را فراهم کردهاند. این روشها با کاهش تشکیل کریستالهای یخ، احتمال آسیب سلولی و مرگ سلولی را کاهش میدهند و موفقیت IVF را بهبود میبخشند. استفاده از ویترریفیکاسیون همچنین انعطافپذیری بیشتری برای برنامهریزی باروری و استفاده از جنینهای سالم فراهم میکند.
تأثیر فناوریهای نوین بر پزشکی بازساختی و آینده درمانها
فناوریهای نوین در جنینشناسی پایهای برای پزشکی بازساختی، ژن درمانی و توسعه اندامهای مصنوعی فراهم کردهاند. با ترکیب دادههای ژنتیکی، اپیژنتیکی و سلولهای بنیادی، امکان ایجاد مدلهای دقیق برای مطالعه اختلالات مادرزادی و طراحی درمانهای هدفمند فراهم میشود. این پیشرفتها همچنین مسیر جدیدی برای کاهش نارساییهای جفت، اختلالات رشد و مرگ جنین در بارداریهای پرخطر باز کردهاند.
نتیجهگیری بخش تحقیقات و فناوریهای نوین
تحقیقات و فناوریهای نوین در جنینشناسی، درک ما از مراحل رشد جنین و فرآیندهای پیچیده آن را متحول کردهاند. استفاده از هوش مصنوعی، تصویربرداری تایملپس، مدلهای سلولهای بنیادی و تشخیص ژنتیکی پیش از کاشت، امکان ارزیابی دقیق کیفیت جنین، پیشبینی موفقیت لانهگزینی و پیشگیری از اختلالات ژنتیکی را فراهم کردهاند. این فناوریها نه تنها در IVF و باروری کمکشده اهمیت دارند، بلکه پایهای برای پژوهشهای آینده، درمانهای نوین و سلامت طولانیمدت نوزادان محسوب میشوند.
جمعبندی و نتیجهگیری
مطالعه مراحل رشد جنین انسان، از باروری تا تولد، یک حوزه علمی پیچیده و چندوجهی است که تعامل میان ژنتیک، اپیژنتیک، عوامل محیطی و فناوریهای نوین را در فرآیند تکوین و رشد نشان میدهد. فهم دقیق این فرآیندها نه تنها برای متخصصان زنان و باروری اهمیت دارد، بلکه پایهای برای تشخیص، پیشگیری و درمان اختلالات رشد و نواقص مادرزادی محسوب میشود.
از باروری تا مرحله پیشنشوی، تعامل میان سلولهای جنسی و محیط رحم، تعیینکننده موفقیت لقاح و تشکیل جنین اولیه است. فرآیندهایی مانند تحریک تخمک، لقاح اسپرم و تقسیم سلولی اولیه، بدون اختلال در محیط رحم و کیفیت سلولها، امکان رشد سالم جنین را فراهم نمیکنند. در این مرحله، میکروRNAها و سیگنالهای مولکولی نقش حیاتی در هدایت مسیرهای اولیه سلولی ایفا میکنند.
مرحله لانهگزینی و گاسترولاسیون نشاندهنده اهمیت تعامل جنین با محیط رحم و شکلگیری لایههای جنینی است. در این مراحل، الگوهای ژنتیکی و اپیژنتیکی تعیینکننده مسیرهای تمایز سلولی، مهاجرت سلولها و شکلگیری اولیه اندامها هستند. اختلالات در این فرآیندها میتوانند منجر به نواقص مادرزادی یا بارداریهای ناموفق شوند.
تکوین اندامها و رشد بافتها، مرحلهای است که برنامهریزی ژنتیکی و اپیژنتیکی دقیق، شکلگیری اندامها و توسعه سیستمهای حیاتی بدن را هدایت میکند. این مرحله حساس، نیازمند هماهنگی میان مسیرهای سیگنالینگ، عوامل محیطی و وضعیت تغذیه و سلامت مادر است. هر گونه اختلال در ژنهای کلیدی یا تغییرات اپیژنتیکی میتواند اثرات طولانیمدت بر رشد و عملکرد اندامها داشته باشد.
رشد جفت و حمایت از جنین، تضمینکننده دسترسی به مواد مغذی و اکسیژن و حذف ضایعات متابولیک است. تکوین سالم جفت با سیگنالهای هورمونی و مولکولی، مسیرهای ایمنی و پاسخهای سلولی کنترل میشود و اختلالات آن میتوانند به مشکلات رشد جنین و خطر سقط منجر شوند.
عوامل ژنتیکی و اپیژنتیکی پایههای اصلی کنترل رشد جنین هستند. ژنها مسیرهای رشد و تمایز را مشخص میکنند، در حالی که اپیژنتیک فعالسازی دقیق ژنها در زمان و مکان مناسب را تضمین میکند. همچنین، میکروRNAها، الگوهای متیلاسیون DNA و تغییرات هیستونی، به تنظیم فعالیت ژنها در مراحل اولیه تکوین کمک میکنند.
عوامل محیطی و سمشناسی نیز نقش مهمی در سلامت جنین دارند. مواجهه با داروهای خاص، فلزات سنگین، مواد شیمیایی و استرس مادر میتواند فرآیند رشد را مختل کند. اهمیت پیشگیری، تغذیه مناسب و مدیریت شرایط محیطی مادر، از نظر کاهش خطر نواقص مادرزادی و اختلالات متابولیک، غیرقابل چشمپوشی است.
تحقیقات و فناوریهای نوین در جنینشناسی، شامل تصویربرداری تایملپس، هوش مصنوعی، مدلهای سلولهای بنیادی، بیوپسی و تشخیص ژنتیکی پیش از کاشت، امکان ارزیابی دقیق کیفیت جنین، پیشبینی موفقیت لانهگزینی و کاهش خطر اختلالات ژنتیکی را فراهم کردهاند. این فناوریها نه تنها در IVF اهمیت دارند، بلکه پایهای برای پزشکی بازساختی، ژن درمانی و تحقیقات آینده در سلامت نوزادان و کودکان محسوب میشوند.
نتیجه نهایی
مطالعه جامع مراحل رشد جنین انسان نشان میدهد که سلامت و تکوین جنین نتیجه تعامل پیچیده و هماهنگ میان ژنتیک، اپیژنتیک، محیط داخلی مادر و فناوریهای نوین علمی است. درک این فرآیندها به متخصصان امکان میدهد که تشخیص زودهنگام اختلالات، پیشگیری از نقصها و افزایش موفقیت بارداری را فراهم کنند. همچنین، تحقیقات پیشرفته در این حوزه، پایهای برای سلامت طولانیمدت کودک، کاهش بیماریهای مزمن و توسعه درمانهای نوین ایجاد میکند. بنابراین، ترکیب دانش علمی، فناوریهای پیشرفته و مدیریت محیطی، کلید رشد سالم و تکامل موفق جنین انسان است.