وسترن بلات چیست؟
وسترن بلات (Western Blot) یا ایمونوبلات (Immunoblot)
وسترن بلات که با نام ایمونوبلات (Immunoblot) نیز شناخته میشود، یکی از روشهای پرکاربرد برای آنالیز کیفی و کمی پروتئینها در یک نمونه آزمایشی است.
بهطور ساده، وسترن بلات به شما نشان میدهد که آیا پروتئین موردنظر شما در نمونه وجود دارد یا خیر و اگر وجود دارد، بهصورت نسبی چه مقدار از آن در نمونه داریم. همچنین این روش امکان تعیین اندازه پروتئین یا تغییرات آن، فراوانی نسبی، تشکیل کمپلکسهای پروتئینی و تغییرات پس از ترجمه (Post-Translational Modifications, PTMs) را فراهم میکند.
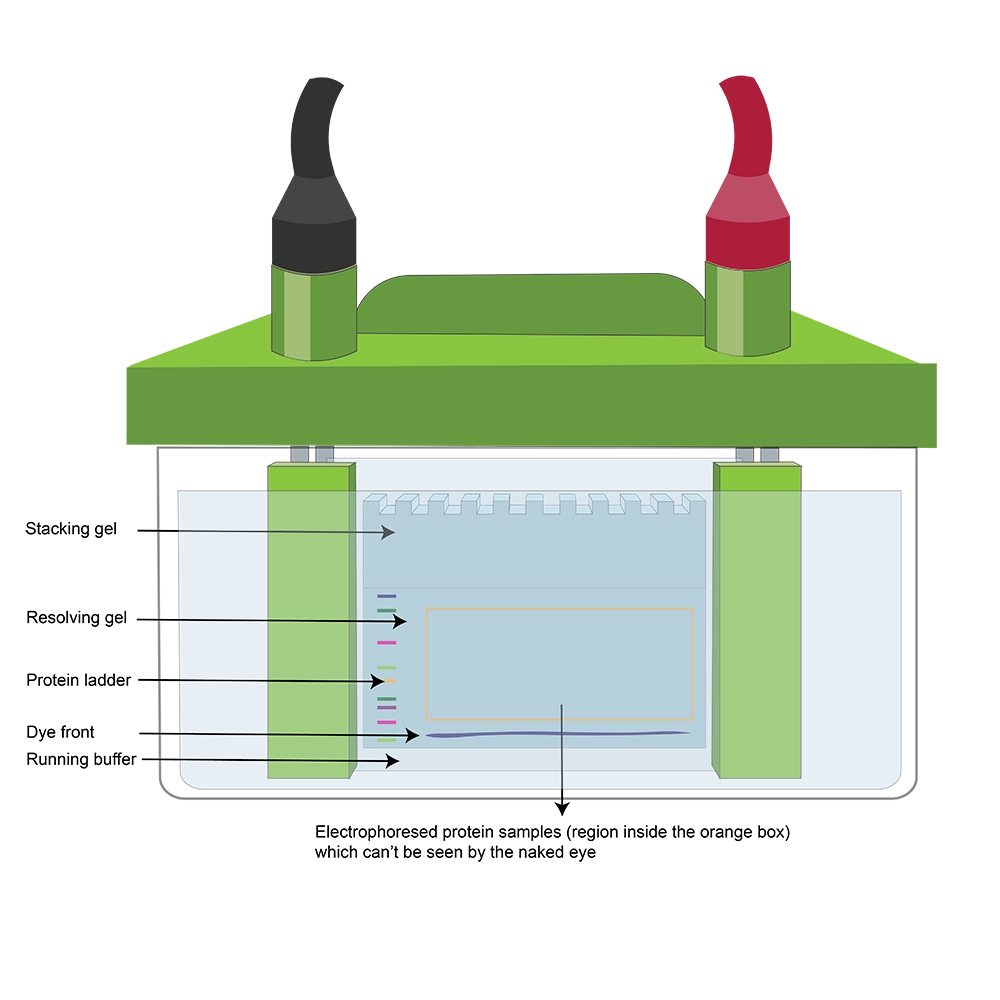
در روش وسترن بلات، ابتدا پروتئینهای موجود در نمونه از طریق ژل الکتروفورز (Gel Electrophoresis) از یکدیگر جدا میشوند. سپس این پروتئینهای جداشده از ژل به یک غشا (Membrane) منتقل میگردند. پس از آن، پروتئین هدف که روی غشا تثبیت شده است، با استفاده از آنتیبادیها که نقش پروبهای مولکولی (Molecular Probes) را ایفا میکنند، شناسایی میشود. در نهایت، غشا با استفاده از مواد آشکارساز (Detection Reagents) ظهور داده میشود تا نتایج بهصورت چشمی قابل مشاهده شوند.
انتقال پروتئینها از ژل به غشا دلیل نامگذاری واژه «بلات (Blot)» است؛ درست مانند زمانی که مایعی ریختهشده روی میز را با دستمال کاغذی جذب و پاک میکنید.
مراحل اصلی آزمایش وسترن بلات
مراحل پایهای یک آزمایش وسترن بلات عبارتاند از:
-
استخراج پروتئینها از نمونههای آزمایشی (بافت گیاهی یا جانوری، رده سلولی یا کشت میکروبی)
-
الکتروفورز نمونه پروتئینی
-
انتقال پروتئینها از ژل به غشا
-
شناسایی پروتئین هدف روی غشا با استفاده از یک یا چند آنتیبادی
-
ظهور بلات تشکیلشده روی غشا بهمنظور تحلیل بصری نتایج
چرا به آن وسترن بلات گفته میشود؟
(Why is it called Western blot?)
وسترن بلات نام خود را از یک تکنیک قدیمیتر به نام ساترن بلات (Southern Blot) گرفته است. ساترن بلات روشی برای آنالیز DNA است که به افتخار کاشف آن، ادوین ساترن (Edwin Southern) نامگذاری شد.
پس از آن، سایر تکنیکهای بلاتینگ نیز بر اساس جهتهای جغرافیایی اصلی (Cardinal Directions) نامگذاری شدند تا هماهنگی در نامگذاری حفظ شود:
-
نُرن بلات (Northern Blot) برای RNA
-
وسترن بلات (Western Blot) برای پروتئین
آمادهسازی نمونه برای وسترن بلات
(Sample Preparation for Western Blot)
نمونههای مورد استفاده در وسترن بلات میتوانند از بافتهای گیاهی یا جانوری بهدست آیند. برای مثال، ممکن است بخواهیم بررسی کنیم آیا یک پروتئین خاص در برگ اسفناج تراریخته یا در کبد موش بیان شده است یا خیر.
همچنین نمونهها میتوانند از کشت سلولی یا کشت میکروبی تهیه شوند.
در برخی موارد، نمونهها بالینی (Clinical Samples) هستند. برای مثال، یک ریسرچر ممکن است بخواهد بداند آیا یک پروتئین خاص در خون بیمار یا در تومور خارجشده طی جراحی وجود دارد یا نه.
شکل ۱. نمایش شماتیک منابع مختلفی که نمونههای پروتئینی میتوانند برای استخراج و آنالیز از آنها تهیه شوند.
منابع استخراج پروتئین شامل ردههای سلولی، بافتها، کشتهای میکروبی و نمونههای بالینی هستند.
نمونههایی که حاوی پروتئین هستند میتوانند شامل کل سلولها، عصاره بافتی و یا بخشهایی از سلولی باشند. آمادهسازی نمونههای بافتی دشوارتر است، زیرا باید هموژنیزه یا سونیکید (Sonicate) شوند تا سلولها شکسته شوند و ممکن است به روشهای تخصصی دیگری نیاز باشد.
در همه موارد، سلولها باید لیز شده و پروتئینها محلول شوند. با شروع لیز، آنزیمهایی که میتوانند باعث پروتئولیز (تجزیه پروتئینها) و دفوسفریلاسیون (برداشتن گروه فسفات از پروتئینها) شوند آزاد میشوند؛ بنابراین، لیز معمولاً روی یخ و در حضور مهارکنندههای پروتئاز (Protease inhibitors) و فسفاتاز (Phosphatase inhibitors) انجام میشود تا از تجزیه و تغییرات غیراختصاصی در پروتئینها جلوگیری شود.
اگر زنجیره پلیپپتیدی شکسته شود یا ناقص گردد، نتایج وسترن بلات نادرست و گمراهکننده خواهند بود.
به همین دلیل، در مراحل استخراج و جداسازی پروتئین باید نهایت دقت به خرج داده شود تا پروتئینها توسط پروتئازها (Proteases) تخریب نشوند.
پروتئازها آنزیمهایی هستند که پروتئینها را تجزیه میکنند.
این پروتئازها ممکن است از ابتدا در نمونه وجود داشته باشند. برای مثال، اگر نمونه پروتئینی از یک بافت زنده تهیه شده باشد، پروتئازها بهطور طبیعی در سلولها حضور دارند.
همچنین، پروتئازها ممکن است بهصورت آلودگی تصادفی وارد نمونه شوند. برای مثال، اگر هنگام استخراج پروتئین با همکار آزمایشگاه صحبت کنید، قطرات بزاق یا ذرات معلق هوا که حاوی پروتئاز هستند، ممکن است وارد نمونه شوند و باعث تخریب پلیپپتیدها گردند.
در صورت آلودگی نمونه به پروتئازها، تجزیه پروتئینها (Proteolysis) رخ میدهد که یک وضعیت کاملاً نامطلوب است.
برای جلوگیری از این نوع تجزیه ناخواسته، در مراحل استخراج و آمادهسازی نمونه برای وسترن بلات از مهارکنندههای اختصاصی پروتئاز استفاده میشود. این ترکیبات فعالیت پروتئازها را مهار کرده و از سالم ماندن پروتئین هدف محافظت میکنند.
جدول ۱: مهارکنندههای رایج پروتئاز در بافر لیز
|
مهارکننده پروتئاز |
اهداف |
|
آپروتینین (Aprotinin |
تریپسین، کیموتریپسین، پلاسمن |
|
EDTA |
متالپروتئازهای Mg²⁺ و Mn²⁺ |
|
EGTA, |
متالپروتئازهای Ca²⁺ |
|
لوئپتین (Leupeptin) |
پروتئازهای لیزوزومی |
|
پپستاتین A (Pepstatin A), |
آسپارتیک پروتئازها |
|
PMSF |
سرین پروتئازها |
جدول ۲: مهارکنندههای رایج فسفاتاز در بافر لیز
|
مهارکننده فسفاتاز |
اهداف |
|
β-گلیسروفوسفات, 1-2 mM |
فسفاتازهای سرین و ترئونین |
|
سدیم ارتووانادات, 1 mM |
فسفاتازهای تیروزین |
|
سدیم پیروفوسفات, 1-2 mM |
فسفاتازهای سرین و ترئونین |
|
سدیم فلوراید, 5-10 mM |
فسفاتازهای سرین و ترئونین |
توضیح کوتاه: مهارکنندهها باعث جلوگیری از تجزیه یا تغییرات غیرمطلوب پروتئینها هنگام لیز شدن سلولها میشوند، که برای حفظ صحت نتایج وسترن بلات ضروری است.
انتخاب بافر لیز (Choosing a Lysis Buffer)
ترکیب و فرمولاسیون بافر لیز (Lysis Buffer) بسیار اهمیت دارد.
جدول ۳: انتخاب بافر لیز بر اساس محل پروتئین هدف در سلول
|
نمونه |
بافر پیشنهادی |
|
کل سلول (Whole cell) |
NP-40 یا RIPA |
|
پروتئینهای غشایی (Membrane-bound) |
RIPA |
|
سیتوپلاسم (Cytoplasmic) |
Tris-HCl |
|
هسته (Nuclear) |
RIPA یا انجام جداسازی هستهای |
|
میتوکندری (Mitochondria) |
RIPA یا انجام جداسازی میتوکندریایی |
|
اسکلت سلولی (Cytoskeleton) |
Tris-Triton |
دناتوره کردن پروتئینها در وسترن بلات
در بیشتر آزمایشهای وسترن بلات، پروتئینهای موجود در نمونه به کمک حرارت، دترجنت سدیم دودسیل سولفات (Sodium Dodecyl Sulfate – SDS) و عوامل کاهنده (Reducing Agents) مانند بتا-مرکاپتواتانول (β-mercaptoethanol – BME) یا دیتیوتریتول (Dithiothreitol – DTT) به ساختار اولیه (Primary Structure) خود دناتوره میشوند.
(یعنی ساختارهای دوم، سوم و چهارم باز میشوند و پروتئین فقط به صورت یک زنجیره خطی باقی میماند.)
با این حال، بسیار حیاتی و ضروری است که کل زنجیره پلیپپتیدی تمام پروتئینها در همه نمونههایی که قرار است وسترن بلات شوند، کاملاً سالم و دستنخورده باقی بماند
از آنجا که مبنای اصلی جداسازی در اغلب آزمایشهای وسترن بلات، وزن مولکولی (Molecular Weight) پروتئینهاست، رایجترین روش الکتروفورز مورد استفاده، SDS-PAGE است.
در روش SDS-PAGE (Sodium Dodecyl Sulfate–Polyacrylamide Gel Electrophoresis)، پروتئینهای موجود در نمونه بهطور کامل دناتوره (Denatured) میشوند و به ساختار اولیه (Primary structure) خود تبدیل میگردند؛ به این معنا که تمام سطوح بالاتر ساختاری پروتئین (ساختار ثانویه، سوم و چهارم) که مسئول برهمکنشهای پروتئین–پروتئین هستند، از بین میروند (SDS با ایجاد بار منفی یکنواخت و باز کردن ساختار فضایی پروتئین، باعث میشود جداسازی فقط بر اساس اندازه انجام شود).
در مقابل، اگر هدف حفظ برهمکنشهای پروتئین–پروتئین و بررسی کمپلکسهای پروتئینی بهجای پلیپپتیدهای منفرد باشد، از روشهای غیردناتورهکننده (Non-denaturing electrophoresis) مانند Native PAGE استفاده میشود، نه SDS-PAGE در این حالت ساختار طبیعی پروتئین حفظ میشود.
خواص ژلهای پلیآکریلآمید
خواص ژل بر حرکت کمپلکسهای پلیپپتید تأثیر میگذارد. ژلهای SDS PAGE از شبکه پلیمر اکریلامید غیر فعال (Inert) با اندازه حفره مشخص تشکیل شدهاند. این ژلها با پیوند متقابل اکریلامید و بیسآکریلامید و با افزودن عامل پلیمریزاسیون آمونیوم پرسولفات (APS) و کاتالیزور TEMED ساخته میشوند.
اندازه حفره ژل با تغییر غلظت پلیآکریلآمید قابل تنظیم است:
-
ژلهای با درصد پایین: حفرههای بزرگ، امکان عبور اکثر پروتئینها، مناسب پروتئینهای با وزن مولکولی بالا
-
ژلهای با درصد بالا: حفرههای کوچک، محدود کردن عبور پروتئینهای بزرگ، مناسب پروتئینهای با وزن مولکولی پایین
-
ژلهای گرادیان: دارای محدودهای از غلظتهای پلیآکریلآمید، امکان جداسازی همزمان پروتئینها با اندازههای مختلف
جدول ۴: درصد ژل پیشنهادی بر اساس وزن مولکولی پروتئین
|
بازه وزن مولکولی پروتئین |
درصد ژل پیشنهادی |
|
4 – 40 kDa |
20% |
|
12 – 45 kDa |
15% |
|
10 – 70 kDa |
12.5% |
|
15 – 100 kDa |
10% |
|
25 – 100 kDa |
7.5% |
الکتروفورز ژل پروتئین
(Protein Gel Electrophoresis)
پس از آمادهسازی نمونهها، دومین مرحله در آزمایش وسترن بلات (Western blot)، انجام الکتروفورز نمونههای پروتئینی در ژل است.
هدف اصلی از الکتروفورز این است که پروتئین هدف مورد نظر (protein of interest) از سایر پروتئینهای موجود در هر نمونه جدا شود تا بتوان آن را در مراحل بعدی بهدرستی شناسایی و آشکارسازی کرد (بدون این جداسازی، تشخیص اختصاصی پروتئین هدف با آنتیبادیها امکانپذیر نخواهد بود).
نمونههای پروتئینی در دستگاه الکتروفورز برای آنالیز پروتئین و وسترن بلات بارگذاری میشوند.
شکل ۲. الکتروفورز نمونههای پروتئینی
(Figure 2. Electrophoresing protein samples)
در شکل ۲، چهار لاین (Lane) در ژل در حال بارگذاری هستند. یکی از این لاینها مربوط به لدر پروتئینی (Protein ladder) است.
فرض کنید نمونههای موجود در لولههای ۱، ۲ و ۳ پروتئینهایی هستند که از سه جهش ژنتیکی متفاوت در یک سویه باکتریایی استخراج شدهاند. لوله ۴ نمونهی کنترل است؛ یعنی پروتئینهایی که از سویه آزمایشگاهی طبیعی باکتری استخراج شدهاند که این سه جهش در آن وجود ندارد.
هدف شما این است که بررسی کنید یک پروتئین سمی خاص (toxin protein) در اثر این جهشها چگونه بیان میشود و میزان بیان آن را با سویهی بدون جهش مقایسه کنید (یعنی بررسی تأثیر جهشهای ژنتیکی بر سطح بیان پروتئین هدف).
در اغلب ایمونوبلاتها (Immunoblots)، هنگام الکتروفورز، یک (Protein ladder) نیز در یکی از چاهکهای ژل بارگذاری میشود.
شکل ۳. ظاهر ژل پس از الکتروفورز
(Protein gel after electrophoresis)
همانطور که در شکل ۳ نشان داده شده است، پس از پایان الکتروفورز، ژل معمولاً چنین ظاهری دارد:
باندهای لدر پروتئینی قابل مشاهده هستند، اما باندهای مربوط به پروتئینهای نمونه هنوز دیده نمیشوند (زیرا هنوز مرحلهی انتقال و آشکارسازی انجام نشده است
انتقال پروتئینها از ژل به غشاء (Gel-to-membrane transfer)
پس از انجام الکتروفورز، مرحله بعدی در ایمونوبلات (Western blot)، انتقال پروتئینها از ژل به یک غشاء (membrane) است. بعد از انتقال، پروتئینهایی که روی ژل الکتروفورز شدهاند، روی غشاء ثابت شده و غیرفعال میشوند تا امکان شناسایی و تحلیلهای بعدی فراهم شود.
تشبیه ساده برای درک مرحله بلاتینگ (Blotting)
میتوانید این مرحله را با استفاده از یک تشبیه ساده تصور کنید:
فرض کنید یک حوله کاغذی (paper towel) دارید که میخواهید با آن مایع ریخته شده روی میز غذاخوری (مثلاً آب پرتقال) را جذب یا «بلات» کنید.
در این تشبیه:
-
ژل مانند میز غذاخوری است.
-
مایع ریخته شده مانند نمونه پروتئین است.
-
غشاء مانند حوله کاغذی است که پروتئینها را جذب میکند.
بنابراین، پروتئینها از ژل الکتروفورز شده به غشاء وسترن بلات (Western blot membrane) منتقل میشوند.
اگر پروتئینها بدون انجام الکتروفورز مستقیماً روی غشاء بلات شوند، این روش (Dot blot) نامیده میشود.
-
در Dot blot نمونه پروتئین به صورت یک نقطه روی غشاء قرار میگیرد، برخلاف نوارهای جدا شده در ژل الکتروفورز.
-
این روش سریع است و تنها بررسی میکند که آیا پروتئین هدف در نمونه وجود دارد یا خیر. اگر پاسخ مثبت باشد، معمولاً یک وسترن بلات کامل برای تحلیل دقیق انجام میشود.
اصل پایهای انتقال وسترن بلات
تمام نمونههای پروتئینی قبل از الکتروفورز با سدیم دودسیل سولفات (SDS) پیشپردازش میشوند و در نتیجه پروتئینها بار منفی کلی دارند.
به همین دلیل، وقتی جریان الکتریکی اعمال میشود، پروتئینها به سمت الکترود مثبت (+) حرکت میکنند.
با استفاده از این ویژگی، چیدمان پایهای انتقال به شکل زیر انجام میشود:
-
ژل به طور مستقیم روی غشاء قرار میگیرد.
-
ژل در سمت الکترود منفی (-) و غشاء در سمت الکترود مثبت (+) قرار میگیرند.
-
بین ژل و الکترود منفی و همچنین بین غشاء و الکترود مثبت، کاغذهای فیلتر (filter papers) قرار میگیرند.
-
از آنجا که کل فرآیند انتقال وابسته به جریان الکتریکی است، کل مجموعه در محلول بافر انتقال (transfer buffer) مرطوب میشود.
نکته مکانیزمی: بافر انتقال جریان الکتریکی را به راحتی هدایت میکند و در همین حین پروتئینها از ژل به غشاء منتقل میشوند.
نکاتی درباره غشاءهای وسترن بلات
-
غشاءها به صورتی طراحی شدهاند تا به پروتئینها وابستگی و چسبندگی بالایی داشته باشند.
-
این بدان معناست که وقتی پروتئینها به غشاء میرسند، ثابت میشوند و دیگر به سمت الکترود مثبت حرکت نمیکنند.
-
-
غشاءهای وسترن بلات برای تمام انواع پروتئینها یکسان عمل میکنند، بنابراین همه پروتئینها و همچنین پروتئینهای لدر با کارایی یکسان منتقل میشوند.
-
غشاءها معمولاً از نیتروسلولز (nitrocellulose) یا پلیوینیلیدن دیفلوراید (PVDF) ساخته میشوند.
-
PVDF مستحکمتر است و امکان بررسی مجدد پروتئینها (re-probe) را دارد اما گرانتر است.
-
مراحل انتقال وسترن بلات
مرحله ۱: آمادهسازی ژل پس از الکتروفورز
-
پس از الکتروفورز، بخش stacking gel (بخش بالای ژل که برای تمرکز نمونهها است) بریده و دور ریخته میشود، زیرا این بخش دیگر شامل پروتئین نمونه یا نردبان نیست.
-
Resolving gel (بخش جداسازی ژل) با دقت در یک ظرف با بافر انتقال قرار داده میشود.
در این مرحله سه نکته مهم وجود دارد:
-
ژل مرطوب بماند و خشک نشود.
-
ژل در بافر انتقال متعادل شود (Equilibrate).
-
توجه: ترکیب یونی running buffer با transfer buffer متفاوت است، بنابراین برای انتقال صحیح، بافر انتقال باید جایگزین بافر اولیه حتی در داخل ژل شود.
-
-
هیچ چیزی، حتی دست شما که ممکن است پروتئین داشته باشد، نباید ژل را آلوده کند.
مرحله ۲: آمادهسازی غشاء و کاغذهای فیلتر
-
غشاء معمولاً در میان دو لایه پوشش محافظ (enwrapped) قرار دارد.
-
غشاء با قیچی مطابق با اندازه ژل برش داده شده، با انبرک از لایه محافظ خارج میشود و در بافر انتقال برای تعادل قرار میگیرد.
-
کاغذهای فیلتر نیز به همان صورت برش داده شده و در بافر انتقال قرار میگیرند.
مانند ژل، غشاء نباید با دستهای عریان لمس شود تا از هرگونه آلودگی پروتئینی جلوگیری شود.
انتخاب غشاء
غشاءهای رایج برای ایمونوبلاتینگ (Immunoblotting) عبارتند از:
-
نیتروسلولز (Nitrocellulose): توانایی بالایی در ثابت کردن پروتئینها و گلیکوپروتئینها از طریق تعاملات هیدروفوبیک دارد، اما به دلیل شکنندگی نمیتوان آن را چند بار استفاده مجدد کرد.
-
PVDF (Polyvinylidene Difluoride): ظرفیت اتصال پروتئین بالایی دارد، هیدروفوبیک بالا است و باید قبل از استفاده با متانول (Methanol) مرطوب شود. این غشاء کمتر شکننده است و میتوان آن را چندین بار استفاده مجدد کرد.
هر دو نوع غشاء در اندازه منافذ مختلف موجود هستند:
-
غشاءهای 0.45 میکرومتر برای اکثر آزمایشها مناسب هستند.
-
غشاءهای 0.1–0.2 میکرومتر برای پروتئینهای کم وزن بهتر عمل میکنند.
مرحله ۳: ساخت (Transfer Sandwich)
پس از آمادهسازی ژل و غشاء، ساندویچ ساخته میشود، همانطور که در شکل 10 نشان داده شده است.
بعد از انتقال پروتئینها، غشاء معمولاً شبیه چیزی است که در شکل 9 نشان داده شده است:
-
این شکل نشان میدهد که غشاء پس از انتقال چگونه به نظر میرسد.
-
لدر پروتئینی (ladder lane) قابل مشاهده است، اما نمونههای واقعی که به غشاء منتقل شدهاند هنوز قابل دیدن نیستند زیرا پروتئینها بدون رنگآمیزی یا آنتیبادی هنوز نامرئیاند.
انتقال مرطوب (Wet) در مقابل نیمهخشک (Semi-dry)
دو روش اصلی برای انتقال وجود دارد: مرطوب (wet transfer) و نیمهخشک (semi-dry transfer).
انتقال مرطوب (Wet transfer)
در روش مرطوب، ساندویچ انتقال در یک تانک پر از بافر انتقال قرار میگیرد. این تانک دارای دو الکترود است که جریان الکتریکی از آنها عبور میکند.
-
ساندویچ به صورت: اسفنج – کاغذ فیلتر – ژل – غشاء – کاغذ فیلتر – اسفنج چیده میشود و در کاست (cassette) قرار میگیرد، سپس کاست در تانک بافر قرار داده میشود (شکل ۸).
ویژگیهای این روش:
-
انتقال پروتئینها بهویژه پروتئینهای بزرگ، کارایی بالاتری دارد.
-
وجود حجم زیاد بافر، جریان یکنواخت و پایدار جریان الکتریکی را تضمین میکند.
-
میتوان تانک را در اتاق سرد قرار داد تا حرارت ناشی از جریان الکتریکی و گرمایش بافر و ساندویچ کاهش یابد.
انتقال نیمهخشک (Semi-dry transfer)
در روش نیمهخشک، ساندویچ انتقال شامل: کاغذ فیلتر – ژل – غشاء – کاغذ فیلتر، که در بافر مرطوب شده، مستقیماً بین دو الکترود قرار میگیرد.
-
در این روش، ساندویچ مرطوب است، اما در بافر غوطهور نمیشود.
تشبیه ساده:
-
میتوان این روش را مانند ساخت یک ساندویچ پرس شده تصور کرد.
-
دو سطح دستگاه پرس، مانند الکترودهای مثبت و منفی هستند.
-
فیلترها مانند دو تکه نان، ژل مانند یک لایه گوشت سرد (deli meat) و غشاء مانند یک لایه پنیر است. کل ساندویچ با بافر انتقال (مثل سس یا مایع ساندویچ) مرطوب میشود.
ویژگیهای این روش:
-
سریعتر و ارزانتر است زیرا بافر کمتری مصرف میکند.
-
اما خطر خشک شدن یا گرم شدن بیش از حد ساندویچ در طول انتقال وجود دارد.
جمعبندی:
-
روش مرطوب مانند پخت آهسته و دقیق است و بازده بالا دارد.
-
روش نیمهخشک سریع و کمهزینه است، اما کنترل حرارت و یکنواختی انتقال کمتر است.
فرآیند شناسایی پروتئین در وسترن بلات
پس از انتقال پروتئینها، مرحله شناسایی پروتئین آغاز میشود که شامل سه مرحله اصلی است:
-
مسدود کردن غشاء (Blocking)
-
انکوبه کردن با آنتیبادیها (Antibody incubation)
-
توسعه و آشکارسازی غشاء (Developing) برای مشاهده و تجسم نهایی
-
اغلب مرحله رنگآمیزی کل پروتئینها (Total protein staining) قبل از مسدودسازی انجام میشود تا میزان کلی پروتئین انتقالیافته مشخص شود.
شروع شناسایی واقعی
-
پس از مرحله اختیاری رنگآمیزی کل پروتئینها، مراحل شناسایی واقعی آغاز میشود که با مسدودسازی غشاء شروع میگردد.
مسدودسازی (Blocking)
قبل از انجام مراحل (Antibody treatments) برای شناسایی پروتئین هدف، غشاء با یک محلول پروتئینی مانند آلبومین سرم گاوی (Bovine Serum Albumin – BSA) یا شیر خشک بدون چربی (Non-fat dry milk) مسدود میشود.
-
هدف این کار جلوگیری از اتصال غیر اختصاصی (Non-specific binding) یا نویز (Noise) است.
-
به عبارت دیگر، این مرحله باعث میشود که آنتیبادیها فقط به پروتئین هدف بچسبند و به سایر پروتئینها متصل نشوند.
-
توضیح مکانیزمی ساده:
-
همانطور که در شکل 15 نشان داده شده است، آنتیبادی اولیه (Primary Antibody) میتواند به پروتئین هدف (با رنگ آبی تیره) متصل شود، زیرا وابستگی بسیار خاص و قوی دارد.
-
سایر پروتئینهای غیر هدف نمیتوانند به آنتیبادی اولیه متصل شوند، زیرا محلول مسدودکننده تمام محلهای اتصال غیر اختصاصی آنتیبادی اولیه را اشغال میکند.
-
نتیجه: نسبت سیگنال به نویز (Signal:Noise) در نتایج وسترن بلات بهبود مییابد.
بررسی غشاء با آنتیبادیهای اولیه و ثانویه (Probing)
-
آنتیبادی اولیه (Primary Antibody) مانند پروب عمل میکند و برای شناسایی پروتئین هدف روی غشاء استفاده میشود.
-
آنتیبادی ثانویه (Secondary Antibody) نیز مانند پروب برای شناسایی آنتیبادی اولیه عمل میکند؛ یعنی به آنتیبادی اولیه که به پروتئین هدف متصل است میچسبد.
-
به همین دلیل، فرآیند تریتمنت غشاء با آنتیبادیها برای شناسایی پروتئین هدف را probing مینامند.
شکل 15 این فرآیند را نشان میدهد:
-
پروتئین هدف روی غشاء مشخص میشود.
-
آنتیبادی اولیه به پروتئین هدف متصل میشود.
-
آنتیبادی ثانویه به آنتیبادی اولیه متصل شده و امکان مشاهده سیگنال را فراهم میکند.
آزمایش نهایی شناسایی: توسعه ایمونوبلات برای تحلیل تصویری (Developing)
پس از تریتمنت با آنتیبادی ثانویه، مرحله نهایی، آزمایش شناسایی (Detection Assay)است.
سه روش اصلی شناسایی پروتئین:
-
فلورومتریک (Fluorometric) – تولید سیگنال فلورسانس (نور ساطع شده پس از تحریک با نور خاص)
-
شیمیلومینسانس (Chemiluminescent) – تولید نور از واکنش شیمیایی
-
کروموژنی (Chromogenic) – ایجاد رنگ قابل مشاهده به چشم
-
یکی از این سه روش به آنتیبادی متصل میشود تا سیگنال نهایی تولید شود (شکل ۱۱).
توضیح کوتاه: این مرحله به شما امکان میدهد پروتئین هدف را به صورت بصری روی غشاء مشاهده کنید و شدت سیگنال میتواند مقدار پروتئین هدف را نیز نشان دهد.
برچسبگذاری مستقیم و غیرمستقیم در وسترن بلات
قبل از انجام وسترن بلات، تحقیق دقیق درباره پروتئین هدف بسیار مهم است. در وسترن بلات سنتی (برچسبگذاری غیرمستقیم)، ابتدا نمونههای پروتئینی توسط الکتروفورز ژل پلیآکریلآمید با استفاده از SDS-PAGE جداسازی میشوند و سپس به طور الکتروفورز به غشا منتقل میشوند. پس از یک مرحله مسدودسازی، غشا با آنتیبادی اولیهای که علیه آنتیژن مورد نظر ساخته شده است، رنگآمیزی میشود. پس از یک مرحله شستشو، معمولاً غشا با آنتیبادی ثانویه متصل به آنزیم یا فلوروفور رنگآمیزی میشود. در صورت استفاده از تشخیص فلوروسنت، آنتیبادی ثانویه متصل به فلوروفور به جای آنزیم استفاده میشود.
در تحلیل برچسبگذاری مستقیم، از آنتیبادیهای اولیه متصلشده به طور مستقیم (مانند آنتیبادیهای HRP متصلشده) استفاده میشود که نیاز به مرحله آنتیبادی ثانویه را حذف کرده و پروتکل را سادهتر، سریعتر و زمان رسیدن به نتایج را کاهش میدهد.
تشخیص ایمونو بلات
چندین گزینه مختلف برای خواندن نتایج وسترن بلات وجود دارد. هرکدام مزایا و معایب خاص خود را دارند که بسته به نیاز شما و تجهیزات موجود در آزمایشگاه قابل انتخاب است.
تشخیص کولوریمتریک (colorimetric western blotting)
تشخیص کولوریمتریک به تولید یک محصول رنگی بستگی دارد که روی وسترن بلات رسوب میکند و این محصول پس از تبدیل یک سابسترا کروموژنیک توسط یک آنزیم مناسب تشکیل میشود.
تشخیص فلورومتریک (fluorometric western blotting)
تشخیص فلورومتریک نیاز به استفاده از آنتیبادیهایی دارد که به یک فلوروفور متصل شدهاند. یک منبع نور برای تحریک فلوروفور استفاده میشود و نور تولید شده در طول موج بالاتری منتشر میشود و توسط یک دستگاه مخصوص شناسایی میشود.
تشخیص شیمیلومینسنت (chemiluminescent western blotting)
شیمیلومینسنس زمانی اتفاق میافتد که یک آنزیم یک سابسترا را کاتالیز میکند و نور به عنوان یک محصول جانبی از واکنش تولید میشود. این فرآیند از آن جهت مناسب است که حساسیت بالایی دارد و سیگنال تولید شده برای مدت زمان طولانی پایدار است.
برای مشاهده سیگنال نوری، میتوانید از یک دستگاه توسعهدهنده استفاده کنید، اگر با فیلمهای ایکسری کار میکنید، یا از دستگاه دوربین وسترن بلات که نیازی به فیلم ایکسری ندارد، استفاده کنید.
مشکل یابی وسترن بلات
باندهای پخششده (Diffuse Bands)
علتهای احتمالی:
-
غلظت آنتیبادی بیشازحد
-
پروتئین اضافی روی ژل
-
انتقال پروتئین خیلی سریع بوده و یا ژل در طول الکتروفورز بیشازحد داغ شده است
راهحلها:
-
غلظت آنتیبادی را کاهش دهید.
-
مقدار پروتئین کل بارگذاریشده روی ژل را کاهش دهید.
-
زمان انتقال را افزایش دهید و از سیستم سرمایشی برای الکتروفورز استفاده کنید.
مشکل
باندهای غیر اختصاصی (Nonspecific Bands)
علتهای احتمالی:
-
باندهای پروتئین غیر اختصاصی به دلیل SDS
-
تفاوتهای تدریجی در پروفایلهای بیان پروتئین به دلیل پاساژهای مکرر خطوط سلولی
-
نمونه پروتئین تجزیهشده
-
حضور پروتئینهای جدید یا اسپلیس واریانتهای مختلف با اپیتوپهای مشابه
-
حضور ناخالصیها در آنتیبادی
-
تشکیل مولتیمرها (Multimers) روی هدف پروتئین
-
تشکیل زیرگروههای مختلف پروتئین که وزن مولکولی متفاوتی دارند
-
حضور لوکوسهای مولفههای متعدد در پروتئین
-
غلظت آنتیبادی اولیه بیشازحد
-
باندهای غیر اختصاصی به دلیل آنتیبادی ثانویه
-
پروتئین اضافی روی ژل
-
شستوشوی ناکافی
-
مشکل در فرآیند بلوک کردن (Blocking)
راهحلها:
-
پس از انتقال، باندها را شستوشو دهید و از SDS استفاده نکنید.
-
به خط سلولی اصلی (غیرفاقد پاساژ) بازگشته و سپس نمونههای خط سلولی فعلی و اصلی را بهطور همزمان بررسی کنید.
-
از نمونه تازه استفاده کرده و از مهارکننده پروتئاز استفاده کنید.
-
در ادبیات علمی به دنبال گزارشات دیگر بگردید و یک جستوجوی BLAST انجام دهید.
-
از آنتیبادی مونوکلونال استفاده کرده و آن را با روش آفینیتی (Affinity) تصفیه کنید.
-
قبل از انجام SDS-PAGE، پروتئین را به مدت ۱۰ دقیقه بجوشانید تا مولتیمرها از بین بروند.
-
ادبیات علمی را بررسی کرده و از تحلیلهای بیوانفورماتیک برای برآورد اندازه صحیح پروتئین استفاده کنید.
-
از تحلیلهای بیوانفورماتیک برای تأیید حضور لوکوسهای اصلاحی (Modifier locus) و وزن مولکولی آنها استفاده کنید.
-
غلظت آنتیبادی اولیه را کاهش دهید.
-
از نشانگرهای فلورسنت (Fluorescence labels) روی آنتیبادی اولیه استفاده کنید.
-
مقدار پروتئین کل بارگذاریشده روی ژل را کاهش دهید.
-
تعداد شستوشوها را افزایش دهید.
-
زمان بلوک کردن را افزایش دهید و انتخاب ماده بلوککننده را بهینه کنید.
مشکل
سیگنال ضعیف یا عدم مشاهده سیگنال از باند (Weak or No Signal from the Blot)
علتهای احتمالی:
-
مرحله شناسایی (Detection step) فراموش شده یا مواد شناسایی کارایی ندارند.
-
انکوباسیون ناکافی با مواد شناسایی.
-
انتقال ناقص یا ضعیف پروتئین.
-
پروتئین مورد نظر از روی ژل خارج شده است.
-
مواد شناسایی اشتباه اضافه شده یا ظروف نادرست پر شدهاند.
-
نمونه بیشازحد رقیق است.
-
پروتئینها ضعیف به غشاء چسبیدهاند یا جذب ضعیفی دارند.
-
آنتیبادی اولیه یا ثانویه غیرفعال یا رقیق است.
راهحلها:
-
پس از پایان فرآیند بلات، مرحله شناسایی را با استفاده از مواد شناسایی استاندارد و پروتکل خود انجام دهید و از کارایی مواد شناسایی اطمینان حاصل کنید.
-
پس از تکمیل شناسایی، غشاء را از مواد شناسایی خارج کرده و سیگنال بهدست آمده را بررسی کنید.
-
اطمینان حاصل کنید که دستگاه انتقال و ساندویچهای غشاء بهدرستی مونتاژ شدهاند و زمانهای انتقال مناسب استفاده میشود. پس از انتقال، غشاء را رنگآمیزی کنید تا کارایی انتقال بررسی شود.
-
از کنترل مثبت (Positive control) و یا نشانگرهای وزن مولکولی برای تطبیق دامنه تفکیک ژل با اندازه پروتئین هدف استفاده کنید.
-
اطمینان حاصل کنید که آنتیبادیهای اولیه و ثانویه در ظروف درست اضافه شدهاند و شمارههای موجود روی ظرف آنتیبادی در تانک و سینی با یکدیگر مطابقت دارند.
-
مقدار بیشتری پروتئین روی ژل بارگذاری کنید یا غلظت پروتئینها را افزایش دهید.
-
از غشاءهایی با ظرفیت مناسب برای چسباندن پروتئینها استفاده کنید. غشاء PVDF را پس از انتقال پروتئین خشک کنید تا چسبندگی پروتئینها بهخوبی حفظ شود.
-
فعالیت آنتیبادی را با انجام رقیقسازی سریالی با استفاده از تمام سینیهای BlotCycler™ یا دات بلات (Dot blot) بررسی کنید و در صورت لزوم، غلظت آنتیبادی را افزایش دهید.
مشکل
پسزمینه بالا روی باند (High Background on the Blot)
علتهای احتمالی:
-
فیلم بیشازحد در معرض نور قرار گرفته یا در هنگام نوردهی مرطوب شده است.
-
زمان بلوک کردن کوتاه یا شدت شستوشو کم است.
-
غلظت آنتیبادی اولیه و یا ثانویه بیشازحد است.
-
پروتئین بیشازحد بارگذاری شده است.
-
غشاء، محلولها، سینیها یا ظروف آنتیبادی آلوده هستند.
راهحلها:
-
زمان نوردهی را کاهش دهید یا به سیگنال اجازه دهید که بیشتر از بین برود. از نشت محلولها با پوشاندن غشاء با فیلم شفاف جلوگیری کنید و قبل از نوردهی، اضافات زیرلایه را از لبهها پاک کنید.
-
زمان بلوک کردن و تعداد شستوشوها را افزایش دهید.
-
غلظت آنتیبادی را با استفاده از رقیقسازی سریالی با تمام سینیهای BlotCycler™ بهینه کنید. در صورت لزوم، غلظت آنتیبادی را کاهش دهید.
-
بارگذاری را کاهش دهید یا غلظت نمونه را رقیق کنید.
-
از شیشههای تمیز و آب تصفیهشده برای تهیه محلولها استفاده کنید. همیشه دستکش تمیز بپوشید. هنگام کار با غشاء از پنس استفاده کنید. پروتکل شستوشو با محلول تمیزکننده را اجرا کرده و غلظت محلول تمیزکننده را دو برابر کنید.
مشکل
اتصال غیر اختصاصی بیشازحد (Non-specific Binding Too High)
علتهای احتمالی:
-
حذف ناکافی SDS یا پروتئینهای ضعیفچسبیده از غشاء پس از بلات.
-
زمان بلوک کردن کوتاه.
-
تمایل آنتیبادی اولیه به استانداردهای پروتئین.
-
پروتئین بیشازحد بارگذاری شده است.
راهحلها:
-
دستورالعملهای صحیح برای آمادهسازی غشاء قبل از شناسایی ایمونولوژیکی را دنبال کنید.
-
زمان بلوک کردن را افزایش دهید.
-
با تولیدکننده استاندارد پروتئین برای همخوانی با آنتیبادی اولیه مشورت کنید.
-
بارگذاری را کاهش دهید یا غلظت نمونه را رقیق کنید.