مدلهای حیوانی در مطالعه تکوین جنین
مقدمه و اهمیت مدلهای حیوانی در پژوهشهای تکوین جنین
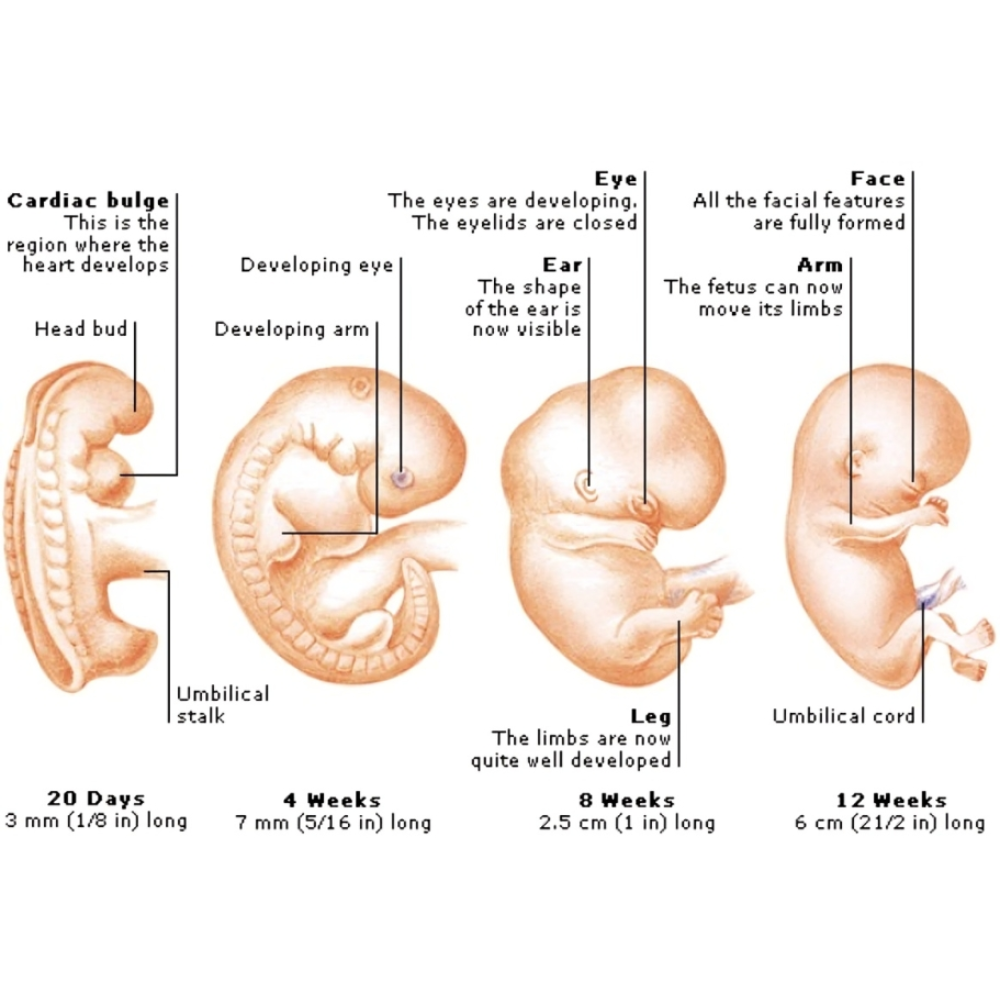
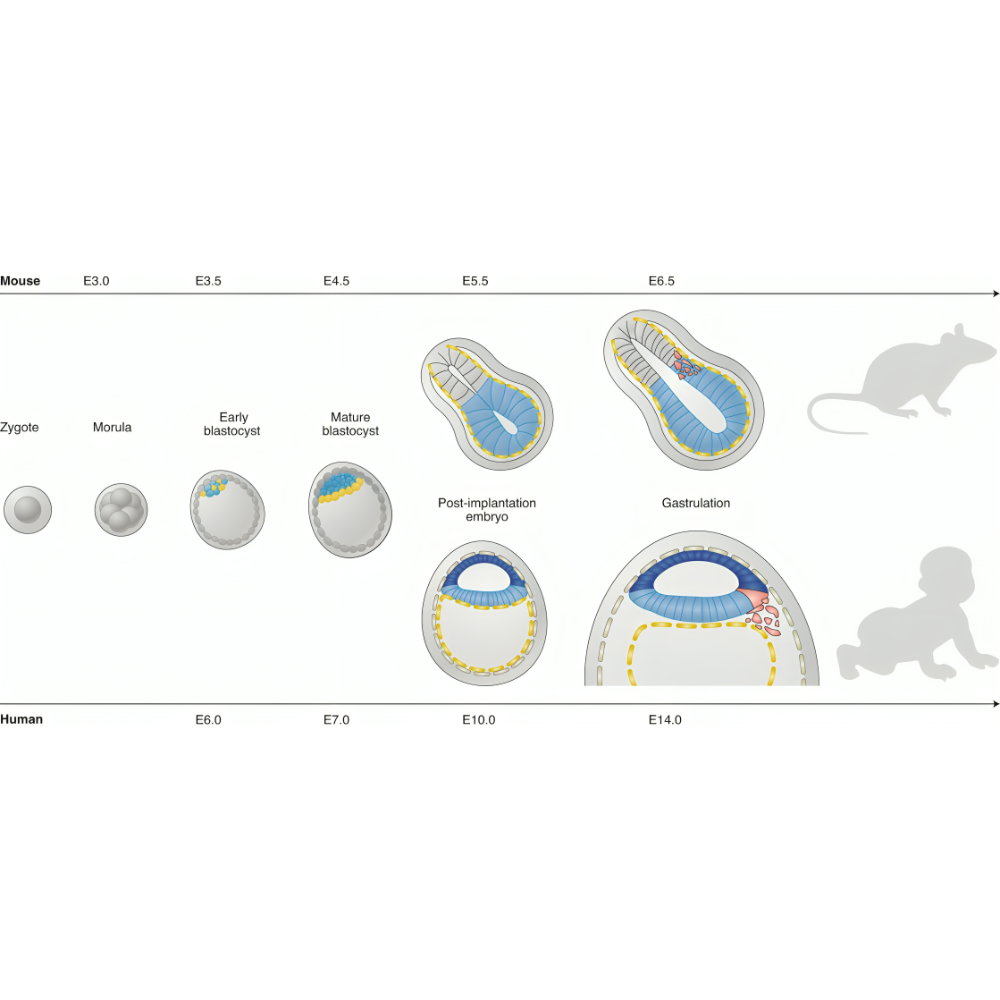
مطالعه تکوین جنین همواره یکی از اساسیترین محورهای پژوهش در زیستشناسی و پزشکی بوده است. فرآیند شکلگیری موجود زنده از یک سلول منفرد تا یک ارگانیسم کامل، مجموعهای پیچیده و هماهنگ از رویدادها را شامل میشود که شامل تقسیم سلولی، تمایز، مهاجرت سلولی، شکلگیری بافتها و اندامها و در نهایت رشد جنین است. شناخت دقیق این فرآیندها نه تنها برای درک اصول بنیادین زیستشناسی ضروری است، بلکه کلید اصلی در تشخیص و درمان بسیاری از بیماریهای مادرزادی، ناباروریها، اختلالات رشدی و مشکلات بارداری محسوب میشود. با این حال، محدودیتهای اخلاقی و عملی در بررسی مستقیم جنین انسان، پژوهشگران را بر آن داشته است که از مدلهای حیوانی برای شبیهسازی و مطالعه این فرآیندها استفاده کنند.
مدلهای حیوانی از دیرباز نقش مهمی در پیشبرد علوم زیستی ایفا کردهاند. استفاده از موجودات سادهای مانند مگس سرکه (Drosophila melanogaster) و کرم C. elegans تا حیوانات پیچیدهتری همچون موش، رت، خرگوش، خوک و حتی نخستیها سبب شده است که درک عمیقتری از چگونگی شکلگیری حیات به دست آید. این مدلها نه تنها به ما کمک کردهاند تا روند طبیعی تکوین را بهتر بشناسیم، بلکه امکان بررسی اختلالات و بیماریهای مرتبط با رشد جنین را نیز فراهم آوردهاند. بهویژه در دوران معاصر که فناوریهای نوین ژنتیکی مانند ویرایش ژنوم با CRISPR-Cas9 و روشهای تصویربرداری پیشرفته توسعه یافتهاند، مدلهای حیوانی بیش از هر زمان دیگری ارزشمند و کاربردی شدهاند.
یکی از دلایل اصلی استفاده از مدلهای حیوانی، شباهتهای ژنتیکی و فیزیولوژیک آنها با انسان است. به عنوان مثال، ژنهای دخیل در بسیاری از مسیرهای تکوینی، در گونههای مختلف بسیار محافظتشدهاند. این بدان معناست که مطالعه عملکرد یک ژن خاص در موش یا زبرا فیش میتواند اطلاعات مهمی درباره نقش آن در تکوین انسان ارائه دهد. به همین دلیل، بسیاری از کشفیات مهم در زمینه تمایز سلولی، رشد عصبی، توسعه جفت، و حتی بیماریهای ژنتیکی و متابولیکی، ابتدا در حیوانات مدل به دست آمده و سپس به مطالعات انسانی تعمیم یافتهاند.
علاوه بر شباهتهای ژنتیکی، مزایای عملی مدلهای حیوانی نیز اهمیت ویژهای دارد. سرعت چرخه زندگی، تعداد زیاد فرزندان، امکان دستکاری ژنتیکی و شرایط قابل کنترل محیطی، از جمله عواملی هستند که پژوهشگران را قادر میسازند آزمایشهای گستردهای انجام دهند که در انسان امکانپذیر نیست. به عنوان نمونه، موشها به دلیل باروری بالا و ژنوم کاملاً شناختهشده، یکی از پرکاربردترین مدلها برای بررسی جنینزایی محسوب میشوند. از سوی دیگر، مدلهای غیرپستاندار مانند زبرا فیش به علت شفاف بودن جنین و رشد سریع، فرصت مشاهده مستقیم روند تکوین را در اختیار پژوهشگران قرار میدهند.
مطالعه جفت به عنوان اندامی حیاتی برای تبادل مواد بین مادر و جنین نیز به شدت وابسته به مدلهای حیوانی است. اختلالات جفتی مانند پرهاکلامپسی یا محدودیت رشد داخل رحمی از دلایل مهم مرگومیر مادران و نوزادان در سراسر جهان هستند. اما به دلیل محدودیتهای اخلاقی و فنی، مطالعه مستقیم این بیماریها در انسان دشوار است. به همین علت، مدلهای حیوانی جفتی همچون موش و خرگوش ابزارهای ارزشمندی برای درک بهتر پاتوفیزیولوژی این اختلالات به شمار میروند و در توسعه درمانهای بالقوه نقش بسزایی دارند.
نکته مهم دیگری که اهمیت مدلهای حیوانی را برجسته میسازد، بررسی اثرات داروها، مواد شیمیایی و عوامل محیطی بر جنین است. دوران جنینی به دلیل حساسیت بالا، بیش از هر مرحلهای از زندگی در معرض آسیبهای محیطی قرار دارد. آزمایش مستقیم داروها یا مواد جدید بر روی جنین انسان امکانپذیر نیست، بنابراین حیوانات بهعنوان مدلهای آزمایشی برای ارزیابی ایمنی و سمیت مورد استفاده قرار میگیرند. بهطور مثال، اثر نانوذرات بر سیستم تولیدمثلی و رشد جنینی ابتدا در مدلهای حیوانی مانند موش و زبرا فیش مورد بررسی قرار گرفته و سپس به نتایج انسانی تعمیم داده میشود.
همچنین مدلهای حیوانی بستری مناسب برای درک ارتباط بین ژنتیک و محیط در تکوین جنین فراهم میآورند. امروزه روشن شده است که نه تنها ژنها، بلکه عوامل محیطی و سبک زندگی والدین نیز بر سلامت نسل بعد تأثیرگذار هستند. مطالعات حیوانی نشان دادهاند که عواملی مانند تغذیه پدر و مادر، مصرف دخانیات، استرس یا قرار گرفتن در معرض آلایندهها میتواند از طریق تغییرات اپیژنتیک بر تکوین جنین اثر بگذارد. این یافتهها پیامدهای مهمی برای سلامت عمومی و سیاستهای پیشگیری از بیماریها دارند.
در نهایت باید تأکید کرد که استفاده از مدلهای حیوانی صرفاً به دلیل محدودیتهای اخلاقی در مطالعه انسان نیست، بلکه این مدلها امکان کشف اصول جهانی زیستشناسی را نیز فراهم میکنند. اصولی که از طریق مطالعه در حیوانات کشف میشوند، غالباً به صورت بنیادین در گونههای مختلف مشترک هستند. از این رو، مدلهای حیوانی پلی میان پژوهشهای پایه و کاربردهای بالینی ایجاد میکنند و به توسعه روشهای درمانی نوین برای اختلالات جنینی و بیماریهای مادرزادی کمک شایانی مینمایند.
با توجه به آنچه بیان شد، روشن است که مدلهای حیوانی بخش جداییناپذیر پژوهشهای تکوین جنین محسوب میشوند. از یک سو، آنها ابزارهای قدرتمندی برای درک فرآیندهای طبیعی رشد و نمو جنین هستند و از سوی دیگر، به ما اجازه میدهند عوامل بیماریزا و محیطی را در محیطی کنترلشده بررسی کنیم. اگرچه استفاده از حیوانات در پژوهش همچنان با ملاحظات اخلاقی همراه است و تلاشهایی برای جایگزینی یا کاهش آنها در جریان است، اما در حال حاضر مدلهای حیوانی همچنان یکی از اساسیترین ابزارها برای مطالعه جنین و آینده سلامت انسان باقی ماندهاند.
مدلهای حیوانی کلاسیک و مدرن در پژوهشهای تکوین جنین
در طول تاریخ زیستشناسی رشد، پژوهشگران برای درک چگونگی تکوین موجودات زنده از مدلهای گوناگون حیوانی استفاده کردهاند. انتخاب این مدلها هرگز تصادفی نبوده است، بلکه بر اساس ویژگیهای خاص بیولوژیکی، ژنتیکی و فیزیولوژیکی هر گونه صورت گرفته است. برخی از این مدلها که بهعنوان مدلهای حیوانی کلاسیک شناخته میشوند، قدمتی طولانی در پژوهشهای زیستی دارند و بنیانهای اصلی دانش ما از جنینزایی را شکل دادهاند. در مقابل، طی دهههای اخیر با پیشرفتهای فناورانه و افزایش نیازهای علمی، گونههای دیگری نیز به کار گرفته شدهاند که به آنها مدلهای مدرن گفته میشود. این مدلها ابزارهایی جدید با قابلیتهای پیشرفته فراهم کردهاند که میتوانند شکاف میان پژوهشهای پایه و کاربردهای بالینی را کاهش دهند.
در میان مدلهای کلاسیک، موش جایگاهی بیبدیل دارد. این حیوان کوچک با چرخه تولیدمثل کوتاه، تعداد زیاد نوزادان در هر زایمان و ژنوم کاملاً توالییابی شده، به یکی از پرکاربردترین ابزارها برای مطالعه تکوین جنین بدل شده است. یکی از مهمترین مزایای موش، امکان دستکاری ژنتیکی گسترده آن است. تکنیکهای ایجاد موشهای ترانسژنیک یا ناکاوت سبب شدهاند که پژوهشگران بتوانند نقش ژنهای خاص را در مراحل مختلف تکوین بررسی کنند. از سوی دیگر، شباهتهای فیزیولوژیکی قابل توجه میان موش و انسان، یافتههای حاصل از این مدل را برای مطالعات پزشکی ارزشمند ساخته است.
رت نیز یکی دیگر از مدلهای مهم کلاسیک است. اگرچه نسبت به موش کمتر در مطالعات تکوینی مورد استفاده قرار گرفته، اما به دلیل اندازه بزرگتر جنین و سهولت دسترسی به نمونهها، در برخی حوزهها بهویژه در مطالعه رشد مغزی و سیستم عصبی اهمیت ویژهای دارد. در گذشته، بسیاری از داروهای تأییدشده برای استفاده انسانی ابتدا در رتها آزمایش شدهاند تا ایمنی آنها در دوران بارداری بررسی شود.
در میان گونههای کلاسیک، خرگوش و خوکچه هندی نیز جایگاه خاصی دارند. خرگوشها با چرخه بارداری کوتاه و دسترسی آسان، برای مطالعه فرآیندهای جفتی و بررسی اثر داروها بر رشد جنین به کار رفتهاند. خوکچههای هندی به دلیل برخی شباهتهای متابولیکی و هورمونی با انسان در بررسیهای غدد درونریز و تکوین جفت مورد توجه قرار گرفتهاند. این گونهها بهویژه در نیمه اول قرن بیستم نقشی کلیدی در کشف اصول پایه رشد و تکامل داشتند.
اما برای شبیهسازی بهتر جنینزایی انسانی، استفاده از مدلهای حیوانی بزرگ اهمیت زیادی یافته است. حیواناتی مانند خوک، گوسفند و گاو، به دلیل اندازه بزرگتر جنین، طول دوره بارداری مشابه با انسان، و ساختار جفت نزدیکتر به انسان، بهعنوان مدلهای ارزشمند در پژوهشهای پیشرفته شناخته میشوند. در این گونهها امکان بررسی دقیقتر فرآیندهای پیچیده جفتی، محدودیت رشد داخل رحمی و حتی آزمایش روشهای نوین درمانی وجود دارد. بهطور مثال، گوسفندها بارها در مطالعات مربوط به تبادل گازها، گردش خون جنینی و اختلالات بارداری به کار گرفته شدهاند. خوکها نیز به دلیل تشابه فیزیولوژیکی با انسان در زمینه قلب و عروق و دستگاه گوارش، مورد استفاده گسترده قرار گرفتهاند.
از سوی دیگر، نباید نقش مدلهای غیرپستاندار مانند زبرا فیش را نادیده گرفت. این موجود کوچک آبزی به دلیل شفافیت بدن در دوران جنینی، رشد سریع، و امکان مشاهده مستقیم تقسیمات و تمایز سلولی، یکی از محبوبترین مدلها برای مطالعه تکوین به شمار میرود. افزون بر این، زبرا فیش بهخوبی به دستکاری ژنتیکی پاسخ میدهد و امکان بررسی نقش ژنها در روند رشد را فراهم میکند. پژوهشهای گستردهای درباره اثر نانوذرات، داروها و عوامل محیطی بر رشد جنین با استفاده از این مدل انجام شده است. از سوی دیگر، کشفیات مهمی در حوزه سیگنالینگ سلولی و مسیرهای رشد، مانند مسیر Wnt، ابتدا در زبرا فیش شناسایی شدهاند.
در میان مدلهای مدرن، موشهای انسانیسازیشده جایگاه ویژهای پیدا کردهاند. این مدلها با دستکاری ژنتیکی یا پیوند سلولهای انسانی به موش، امکان مطالعه بیماریها و فرآیندهای تکوینی انسانی را در یک بستر زنده فراهم میکنند. به عنوان مثال، ایجاد موشهای دارای سیستم ایمنی انسانیسازیشده به پژوهشگران اجازه داده است تا واکنشهای ایمنی در دوران بارداری و نقش آن در سلامت جنین را بهتر درک کنند. این دستاوردها در توسعه درمانهای نوین برای بیماریهای عفونی و خودایمنی دوران بارداری اهمیت چشمگیری دارند.
از دیگر ابزارهای مدرن میتوان به ارگانوئیدها اشاره کرد. اگرچه ارگانوئیدها بهطور مستقیم مدل حیوانی محسوب نمیشوند، اما بهعنوان سیستمهای تکمیلی برای مدلهای حیوانی مورد استفاده قرار میگیرند. ارگانوئیدها با تقلید ساختار و عملکرد اندامهای جنینی در محیط آزمایشگاه، به پژوهشگران اجازه میدهند مکانیسمهای سلولی و مولکولی را در شرایط کنترلشده بررسی کنند. ترکیب دادههای حاصل از ارگانوئیدها با مطالعات حیوانی، تصویری کاملتر از تکوین ارائه میدهد.
توسعه فناوریهای نوین مانند ویرایش ژنوم با CRISPR یا روشهای تصویربرداری زنده نیز سبب شدهاند مدلهای حیوانی کلاسیک کارایی بیشتری پیدا کنند. امروزه میتوان تغییرات ژنتیکی خاصی را در جنین موش یا زبرا فیش ایجاد کرد و در لحظه تأثیر آنها بر روند رشد را مشاهده نمود. این توانایی، افقهای تازهای برای مطالعه بیماریهای مادرزادی، ناباروری و حتی سرطانهای وابسته به رشد گشوده است.
بنابراین میتوان گفت که استفاده از مدلهای حیوانی در پژوهشهای تکوین جنین ترکیبی از سنت و نوآوری است. مدلهای کلاسیک همچون موش، رت و زبرا فیش همچنان ابزارهای اصلی در این حوزه هستند، در حالی که مدلهای مدرن مانند حیوانات بزرگ، موشهای انسانیسازیشده و ارگانوئیدها امکاناتی تازه و بیسابقه در اختیار پژوهشگران قرار دادهاند. در واقع، هر مدل حیوانی مزایا و محدودیتهای خاص خود را دارد و انتخاب صحیح آنها به پرسش پژوهشی مورد نظر بستگی دارد. تنها با استفاده از این تنوع میتوان تصویری جامع از فرآیند پیچیده تکوین جنین به دست آورد و نتایج آن را به سلامت انسان تعمیم داد.
کاربرد مدلهای حیوانی در مطالعه جنین و جفت
تکوین جنین فرآیندی پیچیده و پویاست که بدون تعامل نزدیک و هماهنگ میان جنین و جفت نمیتواند به درستی پیش رود. جفت بهعنوان اندامی حیاتی، نه تنها وظیفه انتقال اکسیژن و مواد غذایی از مادر به جنین را بر عهده دارد، بلکه به تنظیم هورمونی، ایمنی و حتی سیگنالدهی بین دو موجود زنده کمک میکند. اختلال در عملکرد جفت میتواند پیامدهای جدی برای سلامت جنین و مادر به همراه داشته باشد، از جمله پرهاکلامپسی، محدودیت رشد داخل رحمی، سقط جنین و حتی عوارض بلندمدت بر سلامت کودک در دوران بزرگسالی. از آنجا که مطالعه مستقیم این فرآیندها در انسان به دلیل ملاحظات اخلاقی و عملی بسیار دشوار است، مدلهای حیوانی ابزارهای ارزشمندی برای درک مکانیسمهای جفتی و رشد جنینی به شمار میروند.
یکی از مهمترین دلایل استفاده از مدلهای حیوانی در مطالعه جفت، تنوع ساختاری و عملکردی جفت در گونههای مختلف است. اگرچه جفت انسان ویژگیهای خاصی دارد، اما بسیاری از اصول زیربنایی آن در حیوانات نیز مشترک هستند. بهعنوان مثال، جفت موش و انسان هر دو به گروه «هموکروریال» تعلق دارند؛ یعنی لایههای سلولی میان خون مادر و خون جنین نسبتاً نازک است و تبادل مواد بهطور مستقیم صورت میگیرد. این شباهت موجب شده است که موش به یکی از رایجترین مدلها برای مطالعه تکوین جفت و بررسی اختلالات مربوط به آن تبدیل شود.
مطالعات انجامشده بر روی موشها نشان دادهاند که بسیاری از ژنهای کلیدی در رشد جفت انسان در این حیوان نیز فعال هستند. به همین دلیل، پژوهشگران از موشهای ترانسژنیک یا ناکاوت برای شناسایی ژنهای ضروری در تشکیل جفت استفاده میکنند. این مطالعات کمک کردهاند تا مسیرهای سیگنالدهی حیاتی مانند Wnt، Notch و VEGF در فرآیند آنژیوژنز جفتی و توسعه عروق جنینی مشخص شوند. به عنوان نمونه، اختلال در مسیر Wnt نه تنها بر تشکیل جفت اثر میگذارد، بلکه پیامدهایی جدی برای رشد استخوانها و بافتهای دیگر جنین دارد.
علاوه بر موش، خرگوش و خوک نیز بهعنوان مدلهای ارزشمند در مطالعه جفت شناخته میشوند. خرگوش به دلیل شباهتهای هورمونی و متابولیکی به انسان و امکان مشاهده مستقیم لانهگزینی جنین، بهویژه در پژوهشهای مربوط به آغاز بارداری و تهاجم سلولهای تروفوبلاست اهمیت یافته است. خوکها نیز به دلیل اندازه بزرگتر و دسترسی آسان به بافتهای جفتی، برای مطالعه تغییرات ساختاری و بررسی اثر داروها یا مواد سمی بر جفت به کار میروند.
مدلهای حیوانی همچنین به پژوهشگران امکان دادهاند تا پاسخهای جنسیتی در تکوین جفت را بررسی کنند. مطالعات اخیر نشان دادهاند که جفت جنینهای مذکر و مؤنث ممکن است واکنشهای متفاوتی به استرس، کمبود مواد غذایی یا عفونتها داشته باشند. این تفاوتها نه تنها در رشد جنین بلکه در بروز بیماریهای متابولیکی یا قلبی-عروقی در بزرگسالی نیز تأثیرگذار هستند. بهعنوان مثال، پژوهشهایی در موش نشان دادهاند که محدودیت رشد داخل رحمی در جنینهای مذکر نسبت به مؤنث شدیدتر است، که این یافته پیامدهای مهمی برای درک تفاوتهای جنسی در سلامت دارد.
از دیگر جنبههای مهم استفاده از مدلهای حیوانی، بررسی عملکرد ایمنی جفت است. جفت نه تنها یک سد فیزیکی بلکه یک واسطه ایمنی نیز محسوب میشود. باید میان جنین که از نظر ژنتیکی تا حدی بیگانه با بدن مادر است و سیستم ایمنی مادر نوعی تعادل ایجاد شود. موشهای انسانیسازیشده، که در آنها سلولهای ایمنی انسانی پیوند زده شده است، امکان مطالعه دقیق این فرآیندها را فراهم کردهاند. این مدلها به پژوهشگران کمک میکنند بفهمند چگونه اختلال در سیگنالهای ایمنی ممکن است منجر به سقط جنین یا مشکلات بارداری شود.
مدلهای حیوانی همچنین نقش بسزایی در بررسی بیماریهای جفتی مانند پرهاکلامپسی دارند. در بسیاری از مطالعات، حیوانات با تغییرات ژنتیکی یا تغذیهای خاص دچار شرایطی مشابه پرهاکلامپسی انسانی شدهاند. این مدلها ابزار مهمی برای آزمودن داروهای جدید یا شناسایی بیومارکرهای تشخیصی هستند. بهعنوان مثال، موشهایی که ژنهای تنظیمکننده آنژیوژنز در آنها دستکاری شدهاند، نشانههایی مشابه پرهاکلامپسی انسانی بروز میدهند و امکان بررسی مکانیسمهای مولکولی این بیماری را فراهم میسازند.
علاوه بر جفت، مدلهای حیوانی برای مطالعه مستقیم رشد جنین نیز کاربرد دارند. در حیواناتی مانند زبرا فیش یا قورباغه، مراحل اولیه رشد جنینی بهطور شفاف قابل مشاهده است و پژوهشگران میتوانند روند تقسیم سلولی، مهاجرت و تمایز سلولها را به صورت زنده دنبال کنند. این ویژگی بهویژه در بررسی اثر داروها یا مواد سمی بر رشد اولیه جنین ارزشمند است. برای نمونه، پژوهشهای متعددی اثر مواد مخدر، الکل و نانوذرات بر رشد سیستم عصبی جنین را با استفاده از زبرا فیش بررسی کردهاند.
از سوی دیگر، مدلهای بزرگ مانند گوسفند و گاو این امکان را فراهم میکنند که پژوهشگران فرآیندهای پیچیدهتر مانند گردش خون جنینی، انتقال مواد مغذی از مادر به جنین و اثرات محدودیت رشد داخل رحمی را در شرایطی مشابه انسان مطالعه کنند. در این حیوانات میتوان آزمایشهایی انجام داد که در انسان هرگز امکانپذیر نیست، مانند بررسی مستقیم جریان خون جفتی یا نمونهبرداریهای متوالی از بافتهای جنینی.
ارزش عملی این مطالعات در پزشکی انسانی بسیار گسترده است. یافتههای حاصل از مدلهای حیوانی در زمینه جنین و جفت تاکنون به توسعه راهکارهایی برای پیشگیری یا درمان بسیاری از اختلالات بارداری کمک کردهاند. همچنین، دادههای به دست آمده از این مطالعات به درک بهتر از ریشههای بیماریهای مزمن در بزرگسالی یاری رسانده است، چرا که بسیاری از مشکلات متابولیکی، قلبی یا عصبی در حقیقت ریشه در اختلالات دوران جنینی دارند.
بنابراین، میتوان نتیجه گرفت که مدلهای حیوانی ابزاری بیبدیل در مطالعه جنین و جفت هستند. آنها نه تنها امکان شناخت مکانیسمهای طبیعی رشد و تبادل میان مادر و جنین را فراهم میکنند، بلکه به ما کمک میکنند عوامل بیماریزا، داروها و شرایط محیطی را در یک بستر کنترلشده مورد بررسی قرار دهیم. بدون این مدلها، بسیاری از یافتههای امروز در زمینه تکوین، بیماریهای بارداری و سلامت مادری-جنینی هرگز به دست نمیآمد.
مدلهای حیوانی و بررسی اثر داروها و مواد خارجی
مدلهای حیوانی در بررسی اثر داروها و مواد خارجی بر رشد و تکوین جنین نقش بسیار مهمی ایفا میکنند، چرا که امکان مطالعه مستقیم بر روی انسان نه از نظر اخلاقی و نه از نظر عملی امکانپذیر نیست. از این رو حیوانات آزمایشگاهی به عنوان یک بستر علمی ارزشمند مورد استفاده قرار میگیرند تا اثرات مواد خارجی، داروها و ترکیبات شیمیایی بر رشد جنین و ساختارهای حیاتی بدن بررسی شوند. داروها، مواد شیمیایی و عوامل محیطی میتوانند با مکانیسمهای پیچیدهای همچون تغییر در بیان ژنها، اختلال در مسیرهای سیگنالی یا آسیب مستقیم به سلولها، موجب بروز ناهنجاریهای رشدی یا حتی مرگ جنین شوند. در این میان، مدلهای حیوانی امکان مشاهده مستقیم تغییرات جنینی، مطالعه مراحل مختلف رشد و نیز بررسی پیامدهای کوتاهمدت و بلندمدت را فراهم میکنند.
یکی از زمینههای مهم در این حوزه، تراتوژنز یا ایجاد ناهنجاریهای جنینی ناشی از داروها است. بسیاری از داروهایی که در بارداری مصرف میشوند، توانایی عبور از جفت را دارند و میتوانند به جنین آسیب برسانند. مدلهای حیوانی مانند موش و خرگوش سالهاست که برای بررسی اثر داروهایی همچون تالیدومید، رتینوئیدها یا داروهای ضدصرع به کار میروند. مطالعات نشان دادهاند که در برخی گونهها تالیدومید موجب بروز ناهنجاریهای اندامی شدید میشود، در حالی که در گونههای دیگر چنین تأثیری مشاهده نمیگردد. این تفاوت میان گونهها نشان میدهد که مدل حیوانی باید با دقت و با توجه به شباهتهای فیزیولوژیکی انتخاب شود تا نتایج تا حد امکان قابل تعمیم به انسان باشند.
از سوی دیگر، مواد شیمیایی محیطی و آلایندهها نیز نقش مهمی در اختلالات رشد جنین ایفا میکنند. ترکیباتی مانند فلزات سنگین (سرب و جیوه)، حلالهای صنعتی، آفتکشها و ترکیبات مختلکننده غدد درونریز میتوانند با ورود به بدن مادر، محیط رشد جنین را دچار تغییر کنند. مدلهای حیوانی، بهویژه جوندگان، به دانشمندان اجازه دادهاند که مسیرهای بیوشیمیایی تأثیرگذار بر اثرات این مواد را آشکار سازند. برای نمونه، نشان داده شده است که قرارگیری جنین در معرض بیسفنول A میتواند در شکلگیری دستگاه تناسلی و عملکرد هورمونی اختلال ایجاد کند. این یافتهها نشان میدهد که مدلهای حیوانی پلی میان دانش نظری و کاربردی برای حفاظت از سلامت جنین انسان هستند.
در سالهای اخیر، توجه پژوهشگران به نانوذرات و اثرات آنها بر جنین افزایش یافته است. نانوذرات به دلیل اندازه بسیار کوچک خود توانایی عبور از سدهای بیولوژیکی همچون جفت را دارند و میتوانند وارد محیط جنین شوند. مطالعات بر روی موشها نشان داده است که برخی نانوذرات فلزی میتوانند موجب استرس اکسیداتیو در سلولهای جنینی شوند و فرآیندهای سیگنالی حیاتی برای رشد طبیعی را مختل کنند. همچنین شواهدی وجود دارد که نشان میدهد قرارگیری در معرض نانوذرات میتواند منجر به کاهش وزن جنین، تغییرات در شکلگیری اندامها و حتی افزایش احتمال بروز اختلالات عصبی پس از تولد شود. استفاده از مدلهای حیوانی در این مطالعات نه تنها به روشن شدن مکانیسمهای مولکولی کمک کرده بلکه به تنظیم مقررات ایمنی در استفاده از نانوذرات در صنایع مختلف نیز یاری رسانده است.
نکته مهم دیگر این است که اثر داروها و مواد خارجی تنها به سلامت جنین محدود نمیشود، بلکه پیامدهای بلندمدت پس از تولد را نیز شامل میگردد. برخی از مواد میتوانند اثرات اپیژنتیکی بر جنین بگذارند، به گونهای که تغییرات در الگوهای متیلاسیون DNA یا تغییرات در بیان ژنها تا دوران بزرگسالی باقی بمانند. مطالعات حیوانی در این زمینه نشان دادهاند که قرارگیری در معرض برخی مواد شیمیایی در دوران جنینی میتواند خطر ابتلا به بیماریهای متابولیک، سرطان یا اختلالات رفتاری در بزرگسالی را افزایش دهد. این یافتهها اهمیت حیاتی مدلهای حیوانی را در درک ارتباط میان تجربههای جنینی و پیامدهای سلامت مادامالعمر نشان میدهد.
با این حال، باید توجه داشت که هرچند مدلهای حیوانی اطلاعات ارزشمندی در این زمینه ارائه میدهند، اما محدودیتهایی نیز وجود دارد. گونههای مختلف از نظر مسیرهای متابولیک و حساسیت به مواد خارجی تفاوت دارند. برای مثال، دارویی که در موش موجب ناهنجاری شدید میشود، ممکن است در انسان چنین اثری نداشته باشد. بنابراین نتایج حاصل از مدلهای حیوانی باید همواره با احتیاط تفسیر شوند و به همراه سایر شواهد بالینی و اپیدمیولوژیک در نظر گرفته شوند.
به طور کلی، مطالعه اثر داروها و مواد خارجی بر رشد جنین از طریق مدلهای حیوانی نه تنها به شناسایی عوامل خطرساز کمک میکند بلکه زمینهساز تدوین دستورالعملهای ایمنی و راهکارهای پیشگیرانه در دوران بارداری است. این مطالعات پلی میان علوم پایه و کاربردهای بالینی ایجاد کردهاند و نشان دادهاند که حفاظت از سلامت جنین نیازمند درک عمیق از تعامل میان محیط، داروها و فرآیندهای تکوینی است. در نتیجه، استفاده از مدلهای حیوانی در این حوزه همچنان یک ابزار بیبدیل محسوب میشود که راه را برای ارتقای سلامت نسلهای آینده هموار میسازد.
کاربرد مدلهای حیوانی در تکوین سیستمهای اندامی خاص
کاربرد مدلهای حیوانی در مطالعه تکوین سیستمهای اندامی خاص از مهمترین عرصههای پژوهشی در جنینشناسی به شمار میآید، زیرا رشد و تکامل هر اندام مجموعهای پیچیده از تعاملات ژنتیکی، مولکولی و محیطی است که در بستر موجود زنده قابل بررسی میباشد. انتخاب مدلهای حیوانی مناسب این امکان را فراهم میسازد که مکانیسمهای حاکم بر تشکیل و تمایز هر سیستم اندامی مورد مطالعه قرار گیرد و ارتباط میان اختلالات جنینی و بیماریهای انسانی آشکار شود. در این بخش، نقش مدلهای حیوانی در درک تکوین چندین سیستم کلیدی بدن شامل سیستم عصبی، قلب و عروق، استخوان و غضروف، سیستم تناسلی و ادراری، و همچنین چشم به تفصیل بررسی میشود.
یکی از مهمترین حوزهها، مطالعه تکوین سیستم عصبی و مغز است. مغز و نخاع به دلیل پیچیدگی ساختاری و عملکردی خود نیازمند شبکههای دقیق سیگنالی و فرایندهای سلولی هماهنگ هستند. مدلهایی مانند موش و رت برای بررسی نقش ژنها و مسیرهای سیگنالی در تکامل نورونها و یا مهاجرت سلولی استفاده شدهاند. به عنوان مثال، بررسی نقش میکروگلیا در شکلگیری ارتباطات عصبی در موشها نشان داده است که این سلولها نه تنها در دفاع ایمنی مغز بلکه در تنظیم سیناپسها نیز نقش حیاتی دارند. همچنین مدل زبرا فیش به دلیل شفافیت جنین خود ابزار بینظیری برای مشاهده مستقیم رشد مغز و تشکیل نورونها فراهم کرده است. اهمیت این مطالعات در آن است که اختلال در این مراحل میتواند با بیماریهایی مانند اوتیسم، صرع و اختلالات نوروژنتیکی مرتبط باشد.
در کنار سیستم عصبی، قلب و عروق نیز یکی از نخستین اندامهایی هستند که در جنین شروع به رشد میکنند. مطالعه بر روی مدلهای حیوانی بزرگ مانند خوک و گوسفند به پژوهشگران امکان داده است که مراحل شکلگیری قلب، تشکیل حفرهها و اتصالات عروقی را با دقت دنبال کنند. این مدلها برای درک بیماریهای مادرزادی قلب و نقایص عروقی اهمیت زیادی دارند. برای نمونه، بررسی جهشهای ژنی خاص در موشها توانسته است مکانیسمهای دخیل در بروز نقایص مادرزادی قلبی مانند تترالوژی فالوت را روشن کند. اهمیت دیگر این مطالعات، کاربرد آنها در توسعه روشهای درمانی و جراحی برای بیماران انسانی است، زیرا نتایج حاصل از مدلهای حیوانی راهنمایی برای طراحی مداخلات درمانی فراهم میآورد.
سیستم اسکلتی و غضروفی نیز حوزهای است که مدلهای حیوانی نقشی اساسی در آن ایفا میکنند. رشد استخوانها از طریق مکانیسمهای پیچیدهای مانند استخوانسازی درونغضروفی و مستقیم صورت میگیرد و مسیرهای سیگنالی همچون Wnt، Hedgehog و BMP در این فرایندها دخیل هستند. مطالعات بر روی موشها و مرغها درک عمیقی از این مسیرها به دست دادهاند و نشان دادهاند که تغییرات کوچک در این مسیرها میتواند منجر به بروز اختلالاتی مانند کوتاهقدی، ناهنجاریهای غضروفی یا پوکی استخوان شود. علاوه بر این، استفاده از مدلهای حیوانی در زمینه پزشکی بازساختی و ترمیم استخوان اهمیت یافته است، چرا که امکان آزمایش داروها و بیومواد جدید برای بازسازی بافت استخوانی فراهم میگردد.
سیستم تناسلی و ادراری نیز از دیگر حوزههایی است که بررسی آن در مدلهای حیوانی نتایج ارزشمندی به همراه داشته است. بهویژه، مطالعه فرایندهایی مانند تمایز جنسیتی و شکلگیری دستگاه تناسلی در موشها توانسته است جنبههای ناشناختهای از نقش هورمونها و ژنها را آشکار سازد. برای مثال، مدلهای حیوانی نشان دادهاند که اختلال در مسیرهای هورمونی آندروژنی میتواند منجر به بروز هیپوسپادیاس شود که یکی از شایعترین ناهنجاریهای مادرزادی دستگاه تناسلی مردانه است. همچنین بررسی تأثیر مواد مختلکننده غدد درونریز بر رشد سیستم تناسلی در جوندگان، هشدارهایی جدی درباره اثر این ترکیبات بر سلامت باروری انسان ارائه داده است.
از سوی دیگر، چشم و سیستم بینایی نیز یکی از موضوعات کلیدی در جنینشناسی است که مدلهای حیوانی بهویژه زبرا فیش و موشها نقش بزرگی در روشن ساختن آن داشتهاند. فرایندهای تکوینی مانند تشکیل شبکیه، رشد عروق خونی در چشم و سازماندهی عصب بینایی با کمک این مدلها قابل بررسی شدهاند. این مطالعات نه تنها درک ما را از بیماریهای ژنتیکی مانند رتینیت پیگمنتوزا افزایش دادهاند بلکه زمینهای برای توسعه درمانهای ژنی و دارویی نوین فراهم کردهاند.
در مجموع، کاربرد مدلهای حیوانی در مطالعه تکوین سیستمهای اندامی خاص نشان داده است که هر سیستم بدنی دارای مجموعهای پیچیده از تعاملات ژنتیکی و محیطی است و بدون استفاده از این مدلها شناخت این مکانیسمها امکانپذیر نخواهد بود. مدلهای حیوانی ابزارهای بیبدیلی برای پیوند میان علوم پایه و کاربردهای بالینی هستند و به درک بهتر بیماریهای مادرزادی، کشف اهداف درمانی و توسعه فناوریهای نوین در پزشکی کمک میکنند.
مدلهای انسانیسازی شده و مدلهای پیشرفته
در دهههای اخیر، پیشرفتهای بیوتکنولوژیک و مهندسی ژنتیک منجر به ظهور مدلهای انسانیسازی شده و دیگر مدلهای پیشرفته در پژوهشهای جنینشناسی شده است. این مدلها با هدف ایجاد محیطی نزدیک به شرایط انسانی و شبیهسازی ویژگیهای ژنتیکی، ایمنی و فیزیولوژیکی انسان توسعه یافتهاند. استفاده از این مدلها امکان مطالعه دقیق فرآیندهای تکوین جنین، پاسخ به داروها و مواد خارجی، و بررسی بیماریهای ژنتیکی و مادرزادی را فراهم میکند. در واقع، مدلهای پیشرفته نقطه تلاقی بین مدلهای کلاسیک حیوانی و مطالعات بالینی انسانی هستند و به پژوهشگران اجازه میدهند تا شکاف بین علوم پایه و کاربردهای پزشکی را پر کنند.
یکی از شاخصترین نمونههای مدلهای انسانیسازی شده، موشهای دارای سیستم ایمنی انسانیسازی شده هستند. در این مدلها سلولهای بنیادی انسانی یا سلولهای ایمنی بالغ انسانی به موشهای خاصی پیوند زده میشوند و موش در نتیجه یک سیستم ایمنی انسانی فعال پیدا میکند. این مدلها امکان مطالعه تعامل میان جنین و سیستم ایمنی مادر، پاسخ به عفونتها و واکنشهای ایمنی به داروها را فراهم میکنند. پژوهشها نشان دادهاند که این مدلها ابزار ارزشمندی برای بررسی مکانیسمهای ایمنی در دوران بارداری و نقش اختلالات ایمنی در مشکلات رشد جنین هستند.
مدلهای انسانیسازی شده ژنتیکی نیز به طور گسترده در پژوهشهای جنینی کاربرد دارند. این مدلها با جایگزینی ژنهای موش با نسخههای انسانی، یا دستکاری مسیرهای سیگنالی برای شبیهسازی شرایط انسانی، امکان مطالعه بیماریهای ژنتیکی مادرزادی، اختلالات متابولیک و اثر داروها را فراهم میکنند. به عنوان مثال، مدلهای موش انسانیسازی شده در حوزه اختلالات قلبی و نورولوژیک به ما اجازه دادهاند تا اثر جهشهای ژنتیکی خاص را در تکوین اندامها بررسی کنیم و مسیرهای درمانی مناسب طراحی کنیم.
در کنار موشهای انسانیسازی شده، ارگانوئیدها و سیستمهای سهبعدی مبتنی بر سلولهای انسانی، نمونهای از مدلهای پیشرفته هستند که درک ما از تکوین جنین را تغییر دادهاند. ارگانوئیدها اندامهای مینیاتوری در محیط آزمایشگاهی هستند که ویژگیهای ساختاری و عملکردی اندامهای واقعی را تقلید میکنند. این سیستمها به پژوهشگران امکان میدهند تا رشد سلولی، تعاملات سلولی و پاسخ به عوامل محیطی یا دارویی را در شرایطی کنترلشده مطالعه کنند. ترکیب ارگانوئیدها با مدلهای حیوانی، تصویری جامع از فرآیندهای تکوین جنین و مکانیسمهای مولکولی ارائه میدهد که پیش از این قابل دستیابی نبود.
یکی دیگر از فناوریهای پیشرفته، ویرایش ژنوم با CRISPR/Cas9 است که امکان ایجاد تغییرات دقیق در ژنهای حیوانی و انسانی را فراهم کرده است. با این تکنیک، پژوهشگران میتوانند نقش دقیق ژنهای مشخص در مراحل مختلف تکوین جنین را بررسی کنند و اثر جهشهای ژنتیکی را بهطور مستقیم مشاهده نمایند. این دستاورد، مرزهای مطالعات جنینشناسی را گسترش داده و امکان شبیهسازی بیماریهای انسانی در مدلهای حیوانی یا انسانیسازی شده را فراهم کرده است.
شبیهسازیهای کامپیوتری و مدلسازی مولکولی نیز بخش دیگری از مدلهای پیشرفته هستند که در کنار مدلهای حیوانی و ارگانوئیدها به کار میروند. این مدلها با بهرهگیری از دادههای ژنتیکی، سلولی و بافتی، پیشبینی میکنند که چگونه یک اختلال ژنتیکی یا قرارگیری در معرض یک ماده خارجی میتواند روند تکوین جنین را تحت تأثیر قرار دهد. ترکیب این مدلها با مدلهای حیوانی انسانیسازی شده، امکان یکپارچهسازی دادهها و درک بهتر مکانیسمهای پیچیده را فراهم میسازد.
مزیت دیگر مدلهای انسانیسازی شده و پیشرفته، مطالعه بیماریهای نادر و مادرزادی است که نمونه انسانی آنها در دسترس محدود است. این مدلها امکان بازسازی شرایط بیماری، بررسی اثر داروها و توسعه درمانهای شخصیسازی شده را فراهم میکنند. به عنوان مثال، مدلهای موش انسانیسازی شده در زمینه اختلالات عصبی مانند اوتیسم یا صرع به پژوهشگران کمک کردهاند تا مسیرهای مولکولی مرتبط با این بیماریها را شناسایی کنند و داروهای هدفمند طراحی نمایند.
با وجود تمام مزایای مدلهای انسانیسازی شده، محدودیتهایی نیز وجود دارد. هزینه بالا، نیاز به تخصص فنی پیشرفته، و تفاوتهای بین گونهها و سلولهای انسانی در محیط آزمایشگاه و بدن واقعی، از جمله چالشهای استفاده از این مدلها هستند. با این حال، ترکیب مدلهای انسانیسازی شده با مدلهای حیوانی کلاسیک و ارگانوئیدها، یک چارچوب جامع و قدرتمند برای مطالعه تکوین جنین و بررسی اثر داروها و بیماریها فراهم میآورد که پیش از این هرگز ممکن نبود.
در مجموع، مدلهای انسانیسازی شده و پیشرفته، نسل جدید ابزارهای پژوهشی در جنینشناسی محسوب میشوند و نقش کلیدی در پل زدن میان علوم پایه و پزشکی بالینی ایفا میکنند. این مدلها نه تنها امکان درک دقیق مکانیسمهای مولکولی و سلولی تکوین جنین را فراهم میکنند، بلکه زمینه را برای توسعه درمانهای نوین، پیشگیری از بیماریهای مادرزادی و بهبود سلامت نسلهای آینده مهیا میسازند.
ملاحظات اخلاقی و محدودیتهای مدلهای حیوانی
استفاده از مدلهای حیوانی در پژوهشهای تکوین جنین، علیرغم ارزش علمی بیبدیل، با چالشها و ملاحظات اخلاقی مهمی همراه است که هم پژوهشگران و هم مراجع نظارتی را به دقت و مسئولیتپذیری فرا میخواند. این ملاحظات نه تنها به دلیل رفاه حیوانات بلکه به منظور اطمینان از اعتبار و قابل اعتماد بودن دادههای حاصل، اهمیت حیاتی دارند. شناخت و رعایت محدودیتهای اخلاقی و عملی استفاده از مدلهای حیوانی، یکی از پایههای اصلی انجام پژوهشهای علمی مسئولانه محسوب میشود.
یکی از مهمترین نگرانیهای اخلاقی، رفاه حیوانات آزمایشگاهی است. مطالعات روی جنین اغلب شامل دستکاریهای ژنتیکی، قرارگیری در معرض داروها یا مواد شیمیایی، و حتی گاهی مرگ جنینها میشود. چنین آزمایشهایی میتواند باعث درد، استرس یا اختلالات زیستی در حیوانات شود. بنابراین رعایت اصول سهگانه 3Rs که شامل کاهش (Reduction)، جایگزینی (Replacement) و بهینهسازی (Refinement) است، از الزامات قانونی و اخلاقی پژوهشهای حیوانی به شمار میرود. کاهش به معنای استفاده از حداقل تعداد حیوانات برای رسیدن به نتایج قابل اعتماد، جایگزینی به معنای استفاده از مدلهای غیرحیوانی مانند ارگانوئیدها یا شبیهسازیهای کامپیوتری و بهینهسازی به معنای طراحی آزمایشهایی است که کمترین آسیب را به حیوانات وارد کنند.
در کنار ملاحظات اخلاقی، محدودیتهای علمی و فیزیولوژیکی مدلهای حیوانی نیز از چالشهای مهم پژوهشی محسوب میشوند. گونههای مختلف از نظر ژنتیکی، متابولیک و فیزیولوژیک با انسان متفاوت هستند و این تفاوتها میتواند باعث شود نتایج حاصل از مدل حیوانی به طور کامل قابل تعمیم به انسان نباشد. برای مثال، اثر یک دارو یا ترکیب شیمیایی ممکن است در موش منجر به ناهنجاریهای شدید جنینی شود، در حالی که همان اثر در انسان متفاوت باشد. همین محدودیت نیازمند استفاده از چندین مدل مکمل و تحلیل دقیق مسیرهای سیگنالی و ژنتیکی است تا اطمینان حاصل شود یافتهها قابل تعمیم به انسان هستند.
مسائل قانونی و نظارتی نیز بخش دیگری از محدودیتهای مدلهای حیوانی را تشکیل میدهند. بسیاری از کشورها قوانین سختگیرانهای در زمینه استفاده از حیوانات در پژوهش دارند که شامل بررسی و تأیید طرحهای پژوهشی توسط کمیتههای اخلاقی و رعایت استانداردهای رفاه حیوانات است. این مقررات به پژوهشگران کمک میکنند تا ضمن حفظ سلامت و رفاه حیوانات، کیفیت و اعتبار دادههای علمی را تضمین کنند. عدم رعایت این اصول نه تنها پیامدهای قانونی دارد بلکه میتواند اعتبار علمی پژوهشها را نیز به خطر بیندازد.
محدودیت دیگر، پیچیدگی و هزینههای بالای مدلهای حیوانی پیشرفته و انسانیسازی شده است. استفاده از موشهای انسانیسازی شده یا ارگانوئیدهای پیشرفته نیازمند تجهیزات تخصصی، تیمهای پژوهشی ماهر و منابع مالی قابل توجه است. این محدودیتها میتواند دسترسی به این مدلها را محدود کند و پژوهشگران را مجبور به انتخاب میان مدلهای سنتی با هزینه کمتر و مدلهای پیشرفته با دقت بالاتر نماید.
همچنین، تفسیر دادههای حاصل از مدلهای حیوانی نیازمند دقت بالا است. همانطور که پیشتر ذکر شد، اختلافهای ژنتیکی و فیزیولوژیکی بین گونهها میتواند نتایج را پیچیده کند. به همین دلیل، استفاده از مدلهای چندگانه و بررسی مکانیسمهای مولکولی در چندین سطح زیستی ضروری است تا نتیجهگیریهای علمی معتبر و قابل تعمیم به انسان حاصل شود.
علاوه بر محدودیتهای فیزیولوژیکی و اخلاقی، مسائل زیستمحیطی و رفاه جمعی حیوانات نیز اهمیت دارند. شرایط نگهداری، تغذیه، میزان نور و صدا، و تعاملات اجتماعی حیوانات میتوانند به طور مستقیم بر رشد جنین و نتایج پژوهش اثر بگذارند. بنابراین، طراحی آزمایشها باید به گونهای باشد که شرایط محیطی کنترل شده و استانداردی برای تمام گروههای حیوانی فراهم شود تا تغییرات محیطی موجب سوگیری در نتایج نشود.
در نهایت، رعایت اصول اخلاقی و شناخت محدودیتها به پژوهشگران امکان میدهد یک تعادل منطقی بین پیشرفت علمی و حفظ رفاه حیوانات ایجاد کنند. استفاده مسئولانه از مدلهای حیوانی نه تنها باعث افزایش اعتبار علمی دادهها میشود، بلکه تصویری مثبت از اخلاق پژوهشی در جامعه علمی ارائه میدهد و زمینه را برای پذیرش گستردهتر یافتهها توسط جامعه پزشکی و بالینی فراهم میکند.
بنابراین، ملاحظات اخلاقی و محدودیتهای علمی باید همواره در طراحی و اجرای مطالعات حیوانی مورد توجه قرار گیرند تا پژوهشهای جنینشناسی هم از نظر علمی و هم از نظر اخلاقی به بالاترین استانداردهای ممکن دست یابند. رعایت این اصول، تضمینی است برای تولید دانش معتبر، حفاظت از حیوانات آزمایشگاهی و بهبود سلامت نسلهای آینده.
چشمانداز آینده و نوآوری در مدلهای حیوانی تکوین جنین
پژوهشهای جنینشناسی با استفاده از مدلهای حیوانی و انسانیسازی شده وارد مرحلهای شدهاند که ترکیب فناوریهای نوین، مهندسی ژنتیک و شبیهسازیهای پیشرفته، امکان کشف مکانیسمهای تکوینی را با دقتی بیسابقه فراهم میکند. چشمانداز آینده این حوزه نه تنها شامل بهبود در دقت و قابلیت تعمیم یافتهها به انسان است، بلکه توسعه روشهایی است که جایگزین یا تکمیلکننده مدلهای حیوانی سنتی باشند، کاهش آسیب به حیوانات را تضمین کرده و پژوهشهای بالینی را سرعت میبخشند.
یکی از مهمترین مسیرهای پیشرفت، ادغام مدلهای حیوانی با ارگانوئیدها و سیستمهای مینیاندام سهبعدی است. ارگانوئیدها، که از سلولهای بنیادی انسانی ساخته میشوند، توانایی تقلید از ساختار و عملکرد اندامهای واقعی را دارند. این سیستمها به پژوهشگران اجازه میدهند تا رشد اندامها و تعاملات سلولی در شرایطی کنترلشده بررسی شود و اثر داروها یا مواد شیمیایی بر تکوین جنین به صورت دقیقتر شبیهسازی شود. ترکیب ارگانوئیدها با مدلهای حیوانی انسانیسازی شده، تصویری جامع از مکانیسمهای مولکولی و فیزیولوژیک ارائه میدهد که پیش از این غیرقابل دسترسی بود.
ویرایش ژنوم با CRISPR/Cas9 و فناوریهای مرتبط یکی دیگر از ستونهای نوآوری در این حوزه است. این تکنولوژی امکان ایجاد تغییرات ژنتیکی دقیق در حیوانات و سلولهای انسانی را فراهم کرده است. پژوهشگران میتوانند نقش ژنهای مشخص در مراحل مختلف تکوین جنین را بررسی کنند و اثر جهشهای ژنتیکی را شبیهسازی نمایند. در آینده، انتظار میرود که این فناوری به ایجاد مدلهای شخصیسازی شده برای مطالعه بیماریهای مادرزادی یا پاسخ به داروها منجر شود و مسیرهای درمانی نوینی ارائه دهد.
مدلهای انسانیسازی شده پیشرفته نیز در حال تکامل هستند. پیشرفت در تکنیکهای پیوند سلولهای انسانی به مدلهای حیوانی، توانسته است شباهتهای فیزیولوژیک و ایمنی را به انسان نزدیکتر کند. این مدلها به پژوهشگران امکان مطالعه تعاملات سیستم ایمنی، پاسخ به عفونتها، و اثر داروها بر تکوین جنین را فراهم میکنند. در آینده، انتظار میرود که با بهبود فناوری انسانیسازی و کاهش تفاوتهای گونهای، دقت مدلها در پیشبینی اثرات داروها و عوامل محیطی بر انسان افزایش یابد.
شبیهسازیهای کامپیوتری و هوش مصنوعی نیز به عنوان یک ابزار مکمل نقش مهمی در چشمانداز آینده دارند. مدلهای محاسباتی قادر هستند بر اساس دادههای ژنتیکی، سلولی و بافتی، روند رشد اندامها و پاسخ به عوامل مختلف را پیشبینی کنند. استفاده از هوش مصنوعی و الگوریتمهای یادگیری ماشین میتواند به تحلیل حجم عظیمی از دادهها کمک کند و ارتباطات پیچیده میان ژنها، مسیرهای سیگنالی و عوامل محیطی را شناسایی نماید. ترکیب این رویکرد با مدلهای حیوانی و ارگانوئیدها، به تولید دانش عمیق و دقیقتر درباره تکوین جنین منجر میشود.
یکی از موضوعات نوظهور دیگر، مطالعه اثرات اپیژنتیک و محیطی در طول نسلها است. پژوهشهای اخیر نشان دادهاند که عوامل محیطی و قرارگیری در معرض داروها یا مواد شیمیایی میتوانند تغییرات پایدار اپیژنتیکی در جنین ایجاد کنند که اثرات آن تا دوران بزرگسالی ادامه دارد. مدلهای حیوانی و انسانیسازی شده پیشرفته امکان بررسی این اثرات مولکولی را در سطحی دقیق فراهم کردهاند و انتظار میرود این تحقیقات به درک بهتر ارتباط میان تجربههای جنینی و سلامت مادامالعمر انسانها کمک کنند.
علاوه بر این، فناوریهای تصویربرداری پیشرفته، از جمله میکروسکوپی لایو و تصویربرداری سهبعدی، به پژوهشگران امکان مشاهده رشد جنین و تعاملات سلولی در زمان واقعی را میدهد. این فناوریها میتوانند به شناسایی مراحل بحرانی در تکوین اندامها، نقایص مادرزادی و اثرات داروها کمک کنند و راه را برای توسعه روشهای پیشگیرانه و درمانی نوین باز کنند.
در نهایت، چشمانداز آینده مدلهای حیوانی در جنینشناسی به سوی یکپارچهسازی چندسطحی مدلها، فناوریها و دادهها پیش میرود. ترکیب مدلهای حیوانی کلاسیک، مدلهای انسانیسازی شده، ارگانوئیدها، شبیهسازیهای کامپیوتری و فناوریهای ویرایش ژنوم، امکان یک رویکرد جامع و دقیق برای مطالعه تکوین جنین فراهم میآورد. این رویکرد نه تنها درک ما را از مکانیسمهای زیستی تکوین جنین افزایش میدهد، بلکه مسیرهای درمانی نوین، پیشگیری از بیماریهای مادرزادی و ارتقای سلامت نسلهای آینده را نیز هموار میکند.
به طور خلاصه، نوآوری در مدلهای حیوانی و انسانیسازی شده آینده پژوهشهای جنینشناسی را متحول خواهد کرد. با ترکیب فناوریهای مولکولی، سلولی، تصویربرداری پیشرفته و هوش مصنوعی، پژوهشگران قادر خواهند بود به سطوحی از دقت و صحت دست یابند که پیش از این غیرممکن بود و چشمانداز پزشکی پیشگیرانه و درمانهای هدفمند را به واقعیت نزدیکتر سازند.
جمعبندی و نتیجهگیری
در طول این مقاله، اهمیت و جایگاه مدلهای حیوانی در مطالعه تکوین جنین به طور جامع مورد بررسی قرار گرفت و نشان داده شد که این مدلها ابزارهایی بیبدیل برای درک فرآیندهای پیچیده رشد و تمایز جنین به شمار میروند. مدلهای حیوانی، از جوندگان کوچک مانند موش و رت تا حیوانات بزرگتر و انسانیسازی شده، امکان مطالعه دقیق مسیرهای ژنتیکی، مولکولی و سلولی را فراهم کرده و ارتباط میان اختلالات جنینی و بیماریهای انسانی را روشن ساختهاند.
مدلهای حیوانی کلاسیک و مدرن ابزارهای متفاوتی ارائه میدهند. موشها به دلیل سرعت تولید مثل، هزینه پایین و قابلیت دستکاری ژنتیکی گسترده، در بسیاری از پژوهشها به عنوان مدل اصلی مورد استفاده قرار گرفتهاند، در حالی که مدلهای پیشرفتهتر مانند موشهای انسانیسازی شده و ارگانوئیدها، امکان شبیهسازی شرایط انسانی و مطالعه دقیق پاسخهای سلولی و مولکولی را فراهم میکنند. مدلهای کلاسیک و پیشرفته در کنار یکدیگر، تصویری جامع از فرآیندهای تکوین جنین ارائه میدهند که هیچ یک به تنهایی قادر به ارائه آن نیستند.
یکی از حوزههای کلیدی، مطالعه تکوین سیستمهای اندامی خاص است. مدلهای حیوانی امکان بررسی رشد و شکلگیری سیستم عصبی، قلب و عروق، استخوان و غضروف، سیستم تناسلی و ادراری و چشم را فراهم کردهاند. این مطالعات نه تنها مکانیسمهای طبیعی توسعه اندامها را روشن کردهاند، بلکه پیامدهای اختلالات ژنتیکی و محیطی را نیز آشکار ساختهاند. یافتهها در این زمینه مسیرهای درمانی و پیشگیرانه برای بیماریها و ناهنجاریهای مادرزادی فراهم میآورند و نقش مدلهای حیوانی را در پزشکی بازساختی و توسعه داروهای نوین پررنگ میکنند.
کاربرد مدلهای حیوانی در بررسی اثر داروها و مواد خارجی نیز نشان داد که این مدلها ابزار ضروری برای سنجش ایمنی و سمشناسی هستند. مطالعه اثر داروها، مواد شیمیایی و نانوذرات بر رشد جنین و عملکرد اندامها، اطلاعاتی حیاتی برای پیشگیری از آسیبهای جنینی و بهبود سلامت نسلهای آینده ارائه میدهد. همچنین، استفاده از مدلهای انسانیسازی شده امکان بررسی دقیقتر پاسخهای انسانی به داروها و مواد محیطی را فراهم کرده است.
با این حال، ملاحظات اخلاقی و محدودیتهای مدلهای حیوانی همواره باید در طراحی و اجرای پژوهشها مورد توجه قرار گیرند. رعایت اصول رفاه حیوانات، استفاده از حداقل تعداد حیوانات، جایگزینی مدلهای غیرحیوانی و بهینهسازی آزمایشها، نه تنها الزامات قانونی و اخلاقی هستند، بلکه به افزایش دقت و اعتبار علمی دادهها نیز کمک میکنند. شناخت محدودیتهای گونهای و تفاوتهای فیزیولوژیک حیوانات با انسان، نیاز به طراحی مطالعات تکمیلی و استفاده از چندین مدل همزمان را نشان میدهد.
چشمانداز آینده و نوآوری در مدلهای حیوانی و انسانیسازی شده روشن و امیدوارکننده است. ادغام فناوریهای ارگانوئیدها، شبیهسازیهای کامپیوتری، ویرایش ژنوم با CRISPR و تصویربرداری پیشرفته، امکان مطالعه تکوین جنین با دقت و صحت بیسابقه را فراهم کرده است. این نوآوریها به پژوهشگران اجازه میدهند تا مکانیسمهای مولکولی و سلولی پیچیده را در شرایطی نزدیک به انسان بررسی کنند و توسعه درمانهای هدفمند، پیشگیری از بیماریهای مادرزادی و ارتقای سلامت نسلهای آینده را ممکن سازند.
در نهایت، مدلهای حیوانی و انسانیسازی شده ستون اصلی پژوهشهای جنینشناسی هستند و نقش بیبدیلی در پل زدن میان علوم پایه و پزشکی بالینی دارند. استفاده مسئولانه، ترکیب مدلهای کلاسیک و پیشرفته، و بهرهگیری از فناوریهای نوین، مسیر تولید دانش دقیق، قابل اعتماد و کاربردی در زمینه تکوین جنین و سلامت نسلهای آینده را هموار میسازد. این رویکرد جامع، پایهای مستحکم برای ادامه پژوهشها و نوآوریهای آینده در حوزه جنینشناسی فراهم میآورد و تضمین میکند که یافتههای علمی نه تنها معتبر بلکه قابل استفاده در توسعه پزشکی پیشگیرانه و درمانهای هدفمند خواهند بود.