نقش ژنها در تکوین اندامها
مقدمه
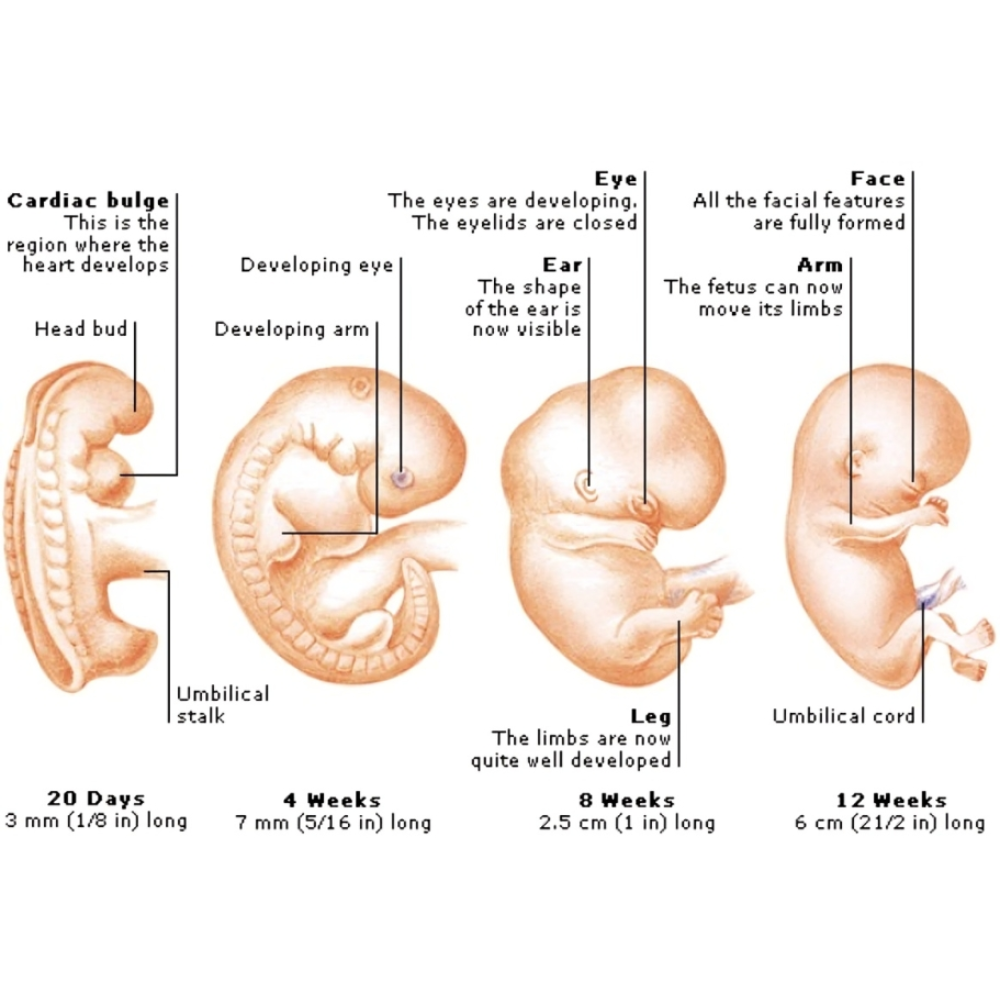
تکوین اندامها یکی از پیچیدهترین و شگفتانگیزترین فرآیندهای زیستی است که طی آن یک ارگانیسم از یک سلول منفرد، یعنی تخمک بارور شده، به یک موجود پیچیده با اندامها و بافتهای مختلف تبدیل میشود. این فرآیند نیازمند هماهنگی دقیق میان مسیرهای ژنتیکی، سیگنالهای سلولی، تعاملات بین سلولی و عوامل محیطی است. ژنها به عنوان واحدهای بنیادی اطلاعات زیستی نقش اساسی در هدایت و کنترل این فرآیندها ایفا میکنند و تعیینکننده نحوه شکلگیری، تمایز و رشد اندامها هستند.
تکوین اندامها تنها نتیجه فعالیت منفرد ژنها نیست، بلکه محصول تعاملات پیچیده میان ژنها، محصولات پروتئینی آنها، مسیرهای سیگنالینگ و تنظیمات اپیژنتیک است. به عنوان مثال، مسیرهای Retinoic Acid و Hippo-YAP/TAZ به طور مستقیم اندازه، شکل و عملکرد اندامها را تنظیم میکنند، در حالی که شبکههای ژنی مانند DACH/EYA/SIX و عوامل اپیژنتیک مانند متیلاسیون هیستون، بیان ژنها را در زمان و مکان مناسب کنترل میکنند. این هماهنگی دقیق، تضمینکننده ایجاد اندامهای سالم با عملکرد بهینه است.
یکی دیگر از ابعاد مهم مطالعه تکوین اندامها، بررسی نقش RNAهای کوچک و میکروRNAها در تنظیم ژنتیکی است. این مولکولها با مهار یا تعدیل ترجمه ژنها، امکان پاسخ سریع به تغییرات محیطی و تنظیم تمایز سلولی را فراهم میکنند. بدون این تنظیمات دقیق، فرآیند تکوین میتواند دچار اختلال شود و منجر به نقصهای مادرزادی یا بیماریهای ارگانی شود.
مطالعات مدرن با استفاده از تکنیکهای پیشرفته مانند تکسلولی RNA-seq، مدلهای ارگانوئیدها و Organs-on-Chips، امکان بررسی دقیق چگونگی عملکرد ژنها در بافتها و اندامهای انسانی را فراهم کردهاند. این رویکردها نه تنها بینشهای بیسابقهای درباره فرآیندهای تکوینی ارائه میدهند، بلکه پتانسیل بالینی برای توسعه درمانهای شخصی و مهندسی بافتها دارند. به عنوان مثال، با استفاده از ارگانوئیدهای کبد یا قلب میتوان اثر جهشهای ژنی خاص بر عملکرد اندامها را مطالعه کرد و راهکارهای درمانی هدفمند طراحی نمود.
اهمیت مطالعه ژنها در تکوین اندامها تنها محدود به فهم فرآیندهای زیستی پایه نیست. این دانش پایه برای پزشکی بازساختی، درمان بیماریهای مادرزادی، پیشگیری از اختلالات رشد و حتی توسعه داروهای نوین حیاتی است. نقش ژنها در تعیین اندازه، شکل، ساختار و عملکرد اندامها، زمینهای برای بررسی علل بیماریهای ارگانیک و طراحی استراتژیهای درمانی فراهم میکند. بدون درک دقیق از این مکانیسمها، بسیاری از تلاشها در زمینه پزشکی بازساختی و ژندرمانی با محدودیت مواجه خواهند شد.
در نهایت، تکوین اندامها نتیجه یک همکاری هماهنگ میان ژنها، مسیرهای سیگنالینگ، عوامل اپیژنتیک و محیط سلولی است. فهم این همکاریها، نه تنها درک ما را از زیستشناسی توسعه عمیقتر میکند، بلکه راه را برای کاربردهای بالینی و مهندسی بافت هموار میسازد. این مقاله به طور جامع به بررسی نقش ژنها در تکوین اندامها میپردازد و تلاش دارد با پوشش کامل مکانیسمها، مسیرهای سیگنالینگ، تنظیمات اپیژنتیک، مدلهای تجربی و تأثیر عوامل محیطی، تصویری جامع از این فرآیند پیچیده ارائه دهد.
تعریف و مبانی ژنتیک در تکوین اندام
برای درک کامل فرآیند تکوین اندامها، ابتدا باید مفهوم ژنتیک و نقش آن در شکلگیری بافتها و اندامها روشن شود. ژنها واحدهای بنیادی اطلاعات زیستی هستند که تعیینکننده ساختار و عملکرد سلولها و در نهایت بافتها و اندامها هستند. هر ژن شامل توالیهای خاصی از DNA است که کد تولید پروتئینها و مولکولهای تنظیمی را دارند. این پروتئینها، از آنزیمها گرفته تا فاکتورهای رونویسی و مولکولهای سیگنالینگ، نقش مستقیم در تعیین هویت سلولی، تمایز و سازماندهی بافتها دارند.
در تکوین اندامها، ژنها نه تنها وظیفه تولید پروتئینها را دارند، بلکه مسیرهای سیگنالینگ پیچیدهای را هدایت میکنند که تعیین میکنند سلولها چه زمانی تقسیم شوند، چه زمانی تمایز یابند و چه زمانی برنامه مرگ سلولی را دنبال کنند. این فرآیندها به صورت هماهنگ با هم کار میکنند تا ساختار سهبعدی اندامها شکل گیرد و عملکرد آنها بهینه باشد. برای مثال، مسیرهای Retinoic Acid و Wnt نقش کلیدی در تعیین محور بدن، طول اندامها و تفکیک بخشهای مختلف بافت دارند، در حالی که مسیر Hippo-YAP/TAZ اندازه و تعداد سلولها را کنترل میکند تا بافتها بیش از حد رشد نکنند یا کوچک باقی نمانند.
اپیژنتیک یکی دیگر از جنبههای حیاتی ژنتیک در تکوین اندامها است. این فرآیند شامل تغییراتی در بیان ژنها است که بدون تغییر توالی DNA اتفاق میافتد، مانند متیلاسیون DNA، استیلگذاری و متیلاسیون هیستونها. این تغییرات به سلولها امکان میدهد پاسخهای انعطافپذیری به سیگنالهای محیطی و نیازهای توسعهای نشان دهند و هویت سلولی پایدار اما قابل تغییر داشته باشند. به عنوان مثال، در رشد اندامهای پیچیده مانند قلب و کلیه، سلولهای جنینی تحت تأثیر اپیژنتیک تمایز مییابند و مسیرهای سیگنالینگ مشخص را فعال یا خاموش میکنند تا لایههای بافتی درست تشکیل شوند.
RNAهای کوچک و میکروRNAها (miRNA) نیز نقش کلیدی در تنظیم ژنها دارند. این مولکولها با مهار ترجمه پیامهای RNA یا هدایت آنها به مسیرهای تخریب، سطح پروتئینهای تولید شده را دقیقاً تنظیم میکنند. در تکوین اندامها، miRNAها به عنوان ناظران ظریف، تعادل بین تقسیم سلولی و تمایز را برقرار میکنند. به عنوان نمونه، miR396 و فاکتورهای رشد GRF در گیاهان یک شبکه تنظیمی حفظکننده توازن رشد را ایجاد میکنند که مشابه مکانیسمهای تنظیم رشد در حیوانات است.
همچنین باید توجه داشت که شبکههای ژنی و تعاملات پیچیده میان ژنها، کلید اصلی در شکلگیری اندامها هستند. ژنهایی مانند DACH، EYA و SIX در توسعه اندامهای حیوانی نقش دارند و نقص یا جهش در آنها میتواند منجر به اختلالات مادرزادی یا حتی تمایل به تومورزایی شود. این شبکهها با فاکتورهای اپیژنتیک و مسیرهای سیگنالینگ ترکیب میشوند تا تصمیمگیری سلولها در مورد تقسیم، تمایز و مرگ کنترل شود.
در سطح سلولی، ژنها با کنترل برنامههای تمایز سلولی و شناسایی هویت بافتی، تعیین میکنند که سلولهای اولیه جنینی به چه نوع بافتی تبدیل شوند. برای مثال، سلولهای پیشساز قلب تحت کنترل ژنهای Nkx2.5 و GATA4 به کاردیومایوسیتها تبدیل میشوند و ساختار قلب را شکل میدهند، در حالی که مسیرهای دیگری مانند Pax و Hox محور بدن و محل تشکیل اندامها را مشخص میکنند.
در نهایت، میتوان گفت که تکوین اندامها نتیجه همکاری نزدیک میان ژنها، محصولات پروتئینی آنها، مسیرهای سیگنالینگ و تنظیمات اپیژنتیک است. هر گونه اختلال در این شبکههای پیچیده میتواند منجر به نقصهای ساختاری یا عملکردی اندامها شود. به همین دلیل مطالعه ژنها و مکانیسمهای تنظیم آنها نه تنها برای درک زیستشناسی پایه حیاتی است، بلکه پایهای برای توسعه درمانهای بازساختی و ژندرمانی فراهم میکند.
سیگنالینگ و مسیرهای ژنی در تکوین اندام
تکوین اندامها فرآیندی پیچیده و پویا است که مستلزم تعامل دقیق بین مسیرهای ژنی و سیگنالینگ سلولی است. سیگنالهای ژنی نه تنها به سلولها میگویند که چه زمانی تقسیم شوند یا تمایز یابند، بلکه محورهای بدن، ساختار فضایی و اندازه اندامها را نیز تعیین میکنند. این مسیرها از طریق ترکیبی از فاکتورهای رونویسی، مولکولهای سیگنالدهنده و شبکههای بازخورد، فرآیندهای تکوینی را کنترل میکنند.
یکی از مسیرهای اساسی در تکوین اندامها، مسیر Retinoic Acid (RA) است. Retinoic Acid که یک متابولیت ویتامین A است، نقش حیاتی در تعیین هویت سلولی و تفکیک بافتها دارد. RA به عنوان یک سیگنال مولکولی عمل میکند و با اتصال به گیرندههای هستهای RAR و RXR، بیان ژنهای هدف را تنظیم میکند. این مسیر به ویژه در تعیین محور قدامی-خلفی اندامها و شکلگیری ساختارهای پیچیده مانند دست و پا اهمیت دارد. کمبود یا اختلال در سیگنالینگ RA میتواند منجر به ناهنجاریهای شدید اندامی و نقصهای مادرزادی شود، که اهمیت این مسیر در تکوین را نشان میدهد.
مسیر Hippo-YAP/TAZ یکی دیگر از مسیرهای کلیدی در تکوین اندامهاست. این مسیر کنترلکننده اندازه اندامها و حفظ تعادل بین تقسیم سلولی و مرگ برنامهریزیشده سلولها است. YAP و TAZ فاکتورهای رونویسی هستند که فعالیت آنها تحت تأثیر شبکه Hippo قرار دارد. هنگامی که مسیر Hippo فعال باشد، YAP/TAZ فسفریله شده و از هسته خارج میشوند، در نتیجه رشد بافت محدود میشود. هنگامی که مسیر غیرفعال باشد، YAP/TAZ وارد هسته شده و ژنهای مرتبط با تقسیم سلولی و رشد را فعال میکنند. این مکانیسم نقش حیاتی در کنترل اندازه قلب، کبد، کلیه و سایر اندامها دارد و اختلال در آن میتواند منجر به رشد بیش از حد بافتها یا تمایل به تومورزایی شود.
مسیرهای Wnt، Notch و Hedgehog نیز در تکوین اندامها نقش حیاتی دارند. Wnt با تنظیم تمایز سلولی و محور بدن، به شکلگیری اندامها کمک میکند و در حفظ سلولهای پیشساز و خودنوزایی آنها نقش دارد. Notch، از طریق تعامل مستقیم سلول با سلول، تصمیمگیری درباره سرنوشت سلولها را هدایت میکند و تعیین میکند که سلول به بافتی خاص تبدیل شود یا مسیر تمایز دیگری را طی کند. Hedgehog به عنوان یک سیگنالگر پاراکرینی، به سلولها میگوید که در چه موقعیتی قرار دارند و چگونه در ساختار فضایی اندامها مشارکت کنند. این مسیرها با یکدیگر تعامل دارند و یک شبکه هماهنگ ایجاد میکنند که خطا در آن میتواند به نقصهای ساختاری اندام منجر شود.
یکی دیگر از مکانیسمهای مهم، بازخوردهای ژنی و مسیرهای خودتنظیمی هستند که تکوین اندامها را دقیق و منعطف میکنند. برای مثال، مسیر Hippo با مسیر Wnt تعامل دارد و ترکیب این دو مسیر، کنترل دقیق اندازه و شکل اندام را تضمین میکند. همچنین، مسیر Retinoic Acid با فاکتورهای هومئوکسپانسی تعامل دارد تا تعیین هویت سلولی در طول محور قدامی-خلفی اندامها به درستی صورت گیرد. این تعاملات نشان میدهد که تکوین اندامها نتیجه همکاری میان مسیرهای متعدد ژنی و سیگنالینگ است، نه فعالیت منفرد یک ژن یا مسیر خاص.
سیگنالینگ سلولی و محیط میکرو نیز نقش مهمی در تکوین ایفا میکند. سلولها تحت تأثیر تماس با سلولهای همسایه، ماتریکس خارج سلولی و سیگنالهای شیمیایی محیطی قرار دارند. این تعاملات، مسیرهای ژنی را تقویت یا مهار میکنند و به شکلگیری ساختارهای سهبعدی اندامها کمک میکنند. برای مثال، primary cilia در سطح سلولها به عنوان حسگرهای مکانیکی و شیمیایی عمل میکنند و مسیرهای Hedgehog و Wnt را تنظیم میکنند. اختلال در این ساختارها میتواند منجر به ناهنجاریهای مادرزادی و اختلالات اندامی شود.
در نهایت، میتوان گفت که سیگنالینگ ژنی و مسیرهای مولکولی نقش محوری در هماهنگی تقسیم سلولی، تمایز، تعیین هویت سلولی و شکلگیری فضایی اندامها دارند. این مسیرها با شبکههای اپیژنتیک و فاکتورهای رونویسی تعامل دارند و تضمین میکنند که اندامها با اندازه، شکل و عملکرد مناسب توسعه یابند. درک کامل این مسیرها و تعاملات آنها، نه تنها برای زیستشناسی پایه، بلکه برای پزشکی بازساختی، ژندرمانی و پیشگیری از نقصهای مادرزادی اهمیت حیاتی دارد.
تنظیم بیان ژن و مکانیسمهای اپیژنتیک
یکی از بنیادیترین ابعاد تکوین اندامها، تنظیم دقیق بیان ژنها است. هر سلول جنینی با داشتن همان ژنوم پایه، قادر است به بافتها و اندامهای کاملاً متفاوت تبدیل شود. این تنوع سلولی به واسطه اپیژنتیک و مکانیسمهای تنظیم ژن امکانپذیر میشود، به گونهای که ژنها در زمان و مکان مناسب فعال یا خاموش میشوند.
اپیژنتیک شامل تغییراتی در بیان ژنها است که بدون تغییر در توالی DNA رخ میدهد و میتواند توسط عوامل محیطی، سیگنالهای سلولی و تعاملات بین سلولی هدایت شود. از جمله مهمترین مکانیسمهای اپیژنتیک میتوان به متیلاسیون DNA، تغییرات هیستونی و بازآرایی کروماتین اشاره کرد. متیلاسیون DNA معمولاً با خاموش شدن ژنها همراه است و در تعیین هویت سلولی نقش حیاتی دارد. برای مثال، در تمایز سلولهای پیشساز قلب، الگوهای متیلاسیون ژنهای Nkx2.5 و GATA4 مشخص میکنند که کدام سلولها به کاردیومایوسیتها تبدیل شوند و کدام مسیر تمایزی دیگر را دنبال کنند.
تغییرات هیستونی نیز به شدت در تنظیم بیان ژنها مؤثرند. هیستونها پروتئینهایی هستند که DNA به دور آنها پیچیده شده و بستهبندی کروماتین را شکل میدهند. تغییراتی مانند استیلگذاری، متیلاسیون یا فسفریلاسیون هیستونها میتواند دسترسی دستگاه رونویسی به ژنها را افزایش یا کاهش دهد. به عنوان مثال، هیستون H3K4me3 معمولاً با فعال بودن ژنها مرتبط است، در حالی که H3K27me3 نشاندهنده سرکوب ژنی است. این مکانیسمها به سلولها اجازه میدهند پاسخهای دقیق و انعطافپذیر به سیگنالهای تکوینی و محیطی نشان دهند و رشد و تمایز اندامها به درستی انجام شود.
Alternative splicing یا انتخاب جایگزین اگزونها، یکی دیگر از مکانیسمهای تنظیمی مهم در تکوین است. این فرآیند باعث میشود یک ژن واحد بتواند چندین پروتئین متفاوت تولید کند که هر کدام عملکرد ویژهای دارند. به عنوان نمونه، در سیستم عصبی و قلب، alternative splicing تنوع پروتئینی ایجاد میکند که برای عملکرد تخصصی سلولها و بافتها ضروری است. این مکانیسم به سلولها اجازه میدهد انعطاف بیشتری در پاسخ به نیازهای تکوینی و محیطی داشته باشند.
RNAهای کوچک و میکروRNAها (miRNA) نیز نقش کلیدی در تنظیم بیان ژنها دارند. این مولکولها با مهار ترجمه پیام RNA یا هدایت آنها به مسیرهای تخریب، سطح پروتئینهای تولید شده را دقیقاً کنترل میکنند. در تکوین اندامها، miRNAها به عنوان ناظران ظریف، تعادل بین تقسیم سلولی و تمایز را برقرار میکنند و از فعال شدن ژنهای نامناسب جلوگیری میکنند. شبکههایی مانند miR396-GRF در گیاهان و miR-17~92 در جانوران مثالهایی از این تنظیم دقیق هستند که حفظ توازن رشد و توسعه را تضمین میکنند.
شبکههای ژنی نیز جزئی جداییناپذیر از تنظیم بیان ژن هستند. ژنهایی مانند DACH، EYA و SIX، با تعامل با فاکتورهای رونویسی و سیگنالهای اپیژنتیک، مسیرهای تمایزی سلولها را تعیین میکنند. این شبکهها یک سیستم بازخوردی ایجاد میکنند که امکان پاسخ دقیق به تغییرات محیطی و داخلی را فراهم میکند. به عنوان مثال، در توسعه چشم و کلیه، اختلال در این شبکهها میتواند به نقصهای مادرزادی شدید یا تمایل به تومورزایی منجر شود.
میکرو محیط سلولی نیز نقش مهمی در تنظیم بیان ژنها دارد. تعاملات بین سلولها، تماس با ماتریکس خارج سلولی و سیگنالهای مکانیکی و شیمیایی، مسیرهای ژنی را تقویت یا مهار میکنند. ساختارهای حسگر مانند primary cilia اطلاعات محیطی را دریافت کرده و مسیرهای Hedgehog، Wnt و Notch را تنظیم میکنند. این تعاملات به سلولها کمک میکند تا محل و زمان مناسب تمایز را انتخاب کنند و ساختار فضایی اندامها دقیقاً شکل گیرد.
اپیژنتیک دینامیک و تغییرات موقت نیز اهمیت ویژهای در تکوین اندامها دارد. تغییرات موقت در بیان ژنها به سلولها امکان میدهد در پاسخ به نیازهای تکوینی به سرعت برنامههای رشد را فعال یا خاموش کنند. این ویژگی برای فرآیندهای پیچیدهای مانند شکلگیری قلب، اندامهای حرکتی و شبکههای عصبی ضروری است. بدون این تنظیمات دقیق، فرآیند تکوین ممکن است به ناهنجاریهای ساختاری یا نقصهای عملکردی منجر شود.
در نهایت، میتوان گفت که تنظیم بیان ژن و مکانیسمهای اپیژنتیک ستون فقرات فرآیند تکوین اندامها هستند. این مکانیسمها با مسیرهای سیگنالینگ و شبکههای ژنی تعامل دارند تا هویت سلولی، تقسیم و تمایز را در زمان و مکان دقیق کنترل کنند. فهم این فرآیندها نه تنها درک ما از زیستشناسی توسعه را عمیقتر میکند، بلکه پایهای برای طراحی استراتژیهای بازساختی، ژندرمانی و پیشگیری از نقصهای مادرزادی فراهم میآورد.
تکامل سلولی و تغییرات ساختاری در تکوین اندام
فرآیند تکوین اندامها تنها به بیان ژنها محدود نمیشود؛ بلکه تکامل سلولی و تغییرات ساختاری نقش بسیار حیاتی در شکلگیری و عملکرد صحیح اندامها دارند. سلولها در طول تکوین، مسیرهای متعددی را طی میکنند که شامل تقسیم، تمایز، مهاجرت، برنامه مرگ سلولی و بازسازی بافتها است. این تغییرات همگی با هماهنگی دقیق شبکههای ژنی و مسیرهای سیگنالینگ رخ میدهند تا ساختار سهبعدی اندامها شکل گیرد و عملکرد فیزیولوژیک آنها تضمین شود.
یکی از مهمترین فرآیندهای سلولی در تکوین اندامها، Epithelial-Mesenchymal Transition (EMT) است. در EMT، سلولهای اپیتلیال قطبیت خود را از دست داده و به سلولهای مزانشیمی با توانایی مهاجرت و تمایز بالا تبدیل میشوند. این فرآیند در شکلگیری اندامها، مانند قلب، کلیه و اندامهای حرکتی، حیاتی است. EMT نوع ۲ به ویژه در بازسازی بافت و ترمیم زخم اهمیت دارد و نقش حیاتی در ایجاد توازن بین رشد بافت و حفظ ساختارهای اولیه اندامها ایفا میکند. اختلال در EMT میتواند منجر به نقصهای مادرزادی یا ایجاد زمینه برای بیماریهای مزمن و تومورزایی شود.
علاوه بر EMT، پلیپلوئیدی یا افزایش تعداد کروموزومها در سلولها نیز یکی از مکانیسمهای حیاتی در تکوین اندامها است. پلیپلوئیدی در بسیاری از بافتهای حیوانی و گیاهی دیده میشود و به افزایش اندازه سلول، افزایش تولید پروتئین و تقویت ظرفیت عملکردی بافتها کمک میکند. این ویژگی در اندامهایی مانند قلب و کبد اهمیت ویژه دارد، زیرا این اندامها نیازمند سلولهایی با توانایی بالا در تولید پروتئین و متابولیسم هستند. پلیپلوئیدی همچنین میتواند به عنوان مکانیسم حفاظتی در برابر آسیبهای سلولی عمل کند و ظرفیت بازسازی بافتها را افزایش دهد.
مهاجرت و سازماندهی سلولی نیز بخش مهمی از تکامل اندامها را تشکیل میدهد. سلولهای پیشساز در طول تکوین، با هدایت مسیرهای سیگنالینگ و مکانیسمهای اپیژنتیک، به محل دقیق خود مهاجرت میکنند و ساختارهای سهبعدی اندامها را شکل میدهند. این فرآیندها به کمک مولکولهای سیگنالدهنده مانند Hedgehog، Wnt و Notch و حسگرهای مکانیکی مانند primary cilia هدایت میشوند. اختلال در مهاجرت سلولی میتواند باعث ناهنجاریهای ساختاری و نقص در عملکرد اندامها شود.
بازآرایی و تغییرات ساختاری بافتی نیز نقش مهمی در تکوین ایفا میکنند. ماتریکس خارج سلولی و اتصالات سلولی به سلولها کمک میکنند تا شکل نهایی بافتها و اندامها را حفظ کنند. این فرآیندها با تغییرات در کروماتین و مسیرهای سیگنالینگ همزمان میشوند تا اطمینان حاصل شود که سلولها در مکان صحیح و با هویت مناسب باقی میمانند. به عنوان مثال، در شکلگیری اندامهای حرکتی، سلولهای مزانشیمی بافتهای غضروفی اولیه را تشکیل میدهند که بعدها به استخوان و عضله تبدیل میشوند.
یکی دیگر از جنبههای حیاتی، حفظ هومئوستازی سلولی و اندامی است. مسیرهای Hippo و Unfolded Protein Response (UPR) با تنظیم تقسیم سلولی، مرگ برنامهریزیشده و کیفیت پروتئینها، اطمینان میدهند که سلولها و بافتها در طول رشد بیش از حد یا کمبود عملکرد قرار نگیرند. این مکانیزمها تضمین میکنند که رشد اندامها با اندازه و عملکرد بهینه انجام شود و نقصهای ساختاری ایجاد نشود.
ارتباط بین تکامل سلولی و اپیژنتیک نیز اهمیت ویژهای دارد. تغییرات اپیژنتیک به سلولها امکان میدهد در پاسخ به نیازهای توسعهای، مهاجرت، تقسیم و تمایز خود را تنظیم کنند. این ویژگی برای هماهنگی بین سلولهای مختلف یک اندام و شکلگیری ساختارهای پیچیده حیاتی است. به عنوان مثال، در توسعه قلب، تغییرات اپیژنتیک و مسیرهای سیگنالینگ با هم عمل میکنند تا سلولهای پیشساز به کاردیومایوسیتها، سلولهای اندوتلیال و فیبروبلاستها تمایز یابند و ساختار پیچیده قلب شکل گیرد.
در نهایت، میتوان گفت که تکامل سلولی و تغییرات ساختاری بخش اساسی فرآیند تکوین اندامها هستند. این فرآیندها از طریق EMT، پلیپلوئیدی، مهاجرت سلولی، بازآرایی بافتی و مکانیسمهای هومئوستاز هماهنگ میشوند تا اندامها با شکل، اندازه و عملکرد صحیح توسعه یابند. درک این فرآیندها برای زیستشناسی پایه و همچنین پزشکی بازساختی و درمان اختلالات مادرزادی اهمیت حیاتی دارد.
مدلهای تجربی برای بررسی نقش ژنها در اندامها
مطالعه نقش ژنها در تکوین و عملکرد اندامها نیازمند مدلهای تجربی دقیق و متنوع است. این مدلها امکان میدهند تا دانشمندان اثرات ژنتیکی، مسیرهای سیگنالینگ و مکانیسمهای اپیژنتیک را به طور سیستماتیک بررسی کنند و بین ژنها و تغییرات ساختاری و عملکردی اندام ارتباط برقرار کنند. مدلهای تجربی به دو دسته اصلی تقسیم میشوند: مدلهای حیوانی و مدلهای مهندسیشده سلولی و بافتی.
مدلهای حیوانی ابزار سنتی و قدرتمند برای مطالعه ژنتیک تکوینی هستند. موش و موش صحرایی به دلیل شباهت ژنتیکی با انسان و امکان دستکاری ژنها، رایجترین مدلها هستند. با استفاده از تکنیکهای knockout و knock-in، پژوهشگران میتوانند اثر حذف یا فعالسازی ژنهای خاص را روی تکوین اندامها بررسی کنند. به عنوان مثال، حذف ژنهای مسیر Hippo یا Retinoic Acid در موشها منجر به تغییرات قابل توجه در اندازه قلب، کبد و اندامهای حرکتی میشود، که اهمیت این مسیرها در تنظیم رشد و تمایز سلولی را آشکار میکند.
مدلهای زبرا فیش و دوزیستان نیز به دلیل شفافیت جنینها و امکان مشاهده مستقیم فرآیندهای تکوینی، نقش مهمی در مطالعه توسعه اندامها دارند. این مدلها به ویژه برای بررسی مهاجرت سلولی، EMT و بازآرایی بافتی مفید هستند. علاوه بر این، زبرا فیش امکان مطالعه اثرات موقت ژنها و مسیرهای سیگنالینگ را فراهم میکند و سرعت تکامل اندامها در این مدلها، پژوهش را تسریع میکند.
مدلهای گیاهی نیز برای درک عملکرد ژنها در رشد و توسعه اندامها، به ویژه ریشه، ساقه و گلها، مورد استفاده قرار میگیرند. ژنهایی مانند MADS-domain transcription factors و GRFs نقش کلیدی در تعیین هویت سلولهای گیاهی و توسعه اندامهای گیاهی ایفا میکنند. مطالعه این مدلها امکان درک بهتر تعامل بین ژنها و فاکتورهای محیطی، مانند هورمونها و شرایط رشد، را فراهم میآورد.
در سالهای اخیر، مدلهای مهندسیشده سلولی و بافتی، به ویژه organoids و organs-on-a-chip، تحولی اساسی در مطالعه ژنها و مسیرهای سیگنالینگ ایجاد کردهاند. Organoids ساختارهای سهبعدی هستند که از سلولهای پیشساز یا سلولهای بنیادی مشتق میشوند و عملکرد و ساختار اندامهای واقعی را شبیهسازی میکنند. این مدلها امکان بررسی اثرات جهشهای ژنی، سیگنالینگ و تعاملات سلول-سلول را در محیطی کنترلشده فراهم میکنند. به عنوان مثال، مطالعه Organoids قلب یا کلیه نشان داده است که تغییر در مسیرهای Hippo و Wnt میتواند منجر به اختلالات ساختاری و عملکردی مشابه آنچه در نقصهای مادرزادی دیده میشود، شود.
Organs-on-a-chip مدل دیگری است که با استفاده از فناوری مهندسی میکروفلوئیدیک و بافتشناسی، محیط فیزیولوژیک اندامها را شبیهسازی میکند. این سیستمها امکان مطالعه دقیق اثرات ژنتیکی، دارویی و محیطی بر عملکرد اندامها را فراهم میآورند و برای مدلسازی بیماریها و تست داروها ایدهآل هستند. برای مثال، بررسی اثر جهشهای ژنی در سلولهای اندوتلیال یا کاردیومایوسیتهای روی chip، اطلاعات مهمی درباره مسیرهای سیگنالینگ و عملکرد سلولی ارائه میدهد.
تکنیکهای تک سلولی مانند Single-cell RNA sequencing نیز نقش مهمی در مدلهای تجربی دارند. این تکنیکها امکان مطالعه بیان ژن در سطح هر سلول و کشف شبکههای ژنی خاص هر نوع سلول در اندام را فراهم میکنند. ترکیب این دادهها با مدلهای organoid و in vivo، یک تصویر جامع از ارتباط بین ژنها، مسیرهای سیگنالینگ و تغییرات ساختاری فراهم میآورد.
در نهایت، ترکیب مدلهای حیوانی، گیاهی و مهندسیشده به دانشمندان اجازه میدهد تا تکوین اندامها را از چندین زاویه مطالعه کنند، اثرات ژنتیکی را در محیط کنترلشده و در شرایط طبیعی بررسی کنند و نقش دقیق ژنها در رشد، تمایز و عملکرد اندامها را درک کنند. این مدلها پایهای برای توسعه درمانهای بازساختی، ژندرمانی و داروهای هدفمند فراهم میآورند و امکان پیشگیری و اصلاح نقصهای مادرزادی را بهبود میدهند.
تأثیر عوامل محیطی و مادرزادی بر ژنها و تکوین اندام
تکوین اندامها نتیجه تعامل پیچیده بین ژنتیک و محیط است. ژنها برنامه اولیه و مسیرهای سلولی را تعیین میکنند، اما عوامل محیطی و وضعیت مادر نقش مهمی در شکلگیری دقیق و عملکرد بهینه اندامها دارند. تغییرات محیطی میتوانند بر بیان ژنها، مسیرهای سیگنالینگ و مکانیسمهای اپیژنتیک اثر بگذارند و در نهایت ساختار و عملکرد اندامها را تحت تأثیر قرار دهند.
یکی از شناختهشدهترین عوامل محیطی، وضعیت متابولیک مادر است. به عنوان مثال، دیابت مادرزادی میتواند با ایجاد تغییرات ژنتیکی و اپیژنتیکی در جنین منجر به نقصهای مادرزادی شود. مطالعهها نشان دادهاند که افزایش گلوکز در محیط جنینی میتواند مسیرهای سیگنالینگ مانند Wnt و Hedgehog را تغییر دهد و رشد قلب، کلیه و اندامهای حرکتی را مختل کند. علاوه بر این، دیابت مادر میتواند باعث تغییر الگوهای متیلاسیون DNA و هیستون شود و تعادل بین تقسیم و تمایز سلولی را در جنین بر هم زند.
مواد شیمیایی محیطی و داروها نیز اثرات قابل توجهی بر تکوین اندامها دارند. قرارگیری در معرض داروهای خاص، مواد آلاینده، فلزات سنگین یا ترکیبات هورمونی میتواند باعث اختلال در مسیرهای سیگنالینگ و بیان ژنها شود. برای مثال، قرارگیری در معرض ترکیبات رتینوئیدی بیش از حد میتواند مسیرهای Retinoic Acid را در جنین تحریک یا سرکوب کند و منجر به ناهنجاریهای اندامی مانند نقصهای قلبی و صورت شود. همچنین، برخی داروها مانند Talidomide در دوره حساس تکوینی باعث اختلال در شکلگیری اندامهای حرکتی میشوند، که نمونهای کلاسیک از تأثیر مستقیم محیط بر ژنها و ساختار اندام است.
تغذیه مادر نقش حیاتی در تکوین اندامها دارد. کمبود ویتامینها و عناصر معدنی مانند فولیک اسید، ویتامین D و روی میتواند باعث تغییر بیان ژنهای کلیدی در تکوین قلب، مغز و اندامهای حرکتی شود. فولیک اسید به ویژه برای فرآیندهای متیلاسیون DNA حیاتی است و کمبود آن میتواند منجر به نقصهای لوله عصبی شود. ویتامین D نیز با تنظیم مسیرهای سیگنالینگ و بیان ژنهای مربوط به استخوان و عضله، رشد و تمایز سلولهای استخوانی و عضلانی را کنترل میکند.
استرس و شرایط فیزیولوژیک مادر نیز تأثیر قابل توجهی دارند. هورمونهای استرس مانند کورتیزول میتوانند مسیرهای ژنی و سیگنالینگ را تغییر دهند و تکامل اندامها، به ویژه مغز و قلب، را تحت تأثیر قرار دهند. مطالعهها نشان دادهاند که استرس مزمن مادر در طول بارداری باعث تغییرات اپیژنتیک در جنین میشود که اثرات بلندمدت بر رشد، پاسخ به محیط و عملکرد اندامها دارد.
عوامل ژنتیکی مادرزادی و ترکیبی نیز تأثیر مستقیمی بر تکوین اندامها دارند. جهشها یا پلیمورفیسمهای ژنی که مادر یا جنین به ارث میبرند، میتوانند مسیرهای سیگنالینگ، بیان ژنها و مکانیسمهای اپیژنتیک را تغییر دهند. برای مثال، جهش در ژنهای شبکه DACH/EYA/SIX میتواند باعث اختلال در شکلگیری چشم، کلیه و اندامهای حرکتی شود. همچنین، تعامل این جهشها با عوامل محیطی مانند مواد غذایی یا استرس، اثرات ترکیبی و پیچیدهای بر تکوین اندامها ایجاد میکند.
عوامل محیطی در طول زندگی جنینی نیز اهمیت دارند. تغییرات دما، سطح اکسیژن، ترکیبات هورمونی و تماس با مواد شیمیایی میتوانند مسیرهای تکوینی و تمایز سلولی را تغییر دهند. برای مثال، کاهش سطح اکسیژن در مراحل اولیه جنینی میتواند بیان ژنهای مرتبط با عروق و بافت قلب را مختل کند و منجر به ناهنجاریهای عروقی شود.
تأثیر اپیژنتیک محیطی نیز در این زمینه قابل توجه است. عوامل محیطی میتوانند تغییرات موقتی یا پایدار در متیلاسیون DNA، تغییرات هیستونی و فعالیت miRNAها ایجاد کنند. این تغییرات میتوانند نسل بعدی سلولها را تحت تأثیر قرار دهند و اثرات طولانیمدت بر شکل و عملکرد اندامها ایجاد کنند. به عنوان مثال، قرارگیری در معرض ترکیبات استرسزا یا داروهای خاص میتواند تغییرات اپیژنتیک ایجاد کند که تا مراحل بعدی زندگی جنین باقی بمانند و حتی احتمال بیماریهای مزمن را افزایش دهند.
در نهایت، تعامل بین ژنتیک و محیط مادرزادی تعیینکننده کیفیت و صحت تکوین اندامها است. درک این تعاملها نه تنها به شناخت مکانیسمهای پایهای توسعه کمک میکند، بلکه پایهای برای پیشگیری و مداخله در نقصهای مادرزادی و ارتقای سلامت جنین فراهم میآورد. با استفاده از مدلهای تجربی و تکنیکهای مدرن، پژوهشگران میتوانند اثرات دقیق عوامل محیطی و مادرزادی بر ژنها و مسیرهای تکوینی را شناسایی کرده و استراتژیهای پیشگیری و درمان هدفمند را توسعه دهند.
ژنتیک بیماریها و اختلالات مرتبط با اندامها
ژنها نه تنها مسئول رشد و توسعه طبیعی اندامها هستند، بلکه نقش تعیینکنندهای در ایجاد بیماریها و اختلالات اندامی نیز دارند. هرگونه اختلال در بیان ژنها، جهشها، تغییرات اپیژنتیک یا اختلال در مسیرهای سیگنالینگ میتواند منجر به ناهنجاریهای ساختاری و عملکردی شود. این ناهنجاریها میتوانند از نقصهای مادرزادی ساده تا بیماریهای پیچیده و مزمن را شامل شوند.
یکی از شناختهشدهترین گروه اختلالات، نقصهای مادرزادی اندامها است. این نقصها غالباً ناشی از جهشهای ژنی یا اختلال در مسیرهای سیگنالینگ حیاتی مانند Hedgehog، Wnt و Notch هستند. به عنوان مثال، اختلال در مسیر Hedgehog میتواند منجر به ناهنجاریهای قلبی و مغزی شود، در حالی که جهش در ژنهای خانواده DACH/EYA/SIX باعث اختلال در شکلگیری چشم، گوش و اندامهای حرکتی میشود. چنین اختلالاتی معمولاً با تغییرات اپیژنتیک و محیطی تشدید میشوند و میتوانند عوارض طولانیمدتی بر سلامت فرد ایجاد کنند.
اختلالات رشد و اندازه اندامها نیز نقش ژنتیک را به وضوح نشان میدهند. مسیرهای Hippo و Retinoic Acid با کنترل تقسیم و تمایز سلولی، تعیینکننده اندازه و شکل نهایی اندامها هستند. اختلال در این مسیرها میتواند باعث هیپرتروفی یا هیپوپلازی اندامها شود. به عنوان مثال، سرکوب مسیر Hippo در سلولهای قلبی یا کبدی میتواند باعث بزرگ شدن غیرطبیعی این اندامها شود، در حالی که کاهش فعالیت این مسیر منجر به رشد ناکافی و نقص عملکردی میشود.
بیماریهای متابولیک و اختلالات عملکردی اندامها نیز ارتباط نزدیکی با ژنتیک دارند. ژنهای تنظیمکننده متابولیسم، مانند آنهایی که در مسیرهای NF-κB و unfolded protein response فعالیت دارند، نقش حیاتی در حفظ هومئوستازی سلولی و عملکرد اندامها ایفا میکنند. اختلال در این ژنها میتواند منجر به بیماریهایی مانند دیابت، بیماریهای کبدی و اختلالات عضلانی شود. مطالعه این ژنها و مسیرها در مدلهای تجربی، امکان شناسایی درمانهای هدفمند و پیشگیری از آسیبهای اندامی را فراهم میکند.
تومورهای اندامی و سرطانها نیز به شدت تحت تأثیر ژنتیک و مسیرهای سیگنالینگ هستند. ژنهای تنظیمکننده رشد و مرگ سلولی مانند DACH/EYA/SIX، Hippo و Osteopontin میتوانند در ایجاد تومورها نقش داشته باشند. اختلال در این ژنها باعث افزایش تکثیر سلولی، کاهش آپوپتوز و تغییرات ساختاری در بافتها میشود. به عنوان مثال، تغییر بیان Osteopontin در بافتهای جامد میتواند پیشرفت تومورها و متاستاز را تسریع کند. درک این مکانیسمها زمینه را برای توسعه داروهای هدفمند و درمانهای ژنتیکی فراهم میآورد.
اختلالات عروقی و قلبی-عروقی نیز نمونهای از نقش ژنتیک در عملکرد اندامها هستند. ژنهایی که در توسعه سلولهای اندوتلیال و شکلگیری عروق فعالیت دارند، مانند مسیرهای Notch و Wnt، برای رشد طبیعی قلب و سیستم عروقی ضروری هستند. اختلال در این مسیرها میتواند باعث نقصهای قلبی مادرزادی، هیپرتنشن و بیماریهای مزمن عروقی شود. مطالعات تک سلولی و مدلهای organ-on-a-chip امکان بررسی دقیق اثر جهشهای ژنی و تغییرات سیگنالینگ بر عملکرد سلولهای عروقی را فراهم کردهاند.
اختلالات کلیوی و ادراری نیز اغلب منشأ ژنتیکی دارند. مسیرهای سیگنالینگ مانند Wnt، Hedgehog و Notch در توسعه کلیهها و مجاری ادراری نقش حیاتی دارند. جهش یا اختلال در این مسیرها میتواند منجر به هیپوپلازی کلیه، بیماریهای فیبروتیک و اختلالات عملکردی ادراری شود. مطالعه ژنتیک این مسیرها در مدلهای حیوانی و organoids کلیه، امکان شناسایی ژنهای حیاتی و مکانیسمهای بیماری را فراهم میکند.
اختلالات حرکتی و عضلانی نیز نقش ژنتیک را برجسته میکنند. ژنهای تنظیمکننده تمایز سلولهای مزانشیمی به سلولهای عضلانی و غضروفی، مانند GRFs و مسیرهای Retinoic Acid، برای رشد طبیعی اندامهای حرکتی ضروری هستند. اختلال در این ژنها میتواند باعث کاهش حجم عضلانی، نقصهای استخوانی و اختلال در عملکرد حرکتی شود. این اختلالات نه تنها کیفیت زندگی فرد را کاهش میدهند، بلکه نیازمند مداخلات پزشکی و توانبخشی طولانیمدت هستند.
در نهایت، اختلالات ایمنی و التهاب مزمن اندامها نیز تحت تأثیر ژنتیک هستند. ژنهایی که در توسعه و عملکرد سلولهای Treg و مسیرهای التهابی فعالیت دارند، مانند مسیرهای NF-κB و miRNAها، نقش حیاتی در حفظ هومئوستازی اندامها ایفا میکنند. اختلال در این ژنها میتواند باعث التهاب مزمن، فیبروز و اختلال در عملکرد اندامها شود، که نمونهای از تعامل بین ژنتیک و پاسخ ایمنی است.
بنابراین، ژنتیک بیماریها و اختلالات اندامی یک زمینه پیچیده و چندلایه است که شامل نقصهای مادرزادی، اختلالات رشد، تومورها، بیماریهای متابولیک و اختلالات عملکردی است. مطالعه دقیق ژنها، مسیرهای سیگنالینگ و تغییرات اپیژنتیک در مدلهای تجربی، امکان درک عمیق این اختلالات و توسعه درمانهای هدفمند و پیشگیرانه را فراهم میکند.
جهشها، واریانتها و آینده ژن درمانی در تکوین اندام
تکوین اندامها فرآیندی پیچیده و دقیق است که توسط تعامل بین ژنتیک، مسیرهای سیگنالینگ و محیط کنترل میشود. هرگونه اختلال در این شبکه منجر به ناهنجاریهای ساختاری و عملکردی میشود. یکی از مهمترین عوامل مؤثر در این فرآیند، جهشها و واریانتهای ژنی هستند که میتوانند اثرات کوتاهمدت و بلندمدت بر رشد و عملکرد اندامها داشته باشند.
جهشهای ژنی میتوانند شامل تغییرات نقطهای، حذفها، الحاقات یا بازآراییهای کروموزومی باشند. این جهشها ممکن است مسیرهای سیگنالینگ حیاتی مانند Hippo، Wnt، Hedgehog و Retinoic Acid را مختل کنند. به عنوان مثال، جهش در ژنهای شبکه DACH/EYA/SIX میتواند منجر به اختلال در شکلگیری چشم، گوش و اندامهای حرکتی شود، در حالی که جهشهای مرتبط با مسیر Hippo ممکن است رشد غیرطبیعی اندامها یا تومورها را ایجاد کنند.
واریانتهای ژنی، که شامل تغییرات طبیعی در توالی DNA بین افراد یک گونه هستند، نیز تأثیر مهمی بر تکوین اندام دارند. برخی واریانتها میتوانند حساسیت به عوامل محیطی، تغذیهای یا دارویی را تغییر دهند و خطر بروز نقصهای اندامی را افزایش دهند. به عنوان مثال، واریانتهای ژنی در مسیرهای Retinoic Acid میتوانند پاسخ جنین به ویتامین A را تغییر دهند و در صورت مصرف بیش از حد یا کمبود آن، اختلالات اندامی ایجاد کنند.
درک اثرات جهشها و واریانتها بر تکوین اندامها به کمک تکنیکهای مدرن ژنومی مانند single-cell RNA sequencing و CRISPR-Cas9 امکانپذیر شده است. این تکنیکها نه تنها تغییرات توالی ژنی را شناسایی میکنند، بلکه اثرات آنها بر بیان ژنها، مسیرهای سیگنالینگ و تمایز سلولی را نیز آشکار میسازند. مطالعات تکسلولی به ویژه امکان شناسایی سلولها و مسیرهایی را فراهم میکنند که به شدت تحت تأثیر جهشها قرار میگیرند و نقشی حیاتی در شکلگیری اندامها دارند.
ژن درمانی به عنوان یک حوزه نوظهور، افقهای جدیدی برای اصلاح نقصهای ژنتیکی و بهبود تکوین اندامها فراهم کرده است. استفاده از وکتورهای ویروسی، CRISPR و سایر فناوریهای ویرایش ژن، امکان اصلاح جهشها یا تنظیم بیان ژنها را فراهم میآورد. به عنوان مثال، اصلاح ژنهای مرتبط با مسیرهای Hippo و Wnt در مدلهای حیوانی، باعث بهبود رشد اندامها و ترمیم آسیبهای مادرزادی شده است.
یکی از کاربردهای ژن درمانی در آینده، درمان نقصهای مادرزادی پیش از تولد است. پژوهشها در مدلهای حیوانی نشان دادهاند که ویرایش ژنهای معیوب در مراحل اولیه جنینی میتواند اختلالات ساختاری را پیشگیری یا به حداقل برساند. این رویکرد با ترکیب دانش ژنتیک، سلولی و اپیژنتیک، امکان درمان هدفمند و شخصیسازیشده را فراهم میکند.
چالشهای ژن درمانی نیز وجود دارد که شامل پاسخ ایمنی به وکتورها، دقت و اثربخشی ویرایش ژن و اثرات طولانیمدت بر رشد و سلامت اندامها است. علاوه بر این، تداخل بین ژنتیک و محیط میتواند نتیجه ژن درمانی را تحت تأثیر قرار دهد. بنابراین، توسعه ژن درمانی نیازمند مطالعات جامع و چندرشتهای است که اثرات محیطی، اپیژنتیک و مسیرهای سیگنالینگ را همزمان بررسی کند.
مستقبل ژن درمانی در تکوین اندامها بسیار امیدوارکننده است. با پیشرفت فناوریهای ویرایش ژن، مدلسازی اندامها با استفاده از organoids و organ-on-a-chip و درک عمیق از تعامل بین ژنها و محیط، میتوان انتظار داشت که بسیاری از نقصهای مادرزادی، اختلالات رشد و حتی برخی بیماریهای مزمن اندامی در آینده قابل پیشگیری یا درمان هدفمند باشند. این روند میتواند تحولی در پزشکی پیشگیرانه، درمانهای شخصیسازیشده و بازسازی بافتها ایجاد کند.
در نهایت، درک جهشها، واریانتها و بهرهگیری از ژن درمانی، نه تنها پایه علمی قوی برای بررسی تکوین اندامها فراهم میکند، بلکه مسیرهای درمانی نوآورانه و پیشگیرانه را در پزشکی مدرن باز میگشاید. با تلفیق دانش ژنتیک، بیولوژی سلولی، اپیژنتیک و فناوریهای پیشرفته، امکان ارتقای سلامت اندامها و کاهش اختلالات مادرزادی در نسلهای آینده فراهم میشود.
جمعبندی و نتیجهگیری
تکوین اندامها فرآیندی پیچیده و هماهنگ است که توسط ژنها، مسیرهای سیگنالینگ، مکانیسمهای اپیژنتیک و تعامل با محیط کنترل میشود. در طول این مقاله، ما بررسی جامع و عمیقی از نقش ژنتیک در رشد و توسعه اندامها داشتیم و نشان دادیم که هر مرحله از این فرآیند، از تعیین هویت سلولی گرفته تا ساختار نهایی اندامها، تحت تأثیر دقیق ژنها و شبکههای تنظیمی آنها قرار دارد.
ژنها به عنوان برنامهریزان اصلی تکوین اندام عمل میکنند. آنها با تنظیم بیان پروتئینها و مسیرهای سیگنالینگ، تمایز سلولی، تقسیم و مرگ سلولی، و شکلگیری ساختارهای پیچیده اندامی را کنترل میکنند. مسیرهایی مانند Hedgehog، Wnt، Notch، Hippo و Retinoic Acid نقش حیاتی در تعیین اندازه، شکل و عملکرد اندامها دارند. اختلال در هر یک از این مسیرها میتواند باعث ناهنجاریهای مادرزادی، نقصهای عملکردی و حتی بروز تومورها شود.
مکانیسمهای اپیژنتیک، از جمله متیلاسیون DNA، تغییرات هیستونی و RNAهای کوچک، به ژنها امکان میدهند تا پاسخهای دینامیک و سازگارانه به محیط و سیگنالهای درونسلولی نشان دهند. این مکانیسمها توضیح میدهند که چگونه یک ژن میتواند در شرایط مختلف، اثرات متفاوتی داشته باشد و چرا برخی ناهنجاریها حتی بدون تغییر در توالی DNA رخ میدهند.
تحولات سلولی و تغییرات ساختاری که در طول تکوین رخ میدهند، از تمایز و مهاجرت سلولها تا بازسازی و بازچیدمان بافتها، به شدت به کنترل ژنتیک و مسیرهای سیگنالینگ وابسته هستند. این فرآیندها تضمین میکنند که سلولها در زمان و مکان مناسب تکثیر و تمایز پیدا کنند و بافتها عملکرد طبیعی خود را حفظ کنند. اختلال در این فرآیندها منجر به ناهنجاریهای پیچیده اندامی و کاهش کارایی عملکردهای بدن میشود.
مدلهای تجربی و تکنیکهای نوین، از جمله مدلهای حیوانی، organoids و organ-on-a-chip، امکان بررسی دقیق نقش ژنها و مسیرهای سیگنالینگ در تکوین اندامها را فراهم کردهاند. این مدلها، علاوه بر درک پایهای، زمینه را برای توسعه درمانهای ژنتیکی و داروهای هدفمند فراهم میکنند. تکنیکهای تکسلولی و ویرایش ژن با CRISPR، امکان بررسی جهشها و واریانتها و پیشبینی اثرات آنها بر رشد اندام را فراهم میآورند.
تأثیر عوامل محیطی و مادرزادی بر ژنها و تکوین اندام نیز اهمیت بسزایی دارد. شرایط تغذیهای مادر، استرسهای محیطی، بیماریها و عوامل دارویی میتوانند با تغییر بیان ژنها و مسیرهای سیگنالینگ، رشد و توسعه اندامها را تحت تأثیر قرار دهند. این تعامل بین ژنها و محیط، زمینه را برای توسعه استراتژیهای پیشگیرانه و درمانهای شخصیسازیشده فراهم میکند.
ژنتیک بیماریها و اختلالات اندامی نشان داد که چگونه نقصهای ژنتیکی، جهشها و اختلالات مسیرهای سیگنالینگ میتوانند منجر به بیماریهای مادرزادی، نقصهای رشد، تومورها و اختلالات عملکردی شوند. شناسایی ژنهای کلیدی و مسیرهای دخیل، پایهای برای توسعه درمانهای هدفمند و بهبود کیفیت زندگی بیماران است.
ژن درمانی و آینده پزشکی بازساختی نمایانگر افقهای نوین در بازسازی و ترمیم اندامها است. با استفاده از فناوریهای ویرایش ژن، مدلسازی اندامها و درک عمیق از تعامل ژنها و محیط، امکان اصلاح نقصهای ژنتیکی پیش از تولد، بازسازی بافتهای آسیبدیده و توسعه درمانهای شخصیسازیشده فراهم میشود. این حوزه نه تنها پتانسیل کاهش اختلالات مادرزادی را دارد، بلکه میتواند مسیرهای درمانی نوآورانه برای بیماریهای مزمن و تومورها ایجاد کند.
در جمعبندی، تکوین اندامها نتیجه یک هماهنگی دقیق بین ژنها، مسیرهای سیگنالینگ، مکانیسمهای اپیژنتیک و محیط است. اختلال در هر یک از این اجزا میتواند پیامدهای جدی برای سلامت و عملکرد اندامها داشته باشد. با پیشرفت فناوریهای ژنتیکی، بیولوژی سلولی و مدلسازی اندامها، ما در مسیر درک کاملتر این فرآیندها و توسعه درمانهای نوین قرار داریم. آینده پژوهش در این حوزه، با تلفیق دانش پایه، تکنولوژی و پزشکی شخصیسازیشده، نویدبخش کاهش اختلالات اندامی و بهبود کیفیت زندگی انسانها است.
نتیجهگیری نهایی این است که درک جامع و یکپارچه نقش ژنها در تکوین اندامها، پایهای برای پزشکی پیشگیرانه، ژن درمانی، بازسازی بافتها و توسعه داروهای هدفمند فراهم میکند و مسیرهای نوآورانهای برای بهبود سلامت اندامی و پیشگیری از اختلالات مادرزادی ایجاد میکند. این دانش، با ترکیب ژنتیک، اپیژنتیک، مدلسازی تجربی و فناوریهای پیشرفته، زمینهای محکم برای آیندهای روشن در پزشکی مدرن و بازساختی فراهم میآورد.