نوآوریهای درمانی: پیوند مغز استخوان و سلولهای بنیادی خونی
مقدمه
در سالهای اخیر، پیوند مغز استخوان و سلولهای بنیادی خونی به یکی از برجستهترین نوآوریهای درمانی در علوم پزشکی تبدیل شده است. این درمانها، که پایهای از بازسازی بافتهای خونی و ایمنی بدن را فراهم میکنند، توانستهاند تحولات قابل توجهی در مدیریت بیماریهای خونی، اختلالات ایمنی و حتی برخی بیماریهای متابولیک ایجاد کنند. اهمیت این موضوع نه تنها در درمان بیماریهای پیشرفته و تهدیدکننده حیات، بلکه در بازتعریف مرزهای پزشکی بازسازیکننده و پزشکی شخصیسازیشده قابل مشاهده است.
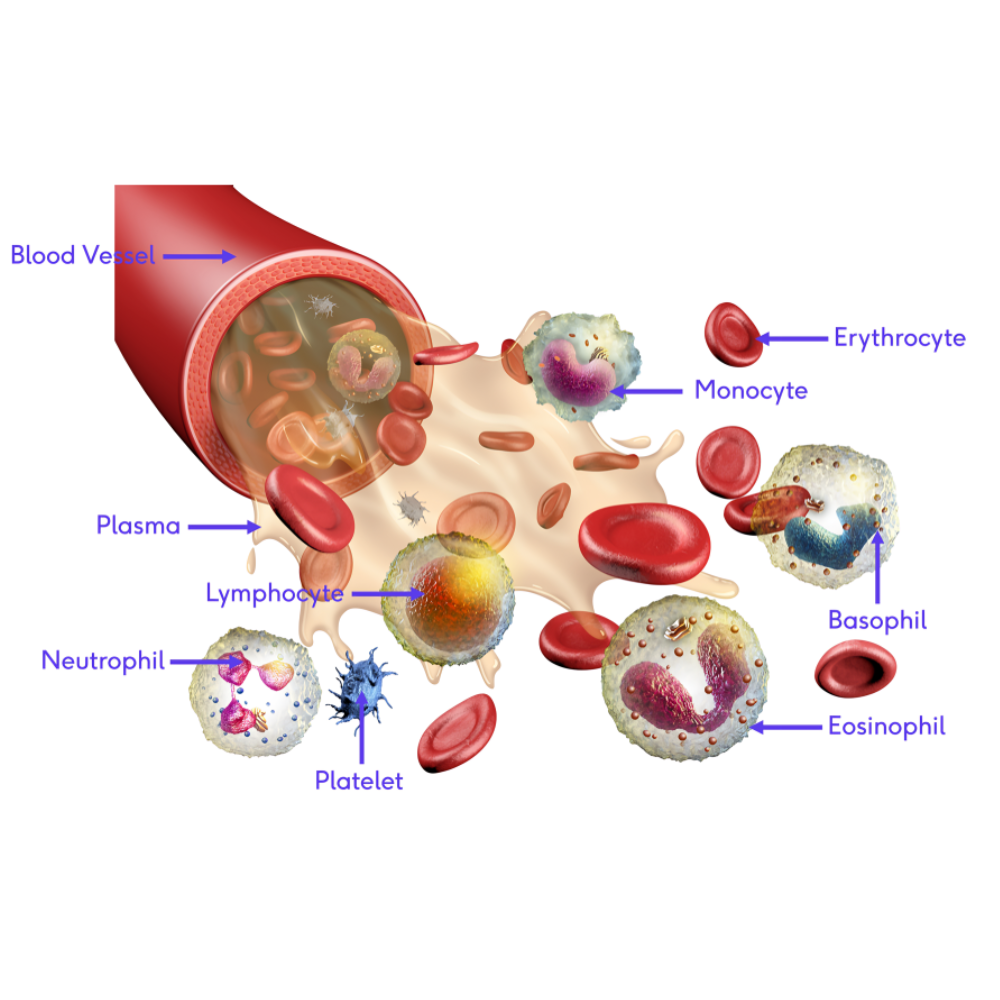
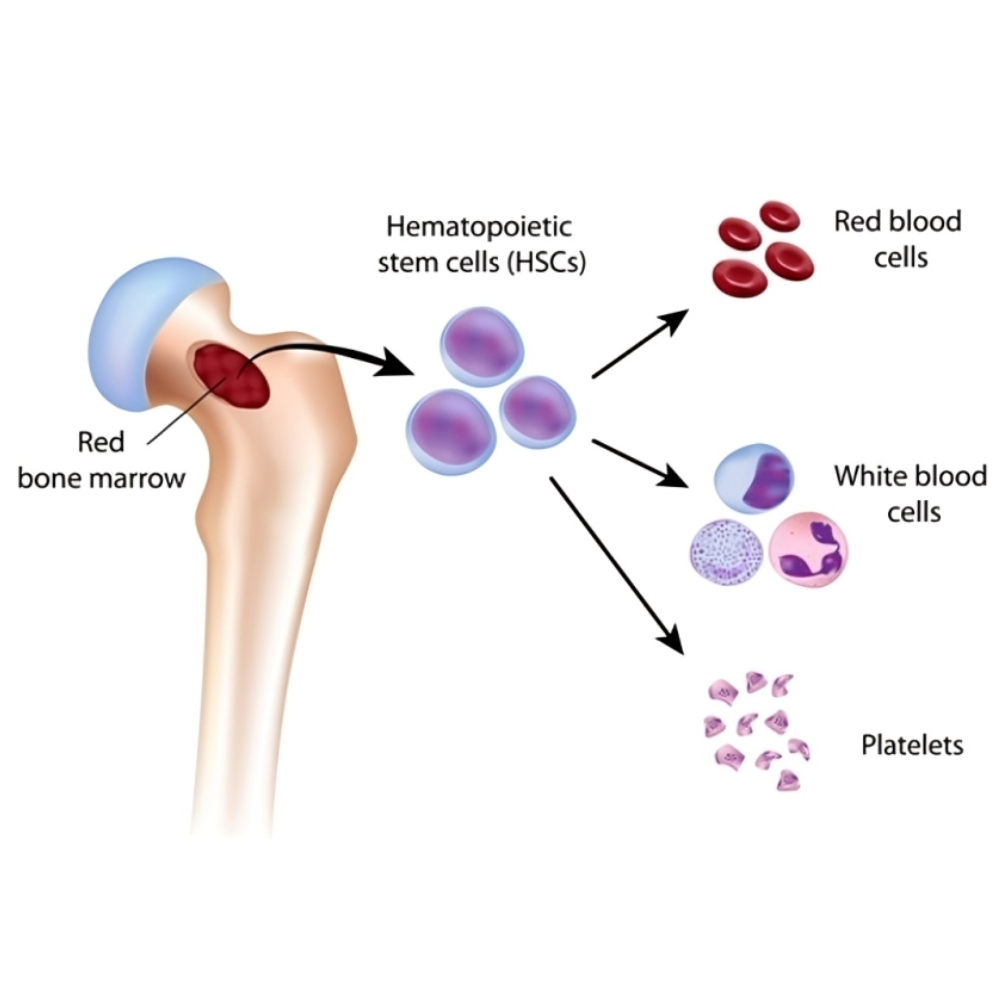
سلولهای بنیادی خونی، به ویژه سلولهای بنیادی هماتوپوئیتیک( Hematopoietic Stem Cells یا (HSCs ، دارای توانایی تمایز به تمامی اجزای خون شامل گلبولهای قرمز، گلبولهای سفید و پلاکتها هستند و نقش محوری در حفظ و بازسازی سیستم هماتوپوئز ایفا میکنند. این سلولها، به همراه سلولهای بنیادی مزانشیمی (MSCs) که توانایی بازسازی بافتهای حمایتی و تنظیم پاسخهای ایمنی را دارند، به عنوان ستونهای اصلی درمانهای بازساختی در نظر گرفته میشوند. پیوند سلولهای بنیادی، به ویژه در بیماریهایی که سلولهای خونی و سیستم ایمنی بیمار دچار اختلال شدید شدهاند، امکان بازگرداندن تعادل عملکردی بدن را فراهم میآورد و زندگی بسیاری از بیماران را نجات داده است.
تاریخچه پیوند مغز استخوان به بیش از شش دهه پیش بازمیگردد و از آن زمان تاکنون این درمانها به صورت مداوم تکامل یافتهاند. اولین پیوندهای موفق، عمدتاً محدود به مواردی بودند که تنها گزینه درمانی برای بیماران مبتلا به لوسمی یا سایر بیماریهای کشنده خونی بودند. اما با پیشرفت تکنولوژی سلولهای بنیادی و توسعه بانکهای سلولی، اکنون دامنه کاربرد پیوندهای مغز استخوان به بیماریهای خودایمنی، اختلالات متابولیک و حتی بیماریهای قلبی و عصبی گسترش یافته است. این تحولات نشان میدهند که پیوند سلول بنیادی تنها یک درمان جایگزین محدود به خون نیست، بلکه یک سکوی نوآوری برای توسعه درمانهای پیشرفته و شخصیسازیشده به شمار میرود.
در کنار پیشرفتهای علمی، نوآوریهای بالینی نیز مسیر این درمانها را هموار کردهاند. تکنیکهای جدید جمعآوری سلولهای بنیادی، استفاده از منابع غیرمعمول سلول بنیادی مانند خون بند ناف و پالپ دندان، و توسعه روشهای مهندسی ژنتیک، همگی به بهبود بقای سلولهای پیوندی و کاهش عوارض پس از پیوند کمک کردهاند. علاوه بر این، مراقبتهای بعد از پیوند و پایش دقیق وضعیت بیمار، به ویژه در زمینه پیشگیری از پسزدن پیوند (Graft-versus-Host Disease) و مدیریت عفونتها، نقش حیاتی در موفقیت درمان دارند.
یکی از نکات برجسته در نوآوریهای درمانی سلول بنیادی، ترکیب درمانهای کلاسیک با رویکردهای جدید مانند درمان ژنتیکی، داروهای هدفمند و سلولهای اصلاح شده در آزمایشگاه است. این رویکردها نه تنها شانس موفقیت پیوند را افزایش میدهند، بلکه امکان درمان بیماریهای پیچیدهای را فراهم میکنند که پیشتر گزینه درمانی مشخصی نداشتند. به عنوان مثال، در بیماران مبتلا به تالاسمی ماژور یا بیماریهای ذخیرهای متابولیک، استفاده همزمان از پیوند سلول بنیادی و درمان ژنی توانسته نتایج چشمگیری ارائه دهد و چشمانداز درمان این بیماران را به طور اساسی تغییر دهد.
همچنین، ملاحظات اخلاقی و قانونی پیرامون استفاده از سلولهای بنیادی، به ویژه منابع نوین مانند سلولهای بند ناف و پالپ دندان، اهمیت ویژهای یافته است. اطمینان از استانداردهای بالینی، رعایت اصول اخلاقی و فراهم آوردن اطلاعات شفاف برای بیماران، جزو ضروریات موفقیت و پذیرش اجتماعی این درمانها محسوب میشود.
در مجموع، پیوند مغز استخوان و سلولهای بنیادی خونی به عنوان یک نوآوری درمانی جامع، نه تنها تحولی در درمان بیماریهای خونی و ایمنی ایجاد کرده، بلکه سکویی برای توسعه درمانهای پیشرفته در بیماریهای عصبی، متابولیک و حتی قلبی به شمار میرود. این درمانها، با تلفیق تحقیقات پایه، پیشرفتهای تکنولوژیک و رویکردهای بالینی نوین، مسیر جدیدی را در پزشکی بازسازیکننده و درمانهای شخصیسازیشده گشودهاند و همچنان افقهای گستردهای برای کشف و توسعه راهکارهای نوین ارائه میدهند.
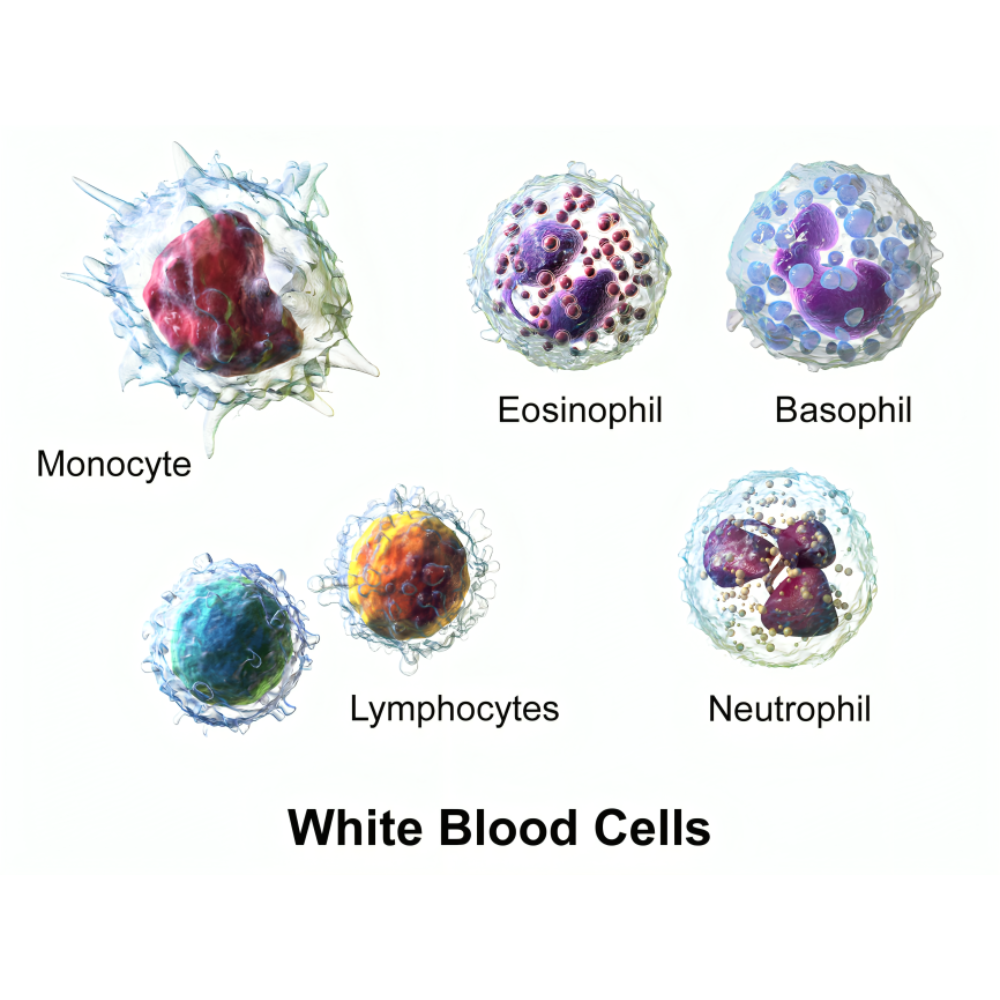
درک پایهای سلولهای بنیادی خونی و مغز استخوان
برای درک عمق نوآوریهای درمانی مبتنی بر پیوند مغز استخوان و سلولهای بنیادی خونی، ابتدا باید با مبانی علمی و زیستشناسی این سلولها آشنا شویم. سلولهای بنیادی خونی یا Hematopoietic Stem Cells (HSCs) جزو سلولهای تمایز نیافتهای هستند که توانایی خودتجدیدی و تمایز به انواع مختلف سلولهای خونی را دارند. این سلولها ستون اصلی بازسازی سیستم خون و ایمنی بدن را تشکیل میدهند و نقش حیاتی در هماتوپوئز، فرآیندی که طی آن سلولهای خونی تولید میشوند، ایفا میکنند.
مغز استخوان، بافت اسفنجی موجود در داخل استخوانهای بلند و برخی استخوانهای تخت، محل اصلی تولید سلولهای خونی است. این بافت علاوه بر اینکه محل ذخیره و تولید HSCها است، یک محیط میکروبی زیستی ایجاد میکند که عملکرد سلولهای بنیادی را پشتیبانی و تنظیم میکند. این محیط، که به آن نیش یا niche سلول بنیادی گفته میشود، شامل سلولهای استرومایی، عروق خونی کوچک، سلولهای مزانشیمی و ترکیبی از عوامل سیتوکینی و متابولیکی است که رشد و تمایز سلولهای بنیادی را کنترل میکند.
سلولهای بنیادی مزانشیمی (MSCs) نیز نقش مکملی در این سیستم دارند. این سلولها توانایی تمایز به سلولهای استخوانی، غضروفی و چربی را دارند و با تولید عوامل ضدالتهابی و تنظیم سیستم ایمنی، میتوانند در موفقیت پیوند سلول بنیادی نقش حیاتی ایفا کنند. ترکیب HSCها و MSCها در پیوندهای بالینی، به ویژه در شرایطی که سیستم ایمنی بیمار آسیب دیده است، امکان بازسازی بهتر و کاهش عوارض پس از پیوند را فراهم میآورد.
یکی از ویژگیهای اساسی سلولهای بنیادی هماتوپوئیتیک، توانایی خودتجدیدی است. این ویژگی به این معنی است که سلولهای بنیادی میتوانند هم به سلولهای مشابه خود تقسیم شوند و جمعیت سلولهای بنیادی را حفظ کنند و هم به سلولهای تخصصیتر مانند گلبولهای قرمز، گلبولهای سفید و پلاکتها تمایز پیدا کنند. این فرآیند در سیستم خونی سالم به طور دقیق تنظیم شده و نقش کلیدی در پاسخ به نیازهای بدن، مانند جایگزینی سلولهای خون از دست رفته یا مقابله با عفونتها، دارد.
در مقایسه با HSCها، سلولهای بنیادی مزانشیمی بیشتر در بازسازی بافتهای پشتیبان و ترمیم بافت آسیب دیده نقش دارند. این سلولها علاوه بر قابلیت تمایز، دارای ویژگیهای ایمنی تنظیمی هستند و میتوانند پاسخهای ایمنی نامطلوب را تعدیل کنند. این ویژگیها موجب شده است که MSCها در پیوندهای سلول بنیادی و درمان بیماریهای خودایمنی، به عنوان یک ابزار درمانی مکمل به کار گرفته شوند و عوارضی مانند پس زدن پیوند یا Graft-versus-Host Disease کاهش یابد.
منابع سلولهای بنیادی نیز تنوع قابل توجهی دارند. مغز استخوان بالغ، منبع اصلی HSCها برای بسیاری از پیوندها است، اما با پیشرفت تکنولوژی، منابع جایگزین مانند خون محیطی، خون بند ناف و حتی پالپ دندان نیز مورد استفاده قرار میگیرند. هر منبع دارای مزایا و محدودیتهای خاص خود است. به عنوان مثال، خون بند ناف حاوی سلولهای بنیادی بسیار جوان و فعال است و خطر ابتلا به عوارض پیوند را کاهش میدهد، اما حجم سلولهای قابل برداشت محدود است و ممکن است برای بیماران بزرگسال کافی نباشد.
ساختار مغز استخوان به گونهای طراحی شده است که سلولهای بنیادی هماتوپوئیتیک در یک میکروانبار تعادلی با سلولهای استرومایی، عروق کوچک و فاکتورهای رشد قرار دارند. این محیط امکان تنظیم دقیق فرآیند تمایز و خودتجدیدی را فراهم میکند. اختلال در این محیط میتواند به کاهش عملکرد سلولهای بنیادی، ایجاد نارسایی پیوند و حتی ابتلا به بیماریهای خونی منجر شود.
تفاوتهای عملکردی بین انواع سلولهای بنیادی نیز در انتخاب نوع پیوند و استراتژی درمانی اهمیت دارد. برای مثال، HSCها بیشتر برای جایگزینی سلولهای خونی و ایمنی استفاده میشوند، در حالی که MSCها به عنوان ابزار درمانی مکمل در پیشگیری از عوارض پیوند یا درمان اختلالات بافتی و التهابی به کار میروند. در نتیجه، ترکیب هوشمندانه این سلولها در طراحی درمانهای نوین، کلید موفقیت بسیاری از پیوندها و درمانهای بازساختی است.
درک این پایههای علمی، به متخصصان بالینی و محققان کمک میکند تا استراتژیهای بهینه برای جمعآوری، آمادهسازی و پیوند سلولهای بنیادی را طراحی کنند. همچنین این دانش، مسیر توسعه درمانهای نوین مانند پیوند سلول بنیادی مهندسی شده با ژن درمانی یا ترکیب سلولهای بنیادی و درمانهای دارویی هدفمند را هموار میسازد. بدون فهم عمیق از ساختار مغز استخوان و عملکرد سلولهای بنیادی، پیوندها نمیتوانند به موفقیت بالینی پایدار دست یابند و احتمال عوارض و پس زدن پیوند افزایش مییابد.
در نهایت، بخش درک پایهای سلولهای بنیادی و مغز استخوان، به ما نشان میدهد که پیوند سلولهای بنیادی فراتر از یک درمان جایگزین ساده است و به عنوان یک ابزار بازساختی قدرتمند، قابلیت اصلاح و ترمیم سیستمهای پیچیده بدن را دارد. این پایه علمی، مسیر ورود به مباحث پیشرفتهتر در نوآوریهای درمانی، انتخاب منابع سلولی، بهبود نتایج بالینی و مدیریت عوارض را فراهم میکند و اهمیت آن در طراحی و اجرای پیوندهای موفق غیرقابل انکار است.
انواع پیوندهای سلول بنیادی و مغز استخوان
پیوند سلولهای بنیادی و مغز استخوان یکی از مهمترین دستاوردهای پزشکی مدرن است که توانسته در درمان بیماریهای خونی و اختلالات ایمنی، انقلابی ایجاد کند. با این حال، موفقیت این درمانها به انتخاب نوع مناسب پیوند و منبع سلولهای بنیادی بستگی دارد. پیوندهای سلول بنیادی به طور کلی به سه دسته اصلی تقسیم میشوند: پیوند خودی (Autologous)، پیوند غیرخودی (Allogeneic) و پیوندهای هاپلواینتیک (Haploidentical). هر یک از این روشها دارای ویژگیها، مزایا و محدودیتهای خاصی هستند که در طراحی درمان و پیشبینی نتایج بالینی نقش اساسی دارند.
در پیوند خودی (Autologous)، سلولهای بنیادی از خود بیمار جمعآوری میشوند، فرآیند پردازش و نگهداری انجام میشود و سپس به بدن همان بیمار بازگردانده میشوند. مزیت اصلی این روش، کاهش شدید ریسک پس زدن پیوند و عوارضی مانند Graft-versus-Host Disease است، زیرا سلولها از منبع خود بیمار تامین میشوند و سیستم ایمنی به آنها واکنش نشان نمیدهد. با این حال، محدودیت مهم این روش در شرایطی است که سلولهای بنیادی خود بیمار به طور ذاتی دچار اختلال یا بیماری باشند. برای مثال، در برخی انواع لوسمی و دیگر بیماریهای خونی، سلولهای بنیادی بیمار ممکن است ناقص یا جهشیافته باشند و استفاده از آنها میتواند منجر به عود بیماری شود.
پیوند غیرخودی (Allogeneic) شامل استفاده از سلولهای بنیادی یک اهداکننده سالم است که ممکن است از اعضای خانواده یا بانکهای سلول بنیادی باشد. این نوع پیوند مزایای قابل توجهی دارد، زیرا سلولهای اهداکننده سالم و بدون اختلال هستند و میتوانند سیستم خونی و ایمنی بیمار را بازسازی کنند. با این حال، ریسک پس زدن پیوند و عوارضی مانند Graft-versus-Host Disease در این روش بسیار بیشتر است. بنابراین، تطابق آنتیژنی بین اهداکننده و گیرنده، پایش دقیق بیمار و مدیریت عوارض جانبی از اهمیت بالایی برخوردار است. پیشرفتهای نوین در انتخاب اهداکنندگان، استفاده از سلولهای بنیادی خون بند ناف و تکنیکهای پیشرفته مهندسی سلول، توانستهاند ریسکها را کاهش دهند و موفقیت پیوند را افزایش دهند.
پیوندهای هاپلواینتیک (Haploidentical) یک نوآوری درمانی نسبتاً جدید هستند که از اهداکنندگانی استفاده میکنند که تنها نیمی از آنتیژنهای اصلی HLA با گیرنده مشترک دارند. این روش به ویژه برای بیمارانی که اهداکننده کامل همسان ندارند، حیاتی است و امکان پیوند سریع و قابل دسترس را فراهم میکند. با استفاده از پروتکلهای نوین مانند Post-transplant Cyclophosphamide، ریسک پس زدن پیوند و عوارض ایمنی تا حد قابل توجهی کاهش یافته است. پیوندهای هاپلواینتیک فرصت درمان بیماران با بیماریهای خونی پیشرفته و شرایط اورژانسی را فراهم میکنند که پیشتر گزینه درمانی محدودی داشتند.
منابع سلولهای بنیادی نیز تأثیر زیادی بر انتخاب نوع پیوند و نتایج درمان دارند. مغز استخوان بالغ، همچنان منبع استاندارد HSCها برای بسیاری از پیوندها است، اما خون محیطی و خون بند ناف نیز به دلیل دسترسی آسانتر و ویژگیهای سلولی مطلوب، نقش فزایندهای پیدا کردهاند. سلولهای بنیادی خون بند ناف، به دلیل ویژگیهای ایمنی خاص و توانایی خودتجدیدی بالاتر، در کاهش عوارض پیوند و موفقیت درمان در بیماران کودک و بزرگسال موثر هستند. البته محدودیت این منبع، حجم سلولهای برداشت شده است که ممکن است برای بیماران بزرگسال کافی نباشد و نیاز به ترکیب با منابع دیگر باشد.
علاوه بر این، سلولهای بنیادی از منابع غیرمعمول مانند پالپ دندان و بافتهای مزانشیمی غیرمعمول نیز در درمانهای نوین مورد بررسی قرار گرفتهاند. این منابع جدید، به ویژه در بیماریهای خودایمنی و شرایطی که سلولهای بنیادی استاندارد محدود یا غیرقابل دسترس هستند، کاربرد دارند و نشاندهنده گسترش افقهای پیوند سلول بنیادی فراتر از منابع سنتی هستند.
هر نوع پیوند نیازمند آمادهسازی دقیق بیمار و سلولها است. در پیوند خودی، معمولاً بیمار تحت یک فرآیند پاکسازی یا conditioning قرار میگیرد تا سلولهای بیمار جایگزین شده و محیط مغز استخوان برای دریافت سلولهای بنیادی آماده شود. در پیوند غیرخودی و هاپلواینتیک، آمادهسازی پیچیدهتر است و شامل سرکوب سیستم ایمنی بیمار برای جلوگیری از پس زدن پیوند و کنترل واکنشهای ایمنی میشود. مراقبتهای بعد از پیوند، پایش دقیق کیمریسم و مدیریت عوارض، کلید موفقیت طولانی مدت این درمانها است.
از منظر بالینی، انتخاب نوع پیوند به نوع بیماری، سن بیمار، دسترسی به منابع سلول بنیادی و وضعیت سلامت عمومی بیمار بستگی دارد. بیماران مبتلا به لوسمی یا تالاسمی ماژور ممکن است نیاز به پیوند غیرخودی یا هاپلواینتیک داشته باشند، در حالی که بیماران مبتلا به اختلالات موقتی یا درمانهای تکمیلی، میتوانند از پیوند خودی بهرهمند شوند.
در نهایت، درک کامل انواع پیوندهای سلول بنیادی و مغز استخوان، همراه با شناخت منابع سلولهای بنیادی و ویژگیهای هر روش، پایهای برای طراحی درمانهای نوین، کاهش عوارض و افزایش موفقیت بالینی محسوب میشود. این دانش، مسیر ورود به بخشهای بعدی مقاله را فراهم میکند، جایی که به بررسی کاربردهای بالینی، پیشرفتهای نوین و چالشهای درمانی خواهیم پرداخت.
موارد استفاده و شاخصهای درمانی
پیوند مغز استخوان و سلولهای بنیادی خونی، امروز به عنوان یک ابزار درمانی پیشرفته، دامنه وسیعی از بیماریها را پوشش میدهد و نه تنها جایگزینی سلولهای از دست رفته، بلکه بازسازی سیستم ایمنی و ارتقای عملکرد بافتها را امکانپذیر میسازد. از منظر بالینی، استفاده از این درمانها به دو دسته اصلی تقسیم میشود: بیماریهای خونی و اختلالات ایمنی، و کاربردهای درمانی در بیماریهای غیرخونی و بافتی.
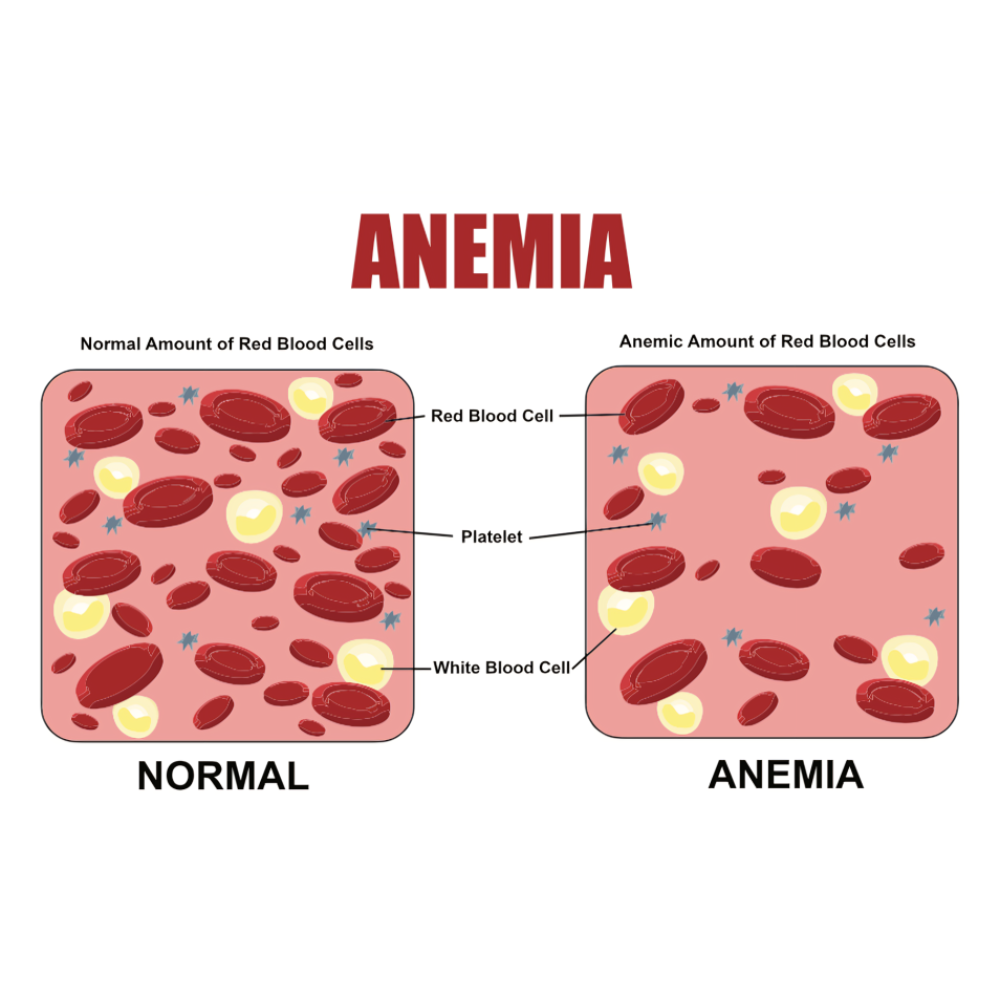
در بیماریهای خونی، پیوند سلولهای بنیادی به ویژه برای درمان لوسمیهای حاد و مزمن، تالاسمی ماژور، کمخونی داسی شکل و دیگر ناهنجاریهای ژنتیکی خون، یک گزینه حیاتی به شمار میآید. در لوسمی، سیستم خونی بیمار با سلولهای سرطانی جایگزین شده و عملکرد طبیعی خون مختل میشود. پیوند سلول بنیادی از اهداکننده سالم، امکان بازسازی کامل سیستم هماتوپوئز و ایمنی را فراهم میکند و شانس بقای بیمار را به شکل قابل توجهی افزایش میدهد. در تالاسمی و کمخونی داسی شکل، پیوند سلول بنیادی میتواند بیماری را درمان کرده و وابستگی به تزریق مداوم خون را کاهش دهد، که این امر کیفیت زندگی بیماران را بهبود میبخشد و طول عمر آنان را افزایش میدهد.
اختلالات ایمنی و خودایمنی نیز یکی از حوزههای کاربردی مهم پیوند سلول بنیادی هستند. در بیماریهایی مانند مولتیپل اسکلروزیس، لوپوس اریتماتوز سیستمیک و کولیت اولسراتیو، سیستم ایمنی بدن به سلولهای خودی حمله میکند و باعث آسیب بافتی و اختلال عملکرد میشود. پیوند غیرخودی سلولهای بنیادی، با جایگزینی سیستم ایمنی آسیب دیده، امکان بازگرداندن تعادل عملکردی را فراهم میآورد. علاوه بر این، سلولهای بنیادی مزانشیمی به دلیل خواص ضدالتهابی و تنظیمی خود، در کاهش عوارض پس از پیوند و پیشگیری از تشدید بیماری نقش حیاتی دارند.
پیوند سلولهای بنیادی همچنین در اختلالات ذخیرهای و متابولیک کاربرد دارد. بیماریهایی مانند سندرومهای ذخیرهای لیزوزومی و بیماریهای ذخیرهای گلیکوژن که به دلیل نقص آنزیمی منجر به تجمع مواد در سلولها میشوند، از جمله شرایطی هستند که درمانهای مرسوم تنها علائم را کنترل میکنند. استفاده از پیوند HSC به همراه مهندسی ژن درمانی میتواند این اختلالات را در سطح سلولی اصلاح کند و مسیر درمانی بلندمدت و موثر فراهم آورد.
یکی از حوزههای نوین کاربرد پیوند سلول بنیادی، درمان اختلالات قلبی و عروقی است. مطالعات نشان دادهاند که تزریق سلولهای بنیادی مغز استخوان در بیماران دچار انفارکتوس حاد میوکارد میتواند به بازسازی بخشی از بافت قلب آسیب دیده کمک کند و عملکرد قلب را بهبود دهد. اگرچه این درمان هنوز در مرحله آزمایشی و بالینی محدود است، اما نتایج اولیه نویدبخش توسعه رویکردهای بازساختی در بیماریهای غیرخونی هستند.
کاربردهای عصبی و درمان بیماریهای نورودژنراتیو نیز از جمله نوآوریهای هیجانانگیز در زمینه سلولهای بنیادی هستند. بیماریهایی مانند پارکینسون، آلزایمر و آسیبهای نخاعی به دلیل تخریب سلولهای عصبی، باعث کاهش عملکرد عصبی و کیفیت زندگی میشوند. مطالعات پیش بالینی و کارآزماییهای بالینی اولیه نشان دادهاند که سلولهای بنیادی میتوانند با ترمیم یا جایگزینی سلولهای آسیب دیده، کاهش پیشرفت بیماری را ممکن سازند. در این زمینه، ترکیب سلولهای بنیادی پرتوان و سلولهای تخصصی عصبی، افقهای جدیدی در درمان بیماریهای نورودژنراتیو ایجاد کرده است.
در زمینه بیماریهای متابولیک و غددی، نوآوریها شامل تمایز سلولهای بنیادی پرتوان انسانی به سلولهای پانکراسی و ترشحکننده انسولین است. این رویکرد، به ویژه در درمان دیابت نوع 1 مورد توجه قرار گرفته است و امکان بازسازی عملکرد لوزالمعده و کنترل قند خون را فراهم میآورد. اگرچه چالشهایی مانند کنترل ایمنی و پایداری عملکرد سلولها وجود دارد، این فناوری پتانسیل ایجاد درمانهای دائمی و جایگزین تزریقهای روزانه انسولین را دارد.
یکی از نکات اساسی در کاربردهای درمانی، شاخصهای انتخاب بیمار و شرایط بالینی او است. موفقیت پیوند سلول بنیادی به عواملی مانند سن بیمار، وضعیت عملکردی ارگانها، نوع بیماری و شدت آن، و دسترسی به منابع سلولهای بنیادی مناسب بستگی دارد. به عنوان مثال، بیماران جوان و سالم با بیماریهای خونی مزمن، معمولاً نتایج بهتری از پیوند خودی یا غیرخودی خواهند داشت، در حالی که بیماران مسن یا با آسیب شدید ارگانها نیاز به مراقبتهای ویژه و ارزیابی دقیق قبل از پیوند دارند.
نکته مهم دیگر، شاخصهای موفقیت پیوند و پایش بیمار بعد از درمان است. این شامل پایش کیمریسم، ارزیابی عملکرد مغز استخوان، کنترل عوارض پس از پیوند مانند Graft-versus-Host Disease و عفونتها، و همچنین پیگیری طولانیمدت برای پیشگیری از عود بیماری میشود. تکنیکهای نوین پایش و مدلهای پیشرفته بالینی، امکان مدیریت بهتر این شاخصها و افزایش موفقیت درمان را فراهم میکنند.
در مجموع، پیوند مغز استخوان و سلولهای بنیادی، یک درمان جامع و چندجانبه است که میتواند طیف وسیعی از بیماریها را هدف قرار دهد. از بازسازی سیستم خونی و ایمنی گرفته تا درمان بیماریهای نورودژنراتیو و قلبی، این نوآوریها نشاندهنده تحولات بنیادی در پزشکی مدرن هستند. انتخاب نوع پیوند، منابع سلولی و مدیریت بالینی دقیق، کلید دستیابی به نتایج موفق و کاهش عوارض در بیماران است.
پیشرفتها و نوآوریهای درمانی در پیوند سلول بنیادی
پیوند سلولهای بنیادی و مغز استخوان طی شش دهه گذشته، تحولات چشمگیری را تجربه کرده است. از روشهای اولیه که صرفاً جایگزینی سلولهای خونی آسیب دیده را هدف قرار میدادند، به سمت درمانهای ترکیبی، مهندسی شده و شخصیسازی شده حرکت کردهایم. این پیشرفتها شامل بهبود روشهای جمعآوری سلول، انتخاب منابع سلولی بهینه، مهندسی ژنتیک، ترکیب سلولهای بنیادی با داروهای هدفمند و بهبود مراقبتهای بالینی پس از پیوند است.
یکی از مهمترین نوآوریها در پیوند سلول بنیادی، استفاده از منابع سلولهای بنیادی غیرمعمول است. علاوه بر مغز استخوان بالغ، خون محیطی و خون بند ناف، منابع جدیدی مانند پالپ دندان، بافت چربی و سلولهای مزانشیمی از منابع غیرمتعارف مورد توجه قرار گرفتهاند. این منابع نوین، به ویژه در شرایطی که دسترسی به اهداکننده همسان محدود است، امکان تامین سلولهای سالم با توانایی تمایز بالا و خواص ایمنی مطلوب را فراهم میکنند. تحقیقات اخیر نشان دادهاند که ترکیب این سلولها با پیوندهای کلاسیک میتواند میزان موفقیت پیوند و بازسازی سیستم ایمنی را افزایش دهد و عوارض جانبی را کاهش دهد.
مهندسی ژنتیک سلولهای بنیادی نیز یکی از پیشرفتهای کلیدی در نوآوریهای درمانی است. با استفاده از تکنولوژیهای ویرایش ژن مانند CRISPR/Cas9، محققان قادر هستند سلولهای بنیادی را به گونهای اصلاح کنند که عملکرد بهینهتری داشته باشند، مقاومت بیشتری در برابر بیماریها پیدا کنند و توانایی بازسازی سیستم ایمنی را افزایش دهند. این رویکرد در درمان بیماریهای ذخیرهای متابولیک، تالاسمی ماژور، کمخونی داسی شکل و حتی برخی لوسمیها نتایج امیدوارکنندهای داشته است. علاوه بر این، مهندسی ژنتیک امکان ایجاد سلولهای بنیادی مقاوم به پس زدن پیوند یا سلولهایی با توانایی تولید عوامل ضدالتهابی و ایمنی تعدیلکننده را فراهم کرده است.
یکی دیگر از پیشرفتهای کلیدی، بهبود روشهای جمعآوری و پردازش سلولهای بنیادی است. تکنیکهای مدرن اجازه میدهند سلولهای بنیادی با کیفیت بالاتر و قابلیت خودتجدیدی بیشتر جمعآوری شوند. استفاده از فاکتورهای رشد و محیطهای کشت تخصصی، تعداد سلولهای مورد نیاز برای پیوند را افزایش میدهد و امکان استفاده از منابع محدود مانند خون بند ناف را به حداکثر میرساند. این تکنولوژیها همچنین به کاهش عوارض جانبی، افزایش بقای سلولهای پیوندی و بهبود نتایج بالینی کمک میکنند.
در حوزه پیوند غیرخودی و هاپلواینتیک، پیشرفتهای درمانی شامل پروتکلهای نوین برای کاهش عوارض پس زدن پیوند و مدیریت ایمنی بیمار است. استفاده از Post-transplant Cyclophosphamide و سایر داروهای ایمونوساپرسیو هدفمند، امکان انجام پیوندهای هاپلواینتیک با موفقیت بالا را فراهم کرده است. این روشها به ویژه برای بیمارانی که اهداکننده همسان ندارند، انقلابی در دسترسی به درمان ایجاد کرده و مرزهای قبلی محدودیت در انتخاب اهداکننده را شکسته است.
ترکیب درمانهای سلولی با داروهای هدفمند و ایمونوتراپی نیز یکی از نوآوریهای حیاتی است. در بیماران مبتلا به لوسمی و سایر بیماریهای خونی، استفاده همزمان از سلولهای بنیادی و داروهای هدفمند میتواند هم کنترل بیماری را افزایش دهد و هم بقای سلولهای پیوندی را بهبود بخشد. در برخی موارد، ترکیب با آنتیبادیهای مونوکلونال، اینترلوکینها و عوامل ضدالتهابی باعث افزایش اثربخشی درمان و کاهش عوارض جانبی شده است.
یکی از حوزههای پیشرفته و در حال توسعه، استفاده از پایش و مدیریت کیمریسم پیشرفته است. تکنیکهای جدید امکان بررسی دقیق میزان حضور سلولهای اهداکننده و گیرنده در بدن پس از پیوند را فراهم میکنند و میتوانند برای پیشبینی عود بیماری، مدیریت عوارض و تصمیمگیریهای بالینی استفاده شوند. این ابزارها کمک میکنند که پیوندهای سلول بنیادی با دقت بالا هدایت شوند و نتایج بلندمدت موفقیتآمیزتری حاصل شود.
علاوه بر این، تحقیقات جدید نشان دادهاند که پیوند سلولهای بنیادی میتواند با سلولهای مزانشیمی تنظیمکننده ایمنی ترکیب شود تا عوارضی مانند Graft-versus-Host Disease کاهش یابد و بازسازی سیستم ایمنی به شکل کنترلشدهتری انجام شود. این رویکرد ترکیبی، به ویژه در بیماران با بیماریهای خودایمنی یا پس از پیوند غیرخودی، باعث بهبود کیفیت زندگی و کاهش ریسک مرگ و میر شده است.
در نهایت، یکی از مهمترین نوآوریها، توسعه رویکردهای شخصیسازی شده در پیوند سلول بنیادی است. با تحلیل ژنتیکی، بررسی وضعیت ایمنی و ارزیابی عملکرد مغز استخوان بیمار، درمانها به شکل فردی طراحی میشوند. این رویکرد امکان بهینهسازی انتخاب نوع پیوند، منبع سلولی، دوز سلولها و مدیریت دارویی را فراهم میکند و باعث افزایش موفقیت درمان و کاهش عوارض جانبی میشود.
به طور خلاصه، پیشرفتها و نوآوریهای درمانی در پیوند سلول بنیادی شامل موارد زیر هستند:
-
استفاده از منابع سلول بنیادی غیرمعمول و خون بند ناف
-
مهندسی ژنتیک سلولهای بنیادی برای افزایش عملکرد و کاهش ریسک پس زدن پیوند
-
بهبود روشهای جمعآوری و پردازش سلولها
-
پروتکلهای نوین در پیوند غیرخودی و هاپلواینتیک
-
ترکیب درمانهای سلولی با داروهای هدفمند و ایمونوتراپی
-
پایش کیمریسم پیشرفته برای پیشبینی عود و مدیریت عوارض
-
استفاده از سلولهای مزانشیمی برای کاهش GvHD و بهبود بازسازی ایمنی
-
توسعه رویکردهای شخصیسازی شده برای بهینهسازی نتایج بالینی
این پیشرفتها نشان میدهند که پیوند سلول بنیادی امروز فراتر از یک جایگزینی ساده سلولهای خونی است و به عنوان یک پلتفرم درمانی چندبعدی و بازساختی، امکان درمان بیماریهای پیچیده، کاهش عوارض جانبی و افزایش کیفیت زندگی بیماران را فراهم کرده است.
چالشها و محدودیتهای بالینی در پیوند سلول بنیادی
با وجود پیشرفتهای چشمگیر در زمینه پیوند سلولهای بنیادی و مغز استخوان، این درمانها همچنان با چالشها و محدودیتهای بالینی متعددی مواجه هستند که میتوانند بر موفقیت درمان و ایمنی بیماران تأثیرگذار باشند. شناخت دقیق این چالشها، پیشبینی ریسکها و طراحی راهبردهای مدیریت آنها، جزو الزامات ضروری در بالین پزشکی مدرن محسوب میشود.
یکی از مهمترین چالشها، پس زدن پیوند یا Graft-versus-Host Disease (GvHD) است. در پیوندهای غیرخودی و هاپلواینتیک، سلولهای اهداکننده ممکن است سیستم ایمنی گیرنده را به عنوان یک عامل خارجی شناسایی کرده و واکنش التهابی ایجاد کنند. این وضعیت میتواند به آسیبهای شدید به بافتهای حیاتی مانند پوست، کبد و روده منجر شود و گاهی کشنده باشد. مدیریت GvHD نیازمند پروتکلهای ایمونوساپرسیو دقیق، پایش مداوم و درمان ترکیبی است و حتی با پیشرفتهای درمانی، همچنان یکی از محدودیتهای اصلی پیوند سلول بنیادی محسوب میشود.
محدودیت دیگر، عفونتها و مشکلات ایمنی پس از پیوند است. بیماران تحت پیوند سلول بنیادی، به ویژه در دورههای پس از پیوند غیرخودی، دچار سرکوب ایمنی موقت میشوند و در معرض عفونتهای باکتریایی، ویروسی و قارچی هستند. بیماریهای مانند عفونتهای قارچی سیستمیک یا ویروس اپشتاین-بار و CMV، میتوانند منجر به مرگ یا عوارض شدید شوند. مدیریت این چالش نیازمند استراتژیهای پیشگیرانه، تشخیص سریع و درمانهای هدفمند ضدعفونی است.
یکی دیگر از محدودیتهای بالینی، عوارض مرتبط با آمادهسازی بیمار و conditioning regimen است. آمادهسازی برای پیوند شامل شیمیدرمانی یا پرتودرمانی برای تخلیه مغز استخوان و سرکوب سیستم ایمنی است. این فرآیند میتواند باعث آسیب اندامهای حیاتی، کاهش قدرت بدنی، تهوع، استفراغ و ناهنجاریهای خونی شود. بیماران مسن یا دارای بیماریهای زمینهای، بیشتر در معرض عوارض شدید هستند و انتخاب مناسب پروتکل conditioning از اهمیت بالایی برخوردار است.
چالش دیگر، دسترسی محدود به منابع سلولهای بنیادی مناسب است. پیوند غیرخودی نیازمند اهداکنندگان همسان یا نزدیک به همسان است و در بسیاری از بیماران، یافتن اهداکننده مناسب دشوار است. حتی با استفاده از پیوندهای هاپلواینتیک یا منابع غیرمعمول مانند خون بند ناف، محدودیت حجم سلولها و کیفیت سلولها میتواند بر نتایج درمان تأثیر منفی بگذارد.
یکی از چالشهای علمی و فنی، عوامل مرتبط با مهندسی ژنتیک و اصلاح سلولهای بنیادی است. اگرچه فناوریهای CRISPR و دیگر ویرایشگرهای ژنی امکان اصلاح سلولها برای بهبود عملکرد و کاهش ریسک پس زدن پیوند را فراهم کردهاند، اما ریسکهای جهشهای ناخواسته، تبدیل بدخیمی و تغییر عملکرد سلولی همچنان وجود دارد. این مسائل نیازمند کنترل دقیق، ارزیابی طولانیمدت و مطالعات پیش بالینی گسترده هستند.
عود بیماری پس از پیوند نیز یکی از محدودیتهای مهم است. در بیماریهایی مانند لوسمی و برخی اختلالات ژنتیکی، حتی پس از پیوند موفق، خطر بازگشت بیماری وجود دارد. مکانیسمهای عود میتوانند شامل فرار ایمنی سلولهای سرطانی، تکثیر سلولهای ناقص یا عدم تطابق کامل بین اهداکننده و گیرنده باشند. مدیریت این ریسک نیازمند پایش مداوم، تکنیکهای پیشرفته کیمریسم و درمانهای ترکیبی پس از پیوند است.
محدودیتهای اقتصادی و مدیریتی نیز چالش بزرگی در بالین هستند. پیوند سلول بنیادی یک فرآیند پیچیده و هزینهبر است که نیازمند زیرساختهای پیشرفته، تیم تخصصی، داروهای گرانقیمت و مراقبتهای طولانیمدت است. عدم دسترسی به مراکز تخصصی یا محدودیتهای مالی بیماران میتواند بر میزان استفاده و موفقیت درمان تأثیرگذار باشد.
یکی دیگر از چالشها، پیشبینی پاسخ بیماران به درمان است. تفاوتهای فردی در ژنتیک، وضعیت سیستم ایمنی، سلامت اندامها و بیماری زمینهای باعث میشود که نتایج درمان متغیر باشد. حتی با پروتکلهای پیشرفته، برخی بیماران پاسخ کافی به پیوند نمیدهند و نیازمند رویکردهای مکمل یا تکرار پیوند هستند.
در نهایت، محدودیتهای اخلاقی و قانونی نیز به ویژه در زمینه استفاده از منابع سلول بنیادی غیرمعمول و مهندسی ژنتیک مطرح هستند. استفاده از سلولهای جنینی یا اصلاح ژنتیکی سلولها نیازمند چارچوبهای اخلاقی و نظارتی دقیق است تا از سوءاستفاده و ارائه درمانهای غیراثربخش یا خطرناک جلوگیری شود.
به طور خلاصه، چالشها و محدودیتهای بالینی پیوند سلول بنیادی شامل موارد زیر هستند:
-
پس زدن پیوند و Graft-versus-Host Disease (GvHD)
-
عفونتها و سرکوب ایمنی پس از پیوند
-
عوارض آمادهسازی بیمار و conditioning regimen
-
دسترسی محدود به منابع سلولهای بنیادی مناسب
-
ریسکهای مهندسی ژنتیک و تغییرات ناخواسته سلولی
-
عود بیماری پس از پیوند
-
محدودیتهای اقتصادی، مدیریتی و زیرساختی
-
پیشبینی متغیر پاسخ بیماران به درمان
-
ملاحظات اخلاقی و قانونی
با وجود این چالشها، پیشرفتهای علمی و بالینی در حوزه پیوند سلول بنیادی، امکان کاهش ریسکها و بهبود موفقیت درمان را فراهم کرده است. شناخت دقیق این محدودیتها، پایهای برای طراحی استراتژیهای نوین، انتخاب مناسب منابع سلولی، استفاده از مهندسی ژنتیک ایمن و مراقبتهای بالینی هدفمند است و مسیر را برای ورود به نسل بعدی درمانهای سلولی باز میکند.
روشهای نوین پایش و بهبود نتایج پیوند سلول بنیادی
با پیشرفت فناوریهای بالینی و زیستی، پایش بیماران پس از پیوند سلول بنیادی به سطحی کاملاً نوین و دقیق رسیده است. این پیشرفتها امکان شناسایی زودهنگام عوارض، پیشبینی موفقیت درمان و اتخاذ اقدامات اصلاحی را فراهم میآورند و نقش حیاتی در بهبود نتایج بالینی دارند.
یکی از مهمترین روشها، پایش کیمریسم پس از پیوند است. کیمریسم به نسبت سلولهای اهداکننده و گیرنده در بدن بیمار گفته میشود و نشاندهنده میزان پذیرش پیوند و بازسازی سیستم ایمنی است. استفاده از تکنیکهای مولکولی حساس مانند PCR کمی، Next-Generation Sequencing و فلوسیتومتری چندرنگی امکان اندازهگیری دقیق کیمریسم را فراهم میکند. این دادهها به پزشکان کمک میکنند تا در صورت کاهش حضور سلولهای اهداکننده، اقدامات پیشگیرانه یا درمانهای کمکی را آغاز کنند و ریسک عود بیماری را کاهش دهند.
روش دیگر، پایش عملکرد مغز استخوان و سلولهای بنیادی پیوندی است. اندازهگیری تعداد و کیفیت سلولهای هماتوپوئیتیک، سطح فاکتورهای رشد و شاخصهای بیولوژیکی مانند پروتئینهای التهابی، امکان ارزیابی سلامت و کارایی سلولهای پیوندی را فراهم میکند. این رویکردها، هم در شرایط پس از پیوند خودی و هم غیرخودی، اطمینان از بازسازی موفق سیستم خونی و ایمنی را افزایش میدهند.
در زمینه کاهش عوارض پس از پیوند، استفاده از سلولهای مزانشیمی و درمانهای ترکیبی ضدالتهابی به عنوان یک نوآوری مؤثر شناخته شده است. سلولهای مزانشیمی توانایی تنظیم پاسخ ایمنی و کاهش التهاب سیستمیک را دارند و میتوانند در پیشگیری یا درمان GvHD نقش داشته باشند. مطالعات نشان دادهاند که ترکیب سلولهای بنیادی و مزانشیمی، میزان بروز عوارض شدید را کاهش داده و کیفیت بازسازی سیستم ایمنی را بهبود میبخشد.
یکی از روشهای پیشرفته برای بهبود نتایج، مهندسی ژنتیک سلولها پیش از پیوند است. اصلاح سلولهای بنیادی به گونهای که مقاومت بیشتری در برابر محیط التهابی یا حمله سیستم ایمنی داشته باشند، باعث افزایش بقای سلولهای پیوندی میشود. علاوه بر این، تعبیه ژنهای ضدالتهابی یا ایمنی تعدیلکننده در سلولها، کنترل دقیقتر روی پاسخ ایمنی و کاهش عوارض جانبی را ممکن میسازد.
پایش زودهنگام عفونتها و تشخیص سریع بیماریهای فرصتطلب، یکی دیگر از ارکان کلیدی بهبود نتایج است. استفاده از تکنیکهای مولکولی و آزمایشگاهی نوین، امکان شناسایی ویروسها، باکتریها و قارچهای بیماریزا در مراحل اولیه را فراهم میکند و باعث میشود اقدامات درمانی سریع و هدفمند انجام شود. این رویکردها به ویژه در بیماران با سیستم ایمنی سرکوبشده، نقش حیاتی در کاهش مرگ و میر ناشی از عفونت دارند.
استفاده از پروتکلهای پیشرفته آمادهسازی بیمار و conditioning regimen با دوز بهینه، یکی دیگر از روشهای بهبود نتایج است. این پروتکلها با ترکیب شیمیدرمانی سبک و عوامل ایمنی تعدیلکننده، هم اثر ضدبیماری را حفظ میکنند و هم آسیب به اندامهای حیاتی را کاهش میدهند. این امر باعث میشود بیماران توان بازسازی سریعتر سیستم ایمنی و خونی خود را داشته باشند و نتایج طولانیمدت پیوند بهبود یابد.
در حوزه پایش فناوری، مدیریت دادهها و هوش مصنوعی نیز نقش قابل توجهی پیدا کرده است. الگوریتمهای یادگیری ماشین میتوانند پیشبینی موفقیت پیوند، شناسایی بیماران با ریسک بالا برای عوارض و تعیین استراتژیهای درمانی بهینه را انجام دهند. این تکنولوژیها امکان تصمیمگیری دقیقتر و شخصیسازی درمان را فراهم میآورند و کمک میکنند که نتایج پیوند در سطح جمعیتی و فردی بهبود یابد.
علاوه بر این، روشهای تصویربرداری نوین و ارزیابی عملکرد ارگانها در دوره پس از پیوند، نقش مهمی در پایش سلامت بیمار دارند. تکنیکهایی مانند MRI با قدرت تفکیک بالا، PET و تصویربرداری مولکولی امکان تشخیص آسیب بافتی ناشی از GvHD یا عوارض دارویی را فراهم میکنند. این اطلاعات، پزشکان را قادر میسازد تا در مراحل اولیه مداخلات درمانی لازم را انجام دهند و از پیشرفت عوارض جلوگیری کنند.
یکی دیگر از نوآوریهای برجسته، پایش مولکولی و زیستنشانگرهای اختصاصی است. این زیستنشانگرها میتوانند وضعیت التهاب، بازسازی سلولی و احتمال عود بیماری را پیشبینی کنند. با ترکیب این دادهها با اطلاعات بالینی و ژنتیکی، امکان طراحی روند درمان شخصیسازی شده و پیشگیرانه فراهم میشود.
به طور خلاصه، روشهای نوین پایش و بهبود نتایج پیوند شامل موارد زیر هستند:
-
پایش کیمریسم با تکنیکهای مولکولی پیشرفته
-
ارزیابی عملکرد مغز استخوان و سلولهای بنیادی پیوندی
-
استفاده از سلولهای مزانشیمی و درمانهای ضدالتهابی ترکیبی
-
مهندسی ژنتیک سلولها برای افزایش بقای پیوندی و کاهش عوارض
-
تشخیص زودهنگام عفونتها و مدیریت هدفمند آنها
-
پروتکلهای آمادهسازی بیمار بهینه و دوزبندی شخصیسازی شده
-
هوش مصنوعی و الگوریتمهای پیشبینی موفقیت درمان
-
تصویربرداری نوین و پایش عملکرد ارگانها
-
زیستنشانگرهای مولکولی برای پیشبینی بازسازی و عود بیماری
این نوآوریها به پزشکان امکان میدهند تا بهبود کیفیت بازسازی سیستم ایمنی، کاهش عوارض و افزایش موفقیت پیوند را تضمین کنند و مسیر حرکت به سمت درمانهای پیشرفته و شخصیسازی شده در پیوند سلول بنیادی را هموار سازند.
مقایسه مدلهای درمانی و مراقبت در بیمارستان و درمانگاه برای پیوند سلول بنیادی
پیوند سلولهای بنیادی و مغز استخوان یک فرآیند پیچیده و چند مرحلهای است که نیازمند مراقبتهای تخصصی و پایش دقیق است. نحوه ارائه خدمات درمانی میتواند تأثیر مستقیم بر موفقیت پیوند، عوارض جانبی و تجربه بیمار داشته باشد. در این زمینه، دو مدل اصلی مراقبت مطرح هستند: مدل بیمارستانی (Inpatient) و مدل درمانگاه یا سرپایی (Outpatient). هر یک از این مدلها دارای مزایا، محدودیتها و شرایط استفاده خاص خود هستند که شناخت دقیق آنها برای انتخاب استراتژی درمانی مناسب ضروری است.
در مدل بیمارستانی، بیماران تمام مراحل آمادهسازی، پیوند و دوره پس از پیوند را تحت نظارت کامل تیم تخصصی در محیط بیمارستان میگذرانند. این مدل مزیت اصلی کنترل ۲۴ ساعته وضعیت بیمار است و امکان مدیریت فوری عوارض شدید، مانند GvHD، عفونتهای سیستمیک یا شوکهای دارویی را فراهم میآورد. همچنین، بیمارستانها مجهز به تجهیزات تشخیصی و درمانی پیشرفته، بخشهای ایزوله برای محافظت از بیماران ایمنوکمپرومایزد و تیمهای تخصصی چندرشتهای هستند که کیفیت مراقبت بالینی را به حداکثر میرساند.
با این حال، مدل بیمارستانی محدودیتهایی نیز دارد. اقامت طولانیمدت، هزینههای بالای درمان، افزایش خطر عفونتهای بیمارستانی و کاهش راحتی و کیفیت زندگی بیمار از جمله چالشهای اصلی آن محسوب میشوند. علاوه بر این، بار روانی ناشی از بستری طولانی و دوری از خانواده، میتواند بر تجربه کلی بیمار و رعایت توصیههای درمانی تأثیرگذار باشد.
در مقابل، مدل درمانگاه یا سرپایی به بیماران امکان میدهد که مراحل پیوند و مراقبتهای پس از آن را در محیط درمانگاه یا خانه تحت نظارت نزدیک تیم پزشکی انجام دهند. این مدل به خصوص برای بیماران با ریسک پایین عوارض و حمایت اجتماعی مناسب مناسب است. مزیت اصلی این روش، افزایش راحتی بیمار، کاهش هزینههای درمان و کاهش طول دوره بستری است. مطالعات نشان دادهاند که با برنامههای پایش دقیق، آموزش بیماران و دسترسی فوری به تیم تخصصی در مواقع اضطراری، نتایج بالینی در بسیاری از بیماران سرپایی با بیمارستانی قابل مقایسه است.
یکی از ابزارهای کلیدی موفقیت در مدل درمانگاه، استفاده از پایش مولکولی و بیومتریک از راه دور است. تکنیکهایی مانند چک کردن کیمریسم، بررسی تعداد سلولهای بنیادی و شاخصهای زیستی از طریق نمونههای خون بیمار، به تیم درمان امکان میدهد که وضعیت بیمار را لحظه به لحظه دنبال کرده و در صورت بروز عوارض، مداخلات سریع انجام دهند. همچنین، برنامههای آموزشی و تلفنی، تماسهای تصویری و اپلیکیشنهای مراقبت از راه دور به بیماران کمک میکنند تا تعهد به درمان و پایش سلامت خود را افزایش دهند.
با وجود مزایا، مدل درمانگاه محدودیتهایی نیز دارد. عدم دسترسی فوری به تجهیزات پیشرفته، امکان تاخیر در شناسایی عوارض شدید، وابستگی بیشتر به توانایی بیمار و خانواده در مدیریت مراقبتها و نیاز به پشتیبانی لجستیک کامل، از جمله چالشهای این روش محسوب میشوند. برای بیماران با ریسک بالای GvHD، عفونت یا مشکلات همزمان پزشکی، این مدل ممکن است مناسب نباشد.
تحقیقات مقایسهای نشان دادهاند که انتخاب مدل درمانی باید بر اساس ارزیابی ریسک فردی، نوع بیماری، وضعیت سیستم ایمنی، منابع اجتماعی و زیرساختهای درمانی انجام شود. در بیمارانی که شرایط پزشکی پیچیده دارند، مدل بیمارستانی بهتر است، در حالی که بیماران پایدار با حمایت اجتماعی قوی میتوانند از مدل سرپایی بهرهمند شوند. در عین حال، استفاده از رویکردهای ترکیبی، که در آن مراحل اولیه و آمادهسازی در بیمارستان و دوره بازسازی و پایش در محیط سرپایی انجام میشود، نتایج بهینه را ارائه میدهد.
علاوه بر این، تحلیل اقتصادی و ارزیابی کیفیت زندگی بیماران نشان میدهد که مدل درمانگاه میتواند بار مالی سیستم بهداشت و درمان را کاهش دهد و رضایت بیمار را افزایش دهد، در حالی که مدل بیمارستانی برای کنترل شدیدتر عوارض و بیماران پرریسک ضروری است. استفاده از شاخصهای ترکیبی بالینی و اجتماعی میتواند به طراحی پروتکلهای شخصیسازی شده کمک کند تا هر بیمار با بهترین ترکیب مراقبت و منابع درمانی مدیریت شود.
از منظر نوآوری، ترکیب این مدلها با پایش دیجیتال، الگوریتمهای هوش مصنوعی و ابزارهای پیشبینی موفقیت پیوند امکان مدیریت بهینه بیماران در هر دو محیط را فراهم کرده است. به عنوان مثال، بیماران میتوانند به طور سرپایی پایش شوند و در صورت تغییرات سریع در وضعیت ایمنی یا عفونت، به بیمارستان منتقل شوند. این رویکرد ترکیبی، افزایش ایمنی، کاهش عوارض و حفظ کیفیت زندگی بیمار را به همراه دارد.
به طور خلاصه، مقایسه مدلهای بیمارستانی و درمانگاه در پیوند سلول بنیادی نشان میدهد:
-
مدل بیمارستانی برای بیماران پرریسک، کنترل فوری عوارض و استفاده از تجهیزات پیشرفته مناسب است.
-
مدل درمانگاه برای بیماران پایدار، کاهش هزینه، راحتی و بهبود کیفیت زندگی مناسب است.
-
استفاده از پایش مولکولی، پایش از راه دور و حمایت اجتماعی، موفقیت مدل درمانگاه را افزایش میدهد.
-
رویکردهای ترکیبی امکان بهرهمندی از مزایای هر دو مدل را فراهم میکنند و به شخصیسازی درمان کمک میکنند.
این تحلیل نشان میدهد که انتخاب محیط درمانی تنها بر اساس سنت یا موجود بودن منابع نیست، بلکه باید بر ارزیابی دقیق بالینی، اجتماعی و فنی مبتنی باشد تا نتایج پیوند بهینه و ایمنی بیماران تضمین شود.
چشمانداز آینده و فرصتهای تحقیقاتی در پیوند سلول بنیادی و مغز استخوان
با گذشت شش دهه از آغاز استفاده بالینی از پیوند سلولهای بنیادی و مغز استخوان، این حوزه به نقطهای رسیده است که میتوان آن را به عنوان پلتفرمی برای درمانهای سلولی نوین و پزشکی بازساختی در نظر گرفت. پیشرفتهای اخیر در مهندسی ژنتیک، سلول درمانی و زیستنشانگرها، چشماندازهای امیدوارکنندهای برای بهبود نتایج، کاهش عوارض و گسترش کاربردهای درمانی ایجاد کردهاند.
یکی از مهمترین مسیرهای تحقیقاتی، بهبود منابع سلول بنیادی و توسعه بانکهای سلولی همهژن است. منابع سنتی سلولهای بنیادی شامل مغز استخوان، خون محیطی و خون بند ناف هستند، اما تحقیقات اخیر بر استفاده از منابع غیرمتداول مانند پالپ دندان، سلولهای مزانشیمی و سلولهای جنینی القا شده (iPSC) متمرکز شدهاند. این منابع میتوانند دسترسی به سلولهای با کیفیت بالا و همسان با بیمار را افزایش دهند و محدودیتهای فعلی اهداکننده را کاهش دهند.
در راستای افزایش موفقیت پیوند، مهندسی ژنتیک سلولها یکی از برجستهترین نوآوریهاست. با استفاده از فناوریهای مانند CRISPR و ویرایش ژنومی دقیق، محققان قادرند سلولهای بنیادی را مقاوم به پس زدن پیوند، کمتر التهابی و کارآمدتر در بازسازی سیستم ایمنی کنند. این فناوری همچنین امکان اصلاح جهشهای ژنتیکی در بیماران با اختلالات ارثی خونی مانند تالاسمی یا کمخونی داسی شکل را فراهم میآورد و میتواند مسیر درمانی بدون نیاز به اهداکننده مناسب را هموار سازد.
پایش مولکولی و زیستنشانگرهای پیشبینیکننده موفقیت پیوند از دیگر فرصتهای تحقیقاتی است. توسعه پروتکلهای مبتنی بر دادههای مولکولی و ژنتیکی به پزشکان امکان میدهد ریسک عود بیماری، احتمال بروز GvHD و پاسخ ایمنی بیمار به پیوند را با دقت بیشتری پیشبینی کنند. ترکیب این دادهها با الگوریتمهای هوش مصنوعی و یادگیری ماشین، میتواند شخصیسازی درمان و اتخاذ تصمیمات بالینی بهینه را تسهیل کند.
در حوزه کاهش عوارض و بهبود کیفیت زندگی بیمار، تحقیقات بر ترکیب سلولهای بنیادی با سلولهای مزانشیمی و درمانهای ترکیبی ضدالتهابی متمرکز شدهاند. این ترکیب میتواند کنترل دقیق پاسخ ایمنی، کاهش GvHD و بهبود بازسازی بافتها را ممکن سازد. مطالعات پیشبالینی همچنین نشان دادهاند که استفاده از سلولهای مزانشیمی مشتق از منابع غیرمعمول و اصلاحشده ژنتیکی، اثرات درمانی قویتر و ایمنی بالاتری دارد.
یکی دیگر از حوزههای مهم، بهبود مدلهای پیش بالینی و آزمایشگاهی پیوند سلول بنیادی است. توسعه مدلهای انسانی سهبعدی، ارگانو-روی-چیپ و سیستمهای شبیهسازی هوشمند، امکان مطالعه دقیقتر مکانیسمهای بازسازی سیستم ایمنی، تعامل سلولهای اهداکننده و گیرنده و اثر داروهای جدید را فراهم میآورد. این مدلها میتوانند کارایی پیشبینی عوارض و پاسخ به درمان را افزایش دهند و فرآیند انتقال از مطالعات آزمایشگاهی به بالین را تسهیل کنند.
توسعه داروهای مکمل و عوامل رشد نیز از فرصتهای تحقیقاتی آینده است. استفاده از فاکتورهای رشد، سیگنالهای تمایز و داروهای تعدیلکننده ایمنی میتواند بازسازی سریعتر و کاملتر سلولهای خونی و کاهش عوارض جانبی را فراهم کند. این رویکردها به ویژه در بیمارانی که توانایی تولید سلولهای بنیادی کافی ندارند یا سیستم ایمنی سرکوبشده دارند اهمیت دارد.
همچنین، گسترش پیوندهای سرپایی و مدلهای ترکیبی بیمارستانی-درمانگاهی، یک حوزه مهم تحقیقاتی است. مطالعات آینده میتوانند مشخص کنند که کدام بیماران میتوانند با پایش از راه دور و مراقبت سرپایی ایمن درمان شوند و چگونه زیرساختهای دیجیتال و هوش مصنوعی میتوانند موفقیت درمان را افزایش دهند. این تحقیقها نه تنها باعث افزایش ایمنی، بلکه کاهش هزینهها و بهبود کیفیت زندگی بیمار نیز خواهد شد.
از منظر کاربردهای نوین، استفاده از سلولهای بنیادی برای درمان بیماریهای غیرخونی و اختلالات عصبی، قلبی و متابولیک در حال گسترش است. تحقیقات اخیر نشان دادهاند که سلولهای بنیادی هماتوپوئیتیک و مزانشیمی میتوانند در بازسازی بافتهای قلبی پس از انفارکتوس، بهبود آسیبهای عصبی در بیماریهای نورودژنراتیو و تنظیم پاسخ التهابی در بیماریهای خودایمنی نقش داشته باشند. این حوزهها فرصتهای تحقیقاتی گستردهای برای توسعه درمانهای چندسیستمی و ترکیبی فراهم میکنند.
یکی دیگر از چشماندازهای آینده، ترکیب درمان سلولی با درمان ژنتیکی و ایمونوتراپی است. ترکیب پیوند سلولهای بنیادی با CAR-T cells، مهندسی ژنتیک هدفمند و ایمونوتراپی شخصیسازی شده، امکان درمان سرطانها، اختلالات ایمنی و بیماریهای ژنتیکی مقاوم به درمانهای سنتی را فراهم میآورد. این رویکردها، پیوند سلول بنیادی را از یک درمان صرف خونی به یک پلتفرم جامع سلولی و ژنتیکی تبدیل میکنند.
همچنین، مطالعات طولانیمدت برای پایش بقای سلولها، عوارض دیررس و کیفیت زندگی بیماران، یک نیاز تحقیقاتی مهم است. این اطلاعات میتوانند استراتژیهای پیشگیرانه و درمانی طولانیمدت، بهبود پروتکلهای پیوند و طراحی مدلهای درمانی شخصیسازیشده را هدایت کنند.
به طور خلاصه، چشمانداز آینده و فرصتهای تحقیقاتی در حوزه پیوند سلول بنیادی و مغز استخوان شامل موارد زیر است:
-
گسترش منابع سلول بنیادی و توسعه بانکهای سلولی همهژن و غیرمتداول
-
مهندسی ژنتیک سلولها برای افزایش موفقیت پیوند و کاهش عوارض
-
پایش مولکولی، زیستنشانگرها و الگوریتمهای هوش مصنوعی برای شخصیسازی درمان
-
ترکیب سلولهای بنیادی با سلولهای مزانشیمی و درمانهای ضدالتهابی
-
توسعه مدلهای پیش بالینی و آزمایشگاهی پیشرفته
-
استفاده از فاکتورهای رشد و داروهای مکمل برای بهبود بازسازی سلولی
-
گسترش مدلهای سرپایی و ترکیبی بیمارستانی-درمانگاهی با فناوری دیجیتال
-
کاربرد سلولهای بنیادی در بیماریهای غیرخونی و بازسازی بافتهای مختلف
-
ترکیب درمان سلولی با ژندرمانی و ایمونوتراپی برای درمان بیماریهای مقاوم
-
مطالعات طولانیمدت برای ارزیابی موفقیت، عوارض و کیفیت زندگی بیماران
این چشماندازها نشان میدهند که پیوند سلول بنیادی نه تنها یک درمان بالینی مؤثر است، بلکه یک بستر تحقیقاتی و فناوری برای توسعه درمانهای پیشرفته، شخصیسازی شده و چندسیستمی فراهم کرده است. آینده این حوزه به سمت ادغام سلول درمانی، ژندرمانی، ایمونوتراپی و فناوریهای دیجیتال حرکت میکند و فرصتهای نامحدودی برای ارتقای سلامت بیماران و درمان بیماریهای پیچیده ایجاد مینماید.
نتیجهگیری
پیوند سلولهای بنیادی و مغز استخوان، امروز به عنوان یکی از پیشرفتهترین و مؤثرترین درمانهای سلولی در پزشکی نوین شناخته میشود. طی شش دهه اخیر، این حوزه از یک تکنیک تجربی و محدود به یک پلتفرم درمانی و تحقیقاتی پیشرفته تبدیل شده است که نه تنها بیماریهای خونی و سرطانهای هماتوپویتیک را درمان میکند، بلکه قابلیت بازسازی سیستم ایمنی و توسعه درمانهای شخصیسازی شده را نیز فراهم میآورد.
در این مقاله نشان داده شد که درک پایهای سلولهای بنیادی، انواع پیوندها و شاخصهای درمانی، زیربنای موفقیت پیوندهای بالینی است. شناخت دقیق سلولهای هماتوپوئیتیک، منابع آنها، عملکرد مغز استخوان و مکانیسمهای بازسازی سیستم ایمنی، امکان انتخاب بهترین نوع پیوند و استراتژی درمانی را برای بیماران فراهم میکند. همچنین، بررسی شاخصهای درمانی، مانند کیمریسم، عملکرد مغز استخوان و پایش عفونتها، به پزشکان اجازه میدهد تا روند درمان را بهینه و ایمن مدیریت کنند.
پیشرفتها و نوآوریهای درمانی، از جمله مهندسی ژنتیک سلولها، ترکیب با سلولهای مزانشیمی، پایش مولکولی پیشرفته، و توسعه پروتکلهای آمادهسازی بیمار، نقش کلیدی در افزایش بقای سلولهای پیوندی، کاهش عوارض جانبی و بهبود کیفیت زندگی بیمار دارند. این نوآوریها نشان میدهند که درمان با سلول بنیادی بیش از یک تکنیک بالینی است و میتواند به یک پلتفرم جامع برای درمانهای چندسیستمی و ترکیبی تبدیل شود.
با وجود این پیشرفتها، چالشها و محدودیتهای بالینی همچنان وجود دارند. ریسک عود بیماری، بروز GvHD، عفونتهای فرصتطلب، کمبود اهداکنندگان مناسب و محدودیتهای اقتصادی از جمله مواردی هستند که نیازمند توجه مداوم هستند. تلاش برای حل این مشکلات از طریق پایش دقیق، مدلهای پیش بالینی پیشرفته، الگوریتمهای هوش مصنوعی و درمانهای ترکیبی، مسیر پیشرفت آینده را روشن میکند.
مقایسه مدلهای مراقبت بیمارستانی و درمانگاه نشان داد که انتخاب محیط درمانی باید مبتنی بر ارزیابی بالینی، ریسک بیمار، منابع اجتماعی و زیرساختهای درمانی باشد. مدلهای ترکیبی و سرپایی با پایش دیجیتال و الگوریتمهای پیشبینی، امکان کاهش هزینهها، افزایش راحتی بیمار و حفظ کیفیت بالای درمان را فراهم میآورند، در حالی که مدل بیمارستانی برای بیماران پرریسک همچنان ضروری است.
چشمانداز آینده پیوند سلول بنیادی بسیار روشن است و فرصتهای تحقیقاتی گستردهای برای گسترش منابع سلولی، مهندسی ژنتیک، کاربرد در بیماریهای غیرخونی، توسعه داروهای مکمل و پایش مولکولی پیشرفته وجود دارد. ادغام این فناوریها با ژنتیک، ایمونوتراپی و هوش مصنوعی، مسیر درمانهای پیشرفته و شخصیسازی شده را هموار میسازد و نوید درمان بیماریهای پیچیده و مقاوم را میدهد.
در جمعبندی، میتوان گفت که پیوند سلول بنیادی و مغز استخوان:
-
یک درمان بالینی مؤثر و پیشرفته برای بیماریهای خونی و سرطانها است.
-
فرصتی بینظیر برای توسعه درمانهای بازساختی، ترکیبی و شخصیسازی شده فراهم میکند.
-
نوآوریهای فناوری و پایش بالینی، ایمنی و موفقیت درمان را افزایش میدهند.
-
چالشها و محدودیتها همچنان وجود دارند، اما تحقیقات و فناوریهای نوین مسیر حل آنها را هموار میکنند.
-
انتخاب مدل مراقبت و محیط درمانی باید هوشمندانه و مبتنی بر ارزیابی دقیق بیمار باشد.
در نهایت، پیوند سلول بنیادی نه تنها یک دستاورد بالینی برجسته است، بلکه یک بستر تحقیقاتی و فناورانه برای آینده پزشکی شخصیسازی شده و درمانهای سلولی و ژنتیکی پیشرفته فراهم میآورد. با پیشرفت تحقیقات و ادغام فناوریهای نوین، میتوان انتظار داشت که در دهههای آینده، این روش به استاندارد طلایی درمان بیماریهای خونی و بسیاری از اختلالات مزمن و پیچیده تبدیل شود و نقش اساسی در افزایش امید به زندگی و کیفیت آن برای بیماران ایفا کند.
سوالات متداول و نکات کاربردی برای متخصصان در پیوند سلول بنیادی و مغز استخوان
با توجه به پیچیدگی و گستردگی حوزه پیوند سلول بنیادی و مغز استخوان، متخصصان همواره با سوالات متعدد بالینی و عملی مواجه هستند. در این بخش، تلاش شده است تا پاسخهای علمی، بهروز و کاربردی ارائه شود و نکات کلیدی برای افزایش موفقیت درمان و کاهش عوارض برجسته شود.
سوالات متداول بالینی و علمی
چرا انتخاب نوع پیوند (اتوگرافی، آلوژنیک یا سینژنیک) اهمیت دارد؟
انتخاب نوع پیوند بر اساس شرایط بیماری، وضعیت سیستم ایمنی بیمار، تطابق HLA و وجود اهداکننده مناسب انجام میشود. پیوند اتوگرافی خطر رد پیوند را کاهش میدهد اما برای بیماریهای بدخیم و ژنتیکی محدودیت دارد. پیوند آلوژنیک، امکان اصلاح نقصهای ژنتیکی و درمان سرطانهای خونی را فراهم میآورد، اما با ریسک بالاتر GvHD و عفونتهای فرصتطلب همراه است.
چه شاخصهایی برای پایش موفقیت پیوند باید در نظر گرفته شود؟
پایش موفقیت پیوند شامل کیمریسم، بازسازی سلولهای خونی، عملکرد مغز استخوان، شاخصهای ایمنی و پایش عفونتها است. استفاده از زیستنشانگرهای مولکولی و پایش ژنتیکی به پیشبینی عوارض و برنامهریزی درمان کمکی مؤثر میکند.
چه عواملی در بروز GvHD نقش دارند و چگونه میتوان آن را کاهش داد؟
GvHD یکی از مهمترین عوارض پیوند آلوژنیک است. عوامل مؤثر شامل تطابق ناقص HLA، تفاوت جنسیت اهداکننده و گیرنده، سن و وضعیت ایمنی بیمار است. اقدامات پیشگیرانه شامل انتخاب اهداکننده مناسب، استفاده از مهارکنندههای ایمنی، سلولهای مزانشیمی و پایش مولکولی دقیق میشوند.
چگونه میتوان ریسک عفونتهای فرصتطلب پس از پیوند را کاهش داد؟
عفونتهای فرصتطلب ناشی از سرکوب سیستم ایمنی پس از پیوند هستند. استراتژیها شامل پیشگیری دارویی، استفاده از محیطهای ایزوله، واکسیناسیون قبل از پیوند، پایش منظم و آموزش بیمار و خانواده میشود. همچنین، تشخیص سریع از طریق PCR و روشهای مولکولی امکان درمان به موقع را فراهم میآورد.
آیا مدلهای سرپایی برای بیماران با ریسک پایین امن هستند؟
مطالعات نشان دادهاند که با انتخاب دقیق بیماران، پایش مولکولی و حمایت اجتماعی مناسب، پیوند سرپایی میتواند موفق و ایمن باشد. این مدل مزایایی مانند کاهش هزینه، افزایش راحتی و کیفیت زندگی بیمار دارد، اما بیماران پرریسک و دارای عوارض همزمان باید در بیمارستان تحت نظر باشند.
نکات کاربردی برای بهبود موفقیت پیوند و کاهش عوارض
استفاده از سلولهای مزانشیمی و ترکیبی:
ترکیب سلولهای بنیادی با سلولهای مزانشیمی میتواند بازسازی سیستم ایمنی را بهبود بخشد و خطر GvHD را کاهش دهد. این ترکیب در مطالعات بالینی و پیشبالینی نتایج امیدوارکنندهای داشته است و به عنوان یک استراتژی کمکی برای بهبود نتایج پیوند آلوژنیک مطرح است.
پایش دقیق مولکولی و کیمریسم:
پایش دقیق کیمریسم، تعداد سلولهای بنیادی و شاخصهای ایمنی، امکان پیشبینی عود بیماری، بروز عوارض و نیاز به مداخلات درمانی را فراهم میکند. این پایش باید از روشهای پیشرفته مولکولی و الگوریتمهای پیشبینی هوش مصنوعی بهرهمند باشد.
انتخاب مناسب منابع سلول بنیادی:
استفاده از خون بند ناف، مغز استخوان یا خون محیطی باید بر اساس نیاز درمانی، تطابق HLA و شرایط بیمار انجام شود. منابع غیرمتداول مانند پالپ دندان یا iPSC نیز در حال توسعه هستند و میتوانند محدودیت منابع را کاهش دهند.
آموزش و پشتیبانی بیمار و خانواده:
موفقیت پیوند و کاهش عوارض، علاوه بر درمان بالینی، وابسته به آموزش و آگاهی بیمار و خانواده است. آموزش در مورد داروها، علائم عفونت، نشانههای GvHD و اهمیت پایش منظم بسیار حیاتی است.
استراتژیهای نوین درمانی:
استفاده از مهندسی ژنتیک، فاکتورهای رشد، داروهای تعدیلکننده ایمنی و ترکیب درمان سلولی با ژندرمانی و ایمونوتراپی میتواند موفقیت پیوند و بازسازی سلولی را بهینه کند. این روشها در حال گسترش هستند و افقهای نوینی برای درمان بیماریهای مقاوم به درمان سنتی فراهم میآورند.
مدیریت محیط درمانی و انتخاب مدل مراقبت:
انتخاب بین بیمارستان و درمانگاه یا مدل ترکیبی باید بر اساس ریسک بیمار، امکانات درمانی و منابع اجتماعی انجام شود. مدل ترکیبی با پایش دیجیتال و هوش مصنوعی، ایمنی و راحتی بیمار را افزایش میدهد و هزینههای درمان را کاهش میدهد.
اهمیت تحقیقات و ثبت دادههای طولانیمدت:
ثبت دادههای بالینی و پیگیری بلندمدت بیماران، درک عوارض دیررس، بقای سلولها و کیفیت زندگی بیمار را ممکن میسازد و مسیر طراحی پروتکلهای پیشرفته و شخصیسازی درمان را هموار میکند.
در جمعبندی این بخش، میتوان گفت که متخصصان با بهرهگیری از پایش پیشرفته، انتخاب منابع سلولی مناسب، آموزش بیمار، استفاده از نوآوریهای سلولی و ژنتیکی و مدیریت هوشمند محیط درمانی میتوانند موفقیت پیوند سلول بنیادی و مغز استخوان را به حداکثر رسانده و عوارض را به حداقل برسانند. این نکات کاربردی به ویژه برای پزشکان، پیوندکاران و تیمهای تخصصی مراقبتهای سلولی اهمیت حیاتی دارد و میتواند مسیر درمان بیماران را به طور محسوسی بهبود بخشد.