بیماری های ژنتیکی خونی
مقدمه
خون به عنوان یکی از حیاتیترین مایعات بدن، نقش کلیدی در حفظ تعادل فیزیولوژیک، انتقال مواد مغذی و اکسیژن، دفع مواد زائد و حمایت از عملکرد سیستم ایمنی ایفا میکند. از منظر بالینی و علمی، سلامت خونی نه تنها شاخص مهمی از وضعیت کلی بدن است، بلکه اختلالات آن میتوانند پیامدهای گستردهای بر سلامت فرد و جامعه داشته باشند. در این میان، بیماریهای ژنتیکی خونی به عنوان یکی از چالشهای عمده پزشکی، توجه زیادی را به خود جلب کردهاند، زیرا این بیماریها نه تنها موجب اختلالات عملکردی در سلولهای خونی میشوند، بلکه میتوانند به طور مستقیم بر طول عمر و کیفیت زندگی بیماران تأثیر بگذارند.
بیماریهای ژنتیکی خونی به گروهی از اختلالات اطلاق میشوند که منشأ آنها تغییرات در ژنها یا کروموزومهای مرتبط با تولید و عملکرد سلولهای خونی است. این تغییرات میتوانند به صورت جهشهای نقطهای، حذف یا اضافه شدن بخشهایی از ژن، تکرارهای ژنتیکی و یا واریانتهای غیرکدکننده در DNA بروز کنند و عملکرد طبیعی خون را مختل سازند. بسته به نوع جهش و مسیرهای مولکولی تحت تأثیر، این بیماریها میتوانند خود را به صورت کمخونی، اختلالات پلاکتی، استعداد به لوسمی یا نئوپلازیهای خونی، و یا اختلالات نادر و ترکیبی نشان دهند.
شیوع بیماریهای ژنتیکی خونی در سراسر جهان متفاوت است و عوامل محیطی، جمعیتشناختی و تاریخی نقش مهمی در آن دارند. به عنوان مثال، کمخونی داسیشکل بیشتر در مناطق آفریقایی و تالاسمیها در خاورمیانه و مدیترانه شایع هستند. این بیماریها علاوه بر تأثیر بر سلامت فرد، بار اقتصادی و اجتماعی قابل توجهی بر جوامع وارد میکنند، زیرا نیازمند مراقبتهای طولانیمدت، درمانهای تخصصی و مدیریت دقیق عوارض هستند.
یکی از چالشهای مهم در مواجهه با این بیماریها، پیچیدگی مسیرهای ژنتیکی و مولکولی مرتبط با آنها است. در بسیاری از موارد، یک جهش ژنتیکی تنها بخشی از داستان را بیان میکند و واریانتهای دیگر، تغییرات اپیژنتیک و حتی تعاملات با عوامل محیطی میتوانند شدت و پیشرفت بیماری را تعیین کنند. این پیچیدگی باعث شده است که تحقیق در زمینه بیماریهای ژنتیکی خونی نه تنها از منظر تشخیص و درمان، بلکه از نظر فهم پایهای و پیشگیری نیز اهمیت زیادی داشته باشد.
از سوی دیگر، پیشرفتهای اخیر در زمینه تشخیص مولکولی و ژنتیکی، نشانگرهای زیستی و درمانهای مبتنی بر ژن چشمانداز جدیدی برای بیماران ایجاد کرده است. ابزارهایی مانند CRISPR/Cas برای اصلاح ژنها، سلولهای بنیادی القایی (iPSC) برای مدلسازی بیماریها و مطالعه مسیرهای مولکولی، و همچنین مدلهای حیوانی مانند Zebrafish، امکان بررسی دقیق مکانیزم بیماریها و توسعه درمانهای هدفمند را فراهم آوردهاند. این پیشرفتها نویدبخش دورهای است که بیماریهای ژنتیکی خونی نه تنها مدیریت میشوند، بلکه ریشهای درمان شده و از بروز آنها پیشگیری خواهد شد.
در نهایت، اهمیت بررسی و مرور جامع بیماریهای ژنتیکی خونی نه تنها در تشخیص و درمان مؤثر این اختلالات نهفته است، بلکه در فهم بهتر تعامل ژنتیک، محیط و مسیرهای مولکولی برای سایر بیماریها نیز نقش اساسی دارد. این مقاله با هدف ارائه یک نگاه جامع و کامل بر بیماریهای ژنتیکی خونی، از مبانی ژنتیکی تا چشماندازهای نوین درمانی، طراحی شده است تا متخصصان، پژوهشگران و حتی مخاطبان عمومی بتوانند تصویر کاملی از این حوزه پیچیده و حیاتی به دست آورند.
پایههای ژنتیکی بیماریهای خونی
درک بنیادین پایههای ژنتیکی بیماریهای خونی برای متخصصان پزشکی و پژوهشگران حوزه هماتولوژی اهمیت اساسی دارد، زیرا شناسایی جهشها و واریانتهای ژنتیکی نه تنها امکان تشخیص دقیق را فراهم میکند، بلکه مسیرهای درمانی هدفمند و پیشگیری مؤثر را نیز مشخص میسازد. خون شامل انواع سلولهای بنیادی و تمایز یافته است که عملکرد صحیح آنها مستلزم هماهنگی پیچیده ژنها و مسیرهای مولکولی است. هرگونه تغییر ژنتیکی میتواند این هماهنگی را مختل کند و منجر به بیماریهای ارثی یا اکتسابی شود.
ژنها و کروموزومها: نقش در سلامت خون
ژنها واحدهای اساسی وراثت هستند و اطلاعات لازم برای ساخت پروتئینها و تنظیم عملکرد سلولها را فراهم میکنند. در سلولهای خونی، ژنها مسئول تولید هموگلوبین، آنزیمهای کلیدی، فاکتورهای انعقادی و مولکولهای سیگنالینگ هستند. به عنوان مثال، ژنهای HBB و HBA که پروتئینهای زنجیره بتا و آلفای هموگلوبین را کد میکنند، نقش حیاتی در تولید گلبولهای قرمز سالم دارند. جهش در این ژنها میتواند به اختلالات جدی مانند تالاسمیها و کمخونی داسیشکل منجر شود.
کروموزومها، به عنوان ساختارهای سازماندهنده DNA، حامل صدها تا هزاران ژن هستند. تعداد و ساختار طبیعی کروموزومها برای عملکرد صحیح سلولهای خونی ضروری است. ناهنجاریهای کروموزومی مانند حذف، تکرار یا جابجایی میتواند مسیرهای ژنتیکی و تولید سلولهای خونی را مختل کند و زمینه را برای بیماریهایی نظیر سندرم میلودیسپلاستیک یا انواع خاص لوسمی فراهم کند.
انواع واریانتهای ژنتیکی و تأثیر آنها بر بیماریهای خونی
واریانتهای ژنتیکی انواع مختلفی دارند که هر یک میتوانند شدت و پیشرفت بیماری را تحت تأثیر قرار دهند. جهشهای نقطهای شامل تغییر یک نوکلئوتید در DNA هستند و میتوانند منجر به تولید پروتئین غیرعملکردی یا ناقص شوند. برای نمونه، جهش نقطهای در ژن HBB موجب جایگزینی یک آمینو اسید میشود که اساس بیماری داسیشکل را تشکیل میدهد.
حذفها و تکرارها نیز از دیگر واریانتهای مهم هستند. حذف یک بخش از ژن یا کروموزوم میتواند منجر به فقدان کامل عملکرد پروتئین شود، در حالی که تکرارهای ژنتیکی ممکن است بیان ژنها را افزایش یا کاهش دهند و تعادل سلولی را برهم بزنند. واریانتهای غیرکدکننده نیز نقش حیاتی در تنظیم بیان ژنها دارند. این مناطق از DNA، اگرچه پروتئین کد نمیکنند، ولی میتوانند به عنوان اپراتور، پروموتر یا عنصر تنظیمکننده عمل کرده و شدت بیماری را تعیین کنند. مطالعات اخیر نشان دادهاند که بسیاری از بیماریهای خونی ناشی از اختلال در این مناطق غیرکدکننده هستند که پیش از این توجه کافی به آنها نمیشد.
نقش اپیژنتیک در بیماریهای خونی ژنتیکی
علاوه بر تغییرات ژنتیکی مستقیم، عوامل اپیژنتیک نیز در بروز بیماریهای خونی تأثیرگذارند. مکانیسمهای اپیژنتیک مانند متیلاسیون DNA، تغییرات هیستونی و RNAهای غیرکدکننده میتوانند بیان ژنها را بدون تغییر توالی DNA تنظیم کنند. این تغییرات ممکن است در پاسخ به محیط، رژیم غذایی یا عوامل التهابی رخ دهند و میتوانند شدت کمخونی، اختلالات پلاکتی یا استعداد به نئوپلازی را افزایش دهند. اپیژنتیک نه تنها در بروز بیماری مؤثر است، بلکه پتانسیل درمانی دارد، زیرا اصلاح مسیرهای اپیژنتیک میتواند عملکرد طبیعی سلولهای خونی را بازیابی کند.
انتقال ژنتیکی و الگوهای وراثتی
الگوهای وراثتی نقش مهمی در تعیین خطر بروز بیماریهای خونی دارند. برخی بیماریها از نوع اتوزومال غالب هستند، به این معنا که تنها یک نسخه معیوب از ژن کافی است تا بیماری ایجاد شود. تالاسمی بتا در برخی جمعیتها نمونهای از این نوع انتقال است. در مقابل، بیماریهای اتوزومال مغلوب نیازمند وجود دو نسخه معیوب از ژن برای بروز بیماری هستند، مانند کمخونی داسیشکل. برخی اختلالات نیز وابسته به X هستند، یعنی ژن معیوب بر روی کروموزوم X قرار دارد و مردان به دلیل داشتن تنها یک کروموزوم X، بیشتر در معرض این بیماریها قرار میگیرند، نمونه بارز آن هموفیلی است.
علاوه بر این، برخی بیماریهای خونی پیچیده هستند و تحت تأثیر چندین ژن و عوامل محیطی شکل میگیرند. در این حالت، جهشهای ژنتیکی با واریانتهای نادر و تغییرات اپیژنتیک تعامل دارند و شدت بیماری را تعیین میکنند. برای مثال، استعداد به سندرم میلودیسپلاستیک و برخی نئوپلازیهای خونی ممکن است ناشی از ترکیب جهشهای ژنتیکی ارثی و جهشهای اکتسابی باشد که در طول زندگی ایجاد میشوند.
همبستگی ژنتیکی با بیماریهای دیگر و اثرات سیستمیک
بسیاری از واریانتهای ژنتیکی که در بیماریهای خونی نقش دارند، با بیماریهای متابولیک، قلبی و عصبی نیز همبستگی دارند. مطالعات اخیر نشان دادهاند که جهشهای ژنتیکی در مسیرهای التهابی و انعقادی میتوانند همزمان خطر ابتلا به بیماریهای قلبی و عروقی را افزایش دهند. همچنین، اختلالات ژنتیکی خونی میتوانند بر سلامت مغز، عملکرد کبد و سیستم ایمنی تأثیر بگذارند، که نشاندهنده ارتباط پیچیده بین ژنتیک و مسیرهای مولکولی در بدن است.
در مجموع، پایههای ژنتیکی بیماریهای خونی ترکیبی از جهشهای ژنتیکی، واریانتهای نادر و شایع، تغییرات اپیژنتیک، و تعاملات محیطی هستند که میتوانند ساختار و عملکرد سلولهای خونی را مختل کنند. درک این پیچیدگیها نه تنها برای تشخیص و درمان دقیق بیماران ضروری است، بلکه مسیر را برای پیشگیری ژنتیکی، مشاوره خانوادگی و توسعه درمانهای مبتنی بر ژن هموار میسازد.
انواع بیماریهای ژنتیکی خونی
بیماریهای ژنتیکی خونی، طیف گستردهای از اختلالات را شامل میشوند که هر یک از آنها دارای مسیرهای مولکولی خاص، ویژگیهای بالینی منحصر به فرد و چالشهای مدیریتی ویژهای هستند. این بیماریها را میتوان بر اساس نوع سلولهای خونی تحت تأثیر و مکانیزم ژنتیکی آنها دستهبندی کرد. بررسی جامع این دستهها نه تنها به درک عمیقتر بیماریها کمک میکند، بلکه مبنایی برای تشخیص، درمان و پیشگیری فراهم میآورد.
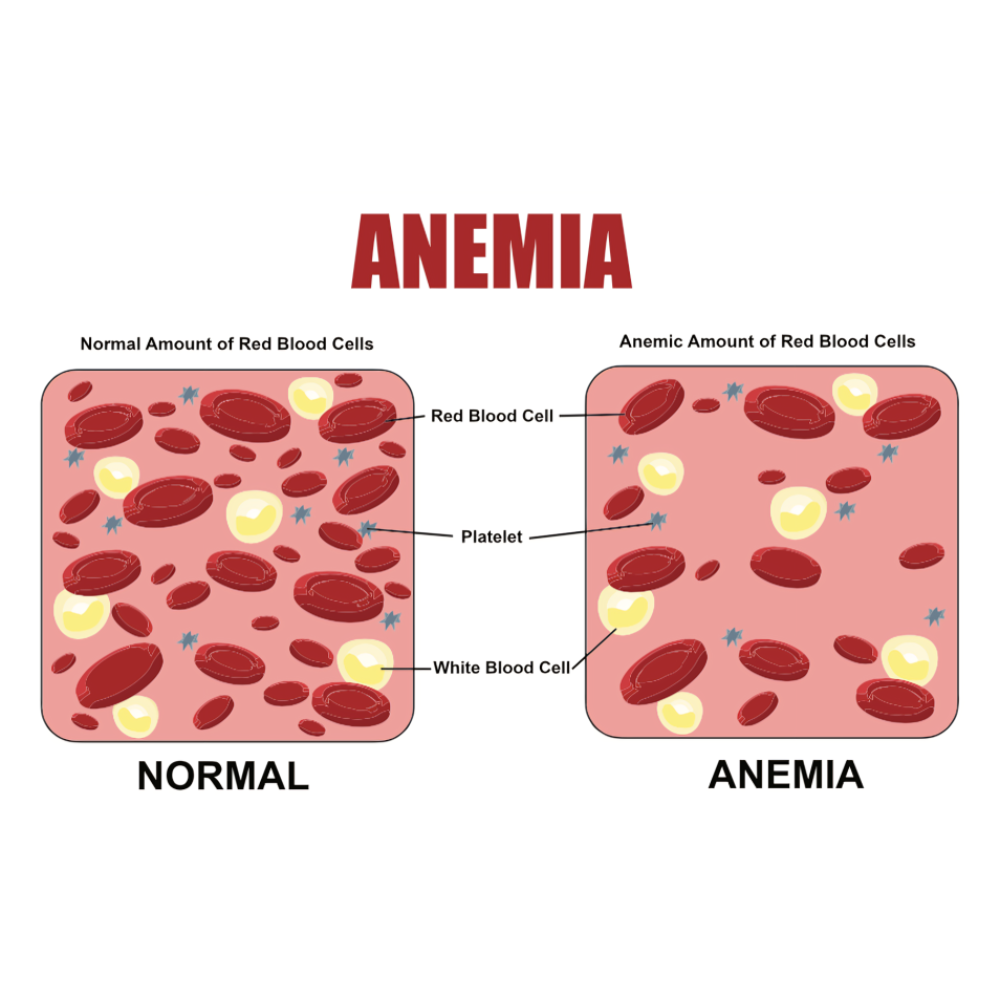
کمخونیهای ارثی
کمخونیهای ارثی یکی از شایعترین انواع بیماریهای ژنتیکی خونی هستند که به دلیل نقص در تولید یا عملکرد گلبولهای قرمز ایجاد میشوند.
-
کمخونی داسیشکل (Sickle Cell Disease)
این بیماری ناشی از جهش نقطهای در ژن HBB است که باعث جایگزینی اسید آمینه والین به جای گلوتامیک در زنجیره بتا هموگلوبین میشود. این تغییر ساختاری موجب میشود گلبولهای قرمز شکل داسی به خود بگیرند و انعطافپذیری خود را از دست دهند. پیامدهای بالینی این تغییر شامل کمخونی مزمن، دردهای ایسکمیک، آسیب اندامها و افزایش خطر عفونت است. مسیرهای مولکولی مرتبط با این بیماری شامل فعال شدن مسیرهای التهابی، تولید رادیکالهای آزاد و اختلال در جریان خون میکروواسکولار است. -
تالاسمیها
تالاسمیها گروهی از کمخونیهای ارثی هستند که ناشی از کاهش یا فقدان تولید زنجیرههای آلفا یا بتای هموگلوبین میباشند. تالاسمی آلفا بیشتر در مناطق آسیای جنوب شرقی شایع است، در حالی که تالاسمی بتا در مدیترانه و خاورمیانه شیوع بیشتری دارد. کمخونی تالاسمی میتواند از فرم خفیف تا شدید متغیر باشد و درمان آن شامل مدیریت نیاز به انتقال خون، داروهای تنظیمکننده هموگلوبین و پیوند مغز استخوان است. -
کمخونیهای ناشی از نقص آنزیمی
یکی از مثالهای بارز، کمخونی ناشی از نقص G6PD است. این بیماری به دلیل جهش در ژن کدکننده آنزیم گلوکز-۶-فسفات دهیدروژناز ایجاد میشود و موجب آسیب پذیری گلبولهای قرمز در برابر استرس اکسیداتیو میگردد. بیماران ممکن است تنها در مواجهه با داروها یا عفونتها دچار همولیز شوند، که نشاندهنده تعامل پیچیده بین ژنتیک و محیط است.
اختلالات پلاکتی و انعقادی
اختلالات ژنتیکی پلاکتها و فاکتورهای انعقادی میتوانند موجب خونریزی شدید یا تمایل به ترومبوز شوند و مدیریت آنها نیازمند تشخیص دقیق و درمان هدفمند است.
-
هموفیلی A و B
هموفیلیها اختلالات انعقادی وابسته به X هستند که به دلیل کمبود فاکتور VIII (هموفیلی A) یا فاکتور IX (هموفیلی B) ایجاد میشوند. این بیماریها معمولاً در مردان بروز میکنند و منجر به خونریزیهای داخلی، همارتروز و عوارض مزمن میشوند. درمان شامل جایگزینی فاکتورهای انعقادی و در موارد جدید، درمانهای ژنمحور است. -
بیماری فون ویلبراند
این بیماری شایعترین اختلال انعقادی ارثی است و به دلیل نقص در فاکتور فون ویلبراند ایجاد میشود. بیماران دچار خونریزیهای پوستی و مخاطی میشوند و شدت علائم میتواند از خفیف تا شدید متغیر باشد. تشخیص دقیق و مدیریت طولانیمدت، از جمله تجویز دسموپرسین و داروهای ضد فیبرینولیتیک، اهمیت زیادی دارد. -
اختلالات نادر پلاکتی
بیماریهایی نظیر ترومبوسیتوپنی ارثی و اختلالات عملکرد پلاکت، هرچند نادر هستند، اما میتوانند منجر به خونریزی شدید و مشکلات مدیریت بالینی شوند. این بیماریها اغلب با جهشهای ژنتیکی در ژنهای مرتبط با تولید و عملکرد پلاکتها مرتبط هستند.
نئوپلازیهای خونی ارثی و میلوپرولیفراتیو
نئوپلازیهای خونی ناشی از اختلالات ژنتیکی سلولهای بنیادی میتوانند به صورت لوسمی، سندرم میلودیسپلاستیک یا پلیسیتمی ظاهر شوند.
-
سندرم میلودیسپلاستیک (MDS)
MDS گروهی از اختلالات خونی است که در آن تولید سلولهای خونی مختل میشود و جهشهای ژنتیکی نقش کلیدی دارند. برخی زیرشاخهها، مانند MDS با جهش SF3B1، ویژگیهای بالینی و پیشآگهی متفاوتی دارند. مسیرهای مولکولی شامل اختلال در اسپایسینگ RNA، ترمیم DNA و مسیرهای آپوپتوز است. -
لوسمیهای ارثی و استعداد به AML
برخی افراد به دلیل جهشهای ژنتیکی خاص، استعداد بالاتری به لوسمی حاد میلوئیدی (AML) دارند. این جهشها میتوانند در ژنهای تنظیمکننده تقسیم سلولی و ترمیم DNA ایجاد شوند و خطر تحول به لوسمی را افزایش دهند. -
پلیسیتمی و ترومبوسیتمی خانوادگی
این اختلالات باعث افزایش غیرطبیعی سلولهای خونی میشوند و میتوانند خطر ترومبوز و اختلالات قلبی-عروقی را افزایش دهند. جهشهای ژنتیکی در ژنهای تنظیمکننده مسیر JAK-STAT نقش مهمی در این بیماریها دارند.
سندرمهای ژنتیکی خاص و نادر
برخی بیماریهای ژنتیکی خونی، نادر هستند اما ویژگیهای بالینی و مولکولی خاصی دارند که شناسایی آنها برای مدیریت بیمار حیاتی است.
-
بیماری ویلسون
این بیماری ناشی از جهش در ژن ATP7B است و موجب تجمع مس در کبد و سیستم عصبی میشود. اختلال عملکرد کبد و تغییرات خونی ناشی از کمخونی و کاهش پلاکت از ویژگیهای شایع است. -
Niemann-Pick
نوع A و B این بیماری ناشی از نقص آنزیم اسفینگومیلیاز است که منجر به تجمع لیپید در سلولها و اختلالات خونی میشود. بیماران ممکن است دچار کمخونی، ترومبوسیتوپنی و آسیب اندامی گسترده شوند. -
اختلالات تلومری و بیماریهای مرتبط
بیماریهای تلومری مانند سندرم دیسکراتوزیس کانژنیتال با کوتاهی غیرطبیعی تلومرها مشخص میشوند و موجب کاهش طول عمر سلولهای بنیادی خونی، کمخونی و استعداد به نئوپلازی میشوند.
در مجموع، انواع بیماریهای ژنتیکی خونی بازتاب پیچیدگی ژنتیک انسان هستند و هر کدام مسیرهای مولکولی، علائم بالینی و رویکردهای درمانی خاص خود را دارند. شناخت دقیق این دستهها، بررسی جهشها و مسیرهای مولکولی، و درک تعامل با عوامل محیطی، اساس تشخیص، درمان و پیشگیری مؤثر است و نقش کلیدی در کاهش بار بیماری و بهبود کیفیت زندگی بیماران ایفا میکند.
مسیرهای مولکولی و فیزیولوژی مرتبط با بیماریهای خونی ژنتیکی
درک دقیق مسیرهای مولکولی و فیزیولوژی خون، پایهای اساسی برای فهم بیماریهای ژنتیکی خونی است. خون، با داشتن ترکیبی پیچیده از سلولهای قرمز، سفید و پلاکتها، به صورت پویا با یکدیگر تعامل دارد تا اکسیژنرسانی، ایمنی و هموستاز را حفظ کند. جهشهای ژنتیکی و واریانتهای نادر میتوانند این تعادل ظریف را برهم زده و منجر به بروز طیف گستردهای از اختلالات خونی شوند.
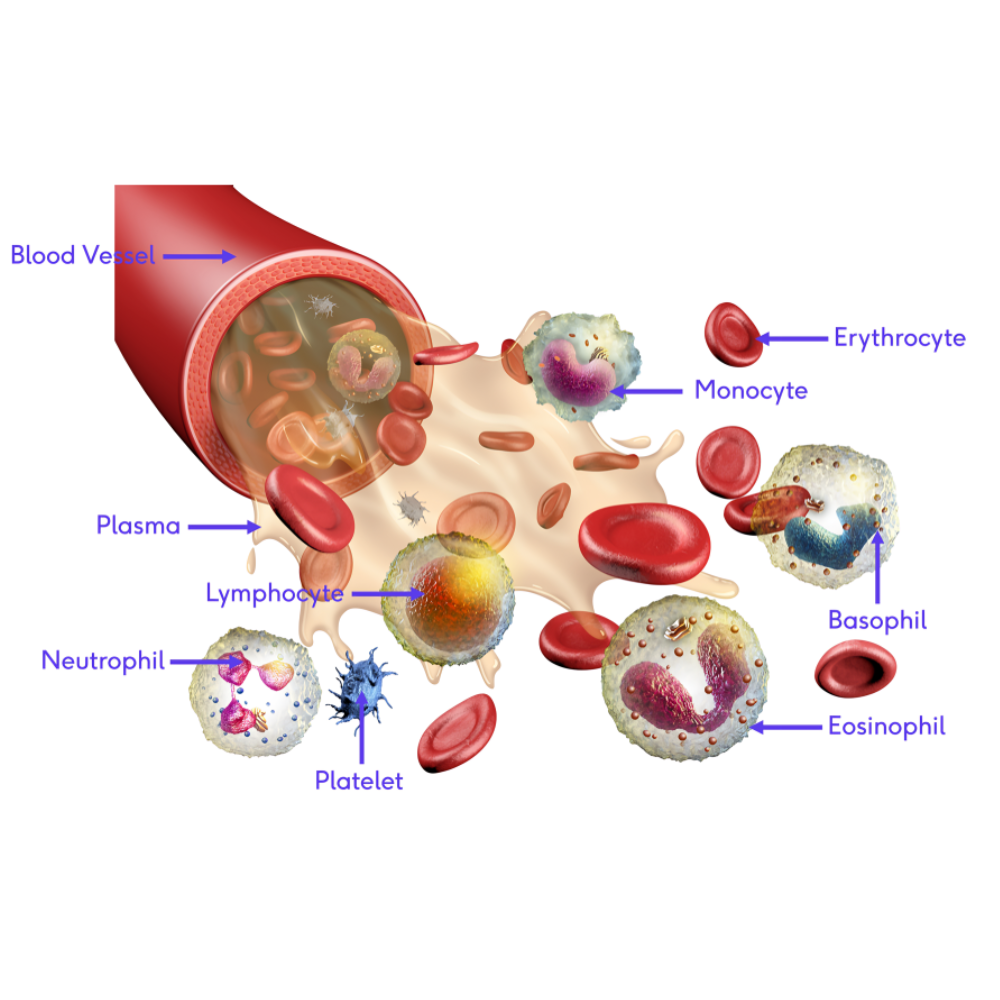
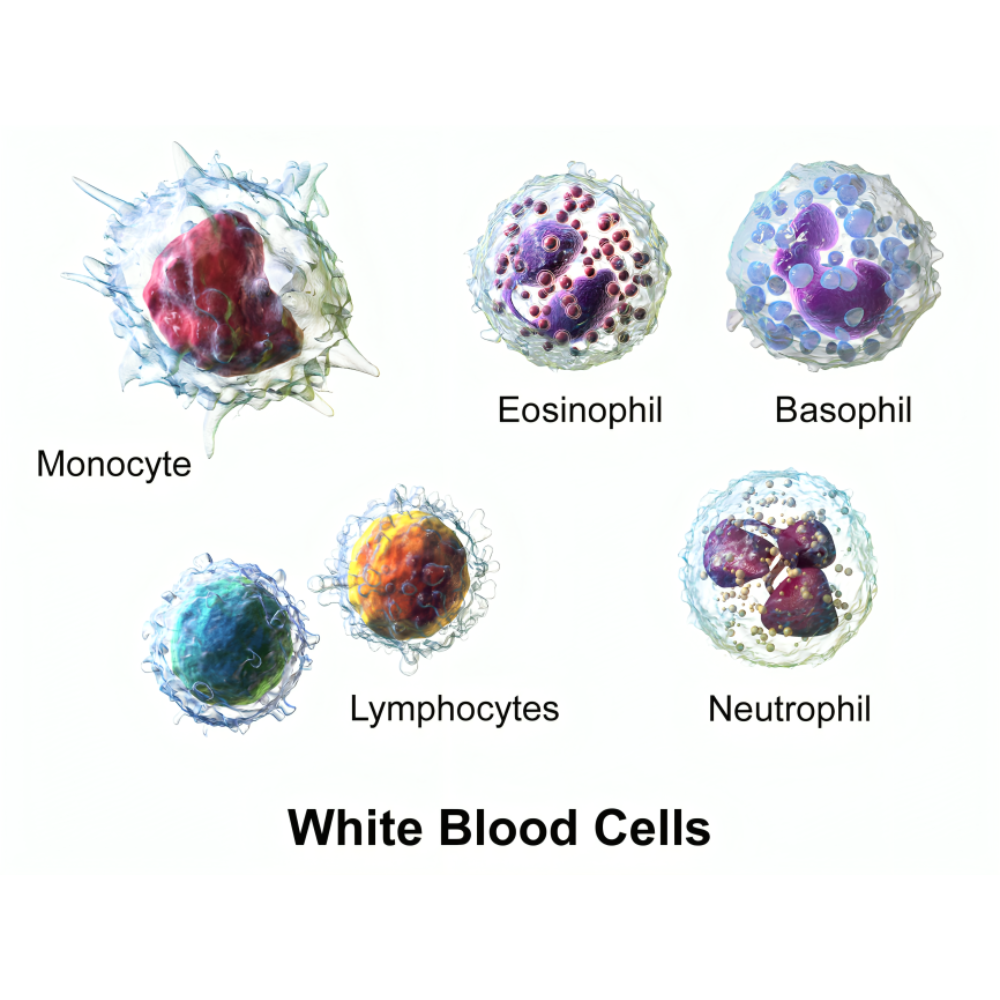
نقش نوتروفیلها و پلاکتها در بیماریهای خونی ژنتیکی
نوتروفیلها و پلاکتها نه تنها در پاسخ ایمنی و انعقاد خون نقش دارند، بلکه در بسیاری از بیماریهای ژنتیکی خونی، مسیرهای التهابی و آسیب اندامی را هدایت میکنند. در بیماری داسیشکل، نوتروفیلها فعال شده و سیتوکینهای التهابی تولید میکنند که باعث التهاب مزمن و آسیب اندامها میشود. پلاکتها نیز با اتصال به سلولهای داسیشکل و اندوتلیوم آسیبدیده، زمینه را برای ترومبوز میکروواسکولار و کاهش جریان خون فراهم میآورند.
در نئوپلازیهای خونی مانند سندرم میلودیسپلاستیک و پلیسیتمی خانوادگی، فعال شدن مسیرهای JAK-STAT در سلولهای بنیادی خونی منجر به افزایش غیرطبیعی تولید سلولها و اختلال در تعادل طبیعی بین انواع سلولهای خونی میشود. این مسیرها نه تنها تکثیر سلولی را کنترل میکنند، بلکه با تغییر بیان ژنهای تنظیمکننده آپوپتوز و تمایز سلولی، شدت بیماری و پاسخ به درمان را تعیین میکنند.
مسیرهای التهابی و اکسیداتیو
فعال شدن مسیرهای التهابی در بسیاری از بیماریهای ژنتیکی خونی نقش کلیدی دارد. سیتوکینهای پروالتهابی مانند TNF-α، IL-1 و IL-6 در بیماریهای داسیشکل و تالاسمی افزایش مییابند و موجب آسیب به اندوتلیوم، همولیز و ترومبوز میشوند. همچنین، تولید رادیکالهای آزاد اکسیژن در سلولهای خونی آسیبدیده باعث تخریب غشا و آپوپتوز میشود، که شدت کمخونی و عوارض اندامی را افزایش میدهد.
اختلال در مسیرهای سیگنالینگ ژنتیکی و بیان ژنها
در بیماریهای ژنتیکی خونی، جهشها اغلب مسیرهای سیگنالینگ حیاتی را مختل میکنند. به عنوان مثال، در تالاسمی و کمخونی داسیشکل، تغییرات ژنتیکی موجب تغییر در بیان ژنهای هموگلوبین و آنزیمهای مرتبط میشود. در نئوپلازیهای میلوپرولیفراتیو، جهشهای JAK2 و CALR مسیرهای سیگنالینگ را فعال کرده و تولید بیش از حد سلولهای خونی را تحریک میکنند. علاوه بر این، جهشهای مرتبط با اسپایسینگ RNA و ترمیم DNA در سندرمهای میلودیسپلاستیک منجر به تجمع سلولهای غیرطبیعی و استعداد به تحول لوسمی میشوند.
تأثیر واریانتهای ژنتیکی نادر و شایع بر عملکرد سلولهای خونی
برخی واریانتهای ژنتیکی نادر، مانند جهشهای SF3B1 در MDS، مسیرهای اسپایسینگ RNA را به گونهای تغییر میدهند که تولید پروتئینهای کلیدی سلولهای خونی مختل میشود. واریانتهای شایع، اگرچه اثر فردی کمتری دارند، میتوانند با واریانتهای نادر ترکیب شده و شدت بیماری را افزایش دهند. مطالعات اخیر نشان دادهاند که تعامل واریانتهای نادر و شایع با عوامل محیطی و اپیژنتیک میتواند موجب طیف گستردهای از اختلالات عملکردی در سلولهای خونی شود.
تأثیر اختلالات مولکولی بر اندامها و سیستمهای دیگر
اختلالات مولکولی خون میتوانند پیامدهای سیستمیک داشته باشند. در کمخونی داسیشکل، کمبود اکسیژن بافتی و فعال شدن مسیرهای التهابی به آسیب قلب، کلیه و مغز منجر میشود. در تالاسمی و بیماریهای پلاکتی، اختلال در تعادل آهن و فاکتورهای انعقادی میتواند موجب آسیب کبدی، ترومبوز و اختلال عملکرد سیستم ایمنی گردد. بیماریهای مرتبط با تلومر، علاوه بر کمخونی، باعث کاهش طول عمر سلولهای بنیادی و استعداد به نئوپلازی میشوند که نمایانگر ارتباط پیچیده بین مسیرهای مولکولی و فیزیولوژی سیستمیک است.
نقش سیستم ایمنی و ارتباط با بیماریهای التهابی و متابولیک
اختلالات ژنتیکی خون تنها بر سلولهای خونی اثر نمیگذارند، بلکه با سیستم ایمنی و مسیرهای التهابی گسترده تعامل دارند. تحقیقات نشان دادهاند که جهشهای ژنتیکی مرتبط با مسیرهای التهابی و انعقادی میتوانند خطر ابتلا به بیماریهای قلبی-عروقی و متابولیک را افزایش دهند. همچنین، التهاب مزمن ناشی از اختلالات ژنتیکی در خون میتواند فرآیندهای ترمیم بافت، عملکرد مغز و سیستم عصبی مرکزی را تحت تأثیر قرار دهد.
ارتباط بین مسیرهای مولکولی و نوآوریهای درمانی
درک مسیرهای مولکولی و فیزیولوژیک مرتبط با بیماریهای ژنتیکی خونی، مسیر را برای توسعه درمانهای هدفمند هموار کرده است. به عنوان مثال، درمانهای مبتنی بر مهار مسیر JAK-STAT در نئوپلازیهای میلوپرولیفراتیو، استفاده از آنتیاکسیدانها و ضدالتهابها در بیماری داسیشکل و طراحی داروهای اصلاحکننده اسپایسینگ RNA در MDS، نمونههایی از کاربرد دانش مولکولی در درمان بالینی هستند. علاوه بر این، ابزارهای ژندرمانی مانند CRISPR/Cas با هدف اصلاح جهشهای خاص، امکان بازگرداندن عملکرد طبیعی سلولهای خونی را فراهم کردهاند.
در مجموع، مسیرهای مولکولی و فیزیولوژی خون پایه و اساس تمام جنبههای بیماریهای ژنتیکی خونی را تشکیل میدهند. تغییرات ژنتیکی، اختلال در مسیرهای سیگنالینگ، فعال شدن مسیرهای التهابی و اکسیداتیو و تعامل با عوامل محیطی و اپیژنتیک، همگی در بروز و پیشرفت این بیماریها نقش دارند. شناخت دقیق این مسیرها نه تنها برای تشخیص و درمان دقیق ضروری است، بلکه امکان پیشگیری، مشاوره ژنتیکی و توسعه درمانهای نوین را نیز فراهم میکند.
تشخیص و ارزیابی بالینی بیماریهای ژنتیکی خونی
تشخیص دقیق و ارزیابی بالینی بیماریهای ژنتیکی خونی یکی از چالشهای کلیدی در هماتولوژی مدرن است. این فرآیند نه تنها شامل بررسی علائم بالینی بیماران میشود، بلکه نیازمند تحلیل دقیق آزمایشات خون، تستهای ژنتیکی و مولکولی، و استفاده از مدلهای پیشرفته تحقیقاتی است. تشخیص زودهنگام و دقیق میتواند پیشرفت بیماری را کنترل کند، عوارض را کاهش دهد و مسیرهای درمانی هدفمند را ممکن سازد.
بررسی بالینی و تاریخچه خانوادگی
مرحله نخست در ارزیابی بیماران، جمعآوری تاریخچه بالینی و خانوادگی است. اطلاعاتی مانند سن شروع علائم، نوع و شدت خونریزیها، کمخونیهای مزمن، عفونتهای مکرر، و سابقه ابتلا به بیماریهای خونی در اعضای خانواده، میتواند الگوهای وراثتی و احتمال بروز بیماریهای ژنتیکی را مشخص کند. به عنوان مثال، سابقه هموفیلی در یک خانواده پدری، احتمال انتقال وابسته به X را نشان میدهد، در حالی که کمخونی داسیشکل یا تالاسمی اغلب از طریق والدین ناقل منتقل میشوند.
آزمایشات خون و بیوشیمیایی
آزمایشات خون پایه، یکی از ارکان اصلی تشخیص هستند و شامل شمارش کامل سلولهای خون (CBC)، بررسی حجم سلولی و اندازه گلبولهای قرمز، میزان هموگلوبین و پلاکتها، و آزمایشات هموگلوبینی میشود.
-
کمخونیها با کاهش تعداد گلبولهای قرمز و هموگلوبین مشخص میشوند و الگوهای MCV و MCH میتوانند کمخونی میکروسیتیک یا ماکروسیتیک را تفکیک کنند.
-
اختلالات پلاکتی با کاهش تعداد پلاکتها یا نقص عملکرد آنها همراه است و آزمایشات زمان پروترومبین (PT) و زمان ترومبوپلاستین جزئی فعال (aPTT) میتوانند اختلالات انعقادی را آشکار کنند.
-
الکتروفورز هموگلوبین به شناسایی کمخونیهای داسیشکل و تالاسمی کمک میکند، زیرا الگوی تولید زنجیرههای هموگلوبین تغییر یافته را نشان میدهد.
تشخیص مولکولی و ژنتیکی
با پیشرفتهای فناوری ژنتیک، استفاده از تستهای مولکولی و ژنتیکی به بخش حیاتی تشخیص تبدیل شده است. این تستها شامل توالییابی نسل جدید (NGS)، PCR جهش-محور، و آنالیز کروموزومی میشوند.
-
در کمخونی داسیشکل و تالاسمی، تشخیص ژنتیکی میتواند نوع جهشها و الگوی وراثتی را مشخص کند و به مشاوره پیش از ازدواج یا پیش از تولد کمک نماید.
-
در نئوپلازیهای خونی مانند MDS و AML، شناسایی جهشهای JAK2، CALR، SF3B1 و دیگر ژنهای مرتبط، پیشآگهی و انتخاب درمان هدفمند را تعیین میکند.
-
تستهای اپیژنتیک و بررسی واریانتهای غیرکدکننده نیز نقش فزایندهای در تشخیص دقیق و پیشبینی شدت بیماری دارند.
نشانگرهای زیستی خون و سیستمیک
علاوه بر آزمایشات ژنتیکی، بیومارکرهای خون نقش کلیدی در تشخیص و پایش بیماریها ایفا میکنند. این نشانگرها شامل پروتئینهای التهابی، فاکتورهای انعقادی، محصولات تخریب سلولی و متابولیتهای خاص هستند. برای مثال، سطح بالای سیتوکینهای التهابی در کمخونی داسیشکل و تالاسمی نشانگر فعال شدن مسیرهای التهابی و پیشبینی عوارض اندامی است. همچنین، نشانگرهای مولکولی مانند پروتئینهای مرتبط با اسپایسینگ RNA و مسیرهای JAK-STAT در سندرمهای میلودیسپلاستیک و پلیسیتمی، اطلاعات ارزشمندی برای انتخاب درمان هدفمند ارائه میدهند.
مدلهای سلولی و حیوانی برای ارزیابی بالینی
برای درک بهتر مسیرهای مولکولی و پیشبینی پاسخ به درمان، استفاده از مدلهای سلولی و حیوانی اهمیت دارد. سلولهای بنیادی القایی (iPSC) امکان شبیهسازی بیماریهای خونی در آزمایشگاه و بررسی عملکرد ژنها را فراهم میکنند. مدلهای حیوانی مانند Zebrafish یا موشهای ژنتیکی اصلاحشده، امکان بررسی اثر جهشها، مسیرهای سیگنالینگ و پاسخ به داروهای جدید را فراهم میآورند. این مدلها علاوه بر تحقیق پایه، در طراحی آزمایشات بالینی و ارزیابی ایمنی و اثربخشی درمانها نیز کاربرد دارند.
تشخیص ترکیبی و استراتژیهای بالینی
در عمل بالینی، تشخیص و ارزیابی بیماران اغلب نیازمند ترکیب اطلاعات بالینی، آزمایشگاهی و ژنتیکی است. تشخیص تنها با علائم بالینی ممکن است ناقص باشد، زیرا بسیاری از بیماریهای ژنتیکی خونی دارای تظاهر بالینی متنوع و پنهان هستند. استفاده از الگوریتمهای تشخیصی چندمرحلهای و مدلهای ریسک ژنتیکی، میتواند احتمال تشخیص صحیح را افزایش دهد و امکان تصمیمگیری دقیق برای درمان هدفمند را فراهم کند.
چالشها و محدودیتها در تشخیص بالینی
با وجود پیشرفتهای فناوری، تشخیص بیماریهای ژنتیکی خونی با چالشهایی همراه است. برخی جهشها نادر یا اپیژنتیک هستند و در تستهای استاندارد آشکار نمیشوند. همچنین، تعامل بین واریانتهای متعدد و عوامل محیطی میتواند الگوهای بالینی پیچیدهای ایجاد کند که نیازمند تحلیل دقیق و تجربه بالینی است. مدیریت این چالشها مستلزم دسترسی به تکنولوژیهای پیشرفته، تیمهای بینرشتهای و آگاهی کامل از مسیرهای مولکولی و ژنتیکی مرتبط است.
در مجموع، تشخیص و ارزیابی بالینی بیماریهای ژنتیکی خونی فرآیندی چندلایه و پیچیده است که ترکیبی از تاریخچه خانوادگی، آزمایشات خون، تحلیل ژنتیکی و مولکولی، نشانگرهای زیستی و مدلهای تحقیقاتی را شامل میشود. این رویکرد جامع، پایهای برای مدیریت موفقیتآمیز بیماریها، انتخاب درمان هدفمند و پیشگیری از عوارض طولانیمدت است.
درمان و مدیریت بیماریهای ژنتیکی خونی
مدیریت و درمان بیماریهای ژنتیکی خونی از پیچیدهترین و حیاتیترین بخشهای مراقبت هماتولوژیک است. این بیماریها طیف گستردهای از اختلالات از کمخونیهای ارثی تا نئوپلازیهای خونی و اختلالات انعقادی را شامل میشوند و نیازمند رویکردهای ترکیبی و شخصیسازیشده هستند. هدف درمان نه تنها کاهش علائم بالینی بلکه اصلاح مسیرهای مولکولی، بهبود کیفیت زندگی و پیشگیری از عوارض طولانیمدت است.
درمان حمایتی و مراقبتهای عمومی
در بسیاری از بیماریهای ژنتیکی خونی، درمان حمایتی به عنوان ستون اصلی مدیریت بالینی شناخته میشود. این اقدامات شامل انتقال خون منظم در تالاسمی شدید، مدیریت کمبود اکسیژن و کمخونی در بیماری داسیشکل، و جایگزینی فاکتورهای انعقادی در بیماران مبتلا به هموفیلی است.
-
در کمخونی داسیشکل، انتقال خون منظم نه تنها کمخونی را کاهش میدهد، بلکه خطر سکته و آسیب اندامها را کاهش میدهد. مراقبت از تغذیه، پیشگیری از عفونتها و استفاده از داروهای کاهشدهنده تولید سلولهای داسیشکل مانند هیدروکسیاوری نیز نقش مهمی دارند.
-
در تالاسمیها، علاوه بر انتقال خون، کنترل بار آهن از طریق داروهای شلاتهکننده (Chelation Therapy) حیاتی است، زیرا تجمع آهن میتواند به آسیب کبد، قلب و سیستم اندوکراین منجر شود.
-
بیماران مبتلا به اختلالات انعقادی، مانند هموفیلی یا بیماری فون ویلبراند، نیازمند مراقبتهای دقیق برای جلوگیری از خونریزی و مدیریت حوادث خونریزی حاد هستند.
داروهای هدفمند و مسیرهای مولکولی
با درک عمیق از مسیرهای مولکولی، توسعه داروهای هدفمند در درمان بیماریهای ژنتیکی خونی رشد چشمگیری داشته است. این داروها با هدف قرار دادن مسیرهای سیگنالینگ و عملکرد سلولهای خونی، اثرات درمانی قابل توجهی ایجاد میکنند.
-
در نئوپلازیهای میلوپرولیفراتیو، داروهای مهارکننده JAK مانند رولوکیتینیب میتوانند تکثیر غیرطبیعی سلولها را کنترل کنند و علائم بالینی مانند افزایش گلبولهای قرمز و پلاکتها را کاهش دهند.
-
داروهای اصلاحکننده اسپایسینگ RNA و مسیرهای آپوپتوز، به ویژه در MDS با جهش SF3B1، میتوانند تولید سلولهای غیرطبیعی را کاهش دهند و پیشآگهی بیماران را بهبود بخشند.
-
استفاده از داروهای ضدالتهاب و آنتیاکسیدانها در بیماری داسیشکل و تالاسمی، مسیرهای التهابی و آسیب اکسیداتیو را هدف قرار میدهد و به کاهش آسیب اندامی کمک میکند.
ژندرمانی و اصلاح ژنتیکی
یکی از نوآوریهای تحولآفرین در درمان بیماریهای ژنتیکی خونی، ژندرمانی است که امکان اصلاح جهشهای بیماریزا و بازگرداندن عملکرد طبیعی سلولهای خونی را فراهم میآورد.
-
در کمخونی داسیشکل و تالاسمی بتا، استفاده از تکنولوژی CRISPR/Cas9 و سایر سیستمهای ویرایش ژن، امکان اصلاح ژنهای HBB و تولید هموگلوبین طبیعی را فراهم کرده است. این درمانها میتوانند به کاهش نیاز به انتقال خون و بهبود کیفیت زندگی بیماران منجر شوند.
-
در هموفیلی A و B، ژندرمانی میتواند سطح فاکتورهای انعقادی را به حد کافی افزایش دهد تا خونریزیها کاهش یابد و نیاز به درمان جایگزین مداوم از بین برود.
-
چالشهای ژندرمانی شامل انتقال کارآمد ژن، پاسخ ایمنی و ایمنی طولانیمدت است، که پژوهشهای بالینی اخیر در حال رفع آنها هستند.
پیوند سلولهای بنیادی و مغز استخوان
پیوند سلولهای بنیادی هماتوپویتیک (HSCT) یکی از روشهای درمانی موثر برای بیماریهای ارثی شدید و نئوپلازیهای خونی است. این روش امکان بازسازی کامل سیستم خونی را فراهم میکند، به ویژه در بیماریهایی که درمان حمایتی یا داروهای هدفمند کافی نیستند.
-
در تالاسمی شدید و کمخونی داسیشکل، پیوند مغز استخوان از اهداکننده مناسب میتواند درمان قطعی ایجاد کند.
-
در MDS و لوسمی، HSCT به همراه شیمیدرمانی یا درمانهای هدفمند، شانس بهبودی و کاهش عود بیماری را افزایش میدهد.
-
انتخاب مناسب بیمار، ارزیابی ریسکها و مدیریت پسزدگی، نقش حیاتی در موفقیت این درمان دارد.
مراقبت طولانیمدت و پیشگیری از عوارض
مدیریت بیماریهای ژنتیکی خونی محدود به درمان حاد نیست، بلکه شامل پایش مستمر و پیشگیری از عوارض مزمن نیز میشود.
-
در بیماری داسیشکل، کنترل فشار خون، پیشگیری از سکته مغزی و مدیریت درد مزمن ضروری است.
-
در تالاسمی و نئوپلازیها، پایش آهن، عملکرد کبد و قلب و بررسی زودهنگام تغییرات مولکولی برای پیشگیری از تحول به لوسمی، حیاتی است.
-
آموزش بیمار و خانواده، پیگیری منظم و استفاده از برنامههای درمانی چندرشتهای، کیفیت زندگی را به طور قابل توجهی بهبود میبخشد.
چشمانداز درمان و نوآوریهای آینده
با پیشرفت در ژنتیک و فناوری سلولهای بنیادی، آینده درمان بیماریهای ژنتیکی خونی نویدبخش است. استفاده از iPSC برای مدلسازی بیماری، توسعه داروهای هدفمند اختصاصی بر اساس واریانتهای ژنتیکی، و ترکیب ژندرمانی با درمانهای دارویی، به سمت درمان شخصیسازیشده و کاهش عوارض پیش میرود. تحقیقات فعلی بر ایمنی طولانیمدت، اصلاح کارآمد ژن و کاهش هزینهها تمرکز دارند تا دسترسی گستردهتری به این درمانها فراهم شود.
در مجموع، درمان و مدیریت بیماریهای ژنتیکی خونی نیازمند رویکردی چندلایه است که شامل درمانهای حمایتی، داروهای هدفمند، ژندرمانی، پیوند سلولهای بنیادی و پایش طولانیمدت میشود. این رویکرد جامع، پایهای برای کاهش مرگومیر، بهبود کیفیت زندگی و تحقق درمانهای نوین و شخصیسازیشده در بیماران مبتلا فراهم میکند.
پیشگیری و مشاوره ژنتیکی در بیماریهای ژنتیکی خونی
پیشگیری و مشاوره ژنتیکی، یکی از ابزارهای کلیدی در مدیریت بیماریهای ژنتیکی خونی است که با هدف کاهش شیوع بیماری، بهبود کیفیت زندگی بیماران و فراهم آوردن تصمیمگیری آگاهانه برای خانوادهها اجرا میشود. این رویکرد از طریق شناسایی افراد در معرض خطر، ارائه اطلاعات دقیق و امکان انتخابهای پیشگیرانه، میتواند تاثیر قابل توجهی بر سلامت جمعیت داشته باشد.
اهمیت مشاوره ژنتیکی
مشاوره ژنتیکی فرآیندی است که در آن متخصصین ژنتیک اطلاعات دقیق و علمی در مورد وراثت، خطر بروز بیماری و گزینههای تشخیصی و پیشگیری به خانوادهها ارائه میدهند. این مشاوره برای بیماریهای خونی ژنتیکی مانند تالاسمی، کمخونی داسیشکل، هموفیلی و نئوپلازیهای ارثی خون اهمیت بالایی دارد، زیرا بسیاری از این بیماریها به صورت اتوزومال غالب، اتوزومال مغلوب یا وابسته به X منتقل میشوند و شناخت الگوی وراثتی به تصمیمگیریهای بالینی و شخصی کمک میکند.
شناسایی افراد در معرض خطر
یکی از گامهای اساسی در پیشگیری، شناسایی افراد ناقل یا در معرض خطر است. این شناسایی میتواند از طریق تاریخچه خانوادگی دقیق، آزمایشات ژنتیکی و بررسی جمعیتی انجام شود.
-
غربالگری پیش از ازدواج یا پیش از تولد: در بسیاری از کشورها، برنامههای ملی غربالگری برای تالاسمی و کمخونی داسیشکل اجرا میشوند تا زوجهای ناقل شناسایی شوند و راهنمایی مناسب دریافت کنند.
-
تستهای مولکولی و ژنتیکی: تشخیص جهشهای خاص، توالییابی ژنهای مرتبط و بررسی واریانتهای شایع و نادر، امکان ارزیابی دقیق خطر را فراهم میکنند. این تستها به ویژه در خانوادههایی با سابقه بیماری شدید اهمیت دارند.
-
آموزش و اطلاعرسانی: افزایش آگاهی در مورد وراثت بیماریهای خونی ژنتیکی و پیامدهای آن، به افراد کمک میکند تا تصمیمات آگاهانه برای ازدواج و فرزندآوری اتخاذ کنند.
گزینههای پیشگیری
با شناسایی ناقلین و افراد در معرض خطر، گزینههای پیشگیری به شکل مؤثری قابل اعمال هستند.
-
مشاوره قبل از بارداری: ارائه اطلاعات دقیق درباره خطر بروز بیماری، گزینههای تشخیصی و درمانی، و نتایج احتمالی برای فرزند آینده.
-
تشخیص پیش از تولد (Prenatal Diagnosis): آزمایشهای مولکولی بر روی نمونههای آمنیوتیک یا خون جنین امکان شناسایی جهشها و تصمیمگیری آگاهانه والدین را فراهم میکند.
-
انتخاب ژنتیکی جنین (Preimplantation Genetic Diagnosis – PGD): در روشهای IVF، جنینها قبل از کاشت از نظر جهشهای ژنتیکی بررسی میشوند و فقط جنینهای بدون جهش بیماریزا انتخاب میشوند. این روش به والدینی که ناقل بیماریهای ژنتیکی خونی هستند، امکان داشتن فرزند سالم را میدهد.
-
مشاوره بعد از تولد و پیشگیری ثانویه: در کودکانی که متولد شدهاند و ناقل یا مبتلا به بیماری هستند، مدیریت زودهنگام و درمان حمایتی میتواند از پیشرفت شدید بیماری جلوگیری کند.
پیگیری و آموزش مستمر خانوادهها
مشاوره ژنتیکی مؤثر تنها یک جلسه مشاوره نیست، بلکه نیازمند پیگیری طولانیمدت و آموزش مستمر است. خانوادهها باید با علائم هشدار، نیاز به آزمایشهای دورهای و گزینههای درمانی آشنا باشند. این آموزش شامل اطلاعاتی درباره سبک زندگی، پیشگیری از عفونتها، تغذیه مناسب و مراقبت از عوارض ناشی از بیماری است.
چالشها و محدودیتها در پیشگیری
با وجود پیشرفتهای ژنتیک و ابزارهای تشخیصی، برخی محدودیتها و چالشها در پیشگیری وجود دارد:
-
تنوع ژنتیکی و جهشهای نادر: برخی جهشها ممکن است در غربالگریهای استاندارد شناسایی نشوند و تشخیص ناقص باشد.
-
محدودیتهای فرهنگی و اجتماعی: پذیرش مشاوره ژنتیکی و روشهای پیشگیری ممکن است در برخی جوامع به دلیل باورهای فرهنگی محدود شود.
-
مسائل اخلاقی و قانونی: انتخاب ژنتیکی جنین و تشخیص پیش از تولد نیازمند رعایت اصول اخلاقی و قوانین مرتبط است.
مزایای اجرای برنامههای پیشگیری و مشاوره ژنتیکی
پیادهسازی سیستماتیک مشاوره ژنتیکی و برنامههای پیشگیری مزایای متعددی دارد:
-
کاهش بروز بیماریهای ژنتیکی خونی در جمعیت
-
کاهش نیاز به درمانهای پیچیده و پرهزینه
-
بهبود کیفیت زندگی بیماران و خانوادهها
-
فراهم شدن امکان تصمیمگیری آگاهانه و کاهش اضطراب والدین
-
حمایت از سیاستهای بهداشت عمومی و کاهش بار اقتصادی و اجتماعی بیماریها
چشمانداز آینده پیشگیری ژنتیکی
با پیشرفت در فناوریهای ژنتیکی، چشمانداز پیشگیری و مشاوره ژنتیکی بسیار روشن است. توسعه تستهای مولکولی سریع، توالییابی نسل جدید و بانکهای واریانتهای ژنتیکی امکان شناسایی دقیقتر افراد در معرض خطر و ارائه گزینههای پیشگیری شخصیسازیشده را فراهم کرده است. همچنین، ترکیب اطلاعات ژنتیکی با دادههای بالینی و اپیژنتیک، امکان طراحی برنامههای پیشگیری هوشمند و مبتنی بر شواهد را فراهم میکند.
در مجموع، پیشگیری و مشاوره ژنتیکی در بیماریهای ژنتیکی خونی، ستون اصلی کاهش شیوع بیماری، بهبود کیفیت زندگی و ارتقای سلامت عمومی است. این رویکرد نیازمند همکاری بینرشتهای، دسترسی به تکنولوژیهای پیشرفته و آموزش مستمر خانوادهها و جوامع است تا اثرگذاری واقعی بر سلامت بیماران و جمعیت ایجاد شود.
چشماندازهای تحقیقاتی و نوآوریها در بیماریهای ژنتیکی خونی
با پیشرفت علم ژنتیک و فناوریهای زیستپزشکی، چشمانداز تحقیقاتی و نوآوریها در زمینه بیماریهای ژنتیکی خونی به طور چشمگیری گسترش یافته است. این تحولات نه تنها باعث درک بهتر مسیرهای مولکولی و فیزیولوژیکی بیماریها شدهاند، بلکه افقهای جدیدی برای درمان هدفمند، ژندرمانی و پیشگیری فراهم آوردهاند. بررسی این چشماندازها، کلید توسعه استراتژیهای درمانی آینده و مدیریت مؤثر بیماران محسوب میشود.
توسعه فناوریهای ویرایش ژن و ژندرمانی
یکی از برجستهترین نوآوریها در درمان بیماریهای ژنتیکی خونی، تکنولوژی ویرایش ژن است. فناوریهایی مانند CRISPR/Cas9، TALENs و ZFNs، امکان اصلاح دقیق جهشهای ژنتیکی و بازگرداندن عملکرد طبیعی سلولهای خونی را فراهم کردهاند.
-
در بیماریهایی مانند کمخونی داسیشکل و تالاسمی بتا، اصلاح ژن HBB با CRISPR، تولید هموگلوبین طبیعی را ممکن ساخته و امید به درمان قطعی را افزایش داده است.
-
تحقیقات پیشبالینی نشان دادهاند که ویرایش ژن در سلولهای بنیادی خونساز میتواند جایگزین انتقال خون منظم شود و خطر عوارض ناشی از بیماری را کاهش دهد.
-
چالشهای موجود شامل انتقال ایمن ژن، جلوگیری از پاسخ ایمنی و بررسی اثرات طولانیمدت است، اما پژوهشهای کنونی در حال ارائه راهحلهای مؤثر هستند.
سلولهای بنیادی القایی و مدلسازی بیماری
استفاده از سلولهای بنیادی القایی (iPSC) امکان شبیهسازی بیماریهای ژنتیکی خونی را در محیط آزمایشگاهی فراهم کرده است. این رویکرد چندین مزیت کلیدی دارد:
-
مدلسازی مسیرهای مولکولی بیماری و شناسایی نقاط هدف درمانی
-
تست اثربخشی داروهای جدید قبل از ورود به آزمایشات بالینی
-
امکان مطالعه واریانتهای نادر و پیچیده که در جمعیت محدود دیده میشوند
مدلهای حیوانی مانند Zebrafish و موشهای ژنتیکی اصلاحشده، نیز در درک مکانیزمهای بیماری و ارزیابی درمانهای نوین نقش اساسی دارند. این مدلها علاوه بر تحقیقات پایه، در طراحی آزمایشات بالینی و پیشبینی پاسخ بیماران به درمانها نیز کاربرد دارند.
داروهای هدفمند و درمانهای مولکولی جدید
درک مسیرهای مولکولی مرتبط با بیماریهای خونی، باعث توسعه داروهای هدفمند شده است. این داروها با اثر بر سیگنالینگ سلولی و مسیرهای آپوپتوز، تولید سلولهای غیرطبیعی و التهاب مزمن را کاهش میدهند.
-
در نئوپلازیهای میلوپرولیفراتیو و MDS، داروهای مهارکننده مسیر JAK-STAT و اصلاحکننده اسپایسینگ RNA، بهبود عملکرد سلولها و کاهش پیشرفت بیماری را فراهم میکنند.
-
داروهای ضدالتهاب و آنتیاکسیدانها در بیماری داسیشکل و تالاسمی، مسیرهای آسیب اکسیداتیو را هدف قرار داده و از عوارض اندامی جلوگیری میکنند.
-
پژوهشهای آینده بر توسعه ترکیب درمانهای دارویی و ژندرمانی تمرکز دارند تا اثرات سینرژیک ایجاد کنند و پاسخ بالینی بیماران را بهبود بخشند.
بیومارکرهای پیشرفته و تشخیص زودهنگام
یکی دیگر از نوآوریهای مهم، شناسایی بیومارکرهای خون و سیستمیک برای تشخیص زودهنگام و پایش پیشرفت بیماری است. این بیومارکرها شامل پروتئینهای التهابی، فاکتورهای انعقادی، متابولیتهای سلولی و نشانگرهای مولکولی مسیرهای اسپایسینگ RNA و JAK-STAT هستند.
-
استفاده از بیومارکرها امکان پیشبینی شدت بیماری، پاسخ به درمان و شناسایی بیماران در معرض عوارض را فراهم میآورد.
-
فناوریهای نوین مانند توالییابی تک سلولی و آنالیز چندپارامتری، قدرت تشخیص را افزایش داده و به شخصیسازی درمان کمک میکنند.
پیشگیری مبتنی بر دادههای ژنتیکی و اپیژنتیکی
با ترکیب اطلاعات ژنتیکی، اپیژنتیکی و بالینی، امکان طراحی برنامههای پیشگیری هوشمند و شخصیسازیشده برای بیماران و افراد ناقل فراهم شده است. این رویکرد میتواند شناسایی ناقلین نادر، انتخاب گزینههای پیش از تولد و مدیریت ریسک خانوادهها را بهبود بخشد.
-
پایگاههای داده واریانتهای ژنتیکی و الگوریتمهای پیشبینی، امکان تصمیمگیری آگاهانه در زمینه فرزندآوری و پیشگیری ثانویه را فراهم میکنند.
-
پژوهشهای آینده بر ادغام اطلاعات مولکولی، اپیژنتیک و بالینی برای پیشبینی دقیق و طراحی درمان شخصیسازیشده تمرکز دارند.
چالشها و مسیرهای آینده تحقیقاتی
با وجود پیشرفتهای چشمگیر، تحقیقات بیماریهای ژنتیکی خونی با چالشهایی همراه است:
-
واریانتهای ژنتیکی نادر و ترکیبی که تشخیص و درمان آنها پیچیده است
-
تعامل ژن و محیط که الگوهای بالینی متنوع ایجاد میکند
-
نیاز به تکنولوژیهای ایمن، مقرون به صرفه و قابل دسترس برای ژندرمانی و ویرایش ژن
-
الزامات اخلاقی و قانونی در استفاده از تکنولوژیهای ژنتیکی و انتخاب ژنتیکی
با این حال، مسیر تحقیقات و نوآوریها به سوی درمانهای هدفمند، ژندرمانی مؤثر، پیشگیری هوشمند و بهبود کیفیت زندگی بیماران حرکت میکند و آینده روشنی برای مدیریت بیماریهای ژنتیکی خونی نوید میدهد.
در مجموع، چشمانداز تحقیقاتی و نوآوریها، شامل ویرایش ژن، ژندرمانی، سلولهای بنیادی، داروهای هدفمند، بیومارکرهای پیشرفته و پیشگیری مبتنی بر دادههای ژنتیکی است. این پیشرفتها پایهای برای درمان شخصیسازیشده، کاهش عوارض و بهبود کیفیت زندگی بیماران فراهم میکنند و مسیر آینده هماتولوژی ژنتیکی را شکل میدهند.
نتیجهگیری
بیماریهای ژنتیکی خونی، مجموعهای پیچیده و متنوع از اختلالات هستند که هماتولوژیستها، ژنتیکدانها و پزشکان بالینی را با چالشهای چندجانبه مواجه میکنند. این بیماریها از کمخونیهای ارثی و اختلالات انعقادی گرفته تا نئوپلازیهای خونی و سندرمهای پیچیده، هر یک دارای مسیرهای مولکولی، فیزیولوژیکی و پیامدهای بالینی منحصر به فردی هستند. درک عمیق پایههای ژنتیکی، مسیرهای مولکولی و پیامدهای بالینی، اولین گام برای مدیریت مؤثر و طراحی درمانهای شخصیسازیشده است.
اهمیت تشخیص و ارزیابی بالینی دقیق
تشخیص صحیح و ارزیابی بالینی جامع، ستون اصلی مراقبت از بیماران مبتلا به بیماریهای ژنتیکی خونی است. با بهرهگیری از ترکیبی از تاریخچه خانوادگی، آزمایشهای خونی، تستهای مولکولی و بیومارکرهای پیشرفته، پزشکان میتوانند نه تنها وضعیت فعلی بیمار را ارزیابی کنند بلکه پیشبینی قابل اعتمادی از روند بیماری و پاسخ به درمان ارائه دهند. این تشخیص زودهنگام، پایهای برای پیشگیری از عوارض طولانیمدت و طراحی استراتژیهای درمانی هدفمند محسوب میشود.
درمان جامع و مدیریت چندلایه
مدیریت بیماریهای ژنتیکی خونی نیازمند رویکردی چندلایه است که شامل درمانهای حمایتی، داروهای هدفمند، ژندرمانی، پیوند سلولهای بنیادی و پایش طولانیمدت میشود. هر یک از این رویکردها نقش مکمل دارند و هدف نهایی، کاهش مرگومیر، کنترل علائم بالینی، پیشگیری از عوارض اندامی و ارتقای کیفیت زندگی بیماران است.
-
درمان حمایتی، مانند انتقال خون منظم، کنترل بار آهن و جایگزینی فاکتورهای انعقادی، ستون اولیه کاهش عوارض حاد و حفظ ثبات وضعیت بالینی است.
-
داروهای هدفمند، با اثرگذاری بر مسیرهای مولکولی و سیگنالینگ سلولی، توانستهاند پیشرفت بیماری و آسیب سلولی را کاهش دهند و امید به درمان طولانیمدت را افزایش دهند.
-
ژندرمانی و ویرایش ژن، به ویژه با فناوریهایی مانند CRISPR/Cas9 و iPSC، مسیر نوینی برای درمان قطعی و اصلاح ژنهای معیوب فراهم کرده است و چشمانداز درمان شخصیسازیشده را تقویت میکند.
-
پیوند سلولهای بنیادی و مغز استخوان، در موارد شدید و نئوپلازیها، امکان بازسازی کامل سیستم خونی و درمان بیماری را فراهم میآورد.
پیشگیری و مشاوره ژنتیکی، ابزار کاهش شیوع بیماری
یکی از ارکان حیاتی مدیریت بیماریهای ژنتیکی خونی، پیشگیری و مشاوره ژنتیکی است. این رویکرد با شناسایی افراد ناقل، ارائه اطلاعات دقیق به خانوادهها و استفاده از فناوریهای پیشرفته تشخیصی و انتخاب ژنتیکی، میتواند شیوع بیماریها را کاهش دهد و امکان تصمیمگیری آگاهانه برای والدین را فراهم کند.
-
غربالگری پیش از ازدواج یا پیش از تولد و تستهای مولکولی، امکان شناسایی ناقلین و پیشگیری اولیه را فراهم میکنند.
-
پیشگیری ثانویه، شامل مدیریت زودهنگام کودکان مبتلا و پایش طولانیمدت، از پیشرفت شدید بیماری جلوگیری میکند و کیفیت زندگی بیماران را بهبود میبخشد.
چشمانداز تحقیقاتی و نوآوریهای آینده
تحقیقات روزافزون در زمینه بیماریهای ژنتیکی خونی، با بهرهگیری از فناوریهای نوین، چشمانداز روشنی برای درمان و مدیریت شخصیسازیشده ارائه کرده است.
-
مدلسازی بیماری با iPSC و مدلهای حیوانی ژنتیکی امکان شناسایی مسیرهای مولکولی و توسعه داروهای هدفمند را فراهم میکند.
-
بیومارکرهای پیشرفته و دادههای ژنتیکی، تشخیص زودهنگام، پیشبینی شدت بیماری و طراحی برنامههای درمانی اختصاصی را امکانپذیر میسازند.
-
ادغام ژندرمانی، داروهای هدفمند و برنامههای پیشگیری مبتنی بر داده، نویدبخش کاهش عوارض، افزایش امید به زندگی و بهبود کیفیت زندگی بیماران است.
پیام نهایی برای پزشکان و بیماران
درک جامع بیماریهای ژنتیکی خونی و مدیریت آنها نیازمند همکاری بینرشتهای، دانش بهروز ژنتیک و فناوریهای نوین، و توجه به جنبههای بالینی و روانی بیماران است. ترکیب درمانهای حمایتی، داروهای هدفمند، ژندرمانی و پیشگیری ژنتیکی، میتواند به کاهش بار بیماری، پیشگیری از عوارض مزمن و ارتقای سلامت جمعیت کمک کند.
در نهایت، موفقیت در مدیریت بیماریهای ژنتیکی خونی مستلزم دیدگاه یکپارچه، رویکرد پیشگیرانه، تحقیق و نوآوری مداوم و تعهد به ارتقای کیفیت زندگی بیماران است. این رویکرد جامع، هم برای پزشکان و متخصصان ژنتیک و هم برای بیماران و خانوادههای آنان، مسیر روشنی برای کاهش اثرات بیماری و دستیابی به درمانهای نوین و پایدار فراهم میکند.