تکوین سیستم عصبی مرکزی و رشد مغز
مقدمه
تکوین سیستم عصبی مرکزی (CNS) و رشد مغز از مهمترین و پیچیدهترین فرآیندهای زیستی در انسان و سایر مهرهداران محسوب میشود. سیستم عصبی مرکزی، شامل مغز و نخاع، کنترلکننده تمامی عملکردهای بدن از جمله حرکت، احساسات، پردازش اطلاعات، حافظه و رفتارهای پیچیده است. سلامت و عملکرد بهینه CNS به شدت به مراحل تکوین دقیق و هماهنگ سلولها، مسیرهای سیگنالینگ مولکولی و تعامل با محیط زیستی بستگی دارد. هر گونه اختلال یا تأخیر در این فرآیندها میتواند به پیامدهای بلندمدت نورولوژیک، شناختی و روانی منجر شود.
اهمیت مطالعه تکوین CNS فراتر از جنبههای بنیادی زیستشناسی است؛ این دانش پایه، درک ما از بیماریهای عصبی مادرزادی، اختلالات رشد مغزی، آسیبهای نروژنتیک و حتی بیماریهای نورودژنراتیو در بزرگسالان را ممکن میسازد. به عنوان مثال، مطالعات نشان دادهاند که نقش سلولهای گلیا، به ویژه میکروگلیا و آستروسیتها، در رشد مغز بسیار حیاتی است و عملکرد نادرست آنها میتواند باعث اختلال در اتصالهای عصبی و یادگیری شود. همچنین، نقش تغذیه، عوامل متابولیک و محور روده-مغز در مراحل ابتدایی زندگی، تاثیر قابل توجهی بر تکوین و پلاستیسیتی مغز دارد.
چالشهای علمی در مطالعه تکوین CNS ناشی از پیچیدگی فوقالعاده مغز انسان و تفاوتهای گونهای است. تحقیقات جدید با استفاده از مدلهای حیوانی، تکنیکهای تک سلولی، تصویربرداری پیشرفته و مدلهای کامپیوتری تلاش میکنند نقشه دقیقی از مسیرهای سلولی و مولکولی رشد CNS ارائه دهند. این مطالعات نشان میدهند که فرآیندهای تکوین مغز نه تنها تحت کنترل ژنها و مسیرهای سیگنالینگ سلولی است، بلکه تحت تأثیر محیط داخلی مانند تغذیه و هورمونها و همچنین عوامل محیطی بیرونی مانند میکروبیوتای روده، تماس اجتماعی و تحریک حسی قرار دارد.
هدف این مقاله ارائه یک مرور جامع و بهروز بر تمامی جنبههای تکوین سیستم عصبی مرکزی و رشد مغز است. این مقاله با پوشش تمامی سطوح از مولکولی، سلولی، بافتی تا عملکردی و رفتاری، قصد دارد تمامی سوالات ممکن یک متخصص یا دانشجوی پیشرفته را پاسخ دهد. همچنین، تمرکز مقاله بر ارائه اطلاعات دقیق و علمی به همراه ارتباطات بالینی و کاربردهای آینده پژوهشی است. از این رو، خوانندگان قادر خواهند بود تصویری جامع از فرآیندهای پیچیده رشد مغز، نقش سلولهای مختلف CNS، اثر عوامل تغذیهای و محیطی، و راهکارهای نوین درمانی و پیشگیری در اختلالات عصبی به دست آورند.
نقش این مقاله در آموزش و پیشگیری نیز قابل توجه است. با درک بهتر مکانیسمهای تکوین CNS، متخصصان پزشکی، پژوهشگران و والدین میتوانند اقدامات پیشگیرانهای برای سلامت مغز جنین و کودک انجام دهند. به طور مثال، شناخت اهمیت DHA، IGF-1 و دیگر عوامل تغذیهای، میتواند به بهبود رشد شناختی و عملکرد عصبی کمک کند. همچنین، فهم نقش میکروبیوتا و محور روده-مغز، افقهای جدیدی برای پیشگیری و مدیریت اختلالات عصبی و روانی باز میکند.
در نهایت، تکوین سیستم عصبی مرکزی و رشد مغز نه تنها موضوعی علمی و پیچیده است، بلکه محور اصلی سلامت انسانی و عملکرد بهینه ذهن و رفتار در تمام طول زندگی به شمار میرود. این مقاله سعی دارد با رویکردی جامع، علمی و کاربردی، تمام جنبههای این فرآیند را بررسی کند و به عنوان مرجعی معتبر برای دانشجویان، پژوهشگران و متخصصان حوزه علوم اعصاب و پزشکی عمل نماید.
سیستم عصبی مرکزی: ساختار و اجزای اصلی
سیستم عصبی مرکزی (CNS) به عنوان هسته اصلی کنترل و هماهنگی بدن انسان، شامل مغز و نخاع است. این سیستم وظیفه پردازش اطلاعات حسی، تنظیم حرکات ارادی و غیرارادی، کنترل عملکردهای حیاتی، حافظه، یادگیری و رفتارهای پیچیده را بر عهده دارد. ساختار CNS به گونهای طراحی شده است که توانایی ارتباط و هماهنگی بین میلیاردها سلول عصبی و انواع سلولهای پشتیبان را فراهم میکند، بنابراین درک دقیق اجزای آن برای فهم عملکردهای طبیعی و غیرطبیعی مغز ضروری است.
مغز: ساختار و تقسیمات اصلی
مغز انسان از چندین بخش اصلی تشکیل شده است که هر کدام وظایف مشخص و حیاتی دارند. کورتکس مغزی یا قشر مغز، لایه سطحی و قشر خاکستری مغز است که مسئول پردازش اطلاعات حسی، برنامهریزی حرکتی، تصمیمگیری، تفکر و رفتارهای شناختی است. این بخش از مغز به صورت لایهای از نورونها و سلولهای گلیا سازماندهی شده و با اتصالهای پیچیده بین قشر و زیر قشر، امکان پردازش و تحلیل اطلاعات را فراهم میکند.
مخچه یا "cerebellum" که در پشت مغز و زیر بخشهای قدامی قرار دارد، نقش حیاتی در هماهنگی حرکتی، حفظ تعادل و یادگیری حرکات پیچیده ایفا میکند. مخچه از میلیونها نورون کوچک و شبکههای ارتباطی دقیق تشکیل شده است و به صورت مداوم اطلاعات حسی از عضلات و مفاصل را پردازش میکند تا حرکات روان و هماهنگ ایجاد شود.
ساقه مغز شامل مدولا، پونس و میانمغز است و وظیفه تنظیم عملکردهای حیاتی مانند تنفس، ضربان قلب، فشار خون و هضم را بر عهده دارد. همچنین، این بخش مسیر اصلی انتقال پیامهای عصبی بین مغز و نخاع است و نقش مهمی در پردازش برخی اطلاعات حسی و حرکتی دارد.
سیستم لیمبیک مجموعهای از ساختارها شامل هیپوکامپ، آمیگدالا و تالاموس است که مسئول پردازش احساسات، حافظه و انگیزش است. هیپوکامپ به ویژه در حافظه بلندمدت و یادگیری مکانی نقش دارد و آمیگدالا به پردازش احساسات، به ویژه ترس و پاسخهای احساسی، مرتبط است. تعامل بین این بخشها و قشر مغز، تجربههای عاطفی و شناختی را شکل میدهد.
نخاع و نقش آن در انتقال پیامهای عصبی
نخاع ستون اصلی ارتباط بین مغز و بقیه بدن است و شامل بافت سفید و خاکستری میشود. بافت سفید شامل آکسونهای میلیندار است که پیامهای عصبی را با سرعت بالا منتقل میکنند، در حالی که بافت خاکستری شامل سلولهای عصبی و سلولهای گلیا است که مرکز پردازش و یکپارچهسازی اطلاعات حسی و حرکتی را تشکیل میدهد. نخاع وظیفه انتقال پیامهای حسی از محیط به مغز و پیامهای حرکتی از مغز به اندامها را بر عهده دارد و در بسیاری از واکنشهای سریع غیرارادی یا رفلکسها نقش کلیدی دارد.
نورونها: واحدهای عملکردی CNS
نورونها سلولهای تخصصیافته CNS هستند که توانایی تولید و انتقال سیگنالهای الکتریکی و شیمیایی را دارند. هر نورون شامل دندریتها (گیرندههای سیگنال)، جسم سلولی (مرکز متابولیک) و آکسون (انتقالدهنده سیگنال) است. سیناپسها نقاط اتصال نورونها هستند که امکان انتقال پیامهای عصبی به وسیله نروترانسمیترها را فراهم میکنند. تنوع ساختاری و عملکردی نورونها، باعث میشود که انواع مختلفی از پیامها با سرعتها و الگوهای متفاوت در مغز و نخاع منتقل شود.
سلولهای گلیا و نقش حمایتکننده آنها
در کنار نورونها، سلولهای گلیا نقش حیاتی در نگهداری، حمایت و حفاظت CNS دارند. آستروسیتها با فراهم کردن تغذیه و پشتیبانی متابولیک، تنظیم محیط یونی و انتقال مواد مغذی، عملکرد نورونها را بهینه میکنند. اولیگودندروسیتها مسئول تولید میلین هستند که به افزایش سرعت انتقال پیامهای عصبی کمک میکند. میکروگلیا سلولهای ایمنی CNS هستند که در پاکسازی مواد زائد، ترمیم بافت و پاسخ به آسیبها نقش دارند. NG2-glia نوعی سلول گلیایی است که در تکوین مغز و بازسازی بعد از آسیب نقشهای کلیدی دارد و تعامل آن با نورونها و دیگر گلیاها به شکلگیری شبکههای عصبی کمک میکند.
ارتباط بین اجزای CNS
تمامی بخشهای مغز و نخاع با یکدیگر در ارتباط پیچیده و پویا هستند. شبکههای عصبی از طریق آکسونها و سیناپسها، ارتباطات محلی و سراسری را ایجاد میکنند و سلولهای گلیا با حمایت و تنظیم محیط، امکان فعالیت مؤثر این شبکهها را فراهم میکنند. این هماهنگی پیچیده باعث میشود که CNS توانایی پردازش اطلاعات حسی، تصمیمگیری، برنامهریزی حرکتی، یادگیری و حافظه را به صورت یکپارچه و مؤثر داشته باشد.
اهمیت درک ساختار CNS
درک دقیق ساختار و اجزای CNS پایهای برای فهم تکوین، رشد و عملکرد مغز است. این دانش، امکان تشخیص اختلالات عصبی، طراحی روشهای درمانی و پژوهشهای پیشرفته در علوم اعصاب را فراهم میکند. همچنین، فهم تعامل نورونها، سلولهای گلیا و اجزای مختلف مغز، کلید درک فرآیندهای پیچیدهای مانند یادگیری، حافظه، احساسات و رفتارهای اجتماعی است.
تکوین سیستم عصبی مرکزی
تکوین سیستم عصبی مرکزی فرآیندی پویا و پیچیده است که از مراحل اولیه جنینی آغاز شده و تا اوایل دوران کودکی ادامه مییابد. این فرآیند شامل تشکیل، رشد و سازماندهی نورونها و سلولهای گلیا، شکلگیری شبکههای عصبی، ایجاد سیناپسها و توسعه عملکردهای پیچیده مغز است. هر مرحله از این تکوین، نیازمند هماهنگی دقیق بین ژنها، مسیرهای سیگنالینگ سلولی، محیط داخلی و عوامل خارجی است.
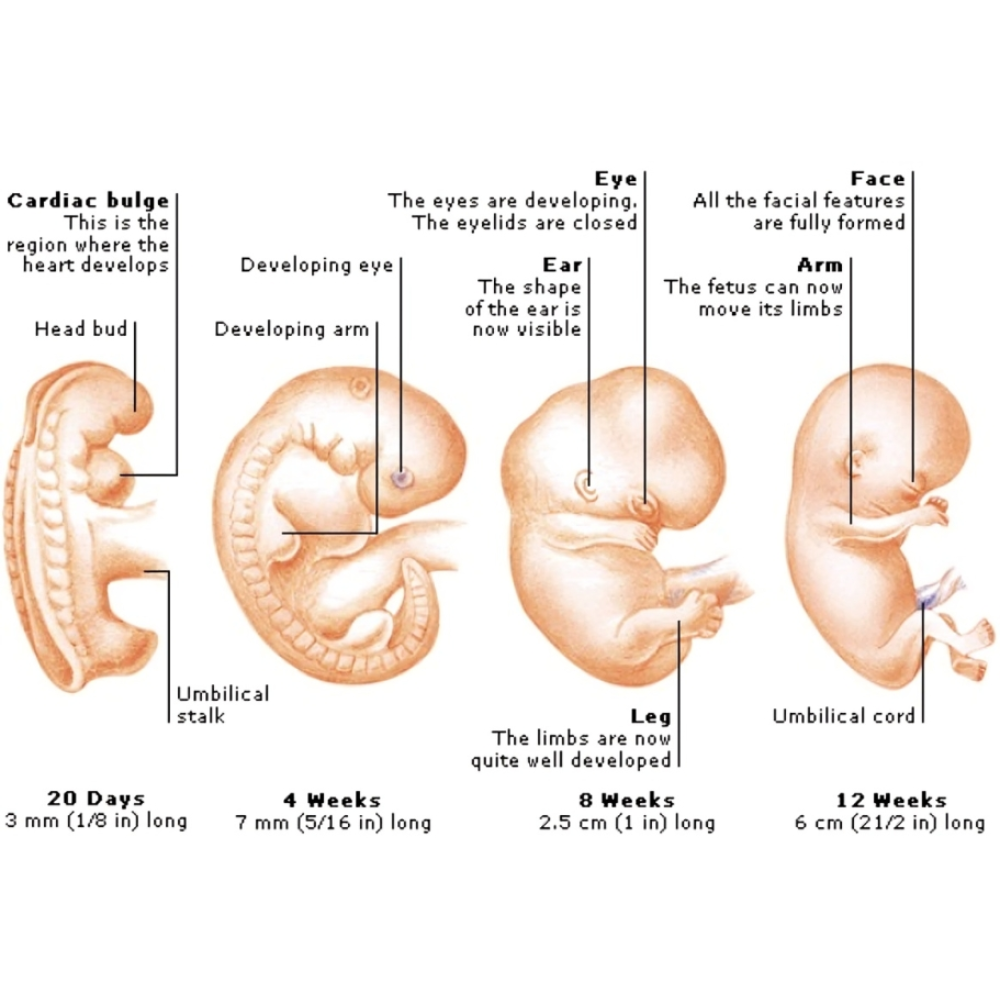
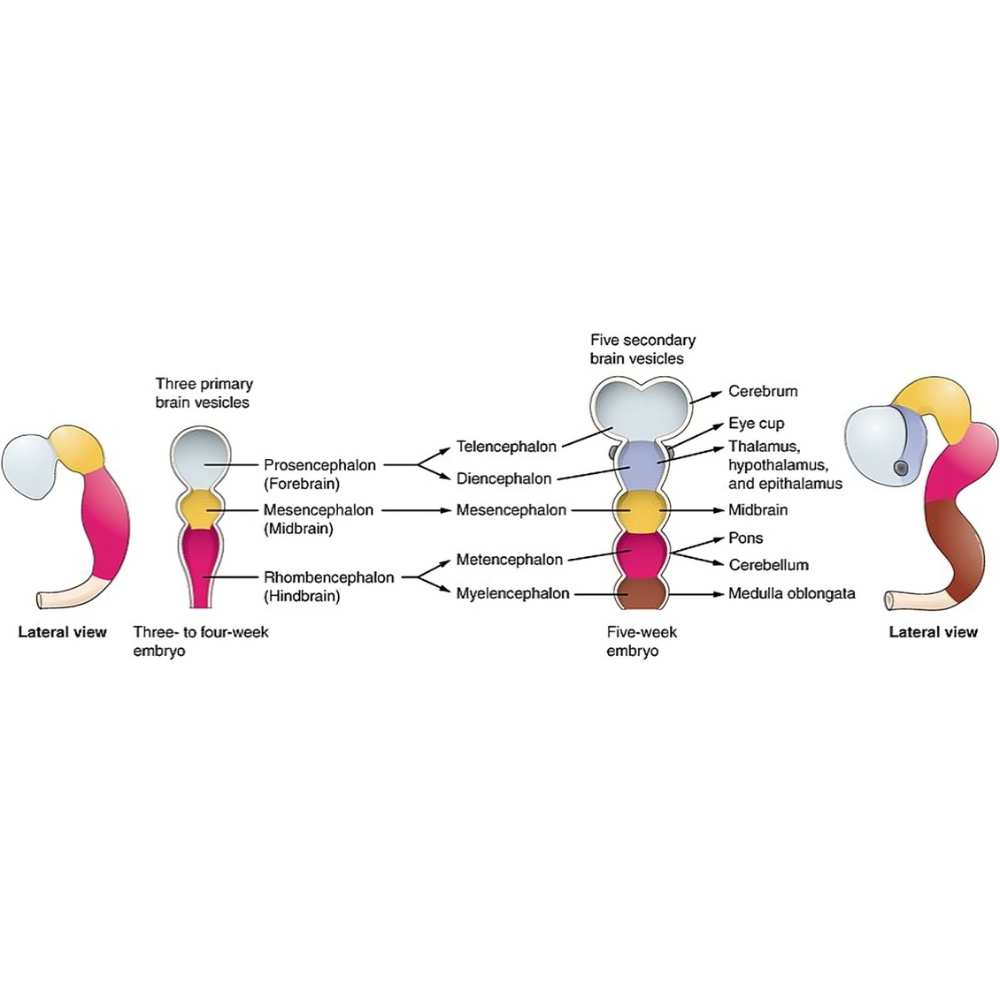
مراحل ابتدایی جنینی: نورولاسیون و شکلگیری لوله عصبی
اولین گام در تکوین CNS، فرآیندی به نام نورولاسیون است که در آن ناحیهای از اکتودرم جنین به نام صفحه عصبی ضخیم میشود و به شکلگیری لوله عصبی میانجامد. لوله عصبی پایهای برای مغز و نخاع است و نقص در این مرحله میتواند منجر به اختلالات مادرزادی جدی مانند اسپینا بیفیدا شود.
در مراحل اولیه، سلولهای بنیادی عصبی که توانایی تمایز به انواع مختلف نورونها و گلیا را دارند، در لوله عصبی تجمع میکنند. این سلولها پس از تقسیمهای مکرر، به نورونها، آستروسیتها و اولیگودندروسیتها تبدیل میشوند. فرآیند تقسیم سلولی به دقت زمانی کنترل میشود تا تعداد کافی نورون و سلول گلیا برای رشد ساختارهای مغزی ایجاد شود.
مهاجرت و تمایز سلولهای عصبی
پس از شکلگیری نورونها، آنها به موقعیت نهایی خود در مغز مهاجرت میکنند. این مهاجرت سلولی تحت کنترل سگنالهای شیمیایی و مسیرهای ژنتیکی است. برای مثال، مولکولهایی مانند reelin و chemokineها نقش هدایتکننده نورونها به لایههای مناسب کورتکس دارند. خطا در مهاجرت نورونها میتواند منجر به اختلالات ساختاری مغز و مشکلات شناختی شود.
تمایز نورونها نیز همزمان با مهاجرت رخ میدهد و هر نورون به نوع خاص خود مانند نورونهای حسی، حرکتی یا بینابینی تبدیل میشود. این تنوع سلولی پایه ایجاد شبکههای عصبی پیچیده را فراهم میکند. علاوه بر نورونها، سلولهای گلیا نیز تمایز پیدا میکنند و نقش حمایتی و تنظیمی خود را برای نورونها ایفا میکنند.
نقش ژنها و مسیرهای سیگنالینگ در تکوین CNS
تکوین CNS به شدت تحت تأثیر ژنها و مسیرهای سیگنالینگ سلولی است. خانواده ژنهای HOX، PAX و SOX نقش کلیدی در تعیین الگوهای بدن و سازماندهی بخشهای مختلف مغز دارند. مسیرهای سیگنالینگ مانند Notch، Wnt و Shh کنترل تقسیم، تمایز و مهاجرت سلولها را بر عهده دارند. تعادل دقیق بین این مسیرها، رشد هماهنگ نورونها و گلیا و تشکیل لایههای مغزی را تضمین میکند.
اختلال در این مسیرها میتواند منجر به نقصهای مادرزادی مغزی، اختلالات شناختی و ناهنجاریهای عملکردی شود. به عنوان مثال، اختلال در مسیر Shh میتواند باعث نقص در توسعه مخچه و کورتکس شود، در حالی که عدم تنظیم Notch منجر به تقسیم نامتعادل سلولهای بنیادی عصبی میشود.
تأثیر محیط داخلی و خارجی بر رشد CNS
رشد مغز نه تنها به ژنها و مسیرهای سیگنالینگ وابسته است، بلکه محیط داخلی بدن و عوامل خارجی نیز نقش حیاتی دارند. عوامل تغذیهای مانند DHA، ویتامینها و پروتئینها، و هورمونها مانند IGF-1 و کورتیزول، بر تقسیم سلولی، تمایز و پلاستیسیتی مغز تأثیرگذارند. کمبود این عوامل در دوران جنینی میتواند به اختلالات شناختی و تأخیر رشد عصبی منجر شود.
همچنین، محیط خارجی شامل تجربههای حسی، تعامل اجتماعی و میکروبیوتای روده میتواند بر توسعه CNS اثر بگذارد. تحقیقات اخیر نشان دادهاند که محور روده-مغز با تنظیم پاسخهای ایمنی و تولید نروترانسمیترها، نقش قابل توجهی در رشد مغز و رفتارهای شناختی دارد. مدلهای حیوانی نشان میدهند که عدم حضور میکروبیوتا یا تغییرات آن میتواند به اختلالات رفتاری و شناختی منجر شود، که اهمیت محیط و تغذیه را در مراحل ابتدایی زندگی نشان میدهد.
تشکیل شبکههای عصبی و سیناپسها
پس از مهاجرت و تمایز سلولها، نورونها شروع به تشکیل اتصالات سیناپسی میکنند. این مرحله پایه شکلگیری شبکههای عصبی و توانایی مغز در پردازش اطلاعات است. سیناپسها با استفاده از نروترانسمیترها پیامهای شیمیایی را منتقل میکنند و انعطافپذیری سیناپسی یا پلاستیسیتی مغز، اساس یادگیری و حافظه را تشکیل میدهد. سلولهای گلیا نیز با تنظیم محیط سیناپسی، پاکسازی مواد زائد و تأمین مواد مغذی، امکان فعالیت بهینه نورونها را فراهم میکنند.
مراحل بعد از تولد و رشد مغز
تکوین CNS تنها محدود به دوران جنینی نیست؛ پس از تولد نیز مغز رشد و سازماندهی خود را ادامه میدهد. افزایش حجم مغز، شکلگیری شبکههای پیچیدهتر، تکامل میلین و بهبود ارتباطات سیناپسی در اوایل کودکی رخ میدهد. این مرحله حساس است و هر گونه اختلال تغذیهای، محیطی یا ژنتیکی میتواند تأثیرات بلندمدت بر عملکرد شناختی و رفتاری کودک داشته باشد.
سلولهای گلیا و نقش آنها در رشد مغز
سلولهای گلیا، که گاهی «سلولهای پشتیبان عصبی» نامیده میشوند، بیش از نیمی از جمعیت سلولی سیستم عصبی مرکزی (CNS) را تشکیل میدهند و نقش آنها فراتر از حمایت فیزیکی نورونها است. این سلولها با ایجاد محیطی پایدار، تأمین مواد مغذی، پاکسازی مواد زائد و تنظیم فعالیت سیناپسی، اساس عملکرد صحیح مغز را فراهم میکنند. در طول تکوین CNS، سلولهای گلیا نه تنها نقش حمایتی دارند، بلکه به عنوان معماران اصلی شبکههای عصبی عمل میکنند و در شکلدهی ساختارهای مغزی، هماهنگی فعالیت نورونها و پلاستیسیتی مغز مؤثرند.
آستروسیتها: پشتیبانهای چندوجهی نورونها
آستروسیتها بزرگترین و پراستعدادترین نوع سلولهای گلیا هستند که شکل ستارهای دارند و با شاخههای متعدد خود، نورونها، عروق مغزی و سیناپسها را احاطه میکنند. نقش آستروسیتها در تکوین مغز شامل موارد زیر است:
-
تغذیه و متابولیسم: آستروسیتها گلوکز را دریافت و به لاکتات تبدیل میکنند، که انرژی لازم برای فعالیت نورونها را فراهم میکند. این فرآیند برای نورونهای در حال رشد حیاتی است.
-
تنظیم محیط یونی و شیمیایی: آستروسیتها یونها و نروترانسمیترهای اضافی را جذب میکنند و از تجمع بیش از حد کلسیم و گلوتمات جلوگیری میکنند، که این امر به سلامت سیناپسها و نورونها کمک میکند.
-
تسهیل تشکیل و تثبیت سیناپسها: آستروسیتها با ترشح مولکولهای سیگنالینگ مانند thrombospondin و glypicans، تشکیل سیناپسهای جدید و تثبیت شبکههای عصبی را تسهیل میکنند.
به طور خلاصه، آستروسیتها محیطی بهینه برای رشد و عملکرد نورونها ایجاد میکنند و نقش مستقیم در یادگیری و حافظه دارند.
اولیگودندروسیتها و میلینسازی
اولیگودندروسیتها سلولهایی هستند که آکسونهای نورونها را با میلین میپوشانند. میلین یک غلاف چربی است که سرعت انتقال پیامهای عصبی را به طرز قابل توجهی افزایش میدهد. در طول تکوین CNS، میلینسازی نقش حیاتی در رشد عملکرد شناختی و هماهنگی حرکتی دارد. نکات کلیدی عملکرد اولیگودندروسیتها عبارتاند از:
-
افزایش سرعت انتقال پیامهای عصبی: میلین امکان ارسال سریع و دقیق سیگنالها بین نورونها و بخشهای مختلف مغز را فراهم میکند.
-
تسهیل هماهنگی شبکههای عصبی: با میلینسازی، اتصالات بین قشرهای مغزی و بخشهای زیرقشری بهتر هماهنگ میشوند، که برای یادگیری و کنترل حرکات ضروری است.
-
پشتیبانی از نورونها در شرایط آسیب: اولیگودندروسیتها با ترشح فاکتورهای رشد و مواد مغذی به ترمیم نورونها و حفظ عملکرد شبکههای عصبی کمک میکنند.
اختلال در عملکرد اولیگودندروسیتها میتواند منجر به بیماریهای نورودژنراتیو مانند اسکلروز چندگانه شود که با تخریب میلین و کاهش سرعت انتقال پیامها همراه است.
میکروگلیا: نگهبان و معمار CNS
میکروگلیا سلولهای ایمنی CNS هستند که نقشهای متعددی در تکوین، نگهداری و بازسازی مغز ایفا میکنند. برخلاف تصور سنتی که میکروگلیا تنها به عنوان سلولهای پاکسازیکننده عمل میکردند، تحقیقات جدید نشان میدهد که این سلولها معمار شبکههای عصبی نیز هستند. وظایف میکروگلیا شامل موارد زیر است:
-
پاکسازی مواد زائد و سلولهای مرده: میکروگلیا سلولهای نابالغ و سیناپسهای اضافی را حذف میکنند، فرآیندی که به شکلگیری شبکههای عصبی بهینه کمک میکند.
-
تنظیم سیناپسها و پلاستیسیتی: میکروگلیا با تعامل مستقیم با سیناپسها، اتصالهای غیرضروری را حذف و اتصالهای مفید را تقویت میکنند، که اساس یادگیری و حافظه است.
-
حفظ ایمنی CNS: میکروگلیا با شناسایی و پاسخ به عوامل التهابی یا آسیبها، محیط CNS را محافظت میکنند و به بازسازی بافت کمک میکنند.
در مراحل بعد از تولد، میکروگلیا همچنان در حفظ شبکههای عصبی و پاسخ به آسیبها نقش کلیدی دارد و اختلال در عملکرد آن میتواند باعث اختلالات شناختی، روانی و نورودژنراتیو شود.
NG2-glia و نقش آنها در تکامل مغز
NG2-glia نوعی سلول گلیایی است که در تکوین CNS و بازسازی بعد از آسیب، عملکردهای حیاتی دارد. این سلولها توانایی تبدیل شدن به اولیگودندروسیتها و برخی سلولهای دیگر را دارند و نقش آنها شامل موارد زیر است:
-
شرکت در میلینسازی و پشتیبانی از نورونهای در حال رشد
-
تسهیل بازسازی بافت بعد از آسیب و تحریک رشد سیناپسهای جدید
-
ارتباط با نورونها و آستروسیتها برای هماهنگی شبکههای عصبی
NG2-glia به دلیل توانایی دوگانه در تمایز و پشتیبانی محیطی، یکی از اجزای کلیدی در تکوین مغز و بازسازی CNS محسوب میشود.
تعامل سلولهای گلیا با نورونها و شبکههای عصبی
تمامی انواع سلولهای گلیا با نورونها در تعامل مستمر هستند. این تعاملات به صورت مکانیسمهای سیگنالینگ مولکولی، تغییرات یونیک و ترشح نروترانسمیترها و فاکتورهای رشد انجام میشود. چنین هماهنگی بین گلیا و نورونها، شکلگیری شبکههای عصبی بهینه، تقویت پلاستیسیتی سیناپسی و حفظ سلامت CNS را تضمین میکند.
اهمیت سلولهای گلیا در رشد شناختی و عملکرد مغز
سلولهای گلیا نه تنها عملکرد نورونها را حمایت میکنند، بلکه با مشارکت در شکلگیری شبکهها، تسهیل یادگیری و حافظه، تنظیم پاسخهای ایمنی و بازسازی بافت، بخش حیاتی از پیشرفت شناختی و رشد مغز هستند. تحقیقات اخیر نشان دادهاند که نقص در عملکرد گلیا میتواند به اختلالات نورودژنراتیو، تأخیر رشد شناختی و مشکلات روانی منجر شود، که اهمیت آنها را در مراحل تکوین مغز دوچندان میکند.
سیستم ایمنی مغز و نقش میکروگلیا
سیستم عصبی مرکزی برخلاف سایر بافتهای بدن، دارای سیستم ایمنی ویژه و پیچیدهای است که برای حفظ عملکرد نورونها و حفاظت از مغز در برابر آسیبها، عفونتها و التهابها طراحی شده است. سلولهای ایمنی مغز عمدتاً شامل میکروگلیا و تعداد محدودی سلولهای ماکروفاژ مرتبط با CNS هستند. این سلولها علاوه بر پاسخ ایمنی، نقشهای حیاتی در تکوین مغز، نگهداری بافت و بازسازی شبکههای عصبی ایفا میکنند.
میکروگلیا: نگهبانان اصلی CNS
میکروگلیا نوعی سلول ایمنی ذاتی در CNS است که منشأ آن از مکروفاژهای جنینی yolk sac است و به مغز مهاجرت میکند. این سلولها در طول رشد مغز فعالیتهای متعددی دارند که فراتر از عملکرد ایمنی ساده است:
-
پاکسازی سلولهای مرده و ضایعات: میکروگلیا با فرآیند فاگوسیتوز، سلولهای نابالغ، سیناپسهای اضافی و مواد زائد را پاک میکنند. این عملکرد نه تنها از تجمع مواد مضر جلوگیری میکند، بلکه شبکههای عصبی بهینه و سازمانیافته ایجاد میکند.
-
تنظیم پلاستیسیتی سیناپسی: میکروگلیا با تعامل مستقیم با سیناپسها، سیناپسهای غیرضروری را حذف و سیناپسهای فعال را تقویت میکنند. این فرآیند برای یادگیری و حافظه ضروری است و پایه شکلگیری ارتباطات عصبی بلندمدت را فراهم میآورد.
-
ترشح فاکتورهای رشد و سیتوکینها: میکروگلیا فاکتورهایی مانند BDNF و IGF-1 ترشح میکنند که رشد نورونها، تشکیل سیناپسها و تمایز سلولهای گلیا را تسهیل میکنند.
میکروگلیا در مراحل تکوین و رشد مغز
در طول دوران جنینی و اوایل کودکی، میکروگلیا فعالیتهای حیاتی متعددی دارند که به تکامل CNS کمک میکنند. آنها نه تنها در حذف سیناپسهای اضافی و تنظیم شبکهها نقش دارند، بلکه با تعامل با نورونها و سلولهای گلیا، محیطی پایدار و بهینه برای رشد نورونها ایجاد میکنند. تحقیقات اخیر نشان دادهاند که نقص عملکرد میکروگلیا در این مراحل میتواند باعث اختلالات نورودویلپمنتال مانند اوتیسم، اختلال نقص توجه و تأخیرهای شناختی شود.
تعامل میکروگلیا با دیگر اجزای سیستم عصبی
میکروگلیا با آستروسیتها و اولیگودندروسیتها در ارتباط مستمر است. این تعاملات شامل تنظیم محیط یونی و شیمیایی، ترشح فاکتورهای رشد و کنترل التهاب است. علاوه بر آن، میکروگلیا با نورونها ارتباط سیناپسی برقرار میکند و نقش مستقیم در شکلگیری شبکههای عصبی دارد. به عنوان مثال، در فرآیند myelination، میکروگلیا با ترشح فاکتورهای پرومیلین و پاکسازی محیط، رشد و عملکرد اولیگودندروسیتها را تسهیل میکنند.
میکروگلیا در پاسخ به آسیب و بیماری
میکروگلیا علاوه بر نقش توسعهای، نقش حیاتی در حفاظت CNS در برابر آسیب و بیماریها دارد:
-
پاسخ به التهاب و عفونت: میکروگلیا با شناسایی پاتوژنها و سلولهای آسیبدیده، پاسخ ایمنی اولیه را فعال میکنند و با ترشح سیتوکینهای التهابی، سیستم ایمنی بدن را به محل آسیب هدایت میکنند.
-
بازسازی بافت و ترمیم: پس از آسیب مغزی، میکروگلیا به بازسازی شبکههای عصبی، حذف سلولهای مرده و تسهیل بازسازی سیناپسها کمک میکنند.
-
تنظیم پاسخهای ایمنی طولانیمدت: میکروگلیا با تعادل بین پاسخهای التهابی و ضدالتهابی، از آسیبهای ثانویه نورونها جلوگیری میکنند.
در بیماریهای نورودژنراتیو مانند آلزایمر، پارکینسون و اسکلروز چندگانه، میکروگلیا نقش دوگانهای دارد؛ در مراحل اولیه، حفاظتکننده است، اما در مراحل پیشرفته میتواند باعث التهاب مزمن و تخریب نورونها شود. این دوگانگی نشاندهنده اهمیت دقیق تنظیم عملکرد میکروگلیا در CNS است.
سیستم ایمنی مغز و ارتباط با روده
تحقیقات جدید نشان دادهاند که میکروگلیا تحت تأثیر محور روده-مغز قرار دارند. میکروبیوتای روده با تولید متابولیتها و نروترانسمیترها، فعالیت میکروگلیا و پاسخهای ایمنی مغز را تنظیم میکند. تغییرات در میکروبیوتا میتواند باعث اختلال در توسعه CNS، کاهش پلاستیسیتی سیناپسی و افزایش ریسک اختلالات رفتاری و روانی شود. این یافتهها اهمیت تعامل بین سیستم ایمنی CNS و محیط میکروبی بدن را نشان میدهند.
اهمیت میکروگلیا در تکوین، عملکرد و حفاظت مغز
به طور خلاصه، میکروگلیا به عنوان معماران، نگهبانان و مدبران CNS عمل میکنند. آنها نه تنها شبکههای عصبی را شکل میدهند و نگهداری میکنند، بلکه پاسخهای ایمنی را هماهنگ و به بازسازی بافت کمک میکنند. نقص در عملکرد میکروگلیا میتواند باعث اختلالات عصبی، تأخیر رشد شناختی، بیماریهای روانی و نورودژنراتیو شود. بنابراین، شناخت دقیق نقش میکروگلیا و مکانیسمهای تنظیمی آن، کلید درک سلامت CNS و طراحی درمانهای نوین برای اختلالات عصبی است.
عوامل متابولیک و تغذیهای در رشد مغز
رشد و تکوین سیستم عصبی مرکزی به شدت تحت تأثیر عوامل متابولیک و تغذیهای است. مغز، با وجود اینکه تنها حدود ۲ درصد وزن بدن را تشکیل میدهد، مصرف انرژی بسیار بالایی دارد و برای رشد سالم، نیازمند مواد مغذی، اکسیژن و تنظیم دقیق مسیرهای متابولیک است. هر گونه اختلال در تامین مواد مغذی یا عملکرد متابولیک میتواند بر تکوین نورونها، شکلگیری شبکههای عصبی و پلاستیسیتی سیناپسی تأثیر منفی بگذارد.
DHA و اسیدهای چرب امگا-۳
یکی از مهمترین عوامل تغذیهای برای رشد مغز، اسید داکوزاهگزانوئیک (DHA) است که جزء اسیدهای چرب امگا-۳ محسوب میشود. DHA نقشهای کلیدی در مراحل زیر ایفا میکند:
-
تشکیل غشاهای نورونی: DHA در غشاهای سلولهای عصبی تجمع مییابد و انعطافپذیری و سیگنالینگ سیناپسی را بهبود میبخشد.
-
تقویت پلاستیسیتی سیناپسی: DHA با افزایش تراکم و کیفیت سیناپسها، یادگیری و حافظه را بهبود میدهد.
-
تنظیم پاسخهای التهابی: DHA و متابولیتهای آن باعث کاهش التهاب و محافظت از نورونها در برابر استرس اکسیداتیو میشوند.
مطالعات حیوانی و انسانی نشان دادهاند که کمبود DHA در دوران جنینی و اوایل کودکی میتواند به کاهش حجم مغز، تأخیر شناختی و اختلالات رفتاری منجر شود. بنابراین تأمین این اسید چرب از طریق رژیم غذایی یا مکملها اهمیت حیاتی دارد.
IGF-1 و فاکتورهای رشد
فاکتور رشد شبه انسولین-۱ (IGF-1) نقش مهمی در رشد مغز و پلاستیسیتی عصبی دارد. IGF-1 با تحریک تقسیم سلولی، تمایز نورونها و تشکیل سیناپسها، مراحل حیاتی تکوین CNS را تقویت میکند. تأثیرات IGF-1 شامل موارد زیر است:
-
تقویت نورونزایی و تکامل نورونها
-
حمایت از رشد و عملکرد سلولهای گلیا
-
بهبود بازسازی شبکههای عصبی بعد از آسیبها
کمبود IGF-1 در دوران جنینی یا پس از تولد با تأخیر رشد شناختی و مشکلات حرکتی همراه است، که نشاندهنده نقش حیاتی آن در سلامت CNS است.
مواد مغذی و ویتامینها
ویتامینها و مواد معدنی نیز نقش اساسی در رشد مغز دارند:
-
ویتامین B9 (فولات): ضروری برای تکثیر سلولهای بنیادی عصبی و تشکیل لوله عصبی در مراحل ابتدایی جنینی
-
ویتامین B12 و کولین: نقش مهم در متابولیسم نورونها و ساخت میلین دارند
-
آهن و روی: برای تشکیل میتوکندریها، سنتز نروترانسمیترها و فعالیت آنزیمهای عصبی ضروری هستند
-
یُد: در سنتز هورمونهای تیروئید که رشد مغز و تکامل نورونها را تنظیم میکنند، حیاتی است
کمبود هر یک از این مواد مغذی میتواند به نقصهای ساختاری و عملکردی CNS، تأخیر رشد شناختی و اختلالات رفتاری منجر شود.
متابولیسم گلوکز و لاکتات
مغز به شدت به گلوکز وابسته است و مصرف انرژی نورونها و گلیا با متابولیسم گلوکز تأمین میشود. جالب اینجاست که لاکتات، محصول متابولیسم گلوکز توسط آستروسیتها، نه تنها به عنوان سوخت انرژی بلکه به عنوان عامل تنظیمی عمل میکند. لاکتات با فعال کردن مسیرهای سیگنالینگ و تقویت پلاستیسیتی سیناپسی، نقش مهمی در یادگیری و حافظه ایفا میکند.
اکسیداتیو استرس و سیستمهای آنتیاکسیدانی
رشد CNS با تولید رادیکالهای آزاد و اکسیداتیو استرس همراه است، که اگر کنترل نشود میتواند باعث آسیب نورونی شود. سیستمهای آنتیاکسیدانی مانند گلوتاتیون و تیوردوکسین با خنثی کردن رادیکالهای آزاد، از نورونها محافظت میکنند و به حفظ تعادل متابولیک کمک میکنند. این مکانیسمها برای رشد سالم مغز و پیشگیری از آسیبهای نورودژنراتیو حیاتی هستند.
نقش میکروبیوتای روده و محور روده-مغز
تغذیه و متابولیسم تنها محدود به مواد مغذی نیست، بلکه میکروبیوتای روده نقش مهمی در رشد CNS دارد. باکتریهای مفید روده با تولید متابولیتها، نروترانسمیترها و فاکتورهای ایمنی، فعالیت میکروگلیا و نوروژنز را تنظیم میکنند. اختلال در این محور میتواند باعث اختلالات رفتاری، کاهش پلاستیسیتی سیناپسی و افزایش ریسک بیماریهای نورودژنراتیو شود.
اهمیت تغذیه و محیط متابولیک در رشد شناختی و رفتاری
به طور کلی، تامین مواد مغذی، کنترل متابولیسم انرژی و حفظ تعادل آنتیاکسیدانی، پایه رشد مغز و توسعه عملکردهای شناختی هستند. تغذیه مناسب در دوران جنینی، نوزادی و کودکی، ارتباطات نورونی، عملکرد سیناپسی و سلامت روانی آینده را شکل میدهد. اختلال در این فرآیندها میتواند تأثیرات بلندمدتی بر هوش، رفتار و عملکرد مغز داشته باشد.
محور روده-مغز و میکروبیوتا
تحقیقات اخیر نشان دادهاند که رشد و عملکرد سیستم عصبی مرکزی (CNS) تنها به ژنها، نورونها و سلولهای گلیا محدود نمیشود، بلکه محور روده-مغز و میکروبیوتای روده نقش حیاتی در توسعه، عملکرد و سلامت مغز ایفا میکنند. این ارتباط پیچیده شامل تبادل سیگنالهای عصبی، ایمنی، متابولیک و هورمونی بین روده و مغز است و بر رشد شناختی، رفتار و حتی پاسخ به استرس تأثیر میگذارد.
ساختار و عملکرد محور روده-مغز
محور روده-مغز از چند مسیر اصلی تشکیل شده است:
-
مسیر عصبی: شامل عصب واگ و شبکههای سمپاتیک و پاراسمپاتیک است که اطلاعات حسی و حرکتی بین روده و مغز را منتقل میکنند. این مسیرها نه تنها عملکرد گوارشی را تنظیم میکنند، بلکه سیگنالهای رشد و فعالیت نورونی را به CNS منتقل میکنند.
-
مسیر ایمنی: میکروبیوتای روده با تولید متابولیتها و مولکولهای فعالکننده سیستم ایمنی، فعالیت سلولهای ایمنی CNS مانند میکروگلیا را تنظیم میکند.
-
مسیر متابولیک و هورمونی: باکتریهای روده میتوانند نروترانسمیترها، کوتاهزنجیرههای اسید چرب و فاکتورهای رشد را تولید کنند که بر نورونها، آستروسیتها و پلاستیسیتی سیناپسی اثرگذارند.
میکروبیوتا و تکوین CNS
میکروبیوتا، شامل میلیاردها باکتری، ویروس و قارچ مفید در روده، نقش مهمی در مراحل اولیه تکوین CNS دارد:
-
تأثیر بر نوروژنز و رشد سیناپسی: مطالعات حیوانی نشان دادهاند که در مدلهای بدون میکروبیوتا (germ-free animals)، کاهش تولید نورونهای جدید و اختلال در تشکیل سیناپسها مشاهده میشود. بازگرداندن میکروبیوتا میتواند این نقصها را تا حدی اصلاح کند.
-
تنظیم عملکرد میکروگلیا: میکروبیوتا با تولید متابولیتهایی مانند اسیدهای چرب کوتاه زنجیرهای فعالیت میکروگلیا را تنظیم کرده و به شکلگیری شبکههای عصبی بهینه کمک میکند.
-
تأثیر بر پلاستیسیتی سیناپسی و یادگیری: باکتریهای روده با تأثیر بر سطح نروترانسمیترها مانند سروتونین، GABA و دوپامین، عملکرد شناختی و رفتارهای اجتماعی را تحت تأثیر قرار میدهند.
محور روده-مغز و سلامت روان
تعدادی از تحقیقات نشان دادهاند که اختلال در میکروبیوتا میتواند با اختلالات رفتاری و روانی مانند اضطراب، افسردگی و اوتیسم مرتبط باشد. تغییرات در ترکیب میکروبیوتا میتواند پاسخهای استرسی CNS را تقویت کرده و فرآیندهای پلاستیسیتی سیناپسی را مختل کند.
نقش تغذیه در محور روده-مغز
تغذیه نقش کلیدی در سلامت میکروبیوتا دارد. رژیمهای غنی از فیبرهای محلول، پروبیوتیکها و اسیدهای چرب امگا-۳ میتوانند ترکیب میکروبیوتا را به سمت تولید متابولیتهای مفید هدایت کنند، که این متابولیتها فعالیت میکروگلیا و نورونها را بهبود میدهند و رشد شناختی و سلامت روان را تقویت میکنند.
میکروبیوتا و بیماریهای عصبی
تغییرات میکروبیوتا با بسیاری از بیماریهای CNS مرتبط است، از جمله:
-
اختلالات نورودویلپمنتال: مانند اوتیسم و ADHD، که با تغییر ترکیب میکروبیوتا و نقص در محور روده-مغز همراه هستند.
-
اختلالات نورودژنراتیو: مانند آلزایمر و پارکینسون، که افزایش التهاب و اختلال در متابولیتهای روده میتواند پیشرفت بیماری را تسریع کند.
-
اختلالات روانی: تغییر میکروبیوتا میتواند رفتارهای اضطرابی و افسردگی را تشدید کند.
مکانیسمهای مولکولی محور روده-مغز
میکروبیوتا از طریق تولید مولکولهای مختلف بر مغز اثر میگذارد:
-
نروترانسمیترها: شامل سروتونین، GABA و دوپامین که تنظیم رفتار، یادگیری و خلق و خو را بر عهده دارند.
-
کوتاهزنجیرههای اسید چرب (SCFA): مانند بوتیرات و پروپیونات که فعالیت میکروگلیا را بهبود میدهند و التهاب CNS را کاهش میدهند.
-
سیتوکینها و فاکتورهای ایمنی: که پاسخهای ایمنی CNS را تنظیم میکنند و بازسازی نورونها و شبکههای عصبی را تسهیل میکنند.
اهمیت محور روده-مغز در رشد شناختی و عملکرد مغز
محور روده-مغز نقش حیاتی در رشد مغز، تکامل شناختی، رفتار اجتماعی و پاسخ به استرس دارد. حمایت از سلامت میکروبیوتا از طریق تغذیه مناسب، پروبیوتیکها و سبک زندگی سالم میتواند به بهبود عملکرد CNS و پیشگیری از اختلالات عصبی و روانی کمک کند.
سیستم عروقی و سد خونی-مغزی
رشد و عملکرد سیستم عصبی مرکزی تنها وابسته به نورونها و سلولهای گلیا نیست؛ شبکه عروقی مغز و سد خونی-مغزی (Blood-Brain Barrier, BBB) نیز نقش حیاتی در حمایت از تکوین، تغذیه، ایمنی و عملکرد مغز ایفا میکنند. این سیستمها با تأمین اکسیژن، مواد مغذی و محافظت در برابر سموم و پاتوژنها، پایهای برای سلامت CNS فراهم میکنند.
ساختار و عملکرد سیستم عروقی مغز
سیستم عروقی CNS شامل شبکهای گسترده از مویرگها، شریانها و وریدها است که نورونها و سلولهای گلیا را تغذیه میکنند. ویژگیهای کلیدی سیستم عروقی مغز عبارتاند از:
-
تأمین اکسیژن و مواد مغذی: گلوکز و اسیدهای آمینه به طور مداوم از طریق خون به مغز منتقل میشوند، که انرژی لازم برای فعالیت نورونها و پلاستیسیتی سیناپسی را تأمین میکند.
-
حذف مواد زائد: مویرگهای مغزی و سلولهای گلیا با همکاری یکدیگر، دیاکسیدکربن و متابولیتهای اضافی را از محیط عصبی حذف میکنند.
-
تعامل با سلولهای گلیا و نورونها: آستروسیتها با شاخههای خود مویرگها را احاطه میکنند و با انتقال مواد مغذی، سیگنالینگ و حمایت ساختاری، عملکرد شبکههای عصبی را بهینه میکنند.
سد خونی-مغزی: محافظ هوشمند CNS
سد خونی-مغزی یک ساختار نیمهتراوا و تخصصی است که ورود مواد مضر، پاتوژنها و سلولهای ایمنی به مغز را محدود میکند، در حالی که امکان انتقال مواد مغذی و مولکولهای حیاتی را فراهم میکند. اجزای اصلی BBB عبارتاند از:
-
سلولهای اندوتلیال مویرگها: با اتصال محکم (tight junctions) از عبور آزاد مولکولها جلوگیری میکنند.
-
آستروسیتها: پایانههای آستروسیت به اندوتلیوم متصل شده و عملکرد سد را تقویت میکنند و مواد مغذی را منتقل میکنند.
-
پرفیوژن مویرگی و پمپهای انتقالی: مولکولهای ضروری مانند گلوکز، اسیدهای آمینه و فاکتورهای رشد به کمک پمپها به مغز منتقل میشوند.
این سد نقش کلیدی در حفاظت CNS دارد و همچنین تعادل یونی و شیمیایی محیط عصبی را حفظ میکند، که برای رشد و تکامل نورونها ضروری است.
رشد و تکوین عروق مغزی در دوران جنینی و کودکی
تکوین شبکه عروقی مغز همزمان با تکامل نورونها و سلولهای گلیا رخ میدهد و به شکل زیر است:
-
آنژیوژنز اولیه: در مراحل جنینی، سلولهای اندوتلیال با انتشار فاکتورهای رشد مانند VEGF شبکه مویرگی اولیه را شکل میدهند.
-
تعامل با آستروسیتها و میکروگلیا: این سلولها با سیگنالدهی متقابل، ثبات مویرگها و شکلگیری صحیح BBB را تضمین میکنند.
-
تکامل عملکردی BBB: در اواخر جنینی و اوایل کودکی، tight junctions تقویت میشوند و نفوذپذیری BBB کاهش یافته و حفاظت CNS افزایش مییابد.
تأثیر سیستم عروقی و BBB بر رشد شناختی
شبکه عروقی سالم و BBB کارآمد، پایه رشد شناختی، هماهنگی حرکتی و سلامت روانی را فراهم میکند. اختلال در عملکرد عروق یا نفوذپذیری غیرطبیعی BBB میتواند باعث کاهش تغذیه نورونها، التهاب CNS و اختلالات نورودژنراتیو شود. به عنوان مثال:
-
اختلال در مویرگها و BBB میتواند با اختلالات رشد شناختی و تأخیرهای یادگیری مرتبط باشد.
-
آسیب به BBB در بیماریهای نورودژنراتیو مانند آلزایمر و پارکینسون باعث افزایش التهاب و تخریب شبکههای عصبی میشود.
تعامل با محور روده-مغز و سلولهای ایمنی
شبکه عروقی و BBB با محور روده-مغز در تعامل مستقیم هستند. متابولیتهای میکروبی و نروترانسمیترها میتوانند نفوذپذیری BBB را تغییر دهند و فعالیت میکروگلیا و آستروسیتها را تنظیم کنند. این ارتباط به ویژه در دوران تکوین CNS اهمیت دارد و میتواند بر رشد شناختی، رفتار و پاسخ به استرس تأثیرگذار باشد.
مکانیسمهای حفاظت و بازسازی CNS
در مواجهه با آسیب یا التهاب، سیستم عروقی CNS و BBB نقش محافظتی و بازسازیکننده دارند:
-
افزایش جریان خون موضعی برای تأمین اکسیژن و مواد مغذی مورد نیاز نورونها
-
فعال شدن سلولهای آستروسیت و میکروگلیا برای ترمیم مویرگها و حذف مواد زائد
-
تنظیم مسیرهای سیگنالینگ و سیتوکینها برای محدود کردن آسیب و التهاب ثانویه
این مکانیسمها نشاندهنده اهمیت حیاتی شبکه عروقی و BBB در حفاظت و پشتیبانی از CNS هستند.
اهمیت سیستم عروقی و BBB در سلامت و بیماری CNS
به طور خلاصه، سیستم عروقی و سد خونی-مغزی نه تنها مواد مغذی و اکسیژن را تأمین میکنند، بلکه به شکلدهی، حفاظت و بازسازی شبکههای عصبی نیز کمک میکنند. اختلال در عملکرد آنها میتواند باعث تأخیر رشد شناختی، آسیب نورونی و پیشرفت بیماریهای عصبی و روانی شود. شناخت دقیق مکانیسمهای آنژیوژنز، تعامل با سلولهای گلیا و تنظیم BBB میتواند زمینهساز راهکارهای درمانی نوین برای اختلالات مغزی باشد.
مکانیسمهای مولکولی و نروترانسمیترها
تکوین و رشد سیستم عصبی مرکزی (CNS) تنها به ساختار سلولی و شبکههای عروقی محدود نمیشود؛ مکانیسمهای مولکولی و نروترانسمیترها نقش اساسی در تنظیم تکثیر، تمایز، پلاستیسیتی و عملکرد نورونها و سلولهای گلیا دارند. این فرآیندها پایه سلامت شناختی، حافظه، رفتار و پاسخ به استرس را شکل میدهند و اختلال در آنها میتواند منجر به مشکلات نورودویلپمنتال و نورودژنراتیو شود.
نقش نروترانسمیترها در رشد و تکامل مغز
نروترانسمیترها مولکولهای شیمیایی هستند که پیامها را بین نورونها و بین نورونها و سلولهای گلیا منتقل میکنند. نقش آنها در مراحل مختلف CNS به شرح زیر است:
-
گلوکامات (Glutamate): اصلیترین نروترانسمیتر تحریکی در CNS است و نقش حیاتی در نوروژنز، تمایز نورونها، و تشکیل سیناپسها دارد. گلوکامات با فعالسازی گیرندههای NMDA و AMPA، سیگنالهای کلسیمی را تحریک میکند که مسیرهای رشد و پلاستیسیتی سیناپسی را تقویت میکنند.
-
GABA (گاما-آمینوبوتیریک اسید): نروترانسمیتر مهاری CNS است که در مراحل اولیه رشد مغز، برخلاف عملکرد مهاری بزرگسالان، نقش تحریکی و تنظیمکننده نورونزایی و مهاجرت سلولی را ایفا میکند. تعادل گلوکامات و GABA برای شکلگیری شبکههای عصبی سالم ضروری است.
-
دوپامین و سروتونین: این نروترانسمیترها علاوه بر تنظیم رفتار و خلق و خو، نقش کلیدی در تمایز نورونها، شکلگیری سیناپسها و رشد مدارهای عصبی دارند. اختلال در مسیرهای دوپامین و سروتونین میتواند باعث اختلالات روانی و نقصهای شناختی شود.
-
استیلکولین: در تکوین هیپوکامپ و کورتکس مغز نقش دارد و برای حافظه و یادگیری حیاتی است.
فاکتورهای رشد و مسیرهای سیگنالینگ مولکولی
رشد مغز علاوه بر نروترانسمیترها به فاکتورهای رشد و مسیرهای سیگنالینگ سلولی وابسته است:
-
BDNF (Brain-Derived Neurotrophic Factor): این فاکتور رشد با تحریک تکثیر نورونها، تمایز، تشکیل و تقویت سیناپسها، پلاستیسیتی سیناپسی را افزایش میدهد. BDNF همچنین با مسیرهای متابولیک و انرژی نورونی تعامل دارد و نورونها را در برابر استرس اکسیداتیو محافظت میکند.
-
IGF-1 (Insulin-like Growth Factor 1): با تأثیر بر نورونزایی، حمایت از سلولهای گلیا و افزایش بازسازی شبکههای عصبی، رشد CNS را بهینه میکند.
-
VEGF و فاکتورهای آنژیوژنیک: علاوه بر ایجاد شبکههای عروقی، VEGF مسیرهای نوروتروفیک را فعال میکند و به نورونها و آستروسیتها سیگنال رشد میدهد.
مکانیسمهای سیگنالینگ سلولی در پلاستیسیتی سیناپسی
پلاستیسیتی سیناپسی فرآیندی است که به مغز اجازه میدهد یاد بگیرد، حافظه ایجاد کند و شبکههای عصبی را بهینه کند. مکانیسمهای مولکولی دخیل شامل موارد زیر است:
-
مسیرهای کلسیم وابسته: ورود کلسیم از طریق گیرندههای NMDA باعث فعال شدن کینازها و فاکتورهای رونویسی میشود که رشد آکسونها و تشکیل سیناپسها را تسهیل میکنند.
-
مسیرهای MAPK/ERK و PI3K/Akt: این مسیرها با فعال کردن ژنهای رشد و بقا، تکثیر نورونها و تقویت پلاستیسیتی سیناپسی را تنظیم میکنند.
-
مکانیزمهای اپیژنتیک و RNAهای غیرکدکننده: lncRNAها و microRNAها با تنظیم بیان ژنهای مرتبط با رشد نورونها و گلیا، نقش حیاتی در شکلگیری شبکههای عصبی ایفا میکنند.
تنظیم نروترانسمیترها توسط محیط و متابولیتها
فعالیت نروترانسمیترها و مسیرهای سیگنالینگ به شدت تحت تأثیر عوامل محیطی و متابولیک مانند DHA، IGF-1، اکسیژن، گلوکز و متابولیتهای میکروبیوتا قرار دارد. برای مثال:
-
DHA غشاهای نورونی را بهینه میکند و تراکم گیرندههای NMDA و AMPA را افزایش میدهد، که بهبود انتقال گلوکامات و پلاستیسیتی سیناپسی را به دنبال دارد.
-
متابولیتهای SCFA و سایر ترکیبات میکروبیوتا فعالیت میکروگلیا را تنظیم کرده و تأثیر نروترانسمیترها بر نورونها را تعدیل میکنند.
-
استرس اکسیداتیو و کمبود مواد مغذی میتواند مسیرهای سیگنالینگ را مختل کرده و رشد و عملکرد مغز را کاهش دهد.
تأثیر اختلالات نروترانسمیترها بر سلامت CNS
اختلال در سنتز، ترشح یا عملکرد نروترانسمیترها میتواند منجر به طیف وسیعی از مشکلات شود:
-
اختلالات نورودویلپمنتال: نقص گلوکامات یا GABA در دوران جنینی باعث اختلالات اوتیسم و ADHD میشود.
-
اختلالات روانی و رفتاری: اختلال در مسیرهای دوپامین و سروتونین باعث افسردگی، اضطراب و نقصهای شناختی میشود.
-
بیماریهای نورودژنراتیو: کاهش BDNF و اختلال مسیرهای PI3K/Akt و MAPK در آلزایمر و پارکینسون باعث کاهش پلاستیسیتی و افزایش مرگ نورونها میشود.
جمعبندی نقش مکانیسمهای مولکولی و نروترانسمیترها
به طور کلی، مکانیسمهای مولکولی و نروترانسمیترها ستون فقرات رشد، تکوین و عملکرد CNS هستند. تعامل بین نروترانسمیترها، مسیرهای سیگنالینگ، فاکتورهای رشد و محیط متابولیک، شبکههای عصبی را شکل داده و سلامت مغز را تضمین میکند. اختلال در این مکانیسمها باعث طیف گستردهای از بیماریهای عصبی، اختلالات رفتاری و تأخیرهای شناختی میشود، بنابراین شناخت دقیق آنها برای توسعه درمانهای هدفمند و بهبود سلامت مغز حیاتی است.
تأثیر فناوری و رویکردهای نوین بر درمان بیماریهای CNS
در دهههای اخیر، پیشرفتهای فناوری و توسعه رویکردهای نوین پزشکی، چشمانداز درمان بیماریهای سیستم عصبی مرکزی (CNS) را متحول کرده است. با درک عمیقتر مکانیسمهای مولکولی، مسیرهای سیگنالینگ و نقش سلولهای گلیا، امکان توسعه درمانهای هدفمند، شخصیسازیشده و کمتهاجمی فراهم شده است. این فناوریها شامل نانوپزشکی، هوش مصنوعی، درمانهای مولکولی و سلولی و دارورسانی پیشرفته هستند.
نانوپزشکی و دارورسانی هدفمند به CNS
یکی از چالشهای اصلی درمان بیماریهای CNS، نفوذ محدود داروها از سد خونی-مغزی (BBB) است. نانوذرات و فناوری نانو میتوانند این محدودیتها را برطرف کنند:
-
نانوذرات لیپیدی و پلیمری: این ذرات قادرند داروهای ضد التهابی، نوروپروتکتیو و نروترانسمیترها را به طور هدفمند به مناطق آسیبدیده مغز منتقل کنند.
-
تکنیکهای دارورسانی هوشمند: نانوذرات با پوششهای خاص میتوانند با سلولهای اندوتلیال BBB تعامل کنند و دارو را بدون آسیب رساندن به ساختار مغز آزاد کنند.
-
کاربرد در درمان بیماریهای نورودژنراتیو: مطالعات نشان دادهاند که استفاده از نانوذرات میتواند تجمع پروتئینهای آسیبزا در آلزایمر و پارکینسون را کاهش دهد و عملکرد نورونها را بهبود بخشد.
هوش مصنوعی و یادگیری ماشینی در CNS
هوش مصنوعی (AI) و یادگیری ماشینی امکان تحلیل حجم وسیع دادههای بالینی، مولکولی و ژنتیکی را فراهم کرده و پیشبینی، تشخیص زودهنگام و توسعه داروهای جدید را تسهیل میکنند:
-
تشخیص دقیق بیماریها: الگوریتمهای AI میتوانند تصاویر MRI، CT و PET را با دقت بالا تحلیل کرده و آسیبهای کوچک و اولیه مغز را شناسایی کنند.
-
پیشبینی پاسخ به درمان: با مدلسازی مسیرهای مولکولی و تعاملات نروترانسمیترها، AI میتواند پاسخ بیماران به داروها و درمانهای سلولی را پیشبینی کند.
-
کمک به کشف داروهای نوین: یادگیری ماشینی امکان شناسایی ترکیبات شیمیایی جدید با قابلیت نفوذ BBB و اثرگذاری بر مسیرهای مولکولی مغز را فراهم میکند.
درمانهای مولکولی و سلولی
با پیشرفت در بیوتکنولوژی و علم سلولی، امکان استفاده از سلولهای بنیادی، اولیگودندروسیتها و فاکتورهای رشد برای ترمیم و بازسازی CNS فراهم شده است:
-
سلولهای بنیادی و پیشسازهای عصبی: این سلولها قابلیت تبدیل به نورونها و سلولهای گلیا را دارند و میتوانند مناطق آسیبدیده مغز را بازسازی کنند.
-
استفاده از فاکتورهای رشد: BDNF، IGF-1 و VEGF با تحریک نورونزایی، افزایش پلاستیسیتی سیناپسی و ترمیم شبکههای عصبی، نقش درمانی مهمی دارند.
-
رویکردهای ژندرمانی: با استفاده از وکتورهای ویروسی یا نانوذرات، امکان اصلاح ژنهای آسیبزا یا افزایش بیان ژنهای حفاظتی در مغز فراهم شده است.
تکنیکهای تصویربرداری پیشرفته
تصویربرداری مدرن CNS نه تنها به تشخیص بیماریها کمک میکند، بلکه در ارزیابی تأثیر درمانها و مطالعه مکانیسمهای مولکولی مغز نیز نقش دارد:
-
MRI و fMRI: برای مشاهده ساختار و عملکرد مغز در زمان واقعی و بررسی پلاستیسیتی سیناپسی.
-
PET و SPECT: امکان بررسی مسیرهای متابولیک و فعالیت نروترانسمیترها را فراهم میکنند.
-
تصویربرداری مولکولی: امکان شناسایی تجمع پروتئینهای آسیبزا و فعالیت میکروگلیا را فراهم میکند.
رویکردهای تغذیهای و متابولیک نوین
تحقیقات اخیر نشان دادهاند که تغذیه هدفمند و متابولیتهای میکروبیوتا میتوانند در درمان اختلالات CNS مؤثر باشند:
-
اسیدهای چرب امگا-۳ و DHA: با تقویت غشاهای نورونی، پلاستیسیتی سیناپسی و عملکرد نروترانسمیترها، اثر محافظتی بر مغز دارند.
-
پروبیوتیکها و پیشبیوتیکها: با اصلاح میکروبیوتا و بهبود محور روده-مغز، التهاب CNS کاهش مییابد و رشد شناختی بهبود مییابد.
-
مکملهای متابولیک: مانند لکتات و ترکیبات آنتیاکسیدانی، تعادل انرژی و پاسخ به استرس اکسیداتیو را تنظیم میکنند.
چالشها و افقهای آینده
با وجود پیشرفتهای چشمگیر، چالشهایی همچنان باقی است:
-
نفوذ محدود داروها به CNS و اطمینان از هدفگیری دقیق مناطق آسیبدیده
-
پیچیدگی مسیرهای مولکولی و تنوع ژنتیکی بیماران که نیاز به شخصیسازی درمانها دارد
-
ایمنی و اثرات بلندمدت فناوریهای نوین مانند نانوذرات و ژندرمانی
با این حال، ترکیب فناوریهای نوین، دارورسانی پیشرفته، هوش مصنوعی و درمانهای سلولی و مولکولی، افقهای امیدوارکنندهای برای درمان بیماریهای CNS ایجاد کرده است. این رویکردها میتوانند ترمیم شبکههای عصبی، بهبود حافظه و یادگیری و کاهش پیشرفت اختلالات نورودژنراتیو و روانی را امکانپذیر کنند.
اختلالات و بیماریهای مرتبط با تکوین CNS
تکوین سیستم عصبی مرکزی (CNS) فرآیندی پیچیده و چندمرحلهای است که شامل نورونزایی، تمایز سلولی، مهاجرت نورونها، شکلگیری سیناپسها، میلینهسازی و تعامل با سلولهای گلیا و شبکههای عروقی میشود. هر گونه اختلال در این فرآیندها میتواند منجر به اختلالات عصبی، روانی و شناختی شود. شناخت دقیق این بیماریها و مکانیسمهای مولکولی مرتبط، برای تشخیص زودهنگام و طراحی درمانهای هدفمند حیاتی است.
اختلالات نورودویلپمنتال
اختلالات نورودویلپمنتال ناشی از اختلال در مراحل اولیه رشد CNS هستند و معمولاً در دوران کودکی ظاهر میشوند. برخی از مهمترین این اختلالات عبارتاند از:
-
اوتیسم اسپکتروم دیساوردر (ASD): ناشی از اختلال در مهاجرت نورونها، نوسانات نروترانسمیترها (گلوکامات و GABA) و کاهش پلاستیسیتی سیناپسی است. مطالعات نشان دادهاند که اختلال در محور روده-مغز و میکروبیوتا نیز میتواند شدت علائم ASD را افزایش دهد.
-
ADHD (اختلال کمتوجهی-بیشفعالی): نقص در مسیرهای دوپامین و نوراپینفرین، همراه با تغییرات در تکامل شبکههای پیشپیشانی، منجر به مشکلات توجه و کنترل رفتاری میشود.
-
تاخیرهای رشد شناختی: اختلال در سنتز نروترانسمیترها، کمبود DHA و عوامل رشد مانند BDNF و IGF-1 میتواند باعث کاهش یادگیری، حافظه و مهارتهای اجرایی شود.
اختلالات نورودژنراتیو
اختلالات نورودژنراتیو معمولاً با مرگ نورونها، اختلال در پلاستیسیتی سیناپسی و التهاب مزمن CNS همراه هستند. برخی از شایعترین این بیماریها عبارتاند از:
-
آلزایمر: تجمع پروتئینهای بتا-آمیلوئید و تاو، اختلال در میکروگلیا و آستروسیتها و کاهش BDNF و پلاستیسیتی سیناپسی از عوامل کلیدی این بیماری هستند.
-
پارکینسون: کاهش نورونهای دوپامینرژیک در ساقه مغز و اختلال در مسیرهای متابولیک و اکسیداتیو باعث اختلال در حرکت و رفتار میشود.
-
اسکلروز چندگانه (MS): تخریب میلین و اختلال در فعالیت اولیگودندروسیتها و میکروگلیا، همراه با پاسخ ایمنی ناسازگار، منجر به اختلال عملکرد عصبی گسترده میشود.
اختلالات مادرزادی و ژنتیکی CNS
برخی از اختلالات CNS ناشی از جهشهای ژنتیکی یا آسیبهای محیطی در دوران جنینی هستند که بر مراحل تکوین تاثیر میگذارند:
-
میلومنینگوcele و اسپینابیفیدا: ناشی از نقص در بسته شدن لوله عصبی در اوایل دوران جنینی است که منجر به اختلالات حرکتی و حسی میشود.
-
اختلالات تکاملی کورتیکال: مانند لیسنسفالی و پولیمیکرولنسفالی که به دلیل اختلال در مهاجرت نورونها و شکلگیری لایههای قشر مغز ایجاد میشوند.
-
سندرم داون و سایر اختلالات کروموزومی: تغییرات ژنتیکی میتواند مسیرهای نوروتروفیک و پلاستیسیتی سیناپسی را مختل کرده و باعث کاهش عملکرد شناختی و رفتارهای غیرطبیعی شود.
اختلالات ناشی از التهاب و ایمنی CNS
فعال شدن غیرطبیعی میکروگلیا و آستروسیتها، نفوذپذیری غیرمعمول BBB و التهاب مزمن میتواند باعث آسیب نورونی و اختلالات عصبی شود:
-
انسفالیتهای ویروسی و باکتریایی: مانند انسفالیت ناشی از CMV که میتواند منجر به تاخیر رشد شناختی، مشکلات حرکتی و اختلالات رفتاری شود.
-
اختلالات ناشی از اختلال محور روده-مغز: اختلالات میکروبیوتا میتواند التهاب CNS را افزایش دهد و رشد نورونها و عملکرد شناختی را مختل کند.
-
اختلالات پس از COVID-19: شواهد نشان میدهد که برخی بیماران دچار اختلالات شناختی، اختلال در حافظه و اختلالات رفتاری پس از ابتلا به کرونا میشوند، که با التهاب CNS و اختلال در BBB مرتبط است.
تداخلات محیطی و متابولیک در اختلالات CNS
محیط و تغذیه نقش مهمی در سلامت CNS دارند. کمبود مواد مغذی، استرس اکسیداتیو و اختلالات متابولیک میتوانند رشد نورونها و پلاستیسیتی سیناپسی را مختل کنند:
-
کمبود DHA و اسیدهای چرب ضروری: کاهش تشکیل سیناپسها و اختلال در پلاستیسیتی مغز
-
کمبود ویتامینها و مواد معدنی: ویتامین B12 و فولات نقش حیاتی در سنتز DNA و رشد نورونها دارند
-
افزایش استرس اکسیداتیو و آسیب رادیکالهای آزاد: باعث آسیب به نورونها و گلیا و افزایش خطر بیماریهای نورودژنراتیو میشود
جمعبندی اختلالات مرتبط با تکوین CNS
به طور خلاصه، اختلالات CNS میتوانند در نتیجه ترکیبی از عوامل ژنتیکی، محیطی، ایمنی، متابولیک و نروترانسمیترها ایجاد شوند. این بیماریها طیف گستردهای از مشکلات شناختی، حرکتی و رفتاری را شامل میشوند. شناخت دقیق مسیرهای مولکولی، نقش سلولهای گلیا، تعامل با محور روده-مغز و اثرات تغذیهای، پایه طراحی راهبردهای درمانی نوین و پیشگیری از اختلالات CNS را فراهم میکند.
جمعبندی و چشمانداز آینده
تکوین و رشد سیستم عصبی مرکزی (CNS) فرآیندی پیچیده و چندلایه است که شامل نورونزایی، تمایز سلولی، مهاجرت نورونها، شکلگیری سیناپسها، میلینهسازی، تعامل با سلولهای گلیا، سیستم ایمنی مغز و شبکههای عروقی میشود. هر یک از این مراحل به صورت هماهنگ و دقیق عمل میکنند تا ساختار مغز و عملکرد آن در دوران جنینی، کودکی و بزرگسالی بهینه باقی بماند. اختلال در هر کدام از این فرآیندها میتواند منجر به طیف وسیعی از اختلالات نورودویلپمنتال، نورودژنراتیو، روانی و شناختی شود.
مطالعات اخیر نشان میدهد که سلولهای گلیا و میکروگلیا نه تنها نقش حمایتکننده دارند، بلکه در شکلدهی مدارهای عصبی، پاکسازی مواد زائد، تنظیم پاسخهای التهابی و کنترل پلاستیسیتی سیناپسی نیز مؤثر هستند. این یافتهها افق جدیدی برای توسعه درمانهای هدفمند در اختلالات CNS ایجاد کرده است.
عوامل محیطی، تغذیهای و متابولیک نیز نقش حیاتی در سلامت CNS دارند. DHA، اسیدهای چرب امگا-۳، فاکتورهای رشد مانند BDNF و IGF-1، و متابولیتهای محور روده-مغز میتوانند رشد نورونها، تقویت پلاستیسیتی و بهبود عملکرد شناختی را تسهیل کنند. کمبود این عوامل یا اختلال در متابولیسم آنها میتواند باعث کاهش حافظه، اختلالات رفتاری و افزایش آسیبپذیری نورونی شود.
تکنولوژیهای نوین و رویکردهای درمانی پیشرفته، از جمله نانوپزشکی، هوش مصنوعی، دارورسانی هدفمند، سلولهای بنیادی، ژندرمانی و تصویربرداری پیشرفته، مسیرهای درمانی نوینی برای بیماریهای CNS فراهم کردهاند. این رویکردها نه تنها قابلیت ترمیم شبکههای عصبی، بازسازی سلولهای آسیبدیده و بهبود عملکرد شناختی را دارند، بلکه امکان شخصیسازی درمانها و پیشگیری از پیشرفت اختلالات نورودژنراتیو را نیز فراهم میکنند.
با توجه به پیشرفتهای علمی اخیر، چشمانداز آینده تحقیق و درمان CNS شامل موارد زیر خواهد بود:
-
ادغام فناوریهای نوین با درمانهای مولکولی و سلولی: استفاده همزمان از نانوذرات، وکتورهای ژنی و سلولهای بنیادی برای افزایش اثربخشی درمان و هدفگیری دقیق مناطق آسیبدیده.
-
شخصیسازی درمانها بر اساس ژنتیک و متابولیسم فردی: بهرهگیری از هوش مصنوعی و یادگیری ماشینی برای تحلیل پروفایلهای مولکولی و پیشبینی پاسخ به درمان.
-
توسعه داروهای جدید با قابلیت نفوذ BBB و اثرگذاری بر مسیرهای مولکولی خاص: طراحی ترکیباتی که بتوانند مسیرهای نوروتروفیک، پلاستیسیتی و نروترانسمیترها را بهینه کنند.
-
پیشگیری و درمان اختلالات نورودویلپمنتال و نورودژنراتیو با محوریت تغذیه و متابولیتها: استفاده از مکملها، پروبیوتیکها و اسیدهای چرب برای بهبود سلامت مغز در دوران جنینی و کودکی.
-
درک بهتر تعامل CNS با سیستم ایمنی و میکروبیوتا: تمرکز بر اصلاح پاسخهای ایمنی مغز و تعامل با محور روده-مغز برای کاهش التهاب و ارتقای عملکرد عصبی.
نتیجهگیری نهایی
مطالعه تکوین CNS و عوامل تأثیرگذار بر آن، دیدگاه گستردهای از پیچیدگی، هماهنگی و حساسیت این سیستم فراهم میکند. از نورونزایی تا پلاستیسیتی سیناپسی، از عملکرد میکروگلیا تا نقش نروترانسمیترها و فاکتورهای رشد، همه اجزا به دقت با یکدیگر تعامل دارند تا سلامت و عملکرد بهینه مغز حفظ شود. اختلال در هر یک از این مراحل میتواند باعث طیف وسیعی از بیماریها و اختلالات شود.
ترکیب دانش پایه، فناوریهای نوین، درمانهای مولکولی و سلولی و رویکردهای تغذیهای مسیر روشنی برای توسعه درمانهای جامع و هدفمند فراهم کرده است. آینده تحقیق و درمان CNS نویدبخش بهبود کیفیت زندگی بیماران، کاهش عوارض اختلالات عصبی و ارتقای سلامت شناختی خواهد بود و امکان دسترسی به درمانهای پیشگیرانه و شخصیسازیشده را به شکل بیسابقهای فراهم میکند.
چشمانداز آینده تحقیق در CNS نه تنها شامل درمان بیماریها، بلکه شامل درک بهتر مکانیسمهای رشد و پلاستیسیتی مغز، شناسایی عوامل محیطی و ژنتیکی مؤثر و توسعه استراتژیهای پیشگیری خواهد بود. این رویکرد جامع میتواند به تحقق هدف نهایی علوم اعصاب یعنی ایجاد مغزی سالم، انعطافپذیر و مقاوم در برابر بیماریها کمک کند.