کاربرد سلولهای بنیادی در مطالعه تکوین
مقدمه: اهمیت مطالعه سلولهای بنیادی در تکوین
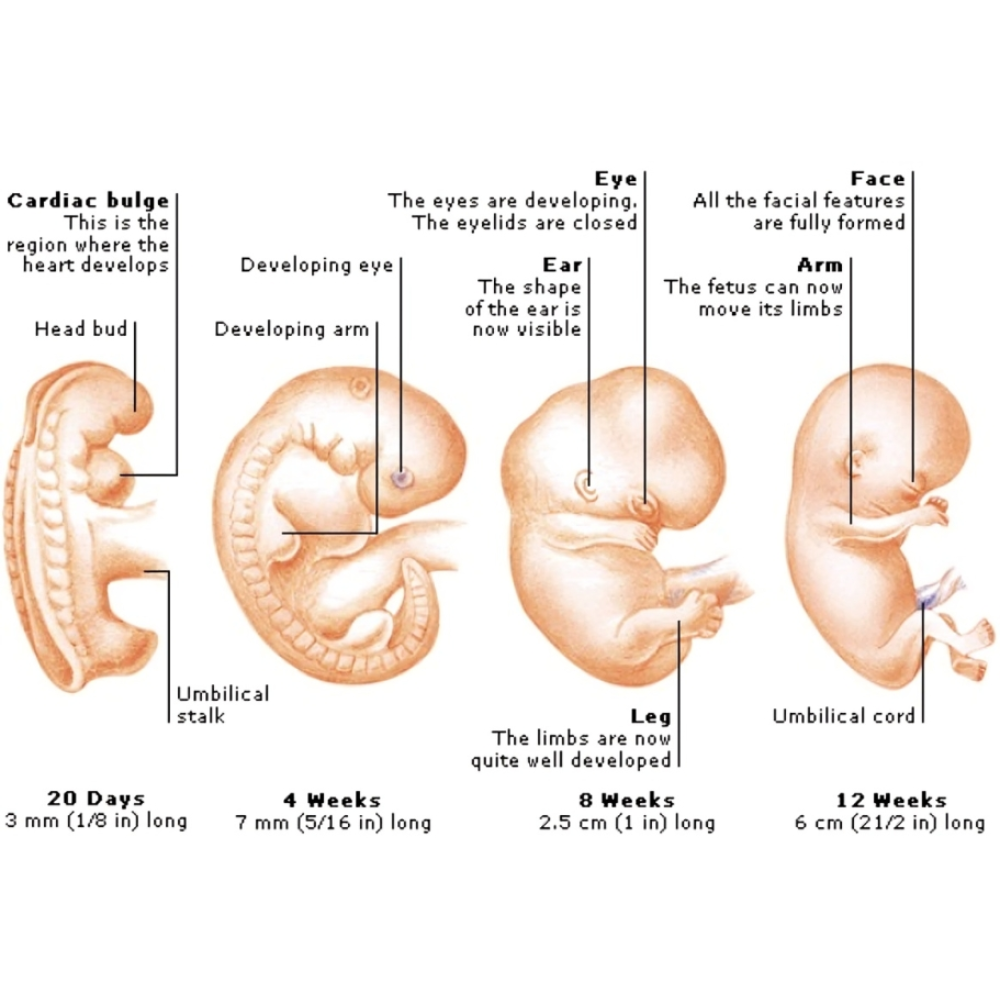
مطالعه تکوین یا توسعه جنینی از مهمترین شاخههای زیستشناسی است که به بررسی فرآیندهای شکلگیری و تمایز سلولها، بافتها و اندامها از لحظه لقاح تا بلوغ میپردازد. درک دقیق این فرآیندها نه تنها به دانش بنیادی زیستشناسی کمک میکند، بلکه مسیرهای پیشرفتهای برای درمان بیماریهای مادرزادی، بازسازی بافتها و توسعه داروهای نوین فراهم میآورد. در این زمینه، سلولهای بنیادی به عنوان یک ابزار کلیدی ظهور کردهاند و توانستهاند نقش محوری در مدلسازی تکوین و شناخت مکانیزمهای سلولی و مولکولی ایفا کنند.
سلولهای بنیادی به دلیل داشتن ویژگیهای منحصر به فرد خودتجدید و چندریختی، توانایی تمایز به انواع سلولهای تخصصی بدن را دارند. این ویژگیها، سلولهای بنیادی را به یک ابزار ایدهآل برای بررسی مراحل اولیه تکوین تبدیل کرده است، چرا که پژوهشگران میتوانند مسیرهای تصمیمگیری سلولی، تعاملات سلولی و پاسخها به سیگنالهای محیطی را به دقت مطالعه کنند. به عبارت دیگر، سلولهای بنیادی امکان بازسازی فرآیندهای تکوینی در شرایط آزمایشگاهی را فراهم میآورند، که در گذشته تنها با مطالعه روی حیوانات یا نمونههای محدود انسانی امکانپذیر بود.
تاریخچه مطالعه سلولهای بنیادی در تکوین نشان میدهد که از زمان کشف سلولهای بنیادی جنینی (ESCs) در دهه ۱۹۸۰، درک ما از مراحل اولیه رشد سلولی و فرآیندهای تمایزی به طور چشمگیری افزایش یافته است. این سلولها به دلیل توانایی تمایز به تمامی خطوط سلولی جنین، به عنوان مدلهای استاندارد برای بررسی تکوین اندامها، سیستم عصبی و سایر بافتها مورد استفاده قرار گرفتهاند. با ظهور تکنولوژی سلولهای بنیادی پرتوان القایی (iPSCs)، امکان تولید سلولهای پرتوان از سلولهای بالغ انسانی بدون نیاز به جنین فراهم شد، که دریچهای جدید برای مطالعات تکوینی و کاربردهای بالینی باز کرد. این پیشرفتها نه تنها محدودیتهای اخلاقی مرتبط با استفاده از ESCها را کاهش داد، بلکه امکان مدلسازی بیماریهای ژنتیکی و نقصهای مادرزادی را با دقت بالا فراهم آورد.
یکی از نکات حیاتی در مطالعه تکوین با سلولهای بنیادی، توانایی کنترل محیط کشت و سیگنالهای تمایزی است. پژوهشگران میتوانند با تغییر فاکتورهای رشد، سیگنالهای شیمیایی و شرایط فیزیکی، مسیرهای مشخصی از تمایز سلولی را شبیهسازی کنند. این قابلیت به درک بهتر فرآیندهای تکوین طبیعی و غیرطبیعی کمک میکند و امکان بررسی مکانیسمهای مولکولی و ژنتیکی در سطح سلولی را فراهم میآورد. به عنوان مثال، با استفاده از iPSCها میتوان بررسی کرد که چگونه تغییرات در ژنهای خاص، مسیرهای تمایزی را مختل کرده و منجر به بیماریهای مادرزادی میشوند.
مزیت دیگر استفاده از سلولهای بنیادی در مطالعه تکوین، امکان ایجاد ارگانوئیدها و مدلهای سهبعدی بافتی است. این مدلها به پژوهشگران اجازه میدهند تا تعاملات پیچیده سلولی، مهاجرت سلولها و شکلگیری ساختارهای بافتی را در شرایط آزمایشگاهی بازسازی کنند. ارگانوئیدها به ویژه در مطالعه مغز، کبد، ریه و اندامهای دیگر، ابزاری قدرتمند برای درک مراحل پیچیده تکوین فراهم کردهاند. علاوه بر این، با ترکیب تکنیکهای تک سلولی مانند scRNA-seq، امکان بررسی تغییرات بیان ژنی در تک سلولها و ردیابی مسیرهای تمایز به شکل بسیار دقیق فراهم شده است، که درک ما از تکوین را به سطحی بیسابقه ارتقا داده است.
با توجه به این پیشرفتها، مطالعه سلولهای بنیادی در تکوین نه تنها اهمیت علمی دارد، بلکه کاربردهای گسترده بالینی نیز دارد. شناخت مکانیزمهای تکوین به توسعه روشهای پیشگیری و درمان بیماریهای مادرزادی کمک میکند و زمینه را برای پزشکی بازساختی و داروسازی شخصیسازیشده فراهم میآورد. به طور کلی، سلولهای بنیادی پلی به سوی درک عمیقتر فرآیندهای زندگی و ایجاد فرصتهای درمانی نوین هستند.
در نهایت، مقدمه این مقاله تأکید دارد که سلولهای بنیادی ابزار محوری در مطالعه تکوین هستند و پیشرفتهای اخیر در زمینه iPSCها، ارگانوئیدها و تکنیکهای تک سلولی، افقهای جدیدی برای مدلسازی تکوین، مطالعه بیماریها و توسعه درمانهای نوین ایجاد کردهاند. اهمیت این مطالعات به حدی است که بدون استفاده از سلولهای بنیادی، بسیاری از رازهای تکوین و توسعه بافتها و اندامها برای بشر غیرقابل دسترسی باقی میماند.
انواع سلولهای بنیادی و ویژگیهای کلیدی آنها
سلولهای بنیادی به عنوان یک ابزار اساسی در بیولوژی تکوین و پزشکی بازساختی شناخته میشوند، زیرا ویژگیهای منحصربهفرد آنها، امکان مطالعه فرآیندهای سلولی و بافتی را فراهم میآورد که در شرایط طبیعی قابل مشاهده نیست. ویژگیهای کلیدی این سلولها شامل توانایی خودتجدید طولانیمدت، ظرفیت تمایز به انواع سلولهای تخصصی و قابلیت پاسخدهی به سیگنالهای محیطی است. این ویژگیها سلولهای بنیادی را به ابزارهای ایدهآل برای مطالعه مراحل اولیه تکوین، مدلسازی بیماریها و توسعه درمانهای نوین تبدیل کردهاند.
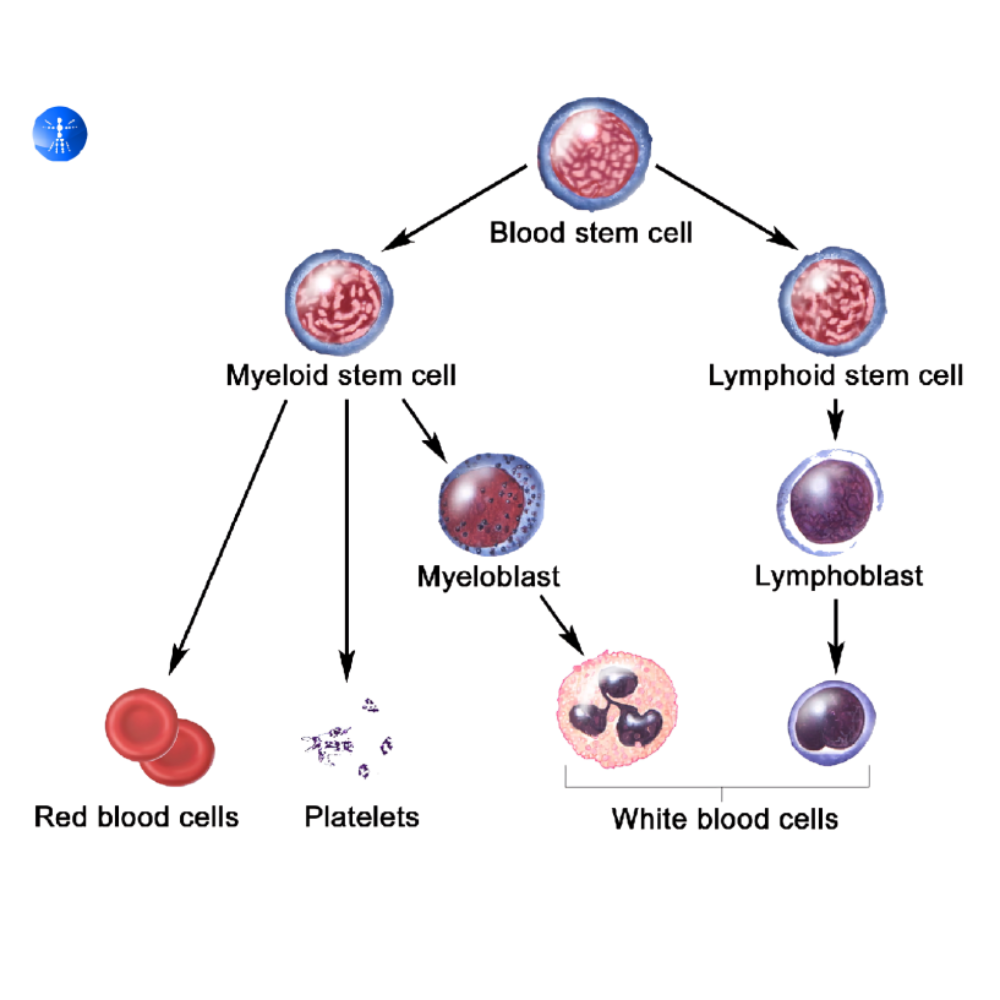
سلولهای بنیادی را میتوان بر اساس منشاء و پتانسیل تمایزی به سه دسته اصلی تقسیم کرد: سلولهای بنیادی جنینی (ESCs)، سلولهای بنیادی پرتوان القایی (iPSCs) و سلولهای بنیادی بالغ یا بافتی. هر یک از این انواع ویژگیها و کاربردهای منحصر به فردی دارند که آنها را برای مطالعه تکوین و کاربردهای بالینی ارزشمند میکند.
سلولهای بنیادی جنینی (ESCs)
سلولهای بنیادی جنینی از جنینهای مرحله بلاستوسیست استخراج میشوند و به دلیل توانایی تمایز به تمامی سلولهای بدن، به عنوان پرتوانترین سلولهای بنیادی شناخته میشوند. این سلولها قابلیت خودتجدید نامحدود دارند و میتوان آنها را در شرایط آزمایشگاهی برای مدت طولانی نگه داشت بدون آنکه از توانایی تمایزی خود کاسته شود. یکی از مهمترین کاربردهای ESCها در مطالعه تکوین، بررسی مسیرهای تصمیمگیری سلولی، سیگنالهای رشدی و تعاملات سلولی در مراحل اولیه رشد اندامها است. با استفاده از ESCها، پژوهشگران میتوانند فرآیندهایی مانند تمایز عصبی، قلبی، کبدی و اندامی را در محیط آزمایشگاهی شبیهسازی کنند و مسیرهای مولکولی دخیل در این فرآیندها را شناسایی نمایند.
سلولهای بنیادی پرتوان القایی (iPSCs)
با ظهور تکنولوژی سلولهای بنیادی پرتوان القایی (iPSCs)، تحول عظیمی در مطالعه تکوین و پزشکی بازساختی ایجاد شد. این سلولها با بازبرنامهریزی سلولهای بالغ مانند فیبروبلاستها به حالت پرتوان تولید میشوند و توانایی مشابه ESCها در تمایز به تمامی خطوط سلولی دارند، اما بدون نیاز به استفاده از جنین انسانی، که محدودیتهای اخلاقی را به میزان قابل توجهی کاهش میدهد. iPSCها امکان مدلسازی بیماریهای ژنتیکی، مطالعه نقصهای مادرزادی و طراحی داروهای شخصیسازیشده را فراهم میآورند. برای مثال، پژوهشگران میتوانند سلولهای پوستی یک بیمار را به iPSC تبدیل کرده و سپس مسیرهای تمایزی را بررسی کنند تا اثر جهشهای ژنتیکی خاص بر توسعه بافتها و اندامها مشخص شود. علاوه بر این، iPSCها قابلیت تولید سلولهای تخصصی مورد نیاز برای تحقیقات بالینی و تولید ارگانوئیدها را دارند، که امکان مطالعه محیط سلولی و مسیرهای تکوینی را در مدلهای سهبعدی فراهم میآورد.
سلولهای بنیادی بالغ و بافتی
سلولهای بنیادی بالغ در بافتهای مختلف بدن یافت میشوند و مسئول بازسازی و ترمیم بافتها در طول عمر فرد هستند. این سلولها معمولاً قابلیت تمایز محدود به نوع بافت خود را دارند و توانایی خودتجدید محدودی نسبت به ESC و iPSC دارند. انواع شناخته شده سلولهای بنیادی بالغ شامل سلولهای مزانشیمی (MSC)، سلولهای بنیادی خونی (HSC) و سلولهای عصبی بالغ است. این سلولها در مطالعه تکوین، به ویژه در درک فرآیندهای بازسازی و تعامل سلول-میکرو محیط بافتها، کاربرد دارند. برای مثال، سلولهای مزانشیمی با ترشح فاکتورهای پاراکرین، تاثیر قابل توجهی بر تکوین استخوان، غضروف و بافت همبند دارند، و سلولهای بنیادی عصبی بالغ در درک نورونزایی و تمایز سلولی در مغز اهمیت ویژهای دارند.
ویژگیهای کلیدی سلولهای بنیادی، از جمله پتانسیل تمایزی، توانایی خودتجدید و پاسخدهی به سیگنالهای محیطی، امکان مطالعه دقیق فرآیندهای تکوینی را فراهم میآورد. برای مثال، با تغییر محیط کشت، افزودن سیگنالهای شیمیایی یا تغییر خواص فیزیکی محیط، میتوان مسیرهای تمایزی مختلف را شبیهسازی کرد و اثرات فاکتورهای محیطی را بر تصمیمگیری سلولی بررسی نمود. این قابلیت به پژوهشگران اجازه میدهد تا چگونگی تعامل ژنها، مسیرهای سیگنالینگ و اپیژنتیک در کنترل تمایز و توسعه بافتها را مطالعه کنند.
مقایسه انواع سلولهای بنیادی و کاربردهای آنها در تکوین
در مطالعه تکوین، ESCها و iPSCها بیشتر برای بررسی مراحل اولیه رشد و شناسایی مسیرهای مولکولی مورد استفاده قرار میگیرند، زیرا توانایی تمایز به تمامی خطوط سلولی را دارند و میتوان آنها را در شرایط کنترل شده آزمایشگاهی پرورش داد. از سوی دیگر، سلولهای بنیادی بالغ برای مطالعه فرآیندهای بازسازی، تعاملات سلول-میکرو محیط و نقش فاکتورهای پاراکرین در تکوین بافتها کاربرد دارند. ترکیب این سلولها با تکنولوژیهای مدرن مانند ارگانوئیدها و تحلیل تک سلولی، امکان مطالعه تکوین در سطح بیسابقهای فراهم میآورد و پژوهشگران میتوانند مسیرهای تمایزی، تغییرات اپیژنتیک و تنوع سلولی را با دقت بالا بررسی کنند.
به طور کلی، شناخت دقیق ویژگیهای سلولهای بنیادی و تفاوتهای آنها برای انتخاب مناسبترین مدل در مطالعات تکوینی حیاتی است. انتخاب نوع سلول بنیادی به هدف پژوهش، بافت مورد مطالعه و مراحل تکوینی مورد نظر بستگی دارد و تعیین استراتژی صحیح، پایهای برای موفقیت در مدلسازی و توسعه درمانهای بالینی به شمار میآید.
مدلسازی تکوین با سلولهای بنیادی
مدلسازی تکوین با استفاده از سلولهای بنیادی به پژوهشگران امکان میدهد تا فرآیندهای پیچیده رشد و تمایز سلولی را به دقت مطالعه کنند و به درک عمیقی از مکانیسمهای مولکولی و ژنتیکی پشت سر آنها برسند. این رویکرد، که به سرعت در دهههای اخیر توسعه یافته است، جایگزینی نوآورانه برای مطالعه مستقیم جنینهای انسانی و حیوانی ارائه میدهد و امکان تحلیل مسیرهای تکوینی در محیط آزمایشگاهی را فراهم میکند. مدلسازی تکوین با سلولهای بنیادی شامل کاربرد سلولهای بنیادی جنینی، پرتوان القایی و بالغ برای بازسازی مراحل مختلف رشد اندامها و بافتها است.
یکی از مهمترین پیشرفتها در مدلسازی تکوین، استفاده از سلولهای بنیادی پرتوان القایی (iPSCs) است. iPSCها با توانایی تبدیل سلولهای بالغ مانند فیبروبلاستها به حالت پرتوان، امکان تولید انواع سلولهای تخصصی و ارگانوئیدها را بدون نیاز به جنین فراهم میآورند. این ویژگی به پژوهشگران اجازه میدهد تا مسیرهای تکوینی اندامهای مختلف را مطالعه کرده و اثر جهشهای ژنتیکی یا تغییرات محیطی را بر فرآیندهای تمایزی بررسی کنند. برای مثال، با تولید iPSC از بیماران دارای نقصهای ژنتیکی، میتوان فرآیندهای تکوینی مغز، قلب و کبد را شبیهسازی کرد و اثرات جهشهای ژنی بر شکلگیری سلولها و بافتها را دقیقاً مشاهده نمود.
سلولهای بنیادی جنینی (ESCs) نیز ابزار مهم دیگری در مدلسازی تکوین هستند. ESCها به دلیل توانایی تمایز به تمامی خطوط سلولی، امکان شبیهسازی مراحل اولیه جنین و مطالعه سیگنالهای رشدی و مسیرهای مولکولی دخیل در تمایز را فراهم میآورند. این سلولها به پژوهشگران اجازه میدهند تا بررسی کنند چگونه سلولها در مراحل مختلف تکوین تصمیم به مسیر خاصی از تمایز میگیرند و چگونه تعاملات بین سلولی، فاکتورهای رشد و سیگنالهای محیطی، این مسیرها را هدایت میکنند.
یکی از کاربردهای کلیدی مدلسازی تکوین، مطالعه تکوین مغز و سیستم عصبی است. با استفاده از iPSCها و ESCها، پژوهشگران توانستهاند مدلهای مغزی سهبعدی یا ارگانوئیدهای مغزی ایجاد کنند که ساختار و عملکرد مغز در مراحل اولیه رشد را تقلید میکند. این ارگانوئیدها امکان بررسی مهاجرت نورونها، تشکیل شبکههای عصبی، و پاسخ به سیگنالهای رشدی را فراهم میآورند و ابزار قدرتمندی برای درک بیماریهای عصبی و اختلالات ژنتیکی مغزی ایجاد کردهاند. علاوه بر مغز، مدلسازی تکوین با سلولهای بنیادی در اندامهای دیگر نیز کاربرد دارد؛ به عنوان مثال، ارگانوئیدهای قلبی، کبدی و ریه به پژوهشگران امکان میدهند تا تعاملات سلولی، شکلگیری ساختار بافتی و پاسخ به فاکتورهای محیطی را در شرایط کنترل شده مطالعه کنند.
در مدلسازی تکوین، بررسی مسیرهای سیگنالینگ و ژنتیکی نقش کلیدی دارد. سلولهای بنیادی، به ویژه در مراحل اولیه تمایز، تحت تاثیر مسیرهای سیگنالینگ مانند Wnt، Notch، BMP و FGF قرار میگیرند که تصمیمگیریهای سلولی و تمایز به خطوط خاص را هدایت میکنند. با استفاده از سلولهای بنیادی در محیط آزمایشگاهی، پژوهشگران میتوانند اثر اختلال در این مسیرها را بر تمایز سلولی و شکلگیری بافتها بررسی کنند و مکانیزمهای مولکولی بیماریهای مادرزادی را شناسایی نمایند.
کاربرد مدلهای سهبعدی و ارگانوئیدها در مطالعه تکوین نیز اهمیت ویژهای دارد. ارگانوئیدها با شبیهسازی محیط میکرو محیط طبیعی بافتها، امکان مطالعه تعاملات سلولی، مهاجرت سلولها و شکلگیری ساختارهای پیچیده را فراهم میکنند. برای مثال، ارگانوئیدهای مغزی میتوانند ساختارهای لایهای و شبکههای عصبی اولیه مغز را تقلید کنند و به بررسی اثرات ژنتیکی و محیطی بر رشد نورونها و تمایز سلولی کمک کنند. همچنین، ارگانوئیدهای کبد و ریه میتوانند برای مطالعه بازسازی بافت، پاسخ به داروها و مدلسازی بیماریهای مادرزادی به کار روند.
یکی از ویژگیهای منحصر به فرد مدلسازی تکوین با سلولهای بنیادی، امکان ادغام فناوریهای تک سلولی مانند scRNA-seq و lineage tracing است. این تکنولوژیها امکان بررسی تغییرات بیان ژنی در تک سلولها، ردیابی مسیرهای تمایز و شناسایی سلولهای بنیادی اولیه و نواحی تمایزی را فراهم میآورند. با استفاده از این روشها، پژوهشگران میتوانند تنوع سلولی، مسیرهای تصمیمگیری سلولی و اثرات محیطی را با دقت بیسابقهای بررسی کنند و درک بهتری از تکوین انسان و حیوانات به دست آورند.
مزیت دیگر مدلسازی تکوین با سلولهای بنیادی، امکان بررسی تأثیر جهشهای ژنتیکی و شرایط محیطی بر مراحل رشد است. برای مثال، با القای جهشهای خاص یا تغییر شرایط محیطی مانند اکسیژن و ترکیبات شیمیایی، میتوان اثرات این تغییرات بر مسیرهای تمایزی و رشد اندامها را مطالعه کرد. این رویکرد نه تنها درک فرآیندهای طبیعی تکوین را افزایش میدهد، بلکه ابزاری حیاتی برای مطالعه بیماریها و توسعه درمانهای هدفمند فراهم میآورد.
به طور خلاصه، مدلسازی تکوین با سلولهای بنیادی، شامل استفاده از ESCها، iPSCها و سلولهای بنیادی بالغ، امکان بازسازی فرآیندهای پیچیده رشد و تمایز سلولی را در محیط آزمایشگاهی فراهم میکند. این رویکرد به پژوهشگران اجازه میدهد تا مسیرهای ژنتیکی، مولکولی و محیطی دخیل در تکوین را بررسی کنند، بیماریهای مادرزادی و نقصهای ژنتیکی را مدلسازی کنند و ابزارهایی برای توسعه درمانهای بالینی نوین ایجاد نمایند. با پیشرفت تکنولوژی ارگانوئیدها و تحلیل تک سلولی، مدلسازی تکوین به سطحی بیسابقه از دقت و کارایی دست یافته و افقهای جدیدی در درک فرآیندهای زندگی و طراحی درمانهای بازساختی باز کرده است.
استفاده از ارگانوئیدها و سیستمهای سهبعدی
در سالهای اخیر، استفاده از ارگانوئیدها و سیستمهای سهبعدی (3D) سلولی به یک تحول اساسی در مطالعه تکوین و مدلسازی بافتها و اندامها تبدیل شده است. ارگانوئیدها، ساختارهای سهبعدی خودسازماندهنده هستند که از سلولهای بنیادی مشتق میشوند و قادرند بسیاری از ویژگیهای بافت طبیعی را تقلید کنند. این سیستمها به پژوهشگران امکان میدهند تا فرآیندهای پیچیده تکوینی، مهاجرت سلولی، تعاملات سلول-سلول و سلول-میکرو محیط را در شرایط کنترل شده آزمایشگاهی مطالعه کنند، که پیش از این تنها با مدلهای حیوانی محدود امکانپذیر بود.
تاریخچه و تعریف ارگانوئیدها
ارگانوئیدها برای اولین بار در اوایل دهه ۲۰۰۰ به عنوان مدلهای سهبعدی با قابلیت تمایز خودسازماندهنده سلولهای بنیادی معرفی شدند. این ساختارها از ESCها، iPSCها یا سلولهای بنیادی بالغ مشتق میشوند و توانایی بازسازی ساختار و عملکرد اندام مورد نظر را در مقیاس کوچک دارند. برخلاف سیستمهای دوبعدی سنتی، ارگانوئیدها تعاملات فضایی سلولها و تشکیل ساختارهای پیچیده بافتی را تقلید میکنند، که برای مطالعه مراحل تکوین بسیار حیاتی است.
مزایای ارگانوئیدها در مطالعه تکوین
یکی از بزرگترین مزایای استفاده از ارگانوئیدها، امکان بازسازی محیط طبیعی سلولی (niche) و تعاملات سلول با میکرو محیط است. پژوهشگران میتوانند شرایط محیطی مانند فاکتورهای رشد، اکسیژن و فشار مکانیکی را کنترل کرده و اثر آنها بر تمایز و مهاجرت سلولی را بررسی کنند. این ویژگی به ویژه در مطالعه تکوین مغز، ریه، کبد، روده و اندامهای دیگر اهمیت دارد، زیرا بسیاری از فرآیندهای تکوینی وابسته به ارتباطات سلولی و سیگنالهای محیطی هستند. ارگانوئیدها همچنین امکان بررسی مسیرهای ژنتیکی و مولکولی دخیل در توسعه بافتها را فراهم میکنند و به پژوهشگران اجازه میدهند اثر جهشهای ژنتیکی یا تغییرات محیطی را به شکل دقیق مطالعه کنند.
کاربرد ارگانوئیدهای مغزی و عصبی
یکی از حوزههای پیشرفته در استفاده از ارگانوئیدها، مدلسازی تکوین مغز و سیستم عصبی است. ارگانوئیدهای مغزی قادرند ساختار لایهای قشر مغز، مهاجرت نورونها، تشکیل شبکههای عصبی و تعاملات سلولی را تقلید کنند. با ترکیب این مدلها با تکنیکهای تحلیل تک سلولی و توالییابی RNA، پژوهشگران میتوانند مسیرهای تمایزی نورونها، تنوع سلولی و تغییرات اپیژنتیک را با دقت بالا بررسی کنند. این رویکرد نه تنها به درک بهتر فرآیندهای طبیعی تکوین مغز کمک میکند، بلکه ابزاری قدرتمند برای مطالعه اختلالات عصبی، بیماریهای ژنتیکی و اثر داروهای نوین فراهم میآورد.
ارگانوئیدهای اندامی و بازسازی بافتها
علاوه بر مغز، ارگانوئیدهای قلبی، کبدی، رودهای و ریوی نیز برای مطالعه تکوین کاربرد دارند. این مدلها امکان بررسی تشکیل ساختارهای سهبعدی، تعامل سلولهای تخصصی و پاسخ به فاکتورهای رشدی و محیطی را فراهم میکنند. به عنوان مثال، ارگانوئیدهای ریه میتوانند مراحل اولیه توسعه مجاری هوایی و بازسازی بافتی پس از آسیب را مدلسازی کنند، در حالی که ارگانوئیدهای کبدی امکان مطالعه متابولیسم سلولی، تمایز هپاتوسیتها و اثر داروهای مختلف را فراهم میآورند. این مدلها نه تنها برای تحقیقات بنیادی مفید هستند، بلکه در مهندسی بافت، داروسازی و توسعه درمانهای شخصیسازیشده کاربرد دارند.
مدلسازی تعاملات میکرو محیطی و سیگنالینگ
یکی از قابلیتهای کلیدی ارگانوئیدها، شبیهسازی تعاملات سلولی و میکرو محیط بافتی است. این مدلها امکان مطالعه اثر سیگنالهای پاراکرین، تماس سلول-سلول و فاکتورهای مکانیکی بر تمایز و توسعه سلولها را فراهم میکنند. برای مثال، پژوهشها نشان دادهاند که تغییر در میزان نیروی مکانیکی یا سختی ماتریکس سلولی میتواند مسیر تمایز سلولهای بنیادی را هدایت کند و شکلگیری ساختارهای بافتی را تغییر دهد. این ویژگی به ویژه در مطالعه تکوین اندامهای پیچیده و بازسازی بافتها اهمیت دارد.
محدودیتها و چالشهای ارگانوئیدها
با وجود مزایای متعدد، ارگانوئیدها با چالشهایی نیز مواجه هستند. یکی از مهمترین محدودیتها، نبود جریان خون واقعی و سیستم ایمنی در مدلهای ارگانوئیدی است که میتواند بر رشد و عملکرد بافتها تأثیر بگذارد. همچنین، ایجاد ساختارهای با اندازه و پیچیدگی مشابه اندامهای واقعی هنوز با محدودیت مواجه است. از سوی دیگر، همگنی سلولی و کنترل دقیق شرایط کشت چالشی است که پژوهشگران برای تکرارپذیری نتایج باید به آن توجه کنند. با این حال، ترکیب ارگانوئیدها با فناوریهای مهندسی بافت، چاپ سهبعدی سلولی و میکروفلوئیدیک، امکان غلبه بر بسیاری از این محدودیتها را فراهم کرده است.
چشمانداز آینده در استفاده از ارگانوئیدها
ارگانوئیدها به عنوان ابزاری پیشرفته برای مطالعه تکوین و مدلسازی بیماریها به سرعت در حال تکامل هستند. پژوهشگران در حال توسعه مدلهایی هستند که قادر به شبیهسازی تعامل بین چند بافت، سیستم گردش خون و شبکه عصبی پیچیده باشند. علاوه بر این، ترکیب ارگانوئیدها با تحلیل تک سلولی، CRISPR و مدلهای کامپیوتری میتواند مسیرهای تکوینی، تاثیرات محیطی و بیماریهای ژنتیکی را با دقت بیسابقهای بررسی کند. این رویکردها نه تنها به درک بهتر فرآیندهای بنیادی تکوین کمک میکنند، بلکه ابزارهایی قدرتمند برای پزشکی بازساختی، توسعه دارو و درمانهای شخصیسازیشده فراهم میآورند.
به طور خلاصه، ارگانوئیدها و سیستمهای سهبعدی سلولی انقلاب بزرگی در مطالعه تکوین ایجاد کردهاند. این مدلها امکان شبیهسازی محیط طبیعی سلولها، تعاملات میکرو محیطی، تمایز سلولی و تشکیل ساختارهای بافتی پیچیده را فراهم میکنند و ابزارهایی قدرتمند برای تحقیق، توسعه درمانهای بالینی و مهندسی بافت محسوب میشوند. ترکیب این فناوریها با سلولهای بنیادی و تکنولوژیهای نوین تحلیل سلولی، آیندهای روشن برای مطالعه تکوین و توسعه درمانهای نوین بازساختی نوید میدهد.
میکرو محیط و نقش عوامل مکانیکی و شیمیایی در تکوین سلولی
در مطالعه تکوین، یکی از عوامل حیاتی که تعیینکننده سرنوشت سلولهای بنیادی و مسیرهای تمایزی آنها است، میکرو محیط سلولی است. میکرو محیط یا stem cell niche، مجموعهای پیچیده از سلولها، ماتریکس خارج سلولی، فاکتورهای شیمیایی و نیروهای مکانیکی است که به صورت هماهنگ بر تصمیمات تمایزی، خودتجدید و مهاجرت سلولی تأثیر میگذارد. درک نقش میکرو محیط برای مدلسازی دقیق تکوین و طراحی درمانهای بازساختی اهمیت اساسی دارد، زیرا بدون این اطلاعات، مطالعه مسیرهای سلولی در شرایط آزمایشگاهی ناقص خواهد بود.
عوامل شیمیایی در میکرو محیط
یکی از مهمترین اجزای میکرو محیط، سیگنالهای شیمیایی هستند که شامل فاکتورهای رشد، سیتوکینها و مولکولهای سیگنالینگ بین سلولی میشوند. این عوامل نقش حیاتی در تعیین مسیرهای تمایزی و زمانبندی تمایز سلولها دارند. برای مثال، مسیرهای سیگنالینگ Wnt، Notch، BMP و FGF به طور گسترده در تنظیم تصمیمات سلولی، شکلگیری بافتها و توسعه اندامها نقش دارند. تغییر در سطح این سیگنالها یا وجود جهش در مولکولهای مربوطه میتواند منجر به اختلالات تکوینی، نقصهای مادرزادی و بیماریهای ژنتیکی شود.
علاوه بر مسیرهای سیگنالینگ کلاسیک، مولکولهای متابولیک و فاکتورهای محیطی مانند اکسیژن و pH نیز اثرات مهمی بر میکرو محیط دارند. پژوهشها نشان دادهاند که شرایط هایپوکسی یا کمبود اکسیژن میتواند مسیرهای تمایزی سلولهای بنیادی را به سمت خطوط سلولی خاص هدایت کند و در برخی موارد، باعث فعال شدن سلولهای بنیادی سرطانی یا تغییرات اپیژنتیک میشود. این یافتهها اهمیت ایجاد شرایط کنترلشده محیطی در مدلهای آزمایشگاهی را برجسته میکند.
نقش عوامل مکانیکی در میکرو محیط
عوامل مکانیکی، از جمله سفتی ماتریکس، نیروهای کششی و فشار مکانیکی، نقش تعیینکنندهای در رفتار سلولهای بنیادی و تکوین دارند. سلولها قادرند نیروهای مکانیکی محیط خود را حس کرده و پاسخهای بیوشیمیایی متناسب با آن ارائه دهند، فرآیندی که به عنوان mechanotransduction شناخته میشود. به عنوان مثال، سلولهای بنیادی مزانشیمی (MSC) در محیطهای با ماتریکس سفت، تمایل بیشتری به تمایز به سلولهای استخوانی دارند، در حالی که در ماتریکس نرم، مسیر تمایز به سلولهای چربی یا غضروفی غالب میشود. این پدیده نشان میدهد که خواص فیزیکی محیط میتواند مسیرهای ژنتیکی و تمایزی را هدایت کند و بدون درک آن، مدلسازی دقیق تکوین امکانپذیر نخواهد بود.
تعامل بین عوامل شیمیایی و مکانیکی
میکرو محیط یک شبکه پیچیده است که در آن عوامل شیمیایی و مکانیکی به طور همزمان عمل میکنند و تصمیمات سلولی را شکل میدهند. برای مثال، فشار مکانیکی میتواند حساسیت سلولها به فاکتورهای رشد را تغییر دهد و بالعکس، وجود فاکتورهای رشد میتواند پاسخ سلولها به نیروهای مکانیکی را تعدیل کند. این تعاملات پیچیده نقش اساسی در تشکیل ساختارهای سهبعدی بافتی، مهاجرت سلولی و ایجاد توازن بین خودتجدید و تمایز دارد. درک این تعاملات برای طراحی مدلهای آزمایشگاهی ارگانوئیدی و مطالعه بیماریها ضروری است.
میکرو محیط و اپیژنتیک
تکوین سلولی تنها به ژنها و سیگنالهای خارجی محدود نمیشود، بلکه اپیژنتیک نقش حیاتی در تعیین مسیرهای تمایزی دارد. میکرو محیط با تغییر شرایط شیمیایی و مکانیکی میتواند نشانههای اپیژنتیک مانند متیلاسیون DNA، تغییرات هیستونی و بازآرایی کروماتین را تحت تأثیر قرار دهد. این تغییرات میتوانند رفتار سلولهای بنیادی را برای نسلهای بعدی تثبیت کرده و مسیرهای تمایزی خاصی را تثبیت کنند. بنابراین، مطالعه اپیژنتیک در تعامل با میکرو محیط، به درک عمیقتر فرآیندهای تکوین و مدلسازی دقیق آن کمک میکند.
کاربرد در مدلسازی تکوین و بیماریها
در مدلسازی تکوین با سلولهای بنیادی و ارگانوئیدها، کنترل میکرو محیط امکان شبیهسازی مراحل مختلف رشد و بررسی اثرات جهشهای ژنتیکی و شرایط محیطی را فراهم میکند. برای مثال، در مدلسازی مغز با ارگانوئیدها، تغییر شرایط اکسیژن، سفتی ماتریکس و فاکتورهای رشد میتواند مسیرهای تمایزی نورونها و شکلگیری لایههای قشر مغز را به دقت بازسازی کند. مشابه آن، در مطالعه بازسازی بافتهای قلب و ریه، کنترل میکرو محیط به پژوهشگران امکان میدهد تا تعاملات سلولی، بازسازی بافتی و پاسخ به آسیبهای محیطی را مدلسازی کنند.
چالشها و چشمانداز آینده
با وجود اهمیت میکرو محیط در تکوین، هنوز چالشهای بسیاری در مطالعه دقیق آن وجود دارد. یکی از مهمترین محدودیتها، پیچیدگی تعاملات بین عوامل شیمیایی، مکانیکی و اپیژنتیک است که نیازمند ابزارهای پیشرفته برای اندازهگیری و کنترل است. فناوریهای نوین مانند بیوفیزیک سلولی، میکروفلوئیدیک و چاپ سهبعدی سلولی فرصتهای جدیدی برای مهندسی میکرو محیط فراهم کردهاند و امکان بررسی اثرات دقیق هر عامل را فراهم میآورند. پیشرفت در این حوزه، نه تنها درک فرآیندهای طبیعی تکوین را افزایش میدهد، بلکه زمینهای برای طراحی درمانهای بازساختی و مدلسازی بیماریهای پیچیده فراهم میکند.
به طور خلاصه، میکرو محیط سلولی و تعامل عوامل مکانیکی و شیمیایی نقش مرکزی در تعیین سرنوشت سلولهای بنیادی و مسیرهای تمایزی آنها دارد. درک این محیط پیچیده برای مدلسازی دقیق تکوین، طراحی ارگانوئیدها و توسعه درمانهای بازساختی ضروری است. ترکیب این دانش با فناوریهای پیشرفته، چشمانداز روشنی برای آینده تحقیقات تکوینی و پزشکی بازساختی ایجاد میکند.
تحلیل تک سلولی و تکنولوژیهای مدرن در مطالعه تکوین
یکی از پیشرفتهای انقلابی در زمینه مطالعه تکوین، استفاده از تکنولوژیهای تک سلولی برای بررسی رفتار و مسیرهای تمایزی سلولهاست. این رویکردها امکان مشاهده تغییرات بیان ژنی، پروتئینی و اپیژنتیک در سطح هر سلول به صورت مستقل را فراهم میکنند و به پژوهشگران اجازه میدهند تا تنوع سلولی، مسیرهای تصمیمگیری و مکانیسمهای مولکولی را با دقت بیسابقهای مطالعه کنند. قبل از ظهور تکنولوژیهای تک سلولی، تحلیل سلولی اغلب به سطح جمعیتهای سلولی محدود میشد و اطلاعات جزئی درباره سلولهای نادر یا مراحل انتقالی در تکوین از دست میرفت.
تکنولوژیهای تک سلولی و RNA-seq تک سلولی
یکی از پرکاربردترین روشها، توالییابی RNA تک سلولی (scRNA-seq) است که امکان بررسی پروفایل بیان ژنی هر سلول را فراهم میآورد. با استفاده از scRNA-seq، پژوهشگران میتوانند مسیرهای تمایزی سلولهای بنیادی، تغییرات بیان ژنی در مراحل مختلف تکوین و ظهور زیرگروههای سلولی خاص را شناسایی کنند. این تکنولوژی به ویژه در مطالعه مغز، سیستم ایمنی، قلب و اندامهای پیچیده اهمیت دارد، زیرا امکان ردیابی مسیرهای تمایزی سلولهای نادر و بررسی اثرات تغییرات محیطی یا ژنتیکی بر توسعه سلولها را فراهم میکند.
تکنولوژیهای تک سلولی همچنین با ترکیب تحلیل اپیژنتیک، پروتئومیک و متابولومیک، دید جامعی از وضعیت هر سلول ارائه میدهند. این ترکیب چندلایهای امکان شناسایی مکانیزمهای تنظیمی، نقش فاکتورهای رونویسی و اثرات محیطی را در فرآیندهای تکوین فراهم میکند. به عنوان مثال، در مطالعه تکوین مغز، scRNA-seq به پژوهشگران اجازه داده تا ظهور انواع نورونها، تمایز گلیالها و مسیرهای مهاجرت سلولی را با دقت بالا نقشهبرداری کنند.
تکنیکهای lineage tracing و ردیابی مسیر سلولی
تکنولوژیهای مدرن دیگری که در تحلیل تک سلولی اهمیت دارند، روشهای lineage tracing هستند. این روشها امکان ردیابی مسیرهای تمایزی سلولهای بنیادی در طول تکوین را فراهم میکنند و نشان میدهند که هر سلول چگونه تصمیم به مسیر تمایزی خاص میگیرد. با ترکیب lineage tracing با scRNA-seq، پژوهشگران میتوانند ارتباط بین بیان ژنی، سیگنالینگ سلولی و سرنوشت نهایی سلول را بررسی کنند. این رویکرد به ویژه در مدلسازی تکوین مغز، روده، قلب و دیگر اندامها مفید است، زیرا مسیرهای پیچیده تمایز و تصمیمگیری سلولی را به شکل واقعی بازسازی میکند.
تحلیل دادههای تک سلولی و الگوریتمهای پیشرفته
با پیشرفت تکنولوژیهای تک سلولی، حجم دادههای تولید شده بسیار بزرگ شده و نیازمند ابزارهای محاسباتی پیشرفته و الگوریتمهای بیوانفورماتیکی برای تحلیل دقیق است. الگوریتمهایی مانند pseudotime analysis امکان مدلسازی مسیرهای تمایزی و تعیین توالی رخدادهای ژنتیکی در تکوین را فراهم میکنند. این تحلیلها به پژوهشگران اجازه میدهند تا توالی زمانی و مکانی تمایز سلولها، ظهور سلولهای نادر و نقاط بحرانی در مسیرهای تکوینی را شناسایی کنند.
ترکیب تکنولوژیهای تک سلولی با ارگانوئیدها
یکی از پیشرفتهترین کاربردهای تکنولوژیهای تک سلولی، ترکیب آنها با ارگانوئیدها و سیستمهای سهبعدی سلولی است. این ترکیب امکان بررسی تکوین سلولها در محیطی شبیه به بافت طبیعی و تحلیل مسیرهای تمایزی در سطح تک سلولی را فراهم میکند. به عنوان مثال، در ارگانوئیدهای مغزی، ترکیب scRNA-seq با lineage tracing به پژوهشگران اجازه داده تا تنوع نورونی، مسیرهای مهاجرت و تعاملات سلولهای بنیادی با میکرو محیط را به دقت بازسازی کنند. این روشها همچنین برای مطالعه اختلالات ژنتیکی، بیماریهای عصبی و اثر داروها کاربرد دارند و امکان پیشبینی نتایج بالینی را فراهم میکنند.
تکنولوژیهای نوین دیگر
علاوه بر scRNA-seq و lineage tracing، تکنولوژیهای دیگری نیز در تحلیل تک سلولی مورد استفاده قرار میگیرند، از جمله:
-
Single-cell ATAC-seq برای بررسی وضعیت کروماتین و نقاط دسترسی ژنومی هر سلول
-
CITE-seq برای ترکیب پروفایل بیان ژنی با پروتئوم سطح سلول
-
Spatial transcriptomics برای تعیین موقعیت مکانی سلولها در بافت و ارتباط آنها با میکرو محیط
-
Live-cell imaging برای مشاهده رفتار سلولها در طول زمان و تکوین
این تکنولوژیها امکان درک جامع و چندلایه از فرآیندهای تکوینی و مسیرهای تصمیمگیری سلولی را فراهم میکنند و نقش حیاتی در طراحی درمانهای بازساختی و داروهای هدفمند دارند.
چالشها و چشمانداز آینده
با وجود پیشرفتهای چشمگیر، تکنولوژیهای تک سلولی با چالشهایی نیز مواجه هستند. یکی از مهمترین محدودیتها، حجم بالای دادهها و نیاز به تحلیل دقیق بیوانفورماتیکی است. همچنین، حفظ شرایط طبیعی سلولها در طول جمعآوری دادهها و جلوگیری از تغییرات ناشی از دستکاریهای آزمایشگاهی، اهمیت ویژهای دارد. با این حال، پیشرفتهای مداوم در الگوریتمهای محاسباتی، هوش مصنوعی و ترکیب با سیستمهای سهبعدی و ارگانوئیدها، امکان مدلسازی دقیقتر تکوین، شناسایی مسیرهای بیماری و توسعه درمانهای نوین بازساختی را فراهم میآورد.
به طور خلاصه، تحلیل تک سلولی و تکنولوژیهای مدرن، چشماندازی نوین برای مطالعه تکوین ارائه کردهاند. این رویکردها امکان بررسی مسیرهای تمایزی سلولهای بنیادی، تعاملات با میکرو محیط، تغییرات اپیژنتیک و پاسخ به شرایط محیطی را با دقت بیسابقه فراهم میکنند. ترکیب این تکنولوژیها با ارگانوئیدها و سیستمهای سهبعدی، درک ما از فرآیندهای پیچیده رشد و توسعه اندامها را به سطحی بیسابقه ارتقا داده و مسیرهای جدیدی برای تحقیقات بنیادی و کاربردهای بالینی ایجاد کرده است.
سلولهای بنیادی و مطالعه بیماریها در مراحل تکوینی
یکی از مهمترین کاربردهای سلولهای بنیادی، امکان مدلسازی بیماریها در مراحل مختلف تکوین است. سلولهای بنیادی، به ویژه سلولهای بنیادی پرتوان القایی (iPSCها) و سلولهای بنیادی جنینی (ESCها)، توانایی ایجاد هر نوع سلولی در بدن را دارند و میتوانند شرایط بیماریهای ژنتیکی، محیطی یا ترکیبی را در سطح سلولی بازسازی کنند. این قابلیت باعث شده تا پژوهشگران بتوانند ریشههای بیماریها را در مراحل اولیه تکوین شناسایی کرده و مکانیسمهای مولکولی آنها را بررسی کنند.
مدلسازی بیماریهای ژنتیکی با سلولهای بنیادی
با استفاده از سلولهای بنیادی مشتق از بیماران، پژوهشگران میتوانند اختلالات ژنتیکی مادرزادی و بیماریهای متابولیک را به صورت درونسلولی و در محیط آزمایشگاهی بررسی کنند. به عنوان مثال، در بیماریهای عصبی مانند بیماری هانتینگتون، اسکیزوفرنی و اختلالات طیف اوتیسم، iPSCها قادرند مسیرهای تمایزی نورونها، مهاجرت سلولی و تشکیل شبکههای عصبی را شبیهسازی کنند و اثر جهشهای ژنتیکی را در مراحل اولیه تکوین بررسی کنند. این مدلها نه تنها درک ما از بیماریهای ژنتیکی را افزایش میدهند، بلکه امکان تست داروها و روشهای درمانی جدید را فراهم میکنند.
مطالعه بیماریهای قلبی و عروقی در تکوین
سلولهای بنیادی مزانشیمی و iPSCهای مشتق از بیماران قلبی، امکان مدلسازی تکوین قلب و اختلالات مادرزادی قلبی را فراهم میکنند. پژوهشها نشان دادهاند که اختلال در مسیرهای سیگنالینگ مانند Notch و Wnt میتواند باعث ناهنجاریهای ساختاری قلب شود. با استفاده از مدلهای ارگانوئیدی قلبی و سیستمهای سهبعدی، میتوان اثر جهشهای ژنتیکی، شرایط محیطی و داروهای مختلف بر تمایز سلولهای قلبی و تشکیل بافتهای قلبی را بررسی کرد. این مدلها به ویژه برای پیشبینی اثرات داروها و توسعه درمانهای بازساختی اهمیت دارند.
مدلسازی بیماریهای عصبی و مغزی با ارگانوئیدها
یکی از پیشرفتهترین حوزههای مطالعه بیماریها با سلولهای بنیادی، استفاده از ارگانوئیدهای مغزی است. این ارگانوئیدها قادرند ساختارهای لایهای قشر مغز، تنوع سلولی نورونها و گلیالها و مسیرهای مهاجرت سلولی را بازسازی کنند. با ترکیب ارگانوئیدها با تکنولوژیهای تک سلولی و lineage tracing، پژوهشگران میتوانند اختلالات ژنتیکی، اثر داروها و مسیرهای سیگنالینگ مختل شده را به دقت بررسی کنند. این رویکرد امکان شناسایی مکانهای بحرانی در تکوین مغز و نقاط حساس به آسیب محیطی را فراهم میآورد.
مطالعه سرطانها و سلولهای بنیادی سرطانی در تکوین
علاوه بر بیماریهای ژنتیکی و متابولیک، سلولهای بنیادی در مدلسازی سرطان و سلولهای بنیادی سرطانی (CSCها) نیز کاربرد دارند. پژوهشها نشان دادهاند که بسیاری از سرطانها ریشه در اختلالات سلولهای بنیادی تکوینی دارند و مسیرهای سیگنالینگ مشابه مسیرهای طبیعی تمایز سلولهای بنیادی را فعال یا سرکوب میکنند. با استفاده از CSCها و مدلهای ارگانوئیدی، میتوان مسیرهای تکوینی مختل شده، مقاومت دارویی و اثر فاکتورهای محیطی مانند هایپوکسی را بررسی کرد. این اطلاعات برای طراحی درمانهای هدفمند و شخصیسازیشده سرطانها بسیار حیاتی هستند.
بازسازی بیماریهای بافتی و اندامی
سلولهای بنیادی همچنین امکان مطالعه بیماریهای بافتی مانند بیماریهای ریوی، کبدی و رودهای را فراهم میکنند. با استفاده از ارگانوئیدهای سهبعدی و سیستمهای مهندسی بافت، پژوهشگران میتوانند بازسازی مراحل تکوینی اندامها، اثر جهشهای ژنتیکی و پاسخ به آسیبهای محیطی را مدلسازی کنند. این مدلها امکان بررسی اثر داروهای بازساختی و روشهای درمانی نوین را فراهم میکنند و به توسعه پزشکی شخصیسازیشده کمک میکنند.
کنترل میکرو محیط و مسیرهای سیگنالینگ در بیماریها
یکی از مزایای کلیدی استفاده از سلولهای بنیادی در مطالعه بیماریها، امکان کنترل دقیق میکرو محیط و مسیرهای سیگنالینگ است. با تغییر شرایط محیطی، مانند فاکتورهای رشد، فشار مکانیکی و سطح اکسیژن، پژوهشگران میتوانند اثرات محیط بر مسیرهای تمایزی سلولها و اختلالات ژنتیکی را بررسی کنند. این رویکرد به شناسایی مکانیزمهای مولکولی، نقاط ضعف سلولی و مسیرهای درمانی بالقوه کمک میکند.
تکنولوژیهای تک سلولی و مدلسازی بیماریها
ترکیب سلولهای بنیادی با تحلیل تک سلولی امکان شناسایی تغییرات بیان ژنی، مسیرهای اپیژنتیک و تنوع سلولی در بیماریها را فراهم میکند. این تکنولوژیها به پژوهشگران اجازه میدهند تا مکانیزمهای مولکولی بیماریهای ژنتیکی، اختلالات عصبی و سرطانها را در مراحل اولیه تکوین بازسازی کنند و مدلهای آزمایشگاهی دقیق برای توسعه درمانها ایجاد نمایند.
چالشها و چشمانداز آینده
با وجود مزایای متعدد، استفاده از سلولهای بنیادی برای مطالعه بیماریها با چالشهایی همراه است. یکی از محدودیتها، پیچیدگی تعاملات بین ژنها، مسیرهای سیگنالینگ و میکرو محیط است که نیازمند ابزارهای پیشرفته برای تحلیل دقیق است. همچنین، بازسازی کامل شرایط طبیعی بدن و اندامها در آزمایشگاه هنوز با محدودیتهایی مواجه است. با این حال، پیشرفتهای مداوم در ارگانوئیدها، تکنولوژیهای تک سلولی و مهندسی بافت، چشمانداز روشنی برای مدلسازی دقیق بیماریها و توسعه درمانهای نوین فراهم میآورد.
به طور خلاصه، سلولهای بنیادی ابزار قدرتمندی برای مطالعه بیماریها در مراحل تکوین هستند. این سلولها امکان بررسی ریشههای ژنتیکی و محیطی بیماریها، مسیرهای تمایزی مختل شده، اثر داروها و بازسازی بافتها را فراهم میکنند و مسیرهای جدیدی برای تحقیقات بنیادی، پزشکی بازساختی و درمانهای شخصیسازیشده ایجاد کردهاند.
سلولهای بنیادی در بازسازی و مهندسی بافتها
یکی از مهمترین و پرکاربردترین حوزههای تحقیقاتی سلولهای بنیادی، استفاده از آنها در بازسازی بافتها و مهندسی اندامها است. سلولهای بنیادی به دلیل توانایی خودتجدیدی و تمایز به انواع سلولها، ابزار ایدهآلی برای بازسازی بافتهای آسیبدیده و طراحی درمانهای نوین بازساختی به شمار میروند. این رویکرد، به ویژه برای بافتهایی که توان بازسازی طبیعی محدودی دارند، مانند قلب، مغز و غضروف، اهمیت حیاتی دارد.
بازسازی بافتهای پوستی و اپیتلیال
سلولهای بنیادی اپیتلیال و مزانشیمی، در بازسازی پوست، غشاهای مخاطی و اپیتلیوم اندامی کاربرد فراوان دارند. در درمان زخمهای مزمن، سوختگیها و نقصهای پوستی، سلولهای بنیادی میتوانند بافتهای آسیبدیده را بازسازی کرده و فرایند ترمیم را تسریع کنند. ترکیب این سلولها با اسکافولدهای زیستی و هیدروژلهای سهبعدی امکان رشد سازمانیافته سلولها و تشکیل لایههای اپیتلیال منظم را فراهم میآورد. همچنین، پژوهشها نشان دادهاند که میکرو محیط و فاکتورهای رشد نقش مهمی در هدایت تمایز سلولهای بنیادی و بهبود کیفیت بازسازی دارند.
مهندسی بافتهای عصبی و مغزی
بازسازی بافتهای عصبی یکی از چالشبرانگیزترین حوزهها در پزشکی بازساختی است، زیرا سلولهای عصبی بالغ توان محدودی در بازسازی دارند. سلولهای بنیادی پرتوان و iPSCها امکان تولید نورونها، گلیالها و سلولهای حمایتی را فراهم میکنند. با استفاده از ارگانوئیدهای مغزی و سیستمهای سهبعدی، پژوهشگران میتوانند شبکههای عصبی پیچیده را شبیهسازی کرده و آسیبهای عصبی، بیماریهای ژنتیکی و اختلالات مغزی را در شرایط آزمایشگاهی بازسازی کنند. این رویکرد همچنین امکان بررسی اثر داروها و فاکتورهای محیطی بر بازسازی سلولهای عصبی را فراهم میآورد.
بازسازی بافتهای قلبی و عروقی
سلولهای بنیادی مزانشیمی و iPSCها در مهندسی بافت قلبی و عروقی کاربرد گستردهای دارند. بازسازی قلب آسیبدیده ناشی از سکته یا نارساییهای مادرزادی با استفاده از این سلولها و اسکافولدهای زیستی مهندسی شده امکانپذیر شده است. پژوهشها نشان دادهاند که سلولهای بنیادی قادرند سلولهای عضلانی قلب، سلولهای اندوتلیال و سلولهای پشتیبان را تولید کنند و بافتهای قلبی منظم و عملکردی ایجاد کنند. کنترل دقیق نیروهای مکانیکی، فاکتورهای رشد و ترکیبات ماتریکس خارج سلولی برای موفقیت این فرآیند حیاتی است.
مهندسی بافتهای غضروفی و استخوانی
بازسازی غضروف و استخوان یکی دیگر از حوزههای مهم سلولهای بنیادی است. سلولهای بنیادی مزانشیمی میتوانند به سلولهای غضروفی و استخوانی تمایز پیدا کنند و با ترکیب آنها با اسکافولدهای زیستسازگار و فاکتورهای بیوشیمیایی، ساختارهای سهبعدی با استحکام مکانیکی مناسب ایجاد کنند. این رویکردها در درمان آرتروز، شکستگیهای پیچیده و نقصهای استخوانی کاربرد دارند. همچنین، فشار مکانیکی و بارگذاری فیزیکی میتوانند مسیرهای تمایزی سلولها را هدایت کرده و کیفیت بازسازی را بهبود بخشند.
بازسازی بافتهای ریه و کبدی
سلولهای بنیادی مزانشیمی و اپیتلیال در بازسازی بافتهای ریه و کبد نیز کاربرد دارند. با استفاده از ارگانوئیدهای ریه و کبد، میتوان مسیرهای تکوینی طبیعی را شبیهسازی کرده و اثر آسیبهای محیطی، داروها و جهشهای ژنتیکی را بررسی کرد. این مدلها همچنین امکان توسعه داروهای بازساختی و سلولدرمانی را فراهم میکنند و به درمان بیماریهای مزمن مانند فیبروز ریوی و سیروز کبدی کمک میکنند.
ترکیب سلولهای بنیادی با بیومواد و چاپ سهبعدی
یکی از پیشرفتهای کلیدی در مهندسی بافت، استفاده از بیومواد و فناوری چاپ سهبعدی سلولی است. این فناوریها امکان طراحی اسکافولدهای دقیق با خواص مکانیکی و شیمیایی کنترلشده را فراهم میکنند، که میتواند مسیر تمایزی سلولها و سازمانیابی بافت را هدایت کند. ترکیب چاپ سهبعدی با سلولهای بنیادی، امکان تولید اندامهای مینیاتوری، بازسازی ساختارهای پیچیده و مدلسازی بیماریها را فراهم میآورد.
کاربردهای بالینی و ترجمه به درمان
بازسازی بافتها با سلولهای بنیادی در حال حاضر به مطالعات بالینی در زخمهای پوستی، نقصهای استخوانی، بیماریهای قلبی و عصبی وارد شده است. استفاده از سلولهای بنیادی خود فرد یا مشتق از iPSCها، خطر رد ایمنی را کاهش میدهد و امکان درمان شخصیسازیشده و ایمن را فراهم میکند. ترکیب این رویکردها با مهندسی بافت و ارگانوئیدها، مسیرهای جدیدی برای بازسازی اندامها، درمان آسیبهای مزمن و توسعه پزشکی بازساختی ایجاد کرده است.
چالشها و چشمانداز آینده
با وجود پیشرفتهای قابل توجه، بازسازی بافتها با سلولهای بنیادی با چالشهایی مواجه است. برخی از محدودیتها شامل پیچیدگی میکرو محیط طبیعی، کنترل تمایز سلولها، تأمین خونرسانی و ساختار سهبعدی بافتها است. با این حال، پیشرفتهای فناوریهای بیومواد، چاپ سهبعدی، میکروفلوئیدیک و ارگانوئیدها، چشمانداز روشنی برای توسعه درمانهای بازساختی فراهم کرده و امکان بازسازی بافتها و اندامها با دقت بالا و عملکرد طبیعی را افزایش میدهد.
به طور خلاصه، سلولهای بنیادی ابزار قدرتمندی در بازسازی و مهندسی بافتها هستند. آنها امکان تولید سلولهای تخصصی، تشکیل بافتهای سهبعدی و بازسازی اندامهای آسیبدیده را فراهم میکنند و با ترکیب فناوریهای نوین، مسیرهای جدیدی برای تحقیقات بنیادی، درمانهای بالینی و توسعه پزشکی بازساختی ایجاد میکنند.
چالشها و محدودیتها در استفاده از سلولهای بنیادی برای مطالعه تکوین
اگرچه سلولهای بنیادی ابزار قدرتمندی برای مطالعه تکوین و توسعه پزشکی بازساختی هستند، اما استفاده از آنها با چالشها و محدودیتهای متعددی مواجه است که پژوهشگران باید به دقت در نظر بگیرند. این محدودیتها نه تنها بر جنبههای علمی و فنی تأثیر میگذارند، بلکه شامل مسائل اخلاقی، قانونی و بالینی نیز میشوند.
محدودیتهای بیولوژیکی و فنی
یکی از بزرگترین چالشها، پیچیدگی تمایز و کنترل مسیرهای سلولی است. سلولهای بنیادی، به ویژه iPSCها و ESCها، در محیط آزمایشگاهی ممکن است مسیرهای تمایزی غیرطبیعی یا ناخواسته را طی کنند و در نتیجه نتایج مدلسازی تکوین، دقیقاً بازتابدهنده فرآیندهای طبیعی بدن نباشد. علاوه بر این، حفظ پایداری ژنتیکی و اپیژنتیکی سلولها در طول تکثیر و نگهداری طولانیمدت، از اهمیت بالایی برخوردار است، زیرا جهشهای ناخواسته یا تغییرات اپیژنتیک میتوانند نتایج آزمایشها را تحریف کنند.
یکی دیگر از محدودیتها، محدودیت در بازسازی کامل میکرو محیط طبیعی است. در تکوین واقعی، سلولها تحت تأثیر فاکتورهای مکانیکی، شیمیایی و سیگنالینگ بین سلولی قرار میگیرند که در شرایط آزمایشگاهی، بازسازی دقیق آنها دشوار است. اگرچه ارگانوئیدها و سیستمهای سهبعدی پیشرفت قابل توجهی داشتهاند، اما هنوز قادر به بازسازی تمامی لایههای بافت، شبکههای رگهای خونی و تعاملات پیچیده سلولی به شکل کاملاً طبیعی نیستند.
چالشهای مرتبط با ارگانوئیدها و مدلهای سهبعدی
ارگانوئیدها و سیستمهای سهبعدی، علیرغم توانایی بالا در شبیهسازی تکوین، با محدودیتهایی در بازسازی ابعاد مکانی، حجم و شبکههای سلولی مواجه هستند. این مدلها معمولاً از نظر اندازه کوچک هستند و دسترسی به اکسیژن، مواد مغذی و جریان مایعات محدود است، که میتواند منجر به تشکیل مناطق هیپوکسیک و مرگ سلولی در مرکز بافت شود. علاوه بر این، تنوع بین ارگانوئیدها و عدم یکنواختی در تمایز سلولها چالشی برای تحلیل دقیق و مقایسه نتایج ایجاد میکند.
چالشهای مرتبط با تکنولوژیهای تک سلولی
استفاده از تکنولوژیهای تک سلولی مانند scRNA-seq و lineage tracing حجم بسیار بالایی از دادهها تولید میکند که تحلیل و تفسیر آنها نیازمند الگوریتمهای پیچیده و قدرت محاسباتی بالا است. علاوه بر این، جمعآوری سلولها و آمادهسازی نمونهها میتواند باعث تغییر بیان ژنی و پاسخ سلولی مصنوعی شود، که نتایج را دچار ابهام میکند.
محدودیتهای مرتبط با کاربردهای بالینی و بازسازی بافتها
بازسازی بافتها و اندامها با سلولهای بنیادی، با محدودیتهای خاص خود همراه است. برخی از این محدودیتها شامل ایجاد ساختار سهبعدی کامل، ایجاد رگهای خونی کارآمد و بازسازی عملکرد طبیعی بافت است. علاوه بر این، کنترل تمایز سلولها و جلوگیری از تشکیل تومور یا رشد غیرقابل کنترل سلولها یکی از دغدغههای اصلی در کاربردهای بالینی است. بدون کنترل دقیق مسیرهای تمایزی و شرایط میکرو محیط، خطر ایجاد سلولهای ناهنجار یا حتی سرطانزا وجود دارد.
مسائل اخلاقی و قانونی
یکی از چالشهای برجسته در استفاده از سلولهای بنیادی، مسائل اخلاقی و قانونی است. به ویژه در مورد ESCها، استفاده از سلولهای بنیادی جنینی میتواند با محدودیتهای اخلاقی و حساسیتهای اجتماعی مواجه شود. همچنین، استانداردسازی روشها، مجوزهای قانونی برای تولید و استفاده از سلولها، و رعایت اصول حفظ حریم خصوصی بیماران در نمونهگیری iPSCها از جنبههای مهم و چالشبرانگیز محسوب میشوند.
چالشهای مرتبط با انتقال یافتههای آزمایشگاهی به بالین
یکی از بزرگترین محدودیتها، ترجمه موفق یافتههای آزمایشگاهی به درمانهای بالینی است. بسیاری از مدلهای سلولهای بنیادی و ارگانوئیدی، با وجود دقت بالا، هنوز قادر به بازسازی کامل شرایط بافتی و عملکردی اندامها در بدن انسان نیستند. همچنین، واکنش ایمنی بدن و تعامل با سیستمهای پیچیده اندامی ممکن است نتایج بازسازی را محدود یا غیرقابل پیشبینی کند.
چشمانداز آینده و راهحلها
با وجود این چالشها، پیشرفتهای مداوم در حوزههای بیومواد، چاپ سهبعدی، میکروفلوئیدیک، ارگانوئیدهای پیشرفته و هوش مصنوعی، امیدهای زیادی برای رفع محدودیتها ایجاد کرده است. ترکیب تکنولوژیهای تک سلولی، سیستمهای سهبعدی و کنترل دقیق میکرو محیط میتواند دقت مدلسازی تکوین و بازسازی بافتها را به شکل چشمگیری افزایش دهد. همچنین، استانداردسازی روشها و همکاریهای بینرشتهای بین بیولوژی، مهندسی بافت و پزشکی بازساختی، مسیر روشنی برای توسعه کاربردهای بالینی ایمن و مؤثر فراهم میآورد.
به طور خلاصه، استفاده از سلولهای بنیادی برای مطالعه تکوین با چالشهای بیولوژیکی، فنی، بالینی و اخلاقی مواجه است. اما با پیشرفت تکنولوژیها و توسعه رویکردهای نوین، این محدودیتها به تدریج کاهش یافته و مسیر پژوهش و کاربردهای پزشکی بازساختی هموارتر میشود.
چشمانداز آینده و نوآوریها
استفاده از سلولهای بنیادی در مطالعه تکوین و بازسازی بافتها، علیرغم پیشرفتهای چشمگیر، همچنان در آغاز مسیر خود قرار دارد و چشمانداز آینده این حوزه، بسیار وسیع و هیجانانگیز است. تحقیقات اخیر نشان دادهاند که ترکیب سلولهای بنیادی با تکنولوژیهای نوین مهندسی، زیستشناسی تک سلولی و هوش مصنوعی، میتواند فرصتهای بیسابقهای برای درک تکوین، مدلسازی بیماریها و توسعه درمانهای بازساختی فراهم کند.
پیشرفت در ارگانوئیدها و سیستمهای سهبعدی پیچیده
یکی از مهمترین نوآوریها، توسعه ارگانوئیدهای پیچیده و سیستمهای سهبعدی چند بافتی است که قادرند تعامل بین سلولهای مختلف و سازماندهی فضایی بافتها را به شکلی طبیعیتر بازسازی کنند. ارگانوئیدهای چنداندامی میتوانند تعاملات بین قلب، مغز، ریه، کبد و روده را شبیهسازی کنند و مطالعه تکوین و بیماریها را در سطح اندامها و سیستمها امکانپذیر سازند. این نوآوریها به پژوهشگران اجازه میدهند که فرآیندهای تکوینی پیچیده و اختلالات چندسیستمی را بررسی کنند، موضوعی که پیش از این با مدلهای دو بعدی امکانپذیر نبود.
ترکیب سلولهای بنیادی با مهندسی بافت و چاپ سهبعدی
فناوریهای چاپ سهبعدی و مهندسی بافت، فرصتهای تازهای برای بازسازی بافتها و تولید اندامهای مینیاتوری و قابل استفاده در بالین ایجاد کردهاند. این تکنیکها امکان طراحی اسکافولدهای دقیق با خواص مکانیکی و شیمیایی کنترلشده را فراهم میآورند و مسیر تمایز سلولها را هدایت میکنند. پیشبینی میشود که ترکیب چاپ سهبعدی با سلولهای بنیادی، روزی به تولید اندامهای کامل یا بخشهایی از اندامها برای پیوند بالینی منجر شود، موضوعی که تاکنون در مراحل آزمایشگاهی و پیشبالینی به موفقیتهای محدود دست یافته است.
پیشرفت در تکنولوژیهای تک سلولی و تحلیل ژنومیک
تحلیل تک سلولی، مانند scRNA-seq، lineage tracing و multi-omics، به سرعت در حال تحول است و امکان شناسایی مسیرهای مولکولی، تغییرات اپیژنتیک و تنوع سلولی در تکوین و بیماریها را فراهم میکند. انتظار میرود که در آینده نزدیک، این تکنولوژیها با هوش مصنوعی و یادگیری ماشین ترکیب شوند تا الگوهای پیچیده سلولی و مسیرهای سیگنالینگ با دقت بالاتر پیشبینی و تحلیل شوند. این ترکیب میتواند مسیرهای جدید درمانی را برای بیماریهای ژنتیکی و اختلالات تکوینی باز کند و به توسعه داروهای هدفمند کمک کند.
بازسازی و مهندسی اندامها با رگزایی و میکرو محیط طبیعی
یکی از چالشهای کلیدی، بازسازی رگهای خونی و شبکههای لنفاوی در بافتهای مهندسی شده است. نوآوریهای اخیر در زمینه میکروفلوئیدیک، رگزایی مصنوعی و بیوراکتورهای پیشرفته امکان ایجاد محیطی نزدیک به شرایط طبیعی اندامها را فراهم میکنند. این پیشرفتها میتوانند بازسازی بافتهای بزرگ و عملکردی را امکانپذیر کنند و مسیر انتقال یافتههای آزمایشگاهی به درمانهای بالینی را هموارتر سازند.
توسعه دارو و پزشکی شخصیسازیشده
مدلهای سلولهای بنیادی و ارگانوئیدی، همراه با تحلیل تک سلولی، امکان تست داروها و بررسی پاسخهای فردی به درمانها را فراهم میکنند. این رویکرد، پایه پزشکی شخصیسازیشده را تشکیل میدهد و میتواند به پیشبینی پاسخ بیماران به داروها و کاهش عوارض جانبی کمک کند. انتظار میرود که در آینده، ترکیب دادههای مولکولی، مدلهای ارگانوئیدی و تحلیل هوشمند، طراحی داروهای بازساختی و درمانهای مبتنی بر سلولهای بنیادی را به سطح کاملاً جدیدی ارتقا دهد.
نوآوریهای مرتبط با هوش مصنوعی و مدلسازی پیشبینیکننده
هوش مصنوعی و یادگیری ماشین، به ویژه در تحلیل حجم عظیم دادههای تک سلولی و ارگانوئیدی، امکان شبیهسازی مسیرهای تکوینی و پیشبینی اثرات ژنتیکی و محیطی را فراهم میکنند. این رویکرد میتواند به کشف مکانهای بحرانی در تکوین، نقاط آسیبپذیر سلولها و مسیرهای درمانی بالقوه کمک کند. در آینده، مدلهای پیشبینیکننده بر اساس سلولهای بنیادی، به ابزارهای تصمیمگیری در تحقیقات بالینی و طراحی درمانهای نوین تبدیل خواهند شد.
چشمانداز ترکیبی و همافزایی حوزهها
پیشبینی میشود که آینده تحقیقات سلولهای بنیادی با همافزایی بیولوژی سلولی، مهندسی بافت، بیوفیزیک، هوش مصنوعی و پزشکی بالینی شکل گیرد. این رویکرد میانرشتهای میتواند مطالعه تکوین، مدلسازی بیماریها، بازسازی بافتها و توسعه درمانها را به شکلی کاملتر و دقیقتر امکانپذیر سازد. همچنین، استانداردسازی روشها و ایجاد پلتفرمهای مشترک تحقیقاتی و دادهمحور میتواند سرعت پیشرفت این حوزه را افزایش دهد.
چالشها و راهحلهای نوظهور
با وجود چشمانداز روشن، برخی چالشها همچنان پابرجا هستند، مانند بازسازی کامل بافتهای پیچیده، کنترل دقیق مسیرهای تمایزی، پاسخ ایمنی و مسائل اخلاقی. با این حال، نوآوریهای اخیر در زمینه ارگانوئیدهای چنداندامی، رگزایی مصنوعی، چاپ سهبعدی سلولی و هوش مصنوعی، نوید بخش کاهش محدودیتها و تحقق اهداف بلندمدت در مدلسازی تکوین و بازسازی بافتها هستند.
به طور خلاصه، چشمانداز آینده سلولهای بنیادی در مطالعه تکوین و بازسازی بافتها، بسیار روشن و گسترده است. ترکیب سلولهای بنیادی با فناوریهای نوین و رویکردهای میانرشتهای، مسیرهای جدیدی برای درک فرآیندهای تکوینی، مدلسازی دقیق بیماریها، توسعه داروهای هدفمند و بازسازی اندامها فراهم میآورد و انتظار میرود در دهههای آینده به یکی از ستونهای اصلی پزشکی نوین تبدیل شود.
نتیجهگیری
مطالعه سلولهای بنیادی در زمینه تکوین و بازسازی بافتها، یکی از پیشرفتهترین و تحولآفرینترین حوزههای زیستشناسی و پزشکی نوین محسوب میشود. طی این مقاله، به طور جامع بررسی شد که سلولهای بنیادی چگونه میتوانند درک ما از فرآیندهای تکوینی، توسعه اندامها، و تعاملات پیچیده سلولی را به شکل بیسابقهای ارتقا دهند.
سلولهای بنیادی و اهمیت آنها در تکوین
سلولهای بنیادی با توانایی خودتجدیدی و تمایز به انواع سلولها، ابزار منحصر به فردی برای مدلسازی مراحل تکوین هستند. این سلولها امکان شبیهسازی فرآیندهای اولیه جنینی، مسیرهای تمایزی و تغییرات سلولی در طول رشد بافتها را فراهم میکنند. استفاده از این سلولها در مدلسازی تکوین، نه تنها به درک بهتر اصول بنیادی زیستشناسی سلولی و مولکولی کمک میکند، بلکه به شناسایی مسیرهای بیماریزا و طراحی درمانهای هدفمند نیز میانجامد.
تنوع سلولهای بنیادی و کاربرد آنها
سلولهای بنیادی به انواع مختلفی شامل سلولهای بنیادی جنینی (ESC)، سلولهای بنیادی پرتوان القایی (iPSC)، سلولهای بنیادی بالغ و مزانشیمی تقسیم میشوند. هر یک از این انواع، ویژگیها و توانمندیهای خاص خود را دارند که آنها را برای کاربردهای متفاوتی مناسب میسازد. برای مثال، iPSCها امکان مدلسازی بیماریهای ژنتیکی و طراحی درمانهای شخصیسازیشده را فراهم میکنند، در حالی که سلولهای بنیادی مزانشیمی برای بازسازی بافتهای آسیبدیده و مهندسی بافت بسیار مناسب هستند.
مدلسازی تکوین و استفاده از ارگانوئیدها
استفاده از سلولهای بنیادی برای ایجاد ارگانوئیدها و سیستمهای سهبعدی، تحولی بزرگ در مطالعه تکوین ایجاد کرده است. ارگانوئیدها قادرند شبکههای سلولی پیچیده و تعاملات میکرو محیطی را شبیهسازی کنند و مسیرهای تکوینی طبیعی را در شرایط آزمایشگاهی بازسازی نمایند. این مدلها امکان مطالعه بیماریهای ژنتیکی، اثر داروها و عوامل محیطی بر تکوین را فراهم میآورند و پل ارتباطی بین تحقیقات بنیادی و کاربردهای بالینی هستند.
نقش میکرو محیط و عوامل مکانیکی و شیمیایی
تحقیقات نشان دادهاند که میکرو محیط سلولی، سیگنالهای شیمیایی و نیروهای مکانیکی نقش حیاتی در تعیین مسیر تمایز و سازماندهی بافتها دارند. بازسازی دقیق این عوامل در مدلهای سلولهای بنیادی، کلید موفقیت در شبیهسازی تکوین و طراحی درمانهای بازساختی است. عدم توجه به این عوامل میتواند نتایج مدلسازی را محدود و یا تحریف کند.
تحلیل تک سلولی و فناوریهای نوین
فناوریهای تحلیل تک سلولی، ژنومیک و اپیژنتیک، همراه با هوش مصنوعی و یادگیری ماشین، امکان بررسی دقیق مسیرهای سلولی و شناسایی تغییرات مولکولی در مراحل تکوین را فراهم کردهاند. این تکنولوژیها نه تنها درک ما از پیچیدگیهای سلولی را افزایش میدهند، بلکه مسیرهای جدید برای توسعه داروها، درمانهای بازساختی و پزشکی شخصیسازیشده ایجاد میکنند.
کاربرد سلولهای بنیادی در مطالعه بیماریها و بازسازی بافتها
سلولهای بنیادی نقش حیاتی در مدلسازی بیماریهای ژنتیکی و اکتسابی در مراحل تکوینی دارند و امکان بررسی اختلالات رشد، آسیبهای بافتی و پاسخ به داروها را فراهم میکنند. علاوه بر این، در حوزه مهندسی بافت و بازسازی اندامها، سلولهای بنیادی میتوانند به بازسازی پوست، غضروف، استخوان، قلب، مغز و اندامهای داخلی کمک کنند و راه را برای توسعه درمانهای بالینی نوین هموار کنند.
چالشها و محدودیتها
با وجود پیشرفتها، استفاده از سلولهای بنیادی با چالشهای بیولوژیکی، فنی، بالینی و اخلاقی مواجه است. محدودیتهایی همچون کنترل دقیق مسیرهای تمایزی، حفظ پایداری ژنتیکی، بازسازی کامل میکرو محیط بافتها، و مسائل اخلاقی مرتبط با سلولهای جنینی از جمله مهمترین موانع هستند. همچنین، انتقال موفق یافتههای آزمایشگاهی به درمانهای بالینی، همچنان نیازمند پیشرفت در فناوریها و رویکردهای میانرشتهای است.
چشمانداز آینده و نوآوریها
چشمانداز آینده سلولهای بنیادی بسیار روشن است و نوآوریهای ارگانوئیدی پیچیده، چاپ سهبعدی سلولی، میکروفلوئیدیک، تحلیل تک سلولی و هوش مصنوعی، مسیر پیشرفت این حوزه را تسریع میکنند. پیشبینی میشود که در دهههای آینده، بازسازی بافتها و اندامها، طراحی داروهای هدفمند، مدلسازی دقیق بیماریها و پزشکی شخصیسازیشده به سطح کاملاً جدیدی ارتقا یابد. ترکیب فناوریهای نوین و رویکردهای میانرشتهای، به تحقق اهداف بلندمدت در زیستشناسی تکوینی و پزشکی بازساختی کمک خواهد کرد.
جمعبندی نهایی
در نهایت، سلولهای بنیادی به عنوان ابزارهای کلیدی در مطالعه تکوین، بازسازی بافتها و توسعه درمانهای نوین شناخته میشوند. آنها نه تنها امکان بررسی فرآیندهای پیچیده رشد و توسعه را فراهم میکنند، بلکه پل ارتباطی بین تحقیقات بنیادی و کاربردهای بالینی محسوب میشوند. با پیشرفت فناوریها و نوآوریهای میانرشتهای، انتظار میرود که مطالعات سلولهای بنیادی به یکی از ستونهای اصلی پزشکی آینده، بازسازی بافتها و درک عمیقتر فرآیندهای زیستی تبدیل شوند. این مسیر، امیدبخش است و میتواند انقلابی در درمان بیماریها، توسعه داروها و بهبود کیفیت زندگی انسانها ایجاد کند.