آیا ماهیها میتوانند مسیر درمان سرطان را تغییر دهند؟
Fish Could Personalize Cancer Treatments
خلاصه مقاله :
تصور کنید که یک ماهی کوچک، شفاف و ظریف بتواند به پزشکان کمک کند تا بهترین درمان سرطان را برای هر بیمار انتخاب کنند. شاید در ابتدا این ایده عجیب و حتی شبیه داستانهای علمیتخیلی به نظر برسد، اما یک آزمایش بالینی جدید به دنبال پاسخ به این سوال است. در این مطالعه پنجساله که توسط ریتا فیور، زیستشناس رشد و توسعه از بنیاد شامپالیمود هدایت میشود، بیماران داروهایی دریافت خواهند کرد که قبلاً روی جنینهای ماهی زبرا (Zebrafish) که حاوی سلولهای سرطانی خودشان هستند آزمایش شدهاند. این روش نوآورانه میتواند مسیر جدیدی برای شخصیسازی درمانهای سرطان باز کند و به پزشکان کمک کند تا داروهای بیاثر و سمی را شناسایی کرده و از آنها اجتناب کنند. با این رویکرد، درمانهای مؤثر و مناسب برای هر بیمار بهطور دقیقتر انتخاب میشود و آسیبهای ناشی از درمانهای نادرست به حداقل میرسد. این مطالعه، اولین آزمایش تصادفی است که در آن ماهی زبرا آواتار (zebrafish avatars) برای پیشبینی پاسخ بیماران به درمانها استفاده میشود و میتواند انقلابی در آینده درمانهای سرطان بهوجود آورد.
آیا ممکن است انکولوژیستها (Oncologists) با «مشورت گرفتن از ماهیها» تصمیمهای دقیقتری برای درمان سرطان بگیرند؟ پرسشی که شاید در نگاه اول عجیب به نظر برسد، اکنون به موضوع یک کارآزمایی بالینی جدی تبدیل شده است؛ مطالعهای که قرار است از همین ماه در پرتغال آغاز شود.
این پژوهش پنجساله به رهبری ریتا فیور (Rita Fior)، زیستشناس تکوینی (Developmental biologist) از بنیاد شامپالیمو (Champalimaud Foundation)، نخستین کارآزمایی تصادفیشده (Randomized trial) از نوع خود به شمار میآید. در این مطالعه، بیماران داروهایی دریافت خواهند کرد که پیش از تجویز، روی جنینهای ماهی زبرا (Zebrafish embryos) آزمایش شدهاند؛ جنینهایی شفاف که سلولهای سرطانی همان بیماران در آنها کاشته شده است، گویی نسخهای کوچک و زنده از تومور هر فرد ساخته شده باشد.
مطالعات گذشته پیشتر نشان دادهاند که این «ماهی زبرا آواتار» (Zebrafish avatars) میتوانستند درمانهایی را شناسایی کنند که در نهایت در بیماران واقعی موفق بودهاند. اکنون فیور و همکارانش میخواهند پا را فراتر بگذارند و پاسخ دهند که آیا این توانایی پیشبینی، در عمل بالینی و در زمان تصمیمگیری واقعی، واقعاً به نفع بیماران تمام میشود یا نه.
لئونارد زون (Leonard Zon)، زیستشناس سلولهای بنیادی (Stem cell biologist) در دانشکده پزشکی هاروارد (Harvard Medical School) که در این کارآزمایی نقشی ندارد، میگوید:
«همه بهدنبال چیزی هستند که قدرت پیشبینی بالاتری داشته باشد»؛ یعنی روشی که بتواند با اطمینان بیشتری نشان دهد یک درمان مشخص، چه تأثیری بر تومور یک بیمار خاص خواهد گذاشت.
در حال حاضر، مجموعهای از «آواتارهای سرطان» در اختیار پژوهشگران است—از موشها و مگسهای میوه گرفته تا کشتهای سلولی (Cell cultures)—که همگی بهعنوان بسترهای شخصیسازیشده برای آزمودن درمانها طراحی شدهاند. اما هیچکدام بینقص نیستند. هر مدل، بخشی از واقعیت زیستی سرطان را بازسازی میکند و بخشی دیگر را از دست میدهد. زون میگوید اگر این مطالعهی جدید نشان دهد که ماهیهای زبرا «ارزش پیشبینی بالایی» دارند، «همه به سراغ این روش خواهند رفت».
یکی از بزرگترین چالشهای انکولوژی، تفاوتهای عمیق میان تومورهای بیماران است. ویژگیهایی مانند ژنتیک (Genetics)، متابولیسم (Metabolism) و پتانسیل رشد (Growth potential) باعث میشود انتخاب درمان مناسب به معمایی پیچیده تبدیل شود. اغلب چند گزینهی درمانی تقریباً همارزش وجود دارد و پزشک ناچار است یکی را انتخاب کند؛ انتخابی که ممکن است برای بیمار به معنای تحمل یک درمان آزاردهنده باشد، بیآنکه سودی داشته باشد. گاهی این روند تکرار میشود تا در نهایت درمانی پیدا شود که واقعاً مؤثر باشد.
تحلیل ژنومی (Genomic analysis) میتواند در برخی موارد گزینهها را محدود کند، اما حتی زمانی که سرطان یک بیمار دارای جهشهایی (Mutations) باشد که به یک درمان مشخص اشاره میکنند، باز هم هیچ تضمینی وجود ندارد که تومور به آن پاسخ دهد.
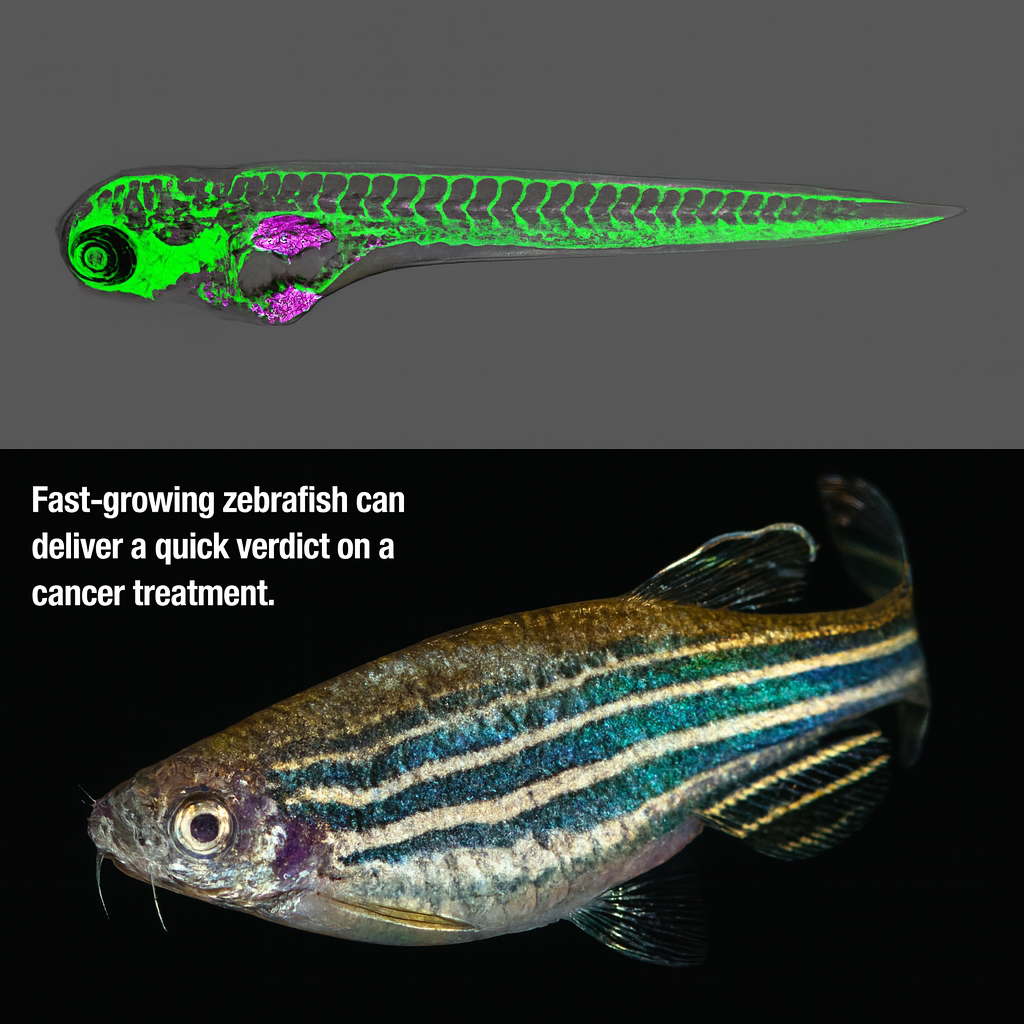
در جستوجوی جایگزینی دقیقتر، آزمایشگاه فیور نزدیک به یک دهه است که روی آواتارهای ماهی زبرا کار میکند. در این روش، پژوهشگران ابتدا سلولهای سرطانی را از بدن بیمار جدا میکنند، سپس آنها را در آزمایشگاه با نشانگرهای فلورسنت (Fluorescent tags) علامتگذاری میکنند؛ بهطوری که زیر میکروسکوپ مانند نقاط نورانی دیده شوند. این سلولها بعد به جنینهای شفاف ماهی زبرا پیوند زده میشوند.
در ادامه، پژوهشگران میتوانند داروهای ضدسرطان را مستقیماً به آب محل زندگی ماهیها اضافه کنند یا دوزهایی از پرتودرمانی (Radiation) اعمال کنند. سپس، با مشاهدهی رفتار سلولهای توموری فلورسنت، بررسی میکنند که آیا تومور کوچکشده، متوقف شده یا همچنان رشد میکند. این تصویر زنده به آنها کمک میکند پیشبینی کنند آیا سرطان بیمار واقعی احتمالاً به همان درمانها پاسخ خواهد داد یا نه.
به همان اندازه مهم، این آواتارها میتوانند گزینههایی را که احتمالاً بیاثر خواهند بود آشکار کنند؛ و همین موضوع میتواند بیماران را از درمانهای بالقوه سمی، پرعارضه و در نهایت بیفایده نجات دهد.
آواتارهای ماهی زبرا نخستینبار در سال ۲۰۱۷ توجه گستردهای را جلب کردند؛ زمانی که فیور و همکارانش گزارش دادند این آواتارها میتوانستند نتیجهی شیمیدرمانی (Chemotherapy) را در چهار نفر از هر پنج بیمار مبتلا به سرطان کولورکتال (Colorectal cancer) پیشبینی کنند.
در گزارشی که سال ۲۰۲۴ در مجله Nature Communications منتشر شد، همین گروه نشان دادند که برای مجموعهی بزرگتری شامل ۵۵ بیمار آواتار تولید کردهاند و ماهیها را دقیقاً تحت همان نوع شیمیدرمانی قرار دادهاند که بیماران انسانی دریافت کرده بودند. نتیجه چشمگیر بود: در مورد ۵۰ بیمار، پاسخ درمانی که در ماهیها دیده شده بود، با نتیجهی واقعی بیماران مطابقت داشت.
فیور میگوید یک مزیت اضافی این روش آن است که آواتارها میتوانند ویژگیهای کلیدی تومورها—مانند احتمال متاستاز (Metastasis)—را نیز آشکار کنند؛ ویژگیهایی که نقش مهمی در تصمیمگیری درمانی دارند. آزمایشگاههای دیگر نیز گزارشهای مشابه و امیدوارکنندهای دربارهی آواتارهای ماهی زبرا منتشر کردهاند.
با این حال، ماهیها تنها گزینهی موجود نیستند. یکی از رقبای جدی آنها، سلولهای سرطانی هستند که از بدن بیمار گرفته شده و در ظروف آزمایشگاهی (In vitro dish) رشد داده میشوند. دیانا عزام (Diana Azzam)، پژوهشگر سرطان در دانشگاه بینالمللی فلوریدا (Florida International University)، و همکارانش در سال ۲۰۲۴ در مجله Nature Medicine گزارش دادند که این روش میتواند تنها در ۹ روز برای سرطانهای خونی (Blood cancers) و ۱۰ روز برای تومورهای جامد (Solid tumors) نتیجه ارائه دهد.
اما این مدل یک ضعف اساسی دارد: برخلاف ماهیهای زبرا، سلولهای سرطانی در کشتهای ساده در محیط طبیعی بدن زندگی نمیکنند. آلانا ولم (Alana Welm)، زیستشناس سرطان از دانشگاه یوتا (University of Utah)، میگوید:
«آنها فاقد بسیاری از مؤلفههایی هستند که میدانیم زیستشناسی تومور و پاسخ به دارو را تنظیم میکنند.»
مدل دیگری که توجه پژوهشگران را جلب کرده، مگسهای میوه (Fruit flies) هستند. این رویکرد به لطف روشی شکل گرفته که توسط راس کاگن (Ross Cagan)، پژوهشگر ژنتیک مگس سرکه—که اکنون در دانشگاه گلاسگو (University of Glasgow) فعالیت میکند—و همکارانش توسعه یافته است.
اینکه آیا مگسهای میوه بهطور طبیعی دچار تومور میشوند یا نه، هنوز محل بحث است. به همین دلیل، پژوهشگران بهجای انتقال سلولهای سرطانی از بیمار، لارو مگس میوه را بهطور ژنتیکی دستکاری میکنند تا حامل جهشهای کلیدی تومور همان بیمار باشد. سپس داروها روی این مگسها آزمایش میشوند تا مشخص شود آیا میتوانند اثرات آن جهشها را خنثی کنند یا نه.
این روش از نظر مقیاسپذیری بسیار قدرتمند است: از یک مگس دستکاریشدهی ژنتیکی، کاگن و همکارانش میتوانند بهسرعت حدود ۴۰۰ هزار آواتار برای هر بیمار تولید کنند. چنین تعدادی امکان آزمودن طیف گستردهای از درمانها و دستیابی به پشتوانهی آماری بسیار قوی را فراهم میکند.
در مقالاتی که در سالهای ۲۰۱۹ و ۲۰۲۱ منتشر شدند، کاگن و همکارانش گزارش دادند که این روش را برای دو بیمار به کار بردهاند: یکی مبتلا به تومور نادر غدهی بزاقی (Salivary gland tumor) و دیگری مبتلا به سرطان کولورکتال متاستاتیک (Metastatic colorectal cancer). در هر دو مورد، آواتارهای مگس ترکیبهای دارویی جدیدی را شناسایی کردند که توانستند بهطور موقت رشد تومور را متوقف کنند—هرچند هیچیک از بیماران بهطور کامل درمان نشدند. تلاش برای آغاز یک کارآزمایی بالینی آیندهنگر (Prospective clinical trial) نیز با همهگیری کووید-۱۹ (COVID-19 pandemic) متوقف شد.
آواتارهای موشی (Mouse avatars) هم به مرحلهی کارآزمایی بالینی رسیدهاند، اما این مدلها به زمان زیادی نیاز دارند. رشد دادن تومورها و آزمودن درمانها در موشها ممکن است ماهها طول بکشد. ولم در جمعبندی وضعیت فعلی میگوید:
«هنوز نمیتوان دربارهی هیچیک از این رویکردها حکم نهایی داد. ما همچنان منتظر دادهها هستیم.»
با این حال، طرفداران ماهی زبرا معتقدند آواتارهای آنها ترکیبی منحصربهفرد از مزایا را ارائه میدهند. عزام اشاره میکند که این روش—مانند کشتهای سلولی—نتایج سریعی، در حدود ۱۰ روز، ارائه میدهد و تأکید میکند:
«زمان برای تصمیمگیری بالینی بسیار مهم است.»
ماهیهای زبرا از نظر زیستی به انسان نزدیکتر از کشتهای سلولی هستند و در عین حال نگهداری از آنها بسیار ارزانتر از موشهاست. افزون بر این، جنینهای کوچک و شفاف آنها مانند یک «پنجرهی زنده» عمل میکنند که امکان مشاهدهی مستقیم فرایندهای درون بدن را فراهم میسازد. سوفیا دِ اولیویرا (Sofia de Oliveira)، زیستشناس مولکولی و ایمنیشناس (Molecular biologist and immunologist) در کالج پزشکی آلبرت اینشتین (Albert Einstein College of Medicine)، میگوید:
«میتوانید کل جانور را زیر میکروسکوپ ببینید» و بهراحتی بافتهای آن را برای یافتن متاستاز بررسی کنید.
در کارآزمایی بالینی جدید، فیور و تیمش این وعدهها را در عمل میآزمایند. آنها سلولهای سرطانی را از مایعی جدا میکنند که در شکم افراد مبتلا به سرطان پستان یا تخمدان متاستاتیک تجمع مییابد—مایعی که معمولاً بهعنوان بخشی از روند درمان تخلیه میشود. فیور تأکید میکند:
«ما هیچ اقدام اضافی روی بیماران انجام نمیدهیم.»
پس از آن، سلولها در جنینهای ماهی زبرا کاشته میشوند. برخلاف بسیاری از کارآزماییهای بالینی که داروهای کاملاً آزمایشی را بررسی میکنند، این مطالعه تمرکز خود را بر این میگذارد که کدام ترکیب از درمانهای تأییدشده (Approved treatments) برای هر بیمار بهترین عملکرد را دارد. نیمی از بیماران درمانهایی را دریافت خواهند کرد که بر اساس نتایج آواتارهای ماهی زبرا پیشنهاد شدهاند، و نیم دیگر درمانی را خواهند گرفت که پزشکانشان بدون هیچ ورودی از ماهی انتخاب کردهاند.
با این حال، پذیرش این رویکرد در میان انکولوژیستها هنوز کامل نیست. کاتلین کِلیس (Kathleen Claes)، ژنتیکدان مولکولی (Molecular geneticist) از دانشگاه خِنت (Ghent University)، میگوید:
«بر اساس تجربهی من، پزشکان هنوز کمی در کار با ماهی زبرا مقاومت نشان میدهند.»
او با این حال معتقد است اگر این کارآزمایی بتواند ارزش افزودهی واقعی این روش را نشان دهد—بهویژه برای بیمارانی که گزینههای درمانی بعدی برایشان مشخص نیست—میتواند نقطهی عطفی در انکولوژی باشد.
ریچارد وایت (Richard White)، زیستشناس سرطان و انکولوژیست از دانشگاه آکسفورد (University of Oxford)، نیز با این نگاه موافق است. او میگوید:
«انکولوژیستها دادهمحور هستند. اگر دادهها را در اختیارشان بگذارید، از آن استفاده خواهند کرد.»
منابع:
Leslie M. Fish could personalize cancer treatments. Science. 2025 Jan 10;387(6730):122-123. doi: 10.1126/science.adv7960. Epub 2025 Jan 9. PMID: 39787212.