ژن درمانی سرطان
مقدمه
ژندرمانی سرطان یکی از پیشرفتهترین و امیدوارکنندهترین حوزههای پزشکی نوین است که در سالهای اخیر توجه جهانی را به خود جلب کرده است. این رویکرد درمانی فراتر از روشهای سنتی مانند جراحی، شیمیدرمانی و رادیوتراپی عمل میکند و هدف آن اصلاح یا دستکاری ژنهای دخیل در رشد و تکثیر سلولهای سرطانی است. برخلاف درمانهای معمول که غالباً بر علائم بیماری تمرکز دارند و ممکن است به بافتهای سالم آسیب برسانند، ژندرمانی با تمرکز بر ریشه مولکولی سرطان، امکان درمانهای هدفمند، شخصیسازی شده و با عوارض کمتر را فراهم میکند.
اصول ژندرمانی بر مبنای توانایی اصلاح یا جایگزینی ژنهای معیوب است. در سرطان، اختلالات ژنتیکی متعددی مانند جهشهای فعالکننده آنکوژنها یا از دست رفتن عملکرد ژنهای سرکوبگر تومور مشاهده میشود. ژندرمانی میتواند این اختلالات را اصلاح کرده و مسیرهای رشد غیرطبیعی سلولهای سرطانی را مختل کند. علاوه بر این، این روش قادر است پاسخ ایمنی بدن به تومور را تقویت کرده و امکان تحریک سلولهای ایمنی برای شناسایی و از بین بردن سلولهای سرطانی را فراهم کند.
با پیشرفتهای تکنولوژی و نانوتکنولوژی، توانایی انتقال ژن به سلولهای هدف بهبود یافته است. بردارهای ویروسی و غیر ویروسی پیشرفته، نانوذرات هدفمند، لیپوزومها و اگزوزومها ابزارهایی هستند که امکان رساندن ژنها به بافت سرطانی را با کارایی بالا و سمیت پایین فراهم میکنند. این پیشرفتها زمینه را برای طراحی درمانهای شخصیسازی شده فراهم کرده و افقهای جدیدی در درمان سرطان باز کرده است.
اهمیت ژندرمانی در درمان سرطان نه تنها در توانایی آن برای هدفگیری مولکولی دقیق نهفته است، بلکه در امکان کاهش اثرات جانبی و بهبود کیفیت زندگی بیماران نیز مشهود است. مطالعات بالینی نشان دادهاند که استفاده از ژندرمانی میتواند در مواردی که درمانهای مرسوم ناکارآمد هستند، امیدبخش باشد و حتی در برخی سرطانها مانند سرطان خون و لنفومها نتایج درمانی چشمگیری به همراه داشته باشد.
هدف این مقاله ارائه یک مرور جامع و تخصصی بر ژندرمانی سرطان است. در این مقاله، مفاهیم پایه، روشها و تکنیکهای انتقال ژن، انواع بردارها، کاربردهای ژندرمانی در سرطانهای مختلف، موفقیتها و چالشهای بالینی و آینده این حوزه به تفصیل بررسی خواهد شد. با این مرور، مخاطب نه تنها با اصول علمی ژندرمانی آشنا میشود، بلکه دید جامعی از پیشرفتهای فناورانه و بالینی این حوزه پیدا خواهد کرد.
این مقاله همچنین تلاش میکند تا با یکپارچهسازی دانش مولکولی، تکنولوژی نانو و دادههای بالینی روزآمد، تصویری کامل از وضعیت فعلی ژندرمانی سرطان ارائه دهد و افقهای آینده تحقیق و کاربرد بالینی آن را روشن کند. تمرکز اصلی بر این است که خواننده، چه یک متخصص بالینی و چه پژوهشگر علوم پایه، بتواند پاسخ جامع و دقیقی به تمام سوالات مرتبط با ژندرمانی سرطان پیدا کند و درک عمیقی از امکانات، محدودیتها و چشماندازهای آینده این حوزه داشته باشد.
مبانی ژندرمانی در سرطان
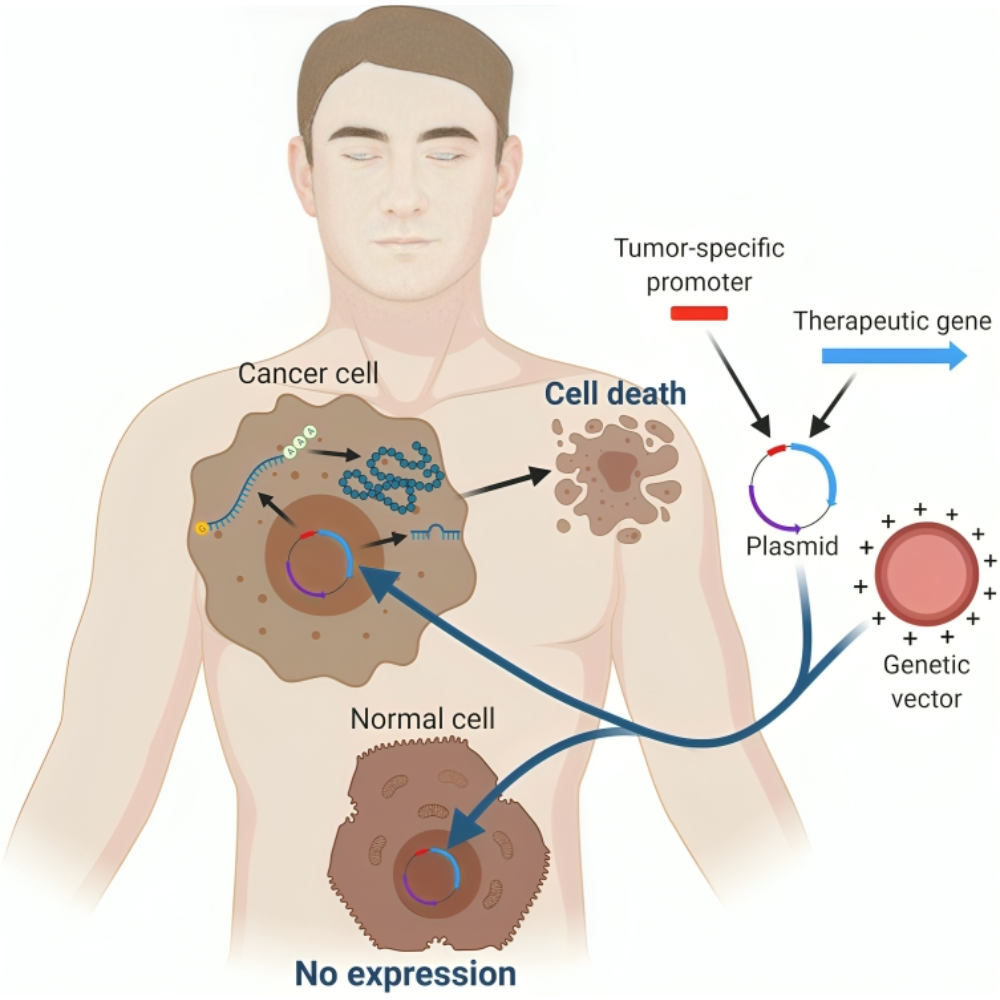
ژندرمانی سرطان بر اساس اصلاح یا دستکاری ژنهایی که در ایجاد و پیشرفت تومور نقش دارند، شکل گرفته است. برای درک کامل این حوزه، ضروری است که با اصول علمی پایه، ژنهای هدف و مکانیسمهای اصلی عملکرد ژندرمانی آشنا شویم.
اصول ژندرمانی بر پایه توانایی وارد کردن مواد ژنتیکی به سلولهای هدف است. این مواد میتوانند شامل ژنهای کدکننده پروتئین، RNAهای کوچک تنظیمکننده و یا عناصر ژنتیکی کنترلکننده باشند. هدف این است که سلولهای سرطانی، توانایی تکثیر غیرطبیعی و مقاومت نسبت به مرگ سلولی را از دست بدهند. در ژندرمانی سرطان، معمولاً سه رویکرد اصلی دنبال میشود: جایگزینی ژنهای سرکوبگر تومور که عملکردشان از بین رفته است، مهار آنکوژنهای فعال و تحریک پاسخ ایمنی علیه سلولهای سرطانی.
ژنهای هدف در سرطان به دو دسته کلی تقسیم میشوند: ژنهای سرکوبگر تومور و آنکوژنها. ژنهای سرکوبگر تومور مانند p53، RB و PTEN، مسئول جلوگیری از رشد سلولهای سرطانی هستند و در بسیاری از سرطانها عملکردشان مختل شده است. جایگزینی یا فعالسازی مجدد این ژنها میتواند مسیرهای رشد غیرطبیعی سلولها را متوقف کند و فرآیند آپاپتوز یا مرگ برنامهریزی شده سلولی را بازگرداند. از سوی دیگر، آنکوژنها مانند RAS و MYC، ژنهایی هستند که در حالت طبیعی تنظیمکننده رشد سلولی هستند اما در سرطان فعال باقی میمانند. مهار این ژنها با استفاده از RNAi یا سایر ابزارهای ژنتیکی میتواند تکثیر سلولهای سرطانی را کاهش دهد.
یکی دیگر از ژنهای هدف مهم، ژنهای مرتبط با سیستم ایمنی هستند. با انتقال ژنهایی که کدکننده سیتوکینها یا فاکتورهای فعالکننده سلولهای T و NK هستند، میتوان پاسخ ایمنی ضد تومور را تقویت کرد. این استراتژی، به ویژه در ترکیب با ژندرمانی سلولی و CAR-T، امکان ایجاد یک حمله هدفمند علیه تومور را فراهم میکند.
مکانیسمهای اصلی ژندرمانی در سرطان شامل چند مسیر مهم است. نخست، جایگزینی یا اصلاح ژن معیوب که با استفاده از بردارهای ژنتیکی، ژن سرکوبگر تومور را وارد سلول میکند و مسیرهای رشد غیرطبیعی را متوقف میسازد. دوم، مهار ژنهای مضر یا آنکوژنها با استفاده از RNAهای کوچک، siRNA و microRNA که باعث خاموشی ژنهای فعالکننده تومور میشوند. سوم، تحریک مرگ سلولی هدفمند که شامل القای آپاپتوز، نِکروپتوز یا پاناپتوز میشود و باعث حذف انتخابی سلولهای سرطانی بدون آسیب به بافت سالم میگردد.
چالشهای اساسی ژندرمانی در سرطان نیز از اهمیت ویژهای برخوردارند. نخست، تحویل دقیق و کارآمد ژنها به سلولهای هدف، بدون ورود به سلولهای سالم، یک مشکل فنی مهم است. این امر نیازمند توسعه بردارهای هدفمند و سیستمهای تحویل پیشرفته است. دوم، ایمنی و واکنشهای ایمنی بدن به بردارهای ژنی میتواند باعث کاهش کارایی یا ایجاد عوارض جانبی شود. سوم، پایداری بیان ژنها یک مسئله حیاتی است؛ برخی ژنها ممکن است تنها به طور موقت بیان شوند و اثر درمانی محدود داشته باشند. علاوه بر این، احتمال ایجاد جهشهای ناخواسته یا سرطان ثانویه نیز یکی از نگرانیهای جدی بالینی است که نیازمند نظارت طولانیمدت است.
با وجود این چالشها، پیشرفتهای اخیر در حوزه نانوذرات، بردارهای ویروسی امن و بردارهای پاسخگو به محرکها، زمینه را برای افزایش کارایی و ایمنی ژندرمانی فراهم کرده است. استفاده از لیپوزومها، کیتوزان، پلیاتیلنایمین و نانوذرات طلایی به عنوان بردارهای غیر ویروسی، تحویل ژن به سلولهای هدف را دقیقتر و با کمترین سمیت انجام میدهد. بردارهای ویروسی مانند AAV و آدنویروسها نیز با طراحی بهینه، میتوانند ژنها را به صورت طولانیمدت و هدفمند بیان کنند.
در مجموع، مبانی ژندرمانی در سرطان ترکیبی از دانش مولکولی، مهندسی ژنتیک و فناوریهای نوین تحویل ژن است که امکان طراحی درمانهای هدفمند و شخصیسازی شده را فراهم میکند. در بخشهای بعدی مقاله، به تفصیل به بردارها و روشهای انتقال ژن، تحویل هدفمند، کاربردهای بالینی و ژندرمانی سلولی پرداخته خواهد شد تا یک تصویر کامل و جامع از وضعیت فعلی و آینده این حوزه ارائه گردد.
بردارهای ژندرمانی و روشهای انتقال ژن
یکی از مهمترین اجزاء موفقیتآمیز ژندرمانی در سرطان، انتخاب مناسب بردار ژنی و روش انتقال ژن است. بدون یک سیستم تحویل کارآمد و هدفمند، ژنها نمیتوانند به سلولهای سرطانی برسند یا در آنها به اندازه کافی بیان شوند، و بنابراین اثر درمانی محدود خواهد بود. بردارها ابزارهایی هستند که مواد ژنتیکی را به داخل سلولهای هدف منتقل میکنند و نقش کلیدی در تعیین ایمنی، کارایی و پایداری درمان ایفا میکنند.
بردارهای ویروسی یکی از قدیمیترین و پرکاربردترین ابزارهای ژندرمانی هستند، زیرا ویروسها به طور طبیعی توانایی ورود به سلولها و بیان ژن را دارند. از جمله مهمترین بردارهای ویروسی میتوان به آدنویروسها، ویروسهای AAV و رتروویروسها اشاره کرد. آدنویروسها قادر به انتقال ژنهای بزرگ به سلولها هستند و سرعت بالایی در بیان ژن دارند، اما محدودیتهایی مانند واکنش ایمنی شدید و کوتاهمدت بودن بیان ژن دارند. ویروسهای AAV به دلیل ایمنی بالاتر و توانایی بیان طولانیمدت ژنها، گزینه مناسبی برای بسیاری از سرطانها محسوب میشوند، هرچند ظرفیت انتقال ژن آنها محدود است. رتروویروسها و لنتیویروسها نیز توانایی یکپارچه شدن در ژنوم سلولهای هدف را دارند و بنابراین میتوانند بیان پایدار ژن را فراهم کنند، اما خطر جهشزایی و سرطان ثانویه باید در نظر گرفته شود.
در کنار بردارهای ویروسی، بردارهای غیر ویروسی نیز به طور گسترده مورد استفاده قرار میگیرند، زیرا میتوانند ایمنی بالاتر و کنترل دقیقتر بر روی تحویل ژن ارائه دهند. از جمله این بردارها میتوان به نانوذرات لیپیدی، لیپوزومها، کیتوزان، پلیاتیلنایمین (PEI) و نانوذرات طلایی اشاره کرد. این بردارها میتوانند DNA، RNA و حتی مولکولهای siRNA را به سلولهای سرطانی منتقل کنند و با اصلاح سطحی، امکان هدفگیری سلولهای خاص تومور را فراهم آورند. به عنوان مثال، لیپوزومهای پوششدار با آنتیبادی یا لیگاندهای خاص میتوانند تنها به سلولهای سرطانی متصل شوند و اثرات جانبی بر بافتهای سالم را کاهش دهند.
یکی از پیشرفتهای مهم در ژندرمانی سرطان، توسعه بردارهای پاسخگو به محرکهای محیطی است. این بردارها قادرند تنها در شرایط خاصی مانند pH اسیدی محیط تومور یا حضور آنزیمهای خاص فعال شوند و ژن مورد نظر را آزاد کنند. چنین رویکردی، دقت درمان را افزایش داده و اثرات جانبی سیستمیک را کاهش میدهد.
روشهای انتقال ژن نیز متنوع هستند و بسته به نوع بردار و هدف درمانی انتخاب میشوند. روشهای شیمیایی شامل استفاده از کمپلکسهای نانوذرات با DNA یا RNA است که با عبور از غشای سلولی، مواد ژنتیکی را وارد هسته میکنند. روشهای فیزیکی شامل الکتروپوریشن، میکرواینژکشن و نانوپارتیکلهای قابل هدایت با میدان مغناطیسی هستند که امکان وارد کردن مستقیم ژنها به داخل سلول را فراهم میکنند. ترکیب روشهای شیمیایی و فیزیکی با بردارهای هدفمند، بیشترین کارایی را در انتقال ژن به سلولهای توموری نشان داده است.
مزیت اصلی استفاده از بردارهای غیر ویروسی، کاهش پاسخ ایمنی و قابلیت تولید انبوه است، در حالی که بردارهای ویروسی همچنان در بسیاری از درمانهای بالینی، به دلیل کارایی بالای ورود به سلول و بیان طولانیمدت ژن، نقش حیاتی دارند. از این رو، انتخاب بردار مناسب همواره یک تعادل بین ایمنی، پایداری و کارایی است.
پیشرفتهای اخیر در نانوتکنولوژی و مهندسی مولکولی، امکان طراحی بردارهای ترکیبی و هوشمند را فراهم کرده است که میتوانند چندین مولکول ژنی یا درمان ترکیبی را به صورت همزمان منتقل کنند. برای مثال، ترکیب siRNA با داروهای ضد تومور یا فاکتورهای ایمنی در یک بردار، همزمان مسیرهای رشد تومور را مهار کرده و پاسخ ایمنی را تقویت میکند.
در مجموع، بردارها و روشهای انتقال ژن اساس موفقیت ژندرمانی سرطان را تشکیل میدهند. انتخاب دقیق نوع بردار، سطح هدفگیری، روش تحویل و طراحی پاسخگو به محیط، تعیینکننده اثر درمانی، ایمنی و دوام ژندرمانی است. در بخشهای بعدی، به نحوه تحویل هدفمند ژن به سلولهای سرطانی پرداخته خواهد شد و انواع سیستمهای نانو مقیاس و استراتژیهای افزایش کارایی و ایمنی درمان بررسی میشوند.
تحویل هدفمند ژن به سلولهای سرطانی
یکی از بزرگترین چالشها در ژندرمانی سرطان، رساندن دقیق ژنها به سلولهای سرطانی بدون آسیب به بافتهای سالم است. تحویل هدفمند ژن، کلید افزایش کارایی درمان و کاهش عوارض جانبی سیستمیک است. پیشرفتهای اخیر در نانوتکنولوژی، مهندسی بردار و بیولوژی سلولی امکان طراحی سیستمهای دقیق تحویل ژن را فراهم کرده است که میتوانند به طور انتخابی به سلولهای سرطانی متصل شوند و ژن درمانی را به طور مؤثر وارد کنند.
سیستمهای نانو مقیاس نقش بسیار مهمی در تحویل هدفمند ژن دارند. این سیستمها شامل نانوذرات لیپیدی، نانوذرات طلایی، نانوذرات پلیمری و کیتوزان هستند که میتوانند DNA، RNA یا siRNA را به سلولهای تومور منتقل کنند. مزیت اصلی این نانوذرات، افزایش نفوذ ژنها به بافت توموری، محافظت از مواد ژنتیکی در برابر تخریب در گردش خون و امکان اصلاح سطح ذرات برای هدفگیری سلولهای خاص است. به عنوان مثال، نانوذرات لیپیدی میتوانند با اتصال آنتیبادیها یا لیگاندهای سطحی به گیرندههای اختصاصی سلولهای سرطانی، انتخابی بودن تحویل ژن را افزایش دهند.
لیپوزومها از جمله بردارهای غیر ویروسی موفق در ژندرمانی هستند که قابلیت حمل ژنهای بزرگ و حفاظت از آنها در برابر آنزیمهای تخریبکننده را دارند. با اصلاح سطح لیپوزومها با آنتیبادیها یا مولکولهای هدفگیرنده، امکان رساندن ژن به سلولهای سرطانی خاص فراهم میشود. علاوه بر این، لیپوزومهای حساس به pH یا آنزیمهای تومور، میتوانند تنها در محیط اسیدی یا آنزیم فعال تومور، ژنها را آزاد کنند و از آسیب به بافت سالم جلوگیری نمایند.
استفاده از اگزوزومها و وزیکولهای خارج سلولی نیز به عنوان یک رویکرد نوین در تحویل هدفمند ژن مطرح شده است. این ذرات طبیعی که از سلولها ترشح میشوند، به دلیل سازگاری بالای بیولوژیک و توانایی نفوذ به بافتهای مختلف، گزینهای ایدهآل برای انتقال ژنها به سلولهای سرطانی هستند. اگزوزومها میتوانند با بارگذاری RNAهای کوچک، DNA یا پروتئینهای درمانی، مسیرهای رشد تومور را مهار کنند و پاسخ ایمنی ضد تومور را تقویت نمایند. مطالعات اخیر نشان دادهاند که اصلاح سطح اگزوزومها با مولکولهای هدفگیرنده اختصاصی، دقت و کارایی درمان را به طور چشمگیری افزایش میدهد.
یکی دیگر از استراتژیهای مهم، استفاده از بردارهای پاسخگو به محرکها است. این بردارها تنها در شرایط خاص فعال میشوند و ژن درمانی را آزاد میکنند. به عنوان مثال، نانوذرات حساس به pH تومور، تنها در محیط اسیدی داخل تومور ژنها را آزاد میکنند و در بافت سالم غیر فعال باقی میمانند. همچنین، بردارهای حساس به دما، آنزیمها یا نور، امکان کنترل دقیقتر زمان و مکان آزادسازی ژن را فراهم میکنند.
هدفگیری سلولهای تومور به کمک آنتیبادیها، لیگاندها یا پپتیدهای خاص، دقت درمان را افزایش میدهد. گیرندههای سطحی مانند HER2 در سرطان پستان یا EGFR در سرطان ریه، میتوانند به عنوان اهداف برای بردارهای ژنی عمل کنند. این رویکرد نه تنها میزان ورود ژن به سلولهای سرطانی را افزایش میدهد، بلکه از ورود به سلولهای سالم جلوگیری کرده و عوارض جانبی را کاهش میدهد.
تحقیقات اخیر نشان دادهاند که ترکیب چندین استراتژی هدفگیری، مانند استفاده همزمان از نانوذرات لیپیدی، اگزوزومها و بردارهای پاسخگو به محرکها، اثر درمانی ژندرمانی را به طور قابل توجهی افزایش میدهد. این روشها امکان استفاده از ژنهای درمانی ترکیبی را فراهم میکنند، به طوری که میتوان همزمان ژنهای سرکوبگر تومور، siRNA برای خاموشی آنکوژنها و ژنهای تحریککننده ایمنی را به سلولهای سرطانی رساند.
به طور کلی، تحویل هدفمند ژن به سلولهای سرطانی، ترکیبی از علم نانو، بیولوژی سلولی و مهندسی بردار است که امکان درمان دقیق، ایمن و مؤثر سرطان را فراهم میکند. این سیستمها، پایه و اساس موفقیت ژندرمانی در انواع سرطانها را شکل میدهند و در بخشهای بعدی، به تفصیل به ژندرمانی بر اساس مکانیزمهای سلولی خاص، شامل p53، سرکوبگرهای تومور و RNA درمانی خواهیم پرداخت.
ژندرمانی بر اساس مکانیزمهای سلولی خاص
یکی از رویکردهای پیشرفته در ژندرمانی سرطان، هدفگیری مسیرها و مکانیسمهای سلولی ویژهای است که در رشد و بقا سلولهای سرطانی نقش دارند. این استراتژی به جای ارائه یک درمان عمومی، با تمرکز بر نقاط آسیبپذیر مولکولی تومور، امکان افزایش اثر درمانی و کاهش آسیب به سلولهای سالم را فراهم میکند.
ژندرمانی مبتنی بر p53 یکی از مهمترین و گستردهترین رویکردها در این زمینه است. ژن p53 به عنوان یک سرکوبگر تومور کلیدی، نقش حیاتی در تنظیم چرخه سلولی و القای آپاپتوز دارد. در بسیاری از سرطانها، جهش یا از دست رفتن عملکرد p53 مشاهده میشود که باعث رشد غیرطبیعی و مقاومت سلولها به مرگ برنامهریزی شده میشود. جایگزینی ژن p53 سالم یا تحریک مسیرهای مرتبط با آن، میتواند چرخه سلولی را اصلاح کرده و سلولهای سرطانی را به سمت آپاپتوز هدایت کند. مطالعات بالینی و پیشبالینی نشان دادهاند که ژندرمانی مبتنی بر p53، به ویژه در سرطان ریه و سر و گردن، توانایی کاهش اندازه تومور و افزایش پاسخ به درمانهای استاندارد را دارد.
هدفگیری سرکوبگرهای تومور خاص، مانند ALDH1L1، یکی دیگر از استراتژیهای مؤثر است. ALDH1L1 به عنوان یک تنظیمکننده متابولیک و سرکوبگر بالقوه تومور شناخته شده و در سرطانهای ریه غیر کوچک نقش حیاتی دارد. فعالسازی یا بازگرداندن عملکرد این ژن، مسیرهای متابولیک و سیگنالینگ مرتبط با رشد سلولهای سرطانی را مختل میکند و میتواند تکثیر سلولهای سرطانی را به طور مؤثر محدود کند.
استفاده از RNA درمانی شامل siRNA، microRNA و shRNA نیز یکی از ابزارهای قدرتمند در ژندرمانی سلولی است. این مولکولها میتوانند آنکوژنهای فعال یا ژنهای مقاوم به درمان را خاموش کنند و مسیرهای حیاتی سلولهای سرطانی را مختل نمایند. به عنوان مثال، siRNAهای هدفمند علیه RAS یا MYC توانستهاند رشد تومور را در مدلهای آزمایشگاهی مهار کنند. RNA درمانی همچنین امکان ترکیب با بردارهای نانوذرات هدفمند را فراهم میکند تا تحویل دقیق و ایمن به سلولهای سرطانی انجام شود.
یکی دیگر از مسیرهای مهم، القای مرگ سلولی برنامهریزی شده است. ژندرمانی میتواند مسیرهای مختلف مرگ سلولی را فعال کند، از جمله آپاپتوز، نِکروپتوز و PANoptosis، که ترکیبی از چند مکانیسم مرگ سلولی است. PANoptosis به عنوان یک رویکرد نوین، توانایی فعال کردن همزمان آپاپتوز، پیروپتوز و نِکروپتوز را دارد و میتواند سلولهای سرطانی مقاوم به درمان را هدف قرار دهد. این روش به ویژه در تومورهایی که به درمانهای معمول مقاوم هستند، امیدوارکننده است.
ژندرمانی ایمنی محور نیز به افزایش توانایی بدن در شناسایی و نابودی سلولهای سرطانی میپردازد. انتقال ژنهای کدکننده فاکتورهای ایمنی مانند سیتوکینها یا گیرندههای فعالکننده سلولهای T و NK، میتواند پاسخ ایمنی ضد تومور را تقویت کند. این رویکرد، به ویژه در ترکیب با CAR-T و سایر درمانهای سلولی، موجب تقویت اثر درمانی و کاهش احتمال عود تومور میشود.
مزیت اصلی این رویکردها، هدفگیری دقیق نقاط آسیبپذیر سلولهای سرطانی و کاهش اثرات جانبی است. به جای حمله عمومی به سلولهای تقسیمشونده، ژندرمانی مبتنی بر مکانیزم سلولی، تنها مسیرهای حیاتی برای بقا و رشد تومور را مختل میکند. این امر باعث افزایش کارایی درمان، کاهش سمیت و امکان استفاده همزمان از درمانهای ترکیبی میشود.
در نهایت، ژندرمانی بر اساس مکانیزمهای سلولی خاص، بستری برای توسعه درمانهای شخصیسازی شده فراهم میآورد. با شناسایی پروفایل ژنتیکی و مسیرهای فعال در هر تومور، میتوان ترکیب مناسبی از ژنهای سرکوبگر، RNAهای درمانی و فاکتورهای ایمنی را انتخاب کرد تا اثر درمانی حداکثری با کمترین عارضه جانبی حاصل شود.
این بخش، پایه و اساس طراحی درمانهای مولکولی دقیق را توضیح داد و در بخش بعدی، به بررسی کاربردهای ژندرمانی در انواع سرطانها خواهیم پرداخت تا نشان دهیم چگونه این رویکردها در عمل، درمانهای واقعی و مؤثر برای بیماران ایجاد میکنند.
کاربردهای ژندرمانی در انواع سرطانها
ژندرمانی سرطان، به دلیل توانایی هدفگیری مسیرهای مولکولی و اصلاح اختلالات ژنتیکی، در بسیاری از انواع سرطانها کاربردهای بالینی و تحقیقاتی متنوعی یافته است. این رویکرد نه تنها میتواند رشد و تکثیر سلولهای سرطانی را مهار کند، بلکه توانایی تحریک پاسخ ایمنی بدن و افزایش حساسیت تومور به درمانهای دیگر را نیز فراهم میآورد. در ادامه، کاربرد ژندرمانی در سرطانهای مختلف به تفصیل بررسی میشود.
ژندرمانی در سرطان پستان یکی از زمینههای فعال و پیشرفته این حوزه است. سرطان پستان، به دلیل وجود گیرندههای اختصاصی مانند HER2 و مسیرهای سیگنالینگ متنوع، هدف ایدهآلی برای ژندرمانی محسوب میشود. استفاده از لیپوزومها و نانوذرات هدفمند برای رساندن ژنهای سرکوبگر تومور یا RNAهای درمانی به سلولهای HER2 مثبت، توانسته است رشد تومور را کاهش دهد و مقاومت سلولها به داروهای شیمیدرمانی را مهار کند. همچنین، ژندرمانی ایمنی محور در این نوع سرطان، با تحریک سلولهای T و NK، پاسخ ایمنی ضد تومور را افزایش داده و باعث کاهش احتمال عود بیماری میشود. مطالعات نشان دادهاند که ترکیب ژندرمانی با درمانهای هدفمند یا شیمیدرمانی سنتی، اثر سینرژیک داشته و نتایج درمانی بهتری ایجاد میکند.
در سرطانهای خون و لنفومها، ژندرمانی نقش حیاتی در اصلاح اختلالات سلولی و ارتقای پاسخ ایمنی ایفا میکند. استفاده از بردارهای ویروسی مانند لنتیویروسها و AAV برای انتقال ژنهای سرکوبگر تومور یا فاکتورهای فعالکننده سلولهای T، منجر به افزایش مرگ سلولهای سرطانی و کاهش بار تومور شده است. CAR-T سلها یکی از موفقترین نمونهها در این زمینه هستند که با مهندسی ژنتیکی سلولهای T بیمار، آنها را قادر به شناسایی و از بین بردن سلولهای سرطانی میکنند. علاوه بر این، RNA درمانی هدفمند و siRNAها نیز برای خاموش کردن آنکوژنها در سلولهای خونریزیدهنده، نتایج امیدوارکنندهای ارائه دادهاند.
سرطانهای ریه و کبد نیز از دیگر حوزههای فعال ژندرمانی هستند. در سرطان ریه غیر کوچک، هدفگیری ژنهای سرکوبگر مانند p53 و ALDH1L1، به همراه RNA درمانی، توانسته است مسیرهای رشد تومور را مختل کند و پاسخ به درمانهای استاندارد را افزایش دهد. در سرطان کبد، استفاده از بردارهای نانوذرات لیپیدی و لیپوزومهای هدفمند برای رساندن siRNA یا ژنهای سرکوبگر تومور، باعث مهار تکثیر سلولهای سرطانی و القای آپاپتوز شده است. مطالعات اخیر نشان میدهند که ترکیب این روشها با داروهای هدفمند مانند سورافنیب، اثر درمانی بهینهای ایجاد میکند و مقاومت سلولی را کاهش میدهد.
در سرطانهای گوارشی و معده، ژندرمانی با تمرکز بر مسیرهای رشد تومور و ژنهای مرتبط با آپاپتوز و متابولیسم سلولی، نتایج قابل توجهی ارائه داده است. استفاده از بردارهای ویروسی و نانوذرات حساس به محرکهای محیطی، باعث انتقال دقیق ژنها به سلولهای توموری شده و از آسیب به بافتهای سالم جلوگیری میکند. علاوه بر این، ژندرمانی ایمنی محور با افزایش فعالیت سلولهای T در بافت تومور، باعث کاهش حجم تومور و کنترل پیشرفت بیماری میشود.
کاربرد ژندرمانی در سرطانهای نادر و مقاوم نیز رو به گسترش است. مطالعات اخیر نشان دادهاند که با استفاده از ترکیب ژنهای سرکوبگر، RNA درمانی و فاکتورهای ایمنی، میتوان حتی سلولهای مقاوم به درمان را هدف قرار داد و مسیرهای رشد آنها را مختل کرد. این استراتژیها به ویژه در تومورهای متاستاتیک و مقاوم به شیمیدرمانی، امکان ایجاد درمانهای جدید و امیدوارکننده را فراهم میکنند.
مزیت اصلی استفاده از ژندرمانی در انواع سرطانها، توانایی هدفگیری مولکولی دقیق و شخصیسازی درمان است. با شناسایی پروفایل ژنتیکی تومور و انتخاب ژنها یا RNAهای مناسب، میتوان اثر درمانی حداکثری با کمترین اثرات جانبی ایجاد کرد. این امر، ژندرمانی را به یک ابزار قدرتمند در ترکیب با درمانهای مرسوم، از جمله شیمیدرمانی، رادیوتراپی و درمانهای هدفمند، تبدیل میکند.
در نهایت، کاربردهای ژندرمانی در انواع سرطانها نشان میدهد که این رویکرد نه تنها برای سرطانهای شایع مانند پستان، خون و ریه موثر است، بلکه پتانسیل درمان سرطانهای مقاوم و نادر را نیز دارد. بخش بعدی مقاله به بررسی ژندرمانی سلولی و CAR-T اختصاص دارد تا نشان دهد چگونه ژندرمانی و مهندسی سلولی میتوانند با هم ترکیب شوند و اثربخشی درمان را به حداکثر برسانند.
ژندرمانی سلولی و CAR-T
یکی از پیشرفتهترین و مؤثرترین حوزهها در درمان سرطان، ژندرمانی سلولی و استفاده از CAR-T است. این روش بر اساس مهندسی ژنتیکی سلولهای ایمنی بیمار به منظور شناسایی و تخریب سلولهای سرطانی شکل گرفته است و نشاندهنده ترکیبی از ژندرمانی و ایمونوتراپی است.
CAR-T (Chimeric Antigen Receptor T-cell) شامل سلولهای T بیمار است که در آزمایشگاه با ژنهای کدکننده گیرندههای اختصاصی تومور مهندسی شدهاند. این گیرندهها، قابلیت شناسایی آنتیژنهای سطحی سلولهای سرطانی را فراهم میکنند و باعث فعال شدن سلولهای T برای حمله به تومور میشوند. فرایند CAR-T شامل جداسازی سلولهای T از بیمار، انتقال ژن CAR به این سلولها با استفاده از بردارهای ویروسی یا غیر ویروسی، و سپس بازگرداندن آنها به بدن بیمار است. این سلولها، پس از بازگشت به بدن، به طور هدفمند سلولهای سرطانی را شناسایی و از بین میبرند.
مزیت اصلی CAR-T، هدفگیری دقیق و مؤثر سلولهای سرطانی است. این روش به ویژه در سرطانهای خون مانند لوسمی لنفوبلاستیک و میلوم چندگانه نتایج شگفتآوری داشته است. مطالعات بالینی نشان دادهاند که بیماران مبتلا به سرطانهای مقاوم به درمانهای معمول، پس از درمان با CAR-T، پاسخهای درمانی طولانیمدت و قابل توجهی نشان دادهاند. علاوه بر این، CAR-T میتواند به گونهای طراحی شود که به چند آنتیژن هدفمند باشد و احتمال فرار سلولهای سرطانی از پاسخ ایمنی را کاهش دهد.
ژندرمانی سلولی گستردهتر از CAR-T، شامل استفاده از سایر سلولهای ایمنی مانند سلولهای NK، سلولهای T تنظیمی و سلولهای بنیادی میشود. این سلولها میتوانند با مهندسی ژنتیکی برای بیان ژنهای سرکوبگر تومور، فاکتورهای ایمنی یا RNA درمانی، عملکرد ضد تومور خود را تقویت کنند. به عنوان مثال، سلولهای NK مهندسی شده قادرند سلولهای سرطانی را بدون نیاز به آنتیژن خاص هدف قرار دهند و پاسخ ایمنی طبیعی را تقویت کنند.
یکی از چالشهای ژندرمانی سلولی و CAR-T، ایمنی و عوارض جانبی است. یکی از عوارض شناخته شده، سندرم آزادسازی سیتوکین (CRS) است که به دلیل فعال شدن شدید سلولهای T ایجاد میشود و میتواند باعث تب، افت فشار خون و آسیب به اندامها شود. برای کاهش این عوارض، از روشهای مدیریتی مانند داروهای ضد التهابی و طراحی نسل جدید CAR-T با کنترل بیشتر بر فعالسازی استفاده میشود.
مزیت دیگر ژندرمانی سلولی، توانایی ترکیب با سایر درمانها است. CAR-T و سایر سلولهای مهندسی شده میتوانند همزمان با شیمیدرمانی، رادیوتراپی یا ژندرمانی RNA درمانی مورد استفاده قرار گیرند تا اثر سینرژیک ایجاد کرده و احتمال عود بیماری را کاهش دهند. همچنین، طراحی نسل جدید CAR-T، شامل گیرندههای چند هدفه و سیستمهای پاسخگو به محرکهای محیطی، باعث افزایش ایمنی و اثربخشی درمان شده است.
مطالعات اخیر نشان دادهاند که استفاده از بردارهای نانوذرات برای تحویل ژن به سلولهای ایمنی، میتواند عملکرد سلولهای CAR-T و NK را تقویت کند و پایداری ژنها در سلولها را افزایش دهد. این رویکرد ترکیبی، امکان طراحی درمانهای شخصیسازی شده و هدفمند را فراهم میکند که میتواند سلولهای مقاوم به درمان را نیز هدف قرار دهد.
به طور کلی، ژندرمانی سلولی و CAR-T، نقطه اوج پیشرفتهای ژندرمانی سرطان را نشان میدهد. این رویکرد، با ترکیب فناوری مهندسی ژنتیک، نانوذرات هدفمند و دانش بیولوژی سلولی، امکان درمان دقیق، مؤثر و شخصیسازی شده برای بیماران مبتلا به انواع سرطانها را فراهم میکند. در بخشهای بعدی، مقاله به بررسی ژندرمانی ترکیبی، استفاده همزمان از ژندرمانی و داروهای هدفمند، و استراتژیهای نوین بالینی خواهد پرداخت تا تصویری کامل از چشمانداز آینده این حوزه ارائه شود.
چالشها و مخاطرات ژندرمانی سرطان
با وجود پیشرفتهای قابل توجه در زمینه ژندرمانی سرطان، هنوز موانع و چالشهای قابل توجهی وجود دارد که محدودیتهای بالقوه این درمان را شکل میدهند و نیازمند بررسی و مدیریت دقیق هستند. شناخت کامل این چالشها، کلید توسعه ژندرمانی ایمن، مؤثر و قابل استفاده در بالین است.
یکی از مهمترین چالشها، انتقال ایمن و کارآمد ژن به سلولهای هدف است. بردارهای ویروسی مانند آدنویروسها، AAV و لنتیویروسها با وجود کارایی بالای ورود به سلولها و بیان ژن، میتوانند باعث واکنشهای ایمنی شدید شوند. پاسخ ایمنی بدن به بردارهای ویروسی ممکن است منجر به التهاب، آسیب بافتی و حتی عوارض تهدیدکننده حیات شود. به همین دلیل، توسعه بردارهای غیر ویروسی و سیستمهای نانو هدفمند، به منظور کاهش پاسخ ایمنی و افزایش ایمنی درمان، از اولویتهای مهم در این حوزه است.
پایداری و کنترل بیان ژن یکی دیگر از چالشهای اساسی است. در بسیاری از بردارهای ویروسی، ژن منتقل شده ممکن است به صورت کوتاهمدت بیان شود و نیاز به تجویز مجدد داشته باشد. همچنین، در بردارهای یکپارچهشونده مانند لنتیویروسها، احتمال جهشزایی و فعال شدن تصادفی ژنهای دیگر وجود دارد که میتواند منجر به سرطان ثانویه شود. بنابراین، ایجاد سیستمهای تحویل ژن با بیان کنترلشده و ایمن، برای تضمین اثر درمانی پایدار ضروری است.
هدفگیری دقیق سلولهای سرطانی چالش دیگری است که باید مورد توجه قرار گیرد. انتقال ژن به سلولهای سالم، میتواند عوارض جانبی جدی ایجاد کند و اثر درمانی را کاهش دهد. استفاده از بردارهای هدفمند با آنتیبادیها، لیگاندهای اختصاصی و سیستمهای پاسخگو به محرکهای محیطی، بخشی از استراتژیهای مقابله با این مشکل هستند، اما هنوز دقت کامل در انتقال ژن به سلولهای هدف نیازمند توسعه بیشتر است.
عوارض جانبی سیستمیک و ایمنی نیز یکی از مهمترین نگرانیها است. به عنوان مثال، در ژندرمانی سلولی CAR-T، سندرم آزادسازی سیتوکین (CRS) و نوروتوکسیسیتی، از جمله عوارض خطرناک گزارش شدهاند. این عوارض میتوانند نیازمند بستری فوری و درمان حمایتی باشند و مدیریت آنها چالش بالینی قابل توجهی ایجاد میکند. علاوه بر این، پاسخ ایمنی ضد بردارهای ژنی و ایجاد آنتیبادیهای خنثیکننده، میتواند اثربخشی درمان را کاهش دهد و نیاز به طراحی نسل جدید بردارها با ایمنی بالاتر را ضروری سازد.
یکی دیگر از مشکلات، محدودیت ظرفیت انتقال ژن در برخی بردارها است. به عنوان مثال، ویروسهای AAV توانایی انتقال ژنهای بزرگ را ندارند و این محدودیت ممکن است کاربرد آنها را در برخی سرطانها که نیازمند انتقال ژنهای طولانی یا چند ژنی هستند، محدود کند. به همین دلیل، توسعه بردارهای ترکیبی، نانوذرات یا سیستمهای چند هدفه، یکی از استراتژیهای مقابله با این محدودیت است.
چالشهای اقتصادی و تولید صنعتی نیز بخشی از موانع پیش روی ژندرمانی هستند. تولید بردارهای ویروسی یا نانوذرات هدفمند با استانداردهای GMP و در مقیاس بزرگ، پیچیده و هزینهبر است. علاوه بر این، فرایند مهندسی سلولها، به ویژه در ژندرمانی سلولی مانند CAR-T، نیازمند زمان، تجهیزات پیشرفته و تیمهای متخصص است که میتواند دسترسی بیماران به درمان را محدود کند.
در نهایت، چالشهای اخلاقی و نظارتی نیز باید در نظر گرفته شوند. ژندرمانی شامل دستکاری ژنتیکی سلولها است و احتمال ایجاد اثرات غیرقابل پیشبینی وجود دارد. بنابراین، رعایت استانداردهای اخلاقی، پیروی از مقررات بینالمللی و انجام مطالعات بالینی دقیق، برای تضمین ایمنی و اثر درمانی لازم است.
با وجود تمام این چالشها، پیشرفتهای اخیر در نانوتکنولوژی، مهندسی بردار، ژندرمانی سلولی و طراحی ژنهای هدفمند، نویدبخش حل بسیاری از این محدودیتها هستند. مطالعات ترکیبی و توسعه فناوریهای پاسخگو به محیط، امکان افزایش دقت، کاهش عوارض جانبی و بهبود پایداری ژندرمانی را فراهم میکنند.
در بخش بعدی، مقاله به پیشرفتهای بالینی و آینده ژندرمانی سرطان میپردازد تا چشمانداز عملی و نوآورانه این درمان را در محیط بالینی بررسی کند و راهکارهای احتمالی برای غلبه بر چالشها ارائه دهد.
موارد موفقیت بالینی و محصولات تایید شده
یکی از نقاط عطف در ژندرمانی سرطان، دستیابی به موفقیتهای بالینی و ثبت محصولات تایید شده توسط سازمانهای نظارتی است. این موفقیتها نشان میدهند که ژندرمانی نه تنها در سطح تحقیقاتی بلکه در محیط بالینی نیز توانسته است تأثیر واقعی بر روند درمان بیماران داشته باشد و محدودیتهای پیشین را تا حدی برطرف کند.
یکی از برجستهترین نمونهها، ژندرمانی سلولی CAR-T است که در درمان برخی سرطانهای خون موفقیتهای چشمگیری داشته است. محصولاتی مانند Kymriah (tisagenlecleucel) و Yescarta (axicabtagene ciloleucel) توسط FDA تأیید شدهاند و برای درمان بیماران مبتلا به لوسمی لنفوبلاستیک و لنفوم غیر هوچکین مورد استفاده قرار میگیرند. این درمانها، با مهندسی ژنتیکی سلولهای T بیمار برای شناسایی آنتیژنهای خاص سلولهای سرطانی، توانستهاند نرخ پاسخهای درمانی طولانیمدت و کاهش قابل توجه حجم تومور را ایجاد کنند. مطالعات بالینی نشان دادهاند که بسیاری از بیماران مقاوم به شیمیدرمانی یا درمانهای استاندارد، پس از دریافت CAR-T، به پاسخ کامل یا نسبی دست یافتهاند.
علاوه بر CAR-T، بردارهای ویروسی مورد تایید نیز در درمان برخی سرطانها مورد استفاده قرار گرفتهاند. به عنوان مثال، استفاده از ویروسهای اصلاحشده آدنو یا HSV-1 (herpes simplex virus) برای انتقال ژنهای سرکوبگر تومور یا عوامل ایمنی، در برخی سرطانهای جامد مورد تایید قرار گرفته است. این محصولات با القای پاسخ ایمنی ضد تومور و القای آپاپتوز در سلولهای سرطانی، موفقیتهای بالینی اولیه را نشان دادهاند و مسیر را برای توسعه بردارهای ویروسی هدفمندتر و ایمنتر هموار کردهاند.
یکی دیگر از موفقیتهای مهم، استفاده از RNA درمانی و siRNA هدفمند است. محصولات بالینی حاوی siRNA توانستهاند بیان آنکوژنهای خاص در سرطانهای خون و جامد را مهار کنند و پاسخ درمانی قابل توجهی ایجاد نمایند. ترکیب این درمانها با نانوذرات هدفمند و بردارهای پاسخگو به محیط، دقت تحویل ژن را افزایش داده و از آسیب به سلولهای سالم جلوگیری کرده است.
تجارب موفق در ژندرمانی سرطانهای خون، ریه و پستان نیز نشان میدهد که شخصیسازی درمان و هدفگیری مولکولی، کلید موفقیت در ژندرمانی بالینی است. بیماران با پروفایل ژنتیکی خاص و آنتیژنهای مشخص، بیشترین پاسخ درمانی را نشان دادهاند. این رویکردها نشان میدهند که ژندرمانی، به ویژه زمانی که با درمانهای استاندارد یا هدفمند ترکیب شود، میتواند اثربخشی درمان را به طور چشمگیری افزایش دهد.
موفقیتهای بالینی اخیر، ایجاد استانداردهای تولید و کنترل کیفیت بردارها و سلولهای مهندسی شده را نیز به همراه داشتهاند. رعایت استانداردهای GMP، بررسی دقیق پایداری ژن و ایمنی سلولها، و ارزیابی پاسخ ایمنی بیماران، از جمله اقداماتی هستند که امکان استفاده بالینی ایمن و مؤثر ژندرمانی را فراهم کردهاند.
در نهایت، این موفقیتها نشان میدهند که ژندرمانی سرطان از یک روش تجربی و آزمایشگاهی، به درمانهای بالینی واقعی و مورد تأیید تبدیل شده است. محصولات تایید شده نه تنها توانستهاند زندگی بیماران مقاوم به درمانهای مرسوم را بهبود دهند، بلکه مسیر توسعه نسلهای بعدی ژندرمانی، از جمله بردارهای ویروسی اصلاحشده، نانوذرات هدفمند و سلولهای مهندسی شده با قابلیت چند هدفه، را هموار کردهاند.
این بخش پایه و شواهد بالینی ژندرمانی را توضیح داد و در بخش بعدی، مقاله به چشمانداز آینده ژندرمانی سرطان و مسیرهای تحقیقاتی نوین خواهد پرداخت تا تصویری کامل از فرصتها و مسیرهای پیش رو ارائه شود.
چشمانداز آینده ژندرمانی در سرطان
با توجه به موفقیتهای بالینی و پیشرفتهای فناوری در حوزه ژندرمانی سرطان، آینده این حوزه نویدبخش توسعه درمانهای دقیق، شخصیسازی شده و ایمنتر است. پیشرفتهای اخیر در نانوذرات هدفمند، مهندسی بردارهای ویروسی، RNA درمانی و ژندرمانی سلولی، نشاندهنده مسیر روشنی برای افزایش اثربخشی و کاهش عوارض جانبی این درمانها هستند.
یکی از مهمترین روندهای آینده، توسعه درمانهای شخصیسازی شده است. با استفاده از پروفایل ژنتیکی و مولکولی تومور هر بیمار، میتوان ترکیب دقیقی از ژنهای سرکوبگر تومور، RNA درمانی و فاکتورهای ایمنی را انتخاب کرد. این رویکرد نه تنها اثربخشی درمان را افزایش میدهد، بلکه احتمال عوارض جانبی ناشی از حمله به سلولهای سالم را کاهش میدهد. تکنولوژیهای نوین توالییابی و شناسایی آنکوژنها، پایه و اساس طراحی چنین درمانهایی را فراهم میکنند.
ژندرمانی ترکیبی و چندهدفه نیز یکی دیگر از محورهای مهم آینده است. ترکیب ژندرمانی با شیمیدرمانی، رادیوتراپی، درمانهای هدفمند و ایمونوتراپی میتواند اثر سینرژیک ایجاد کند و مقاومت سلولهای سرطانی را کاهش دهد. به عنوان مثال، استفاده از CAR-T همراه با RNA درمانی هدفمند یا فاکتورهای فعالکننده ایمنی، امکان از بین بردن سلولهای مقاوم به درمانهای استاندارد را فراهم میکند.
پیشرفت در بردارهای نانوذرات و سیستمهای تحویل هدفمند نیز نقش حیاتی در آینده ژندرمانی ایفا میکند. بردارهای نانو با قابلیت پاسخ به محرکهای محیطی مانند pH، آنزیمها و گرما، میتوانند ژنها یا RNA درمانی را به طور دقیق به سلولهای سرطانی منتقل کنند و از آسیب به بافتهای سالم جلوگیری نمایند. این فناوریها همچنین امکان رساندن همزمان چند ژن یا ترکیبی از ژن و دارو را فراهم میکنند، که میتواند اثربخشی درمان را به طور چشمگیری افزایش دهد.
ژندرمانی سلولی نسل بعدی نیز در حال تحول است. طراحی نسلهای جدید CAR-T با قابلیت چند هدفه، کنترل بهتر بر فعالسازی و کاهش عوارض جانبی، افقهای جدیدی را در درمان سرطانهای مقاوم و متاستاتیک باز میکند. علاوه بر CAR-T، سلولهای NK و سایر سلولهای ایمنی مهندسی شده، به عنوان گزینههای تکمیلی یا جایگزین، در حال توسعه هستند و پتانسیل ایجاد درمانهای ترکیبی و مؤثر را دارند.
استفاده از فناوریهای نوین ژن و RNA، از جمله CRISPR-Cas و RNAهای غیر کدکننده، امکان اصلاح دقیق ژنهای سرطانی و فعالسازی مسیرهای سرکوبگر تومور را فراهم میآورد. این رویکردها، با کاهش اثرات جانبی و افزایش دقت هدفگیری، میتوانند درمانهای نسل بعدی ژندرمانی را شکل دهند و امکان مقابله با سلولهای مقاوم به درمانهای مرسوم را فراهم کنند.
یکی دیگر از چشماندازهای مهم، توسعه استانداردهای بالینی و مقرراتی برای ژندرمانی است. ایجاد دستورالعملهای دقیق برای تولید، کنترل کیفیت و استفاده بالینی، میتواند اعتماد بیماران و پزشکان را افزایش دهد و مسیر استفاده گستردهتر از ژندرمانی را هموار کند.
در نهایت، آینده ژندرمانی سرطان به سمت درمانهای دقیق، شخصیسازی شده، ایمن و ترکیبی حرکت میکند. با ادغام فناوریهای نوین، ژندرمانی میتواند نه تنها جایگزینی برای درمانهای مرسوم باشد، بلکه مکملی قوی برای افزایش اثربخشی شیمیدرمانی، رادیوتراپی و ایمونوتراپی فراهم کند. این رویکردها نویدبخش نسل جدیدی از درمانهای سرطان هستند که با هدف کاهش مقاومت تومور، افزایش پاسخ ایمنی و بهبود کیفیت زندگی بیماران، تحولی واقعی در مراقبتهای بالینی ایجاد خواهند کرد.
جمعبندی
ژندرمانی سرطان به عنوان یکی از پیشرفتهترین و امیدوارکنندهترین رویکردهای درمانی در دهههای اخیر، تحول قابل توجهی در نحوه برخورد با تومورها ایجاد کرده است. این حوزه، با هدف اصلاح اختلالات ژنتیکی، مهندسی سلولهای ایمنی و ارائه درمانهای هدفمند، توانسته است محدودیتهای درمانهای سنتی مانند شیمیدرمانی و رادیوتراپی را تا حد زیادی کاهش دهد و مسیر درمان دقیق و شخصیسازی شده را هموار کند.
مبانی ژندرمانی نشان داد که سرطان، در بسیاری از موارد، نتیجه اختلال در مسیرهای ژنتیکی و سیگنالینگ سلولی است و هدفگیری مستقیم این مسیرها میتواند رشد و تکثیر تومور را مهار کند. با پیشرفت فناوریهای برداری و روشهای انتقال ژن، امکان تحویل دقیق و مؤثر ژنها به سلولهای سرطانی فراهم شده است و از آسیب به سلولهای سالم جلوگیری میکند.
بردارهای ژندرمانی و روشهای انتقال ژن، شامل بردارهای ویروسی و غیر ویروسی، نانوذرات لیپیدی، لیپوزومها و سیستمهای پاسخگو به محرکهای محیطی، پایهای برای موفقیتهای بالینی هستند. این بردارها، امکان انتقال ژنهای سرکوبگر تومور، RNAهای درمانی و فاکتورهای ایمنی را به سلولهای هدف فراهم میکنند و اثربخشی درمان را افزایش میدهند.
تحویل هدفمند ژن به سلولهای سرطانی و توسعه بردارهای حساس به محیط، امکان شناسایی دقیق سلولهای سرطانی و کاهش عوارض جانبی را فراهم کرده است. این امر، به ویژه در سرطانهای مقاوم و متاستاتیک، اهمیت حیاتی دارد و میتواند کیفیت زندگی بیماران را بهبود بخشد.
ژندرمانی بر اساس مکانیزمهای سلولی خاص، شامل القای آپاپتوز، مهار آنکوژنها، اصلاح مسیرهای سیگنالینگ و فعالسازی پاسخ ایمنی، نشان داده است که رویکردهای مولکولی دقیق، میتوانند اثرات درمانی قابل توجهی ایجاد کنند. این روشها، به طور مستقیم مسیر رشد تومور را مختل کرده و احتمال عود بیماری را کاهش میدهند.
کاربردهای ژندرمانی در انواع سرطانها، از سرطان پستان و خون تا سرطانهای ریه، کبد و گوارش، موفقیتهای چشمگیری داشتهاند. استفاده از نانوذرات هدفمند، RNA درمانی و ژندرمانی سلولی، امکان شخصیسازی درمان بر اساس پروفایل ژنتیکی بیمار را فراهم کرده و به کاهش مقاومت به درمانهای مرسوم کمک میکند.
ژندرمانی سلولی و CAR-T، نقطه اوج پیشرفتهای ژندرمانی محسوب میشود. مهندسی سلولهای T و NK برای شناسایی و از بین بردن سلولهای سرطانی، همراه با کنترل دقیق فعالسازی و کاهش عوارض جانبی، نمونهای برجسته از ترکیب ژندرمانی و ایمونوتراپی است. موفقیتهای بالینی CAR-T در سرطانهای خون، نشاندهنده ظرفیت ژندرمانی برای ایجاد پاسخهای درمانی طولانیمدت و پایدار است.
با وجود تمام پیشرفتها، چالشها و مخاطرات ژندرمانی، از جمله پاسخ ایمنی، عوارض جانبی، محدودیت ظرفیت بردارها، هدفگیری دقیق و مسائل اقتصادی و اخلاقی، نیازمند توجه و مدیریت دقیق هستند. توسعه نسلهای جدید بردارها، نانوذرات هدفمند و فناوریهای پاسخگو به محیط، مسیر حل این مشکلات را هموار کرده است و نویدبخش افزایش ایمنی و اثربخشی درمان است.
موارد موفقیت بالینی و محصولات تایید شده، از جمله CAR-T و بردارهای ویروسی مورد تأیید، نشان میدهند که ژندرمانی اکنون نه تنها در سطح تحقیقاتی بلکه در محیط بالینی نیز اثربخش است. این موفقیتها، مسیر توسعه نسل بعدی درمانهای ژندرمانی، شامل ترکیب ژندرمانی با درمانهای هدفمند، RNA درمانی و سلولهای مهندسی شده را هموار کردهاند.
چشمانداز آینده ژندرمانی سرطان، شامل درمانهای شخصیسازی شده، ژندرمانی ترکیبی، استفاده از نانوذرات هدفمند، نسلهای جدید CAR-T و RNA درمانی پیشرفته است. این رویکردها، پتانسیل ایجاد درمانهای دقیق، ایمن و مؤثر را دارند و میتوانند مسیر درمان سرطان را متحول کنند.
در جمعبندی نهایی، ژندرمانی سرطان، با ترکیب دانش ژنتیک، بیولوژی سلولی، مهندسی بردارها و فناوریهای نوین، یک انقلاب در درمان سرطان به وجود آورده است. این حوزه، امکان درمانهای شخصیسازی شده، کاهش مقاومت سلولهای سرطانی، افزایش پاسخ ایمنی و بهبود کیفیت زندگی بیماران را فراهم میآورد و به عنوان یکی از مهمترین دستاوردهای پزشکی مدرن شناخته میشود.