سرطانشناسی
مقدمهای بر سرطانشناسی
سرطانشناسی یا انکولوژی شاخهای از علم پزشکی است که به مطالعه، پیشگیری، تشخیص و درمان سرطان اختصاص دارد. این علم نهتنها یکی از پیشرفتهترین حوزههای پزشکی مدرن محسوب میشود، بلکه از نظر اجتماعی، اقتصادی و انسانی نیز جایگاهی بیبدیل دارد. با توجه به اینکه سرطان دومین علت مرگومیر در سراسر جهان شناخته میشود و روند رو به رشد آن در کشورهای در حال توسعه نیز بسیار نگرانکننده است، توجه به دانش سرطانشناسی اهمیت روزافزونی پیدا کرده است.
از دیدگاه تاریخی، درک انسان از سرطان به دوران باستان بازمیگردد. بقراط، پزشک یونانی، برای نخستینبار واژه «کارسینوس» را برای توصیف تودههای سخت و غیرقابل درمان به کار برد. این واژه بعدها پایهای برای اصطلاح امروزی «کارسینوم» شد. در طول قرون وسطی و دوران رنسانس، سرطان بهعنوان بیماریای مرموز و غیرقابل توضیح شناخته میشد و درمانهای محدودی برای آن وجود داشت. اما با پیشرفت میکروسکوپی در قرن نوزدهم و کشف اصول پاتولوژی توسط رودولف ویرشو، نخستین گامهای جدی برای شناسایی منشاء سلولی سرطان برداشته شد. این تحولات علمی سرآغاز شکلگیری رشتهای مستقل با عنوان «انکولوژی» بود.
در عصر حاضر، سرطانشناسی ترکیبی از علوم مختلف از جمله زیستشناسی مولکولی، ژنتیک، ایمنیشناسی، تصویربرداری پزشکی و فناوریهای دادهمحور است. این تنوع میانرشتهای نشان میدهد که سرطان صرفاً یک بیماری واحد نیست، بلکه مجموعهای پیچیده از اختلالات سلولی است که میتواند هر بافت و اندامی را درگیر کند. همین ویژگی سبب شده که رویکردهای تشخیصی و درمانی بسیار متنوعی برای آن شکل گیرد و پزشکان و پژوهشگران بهطور مداوم در حال کشف روشهای جدید باشند.
اهمیت سرطانشناسی در پزشکی مدرن تنها به دلیل شیوع بالای این بیماری نیست، بلکه بهخاطر پیامدهای گسترده آن بر کیفیت زندگی بیماران و خانوادههایشان نیز میباشد. سرطان صرفاً یک چالش بیولوژیک نیست، بلکه بار روانی، اجتماعی و اقتصادی سنگینی را نیز به همراه دارد. بسیاری از بیماران در مسیر درمان با مشکلاتی چون افسردگی، اضطراب، انزوای اجتماعی و فشارهای مالی مواجه میشوند. از اینرو، سرطانشناسی امروز فراتر از مطالعه سلولها و ژنهاست و به جنبههای انسانی و حمایتی بیماران نیز توجه ویژه دارد.
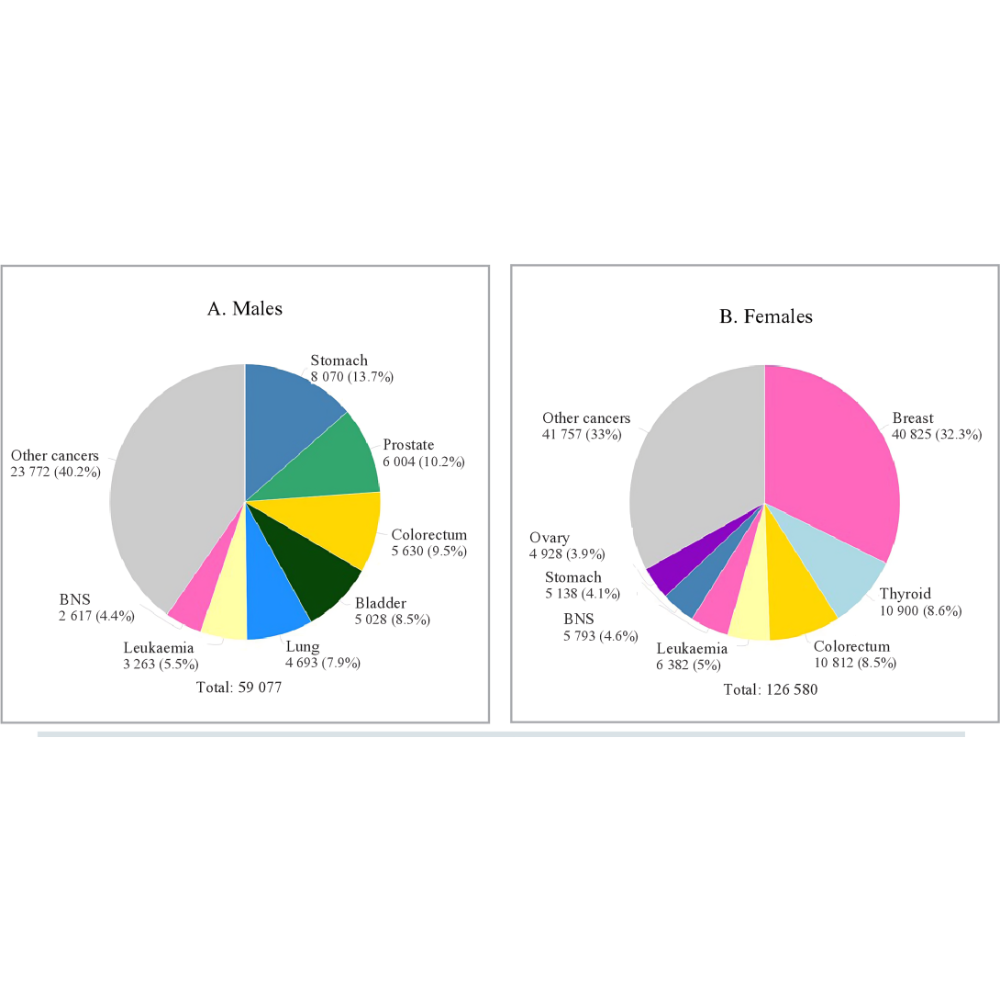
از منظر اپیدمیولوژیک، آمارها حاکی از آن است که هر سال بیش از ۱۹ میلیون مورد جدید سرطان در جهان تشخیص داده میشود و نزدیک به ۱۰ میلیون نفر جان خود را بهدلیل ابتلا به این بیماری از دست میدهند. این ارقام نشاندهنده ابعاد وسیع بحران جهانی سرطان است. در ایران نیز، با توجه به تغییر الگوی زندگی، افزایش امید به زندگی و پیر شدن جمعیت، میزان بروز سرطان رو به افزایش است. بررسیهای ملی نشان میدهد که سرطانهای دستگاه گوارش، پستان و پروستات از شایعترین انواع در کشور بهشمار میروند. چنین دادههایی اهمیت سیاستگذاریهای بهداشتی و تقویت زیرساختهای درمانی را دوچندان میکند.
یکی دیگر از جنبههای مهم درک مقدمهای بر سرطانشناسی، توجه به ماهیت چندوجهی این بیماری است. برخلاف بیماریهای عفونی که معمولاً یک عامل مشخص مانند ویروس یا باکتری دارند، سرطان محصول مجموعهای پیچیده از عوامل است. ژنتیک فردی، سبک زندگی، رژیم غذایی، تماس با عوامل محیطی مانند مواد شیمیایی یا پرتوها، و حتی وضعیت روانی و اجتماعی میتوانند در ایجاد یا پیشرفت سرطان نقش داشته باشند. این چندعاملی بودن سرطان باعث شده که رویکرد درمانی آن نیز چندجانبه و ترکیبی باشد. به همین دلیل، درمان بیماران معمولاً به همکاری نزدیک بین جراحان، انکولوژیستها، رادیوتراپیستها، پاتولوژیستها، روانشناسان و متخصصان تغذیه نیاز دارد.
از سوی دیگر، پیشرفتهای چشمگیر در حوزههایی مانند پزشکی دقیق و ایمنیدرمانی مسیرهای جدیدی را در انکولوژی گشودهاند. برای مثال، در گذشته شیمیدرمانی بهصورت کلی و بدون توجه به ویژگیهای ژنتیکی بیمار انجام میشد، اما امروزه با بهرهگیری از توالییابی ژنوم و فارماکوژنومیک، میتوان درمانها را متناسب با خصوصیات منحصربهفرد هر فرد طراحی کرد. همین تحول، امید تازهای برای بهبود نتایج درمانی و کاهش عوارض جانبی به بیماران داده است.
با نگاهی کلان، میتوان گفت که مقدمه بر سرطانشناسی صرفاً یک پیشگفتار برای ورود به مباحث پیچیدهتر است. این حوزه علمی در حال حاضر در نقطه عطفی تاریخی قرار دارد؛ جایی که فناوریهای نوینی همچون هوش مصنوعی، یادگیری ماشین و مدلهای زبانی بزرگ به کمک انکولوژی آمدهاند تا تشخیص دقیقتر، درمانهای کارآمدتر و پیشبینی بهتر آینده بیماری را ممکن سازند. همچنین، پژوهشهای گسترده در زمینه تغذیه، سبک زندگی و رواندرمانی نشان میدهد که مدیریت سرطان باید بهصورت جامع و فراگیر باشد و صرفاً محدود به دارو یا جراحی نشود.
بهطور خلاصه، سرطانشناسی نهتنها به درک مکانیزمهای زیستی سرطان کمک میکند، بلکه چارچوبی برای طراحی استراتژیهای پیشگیرانه، تشخیصی و درمانی فراهم میآورد. اهمیت آن در این است که پلی میان علم و انسانیت میسازد؛ پلی که هدف نهایی آن ارتقای سلامت، افزایش طول عمر و بهبود کیفیت زندگی بیماران است. بنابراین، آشنایی با مبانی و چشماندازهای سرطانشناسی نخستین گام برای درک بهتر این علم گسترده و پویاست.

زیستشناسی سرطان
زیستشناسی سرطان شاخهای بنیادی در انکولوژی است که به بررسی سازوکارهای سلولی و مولکولی منجر به ایجاد، پیشرفت و گسترش تومورها میپردازد. درک این فرآیندها نهتنها برای تشخیص و درمان موثر سرطان حیاتی است، بلکه مسیر توسعه درمانهای نوین و هدفمند را نیز هموار میکند. سرطان برخلاف بسیاری از بیماریها، یک پدیده یکنواخت و ساده نیست، بلکه محصول اختلالات پیچیده در شبکههای سیگنالی، ژنومی و ایمنی بدن است.
اساس شکلگیری سرطان با اختلال در چرخه طبیعی تقسیم سلولی آغاز میشود. در شرایط عادی، سلولها از یک برنامه دقیق تکثیر و مرگ سلولی پیروی میکنند که از طریق ژنها، پروتئینها و مسیرهای پیامرسان تنظیم میشود. این نظم برای حفظ هموستاز بافتی و جلوگیری از رشد بیرویه حیاتی است. هنگامی که این تعادل در نتیجه جهشهای ژنی یا اختلالات اپیژنتیک از بین میرود، سلولها کنترل چرخه رشد خود را از دست داده و به سمت تکثیر بیپایان پیش میروند. یکی از ویژگیهای کلیدی سلولهای سرطانی، توانایی فرار از مکانیسمهای تنظیمی مرگ برنامهریزیشده یا آپوپتوز است. این قابلیت به آنها اجازه میدهد حتی در شرایطی که آسیبهای جدی در DNA وجود دارد، همچنان به بقای خود ادامه دهند.
از منظر ژنتیکی، جهشها در دو گروه اصلی از ژنها بیشترین نقش را در سرطان دارند: آنکوژنها و ژنهای سرکوبگر تومور. آنکوژنها نسخههای جهشیافته ژنهای طبیعی به نام پروتوانکوژنها هستند که در حالت عادی فرآیند رشد سلول را تنظیم میکنند. وقتی این ژنها دچار جهش یا فعالسازی غیرطبیعی میشوند، سیگنالهای تکثیر سلولی را بدون توقف صادر میکنند. در مقابل، ژنهای سرکوبگر تومور مانند TP53، RB1 یا BRCA1 و BRCA2 نقش مهارکننده رشد و محافظت از ژنوم را بر عهده دارند. غیرفعال شدن این ژنها به معنای حذف ترمزهای طبیعی چرخه سلولی است و همین امر به سلولهای سرطانی اجازه میدهد بدون هیچ محدودیتی رشد کنند.
جهشهای ژنتیکی به تنهایی برای توضیح همه جنبههای سرطان کافی نیستند. تغییرات اپیژنتیکی نیز نقشی اساسی دارند. این تغییرات شامل متیلاسیون DNA، تغییرات هیستونی و تنظیم بیان ژن توسط RNAهای غیرکدکننده است که بدون تغییر توالی DNA رخ میدهند. چنین تغییراتی میتوانند ژنهای سرکوبگر تومور را خاموش کرده یا بیان آنکوژنها را تقویت کنند. ویژگی جالب تغییرات اپیژنتیکی این است که برخلاف جهشهای ژنی، در برخی موارد برگشتپذیر هستند، و همین موضوع فرصتهای درمانی جدیدی را ایجاد کرده است.
مسیرهای سیگنالی درونسلولی نیز از دیگر محورهای اصلی زیستشناسی سرطان به شمار میروند. مسیرهایی مانند PI3K/AKT/mTOR، RAS/RAF/MEK/ERK و Wnt/β-catenin در بسیاری از سرطانها بیشفعال میشوند. این مسیرها مسئول ارسال پیامهای تکثیر، بقا و مهاجرت سلولی هستند و هرگونه اختلال در آنها میتواند تعادل سلول را بر هم بزند. به همین دلیل، بسیاری از داروهای نوین ضدسرطان بهطور اختصاصی برای مهار این مسیرها طراحی شدهاند. هدف قرار دادن این مسیرها به معنای ضربه زدن به موتور محرک رشد سلولهای سرطانی است.
یکی از جنبههای مهم در زیستشناسی سرطان، درک پدیده آنژیوژنز توموری یا همان رگزایی جدید است. برای آنکه تومورها بتوانند بیش از چند میلیمتر رشد کنند، نیاز به تأمین اکسیژن و مواد غذایی از طریق رگهای خونی جدید دارند. سلولهای سرطانی با ترشح فاکتورهایی مانند VEGF باعث تحریک رشد رگهای تازه میشوند. این رگهای جدید اغلب نابالغ و غیرمنظم هستند که خود به گسترش تومور و حتی تسهیل متاستاز کمک میکند. همین کشف، مبنای توسعه داروهای ضدآنژیوژنیک مانند بواسیزوماب شد که امروزه در درمان برخی سرطانها به کار میروند.
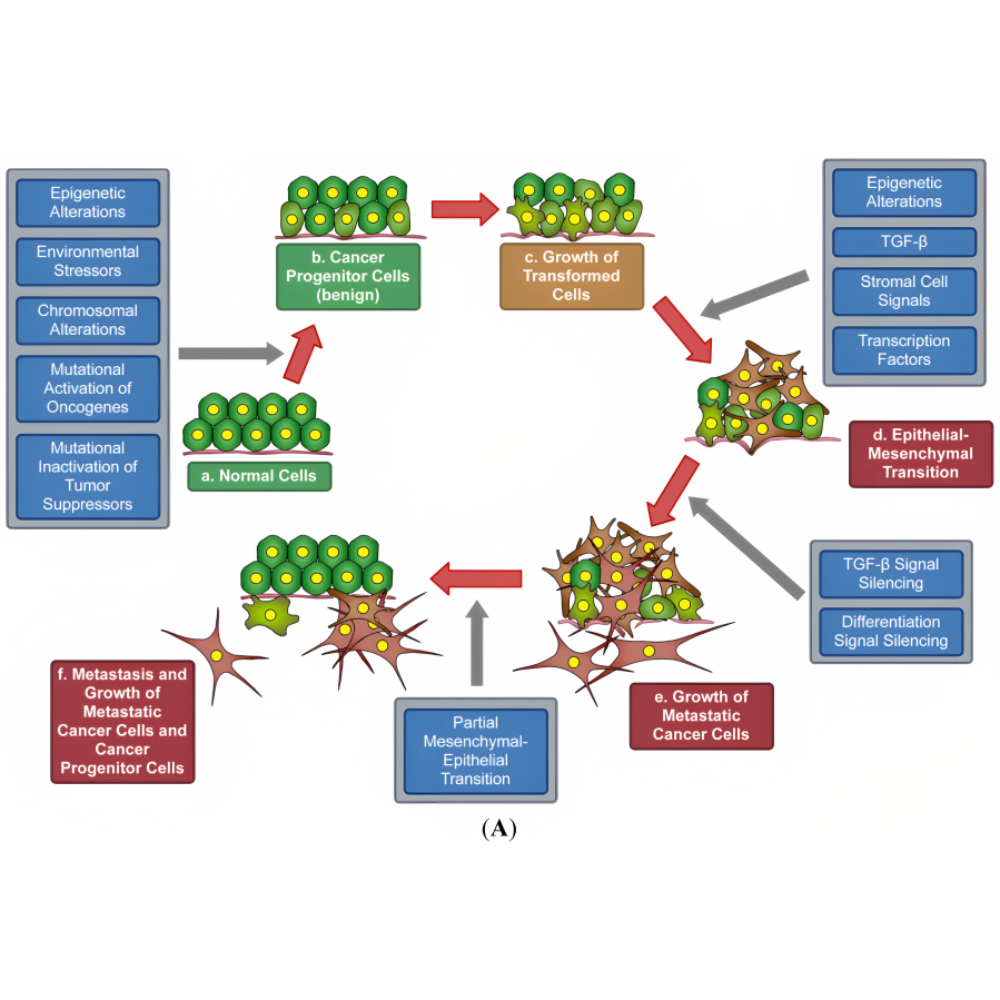
پدیده متاستاز یکی دیگر از ویژگیهای اساسی سلولهای سرطانی است که زیستشناسی سرطان را پیچیدهتر میکند. متاستاز فرآیندی چندمرحلهای است که طی آن سلولهای توموری از محل اولیه جدا شده، به جریان خون یا لنف وارد میشوند و در اندامهای دوردست مستقر میگردند. برای این کار، سلولها باید از سدهای فیزیکی و ایمنی متعددی عبور کنند. یکی از مکانیسمهای کلیدی در این فرآیند، تغییر فنوتیپ سلولهای اپیتلیالی به حالت مزانشیمی است که به آن EMT یا گذار اپیتلیال-مزانشیمی گفته میشود. این تغییر باعث افزایش تحرک، تهاجم و مقاومت سلولها در برابر آپوپتوز میشود.
در کنار مکانیسمهای مولکولی، تعامل سرطان با سیستم ایمنی بدن اهمیت ویژهای دارد. در حالت طبیعی، سلولهای ایمنی مانند لنفوسیتهای T و سلولهای کشنده طبیعی (NK) میتوانند سلولهای غیرطبیعی را شناسایی و نابود کنند. اما سلولهای سرطانی با مکانیسمهایی نظیر بیان پروتئینهای مهارکننده ایمنی مانند PD-L1 یا ترشح فاکتورهای سرکوبگر، توانایی فرار از سیستم ایمنی را پیدا میکنند. این پدیده موسوم به فرار ایمنی، یکی از دلایل اصلی تداوم و پیشرفت سرطان است. به همین دلیل، ایمونوتراپی یا ایمنیدرمانی یکی از انقلابیترین رویکردهای درمانی در دهه اخیر بوده است.
زیستشناسی سرطان همچنین بر نقش میکرو محیط تومور تاکید دارد. تومور تنها مجموعهای از سلولهای جهشیافته نیست، بلکه محیط اطراف آن شامل فیبروبلاستها، سلولهای ایمنی، رگهای خونی و ماتریکس خارجسلولی نیز در پیشرفت بیماری نقش دارند. این میکرو محیط میتواند با ترشح سیگنالها، تغییر متابولیسم و بازسازی بافتی، بقای سلولهای سرطانی را تقویت کند. بنابراین، بسیاری از پژوهشهای جدید به جای تمرکز صرف بر خود سلولهای سرطانی، به دنبال هدف قرار دادن اجزای میکرو محیط تومور هستند.
نکتهای دیگر که در سالهای اخیر توجه زیادی را جلب کرده، نقش متابولیسم سلولی در سرطان است. سلولهای سرطانی اغلب ترجیح میدهند انرژی خود را از طریق گلیکولیز بیهوازی حتی در حضور اکسیژن تأمین کنند، پدیدهای که به نام اثر واربورگ شناخته میشود. این تغییر متابولیکی نهتنها نیازهای انرژی سلولهای سرطانی را تأمین میکند، بلکه مواد خام لازم برای سنتز بیومولکولهای جدید را نیز فراهم میسازد. همین ویژگی باعث شده که مهار مسیرهای متابولیکی بهعنوان یک استراتژی درمانی نوظهور مطرح شود.
در نهایت باید گفت، زیستشناسی سرطان تلاشی است برای رمزگشایی از شبکهای پیچیده و پویا که شامل ژنوم، پروتئوم، اپیژنوم، ایمنیشناسی و تعاملات محیطی میشود. شناخت این لایههای مختلف نهتنها به توضیح چرایی شکلگیری سرطان کمک میکند، بلکه مسیرهایی نوین برای درمانهای اختصاصی و هوشمند فراهم میآورد. درک این مفاهیم زیربنای بسیاری از پیشرفتهای آینده در سرطانشناسی خواهد بود و به ما امکان میدهد بیماریای که قرنها بهعنوان معمایی غیرقابل حل شناخته میشد، گامبهگام تحت کنترل قرار گیرد.

طبقهبندی سرطانها
طبقهبندی سرطانها یکی از مباحث بنیادی در مطالعات سرطانشناسی است، زیرا شناخت دقیق انواع مختلف سرطان و ویژگیهای آنها، اساس تشخیص صحیح، انتخاب روشهای درمانی مناسب و همچنین پیشبینی سیر بیماری را فراهم میکند. سرطانها به دلیل تنوع گسترده در محل ایجاد، نوع سلول مبدأ، سرعت رشد، رفتارهای بالینی و حتی پاسخ به درمان، نیازمند یک نظام دقیق برای دستهبندی هستند. این طبقهبندی نهتنها در سطح نظری و پژوهشی اهمیت دارد، بلکه در حوزه بالینی نیز نقشی کلیدی در تصمیمگیریهای پزشکی ایفا میکند.
به طور کلی، طبقهبندی سرطانها بر پایه چند معیار مختلف صورت میگیرد. یکی از مهمترین معیارها نوع بافت یا سلول مبدأ است. در این دستهبندی، سرطانها بر اساس سلولهایی که از آن منشأ میگیرند گروهبندی میشوند. به عنوان مثال، سرطانهای اپیتلیالی که از سلولهای پوشاننده سطح اندامها و بافتها ایجاد میشوند، بیشترین شیوع را دارند و نمونه بارز آنها کارسینومها هستند. کارسینومها میتوانند در اندامهای مختلفی مانند ریه، معده، روده بزرگ، پستان و پروستات ایجاد شوند. در مقابل، سرطانهایی که از سلولهای بافت همبند مانند استخوان، غضروف و عضلات منشأ میگیرند، به نام سارکومها شناخته میشوند. این نوع سرطانها اگرچه شیوع کمتری نسبت به کارسینومها دارند، اما اغلب مهاجمتر و تهاجمیتر هستند.
دسته دیگری از سرطانها، لوسمیها هستند که در سلولهای خونی و مغز استخوان بروز پیدا میکنند. در این بیماری، تولید غیرطبیعی و بیرویه سلولهای خونی باعث اختلال در عملکرد طبیعی خون میشود. همچنین، سرطانهایی که سیستم ایمنی بدن و سلولهای لنفاوی را درگیر میکنند، تحت عنوان لنفومها شناخته میشوند. این گروه خود شامل انواع متعددی از جمله لنفوم هوچکین و لنفوم غیرهوچکین است که از نظر بالینی، علائم و پاسخ به درمان تفاوتهای چشمگیری دارند. افزون بر این، دستهای از سرطانها به نام ملانومها وجود دارند که از سلولهای تولیدکننده رنگدانه پوست یا همان ملانوسیتها آغاز میشوند و معمولاً با تغییرات غیرعادی در خالها یا لکههای پوستی شناسایی میگردند.
علاوه بر طبقهبندی بر اساس سلول مبدأ، سرطانها را میتوان بر اساس محل ایجاد یا اندام درگیر نیز دستهبندی کرد. در این نوع تقسیمبندی، سرطانها به صورت اختصاصی به نام اندامی که در آن بروز میکنند شناخته میشوند. برای نمونه، سرطان ریه، سرطان معده، سرطان پستان و سرطان کبد، هر یک ویژگیها و الگوهای پیشرفت مخصوص به خود را دارند. این نوع نامگذاری کمک میکند تا پزشکان در روند تشخیص و درمان، با توجه به خصوصیات ویژه هر اندام، استراتژی مناسبتری اتخاذ کنند.
از دیدگاه بالینی، یکی از مهمترین جنبههای طبقهبندی سرطانها، توجه به درجه تمایز سلولی و مرحله پیشرفت بیماری است. سرطانها بر اساس درجه تمایز به خوشخیم و بدخیم تقسیم میشوند. تومورهای خوشخیم معمولاً رشد آهستهتری دارند، مرز مشخصی از بافت سالم دارند و کمتر احتمال گسترش به سایر بخشهای بدن را دارند. در مقابل، تومورهای بدخیم رشد سریعتری داشته و قابلیت نفوذ به بافتهای مجاور و متاستاز به اندامهای دوردست را دارا هستند. مرحلهبندی سرطانها نیز که اغلب بر اساس سیستمهایی مانند TNM انجام میشود، نشاندهنده اندازه تومور، درگیری غدد لنفاوی و وجود یا عدم وجود متاستاز است. این سیستمها به پزشکان اجازه میدهند شدت بیماری را دقیقتر ارزیابی کرده و درمان را متناسب با شرایط بیمار برنامهریزی کنند.
در کنار این تقسیمبندیها، باید توجه داشت که امروزه پیشرفتهای علمی در زمینه ژنتیک و بیولوژی مولکولی موجب شده است که طبقهبندی سرطانها تنها محدود به سلول و بافت مبدأ نباشد، بلکه پروفایل ژنتیکی و مولکولی تومورها نیز به عنوان شاخصهای مهم در دستهبندی مورد استفاده قرار گیرند. به عنوان مثال، در سرطان پستان، بیان گیرندههای هورمونی مانند ER و PR یا وضعیت HER2 میتواند زیرگروههای مختلفی را ایجاد کند که هر یک نیازمند رویکرد درمانی خاص هستند. در سرطان ریه نیز جهشهای ژنتیکی نظیر EGFR یا ALK میتوانند نوع درمان هدفمند را تعیین کنند.
به طور خلاصه، طبقهبندی سرطانها یک فرایند چندوجهی است که از معیارهای سنتی مانند نوع سلول و محل ایجاد تا معیارهای نوین مانند نشانگرهای مولکولی و ژنتیکی را شامل میشود. این طبقهبندی دقیق نه تنها به درک بهتر ماهیت بیماری کمک میکند، بلکه به پزشکان اجازه میدهد تا برای هر بیمار، درمانی شخصیسازیشده و متناسب با ویژگیهای خاص بیماری طراحی کنند. در نتیجه، درک و بهکارگیری این طبقهبندیها از ارکان اصلی مدیریت موفق سرطان در عصر حاضر به شمار میرود.

علل و عوامل بروز سرطان
روشهای تشخیص در سرطانشناسی از مهمترین ابزارهایی هستند که به پزشکان و پژوهشگران امکان میدهند وجود، نوع، مرحله و ویژگیهای مولکولی تومور را شناسایی کنند. تشخیص صحیح و به موقع سرطان، اساس انتخاب درمان مناسب و افزایش شانس بقا در بیماران است. از آنجا که سرطان بیماریای چندوجهی و بسیار پیچیده است، روشهای تشخیصی نیز طیف گستردهای را شامل میشوند؛ از معاینات اولیه بالینی گرفته تا فناوریهای پیشرفته ژنتیکی و تصویربرداری مولکولی.
یکی از نخستین گامها در فرآیند تشخیص سرطان، معاینات بالینی و ارزیابی علائم بیمار است. پزشک با بررسی شرححال بیمار، توجه به نشانههایی مانند کاهش وزن غیرقابل توجیه، خونریزیهای غیرعادی، تودههای مشکوک یا تغییرات پوستی، میتواند به احتمال وجود سرطان مشکوک شود. معاینات فیزیکی مانند لمس توده در پستان یا غدد لنفاوی بزرگشده، نقطه شروع بسیاری از فرآیندهای تشخیصی است. هرچند این مرحله به تنهایی کافی نیست، اما میتواند مسیر بررسیهای تخصصیتر را تعیین کند.
از مهمترین ابزارهای تشخیصی، روشهای تصویربرداری پزشکی هستند که امکان مشاهده ساختار داخلی بدن را فراهم میسازند. تصویربرداری با اشعه ایکس و ماموگرافی در تشخیص سرطانهای پستان کاربرد گستردهای دارند. سیتی اسکن توانایی ارائه تصاویر مقطعی با جزئیات بالا از اندامهای داخلی را دارد و در شناسایی تودهها، متاستازها و میزان درگیری بافتی بسیار مؤثر است. امآرآی نیز با استفاده از میدانهای مغناطیسی، تصاویری با وضوح بالا از بافتهای نرم ارائه میدهد و به ویژه در تشخیص تومورهای مغزی و نخاعی کاربرد زیادی دارد. علاوه بر این، سونوگرافی به دلیل غیرتهاجمی بودن و نداشتن اشعه، برای بررسی تودههای شکمی یا پستانی بسیار رایج است. در سالهای اخیر، پت اسکن (PET scan) که از ردیابهای رادیواکتیو برای بررسی فعالیت متابولیکی سلولها استفاده میکند، نقش ویژهای در تشخیص و مرحلهبندی سرطانها ایفا کرده است، چرا که سلولهای سرطانی معمولاً فعالیت متابولیکی بالاتری دارند و در تصاویر پت اسکن به وضوح قابل تشخیص هستند.
روش دیگری که پایه و اساس تشخیص قطعی سرطان به شمار میآید، نمونهبرداری یا بیوپسی است. در این روش، نمونهای از بافت مشکوک با استفاده از ابزارهای خاص برداشته شده و تحت بررسیهای پاتولوژیک قرار میگیرد. بیوپسی میتواند به صورت جراحی، سوزنی یا اندوسکوپیک انجام شود. بررسیهای پاتولوژی این نمونهها امکان تعیین نوع دقیق سلول سرطانی، درجه تمایز آنها و ویژگیهای بافتی را فراهم میآورد. در بسیاری از موارد، بدون انجام بیوپسی تشخیص سرطان قطعی نیست، زیرا تنها از طریق بررسی میکروسکوپی میتوان به ماهیت واقعی ضایعه پی برد.
با پیشرفتهای علم ژنتیک و زیستشناسی مولکولی، آزمایشهای مولکولی و ژنتیکی به عنوان روشی نوین و بسیار دقیق در تشخیص سرطان جایگاه ویژهای یافتهاند. بررسی جهشهای ژنی خاص، مانند BRCA1 و BRCA2 در سرطان پستان و تخمدان، یا جهشهای EGFR و KRAS در سرطان ریه، میتواند نه تنها به تشخیص کمک کند بلکه در انتخاب درمانهای هدفمند نیز نقش تعیینکنندهای داشته باشد. تکنیکهایی مانند PCR، توالییابی نسل جدید (NGS) و FISH امکان شناسایی تغییرات ژنی و کروموزومی را فراهم کردهاند. این نوع روشها موجب شدهاند که مفهوم پزشکی شخصیسازیشده در درمان سرطان بیشتر مورد توجه قرار گیرد.
از دیگر روشهای تشخیصی، آزمایشهای آزمایشگاهی و بیوشیمیایی هستند که در خون یا سایر مایعات بدن انجام میشوند. بررسی مارکرهای توموری مانند PSA در سرطان پروستات، CA-125 در سرطان تخمدان و CEA در سرطان روده بزرگ، میتواند اطلاعاتی درباره احتمال وجود یا عود سرطان فراهم آورد. هرچند این نشانگرها به تنهایی ابزار قطعی تشخیص نیستند، اما در ترکیب با سایر روشها ارزشمند میشوند و به ویژه در پیگیری روند درمان یا تشخیص بازگشت بیماری اهمیت بالایی دارند.
در برخی موارد، روشهای آندوسکوپی نقش مهمی در تشخیص سرطان ایفا میکنند. کولونوسکوپی در بررسی روده بزرگ، گاستروسکوپی در معده و برونکوسکوپی در ریه، به پزشکان این امکان را میدهد که مستقیماً بافتها را مشاهده کرده و در صورت لزوم نمونهبرداری کنند. این روشها علاوه بر تشخیص، در برخی مواقع امکان مداخله درمانی نیز فراهم میکنند.
همچنین باید به نقش هوش مصنوعی و فناوریهای نوین در تشخیص سرطان اشاره کرد. امروزه الگوریتمهای یادگیری ماشین با تحلیل دادههای تصویربرداری، الگوهای بافتی و اطلاعات ژنتیکی، قادرند دقت تشخیص را افزایش دهند و حتی مواردی را شناسایی کنند که ممکن است از دید پزشک پنهان بماند. توسعه ابزارهای بیومارکرهای مبتنی بر مایع (liquid biopsy) نیز چشمانداز تازهای در تشخیص زودهنگام ایجاد کرده است. در این روش، با بررسی DNA یا سلولهای سرطانی در گردش خون، میتوان وجود تومور را بدون نیاز به نمونهبرداری تهاجمی شناسایی کرد.
در مجموع، روشهای تشخیص سرطان یک طیف گسترده و تکمیلی را شامل میشوند که از معاینات ساده و غیرتهاجمی تا تکنیکهای پیچیده مولکولی و پیشرفتهترین فناوریهای تصویربرداری را در بر میگیرند. ترکیب این روشها و استفاده همزمان از آنها میتواند بهترین نتیجه را در شناسایی دقیق بیماری به همراه داشته باشد. در نهایت، تشخیص دقیق و بهموقع نه تنها کلید موفقیت در درمان است، بلکه امید به زندگی و کیفیت حیات بیماران مبتلا به سرطان را به طور چشمگیری افزایش میدهد.

درمانهای کلاسیک در انکولوژی
درمانهای کلاسیک در انکولوژی، پایه و اساس مدیریت بیماران سرطانی را تشکیل میدهند و شامل روشهای جراحی، شیمیدرمانی و پرتودرمانی میشوند. این درمانها سالها است که به عنوان استانداردهای طلایی در مراقبت از بیماران مورد استفاده قرار میگیرند و هر یک، با توجه به نوع، مرحله و ویژگیهای سرطان، نقش تعیینکنندهای در کنترل بیماری ایفا میکنند. هرچند درمانهای نوین و هدفمند در دهههای اخیر توجه زیادی را به خود جلب کردهاند، اما هنوز هم روشهای کلاسیک بخش عمدهای از پروتکلهای درمانی را تشکیل میدهند و در بسیاری از موارد، پایهای برای استفاده از فناوریها و داروهای جدید محسوب میشوند.
جراحی یکی از قدیمیترین و مهمترین روشهای درمانی در انکولوژی است. هدف اصلی جراحی حذف تومور و بافتهای اطراف درگیر به همراه غدد لنفاوی مجاور است تا احتمال بازگشت بیماری کاهش یابد. در بسیاری از سرطانها مانند سرطان پستان، سرطان روده بزرگ و سرطان کبد، جراحی بهعنوان درمان اولیه و حتی گاهی درمان قطعی به کار میرود. جراحی همچنین نقش مهمی در مرحلهبندی بیماری دارد، زیرا نمونهبرداری از غدد لنفاوی و تودههای اطراف، اطلاعات دقیقی درباره انتشار سرطان و درجه آن فراهم میکند. با پیشرفت فناوری، روشهای جراحی کمتر تهاجمی مانند لاپاراسکوپی و جراحی رباتیک توسعه یافتهاند که با کاهش عوارض و بهبود کیفیت زندگی بیمار همراه هستند. علاوه بر حذف تومور، جراحی در برخی موارد با هدف تسکینی انجام میشود، به ویژه زمانی که تومور قابل درمان کامل نیست اما کاهش حجم آن میتواند علائم بیمار را بهبود بخشد.
شیمیدرمانی روش دیگری است که بر اساس استفاده از داروهای سیتوتوکسیک عمل میکند و سلولهای سرطانی را هدف قرار میدهد. این داروها سرعت تقسیم سلولها را کاهش داده یا باعث مرگ سلولهای سرطانی میشوند. شیمیدرمانی میتواند به صورت سیستمیک، یعنی وارد جریان خون شود و در سراسر بدن اثر کند، یا به صورت موضعی، مانند تزریق مستقیم به فضای خاصی از بدن، به کار گرفته شود. انتخاب دارو، دوز و زمانبندی درمان براساس نوع سرطان، مرحله آن و وضعیت عمومی بیمار تعیین میشود. هرچند شیمیدرمانی یکی از قدرتمندترین ابزارهای کنترل سرطان است، اما به دلیل اثرات سیتوتوکسیک بر سلولهای سالم، عوارض جانبی متعددی مانند تهوع، ریزش مو، سرکوب سیستم ایمنی و آسیب به بافتهای داخلی ایجاد میکند. بنابراین، مدیریت این عوارض و حمایتهای درمانی مکمل بخش جداییناپذیر شیمیدرمانی است.
پرتودرمانی نیز یکی از روشهای سنتی و مؤثر در درمان سرطانهاست که از اشعههای یونیزان برای تخریب سلولهای سرطانی استفاده میکند. هدف اصلی پرتودرمانی، وارد کردن آسیب DNA به سلولهای توموری به گونهای است که قادر به بازسازی نباشند و در نهایت به مرگ سلول منجر شود. پرتودرمانی میتواند به صورت خارجی (External Beam Radiotherapy) انجام شود، که در آن اشعه از دستگاه خارج از بدن به تومور تابانده میشود، یا به صورت داخلی (Brachytherapy)، که شامل قراردادن مواد رادیواکتیو در نزدیکی یا داخل تومور است. این روش اغلب در ترکیب با جراحی یا شیمیدرمانی استفاده میشود تا اثربخشی درمان افزایش یابد. پیشرفتهای فناوری در پرتودرمانی مانند IMRT (Intensity-Modulated Radiotherapy) و SBRT (Stereotactic Body Radiotherapy) امکان تابش دقیقتر به تومور و کاهش آسیب به بافتهای سالم اطراف را فراهم کرده است.
در بسیاری از سرطانها، ترکیب درمانها از اهمیت ویژهای برخوردار است. به عنوان مثال، در سرطان ریه یا کولورکتال، ترکیب جراحی با شیمیدرمانی و پرتودرمانی به شکل همزمان یا متوالی میتواند شانس بقای بیماران را به طور چشمگیری افزایش دهد. انتخاب ترتیب و نوع ترکیب درمانها براساس شواهد علمی و ویژگیهای فردی بیمار تعیین میشود و به همین دلیل، تیمهای انکولوژی چندرشتهای نقش مهمی در طراحی برنامه درمانی ایفا میکنند.
با وجود اثربخشی بالای درمانهای کلاسیک، محدودیتها و چالشهایی نیز وجود دارد. سلولهای سرطانی میتوانند مقاومت دارویی پیدا کنند، به گونهای که شیمیدرمانی یا پرتودرمانی دیگر اثربخشی سابق را نداشته باشد. علاوه بر این، آسیب به بافتهای سالم و عوارض جانبی شدید میتواند کیفیت زندگی بیمار را تحت تاثیر قرار دهد. به همین دلیل، پژوهشهای جدید تلاش میکنند با ترکیب روشهای کلاسیک با داروهای هدفمند، ایمونوتراپی یا فناوریهای نوین، اثربخشی درمان را افزایش و عوارض جانبی را کاهش دهند.
در مجموع، درمانهای کلاسیک در انکولوژی همچنان ستون اصلی مدیریت سرطانها هستند. جراحی، شیمیدرمانی و پرتودرمانی، با توجه به نوع و مرحله سرطان، ابزارهایی قابل اعتماد و مؤثر برای کنترل بیماری و بهبود بقا به شمار میروند. این روشها، همراه با پیشرفتهای علمی و فناوریهای نوین، امکان طراحی درمانهای جامع و چندجانبه را فراهم میکنند که هدف نهایی آنها افزایش طول عمر و ارتقای کیفیت زندگی بیماران است.

پزشکی دقیق و انکولوژی شخصیسازیشده
مفهوم پزشکی دقیق یا Precision Medicine و انکولوژی شخصیسازیشده یکی از پیشرفتهترین و تحولیترین رویکردها در مدیریت سرطان به شمار میرود. این شاخه از درمان، برخلاف روشهای سنتی که به طور کلی بر اساس نوع سرطان و مرحله آن تصمیمگیری میکردند، به دنبال ارائه درمانهای اختصاصی و متناسب با ویژگیهای ژنتیکی، مولکولی و بیولوژیکی هر بیمار است. هدف اصلی پزشکی دقیق، افزایش اثربخشی درمان و کاهش عوارض جانبی با طراحی برنامه درمانی متناسب با پروفایل منحصر به فرد بیمار است.
در قلب پزشکی دقیق، تحلیل ژنومی و مولکولی تومور قرار دارد. با استفاده از تکنیکهایی مانند توالییابی نسل جدید (NGS) و بررسی جهشهای ژنی خاص، پروفایل ژنتیکی هر تومور مشخص میشود. این اطلاعات نه تنها در تشخیص دقیقتر سرطان، بلکه در انتخاب درمانهای هدفمند اهمیت بالایی دارند. برای مثال، در سرطان ریه جهش EGFR میتواند نشاندهنده پاسخ بهتر به داروهای مهارکننده تیروزین کیناز باشد، در حالی که جهش KRAS نیازمند رویکرد درمانی متفاوتی است. شناسایی این مشخصههای ژنتیکی امکان طراحی درمانهایی را فراهم میکند که مستقیماً مسیرهای مولکولی مختلشده در سلولهای سرطانی را هدف قرار میدهند.
یکی دیگر از ارکان مهم پزشکی دقیق، داروهای هدفمند و درمانهای مولکولی هستند. برخلاف شیمیدرمانی سنتی که سلولهای سالم و سرطانی را به طور مشابه تحت تأثیر قرار میدهد، داروهای هدفمند با اختصاصی کردن اثر خود به مسیرها و پروتئینهای مختل شده در سلولهای سرطانی، اثربخشی بالاتر و عوارض کمتر دارند. به عنوان نمونه، مهارکنندههای HER2 در سرطان پستان، مهارکنندههای BRAF در ملانوم و داروهای ضدangiogenic نمونههایی از این درمانها هستند. استفاده از این داروها بر اساس نتایج تستهای مولکولی و ژنتیکی تومور تعیین میشود و نشاندهنده ترکیب بیولوژی مولکولی با تصمیمگیری بالینی است.
ایمونوتراپی نیز جزء کلیدی انکولوژی شخصیسازیشده به شمار میرود. این روشها سیستم ایمنی بدن را برای شناسایی و حمله به سلولهای سرطانی تقویت میکنند. داروهایی مانند مهارکنندههای PD-1 و CTLA-4 نمونههای موفقی هستند که در درمان سرطانهای مختلف از جمله ملانوم، سرطان ریه و سرطان کلیه استفاده شدهاند. با بررسی بیومارکرهای ایمنی، مانند بار جهشی تومور (TMB) و بیان PD-L1، پزشکان میتوانند پیشبینی کنند که کدام بیماران بیشترین بهره را از ایمونوتراپی خواهند برد. این ویژگی، انکولوژی شخصیسازیشده را به یک ابزار دقیق و هوشمند تبدیل میکند که درمان را با ویژگیهای خاص بیماران همسو میسازد.
علاوه بر داروهای هدفمند و ایمونوتراپی، درمانهای ژنتیکی و سلولی مانند CAR-T و فناوریهای ویرایش ژن نیز بخشی از پزشکی دقیق هستند. CAR-T therapy شامل مهندسی لنفوسیتهای T بیمار برای شناسایی و حمله به سلولهای سرطانی است و موفقیتهای چشمگیری در برخی لوسمیها و لنفومها نشان داده است. همچنین، استفاده از CRISPR و سایر ابزارهای ویرایش ژن در مرحله تحقیقاتی، امکان اصلاح جهشهای مولکولی یا القای حساسیت سلولهای سرطانی به داروهای خاص را فراهم میآورد.
پیشرفت فناوری و هوش مصنوعی نقش مهمی در توسعه پزشکی دقیق ایفا کرده است. الگوریتمهای یادگیری ماشین و مدلهای پیشبینی قادرند حجم عظیمی از دادههای ژنتیکی، تصویربرداری و اطلاعات بالینی را تحلیل کنند و الگوهایی را شناسایی نمایند که به تصمیمگیری بالینی کمک میکنند. از جمله کاربردهای عملی، شناسایی بیماران مناسب برای درمانهای هدفمند، پیشبینی پاسخ به دارو و حتی توصیه دوز بهینه برای کاهش عوارض است. این ترکیب هوش مصنوعی و دانش مولکولی، امکان ارائه درمانهای بسیار دقیق و شخصیسازیشده را فراهم میآورد.
تغذیه، سبک زندگی و عوامل محیطی نیز در پزشکی دقیق جایگاه خود را دارند. پژوهشها نشان دادهاند که عوامل غذایی و سبک زندگی میتوانند بر پاسخ به درمانهای هدفمند و ایمونوتراپی تأثیرگذار باشند. به همین دلیل، مراقبت جامع انکولوژیک، علاوه بر درمان مستقیم تومور، شامل مداخلات تغذیهای، روانی و حمایتی نیز میشود تا اثربخشی درمان افزایش یافته و کیفیت زندگی بیمار حفظ شود.
در نهایت، پزشکی دقیق و انکولوژی شخصیسازیشده، یک تغییر پارادایمی در درمان سرطان به شمار میرود. این رویکرد، تلفیقی از دانش ژنتیک، زیستشناسی مولکولی، ایمونولوژی، داروشناسی و هوش مصنوعی است و امکان ارائه درمانی اختصاصی و بهینه را برای هر بیمار فراهم میکند. با پیشرفت تحقیقات و توسعه فناوریها، انتظار میرود در دهههای آینده این روشها به استاندارد غالب در درمان سرطانها تبدیل شوند و میزان بقای بیماران را به شکل قابل توجهی افزایش دهند.

ایمنوتراپی و درمانهای نوین در انکولوژی
ایمونوتراپی به عنوان یکی از پیشرفتهترین رویکردهای درمانی در سرطانشناسی، بر پایه فعالسازی سیستم ایمنی بدن برای شناسایی و نابودی سلولهای سرطانی استوار است. برخلاف روشهای سنتی که مستقیماً سلولهای سرطانی را هدف قرار میدهند، ایمونوتراپی از ظرفیت ذاتی بدن برای مقابله با بیماری بهره میبرد و به همین دلیل میتواند اثربخشی طولانیمدت و در برخی موارد پاسخهای پایدار ایجاد کند. در سالهای اخیر، ایمونوتراپی به ویژه در درمان ملانوم، سرطان ریه، سرطان کلیه، و برخی لوسمیها و لنفومها تحول چشمگیری ایجاد کرده است.
یکی از شاخههای کلیدی ایمونوتراپی، استفاده از مهارکنندههای نقاط کنترل ایمنی (Immune Checkpoint Inhibitors) است. این داروها، مانند آنتیبادیهای ضد PD-1، PD-L1 و CTLA-4، مسیرهایی را که سلولهای سرطانی برای فرار از شناسایی سیستم ایمنی ایجاد میکنند، مسدود میکنند. با بازگرداندن عملکرد طبیعی لنفوسیتهای T، این داروها امکان شناسایی و حمله به تومور را فراهم میآورند. موفقیت این رویکرد نه تنها در افزایش طول عمر بیماران، بلکه در ایجاد پاسخهای پایدار حتی پس از توقف درمان، بسیار چشمگیر است.
ایمونوتراپی سلولی نیز بخش مهمی از درمانهای نوین را تشکیل میدهد. CAR-T therapy (Chimeric Antigen Receptor T-cell therapy) نمونهای برجسته است که در آن لنفوسیتهای T بیمار مهندسی میشوند تا یک گیرنده اختصاصی برای شناسایی سلولهای سرطانی بیان کنند. این سلولهای اصلاحشده مجدداً به بدن بیمار تزریق میشوند و با قدرت شناسایی دقیق، تومور را هدف قرار میدهند. CAR-T therapy به ویژه در درمان لوسمیهای مقاوم به درمان و لنفومهای خاص بسیار مؤثر بوده است و نشاندهنده تحولی عظیم در زمینه درمانهای شخصیسازیشده است.
علاوه بر این، آنتیبادیهای درمانی و آنتیبادیهای چندوجهی (Bispecific and Multispecific Antibodies) نقش مهمی در درمان سرطانهای مقاوم و پیچیده دارند. این آنتیبادیها میتوانند به طور همزمان دو یا چند هدف مولکولی را شناسایی کنند و پاسخ ایمنی یا اثر دارویی خود را تقویت کنند. به عنوان مثال، برخی از این آنتیبادیها به طور همزمان سلولهای T و سلولهای سرطانی را هدف میگیرند تا حمله مستقیم به تومور افزایش یابد. این رویکرد باعث میشود که درمانهای نوین با دقت بالا و کمترین آسیب به سلولهای سالم انجام شود.
واکسنهای ضدسرطان نیز به عنوان یکی دیگر از روشهای نوین مورد بررسی و استفاده قرار گرفتهاند. این واکسنها سلولهای ایمنی بدن را آموزش میدهند تا پروتئینهای خاص تومور را شناسایی کنند و پاسخ ایمنی موضعی و سیستمیک ایجاد نمایند. در حالی که واکسنهای پیشگیرانه برای برخی سرطانها مانند سرطان دهانه رحم با موفقیت به کار گرفته شدهاند، توسعه واکسنهای درمانی برای سرطانهای دیگر همچنان در مرحله تحقیق و کارآزماییهای بالینی قرار دارد.
پیشرفتهای فناوریهای نوین مانند نانوزایمها و سیستمهای دارورسانی هوشمند (Smart Nanozymes) امکان هدفگیری دقیق سلولهای سرطانی و افزایش اثربخشی درمانهای نوین را فراهم کرده است. این فناوریها میتوانند داروها یا عوامل فعالکننده ایمنی را مستقیماً به محیط تومور منتقل کنند و بدین ترتیب اثرات جانبی سیستمیک کاهش یابد. ترکیب این فناوریها با ایمونوتراپی، چشمانداز جدیدی برای درمان سرطانهای مقاوم و پیشرفته ایجاد کرده است.
هوش مصنوعی و یادگیری ماشین نیز در بهینهسازی ایمونوتراپی و درمانهای نوین نقش مهمی دارند. الگوریتمها میتوانند پاسخ بیماران به درمان را پیشبینی کنند، دوز دارو را بهینه نمایند و الگوهای مولکولی پیچیده تومورها را شناسایی کنند که به طراحی درمان شخصیسازیشده کمک میکند. استفاده از مدلهای پیشبینی مبتنی بر دادههای بزرگ، امکان کاهش خطاهای بالینی و افزایش دقت در تصمیمگیریهای درمانی را فراهم میکند.
در نهایت، ترکیب درمانهای کلاسیک با روشهای نوین اثربخشی درمانها را افزایش میدهد. برای مثال، ترکیب شیمیدرمانی یا پرتودرمانی با ایمونوتراپی میتواند اثرات مکمل ایجاد کرده و احتمال بازگشت بیماری را کاهش دهد. همچنین، انتخاب استراتژی درمان بر اساس پروفایل ژنتیکی و مولکولی تومور، استفاده از نشانگرهای زیستی و ارزیابی پاسخ سیستم ایمنی، امکان ارائه یک درمان جامع، چندجانبه و شخصیسازیشده را فراهم میکند.
به طور خلاصه، ایمونوتراپی و درمانهای نوین در انکولوژی، یک تغییر پارادایمی در مدیریت سرطانها ایجاد کردهاند. این رویکردها با بهرهگیری از توان سیستم ایمنی، فناوریهای مهندسی سلولی، آنتیبادیهای چندوجهی و هوش مصنوعی، امکان ارائه درمانهای دقیق، هدفمند و شخصیسازیشده را فراهم میآورند. انتظار میرود با ادامه تحقیقات و توسعه فناوریها، این روشها به ستون اصلی درمان سرطانها در دهههای آینده تبدیل شوند و نتایج درمانی چشمگیری برای بیماران به همراه داشته باشند.

رادیوترانواستیک و آینده پزشکی هستهای در انکولوژی
رادیوترانواستیک، شاخهای نوظهور و نوآورانه در انکولوژی است که به همگرایی تشخیص و درمان مبتنی بر رادیواکتیو میپردازد. این مفهوم با تلفیق روشهای تصویربرداری پزشکی هستهای و درمانهای هدفمند رادیواکتیو، امکان ارائه درمانهای دقیق، اختصاصی و شخصیسازیشده را فراهم میکند. برخلاف پرتودرمانی سنتی که تنها بر تابش خارجی تمرکز دارد، رادیوترانواستیک به سلولهای سرطانی به طور مستقیم و با حداقل آسیب به بافتهای سالم هدف میگیرد، و این ویژگی، آن را به یک رویکرد تحولآفرین در انکولوژی تبدیل کرده است.
در رادیوترانواستیک، از رادیوترکرها یا مولکولهای نشاندار شده با رادیوایزوتوپ استفاده میشود که به طور خاص به سلولهای توموری متصل میشوند. این مولکولها میتوانند آنتیبادیهای مونوکلونال، پپتیدها یا سایر لیگاندهای هدفمند باشند که به گیرندهها یا آنتیژنهای خاص روی سطح سلولهای سرطانی متصل میشوند. با اتصال این مولکولها، ایزوتوپ رادیواکتیو انرژی خود را مستقیماً به سلولهای سرطانی منتقل میکند و باعث مرگ آنها میشود. این روش نه تنها اثر درمانی مستقیم ایجاد میکند، بلکه با تصویربرداری پزشکی هستهای امکان پایش لحظهای و ارزیابی پاسخ تومور به درمان را نیز فراهم میآورد.
یکی از کاربردهای مهم رادیوترانواستیک، در درمان سرطانهای نورواندوکرین مانند تومورهای گاسترونوآنتروپانکرتیک (GEP-NETs) است. استفاده از Lu-177 DOTATATE نمونهای از این روش است که توانسته نتایج بالینی قابل توجهی در کاهش تومور و افزایش بقا ارائه دهد. علاوه بر این، رادیوترانواستیک در سرطان پروستات با استفاده از PSMA-targeted radioligands نیز تحول ایجاد کرده و گزینههای درمانی جدیدی برای بیماران مبتلا به سرطان مقاوم به درمان فراهم کرده است.
پیشرفتهای اخیر در این حوزه، شامل ایزوتوپهای نوین با نیمهعمر و ویژگیهای رادیوبیولوژیکی مناسب و همچنین سیستمهای هدفگیری چندوجهی است که دقت و اثربخشی درمان را افزایش میدهد. برای مثال، ترکیب چندین رادیوترکر هدفمند یا استفاده از آنتیبادیهای چندوجهی امکان اثرگذاری بر انواع سلولهای توموری و مقاومتهای دارویی را فراهم میکند. این نوآوریها نشاندهنده تحولی بنیادین در طراحی درمانهای شخصیسازیشده بر پایه پزشکی هستهای است.
یکی از مزایای کلیدی رادیوترانواستیک، همراهی آن با پزشکی دقیق و تحلیل مولکولی تومور است. بررسی ویژگیهای ژنتیکی و بیولوژیکی سلولهای سرطانی میتواند تعیین کند که کدام بیمار بیشترین بهره را از درمان رادیوترانواستیک خواهد برد. به عنوان مثال، سطح بیان گیرندههای خاص روی سطح سلولهای توموری یا میزان نفوذپذیری بافتها میتواند در انتخاب ایزوتوپ و دوز بهینه مؤثر باشد. این تلفیق علم مولکولی و فناوری پزشکی هستهای، امکان طراحی درمانهای دقیق و شخصیسازیشده را فراهم میکند.
رادیوترانواستیک همچنین نقش مهمی در پایش درمان و ارزیابی پاسخ تومور دارد. با استفاده از تصاویر PET یا SPECT، پزشکان میتوانند توزیع رادیوترکرها و میزان جذب آنها توسط تومور را مشاهده کنند و در صورت نیاز، برنامه درمانی را اصلاح نمایند. این ویژگی، امکان مدیریت پویا و واکنش سریع به تغییرات وضعیت بیمار را فراهم میکند و سطح کنترل بالینی بر درمان را افزایش میدهد.
علاوه بر کاربردهای درمانی، رادیوترانواستیک در تشخیص دقیق و مرحلهبندی سرطانها نیز اهمیت دارد. استفاده از رادیوترکرهای هدفمند به پزشکان اجازه میدهد که تومورها، متاستازها و حتی سلولهای سرطانی پراکنده در بدن را شناسایی کنند. این اطلاعات برای طراحی برنامه درمانی جامع و کاهش عوارض جانبی بسیار حیاتی هستند.
با نگاه به آینده، ادغام هوش مصنوعی و یادگیری ماشین در رادیوترانواستیک، چشماندازهای نوینی ایجاد کرده است. الگوریتمها میتوانند دادههای تصویربرداری، نتایج مولکولی و ویژگیهای بیمار را تحلیل کرده و دوزهای دقیق، زمانبندی درمان و بهترین ترکیب درمانی را پیشنهاد دهند. همچنین، توسعه سیستمهای چندوجهی و ایزوتوپهای جدید، امکان گسترش کاربرد این روش به انواع سرطانها و تومورهای مقاوم به درمان را فراهم کرده است.
در نهایت، رادیوترانواستیک و پزشکی هستهای نوین در انکولوژی، یک رویکرد جامع و چندبعدی را برای تشخیص و درمان سرطانها ارائه میدهند. این روشها با هدفگیری دقیق سلولهای سرطانی، کاهش آسیب به بافتهای سالم و امکان پایش لحظهای پاسخ به درمان، تحولی بنیادین در مدیریت سرطانها ایجاد کردهاند و انتظار میرود در دهههای آینده، ستون اصلی درمانهای شخصیسازیشده و پزشکی دقیق در انکولوژی باشند.

هوش مصنوعی و انکولوژی هوشمند
هوش مصنوعی (AI) و فناوریهای یادگیری ماشین وارد عرصه انکولوژی شدهاند و نقش آنها در تشخیص، درمان و پیشبینی پاسخ بیماران، انقلابی در مدیریت سرطانها ایجاد کرده است. انکولوژی هوشمند بر پایه تحلیل دادههای عظیم بالینی، مولکولی، تصویربرداری و ژنتیکی بیماران استوار است و امکان ارائه تصمیمات درمانی دقیق، شخصیسازیشده و بهینه را فراهم میکند. این تحول، انکولوژی را از یک فرآیند مبتنی بر تجربه و پروتکلهای عمومی، به یک علم دادهمحور و پیشبینیکننده تبدیل کرده است.
یکی از کاربردهای اصلی هوش مصنوعی در انکولوژی، تشخیص دقیق و زودهنگام سرطانها است. الگوریتمهای یادگیری عمیق قادرند تصاویر پزشکی مانند MRI، CT و PET را تحلیل کنند و ضایعات سرطانی را با دقت بسیار بالا شناسایی نمایند. این الگوریتمها میتوانند تغییرات میکروسکوپی و ویژگیهای پنهان تومور را تشخیص دهند که چشم انسان ممکن است آنها را نادیده بگیرد. چنین تواناییای باعث کاهش خطاهای تشخیصی، شناسایی زودهنگام تومورها و افزایش شانس درمان موفق میشود.
هوش مصنوعی همچنین نقش کلیدی در طبقهبندی سرطانها و پیشبینی رفتار تومور دارد. با تحلیل دادههای ژنتیکی، مولکولی و بالینی، الگوریتمها میتوانند پیشبینی کنند که یک تومور چگونه رشد خواهد کرد، به چه درمانی پاسخ میدهد و احتمال بازگشت آن چقدر است. این ویژگی به پزشکان اجازه میدهد تا برنامه درمانی را متناسب با پروفایل دقیق هر بیمار طراحی کنند و از روشهای شخصیسازیشده بهرهمند شوند.
یکی از حوزههای نوین و مهم، پشتیبانی تصمیمگیری بالینی در انکولوژی با استفاده از سیستمهای هوشمند است. این سیستمها میتوانند حجم عظیمی از دادهها، شامل نتایج آزمایشگاهی، پروفایل ژنتیکی، سابقه دارویی و وضعیت بالینی بیمار را تحلیل کرده و بهترین گزینههای درمانی را پیشنهاد دهند. علاوه بر این، این سیستمها میتوانند خطرات، عوارض جانبی و اثربخشی احتمالی هر درمان را پیشبینی کنند، که باعث کاهش اشتباهات و افزایش دقت تصمیمگیری میشود.
پیشبینی پاسخ به درمان و بهینهسازی دوز داروها یکی دیگر از مزایای هوش مصنوعی در انکولوژی است. الگوریتمها قادرند الگوهای پاسخ بیماران به شیمیدرمانی، ایمونوتراپی و درمانهای هدفمند را تحلیل کنند و به پزشکان در انتخاب دوز بهینه کمک کنند. این ویژگی به ویژه در کاهش عوارض جانبی و جلوگیری از مقاومت دارویی اهمیت دارد. پروژههایی مانند Project Optimus در حال حاضر به دنبال بهینهسازی دوز داروها در انکولوژی هستند و استفاده از AI میتواند این هدف را به شکلی دقیقتر و شخصیسازیشدهتر محقق کند.
هوش مصنوعی همچنین با تجزیه و تحلیل دادههای تصویربرداری و رادیوترانواستیک ترکیب شده و امکان پایش دقیق پاسخ به درمان را فراهم میکند. برای مثال، الگوریتمها میتوانند میزان جذب رادیوترکرها در تومور را تحلیل کرده و تغییرات را در طول زمان بررسی کنند. این اطلاعات برای اصلاح برنامه درمانی و تصمیمگیریهای لحظهای بسیار ارزشمند است.
یکی دیگر از کاربردهای نوین، استفاده از مدلهای زبان بزرگ (Large Language Models) در انکولوژی است. این مدلها قادرند اطلاعات پزشکی و پژوهشی عظیم را تحلیل و خلاصه کنند، پروتکلهای درمانی مناسب را پیشنهاد دهند و حتی با پزشکان در برنامهریزی درمانی و آموزش بیماران تعامل کنند. استفاده از این فناوریها باعث کاهش زمان تحقیق، افزایش دقت علمی و دسترسی سریع به اطلاعات جدید میشود.
هوش مصنوعی همچنین میتواند در مدیریت علائم و کیفیت زندگی بیماران سرطانی نقش داشته باشد. با تحلیل دادههای جمعآوری شده از دستگاههای پوشیدنی، اپلیکیشنهای سلامت و پایش علائم بالینی، الگوریتمها میتوانند تغییرات وضعیت بیمار را پیشبینی کرده و اقدامات پیشگیرانه پیشنهاد دهند. این رویکرد، به ویژه در مدیریت علائم اضطراب، افسردگی، خستگی و اثرات جانبی درمانها، اهمیت زیادی دارد و بخشی از انکولوژی جامع و شخصیسازیشده محسوب میشود.
به طور خلاصه، هوش مصنوعی و انکولوژی هوشمند، یک تحول بنیادین در مدیریت سرطانها ایجاد کردهاند. با ترکیب تحلیل دادههای بالینی، مولکولی و تصویربرداری، هوش مصنوعی امکان تشخیص زودهنگام، پیشبینی رفتار تومور، طراحی درمانهای دقیق و شخصیسازیشده و بهینهسازی دوز داروها را فراهم میکند. انتظار میرود با پیشرفت فناوریها و توسعه الگوریتمهای پیشرفته، انکولوژی هوشمند به یکی از ستونهای اصلی درمان سرطانها در دهههای آینده تبدیل شود و کیفیت زندگی و بقای بیماران را به شکل چشمگیری افزایش دهد.

مراقبتهای حمایتی و رویکرد چندرشتهای در انکولوژی
مراقبتهای حمایتی در انکولوژی، بخش جداییناپذیر مدیریت بیماران سرطانی به شمار میروند و به مجموعهای از خدمات بالینی، روانی، تغذیهای و اجتماعی اشاره دارند که با هدف افزایش کیفیت زندگی، کاهش عوارض درمان و بهبود تجربه بیمار ارائه میشوند. این مراقبتها نه تنها به مدیریت عوارض جانبی درمانهای کلاسیک و نوین کمک میکنند، بلکه نقش حیاتی در حفظ سلامت روان، توانبخشی و توانایی فرد برای ادامه زندگی روزمره دارند.
در رویکرد مدرن، مدیریت چندرشتهای بیماران سرطانی به عنوان یک استاندارد طلایی مطرح است. این تیم شامل انکولوژیستها، پرستاران متخصص سرطان، روانشناسان، تغذیهدانان، فیزیوتراپیستها و متخصصان دارویی است که با همکاری یکدیگر برنامه مراقبتی جامع و هماهنگ برای هر بیمار طراحی میکنند. این همکاری چندرشتهای، امکان شناسایی و مدیریت همزمان عوارض جسمی و روانی، بهینهسازی درمان و کاهش استرس بیماران و خانوادههایشان را فراهم میکند.
یکی از مهمترین اجزای مراقبتهای حمایتی، مدیریت عوارض جانبی درمانها است. شیمیدرمانی، پرتودرمانی و درمانهای هدفمند میتوانند باعث تهوع، خستگی، درد، از دست دادن اشتها و تغییرات پوستی شوند. تیم حمایتی با ارائه داروهای کنترلکننده علائم، مشاوره تغذیهای و آموزشهای رفتاری، میتواند این اثرات را کاهش دهد و توانایی بیمار برای تحمل درمانها را افزایش دهد.
حمایت روانی و مدیریت اضطراب و افسردگی نیز جزء ضروری مراقبتهای چندرشتهای است. مطالعات نشان دادهاند که بیماران سرطانی به طور قابل توجهی در معرض اضطراب، افسردگی و استرس هستند، که میتواند روند درمان را مختل کرده و کیفیت زندگی را کاهش دهد. مداخلات روانشناختی شامل مشاوره فردی، گروههای حمایتی، تکنیکهای ذهنآگاهی و درمانهای رفتاری-شناختی میتواند سطح استرس و علائم روانی را کاهش دهد و به بیماران کمک کند تا با چالشهای بیماری و درمان بهتر مقابله کنند.
تغذیه درمانی و مداخلات سبک زندگی نیز بخش حیاتی مراقبتهای حمایتی هستند. بررسیها نشان میدهد که وضعیت تغذیهای بیماران سرطانی میتواند بر پاسخ به درمان، بقای بیمار و کیفیت زندگی تاثیر مستقیم داشته باشد. تیمهای تغذیهای با طراحی برنامههای غذایی متناسب با نیازهای فردی و شرایط درمانی، سوءتغذیه و کاهش وزن ناشی از بیماری یا درمان را مدیریت میکنند. همچنین، ورزشهای سبک و برنامههای توانبخشی میتوانند خستگی، ضعف عضلانی و مشکلات فیزیکی ناشی از درمان را کاهش دهند.
مراقبتهای تسکینی و مدیریت درد نیز از اجزای مهم این رویکرد هستند. درد مزمن ناشی از تومور یا درمانها میتواند کیفیت زندگی بیماران را به شدت کاهش دهد. استفاده از داروهای کنترلکننده درد، روشهای غیر دارویی مانند فیزیوتراپی، ماساژ درمانی و تکنیکهای آرامسازی، همراه با پایش مستمر توسط تیم تخصصی، امکان کاهش درد و افزایش رفاه بیمار را فراهم میآورد.
در نهایت، رویکرد چندرشتهای و حمایتی تضمین میکند که درمان سرطان تنها به مهار بیماری محدود نمیشود، بلکه سلامت کلی بیمار، توانایی عملکرد روزمره، رفاه روانی و اجتماعی او نیز مورد توجه قرار میگیرد. این رویکرد، از طریق هماهنگی میان تخصصهای مختلف و ارائه مراقبتهای جامع و فردمحور، امکان ارائه یک تجربه درمانی انسانی، دقیق و بهینه را فراهم میآورد و اثربخشی درمانهای نوین را نیز تقویت میکند.
انکولوژی مقایسهای
انکولوژی مقایسهای، شاخهای نوین در علوم سرطانشناسی است که به مطالعه سرطانها در گونههای مختلف جانوری و مقایسه آنها با سرطانهای انسانی میپردازد. هدف اصلی این حوزه، شناسایی مکانیسمهای پایهای سرطان، کشف اهداف درمانی جدید و بهبود اثربخشی درمانها در انسان است. این رویکرد بر این اصل استوار است که بسیاری از ویژگیهای مولکولی و رفتاری سرطانها در انسان و حیوانات مشابه هستند و مطالعه آنها میتواند بینشهای ارزشمندی برای انکولوژی بالینی فراهم کند.
یکی از محورهای اصلی انکولوژی مقایسهای، استفاده از حیوانات همراه (Companion Animals) مانند سگها و گربهها در پژوهشهای سرطان است. این حیوانات به طور طبیعی به برخی انواع سرطانها مبتلا میشوند و ویژگیهای بیماری در آنها بسیار شبیه به انسان است. برای مثال، سرطان پستان در سگها از نظر بیولوژیکی و رفتاری با سرطان پستان در انسان شباهتهای قابل توجهی دارد و مطالعه آنها میتواند اطلاعات ارزشمندی در زمینه عوامل خطر، مسیرهای مولکولی و پاسخ به درمان ارائه دهد.
مزیت حیوانات همراه نسبت به مدلهای آزمایشگاهی سنتی، مشابهت بالای بیماری با شرایط بالینی واقعی است. در حالی که مدلهای موشی و سلولی اغلب نیازمند دستکاری ژنتیکی یا شرایط مصنوعی برای ایجاد تومور هستند، سرطانهای طبیعی در حیوانات همراه مسیر طبیعی پیشرفت بیماری، متاستاز و پاسخ به درمان را نشان میدهند. این امر، امکان ارزیابی اثر بخشی داروها، ایمونوتراپی و روشهای نوین درمانی در شرایط نزدیک به بالین انسانی را فراهم میکند.
انکولوژی مقایسهای همچنین بر مطالعه مکانیسمهای مولکولی و ژنتیکی سرطانها تاکید دارد. تحلیل ژنوم، پروتئوم و متابولوم سرطانهای حیوانات همراه میتواند مسیرهای سیگنالینگ، تغییرات ژنتیکی کلیدی و اهداف دارویی جدید را شناسایی کند. این دادهها به طراحی درمانهای دقیق و شخصیسازیشده در انسان کمک کرده و امکان توسعه داروهای موثرتر و کمعارضهتر را فراهم میآورد.
یکی دیگر از کاربردهای انکولوژی مقایسهای، پیشبینی پاسخ به درمان و مقاومت دارویی است. مطالعه واکنشهای حیوانات همراه به شیمیدرمانی، پرتودرمانی و ایمونوتراپی میتواند الگوهای مقاومت دارویی را آشکار کند و اطلاعات لازم برای بهینهسازی درمانها در انسان فراهم کند. این رویکرد به ویژه در توسعه داروهای نوین و روشهای درمانی ترکیبی اهمیت دارد.
همگرایی بین انکولوژی مقایسهای و پزشکی دقیق نیز از اهمیت ویژهای برخوردار است. دادههای به دست آمده از حیوانات همراه میتوانند در کنار پروفایل ژنتیکی و مولکولی بیماران انسانی تحلیل شوند تا بهترین استراتژی درمانی انتخاب شود. این تلفیق علوم پایه و بالینی، امکان ارائه درمانهای جامع، هدفمند و شخصیسازیشده را فراهم میکند.
همچنین، انکولوژی مقایسهای به بهبود درک فرآیندهای متاستاز و رشد تومور کمک میکند. مطالعه تومورهای طبیعی در حیوانات همراه نشان میدهد که چگونه سلولهای سرطانی از محل اولیه به بافتهای دیگر مهاجرت میکنند و چه عوامل محیطی، ایمنی و ژنتیکی در این فرآیند نقش دارند. این اطلاعات برای توسعه درمانهای نوین ضدمتاستاز و بهبود پیشآگهی بیماران حیاتی هستند.
از دیدگاه تحقیقاتی، انکولوژی مقایسهای میتواند زمان توسعه داروها و کارآزماییهای بالینی را کاهش دهد. ارزیابی ایمنی و اثربخشی داروها در حیوانات همراه قبل از ورود به فاز بالینی انسانی، امکان شناسایی داروهای امیدوارکننده و حذف گزینههای کماثر یا پرخطر را فراهم میکند. این فرآیند میتواند منابع تحقیقاتی را به شکل بهینهتری مصرف کند و شانس موفقیت در کارآزماییهای بالینی را افزایش دهد.
در نهایت، انکولوژی مقایسهای یک پل بین پژوهشهای پایه و بالین انسانی ایجاد میکند و به توسعه درمانهای نوین، پیشبینی پاسخ بیمار و بهبود کیفیت زندگی بیماران سرطانی کمک میکند. این شاخه از علوم سرطانشناسی، با تمرکز بر شباهتها و تفاوتهای زیستی بین گونههای مختلف، امکان دستیابی به دانش عمیقتر و کاربردیتر در مدیریت سرطانها را فراهم میآورد و چشمانداز روشنی برای تحقیقات آینده ارائه میدهد.
آینده سرطانشناسی
آینده سرطانشناسی بر پایه تلفیق فناوریهای نوین، پزشکی دقیق و رویکردهای شخصیسازیشده شکل خواهد گرفت و چشمانداز درمان و مدیریت سرطانها را به شکلی بنیادین تغییر میدهد. این چشمانداز با بهرهگیری از پیشرفتهای بیوتکنولوژی، هوش مصنوعی، پزشکی هستهای، ایمونوتراپی و علوم مولکولی، امکان ارائه درمانهای هدفمند، کمعارضه و اثربخشتر را فراهم میکند.
یکی از محورهای اصلی آینده سرطانشناسی، پزشکی دقیق و انکولوژی شخصیسازیشده است. پیشرفت در توالییابی ژنوم، پروتئومیک و متابولومیک امکان شناسایی ویژگیهای منحصر به فرد هر تومور را فراهم میکند. این اطلاعات اجازه میدهند تا درمانها بر اساس پروفایل مولکولی بیمار انتخاب شوند، مقاومت دارویی پیشبینی شود و پاسخ به درمان بهینه شود. انتظار میرود که در دهههای آینده، ترکیب دادههای مولکولی با الگوریتمهای هوش مصنوعی، به طراحی درمانهای کاملاً شخصیسازیشده منجر شود که شانس موفقیت بالایی دارند و عوارض جانبی کاهش یافتهاند.
ایمونوتراپی و درمانهای نوین نیز بخش حیاتی آینده انکولوژی را تشکیل میدهند. پیشرفت در زمینه CAR-T therapy، آنتیبادیهای چندوجهی و واکسنهای درمانی، امکان مقابله با سرطانهای مقاوم به درمانهای کلاسیک را فراهم میکند. همچنین، ترکیب این روشها با سیستمهای دارورسانی هوشمند و نانوزایمها باعث افزایش دقت هدفگیری تومورها و کاهش اثرات جانبی سیستمیک خواهد شد.
رادیوترانواستیک و پزشکی هستهای پیشرفته یکی دیگر از ارکان مهم آینده سرطانشناسی هستند. استفاده از رادیوترکرهای هدفمند و سیستمهای تصویربرداری پیشرفته، نه تنها امکان درمان دقیق و هدفمند را فراهم میکند، بلکه به پزشکان اجازه میدهد پاسخ درمان را به صورت بلادرنگ پایش کنند. این رویکردها با تلفیق با هوش مصنوعی، امکان برنامهریزی پویا و اصلاح سریع درمانها را ایجاد میکنند و میتوانند به استاندارد طلایی در درمانهای شخصیسازیشده تبدیل شوند.
هوش مصنوعی و انکولوژی هوشمند بخش جداییناپذیر آینده مدیریت سرطانها است. الگوریتمهای پیشرفته میتوانند حجم عظیمی از دادههای بالینی، مولکولی و تصویربرداری را تحلیل کنند و بهترین استراتژی درمانی را پیشنهاد دهند. این فناوری همچنین امکان شناسایی الگوهای مقاومت دارویی، پیشبینی پاسخ به درمان، بهینهسازی دوز دارو و مدیریت علائم جانبی را فراهم میآورد. استفاده از مدلهای زبان بزرگ و یادگیری ماشین، سرعت دسترسی به دانش علمی و اطلاعات درمانی جدید را افزایش داده و تصمیمگیری بالینی را دقیقتر میکند.
مراقبتهای حمایتی و رویکرد چندرشتهای نیز در آینده سرطانشناسی نقشی کلیدی خواهند داشت. توجه به کیفیت زندگی بیمار، مدیریت روانی، تغذیه، توانبخشی و کنترل علائم جانبی، مکمل درمانهای نوین است و امکان ارائه یک تجربه درمانی جامع، انسانی و اثربخش را فراهم میآورد. این رویکردهای چندرشتهای باعث میشوند بیماران نه تنها بیماری را مدیریت کنند، بلکه سلامت کلی و رفاه خود را نیز حفظ نمایند.
یکی از چشماندازهای هیجانانگیز آینده، ترکیب انکولوژی مقایسهای با علوم بالینی و مولکولی است. دادههای به دست آمده از حیوانات همراه و مدلهای طبیعی سرطان میتوانند در طراحی داروها، پیشبینی پاسخ بیماران و شناسایی اهداف درمانی جدید به کار روند. این تلفیق بین پژوهشهای پایه و بالین انسانی، سرعت توسعه درمانها و اثربخشی آنها را افزایش میدهد و امکان دستیابی به درمانهای نوآورانه و کارآمدتر را فراهم میکند.
پیشگیری، شناسایی زودهنگام و سبک زندگی نیز در آینده سرطانشناسی نقش تعیینکنندهای خواهند داشت. آموزش عمومی، غربالگریهای پیشرفته، ارزیابی عوامل ژنتیکی و محیطی، و مداخلات تغذیهای و ورزشی، باعث کاهش خطر ابتلا به سرطانها و بهبود نتایج درمانی خواهند شد. این ترکیب از رویکردهای پیشگیرانه و درمانی، به یک استراتژی جامع برای مدیریت سرطانها منجر میشود که نه تنها بر درمان بیماری تمرکز دارد، بلکه سلامت کلی و طول عمر بیماران را نیز بهبود میبخشد.
در نهایت، آینده سرطانشناسی یکپارچگی کامل بین فناوری، علم مولکولی، پزشکی شخصیسازیشده و مراقبتهای جامع را نشان میدهد. این مسیر منجر به درمانهایی هدفمند، اثربخش و کمعارضه میشود، کیفیت زندگی بیماران را بهبود میبخشد و امکان مقابله با سرطانهای مقاوم و پیشرفته را فراهم میآورد. انتظار میرود که در دهههای آینده، ترکیب این فناوریها و رویکردها، انکولوژی را از یک علم واکنشی و پروتکلمحور به یک علم پیشبینانه، پویا و کاملاً شخصیسازیشده تبدیل کند و تحولی بیسابقه در درمان و مدیریت سرطانها ایجاد نماید.
جمعبندی و نتیجهگیری
سرطانشناسی یا انکولوژی، رشتهای چندبعدی و پویا است که از زمان شناسایی اولیه سلولهای سرطانی تا توسعه درمانهای پیشرفته و شخصیسازیشده، مسیر پیچیدهای را طی کرده است. مروری جامع بر این حوزه نشان میدهد که درمان و مدیریت سرطانها نیازمند ترکیبی از دانش پایه، فناوریهای نوین و مراقبتهای جامع بیمار محور است.
در بخش ابتدایی، مقدمهای بر سرطانشناسی به اهمیت شناخت ماهیت بیماری، عوامل خطر و پیامدهای اجتماعی و بالینی سرطانها پرداخت. مشخص شد که سرطانها نه تنها یک چالش پزشکی هستند، بلکه اثرات گستردهای بر کیفیت زندگی بیماران و خانوادههای آنها دارند.
با پیشروی به زیستشناسی سرطان، مشخص شد که سرطانها نتیجه تعامل پیچیده بین جهشهای ژنتیکی، تغییرات اپیژنتیکی، اختلالات مسیرهای سیگنالینگ و عوامل محیطی هستند. درک این مکانیزمها، اساس طراحی درمانهای هدفمند و توسعه رویکردهای پیشگیرانه را فراهم میکند و نقش حیاتی در پزشکی دقیق دارد.
در بخش طبقهبندی سرطانها، اهمیت تشخیص نوع و زیرنوع تومور برای انتخاب درمان مناسب و پیشبینی پیشآگهی بیماران برجسته شد. طبقهبندی دقیق، اساس تصمیمگیری درمانی و توسعه استراتژیهای نوین را تشکیل میدهد.
روشهای تشخیص در سرطانشناسی نیز به طور گسترده بررسی شدند و مشخص شد که ترکیب روشهای تصویربرداری، آزمایشهای مولکولی و بیومارکرها، امکان شناسایی زودهنگام تومورها و پایش پاسخ به درمان را فراهم میکند. پیشرفتهای فناورانه و ظهور سیستمهای هوشمند، دقت و سرعت تشخیص را بهبود بخشیدهاند و نقش کلیدی در مدیریت بهینه بیماری دارند.
در حوزه درمانهای کلاسیک، شیمیدرمانی، پرتودرمانی و جراحی، ستونهای اصلی درمان سرطانها باقی ماندهاند، اما محدودیتها و عوارض جانبی این روشها، نیاز به توسعه درمانهای دقیقتر و شخصیسازیشده را برجسته کرده است.
پزشکی دقیق و انکولوژی شخصیسازیشده، چشمانداز جدیدی در درمان سرطانها ایجاد کرده است. استفاده از دادههای مولکولی، ژنتیکی و بالینی، امکان طراحی درمانهای منحصر به فرد برای هر بیمار را فراهم میآورد و اثربخشی و ایمنی درمانها را بهبود میبخشد.
در بخش ایمونوتراپی و درمانهای نوین، مشخص شد که فناوریهای مانند CAR-T، آنتیبادیهای چندوجهی و نانوزایمها، قابلیت هدفگیری دقیق تومورها را دارند و میتوانند بیماران مقاوم به درمانهای سنتی را تحت پوشش قرار دهند.
رادیوترانواستیک و پزشکی هستهای پیشرفته نشان داد که ترکیب درمان و تشخیص در یک رویکرد واحد، امکان پایش دقیق پاسخ به درمان و اصلاح برنامهها را فراهم میکند و به سمت پزشکی پویا و دقیق حرکت میکند.
با پیشرفت هوش مصنوعی و انکولوژی هوشمند، توانایی تحلیل دادههای بالینی، مولکولی و تصویربرداری، پیشبینی پاسخ بیمار و بهینهسازی دوز داروها، به سطحی بیسابقه رسیده است. این فناوریها همچنین امکان مدیریت علائم جانبی و بهبود کیفیت زندگی بیماران را فراهم میآورند.
مراقبتهای حمایتی و رویکرد چندرشتهای بر اهمیت مدیریت جامع بیماران، توجه به جنبههای روانی، تغذیهای و توانبخشی تاکید کردند. این رویکرد، تجربه درمانی انسانی، امن و اثربخش را برای بیماران فراهم میکند و مکمل درمانهای بالینی است.
در حوزه انکولوژی مقایسهای، استفاده از حیوانات همراه به عنوان مدلهای طبیعی سرطان، چشمانداز تحقیقاتی جدیدی ایجاد کرده است. این مطالعات امکان شناسایی اهداف درمانی جدید، پیشبینی مقاومت دارویی و بهبود طراحی درمانها را فراهم میکنند.
در نهایت، آینده سرطانشناسی با همگرایی فناوریهای نوین، پزشکی دقیق، مراقبتهای جامع و تحقیقات پیشرفته، امکان ارائه درمانهای کمعارضه، هدفمند و اثربخش را فراهم میآورد. تمرکز بر پیشگیری، شناسایی زودهنگام، سبک زندگی سالم و مدیریت جامع بیماران، مکمل درمانهای پیشرفته است و چشمانداز امیدبخشی برای بیماران و جامعه پزشکی ایجاد میکند.
در جمعبندی، میتوان گفت که سرطانشناسی امروز در مسیر تحولی بنیادین قرار دارد؛ از درمانهای کلاسیک و استاندارد گرفته تا رویکردهای شخصیسازیشده و هوش مصنوعی، همه بخشهایی از یک چرخه یکپارچه هستند که هدف آن بهبود بقای بیماران، کاهش عوارض درمان و افزایش کیفیت زندگی است. این مسیر ترکیبی از علم، فناوری و مراقبت انسانی، آیندهای روشن و نویدبخش برای مدیریت سرطانها ترسیم میکند و امید به درمانهای موفق و جامع را برای بیماران فراهم میسازد.