مکانیسم های مولکولی در ایجاد سرطان
مقدمه
سرطان به عنوان یکی از پیچیدهترین و تهدیدکنندهترین بیماریهای قرن حاضر، همچنان به یکی از اصلیترین دغدغههای پزشکی و پژوهشی در سطح جهانی تبدیل شده است. این بیماری به دلیل ویژگیهای مولکولی پیچیده، تنوع بالای سلولی و قابلیت سازگاری با محیطهای مختلف، از جمله بیماریهایی است که درمان و کنترل آن چالشهای فراوانی را به همراه دارد. در طول دهههای گذشته، تحقیقات گستردهای بر روی شناسایی عوامل ژنتیکی، اپیژنتیکی و محیطی مؤثر در شکلگیری و پیشرفت سرطان انجام شده است، اما هنوز بسیاری از مکانیسمهای مولکولی آن به طور کامل شناخته نشدهاند.
درک مکانیسمهای مولکولی در سرطان، اساس طراحی استراتژیهای درمانی نوین و هدفمند است. این دانش امکان شناسایی مسیرهای سیگنالینگ حیاتی، ژنهای کلیدی و تغییرات متابولیک سلولهای سرطانی را فراهم میکند و به پزشکان و محققان اجازه میدهد تا درمانها را بر اساس ویژگیهای مولکولی هر تومور شخصیسازی کنند. از آنجا که سرطان تنها یک اختلال سلولی ساده نیست و یک فرآیند پیچیده زیستی چندمرحلهای به شمار میرود، بررسی دقیق مکانیسمهای مولکولی مرتبط با آغاز، رشد، متاستاز و مقاومت به درمان، برای دستیابی به روشهای پیشگیرانه و درمانی مؤثر ضروری است.
یکی از نکات کلیدی در مطالعه سرطان، توجه به تنوع میکرو محیط تومور است. سلولهای سرطانی نه تنها تحت تأثیر عوامل ژنتیکی خود قرار دارند، بلکه تعامل مستمر آنها با سلولهای ایمنی، ماتریکس خارج سلولی و شرایط فیزیکی و شیمیایی محیط، مسیر پیشرفت بیماری را شکل میدهد. به طور مثال، کماکسی یا کاهش اکسیژن در میکرو محیط تومور، موجب فعال شدن مسیرهای سیگنالینگ خاصی میشود که رشد سلولهای سرطانی را تحریک کرده و مقاومت آنها را در برابر درمانهای سنتی افزایش میدهد. همچنین، تغییرات متابولیکی سلولهای سرطانی، مانند گرایش به گلیکولیز حتی در حضور اکسیژن (اثر واربرگ)، نشاندهنده نیاز این سلولها به انرژی و بیومولکولهای مورد نیاز برای تقسیم و تکثیر سریع است.
مکانیسمهای ژنتیکی و اپیژنتیکی، دیگر بخش حیاتی در فهم سرطان هستند. جهشهای آنکوژنها و سرکوبگرهای تومور، تغییرات اسپلیسینگ، و تنظیمات اپیژنتیکی، همگی نقش کلیدی در ایجاد ناپایداری ژنتیکی و افزایش تمایل سلولها به تقسیم غیرقابل کنترل دارند. مسیرهایی مانند p53، Cyclin D1 و سایر مسیرهای تنظیم چرخه سلولی، نمونههایی از نقاط کلیدی هستند که مطالعه آنها درک عمیقی از نحوه کنترل یا فرار سلولهای سرطانی از مکانیسمهای طبیعی آپوپتوز فراهم میکند.
از سوی دیگر، تعامل سرطان با سیستم ایمنی و پاسخ به درمانهای نوین، یک بعد دیگر از پیچیدگی این بیماری را نشان میدهد. سرطان نه تنها میتواند توسط سیستم ایمنی شناسایی و نابود شود، بلکه با استفاده از مکانیسمهای مولکولی متعدد، توانایی فرار از ایمنی میزبان و ایجاد مقاومت به ایمونوتراپی را نیز دارد. درک این مکانیسمها، کلید توسعه استراتژیهای درمانی جدید و شخصیسازی شده است.
علاوه بر این، عوامل محیطی و سبک زندگی، مانند قرارگیری در معرض ترکیبات سرطانزا، رژیم غذایی، وضعیت متابولیک بدن و تغییرات میکروبیوتای روده، به طور مستقیم یا غیرمستقیم بر مسیرهای مولکولی سرطان تأثیر میگذارند. ترکیب این عوامل با تغییرات ژنتیکی و اپیژنتیکی، یک شبکه پیچیده از تعاملات مولکولی ایجاد میکند که تعیینکننده مسیر پیشرفت و شدت بیماری است.
هدف این مقاله، ارائه یک مرور جامع و بهروز از مکانیسمهای مولکولی دخیل در ایجاد سرطان است. این مرور تلاش میکند تمامی ابعاد مولکولی، متابولیکی، ژنتیکی، اپیژنتیکی و محیطی را پوشش دهد و اطلاعات علمی بهروز را با مثالهای بالینی و کاربردهای درمانی مرتبط ترکیب کند. درک این مکانیسمها، نه تنها برای پژوهشگران و متخصصان حوزه سرطان حیاتی است، بلکه به پزشکان، داروسازان و سیاستگذاران حوزه سلامت امکان میدهد تا تصمیمات مبتنی بر شواهد برای پیشگیری، تشخیص و درمان سرطان اتخاذ کنند.
با توجه به پیچیدگیهای متعدد سرطان و نقش کلیدی مکانیسمهای مولکولی در پیشرفت بیماری، ادامه مقاله به بررسی جامع هر یک از این جنبهها، شامل میکرو محیط تومور، مسیرهای ژنتیکی و اپیژنتیکی، تغییرات متابولیک، متاستاز و مهاجرت سلولی، مقاومت به درمان، اثرات عوامل محیطی و سبک زندگی، سرطانهای خاص و راهکارهای درمانی مبتنی بر مکانیسم مولکولی خواهد پرداخت. این رویکرد جامع، پایهای قوی برای درک کامل و علمی بیماری سرطان و توسعه استراتژیهای نوین درمانی فراهم میکند.
میکرو محیط تومور و نقش آن در سرطان
سلولهای سرطانی به تنهایی قادر به پیشرفت و ایجاد تومور نیستند؛ آنها در یک محیط پیچیده و پویا قرار دارند که شامل سلولهای ایمنی، سلولهای اندوتلیال، فیبروبلاستها، ماتریکس خارج سلولی و مولکولهای سیگنالدهنده متعدد است. این مجموعه که به آن میکرو محیط تومور گفته میشود، نه تنها شرایط رشد سلولهای سرطانی را فراهم میکند، بلکه مسیرهای سیگنالینگ متعدد و متنوعی را فعال میکند که منجر به تکثیر، بقا و مقاومت سلولها میشود. میکرو محیط تومور یک شبکه پیچیده است که هر جزء آن با دیگر اجزا تعامل دارد و در نتیجه، رفتار تومور را به طور کلی شکل میدهد.
یکی از ویژگیهای شاخص میکرو محیط تومور، کماکسی یا کاهش اکسیژن است. تومورهای در حال رشد به سرعت نیاز به اکسیژن دارند، اما رگزایی ناکافی باعث ایجاد مناطق کماکسی میشود. کماکسی باعث فعال شدن فاکتورهای هستهای مانند HIF-1α میشود که مسیرهای متعددی از جمله بیوسنتز گلیکولیتیک، مقاومت به آپوپتوز و تحریک رگزایی را تنظیم میکند. این فرآیند نه تنها به سلولهای سرطانی اجازه زنده ماندن در شرایط دشوار را میدهد، بلکه توانایی مهاجرت و متاستاز آنها را نیز افزایش میدهد. مطالعات اخیر نشان میدهد که کماکسی باعث مقاومت سلولها به درمانهای رادیوتراپی و شیمیدرمانی میشود، زیرا سلولهای کماکسی کمتر در معرض آسیبهای اکسیداتیو قرار میگیرند.
علاوه بر اکسیژن، شرایط شیمیایی و متابولیکی میکرو محیط نیز تأثیر بسزایی در پیشرفت سرطان دارد. سلولهای سرطانی با استفاده از اثر واربرگ، حتی در حضور اکسیژن، انرژی خود را عمدتاً از طریق گلیکولیز تامین میکنند. این تغییر متابولیکی باعث تولید لاکتات و کاهش pH محیط میشود، که نه تنها موجب تغییر رفتار سلولهای سرطانی میگردد، بلکه بر سلولهای ایمنی اطراف و پاسخ به درمان نیز اثرگذار است. محیط اسیدی، عملکرد سلولهای T و سلولهای NK را سرکوب کرده و موجب فرار ایمنی تومور میشود.
یکی دیگر از مؤلفههای کلیدی میکرو محیط، میکروبیوتای روده و باکتریهای مرتبط با سیستم ایمنی است. تحقیقات اخیر نشان میدهد که تغییر ترکیب میکروبیوتای روده میتواند پاسخ به ایمونوتراپی را به طور قابل توجهی تغییر دهد. برخی باکتریها باعث تقویت عملکرد سلولهای ایمنی و افزایش حساسیت به درمان میشوند، در حالی که تغییرات نامطلوب میکروبیوتا موجب افزایش مقاومت تومور و پیشرفت سریع آن میگردد. این یافتهها اهمیت ارتباط بین میکرو محیط سیستمیک و محیط موضعی تومور را برجسته میکند و نشان میدهد که سرطان یک فرآیند چندبعدی است که نه تنها به ژنتیک سلولی، بلکه به وضعیت محیطی و سیستمی بیمار وابسته است.
سلولهای ایمنی میکرو محیط تومور نقش دوگانهای دارند. در حالی که برخی سلولهای ایمنی، مانند سلولهای T و ماکروفاژهای کلاسیک، توانایی شناسایی و حذف سلولهای سرطانی را دارند، سلولهای ایمنی دیگر میتوانند با ترشح فاکتورهای رشد و سیتوکینها، رشد و تکثیر تومور را حمایت کنند. این پدیده به ویژه در تومورهای گرم و سرد دیده میشود؛ تومورهای گرم دارای نفوذ سلولهای ایمنی فعال هستند و پاسخ به ایمونوتراپی بالاتر است، در حالی که تومورهای سرد، دارای محیط ایمنی سرکوبشده و مقاومت بالا به درمان هستند.
فیبروبلاستهای مرتبط با تومور (CAF) و ماتریکس خارج سلولی نیز بخش مهمی از میکرو محیط را تشکیل میدهند. این فیبروبلاستها با تولید ماتریکس خارج سلولی و فاکتورهای رشد، نه تنها رشد سلولهای سرطانی را تسهیل میکنند، بلکه مسیرهای متابولیکی و سیگنالینگ را تغییر میدهند و موجب مقاومت به دارو و رادیوتراپی میشوند. تعامل فیبروبلاستها با سلولهای سرطانی، باعث ایجاد شرایط محیطی مطلوب برای مهاجرت و متاستاز میگردد و نشاندهنده نقش حیاتی میکرو محیط در کل چرخه زندگی تومور است.
از سوی دیگر، استرس اکسیداتیو و تولید گونههای فعال اکسیژن (ROS) نیز یکی از عوامل مهم در تنظیم میکرو محیط تومور است. تولید کنترل نشده ROS میتواند به آسیب DNA، فعال شدن مسیرهای بقا و تحریک مسیرهای مقاومت به درمان منجر شود. سلولهای سرطانی با تقویت مکانیزمهای دفاعی ضد اکسیداتیو، مانند افزایش فعالیت NADPH اکسیدازها و سیتروکینهای آنتیاکسیدان داخلی، میتوانند در محیطهای پر ROS زنده بمانند و رشد کنند. این مکانیسمها هدف مناسبی برای درمانهای مبتنی بر ROS و مهار مقاومت تومور فراهم میکنند.
در مجموع، میکرو محیط تومور یک شبکه پیچیده و پویا است که شامل کماکسی، تغییرات متابولیکی، سلولهای ایمنی، فیبروبلاستها، ماتریکس خارج سلولی، میکروبیوتا و استرس اکسیداتیو میشود. تعامل این عوامل نه تنها رشد و تکثیر سلولهای سرطانی را تسهیل میکند، بلکه مسیرهای مقاومت به درمان را فعال میکند و پیشبینی پاسخ به درمانهای نوین را پیچیده میسازد. درک کامل میکرو محیط تومور، کلید توسعه درمانهای هدفمند، بهینهسازی ایمونوتراپی و افزایش موفقیت درمانهای ترکیبی است.
مکانیسمهای ژنتیکی و اپیژنتیکی
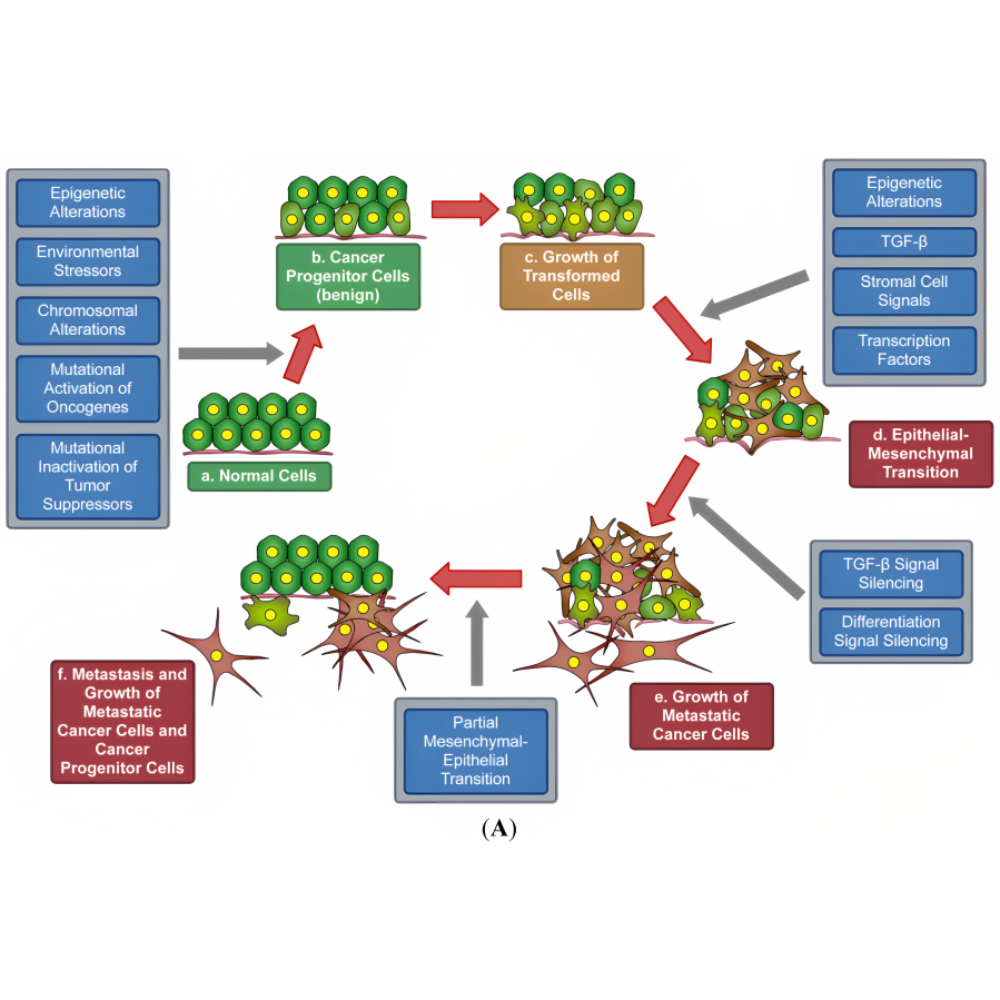
درک سرطان بدون بررسی مکانیسمهای ژنتیکی و اپیژنتیکی غیرممکن است، زیرا تغییرات در سطح DNA، RNA و پروتئینها اساس پیدایش و تکامل سلولهای سرطانی را تشکیل میدهند. سلولهای سرطانی معمولاً دارای ناپایداری ژنتیکی بالا هستند که به آنها امکان میدهد با فشار محیطی و درمانهای مختلف سازگار شوند. این ناپایداری ژنتیکی از طریق فعال شدن آنکوژنها، سرکوب ژنهای مهارکننده تومور، تغییرات اسپلیسینگ و تنظیمات اپیژنتیکی ایجاد میشود و مسیرهای کلیدی تقسیم، بقا و مهاجرت سلولی را تحت تأثیر قرار میدهد.
یکی از پایههای اصلی سرطان، فعال شدن آنکوژنها است. آنکوژنها ژنهایی هستند که در حالت طبیعی، نقش کنترل رشد و تقسیم سلولی را دارند، اما با جهش یا بیان بیش از حد، موجب افزایش تقسیم سلولی غیرقابل کنترل میشوند. از جمله آنکوژنهای شناخته شده میتوان به Ras، Myc و HER2 اشاره کرد. فعال شدن این ژنها باعث فعال شدن مسیرهای سیگنالینگ متعددی مانند MAPK، PI3K/AKT و mTOR میشود که بقای سلولهای سرطانی را تضمین کرده و توانایی آنها در فرار از آپوپتوز را افزایش میدهد.
در مقابل، ژنهای سرکوبگر تومور نقش محافظتی در جلوگیری از رشد غیرطبیعی سلولها دارند. یکی از مهمترین ژنها در این دسته، p53 است که به عنوان «نگهبان ژنوم» شناخته میشود. p53 میتواند در پاسخ به آسیب DNA، چرخه سلولی را متوقف کند، مسیرهای ترمیم DNA را فعال کند یا سلول را به مسیر آپوپتوز هدایت کند. با این حال، در بسیاری از سرطانها، p53 دچار جهش یا بیثباتی میشود و عملکرد محافظتی خود را از دست میدهد. این اختلال به سلولهای سرطانی اجازه میدهد تا بدون کنترل رشد کنند، جهشهای بیشتر جمعآوری کنند و مقاومت به درمان ایجاد نمایند.
علاوه بر این، تغییرات اسپلیسینگ RNA نقش مهمی در سرطان دارند. اسپلیسینگ نادرست میتواند منجر به تولید ایزوفرمهای غیرطبیعی پروتئینها شود که مسیرهای رشد، بقا و مهاجرت سلولی را تقویت میکنند. برای مثال، اسپلیسینگ غیرطبیعی Cyclin D1 باعث فعال شدن مسیرهای چرخه سلولی و افزایش تکثیر سلولهای سرطانی میشود. پژوهشهای اخیر نشان میدهند که این تغییرات اسپلیسینگ میتوانند هدف درمانی بالقوهای برای طراحی داروهای نوین باشند، زیرا مهار اسپلیسینگ غیرطبیعی میتواند رشد تومور را کاهش دهد.
در کنار تغییرات ژنتیکی، تنظیمات اپیژنتیکی نقش حیاتی در سرطان دارند. اپیژنتیک به تغییرات بیان ژنها بدون تغییر در توالی DNA گفته میشود و شامل متیلاسیون DNA، تغییرات هیستونی و تنظیمات RNA غیرکدکننده است. این تنظیمات میتوانند ژنهای سرکوبگر تومور را خاموش کرده یا آنکوژنها را فعال کنند. برای مثال، متیلاسیون بیش از حد پروموتر ژنهای سرکوبگر تومور باعث خاموشی آنها و افزایش رشد سلولهای سرطانی میشود، در حالی که تغییرات هیستونی میتوانند دسترسی به ژنها را محدود کرده و مسیرهای سیگنالینگ حیاتی را تحت تأثیر قرار دهند.
RNAهای غیرکدکننده مانند miRNA و lncRNA نیز نقش مهمی در تنظیم بیان ژنها دارند. این مولکولها میتوانند مسیرهای بقا، مهاجرت و مقاومت به درمان را کنترل کنند. برای مثال، برخی miRNAها با مهار ژنهای سرکوبگر تومور، رشد سلولهای سرطانی را تقویت میکنند، در حالی که برخی دیگر با هدف قرار دادن آنکوژنها میتوانند به عنوان بیومارکرهای تشخیصی و درمانی مورد استفاده قرار گیرند.
یکی دیگر از بخشهای حیاتی در اپیژنتیک، تغییرات در میکرو محیط اپیژنتیک سلولهای سرطانی است. سلولهای سرطانی میتوانند با ترشح فاکتورهای مختلف، اپیژنتیک سلولهای مجاور را تغییر دهند و یک محیط مطلوب برای رشد و مهاجرت ایجاد کنند. این تغییرات شامل القای هیستون استیلازها، متیلازهای DNA و تنظیم RNAهای غیرکدکننده است که در نهایت منجر به پیشرفت تومور و مقاومت به درمان میشود.
ناپایداری ژنتیکی و اپیژنتیکی باعث میشود که سلولهای سرطانی در مواجهه با فشارهای محیطی و درمانهای مختلف بتوانند مسیرهای جدید بقا و مهاجرت را فعال کنند. این ویژگی، سرطان را به یک بیماری پویا و چندوجهی تبدیل میکند که پاسخ به درمانهای سنتی را پیچیده میسازد. به همین دلیل، درک کامل مسیرهای ژنتیکی و اپیژنتیکی، کلید طراحی داروهای هدفمند، مهار آنکوژنها، فعالسازی ژنهای سرکوبگر و تنظیم مسیرهای سیگنالینگ است.
در نهایت، ترکیب مکانیسمهای ژنتیکی و اپیژنتیکی با تغییرات میکرو محیط تومور و شرایط متابولیکی، شبکهای پیچیده از تعاملات مولکولی ایجاد میکند که مسیر پیشرفت سرطان را شکل میدهد. این تعاملات باعث میشوند که سرطان نه تنها یک اختلال ژنتیکی ساده نباشد، بلکه یک فرآیند پیچیده زیستی چندمرحلهای با قابلیت فرار از درمان و سازگاری با محیطهای مختلف باشد.
درک کامل مکانیسمهای ژنتیکی و اپیژنتیکی، کلید توسعه درمانهای نوین و شخصیسازی درمان سرطان است و به پژوهشگران و پزشکان امکان میدهد تا راهکارهای مؤثر برای کنترل رشد تومور و کاهش مقاومت دارویی ارائه دهند.
فرایندهای سلولی و متابولیکی در سرطان
سلولهای سرطانی برخلاف سلولهای طبیعی، دارای ویژگیهای متابولیکی و سلولی غیرمعمول هستند که آنها را قادر میسازد در محیطهای دشوار رشد کنند، از مرگ سلولی فرار کنند و به سرعت تکثیر شوند. این ویژگیها شامل تغییرات متابولیکی، پاسخ به استرس اکسیداتیو، مکانیزمهای اتوفاژی و فروپتوز است که هر یک نقش کلیدی در پیشرفت و مقاومت تومور دارند.
یکی از مهمترین ویژگیهای متابولیکی سلولهای سرطانی، اثر واربرگ است. در شرایط طبیعی، سلولها انرژی خود را عمدتاً از طریق فسفوریلاسیون اکسیداتیو در میتوکندری تولید میکنند، اما سلولهای سرطانی حتی در حضور اکسیژن، ترجیح میدهند انرژی خود را از طریق گلیکولیز بیهوازی تولید کنند. این فرآیند موجب تولید سریع ATP و بیومولکولهای لازم برای سنتز نوکلئوتیدها، اسیدهای آمینه و لیپیدها میشود و بنابراین تکثیر سریع سلولهای سرطانی را امکانپذیر میسازد. علاوه بر این، افزایش تولید لاکتات ناشی از گلیکولیز باعث اسیدی شدن محیط اطراف تومور میشود که مهاجرت سلولهای سرطانی و فرار از پاسخ ایمنی را تسهیل میکند. این تغییر متابولیکی هدف مهمی برای توسعه درمانهای مبتنی بر مهار مسیرهای گلیکولیتیک به شمار میرود.
گونههای فعال اکسیژن (ROS) بخش دیگری از فرآیندهای سلولی هستند که نقش دوگانه در سرطان دارند. در سطح پایین، ROS به عنوان سیگنالدهنده برای رشد و بقا عمل میکنند، اما در سطح بالا میتوانند آسیب DNA ایجاد کرده و مسیرهای آپوپتوز را فعال کنند. سلولهای سرطانی با تقویت سیستمهای دفاعی آنتیاکسیدانی مانند NADPH اکسیدازها، گلوتاتیون و سیتوکرومها، توانایی مقابله با استرس اکسیداتیو را پیدا میکنند و از این طریق مقاومت به شیمیدرمانی و رادیوتراپی ایجاد میشود. هدف قرار دادن این مسیرها، به ویژه در تومورهای مقاوم، یک استراتژی نوین درمانی محسوب میشود.
یکی دیگر از فرآیندهای حیاتی در سلولهای سرطانی، اتوفاژی است. اتوفاژی فرآیندی است که طی آن سلولها اجزای آسیبدیده و پروتئینهای غیرضروری را تجزیه و بازسازی میکنند. در سرطان، اتوفاژی نقش دوگانهای دارد: در مراحل اولیه تومور، اتوفاژی میتواند به عنوان یک مکانیسم محافظتی عمل کرده و رشد سلولهای سرطانی را محدود کند، اما در مراحل پیشرفته، اتوفاژی به سلولهای سرطانی امکان بقا در شرایط کمبود مواد مغذی و استرس اکسیداتیو را میدهد. این ویژگی اتوفاژی، به ویژه در مقاومت به داروهای ضد سرطان، اهمیت بالایی دارد و مهارکنندههای اتوفاژی میتوانند پاسخ درمانی را افزایش دهند.
فروپتوز، یک مکانیسم جدید مرگ سلولی برنامهریزی شده، به ویژه در سلولهای سرطانی مورد توجه قرار گرفته است. فروپتوز ناشی از تجمع آهن و تولید ROS در غشای سلولی است و سلولها را از طریق استرس اکسیداتیو میکشند. تحقیقات اخیر نشان میدهند که تحریک فروپتوز میتواند رشد تومور را مهار کرده و سلولهای مقاوم به درمان را حساس کند. ترکیب فروپتوز با داروهای شیمیدرمانی یا درمانهای هدفمند، یک رویکرد نوین و امیدبخش برای مقابله با سرطانهای مقاوم به درمان ارائه میدهد.
در کنار این مسیرها، تغییرات در مسیرهای سیگنالینگ سلولی و مسیرهای متابولیکی خاص نیز نقش کلیدی در پیشرفت سرطان دارند. مسیرهایی مانند PI3K/AKT/mTOR، AMPK، و MAPK در کنترل بقا، تکثیر و پاسخ به استرس متابولیکی فعال هستند. فعال شدن این مسیرها، سلولهای سرطانی را قادر میسازد تا انرژی مورد نیاز خود را تامین کرده و با فشارهای محیطی و دارویی مقابله کنند. از سوی دیگر، مهار این مسیرها میتواند پاسخ درمانی را افزایش داده و رشد تومور را کاهش دهد.
تعامل متابولیسم با میکرو محیط تومور نیز اهمیت ویژهای دارد. تولید لاکتات و اسیدهای چرب توسط سلولهای سرطانی، علاوه بر تغییر pH محیط، موجب سرکوب عملکرد سلولهای ایمنی مانند سلولهای T و NK میشود و توانایی فرار ایمنی را افزایش میدهد. همچنین، تغییرات متابولیکی باعث فعال شدن مسیرهای مهاجرت و متاستاز میشوند، به ویژه در تومورهایی که در محیطهای کماکسی رشد میکنند.
فرایندهای سلولی و متابولیکی سرطان، همچنین با مقاومت به درمان و تکثیر سلولهای بنیادی سرطانی مرتبط هستند. سلولهای بنیادی تومور، که مسئول بازسازی و پیشرفت تومور هستند، اغلب دارای متابولیسم منحصر به فرد و مکانیسمهای دفاعی فعال میباشند که آنها را در برابر شیمیدرمانی و رادیوتراپی مقاوم میکند. مطالعه و هدف قرار دادن این سلولها، کلید طراحی درمانهای مؤثر و کاهش عود سرطان است.
در نهایت، ترکیب تغییرات متابولیکی، سیگنالینگ سلولی، اتوفاژی، فروپتوز و استرس اکسیداتیو یک شبکه پیچیده و پویا ایجاد میکند که مسیر رشد، بقا و مهاجرت سلولهای سرطانی را شکل میدهد. درک این شبکه، نه تنها برای طراحی داروهای هدفمند، بلکه برای پیشبینی پاسخ به درمان و توسعه استراتژیهای ترکیبی درمانی حیاتی است.
فرایندهای سلولی و متابولیکی، قلب فعالیت سلولهای سرطانی هستند و مطالعه دقیق آنها کلید موفقیت درمانهای نوین سرطان محسوب میشود.
مکانیسمهای مولکولی متاستاز و مهاجرت سلولی
متاستاز یا انتشار سلولهای سرطانی به بافتها و اندامهای دور، یکی از پیچیدهترین و مهمترین ویژگیهای سرطان است که مسئول بیشترین مرگ و میر ناشی از این بیماری محسوب میشود. این فرآیند، شامل چندین مرحله کلیدی است: شکستن اتصال سلولی، مهاجرت سلول، نفوذ به ماتریکس خارج سلولی، ورود به عروق خونی یا لنفاوی، بقا در جریان خون، خروج از عروق و تشکیل تومور ثانویه. هر یک از این مراحل توسط مسیرهای مولکولی پیچیده و چندلایهای کنترل میشوند که مطالعه آنها برای طراحی درمانهای هدفمند و جلوگیری از گسترش سرطان حیاتی است.
یکی از مکانیزمهای اصلی متاستاز، انتقال اپیتلیال به مزانشیمال (EMT) است. EMT فرآیندی است که طی آن سلولهای اپیتلیال که به طور طبیعی دارای اتصالات قوی و چسبندگی بالا هستند، ویژگیهای مزانشیمال پیدا میکنند؛ یعنی توانایی مهاجرت و نفوذ به بافتهای اطراف را به دست میآورند. این تغییر سلولی توسط فاکتورهای ترانسکریپسی مانند Snail، Twist و Zeb1 تنظیم میشود و منجر به کاهش بیان مولکولهای چسبندگی مانند E-cadherin و افزایش بیان پروتئینهای مزانشیمال مانند N-cadherin و ویمتین میگردد. فعال شدن EMT نه تنها مهاجرت سلولهای سرطانی را تسهیل میکند، بلکه باعث افزایش مقاومت به دارو و ایجاد سلولهای بنیادی سرطانی میشود، که نقش کلیدی در عود تومور و گسترش متاستاز دارد.
وزیکولهای خارج سلولی (sEVs) و اگزووزومها نیز در فرآیند متاستاز اهمیت فراوان دارند. سلولهای سرطانی این وزیکولها را حاوی پروتئینها، RNA و miRNAها به محیط خارج سلولی ترشح میکنند. این وزیکولها قادرند سلولهای مجاور و سلولهای ایمنی را تغییر دهند، مسیرهای سیگنالینگ مهاجرت را فعال کنند و آمادهسازی میکرو محیط برای پذیرش سلولهای متاستاتیک را انجام دهند. به عبارت دیگر، sEVها مانند یک پیامرسان مولکولی عمل میکنند که شرایط محیطی را برای مهاجرت و تثبیت تومور ثانویه مهیا میسازد.
یکی دیگر از مسیرهای حیاتی در مهاجرت و متاستاز، فعال شدن ماتریکس متالوپروتئینازها (MMPs) است. این آنزیمها قادرند ماتریکس خارج سلولی را تجزیه کنند و مسیر سلولهای سرطانی را برای نفوذ به بافتهای اطراف و ورود به عروق باز کنند. فعال شدن MMPها توسط مسیرهای سیگنالینگ متعدد، از جمله PI3K/AKT، MAPK و TGF-β تنظیم میشود و نقش کلیدی در تشکیل میکرو متاستاز و افزایش تهاجم سلولها دارد.
متاستاز غدد لنفاوی، یکی از مراحل کلیدی در انتشار سرطان است. سلولهای سرطانی با نفوذ به سیستم لنفاوی، میتوانند به گرههای لنفاوی دسترسی پیدا کنند و از آنجا به سایر اندامها منتقل شوند. این فرآیند با فعال شدن مسیرهای سیگنالینگ مانند VEGF-C/VEGFR3 که موجب رگزایی لنفاوی و افزایش نفوذپذیری عروق میشود، تسهیل میگردد. حضور سلولهای سرطانی در غدد لنفاوی، اغلب نشاندهنده پیشرفت بیماری و پیشآگهی نامطلوب است و یکی از مهمترین فاکتورهای تعیینکننده مرحله سرطان محسوب میشود.
تعامل با سلولهای ایمنی میکرو محیط نیز نقش حیاتی در متاستاز دارد. سلولهای سرطانی با ترشح سیتوکینها و فاکتورهای سرکوبگر ایمنی، عملکرد سلولهای T و NK را کاهش میدهند و محیطی ایمن برای مهاجرت ایجاد میکنند. برخی سلولهای ایمنی مانند ماکروفاژهای مرتبط با تومور (TAMs) نیز با ترشح MMPها و فاکتورهای رشد، مسیر مهاجرت سلولهای سرطانی را تسهیل میکنند.
متاستاز همچنین با تغییرات متابولیکی و استرس اکسیداتیو در سلولهای سرطانی مرتبط است. سلولهای متاستاتیک برای زنده ماندن در جریان خون و مهاجرت به بافتهای دور، نیاز به انرژی زیاد و مقاومت به ROS دارند. مسیرهای متابولیکی مانند گلیکولیز، مسیرهای لیپیدی و تولید آنزیمهای ضد اکسیدانی این توانایی را برای سلولها فراهم میکنند. این ویژگیها نشان میدهد که مهاجرت و متاستاز سلولهای سرطانی فرآیندی پویا و چندلایه است که نیازمند هماهنگی بین مسیرهای سیگنالینگ، متابولیک و محیطی میباشد.
در نهایت، متاستاز یک فرآیند تکاملی و انتخاب طبیعی سلولهای سرطانی است که طی آن سلولهایی که قادر به مهاجرت، بقا و تثبیت در بافتهای دور هستند، برنده میشوند و رشد تومور ثانویه را ایجاد میکنند. این فرآیند به شدت تحت تأثیر مکانیسمهای مولکولی مانند EMT، وزیکولهای خارج سلولی، MMPها، مسیرهای لنفاوی و تعامل با سلولهای ایمنی است.
درک کامل مکانیسمهای مولکولی متاستاز و مهاجرت سلولی، پایهای برای طراحی درمانهای هدفمند، مهار انتشار سرطان و بهبود پیشآگهی بیماران است. مطالعات اخیر نشان میدهند که ترکیب درمانهای هدفمند بر EMT، MMPها و مسیرهای لنفاوی، همراه با تقویت پاسخ ایمنی، میتواند احتمال متاستاز را کاهش دهد و موفقیت درمانهای ترکیبی را افزایش دهد.
مقاومت تومور به درمان
یکی از بزرگترین چالشها در درمان سرطان، مقاومت سلولهای سرطانی به درمانهای مختلف است. مقاومت تومور میتواند به صورت اولیه (innate) یا اکتسابی (acquired) رخ دهد و دلیل اصلی شکست درمانهای شیمیدرمانی، رادیوتراپی و ایمونوتراپی محسوب میشود. درک مکانیسمهای مولکولی مقاومت، کلید توسعه درمانهای هدفمند و موفقیتآمیز است.
مقاومت به شیمیدرمانی یکی از رایجترین اشکال مقاومت است. سلولهای سرطانی میتوانند با فعالسازی مسیرهای بقا، افزایش حذف دارو از سلول، تغییرات متابولیکی و افزایش فعالیت سیستمهای دفاعی ضد اکسیدان، اثر داروها را کاهش دهند. به عنوان مثال، فعال شدن مسیر PI3K/AKT/mTOR باعث تقویت بقا و سرکوب آپوپتوز ناشی از داروها میشود. همچنین، افزایش بیان پمپهای خروج دارو مانند P-gp و MRP1، داروهای شیمیدرمانی را از سلول خارج میکند و مانع از ایجاد اثر درمانی میشود. تغییرات متابولیکی، مانند افزایش گلیکولیز و تولید آنتیاکسیدانها، نیز به سلولهای سرطانی کمک میکنند تا در شرایط استرس ناشی از دارو زنده بمانند.
مقاومت به رادیوتراپی عمدتاً به علت توانایی سلولهای سرطانی در مقابله با آسیب DNA و استرس اکسیداتیو ایجاد میشود. سلولهای مقاوم قادرند با فعال کردن مسیرهای ترمیم DNA مانند ATM/ATR، افزایش بیان آنزیمهای آنتیاکسیدان و تغییرات متابولیکی، آسیب ناشی از رادیوتراپی را کاهش دهند. همچنین، محیط کماکسی در تومورها باعث کاهش اثر رادیوتراپی میشود، زیرا اکسیژن برای تولید گونههای فعال اکسیژن (ROS) ضروری است که آسیب DNA را ایجاد میکنند.
مقاومت به ایمونوتراپی نیز یک چالش مهم در سرطانهای پیشرفته است. سلولهای سرطانی میتوانند با ایجاد میکرو محیط ایمنی سرکوبشده، افزایش بیان پروتئینهای مهارکننده مانند PD-L1 و ترشح سیتوکینهای ضد ایمنی، عملکرد سلولهای T و NK را مختل کنند. علاوه بر این، تغییرات ژنتیکی و اپیژنتیکی میتوانند مسیرهای سیگنالینگ ایمنی را مهار کرده و موجب فرار سلولی از شناسایی توسط سیستم ایمنی شوند. برخی سلولهای سرطانی حتی میتوانند با تولید وزیکولهای خارج سلولی حاوی miRNA یا پروتئینهای سرکوبگر ایمنی، سیگنالهای مهارکنندهای به سلولهای ایمنی منتقل کنند.
یکی دیگر از مکانیسمهای کلیدی مقاومت، سلولهای بنیادی تومور هستند. این سلولها دارای توانایی بازسازی تومور، مقاومت به دارو و فرار از مرگ سلولی هستند و اغلب مسئول عود سرطان پس از درمان میباشند. مسیرهای سیگنالینگ مانند Wnt/β-catenin، Notch و Hedgehog در حفظ سلولهای بنیادی تومور و مقاومت آنها نقش دارند.
استرس اکسیداتیو و ROS نیز در مقاومت نقش مهمی ایفا میکنند. سلولهای سرطانی میتوانند با افزایش فعالیت سیستمهای آنتیاکسیدان، مانند NADPH اکسیدازها و گلوتاتیون، ROS تولید شده توسط داروها یا رادیوتراپی را خنثی کنند. این توانایی، سلولها را در برابر آسیب اکسیداتیو مقاوم میسازد و مسیر رشد و بقا را حفظ میکند.
مقاومت چندمکانی نیز معمول است؛ به این معنا که سلولهای سرطانی میتوانند همزمان به داروهای شیمیدرمانی، رادیوتراپی و ایمونوتراپی مقاوم شوند. این مقاومت ترکیبی، ناشی از ترکیب تغییرات ژنتیکی، اپیژنتیکی، متابولیکی و محیطی است و درمان این سلولها را بسیار دشوار میکند.
راهکارهای نوین برای غلبه بر مقاومت شامل ترکیب داروها برای هدف قرار دادن مسیرهای سیگنالینگ بقا، مهار پمپهای خروج دارو، تغییر متابولیسم سلولی و فعالسازی پاسخ ایمنی است. برای مثال، ترکیب مهارکنندههای PI3K/AKT با داروهای شیمیدرمانی میتواند حساسیت سلولهای مقاوم را افزایش دهد. همچنین، استفاده از فاکتورهای تحریککننده فروپتوز یا اتوفاژی میتواند مقاومت را کاهش داده و اثر درمانی را بهبود بخشد.
در نهایت، مقاومت تومور به درمان یک فرآیند پویا و چندلایه است که شامل تغییرات ژنتیکی، اپیژنتیکی، متابولیکی، سیگنالینگ سلولی و تعامل با میکرو محیط تومور میباشد. درک این مکانیسمها برای طراحی درمانهای هدفمند، توسعه استراتژیهای ترکیبی و پیشبینی پاسخ بیماران به درمانهای نوین حیاتی است.
مقاومت به درمان، عامل اصلی شکست در مدیریت سرطان است و مقابله با آن نیازمند درک عمیق از مکانیسمهای مولکولی و استفاده از رویکردهای چندجانبه درمانی میباشد.
تأثیر عوامل محیطی و سبک زندگی بر سرطان
عوامل محیطی و سبک زندگی نقش مهمی در شروع و پیشرفت سرطان دارند و میتوانند با تعامل با مکانیسمهای ژنتیکی و متابولیکی، خطر ابتلا و شدت بیماری را افزایش دهند. مطالعات اپیدمیولوژیک و مولکولی نشان دادهاند که حدود ۳۰ تا ۴۰ درصد سرطانها به طور مستقیم به عوامل محیطی و سبک زندگی مرتبط هستند. این عوامل شامل قرارگیری در معرض مواد شیمیایی و آلایندهها، رژیم غذایی، فعالیت بدنی، مصرف دخانیات و الکل، استرس و کیفیت خواب میشوند.
یکی از عوامل محیطی کلیدی، قرارگیری در معرض مواد شیمیایی سرطانزا است. مواد شیمیایی مانند آکرولئین موجود در دود سیگار، آفتکشها و آلایندههای صنعتی میتوانند با ایجاد آسیب DNA، جهشهای ژنتیکی و تغییرات اپیژنتیکی، مسیرهای رشد سلولی را فعال کنند. برای مثال، آکرولئین با اتصال به DNA و پروتئینها موجب آسیب اکسیداتیو و اختلال در مسیرهای ترمیم DNA میشود و خطر ابتلا به سرطانهای ریوی و تنفسی را افزایش میدهد.
دخانیات و مصرف سیگار یکی از شناختهشدهترین عوامل خطر سرطان هستند. مواد موجود در دود سیگار شامل ترکیبات سرطانزا مانند بنزوآنتراسن و نیتروزآمینها است که باعث ایجاد جهش در ژنهای سرکوبگر تومور و آنکوژنها میشوند. همچنین، دود سیگار با ایجاد استرس اکسیداتیو و التهاب مزمن در بافتهای تنفسی، محیطی مساعد برای تکثیر سلولهای سرطانی فراهم میکند. مطالعات نشان دادهاند که ترک سیگار به طور قابل توجهی خطر ابتلا به سرطانهای مختلف را کاهش میدهد، حتی در افراد با سابقه مصرف طولانی.
رژیم غذایی و تغذیه نیز نقش حیاتی در تنظیم مسیرهای مولکولی مرتبط با سرطان دارد. مصرف بالای چربیهای اشباع، قندهای ساده و گوشتهای فرآوریشده میتواند مسیرهای التهاب و ROS را فعال کند و منجر به افزایش خطر سرطان شود. در مقابل، رژیمهای غنی از میوهها، سبزیجات، آنتیاکسیدانها و اسیدهای چرب غیر اشباع با کاهش استرس اکسیداتیو، مهار مسیرهای سیگنالینگ رشد و تنظیم اپیژنتیک، نقش محافظتی در برابر سرطان دارند. مطالعات اخیر نشان دادهاند که آنتیاکسیدانهای طبیعی و ترکیبات غذایی فعال مانند پلیفنولها و فیتوکمیکالها میتوانند مسیرهای ROS، اتوفاژی و فروپتوز را تنظیم کنند و رشد سلولهای سرطانی را مهار نمایند.
فعالیت بدنی منظم نقش محافظتی قابل توجهی دارد. ورزش میتواند با کاهش التهاب مزمن، تنظیم متابولیسم و بهبود پاسخ ایمنی، خطر ابتلا به سرطان را کاهش دهد. به ویژه، فعالیت بدنی منظم با کاهش سطح انسولین و IGF-1، مسیرهای رشد سلولی را کنترل میکند و محیطی نامساعد برای تکثیر سلولهای سرطانی ایجاد میکند.
مصرف الکل نیز با افزایش خطر سرطانهای کبد، پستان و دستگاه گوارش مرتبط است. متابولیسم الکل به استالدهید منجر میشود که میتواند DNA را آسیب زده و مسیرهای ترمیم DNA را مختل کند. علاوه بر این، الکل با افزایش تولید ROS و اختلال در مسیرهای سیگنالینگ ایمنی، به پیشرفت تومور کمک میکند.
استرس مزمن و کیفیت پایین خواب نیز عوامل محیطی تاثیرگذار بر سرطان هستند. استرس مزمن میتواند مسیرهای کورتیزول و NF-κB را فعال کند، موجب التهاب مزمن و تضعیف پاسخ ایمنی شود و زمینه را برای تکثیر سلولهای سرطانی فراهم کند. کیفیت پایین خواب نیز با اختلال در ریتم شبانهروزی و افزایش آسیب DNA مرتبط است و میتواند خطر ابتلا به سرطان را افزایش دهد.
آلودگی محیطی و پرتوهای یونیزان نیز نقش مهمی در ایجاد سرطان دارند. قرارگیری طولانیمدت در معرض اشعه UV یا رادیواکتیو میتواند با ایجاد پیوندهای اشتباه DNA، جهشهای ژنتیکی و استرس اکسیداتیو مسیرهای رشد سلولی را فعال کند و سرطانهای پوست، تیروئید و خون را افزایش دهد.
در نهایت، ترکیب چندین عامل محیطی و سبک زندگی میتواند اثرات سینرژیک داشته باشد و خطر ابتلا به سرطان را به طور قابل توجهی افزایش دهد. برای مثال، فردی که هم سیگار مصرف میکند و هم رژیم غذایی پرچرب دارد، بیشترین ریسک ابتلا به سرطانهای گوارشی و ریوی را خواهد داشت. درک این عوامل و ایجاد استراتژیهای پیشگیری از طریق اصلاح سبک زندگی و کاهش قرارگیری در معرض عوامل محیطی یکی از مهمترین رویکردهای کنترل سرطان در سطح جامعه است.
تأثیر عوامل محیطی و سبک زندگی، تعامل پیچیدهای با مکانیسمهای ژنتیکی، اپیژنتیکی و متابولیکی دارد و تغییرات هدفمند در سبک زندگی میتواند به عنوان یک ابزار مؤثر در پیشگیری و کاهش پیشرفت سرطان مورد استفاده قرار گیرد.
سرطانهای خاص و مکانیسمهای منحصر به فرد
سرطانها با توجه به بافت منشأ، جهشهای ژنتیکی و ویژگیهای میکرو محیط، دارای مکانیسمهای مولکولی خاص هستند که درمان و پیشبینی آنها را پیچیده میکند. برخی از سرطانها مانند سرطانهای ریه، پستان، کولورکتال، پروستات، و سرطانهای مرتبط با ویروسها، مسیرهای منحصر به فردی برای رشد، مقاومت و متاستاز دارند که شناخت آنها برای طراحی درمانهای هدفمند ضروری است.
سرطان ریه یکی از سرطانهای شایع با مکانیسمهای منحصر به فرد است. قرارگیری در معرض دود سیگار و آلودگی هوا موجب ایجاد جهش در ژنهای سرکوبگر تومور مانند TP53 و ژنهای راننده رشد مانند KRAS میشود. یکی از مکانیسمهای مهم، فعالسازی مسیرهای استرس اکسیداتیو توسط ترکیبات دود سیگار مانند آکرولئین است که باعث آسیب DNA و تغییرات اپیژنتیکی میشود. همچنین، سرطانهای ریه میتوانند با تغییر متابولیک مسیرهای گلیکولیز و لیپیدها توانایی مقاومت به دارو و رادیوتراپی را پیدا کنند.
سرطان پستان نیز دارای ویژگیهای مولکولی خاص است. تغییرات ژنتیکی در BRCA1 و BRCA2، مسیرهای سیگنالینگ PI3K/AKT/mTOR و HER2، و وضعیت هورمونی از جمله استروژن و پروژسترون، مسیر رشد و بقا را تعیین میکنند. سرطانهای سهگانه منفی پستان (TNBC) به ویژه به دلیل عدم وجود گیرندههای هورمونی و HER2، وابسته به مسیرهای متابولیک و EMT هستند و درمان آنها چالش برانگیز است. مکانیسم مقاومت به درمان در این نوع سرطانها اغلب ناشی از سلولهای بنیادی تومور و فعال شدن مسیرهای اتوفاژی و فروپتوز است.
سرطان کولورکتال یکی دیگر از سرطانهای خاص با مکانیسمهای مولکولی منحصر به فرد است. مسیر Wnt/β-catenin نقش مرکزی در شروع و پیشرفت این سرطان دارد و جهشهای ژنتیکی در APC و KRAS مسیر تکثیر سلولی را تقویت میکند. علاوه بر این، التهاب مزمن کولون، میکروبیوتای روده و تولید ROS میتوانند موجب آسیب DNA و تغییرات اپیژنتیکی شوند. متاستاز در سرطان کولورکتال اغلب از طریق EMT و وزیکولهای خارج سلولی تسهیل میشود و حضور سلولهای بنیادی تومور در میکرو محیط نقش مهمی در مقاومت به شیمیدرمانی دارد.
سرطان پروستات نیز مکانیسمهای مولکولی ویژهای دارد. وابستگی به آندروژن و مسیرهای سیگنالینگ AR، ویژگی سلولهای سرطانی پروستات را تعیین میکند. مقاومت به درمانهای هورمونی در این سرطان، ناشی از فعال شدن مسیرهای جایگزین سیگنالینگ، جهشهای AR و تعامل با میکرو محیط تومور است. تغییرات متابولیکی مانند افزایش گلیکولیز و استفاده از اسیدهای چرب نیز به بقا و مقاومت سلولهای سرطانی کمک میکند.
سرطانهای مرتبط با ویروسها نیز مکانیسمهای منحصر به فردی دارند. برای مثال، سرطانهای پوست و دهانه رحم مرتبط با HPV ناشی از بیان پروتئینهای E6 و E7 ویروس هستند که باعث غیرفعال شدن TP53 و Rb شده و مسیرهای آپوپتوز و تکثیر سلولی را تغییر میدهند. همچنین، این سرطانها با ایجاد تغییرات اپیژنتیکی، فعالسازی مسیرهای ایمنی و التهاب مزمن توانایی بقا و متاستاز را پیدا میکنند.
برخی سرطانها نیز به دلیل ویژگیهای میکرو محیط خاص خود منحصر به فرد هستند. برای مثال، تومورهای سرد و گرم (cold and hot tumors) با توجه به میزان نفوذ سلولهای ایمنی و فعالیت ایمنی، پاسخ متفاوتی به درمانهای ایمونوتراپی نشان میدهند. تومورهای سرد اغلب با کمبود سلولهای T و افزایش سلولهای سرکوبگر ایمنی همراه هستند، در حالی که تومورهای گرم با فعال شدن مسیرهای ایمنی و التهاب پاسخ درمانی بهتری دارند.
تومورهای نادر و خاص مانند سرطانهای کیستیک ریه و سرطان معده نیز مکانیسمهای ویژهای دارند. سرطانهای کیستیک ریه با فعالسازی مسیرهای ترمیم DNA و مقاومت به شیمیدرمانی مشخص میشوند، در حالی که سرطان معده با تغییرات متابولیک، التهاب مزمن و میکروبیوتا رشد میکنند. تحقیقات اخیر همچنین نشان دادهاند که نانوذرات هدفمند و داروهای نوین میتوانند مسیرهای مولکولی این سرطانها را هدف قرار داده و پاسخ درمانی را بهبود دهند.
در نهایت، مطالعه سرطانهای خاص و مکانیسمهای منحصر به فرد آنها نشان میدهد که هر سرطان یک موجود زنده مولکولی پیچیده است که تعامل بین ژنتیک، اپیژنتیک، متابولیسم، میکرو محیط و عوامل بیرونی مسیر رشد، مقاومت و متاستاز را شکل میدهد. درک این تفاوتها برای طراحی درمانهای شخصیسازی شده، شناسایی بیماران پرخطر و پیشبینی پاسخ درمانی حیاتی است.
شناخت مکانیسمهای منحصر به فرد در سرطانهای خاص، پایهای برای توسعه درمانهای هدفمند و افزایش موفقیت بالینی در سرطانهای مقاوم و نادر محسوب میشود.
چشمانداز آینده و تحقیقات نوین در سرطان
تحقیقات سرطان در دهههای اخیر تحولات شگرفی داشته و روندهای نوین، امید به درمانهای هدفمند، شخصیسازی شده و مؤثر را افزایش دادهاند. با افزایش درک از مکانیسمهای مولکولی سرطان، تغییرات ژنتیکی و اپیژنتیکی، تعاملات میکرو محیطی و مسیرهای متابولیکی، چشمانداز درمان سرطان به سوی داروهای هوشمند، ایمونوتراپی پیشرفته و استراتژیهای پیشگیری مولکولی حرکت کرده است.
یکی از مهمترین حوزههای نوین، درمانهای هدفمند بر اساس ژنوم و اپیژنتیک تومور است. با استفاده از تکنیکهای سیکوئنسینگ نسل جدید (NGS) و تحلیل جامع ژنوم، میتوان جهشها و مسیرهای سیگنالینگ خاص هر بیمار را شناسایی کرد و درمانهای دقیق طراحی نمود. برای مثال، داروهای هدفمند بر مسیرهای PI3K/AKT/mTOR، Wnt/β-catenin یا EGFR قادرند سلولهای سرطانی مقاوم را هدف قرار دهند و اثر درمانی را افزایش دهند.
ایمونوتراپی و مهندسی سیستم ایمنی نیز یکی از حوزههای پیشرو در تحقیقات نوین است. استراتژیهایی مانند مهارکنندههای چکپوینت ایمنی، CAR-T سلها و واکسنهای ضد تومور توانستهاند پاسخهای مؤثر در سرطانهای مقاوم ایجاد کنند. تحقیقات اخیر نشان دادهاند که ترکیب ایمونوتراپی با هدفگیری میکرو محیط تومور، کاهش سلولهای سرکوبگر ایمنی و افزایش نفوذ سلولهای T میتواند اثربخشی درمان را به طور قابل توجهی بهبود بخشد.
میکروبیوتا و تغذیه مولکولی نیز به عنوان یک چشمانداز نوین مطرح هستند. مطالعات نشان دادهاند که ترکیب رژیم غذایی، پروبیوتیکها و تنظیم میکروبیوتای روده میتواند پاسخ به درمانهای شیمیدرمانی و ایمونوتراپی را افزایش دهد. برخی میکروبها میتوانند مسیرهای ROS، فروپتوز و اتوفاژی را تنظیم کنند و اثرات درمانی را تقویت نمایند.
فناوریهای نانو و دارورسانی هدفمند نیز در تحقیقات نوین اهمیت زیادی دارند. استفاده از نانوذرات، نانوداروها و وزیکولهای مهندسی شده میتواند داروها را مستقیم به سلولهای سرطانی برساند، سمیت سیستمیک را کاهش دهد و مقاومت دارویی را دور بزند. به عنوان مثال، نانوذرات حامل دارو قادرند مسیرهای متابولیکی مقاوم به دارو را هدف قرار داده و اثرگذاری درمان را افزایش دهند.
تحلیلهای چند-اُمیک (multi-omics)، شامل ژنومیک، ترنسکریپتومیک، پروتئومیک و متابولومیک، یکی از روشهای نوین برای درک پیچیدگی سرطان است. این تحلیلها امکان شناسایی شبکههای سیگنالینگ، تعامل ژن-محیط و مسیرهای مولکولی منحصر به فرد را فراهم میکنند و طراحی درمانهای شخصیسازی شده را ممکن میسازند.
یکی دیگر از حوزههای پیشرو، استراتژیهای پیشگیری مولکولی و اصلاح سبک زندگی بر اساس دادههای مولکولی است. شناسایی بیومارکرهای پیشبینیکننده خطر سرطان و ایجاد برنامههای پیشگیرانه، مانند تغییر رژیم غذایی، فعالیت بدنی منظم و کاهش قرارگیری در معرض آلایندهها، میتواند بار بیماری را کاهش دهد و کیفیت زندگی بیماران را بهبود بخشد.
رویکردهای ترکیبی و چندجانبه نیز بخش مهمی از چشمانداز آینده درمان سرطان هستند. استفاده همزمان از داروهای هدفمند، ایمونوتراپی، دارورسانی نانو و اصلاح سبک زندگی میتواند اثرات سینرژیک ایجاد کند و مقاومت سلولهای سرطانی را کاهش دهد. مطالعات بالینی نوین نشان دادهاند که ترکیب درمانها با توجه به ویژگیهای مولکولی و میکرو محیطی تومور، نتایج درمانی را به طور چشمگیری بهبود میبخشد.
در نهایت، هوش مصنوعی و یادگیری ماشین نیز به عنوان ابزارهای نوین در تحقیقات سرطان مطرح شدهاند. این فناوریها قادرند دادههای کلان مولکولی، بالینی و اپیدمیولوژیک را تحلیل کرده، پیشبینی پاسخ درمانی را دقیقتر کرده و مسیرهای جدید هدف درمانی را شناسایی کنند. استفاده از این فناوریها در طراحی دارو، شناسایی بیومارکرها و مدیریت بیماران، چشمانداز تحقیقات سرطان را به سمت پیشبینی دقیق و شخصیسازی درمانها هدایت میکند.
چشمانداز آینده تحقیقات سرطان نشان میدهد که ترکیبی از درک عمیق مکانیسمهای مولکولی، فناوریهای پیشرفته، داروهای هدفمند، ایمونوتراپی و اصلاح سبک زندگی، میتواند مسیر درمان را متحول کند و امید به درمانهای پایدار و مؤثر را افزایش دهد.
جمعبندی و نتیجهگیری
در این مقاله، ما به بررسی جامع مکانیسمهای مولکولی در ایجاد سرطان پرداختیم و تلاش کردیم تا تمامی ابعاد مرتبط با رشد، پیشرفت و مقاومت سلولهای سرطانی را پوشش دهیم. سرطان به عنوان یک بیماری پیچیده و چندوجهی، نتیجه تعاملات ژنتیکی، اپیژنتیکی، متابولیکی، میکرو محیطی و عوامل بیرونی است و هرکدام از این اجزا نقش حیاتی در مسیر ایجاد و توسعه تومور دارند.
میکرو محیط تومور نقشی کلیدی در تنظیم رشد و مهاجرت سلولهای سرطانی ایفا میکند. تعامل بین سلولهای سرطانی و سلولهای ایمنی، فیبروبلاستها، عروق و ECM میتواند مسیرهای بقا، متاستاز و مقاومت به درمان را تقویت کند. فاکتورهای کماکسی، التهاب مزمن و تغییرات اپیژنتیکی محیط نیز توانایی سلولها برای زنده ماندن در شرایط استرس و مقاومت به درمان را افزایش میدهند.
مکانیسمهای ژنتیکی و اپیژنتیکی، از جمله جهشهای آنکوژنها و سرکوبگرهای تومور، تغییرات متیلاسیون DNA و تغییرات هیستونی، مسیرهای رشد و تقسیم سلولی را تنظیم میکنند. این تغییرات نه تنها موجب شروع تومور میشوند، بلکه در پاسخ به درمان و مقاومت سلولی نیز نقش دارند. تعامل این مکانیسمها با عوامل محیطی، سبک زندگی و میکرو محیط، زمینه را برای پیشرفت بیماری فراهم میکند.
فرایندهای سلولی و متابولیکی، مانند افزایش گلیکولیز (اثر واربرگ)، اتوفاژی، فروپتوز و تغییرات متابولیکی چربیها و اسیدهای آمینه، از دیگر اجزای کلیدی در بقا و پیشرفت تومور هستند. این فرآیندها به سلولها امکان میدهند تا در شرایط نامساعد محیطی زنده بمانند و به مقاومت در برابر درمان دست یابند.
مهاجرت و متاستاز سلولی، که از طریق EMT، وزیکولهای خارج سلولی و مسیرهای سیگنالینگ پیچیده صورت میگیرد، عامل اصلی انتقال سرطان به اندامهای دیگر و افزایش مرگ و میر است. سلولهای بنیادی تومور و تعاملات با میکرو محیط نقش تعیینکنندهای در این فرآیند دارند و مانع موفقیت درمانهای معمولی میشوند.
مقاومت به درمان یکی از بزرگترین چالشها در مدیریت سرطان است. سلولهای سرطانی با استفاده از فعالسازی مسیرهای بقا، پمپهای خروج دارو، تغییرات متابولیکی و سرکوب پاسخ ایمنی، اثر داروها و رادیوتراپی را کاهش میدهند. تحقیقات نوین با هدف شناسایی و هدف قرار دادن این مسیرها، امید به درمانهای موفق و پایدار را افزایش دادهاند.
عوامل محیطی و سبک زندگی، از جمله رژیم غذایی، مصرف سیگار و الکل، فعالیت بدنی و کیفیت خواب، نقش کلیدی در ایجاد و پیشرفت سرطان دارند. اصلاح این عوامل و ایجاد سبک زندگی سالم، میتواند نقش پیشگیرانه قوی در کاهش خطر سرطان ایفا کند و حتی در مراحل بعدی بیماری، پاسخ به درمان را بهبود دهد.
سرطانهای خاص و مکانیسمهای منحصر به فرد نشان میدهند که هر سرطان، بافت و مسیر مولکولی مخصوص خود را دارد. سرطانهای ریه، پستان، کولورکتال، پروستات و سرطانهای مرتبط با ویروسها، دارای ویژگیها و مسیرهای سیگنالینگ خاصی هستند که نیازمند درمانهای هدفمند و شخصیسازی شده میباشند. شناخت این تفاوتها، پایهای برای ایجاد استراتژیهای درمانی دقیق و افزایش موفقیت بالینی است.
چشمانداز آینده و تحقیقات نوین حاکی از آن است که ترکیبی از تکنولوژیهای پیشرفته، داروهای هدفمند، ایمونوتراپی، دارورسانی نانو و اصلاح سبک زندگی، میتواند مسیر درمان سرطان را متحول کند. استفاده از هوش مصنوعی، تحلیلهای چند-اُمیک و شناسایی بیومارکرهای مولکولی امکان طراحی درمانهای شخصیسازی شده و پیشگیری مؤثر را فراهم میکند.
در پایان، درک عمیق مکانیسمهای مولکولی سرطان، تعاملات پیچیده بین سلولها و محیط و عوامل بیرونی، کلید پیشرفت در تشخیص، پیشگیری و درمان این بیماری مرگبار است. تحقیقات نوین و فناوریهای پیشرفته، افقهای تازهای در درمان سرطان ایجاد کرده و امید به زندگی بیماران را افزایش دادهاند. موفقیت در مقابله با سرطان نیازمند رویکردهای چندجانبه، شخصیسازی درمانها و تمرکز بر پیشگیری مولکولی و اصلاح سبک زندگی است.
جمعبندی نهایی نشان میدهد که سرطان یک بیماری پیچیده و چندوجهی است که تنها با درک همهجانبه مکانیسمهای مولکولی و محیطی آن میتوان به درمانهای مؤثر و پایدار دست یافت.