مکانیسم مقاومت دارویی در سرطان
مقدمه
مقاومت دارویی در سرطان یکی از بزرگترین چالشهای درمانی در پزشکی مدرن است و به عنوان یکی از عوامل اصلی شکست درمانهای شیمیدرمانی، هدفمند و ایمنیدرمانی شناخته میشود. با وجود پیشرفتهای چشمگیر در توسعه داروهای ضدسرطان و فناوریهای نوین درمانی، بسیاری از بیماران همچنان با بازگشت بیماری یا پاسخ ناکافی به درمان مواجه هستند. این موضوع نه تنها بر طول عمر بیماران تأثیر مستقیم دارد، بلکه هزینههای اقتصادی و اجتماعی درمان سرطان را نیز به شدت افزایش میدهد.
اهمیت مطالعه مقاومت دارویی در سرطان از چند جنبه قابل بررسی است. اول، درک مکانیسمهای مولکولی مقاومت دارویی به پزشکان و محققان کمک میکند تا درمانهای بهینه و شخصیسازیشده برای بیماران طراحی کنند. دوم، شناخت مسیرهای مولکولی و سلولی مرتبط با مقاومت، زمینه را برای توسعه داروهای نوین و ترکیبی فراهم میکند که بتوانند سلولهای مقاوم به درمان را هدف قرار دهند. سوم، مقاومت دارویی به عنوان یک پدیده پیچیده و چندوجهی، نیازمند رویکردهای بینرشتهای شامل زیستشناسی مولکولی، داروسازی، مهندسی نانو، و ایمنیدرمانی است.
در طول دهههای گذشته، تحقیقات گستردهای نشان دادهاند که مقاومت دارویی تنها محدود به تغییرات ژنتیکی سلولهای سرطانی نیست، بلکه شامل تغییرات اپیژنتیک، متابولیک و تعاملی با میکرو محیط تومور نیز میشود. سلولهای سرطانی قادرند با استفاده از مکانیزمهای متعدد، اثرات داروهای شیمیایی و هدفمند را کاهش دهند. این تغییرات شامل افزایش خروج دارو از سلول، تغییر در مسیرهای سیگنالینگ، بازسازی مسیرهای آپوپتوز، و ایجاد پلاستیسیتی سلولی است. این تنوع مکانیزمی باعث میشود که مقابله با مقاومت دارویی به یکی از چالشهای بزرگ در تحقیقات سرطان تبدیل شود و درمانهای تکخطی معمول، در بسیاری از بیماران ناکارآمد باشد.
پیچیدگی مقاومت دارویی از این جهت اهمیت دارد که سلولهای مقاوم نه تنها نسبت به یک دارو بلکه اغلب نسبت به چند داروی متفاوت مقاوم میشوند، پدیدهای که به آن مقاومت چنددارویی (MDR) گفته میشود. مقاومت چنددارویی باعث میشود که حتی داروهای نوین و پیشرفته نیز نتوانند به طور کامل سلولهای سرطانی را از بین ببرند، و این مسئله نیازمند رویکردهای ترکیبی و استراتژیهای نوین درمانی است.
در نهایت، مطالعه مقاومت دارویی در سرطان نه تنها برای بهبود اثربخشی درمان و افزایش بقا بیماران حیاتی است، بلکه به توسعه درمانهای شخصیسازیشده و طراحی استراتژیهای نوین مقابله با بازگشت بیماری نیز کمک میکند. این مقاله با هدف ارائه یک مرور جامع، به بررسی مکانیسمهای مولکولی و سلولی مقاومت دارویی در سرطان، نقش میکرو محیط تومور، ویژگیهای خاص انواع سرطان و همچنین استراتژیهای نوین مقابله با مقاومت میپردازد. تلاش شده است تا تمامی جنبههای این موضوع به شکل کامل پوشش داده شود و مخاطب چه از منظر علمی و چه از دیدگاه عملی، تصویری جامع و کاربردی از مقاومت دارویی در سرطان به دست آورد.
مبانی مقاومت دارویی در سرطان
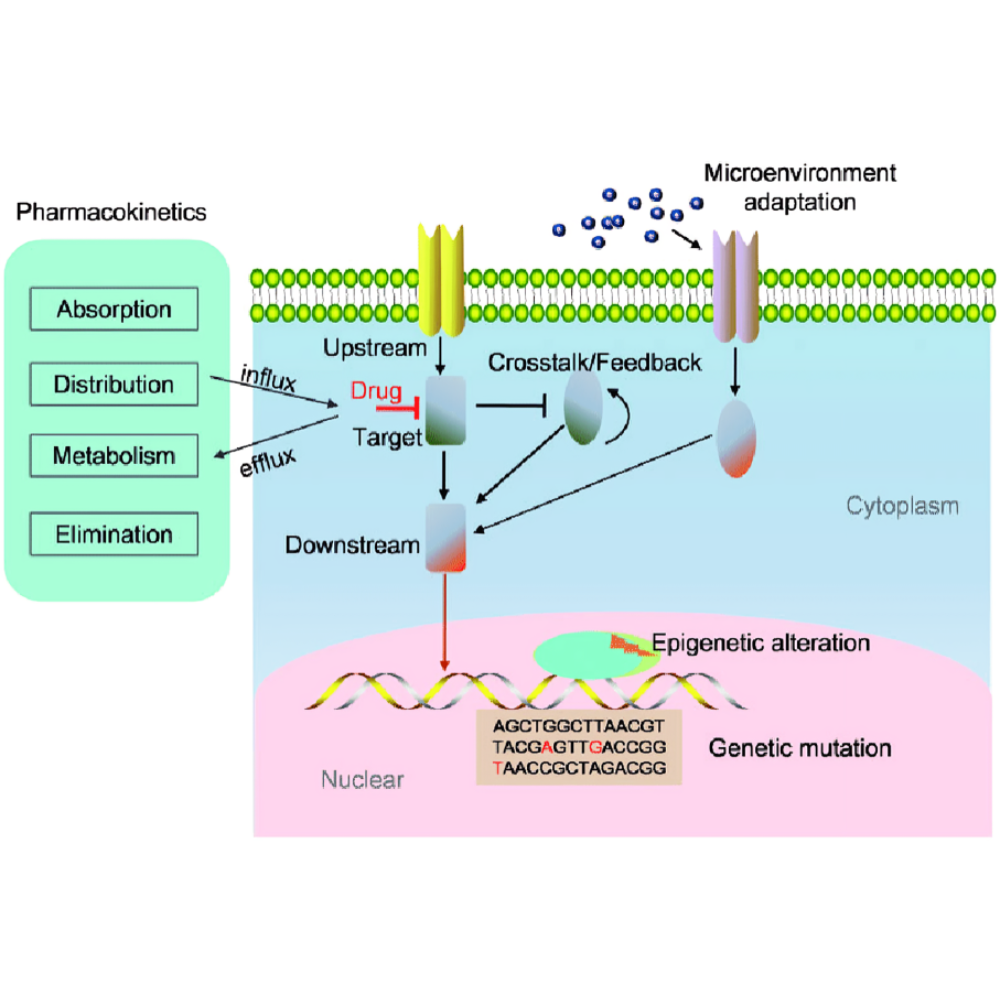
برای درک کامل موضوع مقاومت دارویی در سرطان، ابتدا باید مفاهیم پایهای و تعاریف مرتبط با این پدیده توضیح داده شود. مقاومت دارویی به توانایی سلولهای سرطانی برای بقا و ادامه رشد در حضور داروهای ضدسرطان گفته میشود، حالتی که به طور مستقیم باعث کاهش اثربخشی درمان و افزایش احتمال بازگشت بیماری میشود. این پدیده یک مشکل پیچیده و چندوجهی است که نه تنها بر اساس تغییرات ژنتیکی، بلکه تحت تأثیر تغییرات اپیژنتیک، مسیرهای سیگنالینگ، تعامل با میکرو محیط تومور و عوامل متابولیکی شکل میگیرد.
انواع مقاومت دارویی یکی از مفاهیم پایهای است که درک آن برای طراحی استراتژیهای درمانی مناسب حیاتی است. مقاومت دارویی را میتوان به دو نوع اصلی تقسیم کرد: مقاومت اولیه و مقاومت اکتسابی. مقاومت اولیه به حالتی گفته میشود که سلولهای سرطانی از ابتدای درمان نسبت به دارو مقاوم هستند و بیمار پاسخ مناسبی به درمان نشان نمیدهد. این نوع مقاومت معمولاً ناشی از تغییرات ژنتیکی ذاتی سلولهای تومور یا ویژگیهای خاص میکرو محیط آنها است. در مقابل، مقاومت اکتسابی به حالتی اطلاق میشود که سلولها در ابتدا به دارو پاسخ میدهند، اما طی زمان و تحت فشار درمانی، سلولهای مقاوم انتخاب شده و رشد میکنند. این نوع مقاومت معمولاً نتیجه تغییرات ژنتیکی، اپیژنتیک و سلولی است که در پاسخ به دارو رخ میدهند.
یکی دیگر از مبانی کلیدی، تفاوت بین مقاومت تکدارویی و چنددارویی است. مقاومت تکدارویی به حالتی گفته میشود که سلولها تنها نسبت به یک داروی خاص مقاومت نشان میدهند، در حالی که مقاومت چنددارویی یا Multidrug Resistance (MDR) شامل مقاومت سلولها به مجموعهای از داروهای متفاوت با مکانیزمهای عمل متنوع است. مقاومت چنددارویی به ویژه در درمان سرطانهای پیشرفته و متاستاتیک مشکلساز است، زیرا سلولهای سرطانی قادرند همزمان نسبت به چندین مسیر درمانی مقاوم شوند و اثربخشی ترکیبات شیمیایی، هدفمند یا ایمنیدرمانی کاهش یابد.
علاوه بر این، عوامل زیستشناسی سلولی و مولکولی نقش مهمی در شکلگیری مقاومت دارویی دارند. تغییر در مسیرهای سیگنالینگ، جهش در پروتئینهای هدف، فعال شدن مسیرهای بقا و بازسازی سلولی، و افزایش توانایی سلولها در دفع دارو از طریق پمپهای فعال، همگی از عوامل اصلی مقاومت دارویی هستند. میکرو محیط تومور نیز با فراهم کردن شرایط حمایتی، از جمله کاهش دسترسی به دارو، ایجاد شرایط هیپوکسی و تعامل با سلولهای ایمنی و فیبروبلاستها، سلولهای سرطانی را در برابر درمان مقاوم میسازد.
نقش ژنتیک و اپیژنتیک در مقاومت دارویی نیز بسیار حیاتی است. تغییرات ژنتیکی شامل جهش در ژنهای مرتبط با مسیرهای بقا، متابولیسم دارو و سیگنالینگ سلولی هستند که میتوانند مقاومت را تقویت کنند. در کنار آن، تغییرات اپیژنتیک مانند متیلاسیون DNA، اصلاح هیستون و تغییرات در RNA غیرکدکننده، مسیرهای مقاومتی را فعال میکنند و به سلولها امکان میدهند بدون تغییر در توالی ژنتیکی، نسبت به دارو واکنش نشان دهند.
در نهایت، مبانی مقاومت دارویی نشان میدهند که این پدیده نتیجه تعامل پیچیده بین عوامل سلولی، مولکولی، ژنتیکی و محیطی است. درک این مبانی برای توسعه استراتژیهای درمانی موفق و طراحی داروهای نوین حیاتی است. با توجه به پیچیدگیهای متعدد، مقابله با مقاومت دارویی نیازمند رویکردهای ترکیبی، شامل داروهای هدفمند، نانو دارورسانی، تنظیم مسیرهای آپوپتوز و پلاستیسیتی سلولی، و استفاده از فناوریهای نوین است تا بتوان پاسخ درمانی بیماران را بهینه کرد و میزان بقای آنان را افزایش داد.
مکانیسمهای مولکولی مقاومت دارویی
مقاومت دارویی در سرطان یک پدیده پیچیده است که نه تنها به تغییرات ژنتیکی محدود میشود، بلکه مجموعهای از تغییرات مولکولی، سلولی و محیطی را شامل میشود. فهم دقیق مکانیسمهای مولکولی مقاومت دارویی برای طراحی درمانهای مؤثر و کاهش شکست درمانی حیاتی است. این مکانیسمها میتوانند به شکل مستقل یا به صورت همزمان در یک سلول سرطانی عمل کنند و در نتیجه توانایی سلول برای بقا و ادامه رشد در حضور داروها افزایش مییابد.
یکی از مهمترین مکانیسمها، افزایش خروج دارو از سلول است. سلولهای سرطانی قادرند با فعال کردن پمپهای پروتئینی متعدد، مانند پمپهای ABC (ATP-Binding Cassette) و به ویژه P-gp (P-glycoprotein)، داروهای شیمیایی را از داخل سلول به بیرون منتقل کنند. این فرآیند باعث میشود که غلظت داروی فعال در داخل سلول کاهش یافته و اثر درمانی دارو به میزان قابل توجهی کاهش یابد. پمپهای ABC نه تنها نسبت به یک دارو بلکه نسبت به طیف وسیعی از داروهای ضدسرطان فعالیت دارند، که دلیل اصلی مقاومت چنددارویی (MDR) است.
تغییرات در هدف دارویی یکی دیگر از مکانیسمهای کلیدی مقاومت است. بسیاری از داروهای هدفمند و شیمیدرمانی بر پروتئینها یا مسیرهای سیگنالینگ خاص عمل میکنند. جهشهای ژنتیکی یا تغییرات اپیژنتیک در پروتئینهای هدف میتوانند اتصال دارو را کاهش دهند یا مسیرهای بقا را فعال نگه دارند، به گونهای که دارو نتواند اثر خود را اعمال کند. به عنوان مثال، جهش در EGFR در سرطان ریه یا تغییرات در مسیر PI3K/AKT/mTOR در انواع دیگر سرطانها میتواند باعث مقاومت دارویی شود.
تغییرات متابولیکی و افزایش توانایی سلول در خنثی کردن دارو نیز نقش مهمی در مقاومت دارند. سلولهای سرطانی میتوانند آنزیمهای متابولیک خود را تغییر دهند تا داروهای شیمیایی را غیر فعال کنند یا مسیرهای بقا و ترمیم DNA را فعال نمایند. این تغییرات باعث میشوند که سلولها بتوانند در برابر آسیبهای دارویی دوام بیاورند و از مرگ سلولی جلوگیری کنند.
تغییر در مسیرهای مرگ سلولی، از جمله آپوپتوز، اوتوپازی و نکروز تنظیمشده، یکی دیگر از مکانیسمهای حیاتی است. بسیاری از داروهای ضدسرطان اثر خود را از طریق القای آپوپتوز اعمال میکنند، اما سلولهای مقاوم میتوانند مسیرهای آپوپتوزی را سرکوب کنند یا مسیرهای بازدارنده را فعال نمایند. فعال شدن مسیرهای اوتوپازی به سلولها امکان میدهد در شرایط استرس دارویی انرژی و اجزای حیاتی خود را حفظ کنند، در حالی که سرکوب مسیرهای مرگ سلولی کلاسیک از بقا و گسترش سلولهای مقاوم پشتیبانی میکند.
یکی از مکانیسمهای پیچیده و حیاتی، پلاستیسیتی سلولی و سلولهای بنیادی سرطانی است. سلولهای سرطانی قادرند به طور موقت و برگشتپذیر ویژگیهای خود را تغییر دهند، به گونهای که نسبت به داروهای خاص مقاوم شوند. سلولهای بنیادی سرطانی (Cancer Stem Cells) نیز به دلیل ظرفیت بالای بازسازی و سرکوب مسیرهای مرگ، به شدت نسبت به داروها مقاوم هستند و مسئول بازگشت و متاستاز بیماری پس از درمان میباشند.
اپیژنتیک و نقش تغییرات متیلاسیون DNA و هیستونها یکی دیگر از عوامل کلیدی است. تغییرات اپیژنتیک میتوانند بیان ژنهای مرتبط با مقاومت، مسیرهای بقا و تنظیم چرخه سلولی را تغییر دهند، بدون آنکه توالی ژنوم دچار تغییر شود. این مکانیسم باعث میشود سلولها بتوانند به سرعت به فشار دارویی پاسخ دهند و مقاومت اکتسابی را شکل دهند.
نقش RNAهای غیرکدکننده، از جمله میکروRNA و lncRNA نیز اخیراً به عنوان مکانیسمهای مهم مقاومت دارویی شناسایی شده است. این مولکولها میتوانند بیان ژنها را تنظیم کنند، مسیرهای آپوپتوز را سرکوب نمایند و فعالیت پمپهای خروج دارو را افزایش دهند. به عنوان مثال، برخی میکروRNAها با سرکوب ژنهای حساس به دارو باعث افزایش بقا سلولهای سرطانی میشوند، در حالی که lncRNAها میتوانند شبکههای پیچیدهای از سیگنالینگ را کنترل کنند و مقاومت چنددارویی را تقویت نمایند.
در نهایت، همه این مکانیسمها به صورت همزمان و با تعاملات پیچیده در سلولهای سرطانی عمل میکنند، که نشاندهنده ماهیت چندوجهی و چالشبرانگیز مقاومت دارویی است. شناخت دقیق این مسیرها و ارتباط آنها با نوع سرطان، وضعیت ژنتیکی بیمار و ویژگیهای میکرو محیط تومور، کلید طراحی درمانهای هدفمند و استراتژیهای مقابله با مقاومت دارویی میباشد.
نقش میکرو محیط تومور در مقاومت دارویی
میکرو محیط تومور به عنوان یک عامل کلیدی در شکلگیری و تقویت مقاومت دارویی در سرطان شناخته میشود. این محیط شامل مجموعهای پیچیده از سلولهای غیرسرطانی، ماتریکس خارجسلولی، عروق خونی، سلولهای ایمنی و فیبروبلاستها است که به شکل دینامیک با سلولهای سرطانی تعامل دارند. تعاملات بین سلولهای سرطانی و میکرو محیط، نه تنها بقا و تکثیر سلولها را حمایت میکند، بلکه نقش تعیینکنندهای در کاهش اثربخشی داروهای ضدسرطان ایفا مینماید.
یکی از اجزای مهم میکرو محیط تومور، فیبروبلاستهای مرتبط با تومور (Cancer-Associated Fibroblasts یا CAFs) هستند. این سلولها با ترشح سیتوکینها، فاکتورهای رشد و آنزیمهای ماتریکسی، مسیرهای بقا و مقاومت در سلولهای سرطانی را فعال میکنند. CAFها میتوانند به طور مستقیم فعالیت پمپهای خروج دارو را در سلولهای سرطانی افزایش دهند و یا با ایجاد ماتریکس خارجسلولی متراکم، دسترسی داروها به سلولهای سرطانی را محدود کنند. این پدیده منجر به کاهش غلظت داروی فعال در نزدیکی سلولهای هدف و ایجاد مقاومت چنددارویی میشود.
هیپوکسی و استرس اکسیداتیو از دیگر عوامل مهم میکرو محیط هستند. رشد سریع تومور و توسعه ناکافی شبکه عروقی باعث کاهش اکسیژن و ایجاد شرایط هیپوکسی میشود. سلولهای سرطانی در محیط هیپوکسی قادرند مسیرهای بقا و ترمیم DNA را فعال کنند و همزمان داروهای شیمیدرمانی را خنثی نمایند. هیپوکسی همچنین با فعالسازی مسیرهایی مانند HIF-1α، باعث افزایش بیان پمپهای خروج دارو و تقویت مقاومت چنددارویی میشود. علاوه بر این، افزایش استرس اکسیداتیو میتواند مسیرهای سیگنالینگ حفاظتی سلول را فعال کرده و سلولها را در برابر داروهای اکسیداتیو و شیمیدرمانی مقاوم سازد.
سلولهای ایمنی موجود در میکرو محیط تومور نیز نقشی دوگانه دارند. برخی سلولهای ایمنی، مانند سلولهای T سیتوتوکسیک، اثر ضد توموری دارند، اما سلولهای ایمنی سرکوبکننده مانند Tregs و ماکروفاژهای نوع M2 میتوانند با ترشح فاکتورهای ضد التهابی و مهار مسیرهای آپوپتوز، سلولهای سرطانی را در برابر دارو مقاوم کنند. این تعاملات پیچیده باعث میشوند که داروهای شیمیدرمانی و ایمنیدرمانی نتوانند به شکل کامل اثر خود را اعمال کنند و مقاومت دارویی تقویت شود.
تغییرات ماتریکس خارجسلولی (ECM) نیز در مقاومت دارویی اهمیت دارند. ECM متراکم و تغییر یافته میتواند نفوذ داروها را محدود کند و به عنوان یک مانع فیزیکی عمل نماید. علاوه بر این، تعامل بین سلولهای سرطانی و ECM میتواند مسیرهای سیگنالینگ مرتبط با بقا، رشد و آپوپتوز را فعال کرده و سلولها را مقاوم سازد.
عوامل مولکولی مانند سیتوکینها، فاکتورهای رشد و پروتئینهای ماتریکسی نیز در میکرو محیط، مقاومت دارویی را تقویت میکنند. برای مثال، فاکتورهای رشد مانند TGF-β و VEGF میتوانند مسیرهای سیگنالینگ AKT و MAPK را فعال کنند و سلولها را نسبت به داروهای ضدسرطان مقاوم سازند. این مسیرها باعث فعالسازی ژنهای مرتبط با بقا، ترمیم DNA و افزایش پمپهای خروج دارو میشوند.
در نهایت، میکرو محیط تومور نه تنها سلولهای سرطانی را از آسیب دارویی محافظت میکند، بلکه با ایجاد همکاری بین سلولها و اجزای محیطی، مقاومت چنددارویی و بازگشت بیماری پس از درمان را تسهیل مینماید. شناخت دقیق این تعاملات برای طراحی درمانهای ترکیبی و هدفمند ضروری است، به گونهای که بتوان مسیرهای سیگنالینگ حفاظتی، ارتباطات سلولی و محدودیتهای نفوذ دارو در میکرو محیط را هدف قرار داد و مقاومت دارویی را کاهش داد.
مقاومت دارویی در سرطانهای مختلف
مقاومت دارویی در سرطانها به صورت یکنواخت رخ نمیدهد و ویژگیهای مولکولی، ژنتیکی و میکرو محیطی هر نوع سرطان نقش مهمی در نحوه شکلگیری این مقاومت دارند. بررسی مکانیسمهای خاص در هر نوع سرطان، برای طراحی درمانهای هدفمند و شخصیسازیشده ضروری است.
در سرطان پستان، مقاومت دارویی اغلب ناشی از فعالسازی مسیرهای سیگنالینگ مرتبط با بقا و پلاستیسیتی سلولی است. سلولهای بنیادی سرطانی و HOTAIR (یک lncRNA) نقش حیاتی در ایجاد مقاومت چنددارویی دارند و میتوانند مسیرهای آپوپتوز را سرکوب کنند. علاوه بر این، تغییرات اپیژنتیک و متیلاسیون DNA و هیستونها باعث فعال شدن ژنهای مرتبط با بازسازی سلولی و مقاومت دارویی میشوند. مقاومت در برابر داروهای هدفمند مانند HER2 inhibitors یا شیمیدرمانی کلاسیک، اغلب به تعامل سلولهای سرطانی با میکرو محیط تومور و فیبروبلاستهای مرتبط با تومور (CAF) وابسته است.
در سرطان پروستات، به ویژه نوع مقاوم به کسترشن (CRPC)، مقاومت دارویی به دلیل جهشها در گیرنده آندروژن و فعال شدن مسیرهای سیگنالینگ جایگزین ایجاد میشود. مسیرهای بقا مانند PI3K/AKT/mTOR و NF-κB در سلولهای مقاوم فعال میشوند و باعث میشوند که داروهای ضدسرطان و هورموندرمانی نتوانند اثر کافی داشته باشند. استفاده از ترکیب داروهای هدفمند و مهار مسیرهای جایگزین، یکی از راهکارهای مقابله با این مقاومت محسوب میشود.
در سرطان تخمدان، مقاومت دارویی اغلب ناشی از ترکیبی از چند مکانیسم است. جهشها و تغییرات اپیژنتیک در ژنهای مرتبط با ترمیم DNA، افزایش پمپهای خروج دارو و پلاستیسیتی سلولی، باعث مقاومت در برابر داروهای شیمیدرمانی کلاسیک مانند پلاتینها و تاکسولها میشوند. علاوه بر این، سلولهای بنیادی سرطانی و میکرو محیط تومور، از جمله CAFها و ماتریکس خارجسلولی متراکم، دسترسی داروها به سلولهای هدف را محدود میکنند.
در سرطان کبد یا HCC، مقاومت دارویی اغلب با فعال شدن مسیرهای سیگنالینگ رشد و بقا مانند MAPK/ERK و PI3K/AKT و افزایش بیان پمپهای خروج دارو همراه است. علاوه بر این، سلولهای سرطانی HCC میتوانند با فعالسازی مسیرهای استرس اکسیداتیو و آپوپتوز مقاوم، از اثر داروهای هدفمند و شیمیدرمانی کلاسیک فرار کنند. همچنین تغییرات اپیژنتیک و نقش میانجیهای RNA در مقاومت به این نوع سرطان اهمیت ویژهای دارند.
در سرطان کولورکتال، مقاومت دارویی به دلیل تنوع ژنتیکی و پلاستیسیتی بالای سلولها، یک چالش بزرگ است. مسیرهای سیگنالینگ مانند Wnt/β-catenin و EGFR نقش کلیدی در فعال شدن مقاومت دارند. سلولهای بنیادی سرطانی و تعامل با میکرو محیط تومور، از جمله عروق غیرعادی و سلولهای ایمنی سرکوبکننده، باعث میشوند که داروهای هدفمند و شیمیدرمانی اثر کمتری داشته باشند. تحقیقات اخیر نشان دادهاند که فروپتوز و فعالسازی مسیرهای مرگ سلولی خاص میتواند راهکاری برای مقابله با مقاومت در سرطان کولورکتال باشد.
علاوه بر این سرطانها، مکانیسمهای مقاومت دارویی در انواع دیگر سرطانها مانند سرطان ریه، معده و مغز نیز شامل فعالسازی مسیرهای بقا، پلاستیسیتی سلولی، تغییرات اپیژنتیک و تعامل با میکرو محیط تومور میشوند. نکته مهم این است که هر نوع سرطان یک الگوی منحصر به فرد از مقاومت دارویی دارد و موفقیت درمانی به درک دقیق این الگو و طراحی استراتژیهای هدفمند وابسته است.
در مجموع، مقاومت دارویی در سرطانهای مختلف ترکیبی از تغییرات ژنتیکی، اپیژنتیک، متابولیکی و محیطی است. این پیچیدگی باعث میشود که درمانهای سنتی تنها در برخی بیماران مؤثر باشند و نیاز به توسعه استراتژیهای نوین، ترکیبی و شخصیسازیشده برای مقابله با مقاومت دارویی هر نوع سرطان وجود داشته باشد.
استراتژیهای نوین مقابله با مقاومت دارویی
با توجه به پیچیدگیهای مولکولی و سلولی مقاومت دارویی در سرطان، درمانهای سنتی شیمیدرمانی به تنهایی اغلب ناکافی هستند. در سالهای اخیر، توسعه استراتژیهای نوین و هدفمند، امکان مقابله با مقاومت دارویی را فراهم کرده است. این استراتژیها شامل درمانهای هدفمند، نانو دارورسانی، فعالسازی مسیرهای مرگ سلولی خاص، اصلاح اپیژنتیک، و استفاده از فناوریهای نوین مانند پلاسمای سرد و نانو ساختارهای DNA میشوند.
یکی از مهمترین رویکردها، استفاده از درمانهای هدفمند است. داروهای هدفمند با شناسایی مسیرهای سیگنالینگ مشخص و پروتئینهای کلیدی در سلولهای سرطانی، اثر خود را اعمال میکنند. برای مثال، مهارکنندههای EGFR، HER2 و VEGF در سرطانهای مختلف استفاده میشوند. این داروها میتوانند مسیرهای بقا و ترمیم DNA را در سلولهای سرطانی مختل کنند و مقاومت دارویی را کاهش دهند. علاوه بر این، ترکیب چند داروی هدفمند به صورت همزمان، میتواند مقاومت چنددارویی را مهار نماید.
نانو دارورسانی و سیستمهای دارویی پیشرفته یکی دیگر از استراتژیهای موفق است. استفاده از نانوذرات و حاملهای دارویی میتواند داروها را به شکل مستقیم به سلولهای مقاوم منتقل کند و از توزیع غیر اختصاصی جلوگیری نماید. این روشها باعث افزایش غلظت دارو در سلولهای هدف و کاهش عوارض جانبی میشوند. فناوریهای نوین مانند نانو ساختارهای DNA نیز امکان حمل همزمان چند دارو و فعالسازی دارو در محیط تومور را فراهم میکنند.
یکی از رویکردهای پیشرفته، فعالسازی مسیرهای مرگ سلولی خاص است. این روش شامل القای فروپتوز، آپوپتوز و اوتوپازی در سلولهای مقاوم میشود. برای مثال، فعالسازی فروپتوز در سرطان کولورکتال و سرطانهای مقاوم به پلاتین نشان داده است که میتواند مقاومت اکتسابی را برطرف کند. این رویکردها معمولاً با داروهای هدفمند یا نانو دارورسانی ترکیب میشوند تا اثرگذاری بیشتری داشته باشند.
اصلاح اپیژنتیک و تنظیم RNA غیرکدکننده نیز از دیگر استراتژیهای نوین است. استفاده از داروهای تنظیمکننده متیلاسیون DNA، اصلاح هیستون و miRNA/lncRNA میتواند بیان ژنهای مرتبط با مقاومت دارویی را تغییر دهد و سلولهای مقاوم را حساس کند. این روش به ویژه در سرطان پستان و تخمدان که تغییرات اپیژنتیک نقش مهمی دارند، بسیار موثر است.
فناوریهای نوین و درمانهای مکمل نیز در مقابله با مقاومت دارویی اهمیت پیدا کردهاند. استفاده از پلاسمای سرد (Cold Atmospheric Plasma) میتواند با ایجاد استرس اکسیداتیو و فعالسازی مسیرهای مرگ سلولی، سلولهای مقاوم را هدف قرار دهد. ترکیب این فناوری با شیمیدرمانی یا درمان هدفمند، اثر ضدتوموری را افزایش میدهد. همچنین استفاده از سیستمهای پروتئینتارژینگ و داروهای نوین مبتنی بر پروتئین امکان محدود کردن مسیرهای بقا و سرکوب پمپهای خروج دارو را فراهم میکند.
استراتژیهای ترکیبی، شامل داروهای هدفمند، نانو دارورسانی، اصلاح اپیژنتیک و فعالسازی مسیرهای مرگ سلولی، بیشترین پتانسیل را در مقابله با مقاومت دارویی دارند. تحقیقات نشان دادهاند که استفاده همزمان از چند رویکرد میتواند سلولهای مقاوم را حساس کرده و احتمال بازگشت بیماری را کاهش دهد.
در نهایت، موفقیت در مقابله با مقاومت دارویی نیازمند درک دقیق مکانیسمهای مولکولی و سلولی، ویژگیهای میکرو محیط تومور و مشخصات هر نوع سرطان است. توسعه داروهای نوین و استراتژیهای ترکیبی، همراه با پزشکی دقیق و شخصیسازیشده، چشمانداز روشنی برای بهبود اثربخشی درمان و افزایش بقای بیماران ایجاد کرده است.
چالشها و محدودیتهای درمانی فعلی
با وجود پیشرفتهای چشمگیر در حوزه درمان سرطان و توسعه استراتژیهای نوین مقابله با مقاومت دارویی، هنوز موانع و چالشهای متعددی وجود دارند که محدودیتهای عملی و بالینی این درمانها را مشخص میکنند. درک دقیق این چالشها، کلید طراحی رویکردهای آینده و بهبود اثربخشی درمان بیماران است.
یکی از مهمترین چالشها، تنوع ژنتیکی و پلاستیسیتی سلولهای سرطانی است. سلولهای سرطانی قادرند به سرعت ویژگیهای خود را تغییر دهند و مسیرهای بقا و مقاومت دارویی را فعال کنند. این پلاستیسیتی باعث میشود که حتی داروهای هدفمند و نانو دارورسانیهای پیشرفته نتوانند به شکل دائمی سلولهای مقاوم را از بین ببرند. همچنین این ویژگی باعث میشود که سرطانها پس از درمان اولیه دوباره رشد کنند و مقاومت ثانویه ایجاد شود.
میانجیهای مولکولی و مسیرهای سیگنالینگ پیچیده نیز محدودیت دیگری در درمان هستند. فعال شدن مسیرهای جایگزین و تداخل بین مسیرهای سیگنالینگ، مانند PI3K/AKT، MAPK و NF-κB، باعث میشود که مهار یک مسیر خاص، اثربخشی کامل دارو را نداشته باشد. این وضعیت منجر به نیاز به ترکیب چند داروی هدفمند و افزایش احتمال عوارض جانبی میشود.
میکرو محیط تومور یکی از موانع اصلی در مقابله با مقاومت دارویی است. ماتریکس خارجسلولی متراکم، سلولهای ایمنی سرکوبکننده، فیبروبلاستهای مرتبط با تومور و شرایط هیپوکسی، دسترسی داروها به سلولهای سرطانی را محدود میکنند و مسیرهای بقا را فعال نگه میدارند. این ویژگیها باعث میشوند که حتی داروهایی که در آزمایشگاه مؤثر بودهاند، در شرایط بالینی نتوانند اثر مشابهی داشته باشند.
عوارض جانبی داروها و محدودیتهای دوز درمانی نیز از چالشهای عملی مقابله با مقاومت دارویی هستند. بسیاری از داروهای هدفمند، شیمیدرمانی و فناوریهای نوین مانند پلاسمای سرد یا نانو دارورسانی، در دوزهای بالا میتوانند به بافتهای سالم آسیب برسانند. این محدودیت دوز، مانع از استفاده کامل از توانایی ضدسرطانی داروها میشود و احتمال بقا و رشد سلولهای مقاوم را افزایش میدهد.
تنوع بالای پاسخ بیماران و نیاز به پزشکی دقیق یکی دیگر از محدودیتهای مهم است. تفاوتهای ژنتیکی، اپیژنتیک و وضعیت میکرو محیط تومور در بیماران مختلف باعث میشود که یک دارو یا استراتژی موفق در یک بیمار، در دیگری مؤثر نباشد. این چالش، نیاز به توسعه رویکردهای شخصیسازیشده و آزمایشهای تشخیصی پیش از درمان را افزایش میدهد.
علاوه بر این، محدودیتهای تحقیقاتی و بالینی نیز در توسعه درمانهای نوین وجود دارند. بسیاری از داروها و استراتژیهای نوین هنوز در مراحل آزمایشگاهی یا کارآزماییهای بالینی اولیه هستند و اطلاعات کافی درباره اثربخشی بلندمدت و ایمنی آنها در بیماران واقعی وجود ندارد. همچنین مدلهای حیوانی و سلولهای آزمایشگاهی قادر به شبیهسازی کامل میکرو محیط تومور انسان نیستند، که باعث ایجاد فاصله بین نتایج آزمایشگاهی و بالینی میشود.
در نهایت، پیچیدگی چندسطحی مقاومت دارویی باعث میشود که مقابله با آن نیازمند رویکردهای ترکیبی، هوشمند و چندوجهی باشد. حتی با وجود پیشرفتهای نانو دارورسانی، داروهای هدفمند، فناوریهای اپیژنتیک و فعالسازی مسیرهای مرگ سلولی، هنوز بسیاری از بیماران با مقاومت دارویی مواجه هستند و نیاز به تحقیقات بیشتر و توسعه فناوریهای نوین وجود دارد.
چشمانداز آینده و تحقیقات در حال توسعه
مقاومت دارویی در سرطان یکی از پیچیدهترین چالشهای حوزه درمان است که هنوز به طور کامل حل نشده و تحقیقات گستردهای برای غلبه بر آن در جریان است. با توجه به پیچیدگیهای مولکولی، سلولی و محیطی، چشمانداز آینده مقابله با مقاومت دارویی نیازمند رویکردهای چندوجهی و فناوریهای نوین است.
یکی از حوزههای تحقیقاتی مهم، پزشکی دقیق و شخصیسازیشده درمانها است. با پیشرفت در تحلیل ژنتیکی و اپیژنتیکی بیماران، امکان شناسایی الگوهای مقاومت دارویی اختصاصی هر بیمار فراهم شده است. این اطلاعات میتواند منجر به طراحی درمانهای ترکیبی و هدفمند شود که مسیرهای بقا و مقاومت سلولهای سرطانی را به طور مستقیم هدف قرار میدهند. استفاده از الگوریتمهای هوش مصنوعی و یادگیری ماشین برای پیشبینی پاسخ بیماران به داروها، نقش کلیدی در بهینهسازی درمانها و کاهش شکست دارویی ایفا خواهد کرد.
تحقیقات نانو دارورسانی و فناوریهای هدفمند نیز در آینده نقش محوری خواهند داشت. توسعه نانوذرات چندعملکردی که قادر به حمل همزمان چند دارو، فعالسازی دارو در میکرو محیط تومور و شناسایی سلولهای مقاوم هستند، امکان مقابله با مقاومت چنددارویی را فراهم میآورد. همچنین استفاده از نانو ساختارهای DNA و پروتئینتارژینگ به عنوان حاملهای دارویی پیشرفته، میتواند دقت و اثربخشی درمان را افزایش دهد و اثرات جانبی داروها را کاهش دهد.
فعالسازی مسیرهای مرگ سلولی خاص و فروپتوز یکی دیگر از رویکردهای نوظهور است. تحقیقات اخیر نشان دادهاند که فعالسازی کنترلشده فروپتوز در سرطانهای مقاوم، به ویژه سرطان کولورکتال و هپاتوسلولار، میتواند سلولهای مقاوم را هدف قرار دهد و مقاومت اکتسابی را کاهش دهد. ترکیب این رویکرد با درمانهای هدفمند و نانو دارورسانی، چشمانداز امیدوارکنندهای برای درمان سرطانهای مقاوم ایجاد میکند.
در حوزه اپیژنتیک و RNA غیرکدکننده، مطالعات در حال توسعه روی تنظیم miRNA، lncRNA و اصلاحات متیلاسیون DNA و هیستون نشان میدهد که میتوان مسیرهای مقاومت دارویی را به شکل هدفمند مهار کرد. استفاده از داروهای تنظیمکننده اپیژنتیک در ترکیب با شیمیدرمانی یا داروهای هدفمند، میتواند حساسیت سلولهای سرطانی مقاوم را بازگرداند.
تحقیقات روی میکرو محیط تومور و ایمنیدرمانی نیز در حال گسترش است. هدفگذاری سلولهای ایمنی سرکوبکننده، مهار فیبروبلاستهای مرتبط با تومور و بازسازی ماتریکس خارجسلولی، امکان بهبود نفوذ دارو و افزایش حساسیت سلولهای سرطانی به درمان را فراهم میآورد. همچنین ترکیب ایمنیدرمانی با داروهای هدفمند و فناوریهای نوین، میتواند مقاومت دارویی را کاهش دهد و اثربخشی درمان را افزایش دهد.
یکی دیگر از حوزههای نوظهور، استفاده از فناوریهای نوین مانند پلاسمای سرد و مهندسی اکسیژنرسانی به تومور است. این فناوریها با ایجاد استرس اکسیداتیو و تغییر شرایط میکرو محیط، میتوانند سلولهای مقاوم را هدف قرار دهند و اثر درمانهای شیمیدرمانی و هدفمند را افزایش دهند.
در نهایت، چشمانداز آینده مقابله با مقاومت دارویی در سرطان، بر اساس ترکیب رویکردهای مولکولی، نانو فناوری، اپیژنتیک، ایمنیدرمانی و پزشکی دقیق شکل میگیرد. تحقیقات در حال توسعه نشان میدهند که درمانهای ترکیبی و شخصیسازیشده، همراه با استفاده از فناوریهای نوین، قادر خواهند بود مسیرهای مقاومت دارویی را هدف قرار دهند، سلولهای مقاوم را از بین ببرند و اثربخشی درمان را بهبود بخشند.
جمعبندی چشمانداز آینده نشان میدهد که مقابله با مقاومت دارویی، نیازمند همکاری بین رشتهای، سرمایهگذاری در تحقیقات پایه و بالینی، و توسعه فناوریهای نوین است. تمرکز بر درمانهای ترکیبی، شخصیسازیشده و هدفمند، همراه با استفاده از ابزارهای پیشرفته تشخیصی و تحلیلی، مسیر پیشروی موفق در این حوزه را مشخص میسازد و امید به افزایش بقای بیماران مبتلا به سرطان مقاوم را تقویت میکند.
جمعبندی
مقاومت دارویی در سرطان یکی از پیچیدهترین و چالشبرانگیزترین موانع درمانی است که همچنان درمان موفق و پایدار را در بسیاری از بیماران محدود میکند. این مقاومت نه تنها ناشی از تغییرات ژنتیکی و اپیژنتیک در سلولهای سرطانی است، بلکه تحت تأثیر عوامل محیطی، تعاملات سلولی و ویژگیهای میکرو محیط تومور نیز شکل میگیرد.
در بررسی مبانی مقاومت دارویی مشاهده شد که این پدیده ترکیبی از عوامل درونسلولی و محیطی است و سلولهای سرطانی قادرند با فعالسازی مسیرهای بقا، افزایش پمپهای خروج دارو، تغییر متابولیسم و بازسازی DNA، در برابر اثر داروهای شیمیدرمانی و هدفمند مقاومت کنند. این مکانیسمها نشان میدهند که مقاومت دارویی یک پدیده چندسطحی و پویا است که تنها با رویکردهای یکجانبه قابل غلبه نیست.
مکانیسمهای مولکولی مقاومت دارویی شامل مسیرهای سیگنالینگ مهم مانند PI3K/AKT، MAPK، NF-κB و مسیرهای مرتبط با پلاستیسیتی سلولی، سلولهای بنیادی سرطانی و میانجیهای RNA غیرکدکننده است. این مسیرها سلولهای سرطانی را قادر میسازند تا به سرعت خود را با فشارهای دارویی تطبیق دهند و حتی پس از درمان اولیه، مقاومت ثانویه ایجاد کنند.
نقش میکرو محیط تومور در مقاومت دارویی غیرقابل چشمپوشی است. فیبروبلاستهای مرتبط با تومور، ماتریکس خارجسلولی متراکم، سلولهای ایمنی سرکوبکننده و شرایط هیپوکسی، همگی باعث میشوند که داروها به سلولهای سرطانی دسترسی کافی نداشته باشند و مسیرهای حفاظتی سلولها فعال باقی بماند. این تعاملات پیچیده، مقاومت چنددارویی را تشدید کرده و محدودیتهای درمان بالینی را افزایش میدهند.
مطالعه مقاومت دارویی در سرطانهای مختلف نشان داد که هر نوع سرطان، الگوی منحصر به فردی از مقاومت دارویی دارد. در سرطان پستان، تغییرات اپیژنتیک و HOTAIR نقش کلیدی دارند، در سرطان پروستات مسیرهای جایگزین سیگنالینگ و جهشهای گیرنده آندروژن اهمیت دارند، و در سرطان تخمدان و کبد، ترکیبی از پمپهای خروج دارو، مسیرهای بقا و سلولهای بنیادی سرطانی مقاومت را ایجاد میکنند. این تفاوتها ضرورت طراحی استراتژیهای درمانی شخصیسازیشده و ترکیبی را آشکار میسازد.
استراتژیهای نوین مقابله با مقاومت دارویی شامل درمانهای هدفمند، نانو دارورسانی، فعالسازی مسیرهای مرگ سلولی خاص، اصلاح اپیژنتیک و استفاده از فناوریهای نوین مانند پلاسمای سرد و نانو ساختارهای DNA هستند. ترکیب این رویکردها، اثربخشی درمان را افزایش داده و مسیرهای مقاومت را هدف قرار میدهد. تحقیقات بالینی و آزمایشگاهی نشان دادهاند که استفاده همزمان از چندین رویکرد، اثر ضدتوموری را تقویت کرده و احتمال بازگشت بیماری را کاهش میدهد.
با این حال، چالشها و محدودیتهای درمانی فعلی همچنان وجود دارند. پلاستیسیتی سلولی، فعالسازی مسیرهای جایگزین، موانع میکرو محیط تومور، محدودیتهای دوز درمانی و تنوع پاسخ بیماران، همگی باعث میشوند که مقابله با مقاومت دارویی یک فرآیند پیچیده و چندبعدی باقی بماند. همچنین فاصله بین نتایج آزمایشگاهی و بالینی و نیاز به تحقیقات بیشتر برای اثبات ایمنی و اثربخشی بلندمدت داروهای نوین، از دیگر موانع مهم است.
چشمانداز آینده و تحقیقات در حال توسعه حاکی از امیدواری در مقابله با مقاومت دارویی است. پیشرفت در حوزه پزشکی دقیق، نانو دارورسانی پیشرفته، فعالسازی مسیرهای مرگ سلولی خاص، اصلاح اپیژنتیک، ایمنیدرمانی ترکیبی و فناوریهای نوین، فرصتهای جدیدی برای غلبه بر مقاومت دارویی فراهم کردهاند. رویکردهای چندوجهی و شخصیسازیشده، همراه با توسعه ابزارهای تشخیصی پیشرفته و استفاده از هوش مصنوعی برای پیشبینی پاسخ بیماران، مسیر پیشروی موفق در این حوزه را مشخص میکنند.
در مجموع، مقابله با مقاومت دارویی در سرطان نیازمند درک جامع مکانیسمهای مولکولی و محیطی، استفاده از استراتژیهای نوین و ترکیبی و توسعه تحقیقات بینرشتهای است. این مسیر نه تنها میتواند اثربخشی درمانها را افزایش دهد، بلکه چشمانداز بهبود بقا و کیفیت زندگی بیماران مبتلا به سرطانهای مقاوم را نیز فراهم میآورد.