نانوساختارهای برپایه DNA
طی سه دهه گذشته، مولکولهای DNA در طراحی و ساخت ابزارها و ساختارهایی با مقیاس نانو بهکار رفتهاند و پتانسیلهای زیادی برای کاربردهای نوآورانه آنها شناسایی شده است. با این حال، پیشرفت در ساختارها و کاربردهای پیشرفتهتر نیازمند حل چالشهای قابل توجهی است. از جمله مهمترین مسائل، هزینه بالای تولید DNA و نرخ خطای زیاد در فرآیند خودگردهمآوری است. در این زمینه، به بررسی چالشهای اصلی در فناوری نانوساختارهای مبتنی بر DNA پرداخته میشود و برخی از کاربردهای نویدبخش این فناوری که میتوانند با حل این مشکلات به پیشرفتهایی دست یابند، مورد بحث قرار میگیرند. بهطور خاص، استفاده از نانوساختارهای DNA در بیوفیزیک سلولی و مولکولی بهعنوان سیستمهای مقلد زیستی، در فوتونیک و انتقال انرژی، و در کاربردهای تشخیصی و درمانی برای بهبود سلامت انسان، از جمله این کاربردها هستند.
پیشرفتهای فناوری نانوساختارهای مبتنی بر DNA را میتوان با مراجعه به توصیفات اولیهای که توسط Nadrian Seeman در سال ۱۹۸۲ ارائه شد، پیگیری کرد. در آن زمان، وی به دنبال تولید توالیهای الیگومری از نوکلئیک اسیدها بود که بهجای ایجاد ساختارهای خطی معمولی، بتوانند اتصالات مختلفی ایجاد کنند که امکان ساخت اشکال متنوع را فراهم آورند. هدف Seeman این بود که پروتئینها را در کریستالهای سهبعدی سازماندهی کرده و با استفاده از کریستالوگرافی اشعه ایکس، ساختار آنها را بررسی کند. سه دهه بعد، این حوزه از کریستالوگرافی پروتئینها گسترش یافته و پیشرفتهای مهمی در کنترل ساختارهای نانو مقیاس حاصل شده است.
تحقیقات اولیه در این حوزه با تولید ساختارهایی با اتصالات چندشاخهای و توپولوژیهای انعطافپذیر آغاز شد و اکنون در حال پیشرفت به سمت ساخت آجرهای DNA با سختی و دقت بیشتر است. این ساختارها میتوانند برای ایجاد شبکهها و نانولولههای منظم و نامنظم در مقیاسهای بالاتر مورد استفاده قرار گیرند. یکی از مهمترین پیشرفتها در گردآوری ساختارهای DNA منظم، در سال ۲۰۰۹ توسط Seeman و همکارانش رخ داد، زمانی که آنها توانستند کریستالهای DNA سهبعدی با تفکیکپذیری ۴ آنگستروم از مثلثهای متراکم تولید کنند.
قبل از معرفی «DNA origami»، یکی از بزرگترین دستاوردها در این زمینه استفاده از رشتههای بلند DNA بهعنوان داربست برای سازماندهی ساختارهای نامنظم بود. بهعنوان مثال، یک زنجیره DNA تکرشتهای بلند میتوانست بهعنوان داربستی برای سازماندهی کاشیهای متقاطع دوگانه بهکار رود. مفهوم «DNA origami» یک پیشرفت غیرمنتظره بود که در آن یک رشته DNA تکرشتهای بلند از ژنوم فاژ M13 (که حدود ۷۴۲۹ نوکلئوتید طول دارد) با کمک صدها رشته عمودی کوتاه، اشکال دوبعدی مشخصی تولید میکرد. این ساختارها بهعنوان یک صفحه مولکولی با تفکیکپذیری ۴ تا ۶ نانومتر عمل میکنند و میتوانند در گردهمآوری عناصر مختلف مانند پروتئینها و ذرات نانو بهکار روند.
برای گسترش این فناوری به بعد سوم، سه راهبرد عمده توسعه یافته است. اولین راهبرد، تاخوردن اجزای پیوسته یا صفحات DNA بهصورت قفسهای سهبعدی توخالی است. دومین راهبرد، تولید اشکال سهبعدی معمولی با استفاده از لایههای تحت فشار حلزونی است که شبکههای مربعی یا ششگوشهای را ایجاد میکند. سومین روش، استفاده از حلقههای مارپیچی متحدالمرکز است که تعداد متفاوتی از دورها را بهطور هدفمند در ساختار ایجاد میکنند. با این روشها، میتوان نانوساختارهای DNA مختلفی با کاربردهای گسترده در علم مواد و مهندسی زیستی طراحی کرد. این ساختارها بهویژه برای سازماندهی و جهتدهی به عناصر مختلف، مانند پروتئینها، لیپیدها، کپسیدهای ویروسی، ذرات نانو و نانولولههای کربنی، مفید هستند.
در نهایت، پس از نزدیک به ۳۰ سال از طرح اصلی Seeman، محققان توانستهاند بسیاری از طرحها و تکنیکهای جدیدی را توسعه دهند که میتوانند در کاربردهای پیشرفته مهندسی و فناوری بهکار گرفته شوند. با این حال، فناوری نانوساختارهای مبتنی بر DNA هنوز در مراحل ابتدایی خود قرار دارد و برای رسیدن به سطوح بالاتری از کنترل و عملکرد، لازم است چالشهای تکنیکی بسیاری برطرف شوند.
1. چالشهای تکنیکی
DNA origami نمونهای جذاب از قدرت خودگردهمآوری است که بهعنوان ابزاری برای طراحی ساختارهای پیچیده و مشخص استفاده میشود. این ساختارها معمولاً حدود ۵ مگادالتون جرم دارند که تقریباً دو برابر جرم یک ریبوزوم است. با این حال، در آینده برای ایجاد نانوساختارهای پیچیدهتر DNA، چه طراحیهایی ممکن است مطرح شوند؟ بهطور جالبی، تاریخ علم نشان داده که هر دو سال یکبار، تعداد ترانزیستورها در هر مدار مجتمع دو برابر شده است. این پیشرفتها در مدت زمان چهار دهه اخیر، از سال ۱۹۷۱ تا ۲۰۱۱، موجب افزایش حدود یک میلیون برابری تراکم ترانزیستورها شده است. چنین افزایشی در پیچیدگی، تفاوتهای بسیار بزرگ را در ابزارهای فناوری ایجاد کرده است، همانطور که این تفاوت بین یک تلفن هوشمند مدرن و یک ماشین حساب ساده مشاهده میشود. در زیستشناسی هم این تفاوت قابل مقایسه با تغییرات در مقیاسهای سلولی است؛ از جمله تفاوت میان یک سلول کامل و یک کمپلکس مایکرومولکولی منفرد، مانند ریبوزومها. در این راستا، ما به بررسی دو مسیری خواهیم پرداخت که در دو دهه آینده میتواند بهواسطه سرمایهگذاری و تلاش بیشتر، رشد مشابهی در پیچیدگی نانوساختارهای DNA داشته باشد. اما دو مانع اصلی این مسیر، هزینه بالای تولید DNA سنتزی و میزان بالای خطا در خودگردهمآوری است.
1.1. سنتز DNA و طراحی توالی
هزینه معمول تولید DNA در مقیاسهای آزمایشگاهی، حدود ۱۰ دلار برای هر باز از الیگونوکلئوتید است که در مقیاس ۲۵ نانومول (nmol) برای ساخت یک DNA origami مبتنی بر M13، هزینه مواد بهطور تقریبی به ۷۰۰ دلار میرسد. با این حال، اخیراً فناوریهایی در دسترس قرار گرفتهاند که میتوانند آرایشهایی از الیگونوکلئوتیدها با قیمت بسیار پایینتری ارائه دهند، بهطوریکه هزینه هر باز به کمتر از ۰/۰۰۱ دلار کاهش یابد. این کاهش قیمت بهویژه زمانی که روشهای کارآمد و قابل اعتمادی برای تکثیر آنزیمی توسعه یابند، میتواند امکان تولید نانوساختارهای پیچیدهتر DNA با جرم یک گیگا دالتون را فراهم کند. این ساختارها معمولاً پیچیدهتر از origami معمولی خواهند بود و هزینههای تولید آنها به حدود ۱۰۰۰ دلار برای مواد میرسد.
کاهش هزینههای تکثیر آنزیمی بهطور چشمگیری میتواند تولید انبوه نانوساختارهای پیچیده DNA را از مقیاس گرم به کیلوگرم ممکن سازد. این تحول بهویژه برای بسیاری از کاربردها اهمیت دارد. یکی از محدودیتهای رایج در DNA origami این است که معمولاً از ژنوم M13 (۷ کیلوباز) بهعنوان داربست استفاده میشود. برای ساخت نانوساختارهای بزرگتر، نیاز به داربستهای بلندتر و متنوعتر است. بنابراین، استفاده از توالیهای DNA منحصربهفرد و چندگانه بهعنوان داربستها برای پشتیبانی از تاخوردگیهای مختلف و بهینه، امری ضروری است. این سوال مطرح میشود که چه قوانین طراحی برای تولید ساختارهای بهینه در این زمینه وجود دارند و چگونه باید آزمایشها و تئوریهای مختلف را برای حل این معضلات ترکیب کنیم.
2.1. گردهمآوری با الگو و سلسلهمراتبی
در DNA origami استاندارد، از یک مولکول DNA بلند و منفرد بهعنوان داربست استفاده میشود. برای ساخت نانوساختارهای پیچیدهتر با جرم گیگادالتونی، نیاز به داربستهای بسیار بزرگتر است که معمولاً به طول ژنوم باکتری E.coli (حدود یک میلیون باز) میرسند. چنین مولکولهای بزرگی از نظر مکانیکی شکننده هستند و مشکلاتی در سنتز آنها وجود دارد. بهجای استفاده از یک مولکول داربست واحد، میتوان ساختارهای DNA بزرگتر را بهصورت ابرآجرهایی تصور کرد که قادرند بهصورت سلسلهمراتبی به یکدیگر متصل شوند تا ساختارهای بزرگتر ایجاد کنند. با تغییر طراحی هر ابرآجر، میتوان بهراحتی ابعاد این ساختارها را افزایش داد و آنها را برای تشکیل ساختارهای پیچیدهتر آماده کرد. برای رسیدن به بهرهوری بهتر در این فرآیند، نیاز به طراحی دقیق سطوح مشترک ابرآجرها وجود دارد تا فرآیند گردهمآوری با دقت بیشتری انجام گیرد. ساختارهای فوقسازنده میتوانند با استفاده از داربستهای پیچیدهتر و با الگوریتمهای پیشرفته سازماندهی شوند. این روشها توجه زیادی را در صنایع نیمهرسانا بهخود جلب کردهاند، چرا که به آنها امکان میدهند ساختارهای پیچیدهتر با دقت نانومتری بسازند.
3.1. کنترل در طراحی ساختارهای ظریفتر
پیشرفتهای مداوم در ساخت نانوساختارهای DNA نیازمند درک عمیق از سینتیک و ترمودینامیک خودگردهمآوری درون و بین بلوکهای ساختمانی DNA است. یکی از چالشهای عمده در این راستا، نبود ابزارهای کمی برای تجزیه و تحلیل خطاهای احتمالی در نانوساختارهای پیچیده است. برای طراحی ساختارهای دقیقتر، نیاز است که آزمایشها بهگونهای انجام شوند که خطاهای کوچک تاخوردگی در طراحی بهشکل تغییرات بزرگتری در هندسه ساختار منجر شوند. این تغییرات باید طوری طراحی شوند که بهراحتی توسط روشهای تصویربرداری مولکولی یا سایر روشهای تحلیلی قابل شناسایی باشند. علاوه بر این، بررسی جنبههای سینتیکی گردهمآوری و نحوه ارتباط صحیح رشتههای عمودی با داربست در DNA origami نیز نیاز به تحقیقات بیشتری دارد.
4.1. مکاندهی دقیق عناصر ناهمسان برای عاملدارکردن ساختار
یکی از اهداف بزرگ در فناوری نانو، ساخت دستگاهها و فعالکنندههای پیشرفته است. خودسازماندهی نوکلئیک اسیدها ظرفیت بالایی برای پیشبرد عملکرد نانوساختارها فراهم میکند، اما برای استفاده از این نانوساختارها بهعنوان ماشینها و ابزارهای فعال، نیاز به درج دقیق عناصر ناهمسان مانند پروتئینها یا ذرات نانو وجود دارد. این کار نیازمند کنترل دقیق بر جهتگیری و موقعیت این مولکولها در ساختار نهایی است. برای مثال، یکی از نقاط شروع رایج در این زمینه، استفاده از الیگونوکلئوتیدهای تغییر یافته (مانند تیولی یا آمینی) است که میتوانند از طریق واکنشهای شیمیایی با دیگر عناصر ناهمسان ترکیب شوند. چالش اصلی در این فرآیند، جفتسازی دقیق الیگونوکلئوتیدها با موقعیتهای خاص روی پروتئینها و خالصسازی پس از واکنشهای شیمیایی است. برای تطبیقدادن این تنوعها، روشهای موثر برای ساخت نانوساختارهایی که بتوانند پروتئینها یا سایر مولکولها را با دقت در موقعیتهای دقیق قرار دهند، ضروری است. اگر این چالشها برطرف شوند، ممکن است بتوان از این ساختارها برای تولید نانوساختارهای فعال مانند سیستمهای آنزیمی استفاده کرد که در آنها جفتهای آنزیمی بهطور دقیق در فضای سهبعدی در کنار یکدیگر قرار میگیرند.
درج و یکپارچهسازی نانوذرات غیرآلی درون نانوساختارهای DNA طی سالهای اخیر توجه گستردهای را به خود جلب کرده است. نانوذرات فلزی مانند طلا و نقره، به دلیل قابلیت عملکردیسازی سادهشان با الیگونوکلئوتیدها، مسیرهای قابل اعتمادی برای اتصال به ساختارهای DNA ایجاد کردهاند. با این حال، گزارشهای مربوط به خودسازماندهی مقادیر بسیار کم از نانوساختارهای مبتنی بر DNA همچنان محدود و پراکنده است. عملکردیسازی در مقیاسهای کوچک با چالشهایی چون کاهش پایداری پیوندهای تیولی، عدم سازگاری با غلظتهای لازم نمک و همچنین مشکلات مربوط به محیطهای آبی همراه است. بنابراین، توسعهٔ راهکارهای نوآورانه و کمتر متداول برای این نوع اتصالدهی، ضرورتی آشکار دارد.
در کنار نانوذرات فلزی، تلاشها برای عملکردیسازی و سازماندهی ساختارهای DNA با نانولولههای کربنی تکجداره و مولکولهای فولرین نیز در مراحل آغازین قرار دارد و بهنظر میرسد در آیندهٔ نزدیک اهمیت بسیار بیشتری پیدا کند. این مواد به دلیل رسانایی بالا، رفتارهای الکترونی منحصربهفرد و سطح فعال مناسب، میتوانند نسل جدیدی از نانوساختارهای ترکیبی را امکانپذیر کنند.
در زمینهٔ فلزیکردن DNA نیز—که یکی از رویکردهای کلیدی برای ساخت مواد نانومقیاس با کاربردهای الکترونیکی و فوتونیکی است—روشهای فعلی هنوز توانایی تولید سیمهای فلزی یکنواخت و همگن را ندارند، هرچند پیچیدگی و هندسهٔ این ساختارهای فلزی طی سالها رو به افزایش بوده است. این موضوع نشان میدهد که برای دستیابی به سیمهای رسانای دقیق و کاربردی، نیاز به جهشهای تکنیکی در مرحلهٔ هستهزایی و رشد فلز روی داربست DNA داریم.
۵.۱. خودگردهمآوری فعال
فناوری نانو مبتنی بر DNA معمولاً به عنوان سیستمی ایستا و پایدار تصور میشود؛ با وجود اینکه پیشرفتهای کنونی نشان دادهاند این ساختارها میتوانند در صورت برنامهریزی، رفتارهای پویا و قابل تغییر نیز از خود نشان دهند. این تصور نادرست تا حدی مشابه برداشت اولیه از اسکلت سلولی است؛ جایی که در گذشته تصور میشد اسکلت سلولی ساختاری ثابت و ساکن دارد، در حالی که امروزه میدانیم این شبکهٔ مولکولی دائماً در حال بازآرایی است و حرکات سلولی با کمک موتورهای مولکولی بسیار پیچیده هدایت میشود.
این رفتارهای خارج از تعادل، امکان انجام فرآیندهای خارقالعادهای مانند حرکت خزندهٔ نوتروفیلها در میان شکافهای باریک بین سلولهای اپیتلیال را فراهم میکنند. به همین دلیل، یکی از اهداف مهم در فناوری نانو DNA، طراحی ابزارهایی است که بتوانند همانند سیستمهای درونسلولی، خودگردهمآیی فعال داشته باشند و به صورت پویا عمل کنند.
در دههٔ گذشته، پیشرفتهای چشمگیری در زمینهٔ برنامهریزی نانوساختارهای DNA و کنترل مرحلهای فرآیندهای خودسازماندهی با استفاده از واکنشهای Hybridization Chain Reaction (HCR) انجام شده است. برای مثال، در یک نانوانبر مبتنی بر DNA، یک رشتهٔ آغازگر قادر است ساختار انبرگونه را باز کند و در نتیجه یک بازوی آزاد ایجاد شود. این بازوی آزاد میتواند سنجاقسرهای بعدی را باز کند و زنجیرهای از واکنشها را فعال نماید. جذابیت این سیستم در آن است که با هر مرحله، افزایش انرژی جفتشدگی بازها باعث تقویت خودبهخودی واکنش میشود و یک فرآیند پیشرونده ایجاد میگردد.
از این الگو برای طراحی پلیمرهای رشدکننده نیز الهام گرفته شده است که در آنها، اتصال مونومرهای جدید تنها در محلهایی که یک «کاتالیست اختصاصی» حضور دارد، انجام میشود. این رویکرد تا حدی الهامگرفته از پلیمریزاسیون آکتین در باکتری Listeria است که با استفاده از انرژی شیمیایی، نیروی رانش لازم برای حرکت را فراهم میکند.
ابزارهای DNA فعلی همچنان در مقایسه با ماشینهای طبیعی سلول سادهتر، کمقدرتتر و کندتر هستند. بنابراین، نیاز گستردهای برای طراحی سیستمهایی وجود دارد که بتوانند با بازده بالا، سرعت مناسب و کنترلپذیری بیشتر فعالیت کنند. یکی از مسیرهای آینده میتواند استفاده از منابع انرژی متنوع مانند هیدرولیز ATP یا جذب نور باشد—رویکردهایی که طبیعت برای ساخت موتورهای مولکولی فوقسریع از آنها استفاده میکند.
یکی دیگر از حوزههای پرطرفدار، طراحی Walkerهای مولکولی مبتنی بر DNA است. این ساختارها توانستهاند به صورت خودمختار روی مسیرهای تعیینشده حرکت کنند، بار حمل کنند و حتی به عنوان خطوط مونتاژ نانومقیاس عمل کنند. برای رسیدن به سرعت و کارایی بیشتر، توسعهٔ Walkerهای چندمسیره، سیستمهای تصمیمگیری در لحظه و مدلهای الهامگرفته از شبکههای عصبی مولکولی پیشنهاد شده است.
افزون بر این، هماهنگسازی فعالیت چند Walker در یک مسیر مشترک میتواند منجر به ساخت سیستمهای پیچیدهتر و کارآمدتر شود؛ مشابه رباتهای کوچک هماهنگ که کارهای گروهی انجام میدهند.
۶.۱. طراحی و خودسازماندهی درون بدن
گفتوگو و همکاری گسترده میان پژوهشگران زیستشناسی سلولی نشان داده است که نانوساختارهای DNA نهتنها زیستسازگار هستند، بلکه قابلیت عملکرد درونسلولی نیز دارند. یکی از پرسشهای مهم این است که آیا میتوان نانوساختارهای پیچیده DNA را بهصورت ژنتیکی کدگذاری کرد تا مستقیماً درون سلول ساخته شوند؟
شواهد موجود نشان میدهد رشتههای بلند DNA که بر اساس توالیهای مشخص طراحی شدهاند، میتوانند توسط پلیمرازها درون یا بیرون سلول تکثیر شوند و سپس با بهرهگیری از موتیفهای مناسب، به شکل ساختارهای مورد نظر تاخوردگی پیدا کنند.
با این حال، چالشی اساسی پیش روی ما این است که چگونه میتوان نانوساختارهای بزرگ و پیچیده را با راندمان بالا درون سلول تا کرد. اقبال روزافزون به حوزهٔ فناوری نانو RNA احتمالاً مسیرهای تازهای باز خواهد کرد، زیرا RNA بهطور طبیعی در سلول بهصورت تکرشتهای نسخهبرداری میشود و ظرفیت تاخوردگی مستقیم را دارد.
گرچه تاکنون قوانین طراحی قابل اعتماد برای ایجاد نانوساختارهای RNA محدود بودهاند، اما پیشرفتهای جدید—از جمله کار گروه Aldaye—نشان دادهاند که میتوان موتیفهای RNA را برای ساخت ساختارهای یکبعدی و دوبعدی مهندسی کرد و این مسیر آیندهٔ امیدوارکنندهای دارد. از سوی دیگر، قابلیت پیشبینی بالای تاخوردگی DNA و تنوع عملکردی RNA نشان میدهد که ترکیب DNA–RNA در آینده میتواند نسل تازهای از نانوساختارهای هوشمند را شکل دهد.
ساختارهای DNA origami مقاومت قابلتوجهی در برابر تجزیه بهوسیلهٔ نوکلئازها و تخریب درونسلولی نشان دادهاند. بنابراین، محدودیت اصلی در استفادهٔ درونتنی از این ساختارها، کمبود پایداری نیست، بلکه چالش اصلی توانایی گردهمآوری مؤثر داخل سلول است.
در این زمینه، سیستمهای زیستی میتوانند نقش مهمی در انتخاب و تکامل ساختارهای سازگار زیستی و فعال ایفا کنند. برای مثال، میتوان جمعیت بزرگی از ساختارهای DNA را طراحی کرد که بخشهایی از آنها متغیر باشد تا بتوان از طریق فرآیند انتخاب، ساختارهایی با عملکرد مطلوب را استخراج کرد.
پیشرفتهای اخیر، مانند روش تکامل مداوم وابسته به فاژ که توسط Liu و همکارانش معرفی شده، نشان میدهد که میتوان ویژگیهای مولکولهای DNA کدشده را بهطور مستقیم با تولید پروتئین در باکتری E.coli مرتبط کرد. این فناوری میتواند نقطهٔ آغاز بسیار مناسبی برای تکامل هدایتشدهٔ نانوساختارهای DNA باشد تا ساختارهایی با ویژگیهای زیستی بهتر، پایداری بیشتر و عملکردهای پیچیدهتر ایجاد شوند.
۲. کاربردهای آینده فناوری نانوی مبتنی بر DNA ساختاری
در این بخش، مجموعهای از کاربردهای نوظهور نانوساختارهای DNA بررسی میشود؛ کاربردهایی که با رفع محدودیتهای فنی سالهای گذشته، اکنون بیش از پیش در دسترس و عملیاتی شدهاند.
۲.۱ بیوفیزیک سلولی و مولکولی
هدف اصلی Seeman از جایدهی پروتئینهای مهمان در کریستالهای طراحیشده DNA، دستیابی به تعیین ساختار با تفکیک بسیار بالا از طریق پراش پرتو X بود؛ هدفی که همچنان یکی از مهمترین انگیزههای پژوهش در این حوزه به شمار میرود. انتظار میرود نانوفناوری DNA در دیگر روشهای ساختارشناسی ماکرومولکولی نیز نقشی مؤثر ایفا کند و دامنه کاربردهای خود را فراتر از تکنیکهای مرسوم گسترش دهد.
کریستالهای نانولولهای DNA که مقاومت بالایی در برابر دترجنت دارند و رفتار مایع-بلورینه نشان میدهند، امکان تهیه طیف NMR از پروتئینهای غشاییِ ضعیفهمراستا را فراهم میکنند؛ موضوعی که پیشتر بسیار دشوار بود. کارایی این ابزار در تعیین ساختار پروتئین UCP2 – یک پروتئین 33 کیلودالتونی با هلیکسیهای ترانسممبران در غشای داخلی میتوکندری – بهخوبی نشان داده شده است. میتوان انتظار داشت در دهه آینده تعداد بیشتری از پروتئینهای غشایی کوچک تا متوسط با بهرهگیری از چنین روشهایی تعیین ساختار شوند.
علاوه بر این، قرار دادن ماکرومولکولهای ضعیفهمتراز با تراکم بالا درون منافذ کریستالهای دوبعدی DNA میتواند فرآیند جمعآوری داده در میکروسکوپ کرایوالکترون را تسریع و بهبود بخشد. نانوساختارهای DNA همچنین برای پیشبرد مطالعات بیوفیزیک مولکولی در سطح تکمولکول مطرح شدهاند و میتوانند هم برای تصویربرداری و هم برای اعمال نیروهای کنترلشده بر چند ماکرومولکول بهطور همزمان مورد استفاده قرار گیرند.
در مطالعات اخیر، مولکولهای محصور در چارچوبهای DNA با میکروسکوپ نیروی اتمی روبشی با سرعت بالا تصویربرداری شدهاند و این امکان فراهم شده است که شکلگیری ساختارهایی همچون G-quadruplex و همچنین متیلاسیون DNA در لحظه و بهصورت زنده مشاهده شود. چنین راهبردهایی میتوانند برای مطالعه هر پروتئینی که دامنه اتصال به DNA دارد نیز مورد استفاده قرار گیرند؛ بهعنوان مثال یک کانژوگه DNA–پروتئین.
افزون بر این، با توسعه سیستمهای هیبریدی DNA–پروتئین، ابزارهای جدیدی برای بررسی پویاییهای مولکولی، نیروهای بینمولکولی و تنظیمات ساختاری زیستمولکولها فراهم خواهد شد؛ موضوعی که میتواند در آینده به کشف مکانیسمهای ناشناخته در تنظیم ژن و دینامیک کروماتین کمک کند.
۲.۲ سیستمهای تقلیدکننده زیستی
ریچارد فاینمن جمله معروفی دارد: «چیزی را که نمیتوانم بسازم، نمیتوانم بفهمم.» این نگاه، پایه و انگیزه بسیاری از تلاشها برای ایجاد سیستمهای تقلیدکننده زیستی است؛ سیستمهایی که هم میتوانند الگوی سادهشدهای از سازوکارهای زیستی پیچیده باشند و هم بهعنوان نقطه شروعی برای ساخت مواد و ابزارهای کاملاً جدید و کاربردی عمل کنند.
یکی از چالشهای مهم و بلندمدت در حوزه نانوساختارهای DNA، ساخت «سلولهای مصنوعی» است که بخش قابلتوجهی از رفتارهای زیستی طبیعی را تنها با تکیه بر DNA بازسازی کنند. البته تحقق این هدف در آینده نزدیک بعید است، اما تقلید ماشینهای ماکرومولکولی طبیعی – هرچند در مقیاس محدود – اکنون در دسترستر است.
یکی از راهبردهای جذاب، ترکیب نانوساختارهای DNA با ATPaseهای پروتئینی است تا سیستمهایی ساخته شوند که نسبت به سازههای صرفاً DNA-محور، سرعت عملکردی بیشتری داشته باشند. علاوه بر این، نانوساختارهای DNA میتوانند بهگونهای طراحی شوند که بهعنوان نانومنافذ زیستی پاسخدهنده عمل کنند. با وارد کردن مولکولهای هیدروفوب به الیگونوکلئوتیدها، امکان ادغام این ساختارها در دولایههای لیپیدی فراهم میشود.
این نانومنافذ میتوانند نقش دروازههای کنترلکننده اندازه، بار یا ویژگیهای شیمیایی ماکرومولکولها را بر عهده بگیرند و مسیر انتشار مواد را تنظیم کنند. چنین ساختارهایی میتوانند فراتر از معماریهای DNA-مبنا رفته و در آینده در کنار ATPaseها برای ساخت کانالهای مصنوعی انتقالدهنده فعال مورد استفاده قرار گیرند.
در کنار این موارد، پیشرفت در تولید موتورهای DNA، نانوروباتهای زیستی و ماشینهای مکانیکی قابلبرنامهریزی بر پایه DNA میتواند در بلندمدت مسیر توسعه ابزارهای مصنوعی پیچیده شبیه ماشینهای سلولی را هموار کند.
۲.۳ سیستمهای انتقال انرژی و سامانههای نوری
فتوسنتز یکی از پیچیدهترین و کارآمدترین فرآیندهای طبیعی برای تبدیل انرژی نور به انرژی شیمیایی است. همین موضوع الهامبخش شیمیدانان برای طراحی سامانههای مصنوعی برداشت نور و انتقال انرژی شده است. در سیستمهای کلاسیک، چالش اصلی نیاز به سنتز آلی پیچیده با کنترل دقیق در مقیاس آنگستروم است؛ امری که محدودیتهایی در اندازه، پیچیدگی و تکاملپذیری ساختارها ایجاد میکند.
نانوساختارهای DNA، با قابلیت خودآرایی دقیق و کنترلشده، بهعنوان چارچوبی عالی برای استقرار منظم مولکولهای جاذب نور، ناقلهای بار و رنگهای فلورسانس به کار گرفته شدهاند. این چارچوبها مانند یک چیدمانگر مولکولی (molecular pegboard) عمل میکنند و اجازه میدهند اجزای مختلف با فاصله و جهتگیری دقیق کنار یکدیگر قرار گیرند. چنین سامانههایی میتوانند مسیر ساخت نسل جدیدی از «برگهای مصنوعی» را هموار کنند.
از سوی دیگر، توانایی DNA در انتقال بار الکتریکی در طول بازهای خود – که از طریق اکسیداسیون رخ میدهد – سبب شده از DNA دورشته و ساختارهای DNA اوریگامی بهعنوان داربستهای سیمهای فوتونی استفاده شود؛ سیمهایی که انرژی را در مسیرهای طولانی و با بازده بالا منتقل میکنند. نانوساختارهای DNA بهدلیل سختی و پایداری بالاتر، امکان ساخت سیمهای فوتونی بلندتر و شبکههایی با مسیرهای منشعب را فراهم میکنند.
ترکیب نانوساختارهای DNA با ذرات پلاسمونیک، نیمهرساناها و پروتئینهای نوری میتواند منجر به ایجاد مدارهای مولکولی واقعی شود؛ مدارهایی که در آن تبدیل فوتونها، پتانسیلهای الکتریکی و سیگنالهای شیمیایی به یکدیگر امکانپذیر است. همچنین استفاده همزمان از روشهای ساخت بالابهپایین و پایینبهبالا میتواند گونههای جدیدی از نانوسیمهای غیرآلی را بر روی داربستهای DNA سازماندهی کند.
این نوع سیستمهای نور-پایه در آینده میتوانند در سلولهای خورشیدی نسل جدید، حسگرهای پیشرفته و ابزارهای نانوفوتونیک مورد استفاده قرار گیرند.
۲.۴ کاربردهای تشخیصی و درمانی در پزشکی
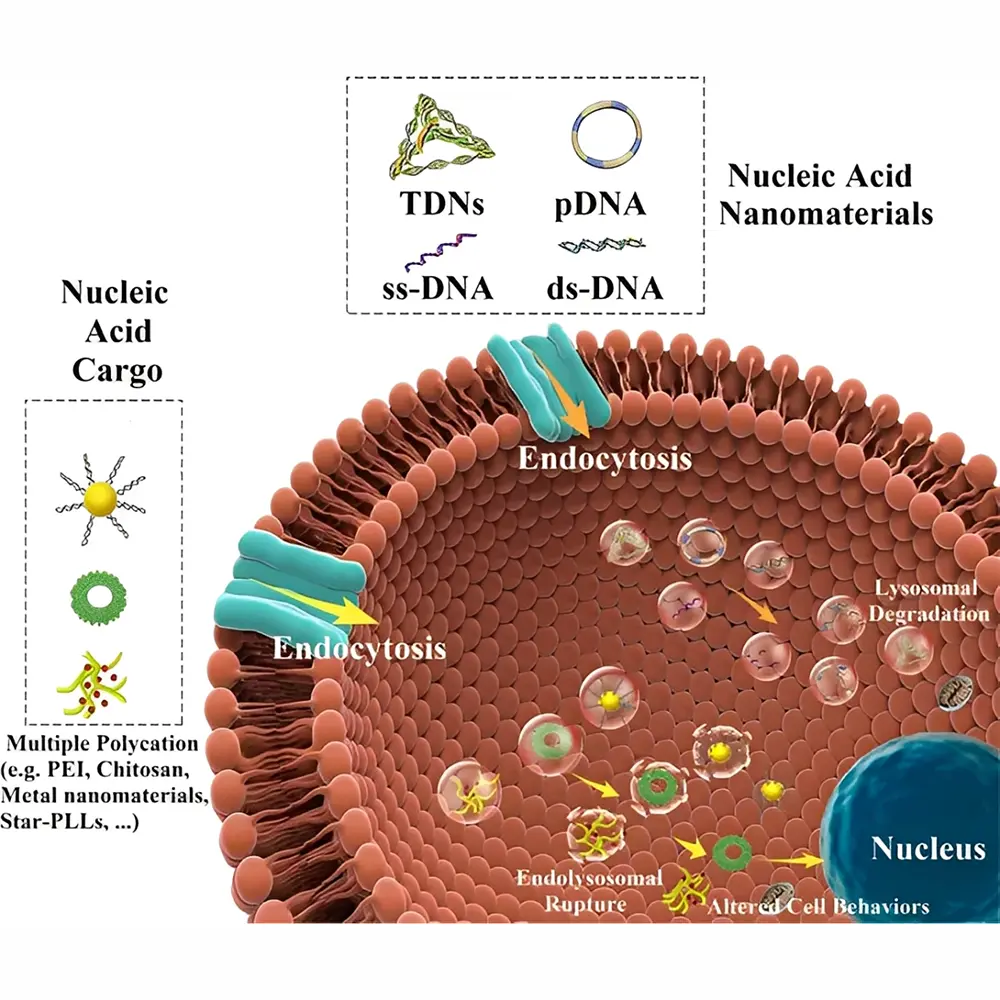
یکی از جذابترین و پرکاربردترین جنبههای فناوری نانوی DNA، توسعه نانوحاملهای دارویی هوشمند است. میتوان یک نانوجعبه DNA را تصور کرد که یک درپوش قابلبرنامهریزی دارد و تنها با یک رشته DNA کلیدی باز میشود. چنین ساختارهایی میتوانند دوزهای سمی یا هدفمند دارویی را دقیقاً در محل موردنظر آزاد کنند و بهطور چشمگیری عوارض جانبی درمان را کاهش دهند.
با وجود این مزایا، رساندن نانوذرات به هدف نهایی در بدن هنوز یک چالش اساسی است. نانوذرات باید بتوانند از پاکسازی توسط سیستم ایمنی – بهویژه ماکروفاژهای کبد و طحال – فرار کنند و در همان حال بافت هدف را بهطور مؤثر نفوذ دهند.
در بسیاری از بیماریها، نشتپذیری عروق میتواند باعث ورود غیرفعال نانوذرات شود؛ اما در شرایطی دیگر، نیاز به نفوذ فعال از میان لایههای اندوتلیال وجود دارد. حتی در تومورهای جامد نیز، اگرچه نانوذرات ممکن است بهصورت غیرفعال تجمع یابند، اما انتشار آنها درون بافت توموری محدود است.
علاوه بر رسیدن نانوذرات به بافت هدف، ورود آنها به درون سلولها نیز بسیار مهم است. مکانیسمهایی مانند اندوسیتوز و پینوسیتوز همیشه کافی نیستند، زیرا این مسیرها عملاً محیطهایی معادل بیرون سلول ایجاد میکنند. بنابراین، توسعه ابزارهای مبتنی بر DNA که قادر به عبور فعال و کنترلشده از غشای سلولی باشند، از جمله اهداف مهم تحقیقات پیشرو است.
در آینده، ترکیب نانوساختارهای DNA با لیگاندهای هدفگیرنده، پپتیدهای نفوذکننده به سلول، و سیستمهای پاسخدهنده به pH یا آنزیم میتواند نسل جدیدی از نانوحاملهای بسیار هوشمند و شخصیسازیشده را برای درمان سرطان، بیماریهای ژنتیکی و عفونتها ایجاد کند.
چگونه نانوذرات مبتنی بر DNA میتوانند به غلبه بر موانع مختلف کمک کنند؟
نانوذرات مبتنی بر DNA قادرند ویژگیهای متنوع و کنترلشدهای از جمله شکل، اندازه، انعطافپذیری مکانیکی و تغییرات سطحی را در خود جای دهند. این ویژگیها به آنها اجازه میدهند تا در مقیاس نانو رفتارهایی مشابه به ذرات زیستی طبیعی نظیر اریتروسیتها یا ذرات پاتوژنی که برای عبور از موانع تکامل یافتهاند، از خود نشان دهند. این نوع نانوساختارها میتوانند زمانهای انتشار طولانی را ایجاد کنند که میتواند در تقویت انتقال دارو و هدفگیری دقیق بافتهای بیمار مؤثر باشد.
یکی از مهمترین ویژگیهای نانوساختارهای DNA، قابلیت تغییر سطح آنها است. این تغییرات سطحی میتوانند به نمایش لیگاندهای خاصی منجر شوند که هدفگیری دقیق بافتهای بیمار را تسهیل کرده و باعث افزایش جذب سلولی در نقاط هدف شوند. به علاوه، تقلید از استراتژیهای ویروسی برای عبور از موانع سلولی و رسیدن به سیتوپلاسم میتواند از طریق کنترل دقیق عملکرد سطحی نانوساختارهای DNA به دست آید. در واقع، سطح این نانوساختارها کاملاً قابل تنظیم است و میتوان لیگاندهای مختلف، نشانههای تصویربرداری زیستی، آنتیبادیها و هورمونها را بهطور همزمان بر روی آنها قرار داد.
این ویژگیها میتوانند در ساخت سیستمهای دارورسانی اختصاصی و مؤثر بسیار مفید باشند. بهعنوان مثال، نانوحاملهای DNA میتوانند برای تحویل دقیق داروها در زمانهای مشخص طراحی شوند، که این امر باعث افزایش اثربخشی دارو و کاهش اثرات جانبی آنها میشود. همچنین، نانوساختارهای DNA میتوانند در شناسایی و مقابله با سرطان، با شناسایی مارکرهای خاص سلولی در شرایط سلولهای بیمار، بهطور مؤثر عمل کنند. این امر میتواند کمک کند تا داروهای خاص فقط به سلولهای سرطانی تحویل داده شوند، در حالیکه اثرات جانبی بر بافتهای سالم به حداقل برسد.
بهویژه با پیشرفت در محاسبات DNA، میتوان سیستمهایی تولید کرد که قادر به شناسایی همزمان مارکرهای چندگانه سرطانی و القای مرگ سلولی از طریق مکانیزمهای خاص باشند. این پیشرفتها در آینده میتوانند در جهت توسعه داروهای هوشمند و سیستمهای تصویربرداری پیشرفته کمک کنند. استفاده از سیستمهای DNA در کنار DNAzyme و موتیفهای انبری برای ایجاد مدارهای مولکولی میتواند رویکرد جدیدی برای تشخیص سریع و دقیق بیماریها در مراحل اولیه ایجاد کند.
آینده درخشان فناوری نانوساختارهای مبتنی بر DNA
با توجه به چالشهای اصلی که پیشروی فناوری نانوساختارهای DNA قرار دارد، مسیری طولانی در پیش است. این فناوری، که بهطور طبیعی در مرزهای مختلف علوم قرار دارد، هنوز مراحل زیادی برای تکامل و رسیدن به اهداف نهایی خود پیش رو دارد. همانطور که طبیعت در طول میلیونها سال تکامل سلولی سیستمهای پیچیدهای را با مقیاس نانو توسعه داده است، انتظار میرود که ما نیز در آینده به کشفیات جدید و تحولآفرینی در این حوزه دست یابیم.
برای رسیدن به این اهداف در چند دهه آینده، نیاز به تلاشهای مستمر و تحقیقات جدید است. این رشته بهطور فزایندهای به یک حوزه تحقیقاتی بینرشتهای تبدیل شده است که شامل همکاریهای گستردهای از سوی محققان در رشتههای مختلف مانند شیمی، فیزیک، زیستشناسی، و علوم کامپیوتر است. به این ترتیب، انتظار میرود که در آینده، تکنیکها و فناوریهای نوینی در این حوزه ظهور کنند که فراتر از محدودیتهایی که امروز با آنها روبهرو هستیم، عمل کنند.
نانوذرات و نانوساختارهای مبتنی بر DNA در حال حاضر در مرحلهای از تحقیق و توسعه قرار دارند که میتوانند تغییرات اساسی در روشهای درمانی و تشخیصی ایجاد کنند. بهویژه در درمان سرطان و بیماریهای ژنتیکی، نانوساختارهای DNA میتوانند بهعنوان داربستهای هوشمند و خودبرنامهریزیشونده برای داروهای اختصاصی و سیستمهای درمانی عمل کنند. همچنین، این فناوری میتواند در زمینههای جدید مهندسی بافت، ساخت ارگانهای مصنوعی و سیستمهای زیستی پیچیده وارد عمل شود.
در نهایت، پیشرفتهای مداوم در این فناوری میتواند موجب توسعه سیستمهای نوینی شود که نهتنها در پزشکی، بلکه در بسیاری از حوزههای دیگر نظیر انرژی، الکترونیک و محیطزیست نیز کاربرد داشته باشد.


