آموزش نانوبیوتکنولوژی
مقیاس نانو به محدودهای از اندازهها اطلاق میشود که در حدود یک تا صد نانومتر (nm) است، یعنی در ابعادی برابر با یک میلیاردم متر. در این مقیاس، قوانین فیزیکی کلاسیک کارایی خود را از دست داده و قوانین مکانیک کوانتومی حاکم میشوند. این تغییر بنیادی در رفتار ماده، باعث میشود که مواد در ابعاد نانویی خواصی متفاوت با حالت ماکروسکوپی خود از خود نشان دهند. نانوتکنولوژی در واقع علمی میانرشتهای است که بر مطالعه، کنترل و بهکارگیری این ویژگیها تمرکز دارد.
تاریخچهی نانوتکنولوژی به سال ۱۹۵۹ برمیگردد؛ زمانی که ریچارد فاینمن فیزیکدان مشهور، در سخنرانی معروف خود تحت عنوان «فضای فراوانی در پایین وجود دارد» به ایدهی کنترل اتم به اتم مواد اشاره کرد. اما تحقق عملی این اندیشه، در دههی ۱۹۸۰ با اختراع میکروسکوپ تونلی پیمایشی (STM) توسط بینینگ و روهرر امکانپذیر شد؛ ابزاری که برای نخستینبار اجازهی مشاهده و جابهجایی اتمها را داد. از آن زمان، نانوتکنولوژی به سرعت رشد کرد و امروزه به حوزههایی چون پزشکی، الکترونیک، انرژی، محیط زیست و زیستفناوری نفوذ کرده است.
اهمیت مقیاس نانو
در مقیاس نانو، نسبت سطح به حجم مواد بسیار زیاد است، که این ویژگی باعث افزایش واکنشپذیری، قابلیت حلشدن و فعالیت کاتالیزوری آنها میشود. همچنین اثرات کوانتومی در این ابعاد، رفتار الکترونی، نوری و مغناطیسی مواد را دگرگون میکند. برای مثال، نانوذرات طلا بسته به اندازهشان میتوانند رنگهای مختلفی از قرمز تا آبی نشان دهند، در حالیکه طلای معمولی زرد است.
در سیستمهای زیستی، مولکولها و ساختارهایی مانند DNA، پروتئین و ویروسها همگی در مقیاس نانومتر فعالیت میکنند. بنابراین علم نانو، زبانی مشترک با زیستشناسی دارد و به ما اجازه میدهد پدیدههای زیستی را در سطح اتمی مطالعه و دستکاری کنیم. این درک دقیق از عملکرد سلولی، اساس توسعهی نانوداروها، نانوحسگرها و نانوپلتفرمهای تشخیصی در پزشکی نوین است.
آینده نانو
چشمانداز آیندهی نانوتکنولوژی، ایجاد پیوندی عمیق میان فناوری نانو و علوم زیستی است. در پزشکی آینده، نانوروباتهایی طراحی خواهند شد که قادر به تشخیص بیماری در سطح سلولی، ترمیم بافتهای آسیبدیده و حتی بازسازی سلولهای عصبی هستند. فناوری نانو همچنین میتواند در طراحی واکسنهای هوشمند، سامانههای تشخیص سریع سرطان و دارورسانی هدفمند نقش محوری ایفا کند. ترکیب نانوتکنولوژی با فناوریهای نوظهور مانند هوش مصنوعی، چاپ سهبعدی زیستی و بیوانفورماتیک نیز زمینهساز تحولاتی بنیادین در پزشکی و کشاورزی خواهد بود.
درس دوم: ساختارهای خودآراییشونده
خودآرایی در سیستمهای زیستی
خودآرایی یا Self-Assembly یکی از بنیادیترین فرآیندهای طبیعی است که در آن مولکولها و ذرات بدون دخالت خارجی و بر اثر نیروهای ضعیف بینمولکولی، مانند پیوند هیدروژنی، برهمکنشهای واندروالسی و الکترواستاتیکی، ساختارهایی منظم و پایدار را تشکیل میدهند. در زیستفناوری، این پدیده نقش اساسی در سازماندهی پروتئینها، شکلگیری غشاهای سلولی، ویروسها و حتی کروموزومها دارد. تقلید از فرایندهای خودآرایی طبیعی به دانشمندان امکان داده است که نانوساختارهای مصنوعی با الگوگیری از طبیعت طراحی کنند.
غشاها و سدهای بیولوژیک
غشاهای سلولی نمونهای شگفتانگیز از خودآرایی طبیعی هستند. این غشاها از دولایهی فسفولیپیدی تشکیل میشوند که سرهای آبدوست و دمهای آبگریز آنها باعث میشود بهصورت خودبهخود در محیط آبی آرایش یابند و سد نفوذناپذیری را برای سلول ایجاد کنند. این غشاها نه تنها مانع ورود و خروج مواد ناخواسته میشوند، بلکه در انتقال یونها، سیگنالهای شیمیایی و تعامل سلول با محیط نقش دارند. مهندسی چنین غشاهایی در مقیاس نانو، راه را برای تولید نانوکپسولها و حاملهای هوشمند دارویی هموار کرده است.

لایه اس (S-Layer)
لایهی S یا سطحی، شبکهای پروتئینی و بلورین است که سطح بسیاری از باکتریها و آرکیها را میپوشاند. این لایهها با نظم نانومتری خود میتوانند الگوهایی دقیق برای ساخت مواد هیبریدی فراهم کنند. امروزه پژوهشگران از S-Layer به عنوان «قالب طبیعی» برای رشد نانوذرات فلزی، ایجاد فیلمهای زیستی و طراحی نانوحسگرها استفاده میکنند.
کاربردهای خودآرایی
از مهمترین کاربردهای خودآرایی میتوان به طراحی ویروسهای مصنوعی، نانولولههای زیستی، نانوکپسولهای دارویی، نانوغشاهای فیلترکننده و حسگرهای زیستی اشاره کرد. این فناوریها به دانشمندان اجازه میدهند مواد زیستی را با دقت مولکولی مهندسی کنند تا در درمان، تشخیص و حتی ذخیرهسازی انرژی مورد استفاده قرار گیرند.
درس سوم: برهمکنش سلول در مواجهه با نانوذرات
راههای ورود نانوذرات به بدن
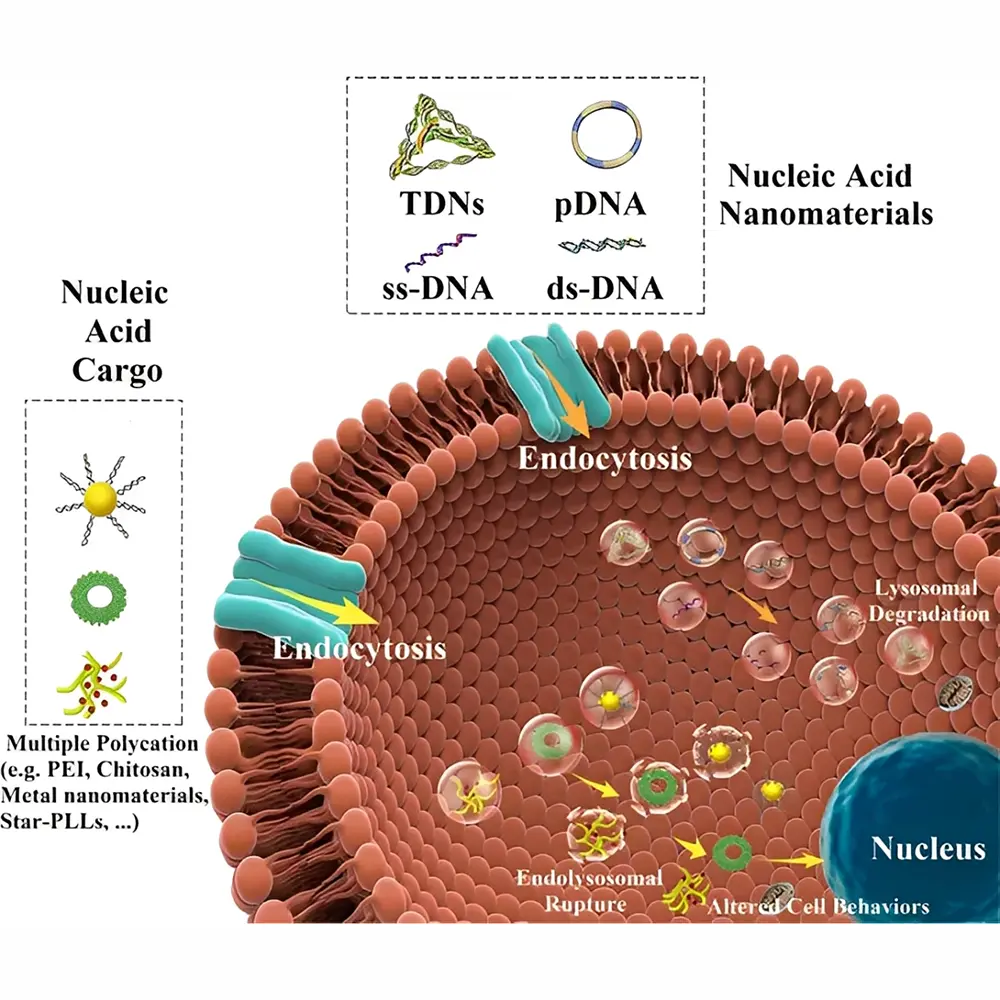
نانوذرات میتوانند از راههای مختلفی از جمله تنفس، جذب پوستی، دستگاه گوارش و تزریق مستقیم وارد بدن شوند. پس از ورود، بسته به نوع و اندازهی آنها، ممکن است در اندامهای خاصی تجمع یابند. به عنوان مثال، نانوذرات کوچکتر از ۵۰ نانومتر میتوانند از سد خونی-مغزی عبور کنند، در حالی که ذرات بزرگتر معمولاً در کبد یا طحال به دام میافتند.
توزیع نانوذرات در بدن
توزیع زیستی نانوذرات به عوامل متعددی مانند اندازه، بار سطحی، پوشش شیمیایی و مسیر ورود بستگی دارد. نانوذرات با سطح آبدوست معمولاً در خون پایدارترند، در حالیکه ذرات آبگریز تمایل به تجمع در بافتها دارند. با طراحی پوششهای زیستسازگار مانند پلیاتیلنگلایکول (PEG)، میتوان از حذف سریع نانوذرات توسط سیستم ایمنی جلوگیری کرد.
اثر نانوذرات بر سیستم ایمنی و خون
نانوذرات ممکن است واکنشهای ایمنی مختلفی را برانگیزند. برخی از نانوذرات مانند نقره و اکسید روی میتوانند سلولهای ایمنی را تحریک کرده و باعث ترشح سیتوکینها شوند، در حالی که برخی دیگر مانند نانوذرات طلا معمولاً اثر ایمنی کمتری دارند. علاوه بر این، تماس مستقیم نانوذرات با گلبولهای قرمز میتواند منجر به تغییر در شکل آنها یا ایجاد لخته شود، بنابراین طراحی نانوذرات باید با دقت و کنترل کامل انجام گیرد.
ورود نانوذرات به سلول و سمیت حاصل
نانوذرات از طریق فرآیندهای آندوسیتوز یا پینوسیتوز وارد سلول میشوند. پس از ورود، ممکن است در اندوزومها یا لیزوزومها قرار گیرند و در صورت واکنشپذیری بالا، به تخریب غشا و استرس اکسیداتیو منجر شوند. سمیت نانوذرات بهویژه در نانوذرات فلزی به دلیل تولید گونههای فعال اکسیژن (ROS) و آسیب به DNA بسیار مورد توجه است. با این حال، کنترل پوشش سطحی و اندازه، میتواند اثرات سمی را به حداقل برساند.
تأثیر نانوذرات بر سلولهای سرطانی
نانوذرات، ابزارهای کلیدی در درمان هدفمند سرطان محسوب میشوند. با اتصال آنتیبادیها یا لیگاندهای خاص به سطح نانوذرات، میتوان آنها را به سمت سلولهای سرطانی هدایت کرد. این روش موجب تمرکز دارو در محل تومور و کاهش عوارض جانبی درمان میشود. برخی نانوذرات حتی قابلیت گرمادهی موضعی (هایپرترمیا) دارند که باعث مرگ انتخابی سلولهای سرطانی میشود.
درس چهارم: بیوکونژوگاسیون (Bioconjugation)
بیوکونژوگاسیون به معنای اتصال کنترلشدهی مولکولهای زیستی مانند آنتیبادی، DNA، پروتئین یا آنزیم به نانوذرات است تا سامانههایی با عملکرد ترکیبی ایجاد شود. این فرایند پایهی بسیاری از فناوریهای تشخیصی و درمانی مدرن است.
نانوذرات طلا
نانوذرات طلا به دلیل پایداری شیمیایی بالا، زیستسازگاری، و امکان عملکرد سطحی متنوع، از پرکاربردترین مواد در بیوکونژوگاسیون هستند. آنها در تصویربرداری زیستی، درمان سرطان با لیزر، و سنجشهای تشخیصی مانند ELISA استفاده میشوند.
نقاط کوانتومی (Quantum Dots)
نقاط کوانتومی نیمهرساناهای نانومتری هستند که خواص نوری آنها به اندازهشان وابسته است. این نقاط، در تصویربرداری سلولی و ردیابی مولکولی فوقالعاده دقیق عمل میکنند و در مقایسه با رنگهای فلورسنت معمولی، درخشش طولانیتر و مقاومت نوری بیشتری دارند.
نانوذرات مغناطیسی
نانوذرات اکسید آهن یا کبالت، در حضور میدان مغناطیسی خارجی قابل کنترلاند. از آنها در تصویربرداری MRI، جداسازی سلولی مغناطیسی، دارورسانی هدفمند و درمان حرارتی تومورها (هایپرترمیا) استفاده میشود.
نانوذرات سیلیکا
نانوذرات سیلیکا به دلیل ساختار متخلخل خود، ظرفیت بالایی در حمل دارو دارند. این ذرات را میتوان با مولکولهای زیستی کونژوگه کرد تا دارو را تنها در محیطهای خاص مانند سلولهای سرطانی آزاد کنند.
درس پنجم: ساختارهای مبتنی بر DNA
DNA به دلیل ویژگی اتصال بازهای مکمل، مادهای هوشمند برای طراحی نانوساختارها محسوب میشود. در فناوری DNA Origami، رشتههای DNA بهصورت کنترلشده تا خورده و ساختارهای سهبعدی نظیر جعبه، لوله یا شبکههای بلوری در ابعاد نانومتری ایجاد میکنند.
کاربردهای این ساختارها از نانوحسگرها و نانوروباتهای زیستی تا ذخیرهسازی اطلاعات مولکولی و حمل داروهای حساس گسترده است.
همچنین در فناوری DNA Microarray، هزاران توالی DNA روی سطحی منظم تثبیت میشوند تا برای تشخیص بیماریهای ژنتیکی و بررسی بیان ژنها مورد استفاده قرار گیرند.
درس ششم: نانوموتورهای بیولوژیک
نانوموتورهای زیستی ماشینهای مولکولی طبیعی هستند که انرژی شیمیایی را به حرکت مکانیکی تبدیل میکنند. از نمونههای برجسته میتوان به ATP سنتاز، کینزین و میوزین اشاره کرد که در سلولهای زنده مسئول تولید انرژی و انتقال مواد هستند.
مهندسان نانو با الهام از این سازوکارهای طبیعی، در حال توسعهی نانوموتورهای مصنوعی هستند که میتوانند با میدانهای مغناطیسی یا واکنشهای شیمیایی حرکت کنند. این نانوموتورها در آینده میتوانند برای حمل دارو در بدن یا انجام واکنشهای شیمیایی هدفمند درون سلولها به کار روند.
درس هفتم: الگوهای میکرو و نانو الکترومکانیکی زیستی (NEMS و MEMS)
سیستمهای MEMS (سیستمهای میکروالکترومکانیکی) و NEMS (نانوالکترومکانیکی) ابزارهایی هستند که اجزای الکتریکی و مکانیکی را در مقیاس میکرو و نانو ترکیب میکنند. این سامانهها در تشخیص زیستی، اندازهگیری غلظت پروتئینها، تشخیص DNA و حتی پایش لحظهای سلامت کاربرد دارند.
Lab-on-a-Chip یا «آزمایشگاه روی تراشه» یکی از برجستهترین فناوریهای مبتنی بر MEMS است که امکان انجام چندین واکنش زیستی را در حجمی بسیار کوچک و با حداقل مصرف نمونه و واکنشگر فراهم میکند.
با افزودن نانوساختارهایی مانند نانولولههای کربنی، نانوذرات فلزی یا گرافن به این تراشهها، حساسیت و سرعت تشخیص چندین برابر میشود. حسگرهای زیستی مدرن اکنون میتوانند تنها چند مولکول از یک ویروس یا نشانگر زیستی را شناسایی کنند.
نتیجهگیری
نانوبیوتکنولوژی نقطهی تلاقی علم نانو و زیستشناسی مولکولی است؛ دانشی که با کنترل دقیق ماده در مقیاس اتمی، به ما امکان داده است تا طبیعت را بازآفرینی و درک کنیم. از طراحی داروهای هوشمند گرفته تا نانوروباتهای درمانگر، از حسگرهای فوقحساس تا ساختارهای DNA محور، همه و همه نشان از انقلاب علمی دارد که آیندهی پزشکی، کشاورزی، محیط زیست و حتی فناوری اطلاعات را دگرگون خواهد کرد.
با وجود تمام دستاوردها، چالشهای اخلاقی، زیستمحیطی و ایمنی نانو نیز باید جدی گرفته شوند تا این فناوری به شکلی پایدار و مسئولانه در خدمت بشر قرار گیرد.