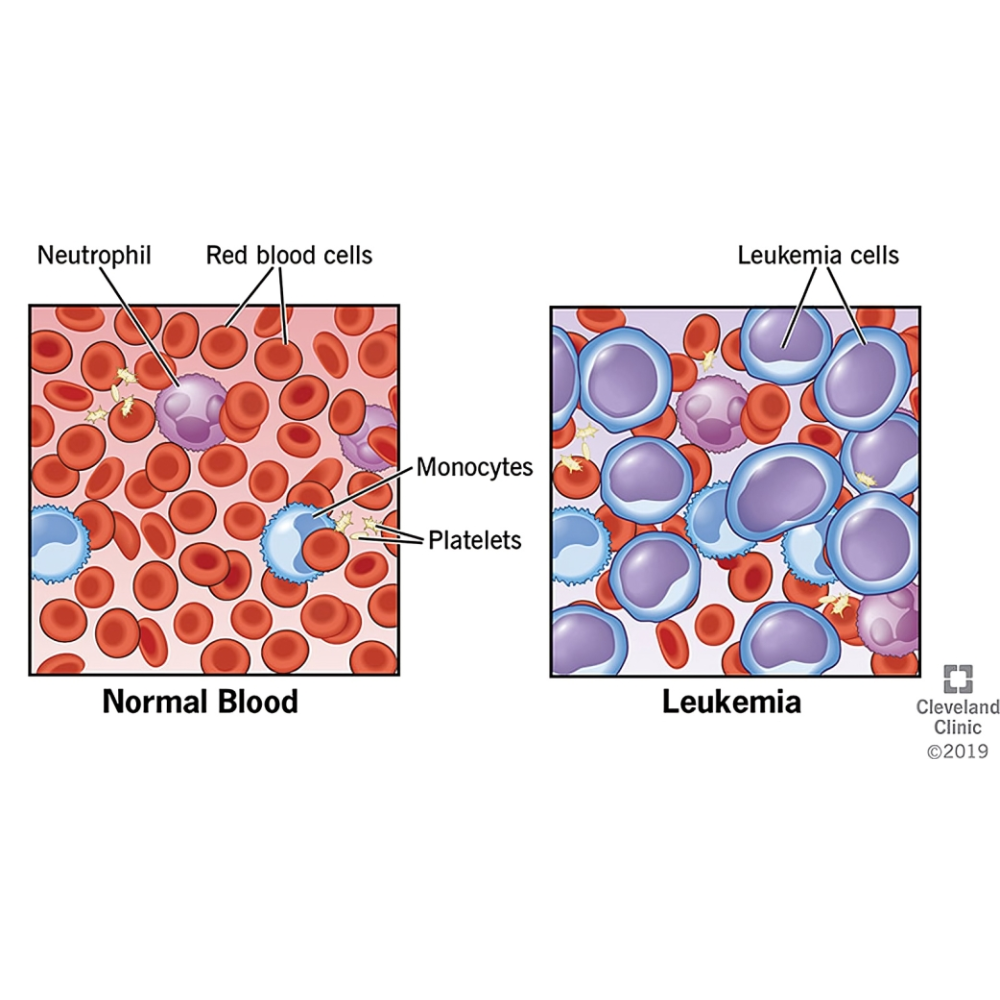
لوسمی و سایر سرطانهای خونی
مقدمه
سرطانهای خونی، از جمله لوسمی، به عنوان یکی از پیچیدهترین و چالشبرانگیزترین اختلالات پزشکی در سطح جهان شناخته میشوند. این گروه از بیماریها شامل طیف گستردهای از نئوپلازیها است که سلولهای بنیادی و بالغ خونی را تحت تأثیر قرار میدهند و میتوانند بر عملکرد طبیعی مغز استخوان، سیستم ایمنی و سایر ارگانهای بدن اثرگذار باشند. برخلاف بسیاری از سرطانهای جامد که در بافتهای مشخص شکل میگیرند، سرطانهای خونی به دلیل ماهیت سیستمیک خود، تشخیص و مدیریت پیچیدهای دارند و نیازمند رویکردهای بینرشتهای برای درمان هستند.
لوسمی، به ویژه، به عنوان یکی از شایعترین سرطانهای خونی شناخته میشود و در انواع حاد و مزمن بروز مییابد. لوسمیهای حاد، مانند لوسمی حاد لنفوبلاستیک و لوسمی حاد میلویید، با پیشرفت سریع و نیاز به درمان فوری همراه هستند، در حالی که لوسمیهای مزمن مانند لوسمی مزمن لنفوئیدی و میلومونوکلئوتیک مزمن، روند آهستهتری دارند اما با پیچیدگیهای ژنتیکی و مقاومت دارویی خاص خود شناخته میشوند. شیوع لوسمی در گروههای سنی مختلف متفاوت است و برخی انواع، به ویژه لوسمی حاد لنفوبلاستیک، در کودکان شایعتر است، در حالی که انواع مزمن معمولاً در بزرگسالان مشاهده میشوند.
از آنجا که سرطانهای خونی به طور مستقیم بر سلولهای بنیادی خون و مغز استخوان تأثیر میگذارند، تغییرات ژنتیکی، جهشهای کروموزومی و اختلالات مسیرهای سیگنالینگ سلولی نقش اساسی در آغاز و پیشرفت بیماری دارند. مطالعه و درک این مکانیسمها نه تنها برای تشخیص دقیق اهمیت دارد، بلکه پایهای برای توسعه درمانهای هدفمند و شخصیسازی شده فراهم میکند. در سالهای اخیر، پیشرفتهای علمی در زمینه ژنتیک مولکولی، اپیژنتیک و استفاده از فناوریهای نوین مانند هوش مصنوعی و یادگیری ماشین، امکانات بیسابقهای برای تشخیص زودهنگام، طبقهبندی دقیق و پیشبینی پاسخ به درمان فراهم کردهاند.
یکی از چالشهای اصلی در مدیریت سرطانهای خونی، تنوع بالای بالینی و مولکولی آنها است. بیماران با همان نوع لوسمی میتوانند پروفایل ژنتیکی، شدت بیماری و پاسخ به درمان بسیار متفاوتی داشته باشند. این موضوع باعث شده است که رویکردهای استاندارد درمانی به تنهایی کافی نباشند و نیاز به برنامههای درمانی شخصیسازی شده بر اساس ویژگیهای مولکولی، اپیژنتیک و شرایط بالینی هر بیمار احساس شود.
علاوه بر پیچیدگیهای بالینی و مولکولی، اثر روانی و اجتماعی بیماریهای خونی نیز اهمیت ویژهای دارد. بیماران مبتلا به لوسمی و سایر سرطانهای خونی نه تنها با چالشهای جسمی و اثرات جانبی درمان مواجه هستند، بلکه فشارهای روانی، اختلال در فعالیتهای روزمره و کیفیت زندگی کاهشیافته نیز بخش جداییناپذیر تجربه آنها است. بررسی این جنبهها و ارائه راهکارهای حمایتی مناسب، یکی از مؤلفههای مهم مدیریت جامع این بیماران محسوب میشود.
این مقاله تلاش دارد تا با ارائه یک مرور جامع بر لوسمی و سایر سرطانهای خونی، تمامی ابعاد بیماری را پوشش دهد. از مکانیسمهای مولکولی و ژنتیکی گرفته تا روشهای تشخیص، طبقهبندی، درمانهای نوین و چالشهای مرتبط با کیفیت زندگی بیماران، همه جوانب به صورت دقیق و علمی بررسی خواهد شد. هدف نهایی این است که متخصصان و پژوهشگران حوزه هماتولوژی، آنکولوژی و علوم پزشکی، و همچنین مخاطبان عمومی علاقهمند، بتوانند تصویری کامل از این گروه پیچیده از بیماریها به دست آورند و با دانش روز، تصمیمات بالینی و مراقبتی بهینه اتخاذ کنند.
با توجه به پیشرفتهای اخیر در زمینه درمانهای هدفمند، نانوذرات، سلولهای بنیادی و هوش مصنوعی، این مقاله همچنین چشماندازی از تحقیقات نوین و فرصتهای آینده برای بهبود پیشآگهی و کیفیت زندگی بیماران ارائه خواهد داد. بدین ترتیب، این مقاله نه تنها یک مرور علمی بلکه یک مرجع عملی و کاربردی برای متخصصان و علاقهمندان به موضوع سرطانهای خونی به شمار میرود.
آشنایی با سرطانهای خونی
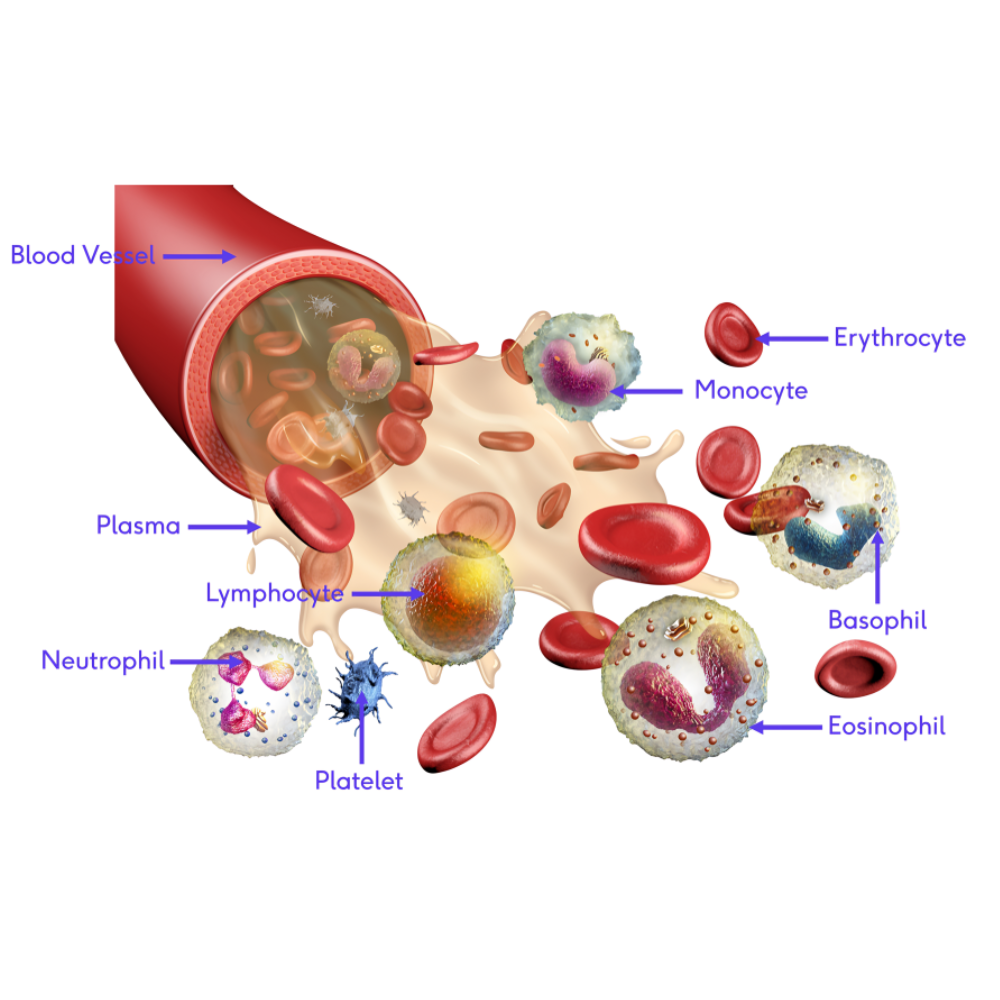
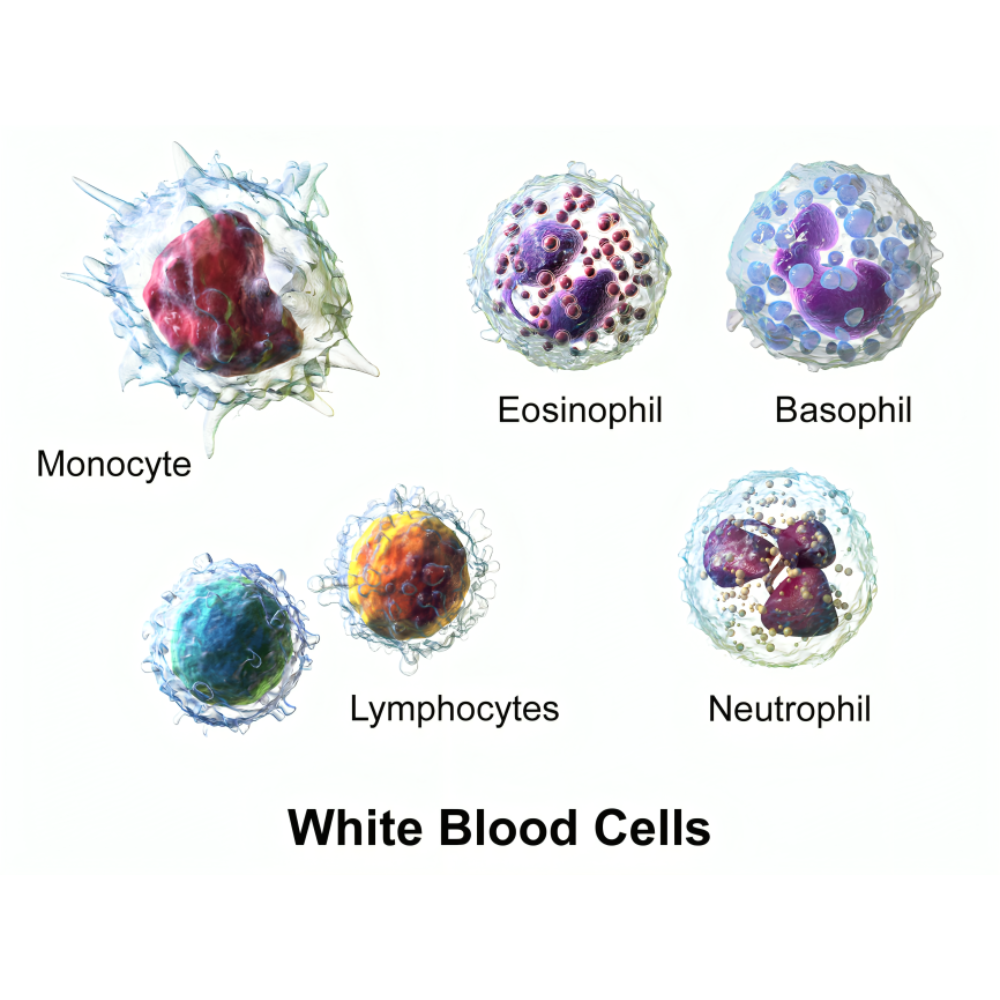
سرطانهای خونی گروهی از بیماریها هستند که سلولهای خونی و مغز استخوان را تحت تأثیر قرار میدهند و میتوانند ساختار طبیعی خون و عملکرد سیستم ایمنی را مختل کنند. برخلاف بسیاری از سرطانهای جامد که تومور مشخص و محلی ایجاد میکنند، سرطانهای خونی ماهیتی سیستمیک دارند و سلولهای غیرطبیعی میتوانند در سراسر بدن پخش شوند. این بیماریها به دلیل تأثیر مستقیم بر سلولهای بنیادی خون، توانایی تولید سلولهای قرمز، سفید و پلاکتها را مختل میکنند و در نتیجه باعث اختلالات متنوع هماتولوژیک میشوند.
لوسمی، یکی از شناختهشدهترین انواع سرطانهای خونی است که با رشد سریع و غیرکنترلشده سلولهای سفید خون در مغز استخوان و خون محیطی همراه است. این بیماری میتواند حاد یا مزمن باشد و بسته به نوع سلولهای تحت تأثیر، علائم، پیشآگهی و روش درمان آن متفاوت است. لوسمی حاد معمولاً با شروع ناگهانی علائم شدید مانند خستگی شدید، تب، خونریزیهای غیرعادی و درد استخوانی ظاهر میشود و نیاز به مداخله فوری پزشکی دارد، در حالی که لوسمی مزمن معمولاً روندی آهسته دارد و در بسیاری از موارد در مراحل اولیه بدون علامت باقی میماند.
علاوه بر لوسمی، سایر سرطانهای خونی نیز شامل لنفومها و میلومهای متعدد میشوند. لنفومها از سلولهای سیستم لنفاوی منشا میگیرند و معمولاً با بزرگ شدن غدد لنفاوی، کاهش وزن غیرقابل توضیح و تب مداوم مشخص میشوند. دو نوع اصلی لنفوم وجود دارد: لنفوم هوچکین و لنفوم غیرهوچکین، که هر یک ویژگیهای بالینی و مولکولی متفاوتی دارند و برنامه درمانی مختص خود را نیاز دارند. میلومهای متعدد، نوعی سرطان سلولهای پلاسما هستند که با تولید غیرطبیعی آنتیبادیها و آسیب به استخوانها و کلیهها همراه هستند و مدیریت آنها نیازمند مراقبت طولانیمدت و ترکیبی از درمانهای دارویی و حمایتی است.
مغز استخوان به عنوان کارخانه تولید سلولهای خونی، نقش حیاتی در ایجاد و پیشرفت سرطانهای خونی ایفا میکند. سلولهای بنیادی مغز استخوان که معمولاً مسئول تولید سلولهای قرمز، سفید و پلاکتها هستند، در صورت بروز جهشهای ژنتیکی یا اختلال در مسیرهای سیگنالینگ سلولی، میتوانند به سلولهای سرطانی تبدیل شوند. این سلولهای غیرطبیعی با سرعت بیشتری تقسیم میشوند و جایگزین سلولهای سالم میشوند، که منجر به کمخونی، کاهش مقاومت ایمنی و اختلال در انعقاد خون میشود.
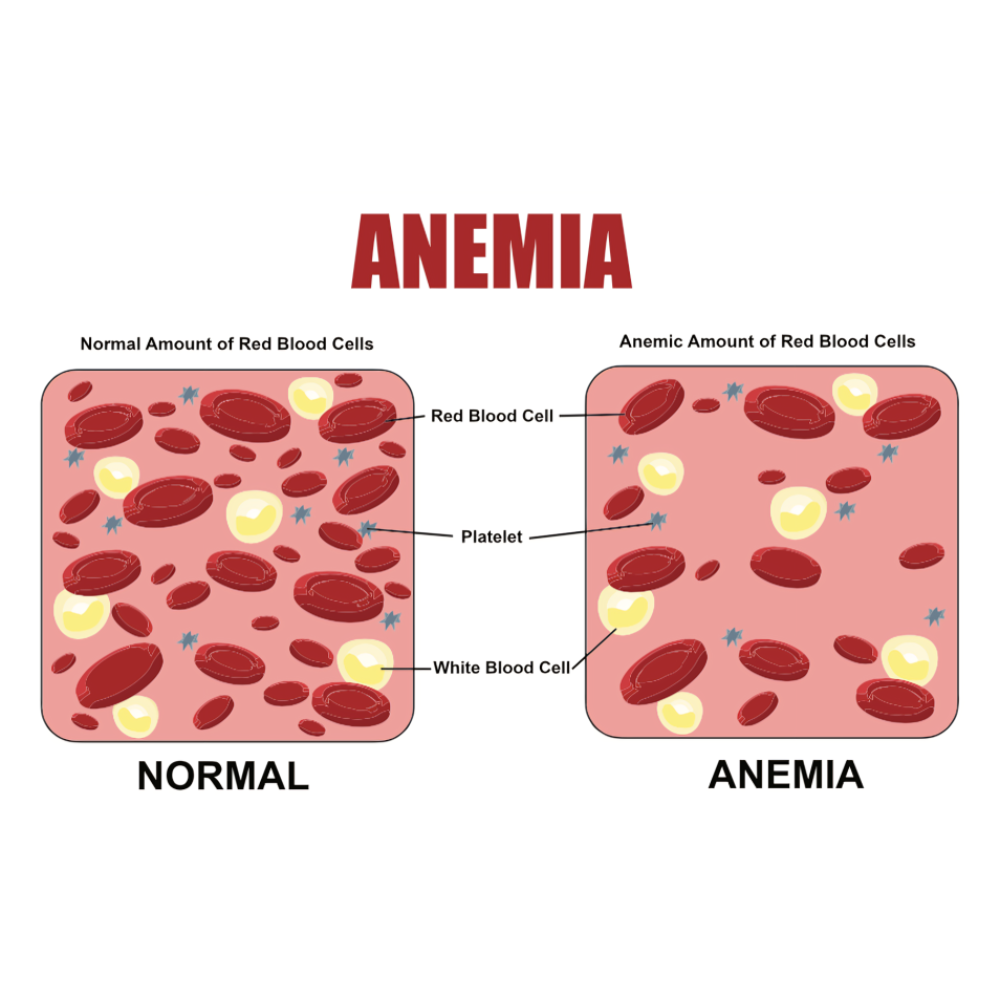
از جنبه بالینی، سرطانهای خونی علائم متنوعی دارند که بسته به نوع و شدت بیماری متفاوت است. کمخونی ناشی از کاهش تولید گلبولهای قرمز باعث خستگی مزمن، ضعف و تنگی نفس میشود. ترومبوسیتوپنی یا کاهش پلاکتها میتواند منجر به خونریزیهای غیرطبیعی، کبودیهای گسترده و خونریزیهای داخلی شود. نوتروپنی یا کاهش گلبولهای سفید، بیماران را مستعد عفونتهای مکرر و شدید میکند. ترکیب این علائم در کنار تب مداوم، کاهش وزن، درد استخوانی و تورم غدد لنفاوی، میتواند نشانههای هشداردهنده اولیه سرطانهای خونی باشد.
از نظر اپیدمیولوژی، سرطانهای خونی در سراسر جهان شایع هستند و شیوع آنها در گروههای سنی مختلف متفاوت است. برخی انواع، مانند لوسمی حاد لنفوبلاستیک، بیشتر در کودکان مشاهده میشوند، در حالی که لوسمیهای مزمن و میلومهای متعدد معمولاً در بزرگسالان و سالمندان شایعتر هستند. تحقیقات نشان دادهاند که عوامل ژنتیکی، محیطی و سبک زندگی در بروز این بیماریها نقش مهمی دارند و شناخت این عوامل میتواند به پیشگیری و تشخیص زودهنگام کمک کند.
یکی از نکات حیاتی در درک سرطانهای خونی، ماهیت سیستمیک و تنوع مولکولی آنها است. هر نوع سرطان خونی ممکن است دارای جهشهای ژنتیکی، اختلالات اپیژنتیک و مسیرهای سیگنالینگ متنوع باشد که بر شدت بیماری، پاسخ به درمان و پیشآگهی اثرگذارند. به همین دلیل، مدیریت این بیماریها نیازمند ارزیابی جامع از پروفایل مولکولی، ژنتیکی و بالینی هر بیمار است تا بتوان برنامه درمانی مناسب و شخصیسازی شده را ارائه داد.
علاوه بر جنبههای بالینی و مولکولی، اثر اجتماعی و روانی بیماران مبتلا به سرطانهای خونی نیز اهمیت ویژهای دارد. این بیماران معمولاً با چالشهای طولانیمدت درمان، فشارهای روانی ناشی از بیماری و کاهش کیفیت زندگی مواجه هستند. توجه به جنبههای حمایتی، روانی و اجتماعی، بخشی جداییناپذیر از مدیریت جامع بیماران محسوب میشود و میتواند در بهبود پیشآگهی و رضایت بیماران نقش بسزایی داشته باشد.
در نهایت، آشنایی کامل با سرطانهای خونی، شامل لوسمی، لنفوم و میلومهای متعدد، پایهای برای درک بهتر مکانیسمهای مولکولی، عوامل خطر، روشهای تشخیص و درمانهای نوین است. این شناخت، علاوه بر کمک به متخصصان در تصمیمگیریهای بالینی، میتواند به بیماران و خانوادههای آنها در درک بهتر بیماری، مدیریت علائم و ارتقای کیفیت زندگی کمک کند.
انواع لوسمی و ویژگیهای بالینی آنها
لوسمی به عنوان یکی از شایعترین و پیچیدهترین سرطانهای خونی، شامل گروهی از بیماریها است که سلولهای سفید خون را در مغز استخوان و خون محیطی تحت تأثیر قرار میدهند. این بیماریها بر اساس سرعت پیشرفت و نوع سلولهای درگیر، به انواع مختلف تقسیم میشوند که هر یک ویژگیهای بالینی، مولکولی و درمانی منحصر به فرد خود را دارند. شناخت دقیق هر نوع لوسمی برای تشخیص، برنامهریزی درمان و پیشآگهی بیمار ضروری است.
لوسمی حاد لنفوبلاستیک (ALL)
لوسمی حاد لنفوبلاستیک یکی از رایجترین انواع لوسمی در کودکان است، اما میتواند بزرگسالان را نیز درگیر کند. این نوع لوسمی ناشی از رشد غیرکنترلشده لنفوبلاستهای پیشرفته در مغز استخوان و خون محیطی است. این سلولها توانایی تمایز طبیعی به گلبولهای سفید بالغ را ندارند و به سرعت جایگزین سلولهای سالم میشوند.
علائم بالینی ALL شامل خستگی شدید، تبهای مکرر، خونریزی و کبودیهای غیرطبیعی، درد استخوان و مفصل، تورم غدد لنفاوی و کاهش اشتها است. در کودکان، شایعترین نشانهها شامل تب، ضعف، بیحالی و علائم گوارشی است، در حالی که در بزرگسالان، علائم ممکن است تدریجیتر و کمتر مشخص باشند. تشخیص دقیق ALL نیازمند بررسی شمارش کامل خون، آزمایش مغز استخوان، بررسی سیتوژنتیک و تحلیل ژنتیکی است تا زیرگروههای مولکولی مانند Philadelphia chromosome یا جهشهای ژنتیکی مهم شناسایی شوند. درمان ALL معمولاً شامل شیمیدرمانی ترکیبی، درمان هدفمند با مهارکنندههای TK و در برخی موارد پیوند سلولهای بنیادی است.
لوسمی حاد میلویید (AML)
لوسمی حاد میلویید یکی از شایعترین لوسمیهای بزرگسالان است و از سلولهای پیشساز میلوییدی منشا میگیرد. این نوع لوسمی با تکثیر سریع سلولهای میلوییدی نابالغ در مغز استخوان مشخص میشود که منجر به کاهش تولید سلولهای خونی سالم و ایجاد کمخونی، ترومبوسیتوپنی و نوتروپنی میشود.
نشانههای AML شامل خستگی، ضعف، تب، خونریزی، عفونتهای مکرر، درد استخوان و بزرگشدن طحال یا کبد است. از نظر مولکولی، AML دارای تنوع بالایی است و جهشهایی در ژنهایی مانند FLT3، NPM1 و IDH1/IDH2 میتوانند مسیر درمان و پیشآگهی را تعیین کنند. درمان AML معمولاً شامل شیمیدرمانی استاندارد، درمان هدفمند با مهارکنندههای FLT3 یا IDH و در صورت لزوم پیوند مغز استخوان است. تحقیقات اخیر نشان دادهاند که ترکیب درمانهای هدفمند و شیمیدرمانی میتواند نرخ بهبودی و پیشآگهی بیماران را بهبود دهد.
لوسمی مزمن لنفوئیدی (CLL)
CLL نوعی لوسمی مزمن است که بیشتر بزرگسالان مسن را درگیر میکند و از رشد غیرطبیعی لنفوسیتهای B بالغ نشأت میگیرد. این نوع لوسمی معمولاً با روند آهسته و بدون علامت در مراحل اولیه پیشرفت میکند و بسیاری از بیماران برای سالها نیاز به درمان فوری ندارند.
علائم بالینی CLL شامل تورم غدد لنفاوی، خستگی مزمن، کاهش وزن، عفونتهای مکرر و کبودیهای غیرطبیعی است. در CLL، تنوع ژنتیکی و اپیژنتیک قابل توجه است و جهشهایی در ژنهایی مانند TP53 و IGHV میتوانند پیشآگهی و پاسخ به درمان را تحت تأثیر قرار دهند. درمان CLL ممکن است شامل نظارت فعال در مراحل اولیه، شیمیدرمانی، درمان هدفمند با مهارکنندههای BCR یا داروهای ایمنوتراپی باشد.
لوسمی میلومونوکلئوتیک مزمن (CMML)
CMML نوعی لوسمی است که ویژگیهای هر دو لوسمی مزمن و میلودیسپلاستیک را دارد و از سلولهای پیشساز میلومونوکلئوتیک منشا میگیرد. این نوع لوسمی عمدتاً در بزرگسالان میانسال و مسن مشاهده میشود و با تکثیر ناقص و غیرطبیعی گلبولهای سفید و اختلال در تولید سلولهای خونی سالم مشخص میشود.
علائم بالینی CMML شامل خستگی، تب، کاهش وزن، بزرگشدن طحال و کبودیها است. از نظر مولکولی، CMML دارای ناهنجاریهای کروموزومی و جهشهای ژنتیکی متنوع است که بر پیشآگهی و انتخاب درمان تأثیر میگذارند. درمان CMML معمولاً شامل داروهای کاهشدهنده گلبولهای سفید، شیمیدرمانی در صورت لزوم و پیوند سلولهای بنیادی در موارد پیشرفته است.
ویژگیهای مشترک بالینی لوسمیها
با وجود تفاوتهای نوعی، اکثر لوسمیها ویژگیهای بالینی مشترکی دارند که ناشی از تأثیر آنها بر مغز استخوان و سیستم ایمنی است. این ویژگیها شامل کمخونی، نوتروپنی، ترومبوسیتوپنی، تب، خونریزی، کبودی و درد استخوانی است. علاوه بر این، برخی لوسمیها با بزرگشدن غدد لنفاوی، طحال و کبد همراه هستند و در بعضی موارد علائم عصبی یا گوارشی نیز مشاهده میشود. تشخیص دقیق هر نوع لوسمی نیازمند ارزیابی جامع بالینی، آزمایشگاهی و مولکولی است تا برنامه درمانی متناسب با ویژگیهای فردی بیمار طراحی شود.
شناخت دقیق انواع لوسمی و ویژگیهای بالینی آنها نه تنها به تشخیص زودهنگام و انتخاب درمان مناسب کمک میکند، بلکه امکان پیشبینی پاسخ به درمان، مدیریت عوارض و ارتقای کیفیت زندگی بیماران را فراهم میآورد. درک تفاوتهای حاد و مزمن، تنوع ژنتیکی و مولکولی، و علائم بالینی هر نوع لوسمی، پایهای است برای توسعه درمانهای هدفمند و شخصیسازی شده که بتوانند نرخ بهبودی و پیشآگهی بیماران را به طور قابل توجهی بهبود دهند.
علل و عوامل خطر
لوسمی و سایر سرطانهای خونی، همانند بسیاری از نئوپلازیها، نتیجه تعامل پیچیده بین عوامل ژنتیکی، محیطی و ایمنی هستند. درک دقیق این عوامل خطر نه تنها برای تشخیص زودهنگام اهمیت دارد، بلکه راهنمایی برای پیشگیری و انتخاب استراتژیهای درمانی هدفمند فراهم میکند. علل این بیماریها اغلب چند عاملی هستند و هیچ یک به تنهایی نمیتواند عامل قطعی بروز لوسمی محسوب شود، بلکه ترکیب این عوامل خطر، زمینه را برای ایجاد جهشها و رشد سلولهای سرطانی فراهم میآورد.
عوامل ژنتیکی و کروموزومی
یکی از مهمترین عوامل خطر در بروز لوسمی، اختلالات ژنتیکی و کروموزومی است. برخی افراد به دلیل جهشهای ارثی در ژنهایی که تقسیم سلولی و مرگ سلولی برنامهریزی شده را کنترل میکنند، حساسیت بیشتری به لوسمی دارند. جهشهای ژنهای کلیدی مانند TP53، FLT3، NPM1، IDH1 و IDH2 میتوانند باعث اختلال در مسیرهای سیگنالینگ سلولی شوند و تکثیر سلولهای غیرطبیعی را تسهیل کنند. علاوه بر این، ناهنجاریهای کروموزومی مانند Philadelphia chromosome در لوسمی حاد لنفوبلاستیک، نقش تعیینکنندهای در شروع و پیشرفت بیماری دارند و میتوانند پاسخ به درمان و پیشآگهی بیمار را تحت تأثیر قرار دهند.
در برخی لوسمیهای مزمن مانند CLL و CMML، تنوع ژنتیکی و اپیژنتیک قابل توجه است و جهشهای خاص میتوانند روند بیماری را تسریع کرده و مقاومت دارویی ایجاد کنند. مطالعات نشان دادهاند که افرادی با سابقه خانوادگی لوسمی یا سایر نئوپلازیهای خونی در معرض خطر بالاتری هستند و بررسی ژنتیکی در این بیماران میتواند به پیشبینی ریسک و تصمیمگیری درمانی کمک کند.
عوامل محیطی و شغلی
عوامل محیطی نقش مهمی در بروز لوسمی و سایر سرطانهای خونی دارند. تماس طولانیمدت با مواد شیمیایی سمی مانند بنزن، برخی حلالها، آفتکشها و مواد شیمیایی صنعتی میتواند ریسک ابتلا به لوسمی را افزایش دهد. مطالعات اپیدمیولوژیک نشان دادهاند که کارگران صنایع پتروشیمی، رنگسازی، کشاورزی و آزمایشگاههای شیمیایی در معرض خطر بالاتری قرار دارند.
علاوه بر مواد شیمیایی، اشعههای یونیزان نیز به عنوان یک عامل خطر شناخته شدهاند. افرادی که در معرض تابش شدید پرتوهای پزشکی یا محیطی قرار گرفتهاند، مانند تکنسینهای رادیولوژی، پرسنل هستهای یا افرادی که در نزدیکی منابع رادیواکتیو زندگی میکنند، در معرض افزایش احتمال بروز لوسمی هستند.
عوامل عفونی و ایمنی
سیستم ایمنی نقش حیاتی در کنترل رشد سلولهای غیرطبیعی دارد و اختلال در عملکرد ایمنی میتواند زمینه را برای بروز سرطانهای خونی فراهم کند. برخی عفونتها، به ویژه ویروسها، میتوانند به طور مستقیم یا غیرمستقیم موجب تغییرات ژنتیکی و تحریک تکثیر سلولی شوند. برای مثال، ویروسهای HTLV-1 و EBV در برخی انواع لوسمی و لنفوم نقش دارند.
علاوه بر عفونتها، بیماریهای نقص ایمنی و استفاده طولانیمدت از داروهای سرکوبکننده سیستم ایمنی نیز میتوانند ریسک ابتلا به لوسمی و سایر سرطانهای خونی را افزایش دهند. بیماران مبتلا به بیماریهای خودایمنی، پیوند عضو یا شرایطی که سیستم ایمنی آنها تضعیف شده است، نیازمند پایش دقیق و اقدامات پیشگیرانه هستند.
عوامل سبک زندگی و تغذیه
سبک زندگی نیز میتواند به عنوان یک عامل خطر محیطی مهم در بروز سرطانهای خونی مطرح شود. مصرف بیش از حد الکل، سیگار کشیدن، و رژیم غذایی ضعیف از نظر مواد مغذی ضروری، میتواند به آسیب DNA و اختلال در عملکرد سلولهای خونی کمک کند. برخی تحقیقات نشان دادهاند که کمبود آهن و اختلال در متابولیسم فلزات نیز میتواند مسیرهای سیگنالینگ سلولی را مختل کرده و ریسک لوسمی را افزایش دهد.
تداخل عوامل خطر و پیشرفت بیماری
در اغلب موارد، بروز لوسمی ناشی از تداخل چندین عامل خطر است. ترکیب زمینه ژنتیکی حساس با قرارگیری در معرض مواد شیمیایی، اشعه، اختلال ایمنی یا عوامل سبک زندگی میتواند مسیر پیشرفت بیماری را تسریع کند. به همین دلیل، درک این تعاملات و بررسی جامع عوامل خطر در هر بیمار، بخش جداییناپذیر پیشگیری و مدیریت این بیماریها است.
اهمیت تشخیص زودهنگام عوامل خطر
شناخت دقیق عوامل خطر نه تنها برای پیشگیری از لوسمی و سایر سرطانهای خونی اهمیت دارد، بلکه به پزشکان کمک میکند تا برنامههای پایش منظم و غربالگری هدفمند برای افراد در معرض خطر طراحی کنند. به عنوان مثال، افراد با سابقه خانوادگی لوسمی، مواجهه شغلی با مواد شیمیایی یا اختلالات ایمنی، باید تحت بررسیهای دورهای خون و مشاوره ژنتیک قرار گیرند تا بیماری در مراحل اولیه شناسایی و درمان شود.
در مجموع، علل و عوامل خطر لوسمی و سایر سرطانهای خونی یک شبکه پیچیده و چندعاملی هستند که شامل ژنتیک، اختلالات کروموزومی، عوامل محیطی، عفونتها، اختلالات ایمنی و سبک زندگی میشوند. درک این عوامل، علاوه بر کمک به پیشگیری، پایهای برای طراحی درمانهای هدفمند و شخصیسازی شده فراهم میکند و نقش مهمی در بهبود پیشآگهی و کیفیت زندگی بیماران دارد.
مکانیزمهای مولکولی و ژنتیکی
لوسمی و سایر سرطانهای خونی، نمونهای برجسته از بیماریهای مولتیفاکتوریال هستند که در آنها اختلالات مولکولی و ژنتیکی نقش محوری در آغاز، پیشرفت و پاسخ به درمان دارند. این اختلالات میتوانند در سطح DNA، RNA، پروتئینها و مسیرهای سیگنالینگ سلولی رخ دهند و منجر به رشد غیرقابل کنترل سلولها، اختلال در تمایز و مقاومت دارویی شوند. درک عمیق این مکانیزمها نه تنها به تشخیص و طبقهبندی دقیق کمک میکند، بلکه اساس توسعه درمانهای هدفمند و شخصیسازی شده را تشکیل میدهد.
مسیرهای سیگنالینگ سلولی در لوسمی
یکی از اجزای کلیدی مکانیزمهای مولکولی، اختلال در مسیرهای سیگنالینگ سلولی است که تقسیم، تمایز و مرگ برنامهریزی شده سلولها را کنترل میکنند. مسیر PI3K/Akt/mTOR به عنوان یکی از مهمترین مسیرهای سیگنالینگ در سلولهای لوسمی شناخته میشود و با تحریک تکثیر سلولی و مهار آپوپتوز، رشد سلولهای سرطانی را تسهیل میکند. فعالسازی غیرطبیعی این مسیر در انواع مختلف لوسمی، به ویژه AML و CLL، مشاهده شده و میتواند مقاومت به شیمیدرمانی ایجاد کند.
مسیرهای دیگر شامل Ras/MAPK، JAK/STAT و Notch هستند که هر یک در کنترل تقسیم سلولی، بقای سلول و تمایز نقش دارند. اختلال در این مسیرها باعث میشود سلولهای خونی نابالغ به طور مداوم تکثیر شده و جایگزین سلولهای سالم شوند. همچنین، این اختلالات مسیرهای پاسخ ایمنی را مختل میکنند و توانایی بدن در مقابله با سلولهای سرطانی را کاهش میدهند.
جهشهای ژنتیکی و کروموزومی
لوسمی با مجموعهای از جهشهای ژنتیکی و ناهنجاریهای کروموزومی همراه است که اساس شروع و پیشرفت بیماری را تشکیل میدهند. جهشهای ژنهایی مانند FLT3، NPM1، IDH1، IDH2 و TP53 میتوانند مسیرهای سیگنالینگ حیاتی را مختل کرده و تقسیم سلولی غیرکنترلشده را تسهیل کنند. به عنوان مثال، جهشهای FLT3 در AML باعث فعالسازی مداوم گیرندههای تیروزین کیناز شده و رشد سلولهای میلوییدی را افزایش میدهند.
ناهنجاریهای کروموزومی نیز نقش مهمی در لوسمی دارند. Philadelphia chromosome که ناشی از جابجایی بین کروموزومهای ۹ و ۲۲ است، در لوسمی حاد لنفوبلاستیک و CML مشاهده میشود و تولید پروتئینی فعال به نام BCR-ABL را موجب میشود که مسیرهای سیگنالینگ رشد سلولی را دائماً تحریک میکند. سایر ناهنجاریها مانند حذف کروموزوم 5 یا 7 و پیچیدگیهای ساختاری، در انواع مزمن لوسمی و CMML شایع هستند و بر پیشآگهی و پاسخ به درمان تأثیر دارند.
نقش RNA غیرکدکننده
در سالهای اخیر، RNA غیرکدکننده شامل miRNAها و lncRNAها به عنوان تنظیمکنندههای مهم رشد و پیشرفت سلولهای لوسمی شناخته شدهاند. این RNAها میتوانند بیان ژنهای سرکوبکننده تومور یا پروتوموتور را تنظیم کنند و در نتیجه مقاومت به دارو و متاستاز را تسهیل کنند. برای مثال، افزایش بیان برخی miRNAها میتواند مسیر PI3K/Akt را فعال نگه دارد و بقای سلولهای لوسمی را تضمین کند. تحقیقات جدید نشان دادهاند که شبکههای پیچیده RNA غیرکدکننده، بهعنوان اهداف درمانی بالقوه برای کاهش مقاومت دارویی و توقف پیشرفت بیماری مورد توجه قرار دارند.
تعامل سلولهای لوسمی با میکرومحیط مغز استخوان
سلولهای لوسمی نه تنها مستقل عمل میکنند، بلکه با میکرومحیط مغز استخوان تعامل دارند و از این محیط برای بقای خود استفاده میکنند. سلولهای لوسمی با ترشح سیتوکینها و فاکتورهای رشد، محیط مغز استخوان را برای تکثیر خود مساعد میکنند و همزمان سلولهای سالم را سرکوب میکنند. این تعامل باعث مقاومت به شیمیدرمانی و درمان هدفمند میشود و یکی از چالشهای اصلی در مدیریت بیماریهای خونی است.
تفاوتهای مولکولی بین لوسمیهای حاد و مزمن
لوسمیهای حاد، مانند AML و ALL، اغلب با جهشهای تک مرحلهای و فعالسازی مسیرهای تقسیم سریع مشخص میشوند که منجر به شروع ناگهانی علائم و پیشرفت سریع بیماری میشود. در مقابل، لوسمیهای مزمن مانند CLL و CMML معمولاً با اختلالات تدریجی و چندمرحلهای ژنتیکی و اپیژنتیک همراه هستند که رشد آهسته و طولانیمدت سلولهای سرطانی را ایجاد میکند. این تفاوتها نه تنها در تشخیص، بلکه در انتخاب استراتژی درمانی و پیشآگهی بیماران نقش مهمی دارند.
پیشرفتهای تحقیقاتی و درمانهای مولکولی هدفمند
درک عمیق از مکانیزمهای مولکولی، پایه توسعه درمانهای هدفمند و شخصیسازی شده را فراهم کرده است. برای مثال، مهارکنندههای FLT3 و IDH در AML، مهارکنندههای BCR-ABL در لوسمیهای Philadelphia مثبت و مهار مسیرهای PI3K/Akt/mTOR در انواع مختلف لوسمی، نشاندهنده موفقیت رویکردهای درمانی مبتنی بر مکانیزم مولکولی هستند. این درمانها نه تنها رشد سلولهای سرطانی را مهار میکنند، بلکه عوارض جانبی سیستمیک شیمیدرمانی سنتی را کاهش میدهند.
جمعبندی مکانیزمهای مولکولی
به طور کلی، مکانیزمهای مولکولی و ژنتیکی لوسمی شامل اختلال در مسیرهای سیگنالینگ، جهشهای ژنتیکی و کروموزومی، نقش RNA غیرکدکننده و تعامل با میکرومحیط مغز استخوان است. این اختلالات باعث رشد غیرقابل کنترل سلولها، مقاومت دارویی و پیشرفت سریع بیماری میشوند. درک این مکانیزمها، پایهای برای تشخیص دقیق، طبقهبندی مولکولی، طراحی درمانهای هدفمند و شخصیسازی شده و بهبود پیشآگهی بیماران فراهم میکند.
تشخیص و طبقهبندی
تشخیص دقیق و طبقهبندی صحیح لوسمی و سایر سرطانهای خونی، پایهای حیاتی برای انتخاب درمان مناسب و پیشبینی پیشآگهی بیمار است. این فرآیند ترکیبی از معاینات بالینی، آزمایشهای آزمایشگاهی، تحلیل ژنتیکی و تصویربرداری است و در سالهای اخیر با پیشرفت فناوریهای مولکولی و هوش مصنوعی به سطحی بسیار دقیقتر و شخصیسازی شده رسیده است.
معاینات بالینی و تاریخچه پزشکی
اولین گام در تشخیص لوسمی، جمعآوری تاریخچه پزشکی کامل و انجام معاینات بالینی دقیق است. پزشک به بررسی علائم عمومی مانند خستگی، تب، خونریزی غیرطبیعی، کبودی، درد استخوان، تورم غدد لنفاوی، بزرگی طحال و کبد میپردازد. همچنین سابقه خانوادگی، مواجهه شغلی با مواد شیمیایی، سابقه بیماریهای نقص ایمنی و درمانهای قبلی سرطان باید مورد توجه قرار گیرد. این مرحله پایهای برای تصمیمگیری در مورد آزمایشهای تکمیلی و تعیین شدت و نوع بیماری است.
آزمایشهای خونی و مغز استخوان
تشخیص لوسمی نیازمند بررسیهای دقیق آزمایشگاهی است. شمارش کامل خون (CBC) اولین و سادهترین آزمایش است که میتواند کاهش یا افزایش سلولهای خونی، کمخونی، نوتروپنی و ترومبوسیتوپنی را نشان دهد. معاینه اسمیر خون محیطی نیز به تشخیص وجود سلولهای نابالغ یا غیرطبیعی کمک میکند و در تمایز بین انواع لوسمی حیاتی است.
بیوپسی مغز استخوان و آسپیراسیون از اصلیترین ابزارهای تشخیص هستند. این روشها امکان بررسی چگالی سلولی، نوع سلولهای سرطانی، میزان تکثیر و حضور جهشهای کروموزومی را فراهم میکنند. تحلیل مغز استخوان معمولاً با رنگآمیزیهای خاص و تکنیکهای ایمونوفنوتیپ انجام میشود تا نوع دقیق سلولهای لوسمی مشخص شود.
تشخیص مولکولی و ژنتیکی
در دهههای اخیر، تکنیکهای مولکولی و ژنتیکی نقش کلیدی در تشخیص و طبقهبندی لوسمی پیدا کردهاند. بررسی جهشهای ژنی مانند FLT3، NPM1، IDH1، IDH2 و TP53 به پزشکان کمک میکند تا زیرگروههای بیماری را مشخص کنند و درمان هدفمند انتخاب شود. علاوه بر جهشها، ناهنجاریهای کروموزومی مانند Philadelphia chromosome و سایر تغییرات ساختاری نیز به عنوان شاخصهای تشخیصی و پیشآگهی اهمیت دارند.
ایمونوفنوتیپ و فلوسیتومتری
فلوسیتومتری یک روش حیاتی برای تشخیص لوسمی است که به شناسایی پروتئینهای سطحی و داخلی سلولها میپردازد و امکان تمایز بین انواع لوسمی حاد و مزمن را فراهم میکند. این روش با استفاده از آنتیبادیهای فلورسنت، جمعیت سلولی و زیرگروههای لنفوسیتی یا میلوییدی را مشخص میکند و در طبقهبندی دقیق بیماری و پیشبینی پاسخ به درمان نقش دارد.
تصویربرداری و ارزیابی سیستمیک
اگرچه لوسمی عمدتاً یک بیماری سیستمیک خون است، اما گاهی نیاز به تصویربرداری برای بررسی بزرگی طحال و کبد یا درگیری مغز و نخاع وجود دارد. تکنیکهای متداول شامل سونوگرافی، CT scan و MRI هستند که اطلاعات اضافی درباره میزان درگیری ارگانها و بافتهای محیطی فراهم میکنند.
نقش هوش مصنوعی و یادگیری ماشین در تشخیص
در سالهای اخیر، استفاده از هوش مصنوعی و یادگیری ماشین برای تحلیل تصاویر اسمیر خون و نمونههای مغز استخوان، تشخیص لوسمی را سریعتر و دقیقتر کرده است. الگوریتمهای پیشرفته قادر به شناسایی سلولهای نابالغ، طبقهبندی انواع لوسمی و حتی پیشبینی پاسخ به درمان هستند. این فناوریها به ویژه در مراکز پیشرفته و پژوهشی به کار گرفته شده و پتانسیل بالایی برای بهبود تشخیص زودهنگام دارند.
طبقهبندی بر اساس سرعت پیشرفت و نوع سلولها
لوسمیها معمولاً بر اساس سرعت پیشرفت (حاد یا مزمن) و نوع سلولهای درگیر (لنفوبلاستیک یا میلوییدی) طبقهبندی میشوند:
- لوسمی حاد لنفوبلاستیک :(ALL) رشد سریع لنفوبلاستها، شایع در کودکان.
- لوسمی حاد میلویید :(AML) رشد سریع سلولهای میلوییدی نابالغ، بیشتر در بزرگسالان.
- لوسمی مزمن لنفوئیدی :(CLL) رشد آهسته لنفوسیتهای B، معمولاً در بزرگسالان مسن.
- لوسمی میلومونوکلئوتیک مزمن :(CMML) ویژگیهای مشترک لوسمی مزمن و میلودیسپلاستیک، رشد تدریجی سلولهای میلومونوکلئوتیک.
این طبقهبندی به پزشکان کمک میکند تا استراتژی درمانی مناسب، پیشآگهی و نیاز به پیوند سلولهای بنیادی را تعیین کنند.
اهمیت طبقهبندی مولکولی و ژنتیکی
فراتر از طبقهبندی سنتی، طبقهبندی بر اساس پروفایل مولکولی و ژنتیکی، دقت تشخیص و انتخاب درمان را افزایش میدهد. برخی جهشها یا ناهنجاریها میتوانند پاسخ به داروهای هدفمند، احتمال عود بیماری و پیشآگهی طول عمر را تعیین کنند. این رویکرد باعث شده است که لوسمی از یک بیماری یکسان به مجموعهای از زیرگروههای بالینی و مولکولی با استراتژیهای درمانی اختصاصی تبدیل شود.
جمعبندی تشخیص و طبقهبندی
تشخیص و طبقهبندی لوسمی و سایر سرطانهای خونی فرآیندی چندمرحلهای و چندبعدی است که شامل معاینات بالینی، آزمایشهای خونی و مغز استخوان، تحلیل ژنتیکی و مولکولی، فلوسیتومتری، تصویربرداری و ابزارهای هوش مصنوعی میشود. این فرآیند دقیق و جامع، پایهای برای تصمیمگیری درمانی، پیشبینی پیشآگهی و مدیریت بیمار فراهم میکند و امکان شخصیسازی درمان بر اساس ویژگیهای مولکولی و بالینی بیمار را فراهم میآورد.
درمانهای رایج و نوین
مدیریت لوسمی و سایر سرطانهای خونی در سالهای اخیر به شدت تحول یافته است و درمانها از رویکردهای سنتی شیمیدرمانی به سمت استراتژیهای هدفمند، ایمنوتراپی و شخصیسازی درمان بر اساس ویژگیهای مولکولی حرکت کردهاند. انتخاب روش درمانی به نوع لوسمی، مرحله بیماری، وضعیت بالینی بیمار، پروفایل ژنتیکی و میزان پاسخ به درمانهای قبلی بستگی دارد.
شیمیدرمانی کلاسیک
شیمیدرمانی هنوز یکی از ستونهای اصلی درمان لوسمی است. این روش با استفاده از داروهای سیتوتوکسیک، تقسیم سلولهای سرطانی را مهار کرده و سلولهای نابالغ را از بین میبرد. در AML و ALL، ترکیب چند دارو با دوزهای کنترلشده به نام regimens چندعاملی استفاده میشود تا اثربخشی افزایش یابد و مقاومت دارویی کاهش پیدا کند. شیمیدرمانی معمولاً شامل دو فاز اصلی درمان القایی و درمان نگهدارنده است:
- فاز القایی: هدف از این مرحله، حذف بیشترین تعداد سلولهای لوسمی و دستیابی به بهبود کامل هماتوژیک است.
- فاز نگهدارنده: این مرحله برای جلوگیری از عود بیماری طراحی شده و شامل دوزهای پایینتر داروها و پیگیری طولانیمدت است.
علیرغم موفقیت شیمیدرمانی در کاهش بار سلولی، عوارض جانبی سیستمیک مانند کمخونی، نوتروپنی، افزایش ریسک عفونت و آسیب اندامها از چالشهای مهم آن محسوب میشوند.
درمان هدفمند مولکولی
با پیشرفت در فهم مکانیزمهای مولکولی لوسمی، داروهای هدفمند به یکی از ستونهای درمان تبدیل شدهاند. این داروها مسیرهای سیگنالینگ خاص سلولهای سرطانی را مهار میکنند و عوارض سیستمیک شیمیدرمانی سنتی را کاهش میدهند. از جمله مهمترین داروهای هدفمند میتوان به موارد زیر اشاره کرد:
- مهارکنندههای FLT3 در :AML این داروها جهشهای FLT3 را هدف قرار داده و تکثیر سلولهای میلوییدی را مهار میکنند.
- مهارکنندههای IDH1 و :IDH2 برای بیماران مبتلا به AML با جهشهای IDH1/2 کاربرد دارند و مسیر متابولیک سلولهای سرطانی را مختل میکنند.
- مهارکنندههای BCR-ABL در لوسمی Philadelphia مثبت: داروهایی مانند ایماتینیب، نیلوتینیب و دازاتینیب مسیر BCR-ABL را مسدود کرده و رشد سلولهای سرطانی را متوقف میکنند.
- مهار مسیر :PI3K/Akt/mTOR استفاده از این داروها در برخی لوسمیها باعث کاهش تکثیر سلولها و افزایش حساسیت به شیمیدرمانی میشود.
ایمونوتراپی و سلولهای CAR-T
ایمونوتراپی یک تحول بنیادین در درمان لوسمی محسوب میشود و شامل فعالسازی سیستم ایمنی بیمار برای شناسایی و تخریب سلولهای سرطانی است. یکی از موفقترین رویکردها، سلولهای CAR-T است که سلولهای T بیمار مهندسی میشوند تا گیرندههای اختصاصی سلولهای لوسمی را شناسایی کنند. این روش به ویژه در ALL مقاوم یا عودکننده کاربرد دارد و نتایج بالینی امیدوارکنندهای نشان داده است.
علاوه بر CAR-T، مهارکنندههای ایمنی (Immune Checkpoint Inhibitors) نیز در مراحل تحقیق و درمان برخی سرطانهای خونی استفاده میشوند تا پاسخ ایمنی علیه سلولهای لوسمی تقویت شود. این داروها با مهار مسیرهای سرکوب ایمنی، توانایی بدن در مقابله با سلولهای سرطانی را افزایش میدهند.
پیوند سلولهای بنیادی
برای لوسمیهای مقاوم یا پیشرفته، پیوند سلولهای بنیادی هماتوپوئیتیک (HSCT) یک گزینه درمانی حیاتی است. این روش شامل جایگزینی سلولهای مغز استخوان بیمار با سلولهای سالم دهنده است و امکان احیای سیستم خونی و ایمنی را فراهم میکند. موفقیت پیوند به سازگاری HLA، وضعیت بیمار و نوع لوسمی بستگی دارد و میتواند منجر به درمان طولانیمدت یا حتی بهبودی کامل شود.
داروهای نوین و ترکیبی
ترکیب داروهای هدفمند با شیمیدرمانی سنتی یا ایمنوتراپی، اثربخشی درمان را افزایش و مقاومت دارویی را کاهش میدهد. از جمله داروهای نوین میتوان به Trisenox، داروهای ضد BCL-2 و داروهای مونوکلونال آنتیبادی اشاره کرد که مسیرهای مرگ سلولی را فعال میکنند و رشد سلولهای لوسمی را مهار میکنند. تحقیقات جدید نیز بر نانوذرات دارویی برای هدفگیری مستقیم سلولهای سرطانی و کاهش سمیت سیستمیک تمرکز دارند.
مراقبتهای حمایتی و مدیریت عوارض جانبی
یکی دیگر از جنبههای حیاتی درمان لوسمی، مراقبت حمایتی است. این شامل پیشگیری و درمان عفونتها، مدیریت کمخونی و ترومبوسیتوپنی، تغذیه مناسب و حمایت روانی بیماران میشود. استفاده از آنتیبیوتیکها، داروهای ضد قارچ، انتقال خون و پلاکت در بیماران با کاهش سلولهای خونی حیاتی است. مراقبت حمایتی نه تنها کیفیت زندگی بیماران را افزایش میدهد، بلکه امکان ادامه درمان هدفمند یا شیمیدرمانی را فراهم میکند.
آینده درمانهای نوین
با پیشرفت علوم مولکولی، درمانهای آینده شامل داروهای هدفمند چندمسیره، ایمنوتراپی ترکیبی و روشهای مهندسی شده سلولهای ایمنی است. همچنین، استفاده از هوش مصنوعی برای پیشبینی پاسخ درمان و شخصیسازی دوز دارو در حال گسترش است. این تحولات نویدبخش بهبود پیشآگهی بیماران و کاهش عوارض جانبی درمانهای سنتی است.
جمعبندی درمانهای رایج و نوین
درمان لوسمی و سایر سرطانهای خونی شامل شیمیدرمانی کلاسیک، داروهای هدفمند مولکولی، ایمنوتراپی و سلولهای CAR-T، پیوند سلولهای بنیادی و مراقبت حمایتی است. رویکردهای نوین بر اساس ویژگیهای مولکولی و ژنتیکی هر بیمار طراحی میشوند و امکان شخصیسازی درمان و افزایش اثربخشی را فراهم میکنند. ترکیب این درمانها با مراقبت حمایتی و تکنولوژیهای نوین، مسیر مدیریت موفق و بهبود کیفیت زندگی بیماران را بهبود بخشیده است.
چالشها و مقاومت درمانی
مدیریت لوسمی و سایر سرطانهای خونی، با وجود پیشرفتهای چشمگیر در درمانهای هدفمند و ایمنوتراپی، همچنان با چالشهای بالینی و مولکولی پیچیده مواجه است. این چالشها نه تنها بر اثربخشی درمان تأثیر میگذارند، بلکه بر کیفیت زندگی بیماران و نرخ عود بیماری نقش مستقیم دارند. مقاومت درمانی یکی از مهمترین موانع در موفقیت درمان محسوب میشود و درک دقیق مکانیسمهای آن، کلید توسعه استراتژیهای مؤثر آینده است.
مقاومت به شیمیدرمانی
یکی از شایعترین چالشها، مقاومت به داروهای شیمیدرمانی کلاسیک است. سلولهای لوسمی میتوانند با استفاده از چند مکانیسم مقاومت ایجاد کنند:
- فعالسازی مسیرهای بقا و مهار آپوپتوز : جهشهای ژنی یا تغییرات اپیژنتیک میتوانند مسیرهای بقا مانند PI3K/Akt/mTOR و BCL-2 را فعال نگه دارند و مانع مرگ سلولی ناشی از داروهای سیتوتوکسیک شوند.
- افزایش پمپهای خروج دارو : برخی سلولها میتوانند داروهای شیمیدرمانی را از طریق پمپهای پروتئینی مانند P-glycoprotein خارج کنند و سطح دارو در سلول کاهش یابد.
- تغییر در مسیرهای متابولیک : سلولهای لوسمی میتوانند مسیرهای متابولیک خود را تغییر دهند تا اثر داروهای شیمیدرمانی کاهش یابد، به ویژه در داروهای مهارکننده دیانای و مسیرهای آنزیمی.
این مقاومت میتواند منجر به عود سریع بیماری، کاهش پاسخ به درمان و نیاز به داروهای جایگزین یا ترکیبی شود.
مقاومت به داروهای هدفمند و مولکولی
با توسعه داروهای هدفمند، مقاومت به این داروها نیز یک چالش مهم شده است. سلولهای لوسمی میتوانند جهشهای ثانویه در ژن هدف، فعالسازی مسیرهای جایگزین و تغییرات اپیژنتیک ایجاد کنند که اثر دارو را خنثی میکند. برای مثال، مقاومت به مهارکنندههای FLT3 در AML ممکن است با جهشهای ثانویه FLT3 یا فعالسازی مسیرهای دیگر رشد سلولی رخ دهد.
در لوسمیهای Philadelphia مثبت، مقاومت به مهارکنندههای BCR-ABL با جهشهای تیروزین کیناز و تغییر در مسیرهای سیگنالینگ مشاهده میشود. این چالش منجر به توسعه نسلهای دوم و سوم مهارکنندههای تیروزین کیناز شده است که قادر به غلبه بر برخی جهشها هستند، اما همچنان پیشگیری کامل از مقاومت دشوار است.
مقاومت در ایمنوتراپی و سلولهای CAR-T
ایمنوتراپی و سلولهای CAR-T، اگرچه پیشرفت انقلابی در درمان لوسمی ایجاد کردهاند، با چالش مقاومت و عود پس از درمان مواجه هستند. سلولهای لوسمی ممکن است آنتیژنهای هدف را کاهش دهند یا مسیرهای سرکوب ایمنی را فعال کنند که باعث فرار از شناسایی توسط سلولهای CAR-T میشود. همچنین، پاسخ سیستم ایمنی میزبان و تعامل با میکرومحیط مغز استخوان میتواند اثربخشی درمان را کاهش دهد.
نقش میکرومحیط و سلولهای بنیادی لوسمی
یکی از دلایل اصلی مقاومت درمانی، وجود سلولهای بنیادی لوسمی (LSC) و تعامل آنها با میکرومحیط مغز استخوان است. این سلولها قادر به قاپیدن دارو، ورود به حالت خواب سلولی و بازسازی کل جمعیت سرطانی پس از درمان هستند. میکرومحیط مغز استخوان با ترشح سیتوکینها و فاکتورهای رشد، نه تنها بقای LSC را تضمین میکند، بلکه اثر داروهای شیمیدرمانی و هدفمند را کاهش میدهد.
چالشهای ژنتیکی و اپیژنتیکی
هتروژنیسیتی ژنتیکی و اپیژنتیکی در لوسمی، مانع از پاسخ یکنواخت به درمان میشود. وجود زیرکلونهای مقاوم، تغییرات DNA متیلاسیون، و تغییرات غیرکدکننده RNA باعث میشود که برخی سلولها به درمان پاسخ ندهند و بیماری مجدداً فعال شود. این ویژگیها نشان میدهند که مدیریت لوسمی نیازمند رویکرد ترکیبی و پیگیری دقیق مولکولی است.
چالشهای بالینی و درمان حمایتی
علاوه بر مقاومت دارویی، عوارض درمان و وضعیت بالینی بیمار نیز چالشهای مهمی هستند. بیماران ممکن است دچار عفونتهای شدید، خونریزی، نارسایی اندامها و کاهش کیفیت زندگی شوند که توانایی ادامه درمان را محدود میکند. مدیریت این عوارض نیازمند مراقبتهای حمایتی دقیق، انتقال خون، داروهای ضدعفونت و پایش مداوم آزمایشگاهی است.
راهکارهای مقابله با مقاومت
برای مقابله با مقاومت درمانی، رویکردهای چندجانبه پیشنهاد میشوند:
- ترکیب درمانها: استفاده همزمان از شیمیدرمانی، داروهای هدفمند و ایمنوتراپی برای غلبه بر مسیرهای جایگزین مقاومت.
- هدفگیری سلولهای بنیادی لوسمی: توسعه داروها و ترکیباتی که LSCها را هدف قرار دهند تا منبع عود بیماری حذف شود.
- تحلیل مولکولی مستمر: پایش تغییرات ژنتیکی و اپیژنتیکی در طول درمان برای تغییر استراتژی درمان به موقع.
- استفاده از فناوریهای نوین: نانوذرات دارویی برای تحویل مستقیم دارو به سلولهای سرطانی، و هوش مصنوعی برای پیشبینی مقاومت و شخصیسازی درمان.
جمعبندی چالشها و مقاومت درمانی
مقاومت درمانی و چالشهای مدیریت لوسمی و سایر سرطانهای خونی شامل مقاومت به شیمیدرمانی، داروهای هدفمند، ایمنوتراپی، نقش میکرومحیط مغز استخوان و سلولهای بنیادی، هتروژنیسیتی ژنتیکی و اپیژنتیکی و عوارض بالینی است. مقابله با این چالشها نیازمند رویکرد ترکیبی، پایش مولکولی، درمانهای هدفمند و نوآورانه و مراقبت حمایتی جامع است. درک عمیق این مکانیزمها، مسیر توسعه درمانهای آینده و افزایش پیشآگهی بیماران را فراهم میکند.
تاثیر بیماری و درمان بر کیفیت زندگی
لوسمی و سایر سرطانهای خونی، علاوه بر اثر مستقیم بر سلامت فیزیکی بیماران، تاثیر عمیقی بر کیفیت زندگی، سلامت روانی و تواناییهای اجتماعی آنها دارند. این تاثیرات نه تنها ناشی از بیماری خود هستند، بلکه درمانهای پیچیده و طولانیمدت نیز نقش مهمی در کاهش کیفیت زندگی دارند. بررسی این جنبه، به ویژه در تصمیمگیریهای درمانی و طراحی مراقبتهای حمایتی، اهمیت حیاتی دارد.
تاثیر بیماری بر کیفیت زندگی
تشخیص لوسمی معمولاً با اضطراب، ترس از مرگ و تغییرات سبک زندگی همراه است. علائم بالینی مانند خستگی مزمن، کمخونی، خونریزی، درد استخوان و ضعف سیستم ایمنی، فعالیتهای روزمره بیمار را محدود میکنند. بیماران ممکن است توانایی انجام کار، ورزش و فعالیتهای اجتماعی را از دست بدهند که منجر به کاهش اعتماد به نفس و انزوای اجتماعی میشود.
در کودکان مبتلا به لوسمی، اختلال در تحصیل و بازیهای گروهی و در بزرگسالان، مشکلات در اشتغال و مسئولیتهای خانوادگی مشاهده میشود. علاوه بر آن، اثرات روانی بلندمدت مانند اضطراب، افسردگی و استرس پس از درمان، کیفیت زندگی بیماران را به شکل قابل توجهی کاهش میدهد.
تاثیر درمان بر کیفیت زندگی
روشهای درمانی مانند شیمیدرمانی، ایمنوتراپی و پیوند سلولهای بنیادی، هرچند اثربخش در کنترل بیماری، با عوارض جانبی گسترده همراه هستند. شیمیدرمانی میتواند باعث تهوع، استفراغ، ریزش مو، ضعف سیستم ایمنی و آسیب اندامها شود. داروهای هدفمند و مهارکنندههای مولکولی نیز گاهی عوارضی مانند اختلالات قلبی، کبدی یا متابولیک ایجاد میکنند.
ایمنوتراپی، به ویژه سلولهای CAR-T، ممکن است با سندرم انتشار سایتوکین و التهاب شدید سیستمیک همراه باشد که نیازمند مراقبتهای ویژه و بستری طولانی است. پیوند سلولهای بنیادی نیز با ریسک بالای عفونت، بیماری پیوند علیه میزبان و طول درمان طولانی کیفیت زندگی بیماران را تحت تأثیر قرار میدهد.
اثرات روانی و اجتماعی درمان
بیماران لوسمی، علاوه بر عوارض فیزیکی، با چالشهای روانی و اجتماعی نیز مواجه هستند. طول درمان و دورههای مکرر بستری، روابط خانوادگی و اجتماعی را تحت تاثیر قرار میدهد. اضطراب مرتبط با آزمایشها، ترس از عود بیماری و فشارهای اقتصادی درمان، بر سلامت روانی بیماران اثر میگذارد.
تحقیقات نشان داده است که کیفیت زندگی بیماران با سطح حمایت اجتماعی، دسترسی به خدمات رواندرمانی و مشاوره، و مدیریت علائم درمانی ارتباط مستقیم دارد. بیماران با مراقبت حمایتی مناسب، توانایی بیشتری برای ادامه درمان و حفظ فعالیتهای روزمره دارند.
ابزارهای ارزیابی کیفیت زندگی
برای ارزیابی دقیق کیفیت زندگی بیماران لوسمی، از ابزارهای استاندارد شده و پرسشنامههای روانسنجی استفاده میشود. این ابزارها شامل شاخصهای فیزیکی، روانی، اجتماعی و عملکرد روزمره هستند. استفاده از این ارزیابیها به پزشکان امکان میدهد که اثرات جانبی درمان را شناسایی کرده، برنامه مراقبتی متناسب با نیازهای بیمار طراحی کنند و تصمیمات درمانی را شخصیسازی نمایند.
مداخلات بهبود کیفیت زندگی
بهبود کیفیت زندگی بیماران لوسمی نیازمند رویکرد چندجانبه است که شامل موارد زیر میشود:
- مراقبت حمایتی پزشکی و پرستاری: مدیریت عوارض درمان، پیشگیری از عفونت و پشتیبانی از تغذیه و فعالیتهای روزمره.
- حمایت روانی و مشاوره: درمان اضطراب، افسردگی و اختلالات خواب مرتبط با بیماری و درمان.
- فعالیت بدنی و توانبخشی: تمرینات کنترل شده برای کاهش خستگی، افزایش تحمل جسمانی و بهبود عملکرد روزمره.
- آموزش و اطلاعرسانی: افزایش آگاهی بیمار و خانواده درباره بیماری، درمانها و مدیریت عوارض جانبی.
- حمایت اجتماعی و اقتصادی: ارائه تسهیلات برای کاهش فشارهای مالی و فراهم کردن شبکه حمایتی خانوادگی و اجتماعی.
کیفیت زندگی و پیشآگهی درمانی
تحقیقات نشان داده است که کیفیت زندگی بیماران ارتباط مستقیمی با پاسخ به درمان و پیشآگهی دارد. بیمارانی که دارای کیفیت زندگی بهتر و حمایت اجتماعی قوی هستند، احتمال بیشتری برای تکمیل درمان، پاسخ بهتر و کاهش عود بیماری دارند. به همین دلیل، ادغام مراقبت حمایتی با درمانهای بالینی به عنوان ستون اصلی مدیریت جامع بیماران لوسمی مورد تأکید قرار گرفته است.
جمعبندی تاثیر بیماری و درمان بر کیفیت زندگی
لوسمی و سایر سرطانهای خونی، علاوه بر اثرات فیزیکی و بالینی، تاثیر عمیقی بر سلامت روان، تواناییهای اجتماعی و کیفیت زندگی بیماران دارند. درمانهای پیشرفته، هرچند اثربخش، با عوارض جسمی و روانی همراه هستند که نیازمند مراقبت حمایتی جامع، مداخلات روانی و توانبخشی، و پشتیبانی اجتماعی و آموزشی است. ارزیابی مستمر کیفیت زندگی بیماران و اتخاذ رویکردهای چندجانبه، نقش کلیدی در افزایش اثربخشی درمان و بهبود طول عمر و رفاه بیماران دارد.
پیشگیری و مدیریت عوامل خطر
پیشگیری از لوسمی و سایر سرطانهای خونی، هرچند چالشبرانگیز به نظر میرسد، اما با شناسایی عوامل خطر، اصلاح سبک زندگی، پایش ژنتیکی و مدیریت محیطی میتوان احتمال ابتلا را کاهش داد یا پیشرفت بیماری را به تاخیر انداخت. درک عوامل خطر و اجرای راهکارهای پیشگیرانه، نه تنها به افراد در معرض خطر کمک میکند، بلکه به بهبود نتایج درمان و کاهش عوارض بلندمدت بیماران مبتلا نیز میانجامد.
شناسایی عوامل خطر ژنتیکی و خانوادگی
برخی از لوسمیها به علت اختلالات ژنتیکی ارثی یا جهشهای فردی ایجاد میشوند. وجود سابقه خانوادگی سرطانهای خونی یا جهشهای ژنی خاص، مانند جهشهای TP53، FLT3 و RUNX1، خطر ابتلا را افزایش میدهد. غربالگری ژنتیکی در افراد پرخطر، به ویژه کسانی که سابقه خانوادگی مثبت دارند، امکان تشخیص زودهنگام و پیگیری فعال را فراهم میکند.
در کودکان، اختلالات ژنتیکی مانند سندرم داون و جهشهای در مسیرهای DNA repair با افزایش خطر ابتلا به لوسمی همراه هستند. در بزرگسالان، جهشهای پیشساز مانند MDS و CMML میتوانند مسیر پیشرفت به AML را تسهیل کنند. پایش ژنتیکی و بررسی مستمر تغییرات مولکولی، ابزار مهمی در پیشگیری و مدیریت اولیه محسوب میشود.
مدیریت عوامل محیطی و شغلی
برخی مواد شیمیایی و شرایط محیطی نقش مهمی در افزایش خطر لوسمی دارند. قرارگیری مزمن در معرض بنزن، برخی حلالها و عوامل رادیواکتیو میتواند باعث آسیب DNA و ایجاد جهشهای سرطانی شود. افراد شاغل در صنایع شیمیایی، نفت، پتروشیمی و محیطهای با آلودگی رادیواکتیو، نیازمند پایش سلامت دورهای، استفاده از تجهیزات حفاظت فردی و کاهش مواجهه با عوامل خطر هستند.
پیشگیری از ابتلا به لوسمی ناشی از درمانهای قبلی
برخی درمانهای سرطان یا شیمیدرمانی قبلی میتوانند خود عامل ایجاد لوسمی ثانویه باشند. به همین دلیل، انتخاب دوز مناسب، فواصل درمانی کنترلشده و استفاده از داروهای محافظتی اهمیت ویژهای دارد. پایش منظم سلولهای خونی پس از درمان، امکان تشخیص زودهنگام و مدیریت سریع عوارض ثانویه را فراهم میکند.
سبک زندگی و پیشگیری از لوسمی
اگرچه سبک زندگی تأثیر مستقیم بر همه انواع لوسمی ندارد، اما برخی اقدامات میتوانند ریسک ابتلا و پیشرفت بیماری را کاهش دهند:
- رژیم غذایی سالم: مصرف میوهها، سبزیجات، منابع پروتئینی سالم و کاهش مصرف مواد فرآوریشده و چربیهای ناسالم.
- فعالیت بدنی منظم: ورزش متوسط و کنترل وزن میتواند سیستم ایمنی را تقویت کرده و التهابات مزمن را کاهش دهد.
- اجتناب از سیگار و الکل: سیگار کشیدن و مصرف بیش از حد الکل با آسیب DNA و افزایش خطر انواع سرطانهای خونی مرتبط هستند.
- کنترل استرس و حمایت روانی: استرس مزمن میتواند سیستم ایمنی را تضعیف کند و به افزایش آسیبهای سلولی کمک نماید.
پایش پزشکی منظم و غربالگری
افراد پرخطر باید تحت پیگیری پزشکی دورهای شامل شمارش سلولهای خونی، بررسی مارکرهای ژنتیکی و تصویربرداریهای تکمیلی باشند. این رویکرد امکان تشخیص زودهنگام تغییرات پیشسرطانی و مداخلات به موقع را فراهم میکند.
مداخلات دارویی پیشگیرانه
در موارد خاص، استفاده از داروهای هدفمند یا مهارکننده مسیرهای پیشرونده در افراد پرخطر تحت بررسی قرار دارد. برای مثال، برخی بیماران با جهشهای FLT3 یا IDH1/2 در مراحل پیشسرطانی ممکن است درمان هدفمند پیشگیرانه دریافت کنند تا تکثیر سلولهای نابالغ کنترل شود. هرچند این رویکرد هنوز در مراحل تحقیقاتی است، اما نویدبخش کاهش عود یا پیشرفت به لوسمی کامل میباشد.
آموزش و اطلاعرسانی عمومی
اطلاعرسانی درباره عوامل خطر، علائم هشداردهنده و اهمیت غربالگری، نقش کلیدی در پیشگیری جامعهمحور دارد. افزایش آگاهی عمومی و آموزش بیماران و خانوادهها، به ویژه در گروههای پرخطر، میتواند تشخیص زودهنگام و مداخله سریع را تسهیل کند و بار بیماری را کاهش دهد.
جمعبندی پیشگیری و مدیریت عوامل خطر
پیشگیری از لوسمی و سایر سرطانهای خونی شامل شناسایی عوامل ژنتیکی و خانوادگی، مدیریت عوامل محیطی و شغلی، رعایت سبک زندگی سالم، غربالگری منظم و استفاده از مداخلات دارویی در موارد خاص است. این اقدامات، در کنار آموزش و حمایت جامعه، میتوانند ریسک ابتلا را کاهش داده، پیشرفت بیماری را به تاخیر اندازند و کیفیت زندگی بیماران را ارتقا دهند.
چشمانداز آینده و تحقیقات نوین
پیشرفتهای اخیر در حوزه علوم زیستی، ژنتیک، ایمنولوژی و فناوریهای پزشکی، نویدبخش چشمانداز روشن و تحولی در مدیریت لوسمی و سایر سرطانهای خونی هستند. تحقیقات نوین، با تمرکز بر درک دقیق مکانیسمهای مولکولی، توسعه درمانهای هدفمند و شخصیسازی مراقبتها، مسیر درمان و پیشگیری را به شکل قابل توجهی تغییر دادهاند.
تحقیقات مولکولی و ژنتیکی پیشرفته
با استفاده از فناوریهای نسل جدید تجزیه و تحلیل ژنوم، توالییابی تک سلولی و اپیژنتیک، دانشمندان قادر شدهاند زیرکلونهای مقاوم و مسیرهای سیگنالینگ کلیدی سلولهای لوسمی را شناسایی کنند. این دانش امکان توسعه داروهای هدفمند جدید، پیشبینی مقاومت درمانی و انتخاب استراتژی درمانی شخصیسازیشده را فراهم میآورد.
مطالعات اخیر نشان دادهاند که شبکههای RNA غیرکدکننده، پروتئینهای TRIM و مسیرهای سیگنالینگ PI3K/Akt/mTOR نقش اساسی در پیشرفت و مقاومت بیماری دارند. هدفگیری این مسیرها میتواند باعث بهبود پاسخ به درمان و کاهش عود بیماری شود.
درمانهای ایمنوتراپی و سلولهای CAR-T
ایمنوتراپی، به ویژه سلولهای CAR-T و آنتیبادیهای منوکلونال، انقلابی در درمان لوسمی ایجاد کرده است. تحقیقات نوین بر بهبود پایداری سلولهای CAR-T، کاهش عوارض سندرم انتشار سایتوکین و گسترش استفاده از آن به انواع مختلف لوسمی متمرکز است. همچنین، توسعه آنتیبادیهای دو یا چند هدفه، امکان حمله همزمان به مسیرهای مختلف رشد سلولی را فراهم میکند و مقاومت درمانی را کاهش میدهد.
نانوذرات و دارورسانی هدفمند
استفاده از نانوذرات دارویی و سیستمهای تحویل هدفمند دارو، امکان رساندن داروهای شیمیدرمانی و مولکولی به سلولهای سرطانی با دوز کمتر و اثر بیشتر را فراهم کرده است. این فناوری نه تنها اثربخشی درمان را افزایش میدهد، بلکه عوارض جانبی داروها را کاهش میدهد و کیفیت زندگی بیماران را بهبود میبخشد.
هوش مصنوعی و یادگیری ماشین در تشخیص و درمان
هوش مصنوعی و الگوریتمهای یادگیری ماشین، امکان تشخیص سریع و دقیق لوسمی از تصاویر خونی، پیشبینی پاسخ به درمان و شناسایی بیماران پرخطر را فراهم کردهاند. این ابزارها میتوانند به پزشکان در تصمیمگیریهای درمانی پیچیده و شخصیسازی مراقبتها کمک کنند و از اشتباهات بالینی جلوگیری نمایند.
پیشگیری مولکولی و درمانهای پیشگیرانه
تحقیقات نوین نشان میدهند که شناسایی افراد با ریسک ژنتیکی بالا و تغییرات پیشسرطانی میتواند مسیر درمان پیشگیرانه یا مداخلات زودهنگام را فراهم کند. استفاده از داروهای هدفمند و مهارکننده مسیرهای پیشرونده، حتی پیش از ظهور لوسمی کامل، میتواند احتمال پیشرفت بیماری را کاهش دهد و زندگی بیماران را نجات دهد.
چالشها و فرصتهای آینده
اگرچه پیشرفتها چشمگیر هستند، چالشهای مهمی مانند هتروژنیسیتی ژنتیکی، مقاومت به درمان و هزینههای بالا همچنان وجود دارند. توسعه درمانهای مقرونبهصرفه، پایش مولکولی بلندمدت و حمایت از بیماران برای دسترسی به فناوریهای نوین، از محورهای کلیدی تحقیقات آینده است.
در عین حال، ادغام دادههای ژنتیکی، بالینی و تصویربرداری با الگوریتمهای هوش مصنوعی میتواند موجب شخصیسازی واقعی درمان و پیشبینی دقیقتر پیشآگهی شود. همچنین، توسعه داروهای چندهدفه و ترکیبی، همزمان با بهبود ایمنوتراپی، نویدبخش افزایش نرخ بقای بیماران و کاهش عوارض جانبی است.
جمعبندی چشمانداز آینده و تحقیقات نوین
چشمانداز آینده لوسمی و سایر سرطانهای خونی بر شخصیسازی درمان، هدفگیری مولکولی دقیق، ایمنوتراپی پیشرفته، دارورسانی نوین و استفاده از هوش مصنوعی متمرکز است. تحقیقات نوین نه تنها در بهبود اثربخشی درمان و کاهش مقاومت دارویی نقش دارند، بلکه با ارتقای کیفیت زندگی و پیشگیری مولکولی، مسیر جدیدی برای مدیریت جامع و بلندمدت بیماران فراهم میکنند. در آینده نزدیک، ترکیب این فناوریها و دانش مولکولی میتواند تحولی در پیشگیری، درمان و پیشآگهی لوسمی و سایر سرطانهای خونی ایجاد کند.
نتیجهگیری
لوسمی و سایر سرطانهای خونی، گروهی از بیماریهای پیچیده هستند که سیستم خون و مغز استخوان را درگیر کرده و باعث اختلال در تولید و عملکرد سلولهای خونی میشوند. این بیماریها میتوانند هر فردی را در هر سن و جنسیتی تحت تأثیر قرار دهند و ترکیبی از عوامل ژنتیکی، محیطی، شغلی و سبک زندگی در ایجاد آنها نقش دارند.
تحقیقات گسترده نشان دادهاند که درک دقیق مکانیسمهای مولکولی و مسیرهای ژنتیکی دخیل در لوسمی، کلید موفقیت در درمانهای مدرن و شخصیسازی شده است. جهشهای ژنی، تغییرات اپیژنتیک، شبکههای RNA غیرکدکننده و مسیرهای سیگنالینگ مانند PI3K/Akt/mTOR، نقش اساسی در پیشرفت بیماری، مقاومت درمانی و احتمال عود دارند. شناسایی این عوامل امکان طراحی درمانهای هدفمند و اثربخش با حداقل عوارض جانبی را فراهم میکند.
تشخیص دقیق و طبقهبندی صحیح، بخش حیاتی مدیریت بیماران لوسمی است. استفاده از روشهای مدرن ژنتیکی، مولکولی، تصویربرداری و هوش مصنوعی، باعث شده است که تشخیص سریع و دقیق، تعیین پیشآگهی و انتخاب استراتژی درمانی بهینه، با دقت بالاتر انجام شود. این امر نه تنها موفقیت درمان را افزایش میدهد، بلکه کیفیت زندگی بیماران را نیز بهبود میبخشد.
در حوزه درمان، ترکیبی از شیمیدرمانی، ایمنوتراپی، داروهای هدفمند و پیوند سلولهای بنیادی، ستون اصلی مدیریت لوسمی هستند. با این حال، مقاومت دارویی، عوارض جانبی و هتروژنیسیتی ژنتیکی، چالشهای مهمی برای پزشکان و بیماران محسوب میشوند. پیشرفتهای نوین در ایمنوتراپی، سلولهای CAR-T، آنتیبادیهای منوکلونال، نانوذرات دارویی و هوش مصنوعی، امیدهای جدیدی برای غلبه بر این چالشها ایجاد کردهاند و مسیر درمان را به سوی شخصیسازی کامل، کاهش عوارض و افزایش بقا هموار میکنند.
از سوی دیگر، کیفیت زندگی بیماران و حمایت روانی، اجتماعی و اقتصادی، همانند درمانهای بالینی اهمیت دارد. مدیریت عوارض فیزیکی و روانی، توانبخشی و حمایت اجتماعی، نقش کلیدی در بهبود عملکرد روزمره بیماران، کاهش اضطراب و افسردگی و افزایش توانایی مقابله با بیماری دارد. توجه به این جنبههای انسانی، مکمل درمانهای پزشکی و حیاتی برای موفقیت طولانیمدت است.
پیشگیری و مدیریت عوامل خطر، از جمله شناسایی ژنتیکی، کاهش مواجهه با مواد شیمیایی و پرتوها، اصلاح سبک زندگی و آموزش عمومی، میتواند ریسک ابتلا و پیشرفت لوسمی را کاهش دهد. ادغام این اقدامات با مراقبتهای پزشکی و پایش مستمر، رویکردی جامع و آیندهنگر برای سلامت جامعه و بیماران پرخطر فراهم میآورد.
در نهایت، چشمانداز آینده لوسمی بر اساس تحقیقات نوین، شخصیسازی درمان، پیشگیری مولکولی و استفاده از فناوریهای پیشرفته شکل گرفته است. ترکیب درمانهای هدفمند، ایمنوتراپی، دارورسانی نوین و هوش مصنوعی، نه تنها افزایش نرخ بقا و کاهش عوارض را امکانپذیر میکند، بلکه کیفیت زندگی بیماران و توانایی آنها در مقابله با بیماری را ارتقا میدهد.
جمعبندی نهایی این است که لوسمی و سایر سرطانهای خونی، با توجه به پیچیدگیهای بالینی و مولکولی، نیازمند رویکرد چندجانبه، همزمان از نظر تشخیصی، درمانی، پیشگیرانه و حمایتی هستند. پیشرفتهای علمی و تکنولوژیک، چشمانداز امیدوارکنندهای برای درمان، کنترل و پیشگیری این بیماریها ایجاد کرده است و ترکیب آنها با مراقبت جامع از بیماران، مسیر مدیریت موفق و پایدار لوسمی را فراهم میآورد.