تکنیکهای آزمایشگاهی در تشخیص بیماریهای خون
مقدمه
تشخیص دقیق و سریع بیماریهای خونی، یکی از مهمترین ارکان حفظ سلامت جامعه و ارتقای کیفیت درمان در پزشکی مدرن محسوب میشود. بیماریهای خون شامل طیف گستردهای از اختلالات هستند که از کمخونی ساده گرفته تا نئوپلاسمهای خونی پیچیده، عفونتهای سیستمیک و اختلالات انعقادی را دربر میگیرند. این بیماریها میتوانند به طور مستقیم سلامت بیمار را تهدید کنند و در مواردی تشخیص دیرهنگام میتواند عوارض جبرانناپذیری ایجاد کند. از این رو، استفاده از تکنیکهای آزمایشگاهی پیشرفته نه تنها به شناسایی دقیق بیماری کمک میکند، بلکه امکان پایش اثر درمان و پیشبینی روند بیماری را نیز فراهم میآورد.
در طول دهههای اخیر، پیشرفتهای چشمگیری در حوزه تشخیص آزمایشگاهی مشاهده شده است. از روشهای سنتی مانند شمارش سلولهای خونی و بررسی مورفولوژی گلبولها گرفته تا تکنیکهای مولکولی و بیومارکری، هر یک نقش ویژهای در شناسایی دقیق بیماریها ایفا میکنند. به عنوان مثال، بررسی هموگلوبین، هماتوکریت و شاخصهای مرتبط با گلبول قرمز، اطلاعات کلیدی برای تشخیص انواع کمخونیها و اختلالات ارثی مانند تالاسمی و سلول داسی شکل ارائه میدهد. در مقابل، تکنیکهای پیشرفتهتر مانند PCR دیجیتال، توالییابی نسل جدید و دستگاههای Lab-on-paper، امکان تشخیص سریع و حساس بیماریهای عفونی و نئوپلاسمها را فراهم کردهاند.
از سوی دیگر، تشخیص بیماریهای عفونی از طریق خون به ویژه در شرایط بحرانی مانند همهگیریهای جهانی، اهمیت ویژهای پیدا کرده است. نمونههایی مانند ویروس SARS-CoV-2 یا ویروس دنگی نیازمند ابزارهای دقیق و قابل اعتماد هستند تا پزشکان بتوانند تصمیمات درمانی بهینه اتخاذ کنند. فناوریهای نوین مانند MALDI-TOF MS، دستگاههای میکروفلوئیدیک و سنسورهای نانو، به همراه الگوریتمهای هوش مصنوعی، نه تنها سرعت تشخیص را افزایش میدهند بلکه دقت را نیز بهبود میبخشند.
علاوه بر این، پایش عملکرد پلاکت و سلولهای سفید خون، شاخصهای مهمی برای مدیریت بیماریهای انعقادی، التهابی و نئوپلاسمیک ارائه میکند. روشهای استاندارد و دقیق برای سنجش عملکرد پلاکت و تحلیل نسبتهای لکوسیتی، میتواند اطلاعات حیاتی برای تصمیمگیری بالینی فراهم کند و امکان پیشبینی عوارض احتمالی را بهبود بخشد.
یکی از چالشهای اصلی در تشخیص آزمایشگاهی، استانداردسازی فرآیند نمونهگیری، آمادهسازی و تحلیل دادهها است. رعایت دقیق استانداردهای پیشآزمایشی و کنترل کیفیت، نقش بسیار مهمی در کاهش خطاهای تشخیصی دارد و به پزشکان این اطمینان را میدهد که نتایج حاصل، دقیق و قابل اعتماد است.
هدف اصلی این مقاله ارائه یک مرور جامع و بهروز از تکنیکهای آزمایشگاهی مورد استفاده در تشخیص بیماریهای خون است. در این مرور، تلاش شده است تا هر جنبهای از تشخیص، از روشهای سنتی تا تکنیکهای مولکولی و ابزارهای نوین، به طور کامل پوشش داده شود. این مقاله برای متخصصان بالینی، پژوهشگران و دانشجویان پزشکی طراحی شده تا نه تنها اطلاعات علمی کامل دریافت کنند، بلکه با کاربردهای عملی تکنیکها در محیط بالینی نیز آشنا شوند.
با توجه به اهمیت روزافزون تشخیص زودهنگام و دقیق، این مقاله به دنبال ایجاد یک منبع مرجع و قابل اعتماد برای تمامی افرادی است که در حوزه سلامت خون فعالیت میکنند. تمرکز مقاله بر ارائه اطلاعات دقیق، بهروز و علمی، همراه با نکات عملی کاربردی برای بالینگران است تا بتوانند تصمیمات درمانی بهتری اتخاذ کنند و روند پایش بیماران را بهبود بخشند.
مروری بر تکنیکهای پایهای آزمایش خون
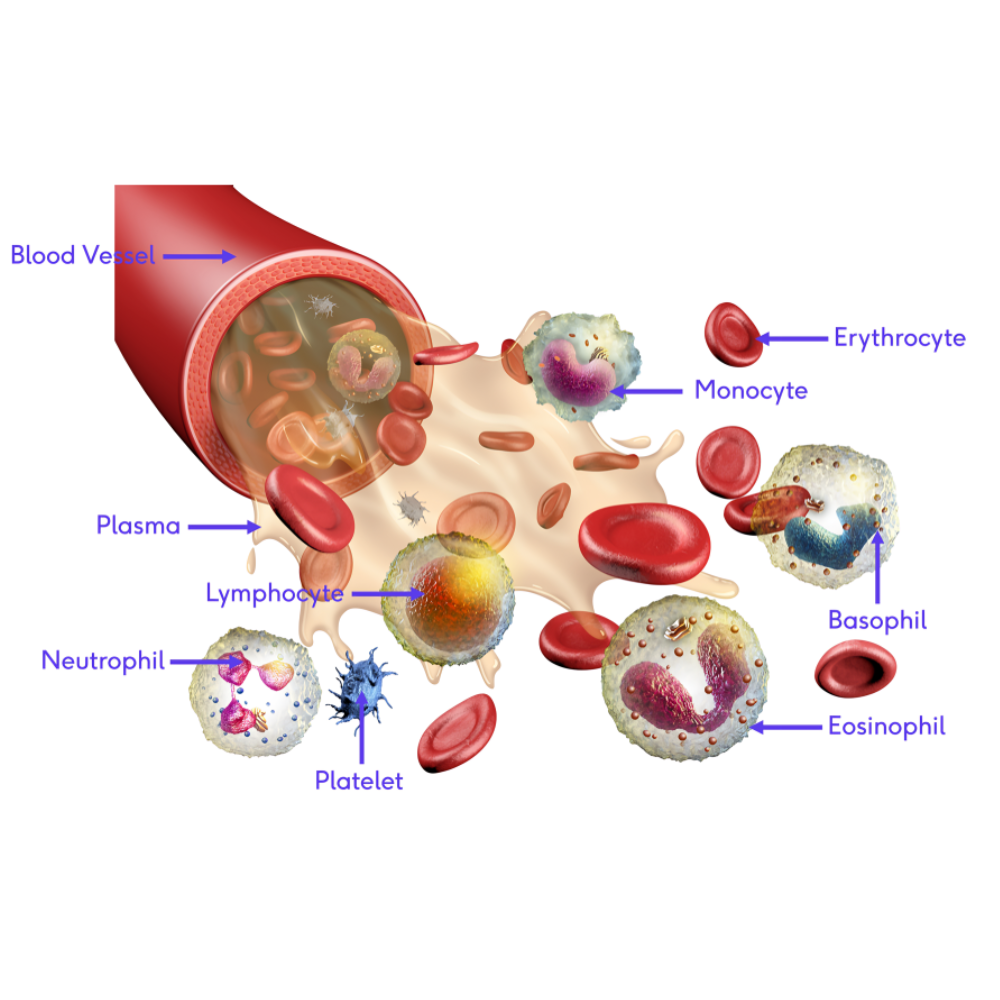
تکنیکهای پایهای آزمایش خون، ستون فقرات تشخیص بسیاری از بیماریهای خونی و اختلالات سیستمیک محسوب میشوند. این روشها، که اغلب در آزمایشگاههای بالینی استاندارد قابل انجام هستند، اطلاعات کلیدی درباره وضعیت سلولهای خونی، عملکرد سیستم ایمنی و میزان مواد حیاتی موجود در خون فراهم میکنند. استفاده صحیح و دقیق از این تکنیکها، امکان شناسایی سریع اختلالات خونی را فراهم میسازد و نقش حیاتی در مدیریت بالینی بیماران ایفا میکند.
یکی از اصلیترین و قدیمیترین تکنیکهای آزمایش خون، شمارش کامل سلولهای خونی یا CBC (Complete Blood Count) است. این آزمایش، اطلاعات جامعی درباره گلبولهای قرمز، گلبولهای سفید و پلاکتها ارائه میدهد و به پزشکان امکان میدهد تا الگوهای غیرطبیعی را شناسایی کنند. در بررسی CBC، شاخصهایی مانند هموگلوبین، هماتوکریت و میانگین حجم گلبول قرمز (MCV) نقش محوری دارند. هموگلوبین، پروتئینی که اکسیژن را در خون حمل میکند، بهعنوان یک نشانگر حساس برای کمخونی و سایر اختلالات خونسازی شناخته میشود. هماتوکریت نیز نسبت حجم گلبولهای قرمز به کل حجم خون را مشخص میکند و تغییرات آن میتواند به تشخیص کمخونی، پلیسیتمی یا دهیدراسیون کمک کند.
شاخصهای تکمیلی گلبول قرمز مانند میانگین هموگلوبین گلبول (MCH)، غلظت هموگلوبین متوسط (MCHC) و توزیع حجم گلبول قرمز (RDW) اطلاعات ارزشمندی درباره اندازه، حجم و هموگلوبین موجود در گلبولها ارائه میدهند. بهعنوان مثال، افزایش RDW معمولاً نشاندهنده وجود جمعیتهای مختلف گلبول قرمز با اندازههای متفاوت است که در بیماریهایی مانند کمخونی فقر آهن و تالاسمی مشهود است. این پارامترها، به پزشکان کمک میکنند تا نوع کمخونی و شدت آن را بهتر تشخیص دهند و تصمیمات درمانی مناسب اتخاذ شود.
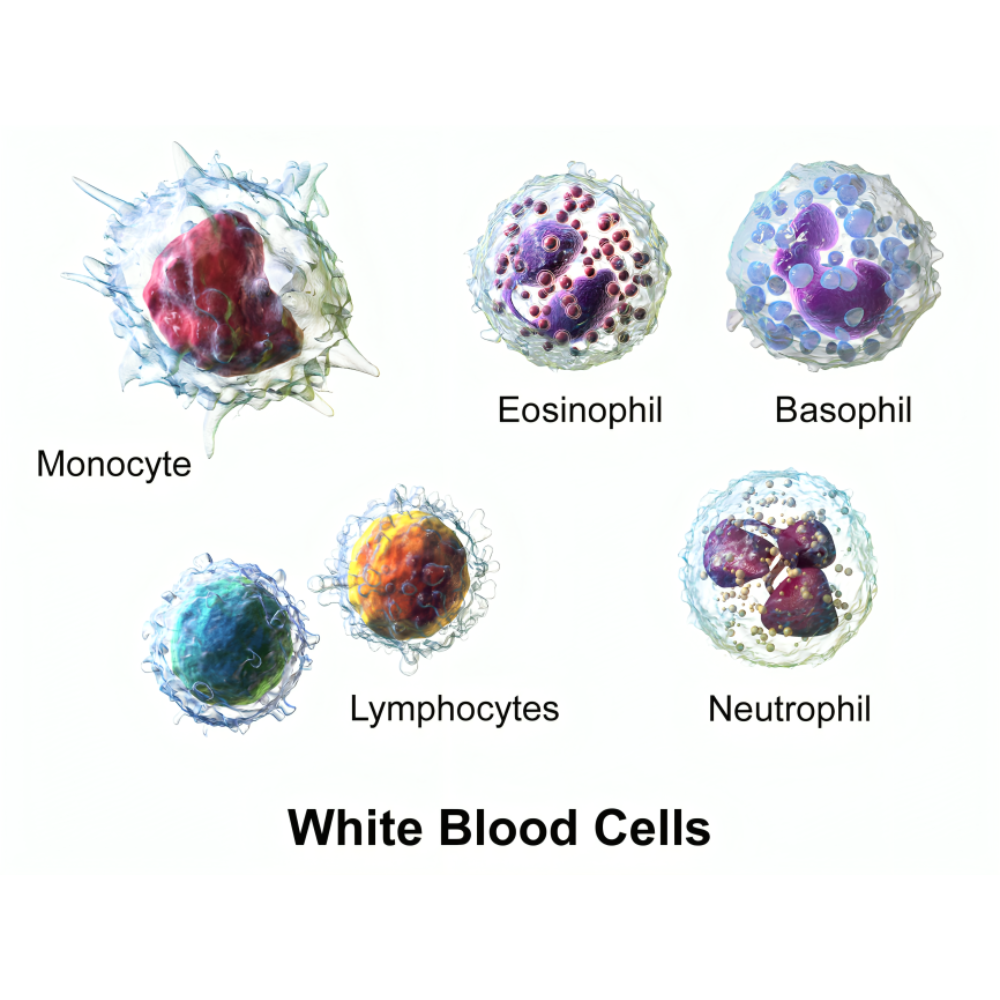
در کنار گلبولهای قرمز، شمارش و بررسی گلبولهای سفید خون، اطلاعات حیاتی درباره وضعیت سیستم ایمنی بدن فراهم میکند. انواع مختلفی از لکوسیتها شامل نوتروفیلها، لنفوسیتها، مونوسیتها، ائوزینوفیلها و بازوفیلها هر کدام نقش ویژهای در پاسخ ایمنی دارند و تغییرات آنها میتواند نشانهای از عفونت، التهاب، آلرژی یا نئوپلاسمهای خونی باشد. برای مثال، افزایش نوتروفیلها غالباً نشاندهنده عفونت باکتریایی حاد است، در حالی که افزایش لنفوسیتها ممکن است با عفونتهای ویروسی یا برخی اختلالات مزمن مرتبط باشد. تحلیل نسبتهای لکوسیتی، مانند نسبت نوتروفیل به لنفوسیت، میتواند به عنوان بیومارکری برای پیشبینی شدت بیماری و روند درمان به کار رود.
شمارش پلاکتها و بررسی عملکرد آنها نیز یکی از اجزای حیاتی CBC و ارزیابی پایهای خون است. پلاکتها نقش کلیدی در انعقاد خون و جلوگیری از خونریزی دارند و کاهش یا افزایش غیرطبیعی آنها میتواند پیامدهای مهمی برای سلامت فرد داشته باشد. علاوه بر شمارش، تستهای عملکرد پلاکت مانند aggregometry به ارزیابی قابلیت تجمع و عملکرد واقعی پلاکتها کمک میکنند، که در تشخیص بیماریهای خونریزیدهنده یا ترومبوتیک بسیار ارزشمند است.
از دیگر تکنیکهای پایهای، آزمایشهای بیوشیمیایی خون مانند بررسی سطح آهن، فریتین، ویتامینها و الکترولیتها نقش مهمی در تشخیص اختلالات خونی و متابولیک ایفا میکنند. برای مثال، تعیین سطح آهن و فریتین به تشخیص دقیق انواع کمخونی کمک میکند و اجازه میدهد تا درمان با مکملهای آهن بهینه و هدفمند انجام شود. همچنین، آزمایشهای بیوشیمیایی میتوانند اطلاعاتی درباره اثر بیماریهای مزمن بر خون و عملکرد مغز استخوان ارائه دهند.
در کنار روشهای استاندارد، بررسی مورفولوژی سلولهای خونی از طریق میکروسکوپی هنوز یکی از ابزارهای تشخیصی قدرتمند به شمار میرود. رنگآمیزیهای اختصاصی مانند Giemsa یا Wright، جزئیات ساختاری گلبولهای قرمز، سفید و پلاکتها را آشکار میکنند و به شناسایی سلولهای غیرطبیعی، اشکال غیرمعمول، و نشانههای بیماریهای ارثی یا اکتسابی کمک میکنند. این روش، به ویژه در تشخیص اولیه بیماریهایی مانند لوکمیها، تالاسمی و سلول داسی شکل اهمیت دارد.
یکی دیگر از جنبههای مهم، استانداردسازی و کنترل کیفیت تکنیکهای پایهای است. دقت نتایج آزمایش خون به شدت تحت تأثیر پیشآزمایشها مانند نمونهگیری، انتقال و ذخیرهسازی خون قرار دارد. رعایت اصول استاندارد، استفاده از ضدانعقادهای مناسب، و حفظ شرایط دمایی مناسب نمونه، از جمله مواردی هستند که میتوانند دقت و قابلیت اطمینان نتایج را به میزان قابل توجهی افزایش دهند.
به طور خلاصه، تکنیکهای پایهای آزمایش خون شامل شمارش و تحلیل سلولهای خونی، بررسی عملکرد پلاکتها، آزمایشهای بیوشیمیایی و ارزیابی مورفولوژی سلولی هستند. این روشها به عنوان پایه تشخیص بسیاری از بیماریها عمل میکنند و اطلاعات اولیه و حیاتی را برای تصمیمگیری بالینی فراهم میآورند. با توجه به پیشرفت تکنولوژی و معرفی روشهای مولکولی و دستگاههای نوین، این تکنیکها همچنان جایگاه خود را به عنوان ابزار اولیه تشخیص حفظ کردهاند و نقش مهمی در ترکیب با روشهای پیشرفتهتر ایفا میکنند.
تشخیص آنمی و اختلالات گلبول قرمز
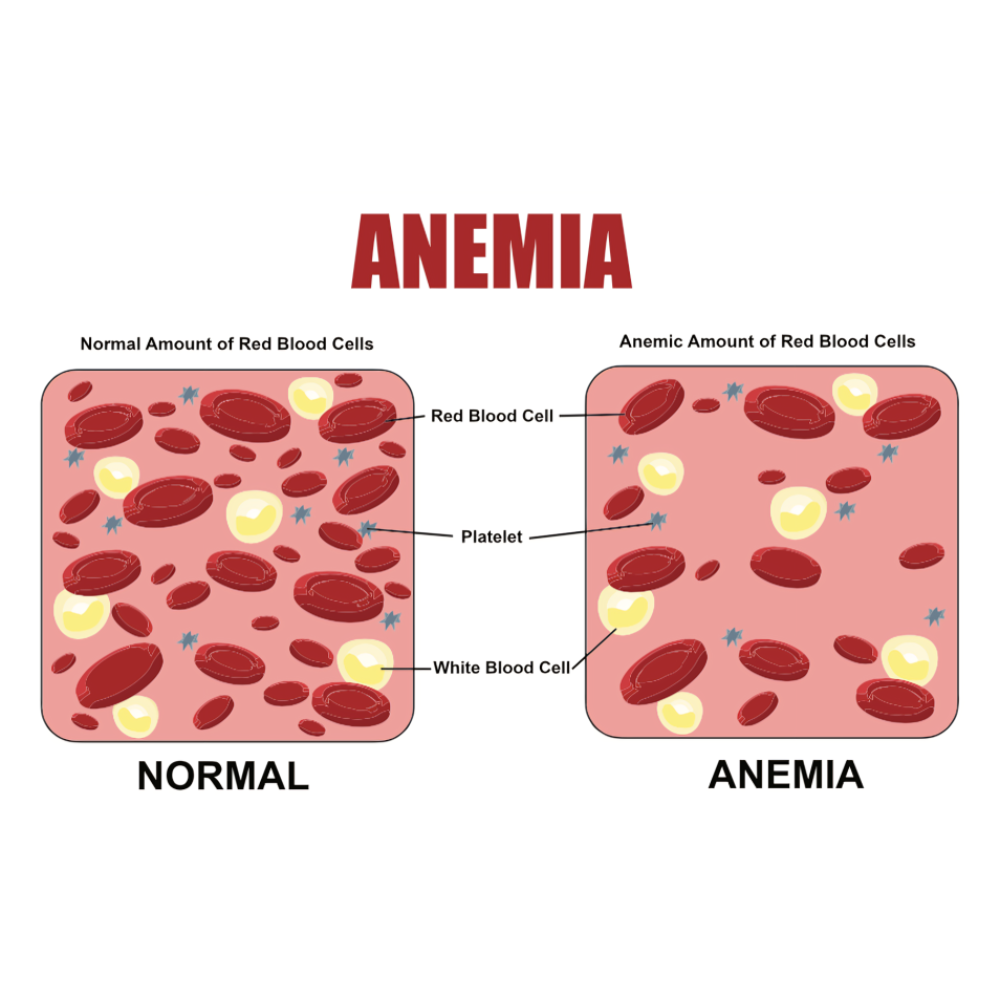
آنمی به عنوان یکی از شایعترین اختلالات خونی در سراسر جهان، به کاهش ظرفیت خون در حمل اکسیژن به بافتها اشاره دارد و میتواند ناشی از کمبود تولید گلبولهای قرمز، از دست رفتن خون یا تخریب زودرس گلبولهای قرمز باشد. تشخیص دقیق نوع آنمی و علت زمینهای آن، اهمیت ویژهای دارد، زیرا درمانها و مدیریت بیماری بسته به نوع اختلال متفاوت است. آزمایشهای خون پایه، شاخصهای گلبول قرمز و تکنیکهای مولکولی، همگی در کنار هم امکان شناسایی دقیق این اختلالات را فراهم میکنند.
یکی از رایجترین انواع آنمی، کمخونی فقر آهن است. این اختلال معمولاً ناشی از کمبود آهن در رژیم غذایی، کاهش جذب آهن، یا خونریزی مزمن است. در تشخیص کمخونی فقر آهن، شاخصهایی مانند هموگلوبین، هماتوکریت، MCV و MCH بسیار حیاتی هستند. کاهش حجم متوسط گلبول قرمز (MCV) و کاهش میانگین هموگلوبین گلبول (MCH) غالباً نشاندهنده کمخونی میکروسیتیک و هیپوکرومیک است که مشخصه کمخونی ناشی از فقر آهن است. علاوه بر این، آزمایشهای بیوشیمیایی مانند سطح سرمی آهن، فریتین و ظرفیت اتصال آهن به ترانسفرین، نقش تکمیلی در تشخیص دقیق و پایش درمان ایفا میکنند.
در مقابل، کمخونی ناشی از اختلالات مغز استخوان مانند آنمی آپلاستیک، با کاهش تولید گلبولهای قرمز و دیگر سلولهای خونی مشخص میشود. در این موارد، CBC به همراه بررسی مغز استخوان از طریق بیوپسی و اسمیر مغز استخوان، اطلاعات جامع درباره میزان و کیفیت تولید سلولهای خونی ارائه میدهد. این تکنیکها به پزشکان امکان میدهند تا تمایز بین کمخونیهای ناشی از کمبود مواد مغذی و آنمیهای پروليفراتیو یا ناشی از بیماریهای مزمن را شناسایی کنند.
یکی از مهمترین اختلالات ژنتیکی گلبول قرمز، تالاسمی است که ناشی از نقص در سنتز زنجیرههای هموگلوبین است و میتواند به صورت خفیف تا شدید بروز کند. تشخیص تالاسمی شامل روشهای کلاسیک مانند بررسی مورفولوژی گلبولهای قرمز و CBC و تکنیکهای مولکولی پیشرفته مانند PCR و توالییابی ژنی است. در CBC، شاخصهای میکروسیتیک و هایپوکرومیک، به همراه افزایش RDW، به تشخیص اولیه کمک میکنند. آزمایشهای مولکولی دقیق، تغییرات ژنی خاص در زنجیرههای α یا β هموگلوبین را شناسایی میکنند و امکان برنامهریزی درمانی و مشاوره ژنتیک برای خانوادهها را فراهم میآورند.
اختلال دیگری که توجه ویژهای در تشخیص آزمایشگاهی میطلبد، بیماری سلول داسی شکل است. این بیماری ناشی از جهش نقطهای در ژن β-هموگلوبین است که باعث ایجاد هموگلوبین غیرطبیعی S میشود. تشخیص سلول داسی شکل از طریق اسمیر خون محیطی با رنگآمیزی اختصاصی، تستهای هموگلوبین الکتروفورز و تکنیکهای مولکولی مانند PCR انجام میشود. این تکنیکها نه تنها امکان شناسایی افراد مبتلا و ناقل را فراهم میکنند، بلکه برای پایش پیشرفت بیماری و برنامهریزی درمان، مانند مدیریت درد، پیشگیری از عوارض و ارزیابی اثربخشی داروها نیز ضروری هستند.
علاوه بر روشهای کلاسیک، تکنیکهای جدیدتر و پیشرفته مانند دستگاههای Lab-on-paper، حسگرهای نانو و بیومارکرهای خون، تشخیص سریع و حساس اختلالات گلبول قرمز را ممکن ساختهاند. این فناوریها، که در مقالات اخیر به آنها پرداخته شده است، میتوانند در محیطهای با منابع محدود نیز کاربرد داشته باشند و امکان غربالگری سریع جمعیتهای پرخطر را فراهم کنند.
یکی دیگر از جنبههای حیاتی در تشخیص اختلالات گلبول قرمز، تحلیل همزمان چند پارامتر خون و استفاده از الگوریتمهای هوش مصنوعی است. ترکیب دادههای CBC، پارامترهای بیوشیمیایی و اطلاعات مولکولی، الگوریتمهای پیشرفته قادر به ارائه یک تصویر جامع از وضعیت سلولهای قرمز خون هستند و میتوانند به پیشبینی روند بیماری و شناسایی بیماران پرخطر کمک کنند. این رویکردها به ویژه در تشخیص آنمیهای پیچیده و اختلالات ترکیبی بسیار ارزشمند هستند.
در کنار تمامی این تکنیکها، استانداردسازی نمونهگیری، آمادهسازی و پردازش نمونهها از اهمیت بالایی برخوردار است. تغییرات دمایی، زمان تأخیر بین نمونهگیری و تحلیل، و استفاده از ضدانعقادهای مناسب میتواند تأثیر مستقیم بر نتایج داشته باشد. رعایت استانداردهای بینالمللی و پروتکلهای کنترل کیفیت، تضمین میکند که نتایج آزمایش قابل اعتماد و دقیق باشند و تصمیمات بالینی بر پایه دادههای صحیح اتخاذ شود.
به طور خلاصه، تشخیص آنمی و اختلالات گلبول قرمز نیازمند ترکیبی از روشهای پایهای و پیشرفته، از CBC و بررسی مورفولوژی گرفته تا تکنیکهای مولکولی و دستگاههای نوین است. این رویکرد جامع، امکان شناسایی دقیق نوع آنمی، تعیین علت زمینهای و پایش درمان را فراهم میکند و پایهای مطمئن برای مدیریت بالینی بیماران است.
تشخیص بیماریهای سفید سلول و نئوپلاسمهای خونی
بیماریهای سفید سلول و نئوپلاسمهای خونی، شامل مجموعهای از اختلالات هستند که در آنها تولید یا عملکرد گلبولهای سفید خون و سلولهای پیشساز مغز استخوان مختل میشود. این اختلالات میتوانند مزمن یا حاد، اولیه یا ثانویه باشند و تشخیص دقیق آنها نیازمند استفاده از تکنیکهای آزمایشگاهی پیشرفته است. به دلیل پیچیدگی بالای این بیماریها، ترکیبی از روشهای پایهای، بیوشیمیایی، ایمونوفنوتیپی و مولکولی برای شناسایی و مدیریت آنها به کار میرود.
یکی از شایعترین نئوپلاسمهای خونی، لوکمیها هستند که شامل اختلالات مختلفی مانند لوکمی حاد لنفوبلاستیک، لوکمی حاد میلوئیدی، لوکمی مزمن لنفوسیتی و لوکمی مزمن میلوئیدی میشوند. CBC و بررسی مورفولوژی سلولهای سفید خون، اولین قدم در شناسایی لوکمیها است. افزایش غیرطبیعی تعداد لکوسیتها، وجود سلولهای نابالغ در گردش خون و تغییرات مورفولوژیکی، شاخصهایی اولیه برای تشخیص هستند. با این حال، بررسیهای پایهای به تنهایی نمیتوانند نوع دقیق لوکمی و برنامه درمانی مناسب را تعیین کنند.
برای تشخیص دقیقتر، تکنیکهای ایمونوفنوتیپی از طریق فلوسایتومتری استفاده میشوند. این روش، امکان شناسایی زیرگروههای مختلف سلولهای سفید خون بر اساس بیان آنتیژنها را فراهم میکند. به عنوان مثال، در لوکمی حاد لنفوبلاستیک، سلولهای نابالغ B یا T بر اساس مارکرهای CD19، CD20، CD3 و CD7 شناسایی میشوند. این تکنیکها نه تنها در تشخیص کمک میکنند، بلکه برای پایش پاسخ به درمان و پیشبینی عود بیماری نیز اهمیت دارند.
تکنیکهای مولکولی و ژنتیکی، ابزارهای کلیدی برای شناسایی جهشها و اختلالات کروموزومی در لوکمیها هستند. روشهایی مانند PCR، RT-PCR، FISH و توالییابی نسل جدید، جهشهای خاص ژنی و بازآراییهای کروموزومی را شناسایی میکنند. این اطلاعات برای تقسیمبندی بیماران به گروههای خطر و انتخاب درمان هدفمند حیاتی هستند. برای مثال، شناسایی جهش BCR-ABL در لوکمی مزمن میلوئیدی، تصمیمگیری برای استفاده از داروهای مهارکننده تیروزین کیناز را ممکن میسازد.
یکی دیگر از نئوپلاسمهای مهم خونی، میلوما یا اختلالات پلاسماسل است که با تکثیر غیرطبیعی سلولهای پلاسما در مغز استخوان و تولید ایمونوگلوبولینهای غیرطبیعی همراه است. CBC و بررسی هموگلوبین و هماتوکریت در این بیماران اغلب کاهش یافته است و کاهش پلاکتها نیز مشاهده میشود. آزمایش پروتئین سرم و ادرار برای شناسایی ایمونوگلوبولینهای مونوکلونال و الکتروفورز سرم، ابزارهای اصلی برای تشخیص و پایش میلوما هستند. در کنار اینها، تکنیکهای بیوپسی مغز استخوان و فلوسایتومتری، ارزیابی درصد سلولهای پلاسما و بررسی مارکرهای سطحی CD38 و CD138 را ممکن میسازند.
تشخیص نئوپلاسمهای خونی همچنین نیازمند ارزیابی شاخصهای التهابی و بیومارکرهای سیستمیک است. نسبتهای لکوسیتی، سطح سیتوکینها و پروتئینهای حاد التهابی میتوانند اطلاعات ارزشمندی درباره شدت بیماری و پاسخ به درمان ارائه دهند. در برخی تحقیقات اخیر، استفاده از الگوریتمهای هوش مصنوعی و یادگیری ماشین برای تحلیل ترکیبی دادههای CBC، بیوشیمی و مولکولی، امکان پیشبینی دقیقتر روند بیماری و شناسایی بیماران پرخطر را فراهم کرده است.
در کنار روشهای فوق، تصویربرداری و تکنیکهای آزمایشگاهی تکمیلی نیز به تشخیص کمک میکنند. بررسی کبد، طحال و غدد لنفاوی از طریق سونوگرافی یا MRI، به همراه آزمایشهای تکمیلی بیوشیمیایی، اطلاعات مهمی درباره انتشار بیماری و وضعیت عمومی بیمار ارائه میدهند. این ارزیابیها به ویژه در نئوپلاسمهای مزمن و بیماریهای با پیشرفت آهسته، مانند لوکمی مزمن و میلوما، اهمیت دارند.
استانداردسازی و کنترل کیفیت در تشخیص نئوپلاسمهای خونی از اهمیت حیاتی برخوردار است. نمونهگیری صحیح، آمادهسازی دقیق، انتخاب آنتیبادیهای مناسب و رعایت پروتکلهای کنترل کیفیت، تضمین میکنند که نتایج آزمایشها قابل اعتماد و دقیق باشند. هرگونه خطا در این مراحل میتواند منجر به تشخیص نادرست و تصمیمگیری اشتباه بالینی شود.
به طور خلاصه، تشخیص بیماریهای سفید سلول و نئوپلاسمهای خونی نیازمند یک رویکرد جامع و چندسطحی است که شامل تکنیکهای پایهای CBC و مورفولوژی، تکنیکهای ایمونوفنوتیپی، روشهای مولکولی و ژنتیکی، آزمایشهای بیوشیمیایی و کنترل کیفیت دقیق نمونهها است. ترکیب این روشها، امکان تشخیص دقیق، پایش درمان و پیشبینی روند بیماری را فراهم میکند و پایهای محکم برای مدیریت بالینی بیماران است.
تشخیص اختلالات پلاکتی و عملکرد پلاکت
پلاکتها، سلولهای کوچک و بیهستهای خون، نقش حیاتی در انعقاد خون، پیشگیری از خونریزی و ترمیم عروق آسیبدیده دارند. هرگونه اختلال در تعداد یا عملکرد پلاکتها میتواند منجر به مشکلات خونریزیدهنده یا افزایش خطر ترومبوز شود. بنابراین، ارزیابی دقیق پلاکتها، از جمله شمارش، مورفولوژی و عملکرد آنها، یکی از اجزای حیاتی تشخیص آزمایشگاهی است.
شمارش پلاکتها، اولین گام در بررسی اختلالات پلاکتی است. کاهش پلاکتها، که به عنوان ترومبوسیتوپنی شناخته میشود، میتواند ناشی از تولید ناکافی پلاکت در مغز استخوان، تخریب بیش از حد پلاکتها یا تجمع آنها در طحال باشد. افزایش پلاکتها، یا ترومبوسیتوز، ممکن است در شرایط التهابی، عفونتها، اختلالات نئوپلاسمی یا به صورت اولیه رخ دهد. CBC معمولی اطلاعات اولیه درباره تعداد پلاکتها ارائه میدهد، اما برای ارزیابی عملکرد آنها، تکنیکهای تخصصیتر مورد نیاز است.
یکی از مهمترین روشها برای بررسی عملکرد پلاکت، تست تجمع پلاکتی یا Platelet Aggregometry است. این تکنیک بر اساس توانایی پلاکتها در تجمع و ایجاد خوشه در حضور عوامل فعالکننده مانند آدنوزین دیفسفات (ADP)، اپینفرین یا رستونین انجام میشود. الگوی تجمع پلاکت میتواند نوع اختلال عملکردی را مشخص کند. برای مثال، در بیماریهایی مانند هموفیلی پلاکتی یا اختلالات وراثتی مانند بیماری برل (Bernard-Soulier) و تالاسمی، الگوی تجمع پلاکت تغییر میکند و میتوان با تحلیل منحنیهای حاصل، نقص عملکردی پلاکتها را شناسایی کرد.
علاوه بر aggregometry، تکنیکهای مدرن مانند فلوسایتومتری پلاکتی امکان بررسی دقیق مارکرهای سطحی پلاکتها و فعالیت آنها را فراهم میکنند. مارکرهایی مانند CD41، CD61 و CD62P میتوانند فعال شدن پلاکتها و پاسخ آنها به تحریکات مختلف را نشان دهند. این روشها به ویژه در بررسی اختلالات پیچیده عملکردی یا بیماریهای مزمن، که تجمع پلاکتها ممکن است نرمال باشد اما عملکرد آنها مختل است، اهمیت دارند.
آزمایشهای بیوشیمیایی و مولکولی نیز نقش تکمیلی در تشخیص اختلالات پلاکتی دارند. برای مثال، بررسی سطح ترومبوپویئتین، فاکتورهای انعقادی و پروتئینهای تنظیمکننده عملکرد پلاکت، اطلاعات ارزشمندی درباره علل ترومبوسیتوپنی یا ترومبوسیتوز ارائه میدهد. در بیماریهای ارثی مانند هموفیلی A یا B و سندرمهای اختلال عملکرد پلاکتی، تحلیل ژنتیکی میتواند جهشهای مرتبط با پروتئینهای پلاکت را شناسایی کند و به تشخیص قطعی کمک کند.
یکی دیگر از جنبههای حیاتی، ارزیابی پلاکتها در شرایط بالینی خاص است. بیماران تحت درمان با داروهای ضدانعقادی یا آنتیپلاکت، مانند آسپرین یا کلوپیدوگرل، نیاز به پایش دقیق عملکرد پلاکت دارند تا از وقوع عوارض خونریزی یا ترومبوز جلوگیری شود. تکنیکهای آزمایشگاهی میتوانند اثر داروها را بر تجمع و فعال شدن پلاکتها اندازهگیری کنند و دوز درمانی بهینه را تعیین نمایند.
تکنولوژیهای نوین و دستگاههای پیشرفته، مانند سنسورهای نانو و Lab-on-chip برای بررسی عملکرد پلاکت، امکان تشخیص سریع و حساس اختلالات را فراهم کردهاند. این دستگاهها میتوانند حجم نمونه بسیار کم، دقت بالا و پاسخ سریع ارائه دهند، که برای محیطهای بالینی و اورژانس اهمیت ویژهای دارد.
استانداردسازی و کنترل کیفیت در بررسی پلاکتها نیز اهمیت بسیار بالایی دارد. پلاکتها به سرعت فعال میشوند و تغییرات دما، زمان تأخیر بین نمونهگیری و تحلیل و استفاده از ضدانعقاد مناسب میتواند بر نتایج تأثیر بگذارد. رعایت دقیق پروتکلهای استاندارد، تضمین میکند که نتایج آزمایشها دقیق و قابل اعتماد باشند و تصمیمات درمانی بر اساس دادههای صحیح اتخاذ شود.
به طور خلاصه، تشخیص اختلالات پلاکتی و بررسی عملکرد آنها نیازمند یک رویکرد جامع و چندسطحی است که شامل شمارش پایه، ارزیابی مورفولوژی، تستهای تجمع و فلوسایتومتری، آزمایشهای بیوشیمیایی و مولکولی و رعایت استانداردهای کنترل کیفیت میشود. این روشها امکان تشخیص دقیق، مدیریت بالینی موثر و پایش درمان بیماران با اختلالات پلاکتی را فراهم میکنند و پایهای محکم برای تصمیمگیریهای درمانی بالینی فراهم میآورند.
تشخیص عفونتها از طریق آزمایش خون
تشخیص سریع و دقیق عفونتها یکی از چالشهای اصلی پزشکی بالینی است، زیرا درمان به موقع میتواند از پیشرفت بیماری و بروز عوارض جدی جلوگیری کند. خون، به عنوان یکی از نمونههای اصلی تشخیصی، اطلاعات ارزشمندی درباره حضور پاتوژنها و پاسخ ایمنی میزبان ارائه میدهد. آزمایشهای خون به طور سنتی برای شناسایی باکتریها، ویروسها و قارچها مورد استفاده قرار میگیرند و با پیشرفت تکنولوژی، روشهای جدیدی مانند PCR، توالییابی و دستگاههای Lab-on-chip، دقت و سرعت تشخیص را افزایش دادهاند.
یکی از تکنیکهای اصلی در شناسایی عفونتهای باکتریایی، کشت خون یا Blood Culture است. این روش، که استاندارد طلایی تشخیص باکتریمی و سپسیس به شمار میرود، امکان رشد و شناسایی باکتریها و قارچها را از نمونه خون فراهم میکند. در این روش، خون به محیطهای کشت مناسب منتقل میشود و پس از رشد میکروبها، شناسایی گونهای و تعیین حساسیت به آنتیبیوتیکها انجام میشود. تکنیکهای مدرن، استفاده از سیستمهای اتوماتیک و شاخصهای نوری برای شناسایی سریعتر رشد باکتریها را ممکن ساختهاند و زمان تشخیص را از چند روز به چند ساعت کاهش دادهاند.
در کنار کشت، تکنیکهای مولکولی مانند PCR و droplet digital PCR امکان شناسایی مستقیم DNA یا RNA پاتوژنها را بدون نیاز به رشد آنها فراهم میکنند. این روشها به ویژه در عفونتهای باکتریایی یا ویروسی با بار پاتوژن کم، یا زمانی که نمونهگیری دیر انجام شده است، اهمیت دارند. PCR میتواند حضور ژنهای اختصاصی باکتریها، ویروسها یا قارچها را شناسایی کند و حساسیت و اختصاصیت بالایی دارد. روش droplet digital PCR، با تفکیک نمونه به هزاران قطره کوچک، امکان شمارش دقیق نسخههای ژن پاتوژن را فراهم میکند و به عنوان یک ابزار کمی برای پایش عفونت و پاسخ به درمان مورد استفاده قرار میگیرد.
شناسایی عفونتهای ویروسی نیز از طریق آزمایش خون به روشهای مختلف انجام میشود. در ابتدا، بررسی شاخصهای ایمنی و حضور آنتیبادیهای اختصاصی علیه ویروسها اطلاعات اولیه را فراهم میکند. برای مثال، در تشخیص عفونتهای ویروسی شایع مانند HIV، هپاتیت و SARS-CoV-2، تعیین سطح آنتیبادیها و آنتیژنها به تشخیص قطعی کمک میکند. علاوه بر این، تکنیکهای مولکولی مانند RT-PCR امکان شناسایی RNA ویروسها را فراهم میآورند و حساسیت بسیار بالایی دارند. در موارد اورژانسی و اپیدمیها، RT-PCR سریعترین و دقیقترین روش برای شناسایی بیماران آلوده و کنترل شیوع است.
تشخیص عفونتهای قارچی مانند هیستوپلاسموز، موکورمایکوز و کاندیدیاز نیز اهمیت ویژهای دارد، زیرا این عفونتها میتوانند شدید و تهدیدکننده زندگی باشند. روشهای سنتی شامل کشت قارچ و بررسی مورفولوژی است، اما تکنیکهای مدرن مانند MALDI-TOF MS و PCR امکان شناسایی سریع گونههای قارچی را فراهم میکنند. MALDI-TOF MS بر اساس الگوهای پروتئینی پاتوژنها عمل میکند و زمان تشخیص را به حداقل میرساند. این تکنیک در ترکیب با PCR و آزمایشهای سرمی، حساسیت و دقت تشخیص را به طور چشمگیری افزایش میدهد.
علاوه بر شناسایی مستقیم پاتوژنها، تحلیل پاسخ ایمنی میزبان نیز در تشخیص عفونتها کاربرد دارد. بررسی سطح لکوسیتها، نسبت نوتروفیل به لنفوسیت، سیتوکینها و پروتئینهای فاز حاد، اطلاعات ارزشمندی درباره شدت عفونت و نوع پاتوژن ارائه میکند. به عنوان مثال، افزایش نوتروفیلها معمولاً با عفونتهای باکتریایی حاد مرتبط است، در حالی که افزایش لنفوسیتها میتواند نشانه عفونتهای ویروسی باشد. این اطلاعات به پزشکان کمک میکند تا تصمیمات درمانی اولیه را سریعتر اتخاذ کنند.
در سالهای اخیر، دستگاههای Lab-on-paper و حسگرهای نانو امکان تشخیص سریع و دقیق عفونتها را در محیطهای با منابع محدود فراهم کردهاند. این فناوریها میتوانند با حجم نمونه کم و زمان پاسخ کوتاه، حضور پاتوژنها را شناسایی کنند و برای غربالگری سریع جمعیتهای پرخطر و محیطهای اورژانسی بسیار مفید هستند.
استانداردسازی نمونهگیری و پردازش نمونهها نیز در تشخیص عفونتها اهمیت بالایی دارد. تأخیر در انتقال نمونه، شرایط نگهداری نامناسب و استفاده نادرست از ضدانعقادها میتواند منجر به کاهش زنده ماندن پاتوژنها یا تخریب RNA/DNA شود و نتایج آزمایشها را تحت تأثیر قرار دهد. رعایت دقیق پروتکلها، استفاده از لولهها و محیطهای کشت مناسب و کنترل کیفیت در تمام مراحل، دقت و قابلیت اطمینان نتایج را تضمین میکند.
به طور خلاصه، تشخیص عفونتها از طریق آزمایش خون نیازمند ترکیبی از روشهای پایهای و پیشرفته است که شامل کشت خون، تستهای بیوشیمیایی و سرمی، تکنیکهای مولکولی و ژنتیکی، MALDI-TOF MS، تحلیل پاسخ ایمنی میزبان و دستگاههای نوین Lab-on-chip میشود. این رویکرد جامع امکان شناسایی سریع و دقیق پاتوژنها، ارزیابی شدت عفونت و پایش درمان را فراهم میکند و پایهای محکم برای مدیریت بالینی بیماران مبتلا به عفونتها ایجاد میکند.
نقش تکنولوژیهای نوین و دستگاههای آزمایشگاهی پیشرفته
پیشرفتهای فناوری در دهههای اخیر باعث تحولی اساسی در تشخیص آزمایشگاهی بیماریهای خونی شده است. دستگاهها و تکنولوژیهای نوین، امکان شناسایی سریعتر، دقیقتر و کمهزینهتر انواع اختلالات خون را فراهم میکنند. این فناوریها نه تنها کارایی آزمایشها را افزایش دادهاند، بلکه نقش مهمی در پایش درمان، پیشبینی روند بیماری و ارائه مراقبت شخصیسازیشده دارند.
یکی از مهمترین حوزهها، دستگاههای Lab-on-chip و Lab-on-paper است. این دستگاهها، که بر اساس میکروفلوئیدیک و حسگرهای نانو طراحی شدهاند، میتوانند آزمایشهای پیچیده را با حجم نمونه کم و زمان کوتاه انجام دهند. Lab-on-chip قادر است ترکیبی از تکنیکهای مختلف را روی یک تراشه کوچک انجام دهد، مانند شمارش سلولهای خونی، شناسایی پاتوژنها و اندازهگیری بیومارکرها. این تکنولوژی به ویژه در محیطهای با منابع محدود، اورژانسها و مناطق دورافتاده اهمیت دارد و امکان غربالگری سریع جمعیتهای پرخطر را فراهم میکند.
فلوسایتومتری پیشرفته نیز نقش بسیار مهمی در تشخیص بیماریهای خونی ایفا میکند. این دستگاه امکان بررسی چندین پارامتر سلولی به صورت همزمان را فراهم میکند، مانند تعداد و زیرگروههای گلبولهای سفید، فعال شدن پلاکتها، سطح مارکرهای سطحی و سایر خصوصیات سلولی. فلوسایتومتری پیشرفته، در ترکیب با آنتیبادیهای اختصاصی و نرمافزارهای تحلیل داده، قادر به ارائه تصویری جامع و دقیق از وضعیت سلولها است. این تکنولوژی به ویژه در تشخیص لوکمیها، نئوپلاسمهای خونی و اختلالات ایمنی کاربرد دارد.
یکی دیگر از فناوریهای تحولآفرین، توالییابی نسل جدید (NGS) و روشهای مولکولی پیشرفته است. این تکنیکها قادرند جهشها، بازآراییهای کروموزومی و تغییرات ژنتیکی کوچک را با دقت بالا شناسایی کنند. برای مثال، در اختلالات ژنتیکی خون، شناسایی جهشهای مرتبط با تالاسمی، بیماری سلول داسی شکل و هموفیلی، امکان ارائه مشاوره ژنتیک، برنامهریزی درمان و پیشبینی عود بیماری را فراهم میکند. NGS همچنین در تشخیص عفونتها با بار ژنتیکی کم یا پاتوژنهای ناشناخته کاربرد دارد و اطلاعاتی جامع درباره تنوع ژنتیکی و مقاومت دارویی ارائه میدهد.
تکنیکهای طیفسنجی و MALDI-TOF MS نیز در تشخیص سریع پاتوژنها و پروتئینهای غیرطبیعی در خون اهمیت دارند. MALDI-TOF MS با تحلیل الگوهای پروتئینی و شناسایی سریع گونههای باکتریایی، قارچی و حتی ویروسی، زمان تشخیص را به حداقل میرساند. این روش در ترکیب با تکنیکهای مولکولی، دقت تشخیص و انتخاب درمان مناسب را به طور قابل توجهی افزایش میدهد.
بیومارکرهای خون و فناوریهای مبتنی بر نانو و سنسورهای هوشمند، یکی دیگر از ابزارهای نوین تشخیصی هستند. این تکنولوژیها قادرند تغییرات میکروسکوپی در مولکولها و سلولها را شناسایی کنند و اطلاعات دقیقی درباره شروع بیماری، شدت و پاسخ به درمان ارائه دهند. بیومارکرها، به ویژه در تشخیص زودهنگام سرطان خون، بیماریهای التهابی و اختلالات انعقادی، اهمیت حیاتی دارند و میتوانند پایهای برای پزشکی شخصیسازیشده باشند.
هوش مصنوعی و الگوریتمهای یادگیری ماشین در تجزیه و تحلیل دادههای آزمایشگاهی نقش افزایندهای دارند. ترکیب دادههای CBC، فلوسایتومتری، نتایج مولکولی و بیومارکرها با الگوریتمهای پیشرفته، امکان پیشبینی روند بیماری، شناسایی بیماران پرخطر و پیشنهاد درمان هدفمند را فراهم میکند. این رویکرد، دقت تشخیص را بهبود میبخشد و از خطاهای انسانی در تحلیل دادههای پیچیده جلوگیری میکند.
علاوه بر این، اتوماسیون و سیستمهای روباتیک آزمایشگاهی، سرعت و دقت انجام آزمایشها را افزایش دادهاند. از نمونهگیری تا پردازش و تحلیل دادهها، اتوماسیون باعث کاهش خطا، استانداردسازی نتایج و افزایش توان عملیاتی آزمایشگاهها میشود. این سیستمها به ویژه در آزمایشگاههای بالینی بزرگ و محیطهای پرخطر مانند واحدهای ICU و مراکز اپیدمی اهمیت دارند.
استانداردسازی، کنترل کیفیت و تطابق با پروتکلهای بینالمللی، بخش جداییناپذیر از کاربرد فناوریهای نوین است. تکنولوژیهای پیشرفته، اگرچه قابلیتهای بالایی دارند، اما بدون رعایت استانداردها و کنترل کیفیت، امکان بروز خطاهای سیستماتیک وجود دارد. بنابراین، آموزش کارشناسان، پیروی از پروتکلها و پایش مداوم کیفیت نمونهها، ابزارها و دادهها، پایه اطمینان از نتایج دقیق و قابل اعتماد است.
به طور خلاصه، تکنولوژیهای نوین و دستگاههای آزمایشگاهی پیشرفته شامل Lab-on-chip، فلوسایتومتری، NGS، MALDI-TOF MS، بیومارکرهای خون، حسگرهای نانو، هوش مصنوعی و اتوماسیون روباتیک، انقلابی در تشخیص بیماریهای خونی ایجاد کردهاند. این فناوریها امکان تشخیص سریع، دقیق و کمهزینه، پایش درمان و پیشبینی روند بیماری را فراهم میکنند و پایهای مطمئن برای تصمیمگیریهای بالینی و ارائه مراقبت شخصیسازیشده ایجاد مینمایند.
استانداردسازی و کنترل کیفیت در آزمایشگاههای خون
در آزمایشگاههای خون، دقت و صحت نتایج از اهمیت حیاتی برخوردار است، زیرا تصمیمات بالینی و درمانی بیماران مستقیماً بر اساس این دادهها اتخاذ میشود. هرگونه خطا در نمونهگیری، پردازش، تحلیل و گزارش نتایج میتواند منجر به تشخیص نادرست، درمان اشتباه و حتی تهدید جان بیمار شود. به همین دلیل، استانداردسازی روشها و کنترل کیفیت مداوم به عنوان ستون فقرات هر آزمایشگاه خون عمل میکند.
یکی از نخستین مراحل در استانداردسازی، نمونهگیری صحیح و آمادهسازی نمونهها است. انتخاب لوله مناسب، استفاده از ضدانعقاد صحیح، رعایت حجم نمونه، برچسبگذاری دقیق و انتقال سریع نمونه به آزمایشگاه، از نکات حیاتی هستند. هرگونه تاخیر، نوسان دما یا اختلال در مخلوط شدن نمونه با ضدانعقاد، میتواند باعث لیز گلبولها، تغییر میزان پلاکتها یا تخریب RNA/DNA شود و دقت نتایج را کاهش دهد.
کنترل کیفیت داخلی (Internal Quality Control – IQC) بخش دیگری از استانداردسازی است که شامل استفاده از نمونههای کنترلی شناختهشده در هر دسته از آزمایشها میشود. این نمونهها امکان پایش عملکرد روزانه دستگاهها و تکنسینها را فراهم میکنند. برای مثال، در شمارش CBC، استفاده از نمونههای استاندارد با میزان شناختهشده گلبولهای قرمز، سفید و پلاکت، دقت دستگاههای هماتولوژی را تضمین میکند و نوسانات سیستماتیک یا خطاهای تصادفی را شناسایی مینماید.
علاوه بر IQC، کنترل کیفیت خارجی (External Quality Assessment – EQA) یا آزمونهای اعتبارسنجی بین آزمایشگاهی نیز اهمیت زیادی دارد. در این روش، نمونههایی با خصوصیات ناشناخته به چندین آزمایشگاه ارسال میشوند و نتایج حاصل مقایسه میشود. این فرآیند باعث شناسایی ناهماهنگیها، بهبود روشها و همسانسازی نتایج بین آزمایشگاهها میشود. EQA به ویژه در آزمایشگاههایی که روشهای پیچیده مولکولی، فلوسایتومتری یا MALDI-TOF MS را اجرا میکنند، اهمیت حیاتی دارد.
استانداردسازی روشها و پروتکلها، شامل انتخاب روشهای تاییدشده، آموزش کارکنان، تعیین شرایط محیطی مناسب و نگهداری دستگاهها است. برای نمونه، دما، رطوبت و فشار محیط میتوانند بر عملکرد حسگرها و دستگاههای نانو و میکروفلوئیدیک تأثیر بگذارند. استانداردسازی این شرایط محیطی، تضمین میکند که نتایج آزمایشها تکرارپذیر و قابل اعتماد باشند.
در کنار اینها، اتوماسیون و نرمافزارهای مدیریت آزمایشگاه نقش مهمی در کنترل کیفیت دارند. این سیستمها، دادههای خام را پردازش و تحلیل میکنند، خطاهای انسانی در ثبت و محاسبه را کاهش میدهند و امکان ردیابی کامل نمونهها از زمان دریافت تا گزارش نهایی را فراهم میآورند. همچنین نرمافزارهای هوشمند میتوانند تغییرات روزانه دستگاهها و روندهای عملکردی را پایش کنند و هشدارهای پیشگیرانه برای جلوگیری از خطا صادر نمایند.
اهمیت آموزش مداوم و ارتقای مهارتهای کارکنان نیز غیرقابل انکار است. کارکنان آزمایشگاه باید با آخرین استانداردها، تکنیکهای نوین و پروتکلهای کنترل کیفیت آشنا باشند. آموزش منظم و ارزیابی مهارتها، تضمین میکند که خطاهای انسانی کاهش یابد و نتایج آزمایشها همواره با بالاترین دقت ارائه شوند.
در نهایت، مستندسازی و نگهداری سوابق کیفیت به عنوان بخش پایانی چرخه کنترل کیفیت اهمیت دارد. ثبت دقیق نتایج IQC، EQA، تعمیرات دستگاهها، تغییرات پروتکلها و گزارشهای خطا، امکان بررسی روند کیفیت، شناسایی مشکلات سیستماتیک و ارائه راهکارهای اصلاحی را فراهم میکند. این مستندسازی همچنین برای اعتبارسنجی آزمایشگاهها و رعایت استانداردهای بینالمللی الزامی است.
به طور خلاصه، استانداردسازی و کنترل کیفیت در آزمایشگاههای خون شامل مجموعهای از اقدامات یکپارچه است که از نمونهگیری صحیح، استفاده از کنترلهای داخلی و خارجی، استانداردسازی روشها، اتوماسیون و نرمافزارهای مدیریت، آموزش مستمر کارکنان و مستندسازی دقیق تشکیل شده است. رعایت این اصول، پایهای محکم برای تولید نتایج دقیق، قابل اعتماد و قابل تکرار فراهم میآورد و تضمین میکند که تصمیمات بالینی و درمانی بیماران بر اساس دادههای درست اتخاذ شود.
چالشها و محدودیتهای تکنیکهای موجود
تشخیص آزمایشگاهی بیماریهای خونی با وجود پیشرفتهای چشمگیر تکنولوژی، همچنان با چالشها و محدودیتهای متعددی مواجه است که میتواند دقت، سرعت و قابلیت اعتماد نتایج را تحت تأثیر قرار دهد. آگاهی از این محدودیتها، اولین گام برای بهبود فرآیندها و ارتقای کیفیت خدمات آزمایشگاهی است.
یکی از مهمترین چالشها، خطاهای نمونهگیری و پیشتحلیلی است. بسیاری از اختلالات در نتیجه آزمایش ممکن است ناشی از مشکلات مربوط به جمعآوری، نگهداری و انتقال نمونهها باشد. تغییرات دما، تاخیر در انتقال، استفاده از ضدانعقاد نامناسب و اشتباهات در برچسبگذاری میتواند باعث لیز گلبولها، فعال شدن پلاکتها یا تخریب RNA/DNA شود. این نوع خطاها اغلب قبل از ورود نمونه به دستگاههای پیشرفته رخ میدهند و حتی پیشرفتهترین تکنولوژیها نیز نمیتوانند آنها را جبران کنند.
محدودیتهای مرتبط با دقت و حساسیت تکنیکها نیز چالش مهمی محسوب میشوند. برای مثال، کشت خون، اگرچه استاندارد طلایی تشخیص عفونتهای باکتریایی است، اما نیازمند زمان طولانی برای رشد میکروبهاست و در برخی موارد باکتریها یا قارچهای کمرشد ممکن است شناسایی نشوند. تکنیکهای مولکولی مانند PCR و RT-PCR حساسیت بالایی دارند، اما حضور مواد مهارکننده، کیفیت پایین نمونه یا جهشهای ژنتیکی پاتوژن میتواند باعث نتایج منفی کاذب شود.
یکی دیگر از محدودیتها، هزینه و دسترسی به تجهیزات پیشرفته است. دستگاههایی مانند فلوسایتومترهای چندپارامتری، MALDI-TOF MS و سیستمهای NGS، سرمایهگذاری بالایی نیاز دارند و برای بسیاری از آزمایشگاهها در مناطق کممنبع قابل دسترس نیستند. علاوه بر هزینه خرید، نگهداری، تعمیرات و آموزش کارکنان برای استفاده مؤثر از این تجهیزات نیز هزینهبر است. این محدودیت باعث میشود که بسیاری از مراکز بالینی هنوز به تکنیکهای سنتی و با دقت کمتر متکی باشند.
پیچیدگی تحلیل دادهها و نیاز به نیروی متخصص نیز یک چالش مهم است. تکنیکهای مدرن آزمایشگاهی، حجم بالایی از دادههای پیچیده تولید میکنند که برای تحلیل صحیح، نیاز به نرمافزارهای پیشرفته و کارشناسان ماهر دارد. خطا در تحلیل دادهها میتواند منجر به تشخیص اشتباه، درمان نادرست و پیامدهای بالینی جدی شود. همچنین، نبود استانداردهای جهانی یکپارچه برای تحلیل دادههای مولکولی و بیومارکری، مشکلات هماهنگی و تفسیر نتایج بین آزمایشگاهها را ایجاد میکند.
چالشهای مرتبط با تکرارپذیری و استانداردسازی نیز از محدودیتهای مهم تکنیکهای موجود است. بسیاری از تکنیکهای پیشرفته، حساس به شرایط محیطی، اپراتور و کیفیت مواد شیمیایی هستند. حتی تغییرات جزئی در پروتکلها، دما، زمان انکوباسیون یا حجم نمونه میتواند نتایج متفاوتی ایجاد کند. این مسأله در مطالعات چندمرکزی و مقایسه نتایج بین آزمایشگاهها اهمیت ویژهای دارد و نیازمند استانداردسازی دقیق و آموزش مستمر است.
مشکلات مربوط به نمونههای خاص و بیماران خاص نیز محدودیت ایجاد میکند. بیماران مبتلا به بیماریهای مزمن، نقص ایمنی، کمخونی شدید یا اختلالات انعقادی، اغلب نمونههای خون آنها غیرمعمول و چالشبرانگیز است. حجم کم خون، حضور مواد مهارکننده یا ترکیبات غیرطبیعی میتواند دقت آزمایشها را کاهش دهد و نیاز به تکنیکهای خاص یا روشهای تقویتکننده دارد.
محدودیتهای مرتبط با زمان پاسخدهی نیز یک چالش بالینی مهم است. بسیاری از آزمایشها، مانند کشت خون یا تحلیلهای مولکولی پیچیده، نیازمند چند ساعت تا چند روز هستند، در حالی که در شرایط اورژانسی، تصمیمگیری سریع برای درمان حیاتی است. توسعه روشهای سریع، مانند Lab-on-chip و سنسورهای نانو، گرچه امیدوارکننده است، اما هنوز به طور گسترده در تمام آزمایشگاهها قابل اجرا نیست.
چالشهای اقتصادی و مدیریتی نیز نباید نادیده گرفته شود. بسیاری از مراکز آزمایشگاهی با محدودیت بودجه مواجه هستند و سرمایهگذاری در تکنولوژیهای پیشرفته و آموزش کارکنان، با فشارهای اقتصادی و محدودیتهای منابع همراه است. این مسأله میتواند باعث اتکا به تکنیکهای سنتی و کاهش دقت و سرعت تشخیص شود.
به طور خلاصه، چالشها و محدودیتهای تکنیکهای موجود شامل مشکلات پیشتحلیلی، محدودیتهای دقت و حساسیت، هزینه و دسترسی به تجهیزات، پیچیدگی تحلیل دادهها، مشکلات تکرارپذیری، نمونههای خاص بیماران، زمان پاسخدهی و محدودیتهای اقتصادی و مدیریتی است. شناخت دقیق این چالشها، گام اول برای بهبود روشها، توسعه فناوریهای نوین و ارتقای کیفیت خدمات آزمایشگاهی به شمار میرود و زمینهای برای نوآوریهای آینده در تشخیص بیماریهای خونی ایجاد میکند.
چشمانداز آینده تشخیص آزمایشگاهی بیماریهای خون
پیشرفتهای علمی و فناوری در زمینه تشخیص آزمایشگاهی بیماریهای خونی، چشمانداز امیدوارکنندهای را برای پزشکی بالینی ایجاد کردهاند. آینده این حوزه بر پایه توسعه روشهای سریع، دقیق، کمهزینه و شخصیسازیشده شکل میگیرد و هدف آن، ارائه تشخیص زودهنگام، پایش درمان و پیشبینی روند بیماری با دقت بالا است.
یکی از روندهای مهم، توسعه فناوریهای میکروفلوئیدیک و Lab-on-chip است. این دستگاهها قادرند آزمایشهای پیچیده را با حجم نمونه بسیار کم و در زمان کوتاه انجام دهند و ترکیبی از تکنیکهای مختلف، مانند شمارش سلولها، شناسایی پاتوژنها و سنجش بیومارکرها را روی یک تراشه کوچک ارائه کنند. پیشرفت در این حوزه، امکان تشخیص در محل (Point-of-Care) و در محیطهای با منابع محدود را فراهم میآورد و سرعت تصمیمگیری بالینی را به طور قابل توجهی افزایش میدهد.
توسعه بیومارکرهای خون و فناوریهای سنجش مولکولی پیشرفته نیز چشمانداز آینده را شکل میدهد. شناسایی بیومارکرهای اختصاصی برای انواع اختلالات خونی، سرطانهای خون و عفونتها، امکان تشخیص زودهنگام بیماریها و پایش دقیق پاسخ به درمان را فراهم میکند. فناوریهای مبتنی بر نانو، حسگرهای هوشمند و میکروسکوپهای پیشرفته، امکان اندازهگیری تغییرات مولکولی کوچک و روندهای پاتوفیزیولوژیک را در سطح سلولی فراهم میآورند. این رویکرد، پایهای برای پزشکی شخصیسازیشده و تصمیمگیری مبتنی بر دادههای دقیق ایجاد میکند.
هوش مصنوعی، یادگیری ماشین و الگوریتمهای پیشرفته تحلیل دادهها، نقش کلیدی در آینده تشخیص آزمایشگاهی دارند. ترکیب دادههای گسترده حاصل از CBC، فلوسایتومتری، نتایج مولکولی و بیومارکری با الگوریتمهای هوشمند، امکان پیشبینی روند بیماری، شناسایی بیماران پرخطر و ارائه درمان هدفمند را فراهم میکند. این تکنولوژی همچنین میتواند خطاهای انسانی در تحلیل دادههای پیچیده را کاهش دهد و روند تشخیص را سریعتر و دقیقتر کند.
توسعه روشهای مولکولی و ژنتیکی پیشرفته، مانند توالییابی نسل جدید (NGS)، droplet digital PCR و تحلیل اپیژنتیکی، امکان شناسایی جهشها، بازآراییهای کروموزومی و تغییرات ژنتیکی نادر را فراهم میآورد. این تکنیکها به ویژه در تشخیص بیماریهای ژنتیکی خونی، نئوپلاسمهای خونی و اختلالات انعقادی اهمیت دارند و پایهای برای مشاوره ژنتیک، مدیریت درمان و پیشبینی عود بیماری ایجاد میکنند.
اتوماسیون کامل آزمایشگاهها و سیستمهای روباتیک پیشرفته نیز از ارکان آینده تشخیص آزمایشگاهی است. این سیستمها، از نمونهگیری تا تحلیل داده و گزارش نهایی، فرآیندها را استانداردسازی و سرعت انجام آزمایشها را افزایش میدهند. همچنین امکان ردیابی دقیق نمونهها و کاهش خطاهای انسانی را فراهم میکنند و ظرفیت آزمایشگاهها برای پاسخ به حجم بالای نمونهها در شرایط اورژانسی یا اپیدمیها را تقویت میکنند.
تشخیص چندپارامتری و ترکیبی، یکی دیگر از روندهای آینده است که در آن دادههای بالینی، مولکولی و ایمنیشناسی با هم تلفیق میشوند تا تصویری جامع از وضعیت بیمار ارائه دهند. این رویکرد، امکان تصمیمگیری دقیقتر و انتخاب درمان مناسب را فراهم میکند و میتواند زمان تشخیص و درمان را کاهش دهد و اثربخشی مراقبتهای بالینی را افزایش دهد.
چالشهای اخلاقی و امنیت دادهها نیز بخشی از چشمانداز آینده هستند. با توسعه تکنولوژیهای پیشرفته و استفاده گسترده از دادههای ژنتیکی و بالینی، حفاظت از حریم خصوصی بیماران و اطمینان از استفاده اخلاقی از دادهها اهمیت پیدا میکند. توسعه استانداردهای بینالمللی برای مدیریت دادهها و قوانین حفاظت از حریم خصوصی، از الزامات ضروری آینده تشخیص آزمایشگاهی است.
در نهایت، ترکیب فناوریهای نوین، بیومارکرهای پیشرفته، هوش مصنوعی و اتوماسیون، چشمانداز آینده تشخیص آزمایشگاهی بیماریهای خون را شکل میدهد. این روندها امکان ارائه تشخیص سریع، دقیق، کمهزینه و شخصیسازیشده را فراهم میکنند و میتوانند محدودیتهای فعلی تکنیکها را برطرف کنند. انتظار میرود که در آینده نزدیک، آزمایشگاههای خون به مراکز هوشمند و متصل تبدیل شوند که قادر به ارائه اطلاعات دقیق و فوری برای مدیریت بالینی بیماران هستند و نقش کلیدی در بهبود نتایج درمان و سلامت جامعه ایفا میکنند.
نتیجهگیری
تشخیص آزمایشگاهی بیماریهای خونی، یکی از ارکان حیاتی مراقبتهای بالینی و تصمیمگیری درمانی است و پیشرفتهای اخیر در این حوزه، تحولی بنیادین در دقت، سرعت و کارایی فرآیندهای تشخیصی ایجاد کرده است. از بررسی تکنیکهای پایهای، مانند شمارش سلولهای خونی و آزمایشهای شیمیایی ساده، تا فناوریهای پیشرفته میکروفلوئیدیک، فلوسایتومتری، توالییابی نسل جدید و MALDI-TOF MS، مشخص شد که هر روش، نقش ویژه و مکملی در تشخیص انواع اختلالات خون، از کمخونیها و نئوپلاسمهای خونی تا اختلالات پلاکتی و عفونتها، ایفا میکند.
مروری بر چالشها و محدودیتها نشان داد که دقت آزمایشها تحت تأثیر عوامل پیشتحلیلی، کیفیت نمونهها، پیچیدگی تکنیکها، هزینه تجهیزات و مهارت کارکنان قرار دارد. همچنین، محدودیتهای زمان پاسخدهی، دسترسی به فناوریهای پیشرفته و تکرارپذیری نتایج، همچنان چالشهایی جدی در مسیر ارائه خدمات تشخیصی کامل و قابل اعتماد محسوب میشوند. این محدودیتها، ضرورت سرمایهگذاری در آموزش، استانداردسازی دقیق و توسعه فناوریهای نوین را دوچندان میکنند.
چشمانداز آینده تشخیص آزمایشگاهی نشان میدهد که ترکیب فناوریهای نوین، هوش مصنوعی، بیومارکرهای پیشرفته و اتوماسیون میتواند بسیاری از محدودیتهای فعلی را برطرف کند. Lab-on-chip، حسگرهای نانو، روشهای مولکولی پیشرفته و تحلیل دادههای چندپارامتری، امکان ارائه تشخیص سریع، دقیق، کمهزینه و شخصیسازیشده را فراهم میآورد و به توسعه پزشکی مبتنی بر داده و مراقبتهای شخصیسازیشده کمک میکند.
اهمیت استانداردسازی، کنترل کیفیت داخلی و خارجی، و آموزش مستمر کارکنان نیز در تمامی مراحل آزمایشگاهها برجسته است. رعایت دقیق پروتکلها، پایش مداوم کیفیت نمونهها و دستگاهها، و استفاده از نرمافزارهای مدیریت داده، پایهای محکم برای اطمینان از صحت و قابلیت اعتماد نتایج ایجاد میکند و تضمین میکند که تصمیمات بالینی بر اساس اطلاعات دقیق و قابل اعتماد اتخاذ شوند.
در نهایت، ادغام روشهای سنتی و پیشرفته، بهکارگیری فناوریهای نوین و رعایت استانداردهای بینالمللی، آیندهای روشن و امیدوارکننده برای تشخیص آزمایشگاهی بیماریهای خون رقم میزند. این مسیر، نه تنها باعث ارتقای کیفیت تشخیص میشود، بلکه امکان پایش دقیق روند بیماری، پیشبینی عوارض، بهینهسازی درمان و افزایش اثربخشی مراقبتهای بالینی را فراهم میآورد.
بنابراین، میتوان نتیجه گرفت که تشخیص آزمایشگاهی در حوزه خون، با ترکیب تکنیکهای متنوع، فناوریهای نوین و استانداردهای دقیق، نقش حیاتی در بهبود سلامت جامعه، کاهش خطاهای بالینی و ارتقای اثربخشی درمان دارد و در آینده نزدیک، با گسترش هوش مصنوعی و فناوریهای نوین، این حوزه به یکی از دقیقترین و مؤثرترین ابزارهای پزشکی بالینی تبدیل خواهد شد.