نقش ایمونوتراپی در درمان سرطانها
مقدمه
سرطان یکی از مهمترین چالشهای سلامت در جهان مدرن است و به عنوان یکی از اصلیترین علل مرگ و میر، بار سنگینی را بر سیستمهای بهداشتی و اقتصادی کشورها تحمیل میکند. با وجود پیشرفتهای چشمگیر در حوزههای تشخیص زودهنگام، جراحی، شیمیدرمانی و پرتودرمانی، بسیاری از سرطانها هنوز پاسخ کافی به درمانهای مرسوم نمیدهند و میزان عود و مقاومت دارویی در بیماران، مسئلهای چالشبرانگیز باقی مانده است. در این میان، ایمونوتراپی به عنوان یک روش نوین و امیدوارکننده، توجه محققان و پزشکان را به خود جلب کرده است و نقش مهمی در تغییر چشمانداز درمان سرطان دارد.
ایمونوتراپی بر پایه این اصل عمل میکند که سیستم ایمنی بدن قادر است سلولهای سرطانی را شناسایی و از بین ببرد، اما بسیاری از تومورها با ایجاد مکانیسمهای فرار ایمنی، این پاسخ طبیعی را سرکوب میکنند. این روش درمانی با هدف بازگرداندن یا تقویت توانایی سیستم ایمنی برای مقابله با سلولهای سرطانی توسعه یافته است و شامل طیف گستردهای از استراتژیها میشود؛ از مهارکنندههای ایمنی (Checkpoint Inhibitors) و درمانهای سلول T adoptive گرفته تا واکسنهای ضدسرطان و آنتیبادیهای منوکلونال. هر یک از این رویکردها با مکانیسم منحصر به فرد خود، تلاش میکنند پاسخ ایمنی بدن را علیه تومور افزایش دهند و اثربخشی درمانهای سنتی را بهبود بخشند.
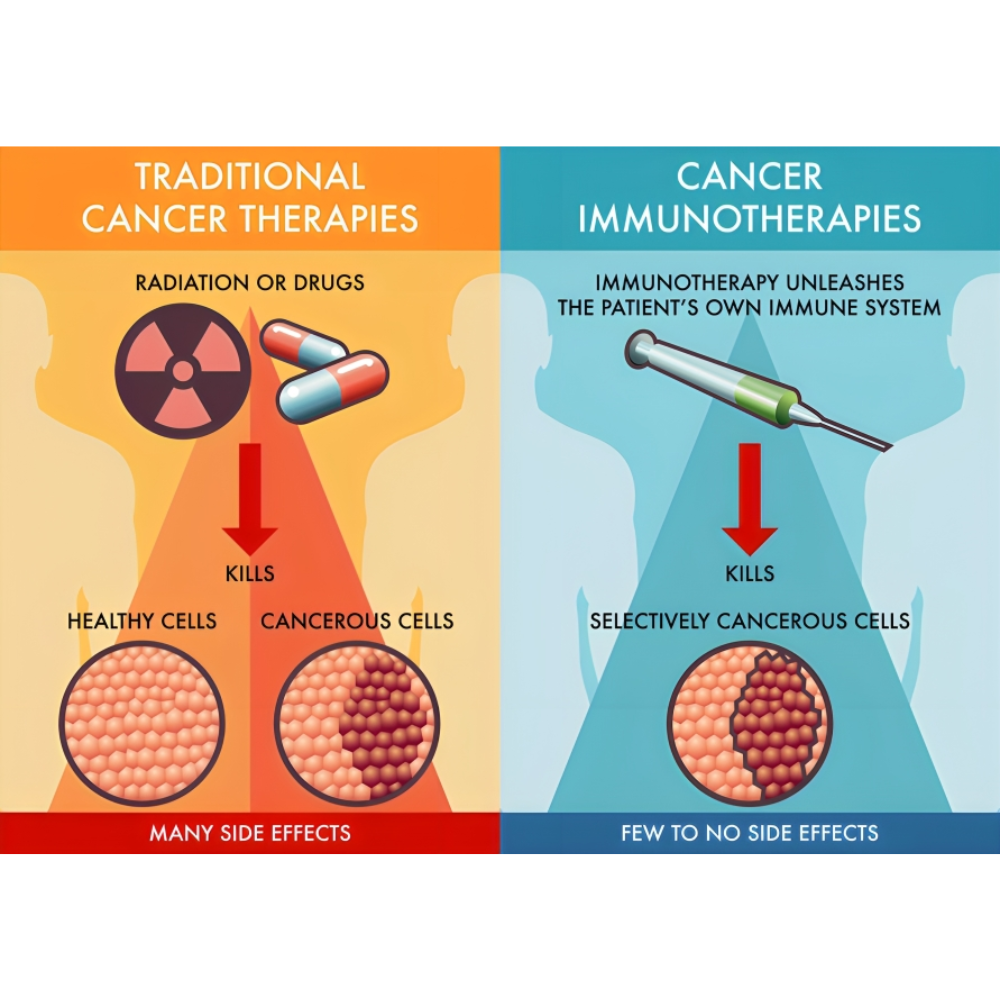
یکی از ویژگیهای برجسته ایمونوتراپی نسبت به درمانهای مرسوم، پایداری و حافظه ایمنی طولانیمدت است. در حالی که شیمیدرمانی و پرتودرمانی عمدتاً سلولهای سرطانی را به طور مستقیم از بین میبرند و ممکن است سلولهای سالم را نیز تحت تأثیر قرار دهند، ایمونوتراپی میتواند با فعالسازی سیستم ایمنی، پاسخ طولانیمدت ایجاد کند و حتی از بازگشت سرطان جلوگیری نماید. این ویژگی باعث شده است که ایمونوتراپی به ویژه در سرطانهای پیشرفته و مقاوم به درمانهای استاندارد، جایگاه ویژهای پیدا کند و به عنوان یک گزینه درمانی مکمل یا جایگزین مطرح شود.
با وجود تمام پیشرفتها، ایمونوتراپی با چالشهایی نیز همراه است. پاسخ بیماران به این روش بسیار متغیر است و عواملی مانند ویژگیهای ژنتیکی تومور، وضعیت سیستم ایمنی فرد و محیط میکروسکوپی تومور نقش مهمی در موفقیت درمان دارند. همچنین، برخی از بیماران ممکن است دچار عوارض جانبی جدی مانند سندرومهای التهابی سیستمیک و خودایمنی شوند که مدیریت این عوارض نیازمند دانش تخصصی و برنامهریزی دقیق درمان است.
هدف این مقاله، ارائه یک مرور جامع و بهروز بر ایمونوتراپی در درمان سرطانها است. در این مقاله، نه تنها مکانیسمها و انواع ایمونوتراپی به تفصیل بررسی خواهند شد، بلکه ترکیب ایمونوتراپی با سایر روشهای درمانی، محدودیتها و چالشهای بالینی، پیشرفتهای نوین و چشمانداز آینده نیز مورد بحث قرار میگیرد. این مرور جامع تلاش دارد پاسخ به تمام سوالات یک متخصص و علاقهمند به حوزه درمان سرطان را فراهم کند و تصویر کاملی از نقش کلیدی ایمونوتراپی در مدیریت سرطان ارائه دهد.
ایمونوتراپی چیست؟
ایمونوتراپی به عنوان یکی از پیشرفتهترین رویکردهای درمان سرطان، بر پایه تقویت یا بازگرداندن توانایی طبیعی سیستم ایمنی بدن برای مقابله با سلولهای سرطانی شکل گرفته است. برخلاف درمانهای سنتی مانند شیمیدرمانی یا پرتودرمانی که مستقیماً سلولهای سرطانی را هدف قرار میدهند، ایمونوتراپی تلاش میکند سیستم ایمنی بدن را بهعنوان یک سلاح هوشمند علیه سرطان فعال کند. این تفاوت بنیادین باعث شده است که ایمونوتراپی نه تنها سلولهای سرطانی را از بین ببرد، بلکه به ایجاد حافظه ایمنی در بدن کمک کند و مانع از بازگشت مجدد سرطان شود.
تعریف و اصول پایه ایمونوتراپی
در تعریف علمی، ایمونوتراپی شامل مجموعهای از روشها و داروها است که با هدف فعالسازی، تقویت یا بازسازی پاسخ ایمنی علیه تومور طراحی شدهاند. این پاسخ ایمنی میتواند شامل فعالسازی سلولهای T، B، و سلولهای NK (Natural Killer) باشد که به صورت طبیعی توانایی شناسایی و از بین بردن سلولهای غیرطبیعی را دارند. اصول پایه ایمونوتراپی بر چند محور کلیدی استوار است:
-
شناسایی سلولهای سرطانی: سیستم ایمنی باید قادر باشد تفاوت بین سلولهای طبیعی و سرطانی را تشخیص دهد. سلولهای سرطانی معمولاً آنتیژنهای خاصی را بیان میکنند که توسط سلولهای ایمنی قابل شناسایی هستند.
-
فعالسازی پاسخ ایمنی: حتی در صورتی که سلولهای ایمنی سلول سرطانی را شناسایی کنند، برخی تومورها با ترشح عوامل سرکوبگر یا تغییر محیط میکروسکوپی خود، پاسخ ایمنی را مهار میکنند. ایمونوتراپی تلاش میکند این سرکوب را خنثی کند و پاسخ قوی و مداوم ایجاد نماید.
-
ایجاد حافظه ایمنی طولانیمدت: یکی از ویژگیهای منحصربهفرد ایمونوتراپی، امکان ایجاد حافظه ایمنی در بدن است که اجازه میدهد سلولهای ایمنی در آینده نیز بتوانند سلولهای سرطانی را شناسایی و نابود کنند.
تاریخچه کوتاه ایمونوتراپی
ایده استفاده از سیستم ایمنی برای مقابله با سرطان، قدمتی طولانی دارد و به بیش از یک قرن پیش بازمیگردد. اولین مشاهدات بالینی در اواخر قرن نوزدهم نشان داد که برخی بیماران پس از عفونتهای ویروسی، رشد تومورهایشان کاهش مییابد، که این پدیده بعدها به عنوان پایهای برای توسعه ایمونوتراپی شناخته شد. در دهههای بعد، مطالعات پیشرفتهتر بر روی واکسنهای ضدسرطان و استفاده از آنتیبادیهای منوکلونال آغاز شد. با پیشرفتهای اخیر در بیوتکنولوژی و مهندسی ژنتیک، ایمونوتراپی توانسته است به یک روش استاندارد و موثر در برخی سرطانها مانند ملانومای پیشرفته و لنفومهای خاص تبدیل شود.
تفاوت ایمونوتراپی با درمانهای سنتی
مقایسه ایمونوتراپی با درمانهای مرسوم نشان میدهد که این روش چند مزیت اساسی دارد:
-
هدفگیری هوشمند: برخلاف شیمیدرمانی که اغلب سلولهای سالم را نیز تحت تاثیر قرار میدهد، ایمونوتراپی سلولهای سرطانی را به طور نسبی هدف قرار میدهد و آسیب به بافتهای سالم کمتر است.
-
پاسخ طولانیمدت و حافظه ایمنی: سیستم ایمنی فعال شده قادر است برای ماهها یا حتی سالها سلولهای سرطانی را کنترل کند و از بازگشت مجدد سرطان جلوگیری نماید.
-
قابلیت ترکیب با سایر درمانها: ایمونوتراپی میتواند به صورت ترکیبی با شیمیدرمانی، پرتودرمانی، درمانهای هدفمند و حتی روشهای نوین نانوتراپی مورد استفاده قرار گیرد و اثر درمانی را افزایش دهد.
با وجود تمام این مزایا، ایمونوتراپی محدودیتها و چالشهای خود را نیز دارد. پاسخ بیماران به این درمان بسیار متغیر است و برخی افراد ممکن است پاسخ ضعیف یا عوارض جانبی جدی داشته باشند. عواملی مانند ویژگیهای ژنتیکی تومور، وضعیت سیستم ایمنی فرد و محیط میکروسکوپی تومور نقش مهمی در موفقیت ایمونوتراپی ایفا میکنند. همچنین، برخی سرطانها مانند پانکراس یا گلیوبلاستوم، به دلیل ویژگیهای محیطی و مقاومتهای داخلی، کمتر به ایمونوتراپی پاسخ میدهند.
در مجموع، ایمونوتراپی نمایانگر یک جهش علمی و درمانی در مدیریت سرطان است که با هدف بهبود کیفیت زندگی بیماران و افزایش بقای طولانیمدت توسعه یافته است. این روش، با ترکیب نوآوریهای بیوتکنولوژیک، مهندسی ژنتیک و فهم عمیقتر سیستم ایمنی، مسیر جدیدی در درمان سرطانها گشوده است و امید به کنترل و حتی درمان برخی از سختترین انواع سرطان را افزایش داده است.
مکانیسمهای ایمونوتراپی در سرطان
ایمونوتراپی با هدف فعالسازی و تقویت سیستم ایمنی برای شناسایی و نابودی سلولهای سرطانی توسعه یافته است. مکانیسمهای این روش درمانی پیچیده و چندلایه هستند و شامل تعاملات سلولهای ایمنی، بیان آنتیژنهای توموری، و مسیرهای سیگنالینگ مولکولی میشوند. درک این مکانیسمها برای طراحی درمانهای مؤثر و شخصیسازی شده حیاتی است.
فعالسازی سیستم ایمنی علیه تومور
یکی از پایهایترین مکانیسمهای ایمونوتراپی، تحریک سلولهای ایمنی برای شناسایی و حمله به سلولهای سرطانی است. سلولهای سرطانی معمولاً آنتیژنهای تومور-اختصاصی (TSA) یا آنتیژنهای تومور-تعلق به سلولهای خودی (TAA) را بیان میکنند که توسط سیستم ایمنی قابل شناسایی هستند. سلولهای T سیتوتوکسیک (CD8+) نقش اصلی در تخریب مستقیم سلولهای سرطانی دارند، در حالی که سلولهای T کمککننده (CD4+) با تولید سیتوکینها و حمایت از سلولهای دیگر ایمنی، پاسخ هماهنگ و گستردهای ایجاد میکنند. همچنین، سلولهای B با تولید آنتیبادیها، امکان شناسایی و حذف سلولهای سرطانی را افزایش میدهند.
ایمونواستیمولاتورها و مهارکنندههای ایمنی (Checkpoint Inhibitors)
تومورها معمولاً با استفاده از مسیرهای مهار ایمنی مانند PD-1/PD-L1 و CTLA-4، پاسخ ایمنی را سرکوب میکنند. مهارکنندههای ایمنی با بلاک کردن این مسیرها، سلولهای T را از حالت خمودگی خارج میکنند و اجازه میدهند که حمله ایمنی علیه تومور ادامه یابد. به عنوان مثال، داروهای ضد PD-1 یا ضد PD-L1 به سلولهای T این امکان را میدهند که مجدداً فعال شوند و به صورت هدفمند سلولهای سرطانی را تخریب کنند. این مکانیسم، پایه بسیاری از موفقیتهای بالینی ایمونوتراپی در ملانوما و سرطانهای ریه است.
درمان سلول T adoptive
یکی دیگر از مکانیسمهای کلیدی ایمونوتراپی، استفاده از سلولهای T مهندسیشده برای حمله به سرطان است. در روش CAR-T، سلولهای T بیمار در آزمایشگاه اصلاح ژنتیکی میشوند تا گیرندههای آنتیژنی ویژهای را بیان کنند که مستقیماً سلولهای سرطانی را شناسایی میکنند. پس از تکثیر این سلولها، آنها به بدن بیمار بازگردانده میشوند تا تومور را هدف قرار دهند. این روش به ویژه در برخی سرطانهای خون مانند لنفومهای مقاوم به درمان مؤثر بوده است و نشاندهنده قدرت سیستم ایمنی مهندسیشده در مقابله با سرطان است.
واکسنهای ضدسرطان
ایمونوتراپی همچنین شامل واکسنهای درمانی ضدسرطان است که با معرفی آنتیژنهای تومور به سیستم ایمنی، پاسخ ایمنی اختصاصی ایجاد میکنند. این واکسنها میتوانند سلولهای T را علیه سلولهای سرطانی فعال کنند و حافظه ایمنی ایجاد نمایند تا از بازگشت سرطان جلوگیری شود. واکسنها معمولاً برای سرطانهایی که آنتیژنهای مشخص و شناختهشده دارند، کاربرد دارند و نقش مکمل در ترکیب با سایر درمانها ایفا میکنند.
نقش سلولهای NK و دیگر سلولهای ایمنی ذاتی
سلولهای NK بخشی از سیستم ایمنی ذاتی هستند و میتوانند سلولهای سرطانی را بدون نیاز به شناسایی آنتیژنهای خاص، تخریب کنند. ایمونوتراپی با فعالسازی یا افزایش تعداد سلولهای NK، اثرات ضدتوموری سیستم ایمنی را تقویت میکند. علاوه بر آن، سلولهای دندریتیک با ارائه آنتیژنهای توموری به سلولهای T، پاسخ ایمنی تطبیقی را فعال میکنند و یک پل حیاتی بین ایمنی ذاتی و تطبیقی ایجاد میکنند.
ایجاد پاسخ ایمنی پایدار و حافظه طولانیمدت
یکی از ویژگیهای مهم ایمونوتراپی، توانایی ایجاد حافظه ایمنی طولانیمدت است. پس از فعالسازی سیستم ایمنی، سلولهای T حافظه قادرند سلولهای سرطانی را حتی ماهها یا سالها پس از درمان شناسایی و تخریب کنند. این مکانیسم، مزیت برجستهای نسبت به درمانهای سنتی مانند شیمیدرمانی ایجاد میکند، چرا که امکان پیشگیری از عود سرطان را فراهم میسازد.
مکانیسمهای محیط میکروسکوپی تومور و چالشها
با وجود قدرت ایمونوتراپی، تومورها با استفاده از محیط میکروسکوپی خود، پاسخ ایمنی را سرکوب میکنند. محیط تومور میتواند شامل سلولهای سرکوبگر T، سیتوکینهای ضدالتهابی و شرایط هیپوکسی باشد که همه این عوامل مانع عملکرد مؤثر سیستم ایمنی میشوند. ایمونوتراپی مدرن با هدف مهار این موانع، مانند ترکیب با درمانهای هدفمند یا کاهش هیپوکسی، سعی در افزایش اثربخشی دارد.
نتیجهگیری
مکانیسمهای ایمونوتراپی در سرطان یک شبکه پیچیده و هماهنگ از فعالسازی سلولهای ایمنی، مهار مسیرهای سرکوب ایمنی تومور و ایجاد حافظه طولانیمدت را شامل میشود. این مکانیسمها نه تنها امکان حمله هدفمند به سلولهای سرطانی را فراهم میکنند، بلکه با ایجاد پاسخ ایمنی پایدار، توانایی پیشگیری از عود سرطان را نیز افزایش میدهند. درک دقیق این مکانیسمها، پایهای برای توسعه روشهای ترکیبی، شخصیسازی درمان و طراحی استراتژیهای نوین ایمونوتراپی است.
انواع ایمونوتراپی و کاربردهای بالینی
ایمونوتراپی شامل مجموعهای گسترده از روشهای درمانی است که با هدف فعالسازی سیستم ایمنی علیه سرطان طراحی شدهاند. هر یک از این روشها دارای مکانیسمهای اختصاصی، مزایا و محدودیتهای خاص خود هستند و در انواع سرطانها به صورت بالینی مورد استفاده قرار میگیرند. شناخت دقیق این روشها برای پزشکان، پژوهشگران و حتی بیماران اهمیت فراوان دارد، زیرا انتخاب مناسبترین نوع ایمونوتراپی میتواند اثر درمانی را به طور قابل توجهی افزایش دهد.
ایمونواستیمولاتورها و مهارکنندههای ایمنی (Checkpoint Inhibitors)
یکی از برجستهترین دستاوردهای ایمونوتراپی در دهه اخیر، استفاده از مهارکنندههای مسیرهای مهاری سیستم ایمنی است. تومورها معمولاً با فعالسازی مسیرهای سرکوب ایمنی مانند PD-1/PD-L1 و CTLA-4، سلولهای T را خاموش میکنند و مانع پاسخ ایمنی مؤثر میشوند. داروهای مهارکننده این مسیرها، معروف به Checkpoint Inhibitors، با مسدود کردن این گیرندهها، سلولهای T را دوباره فعال کرده و حمله به سلولهای سرطانی را ممکن میسازند. این روش به ویژه در سرطانهای ملانوما، ریه و برخی سرطانهای مثانه موفقیتهای چشمگیری داشته است. مطالعات بالینی نشان دادهاند که برخی بیماران حتی پس از توقف درمان نیز پاسخ ایمنی طولانیمدت دارند و میزان بقای کلی بهبود مییابد.
درمان سلول( T adoptive CAR-T و TILs)
درمان سلول T adoptive شامل جمعآوری سلولهای T بیمار، تکثیر و اصلاح آنها در آزمایشگاه و بازگرداندنشان به بدن است تا سلولهای سرطانی را هدف قرار دهند. یکی از معروفترین نمونهها، CAR-T Therapy است که در آن سلولهای T با استفاده از مهندسی ژنتیک گیرندههای آنتیژنی مصنوعی (CAR) میسازند که به طور مستقیم تومور را شناسایی میکنند. این روش به خصوص در سرطانهای خون مانند لنفوم و لوکمیا بسیار مؤثر بوده است. علاوه بر آن، TIL Therapy (Tumor-Infiltrating Lymphocytes) شامل استخراج سلولهای T موجود در تومور، تکثیر و فعالسازی آنها و سپس بازگرداندنشان به بیمار است. این روش به ایجاد پاسخ ایمنی قوی علیه تومورهای جامد کمک میکند و در برخی سرطانهای پیشرفته نتایج امیدبخشی داشته است.
واکسنهای ضدسرطان
واکسنهای درمانی ضدسرطان نوعی از ایمونوتراپی هستند که با معرفی آنتیژنهای تومور به سیستم ایمنی، سلولهای T اختصاصی علیه سلولهای سرطانی فعال میشوند. این واکسنها میتوانند به شکل پپتیدی، سلولی یا دیانای طراحی شوند و به ویژه برای سرطانهایی که آنتیژنهای مشخص و شناختهشده دارند، کاربرد دارند. هدف اصلی واکسنها، ایجاد حافظه ایمنی طولانیمدت است تا سیستم ایمنی بتواند در برابر بازگشت سرطان نیز مقاوم باشد. کاربرد بالینی واکسنها هنوز محدود است، اما در سرطانهای پروستات، ملانوما و برخی سرطانهای سر و گردن مورد بررسی قرار گرفته است.
آنتیبادیهای منوکلونال و بایولوژیکها
آنتیبادیهای منوکلونال، مولکولهایی هستند که به طور خاص به آنتیژنهای سطح سلولهای سرطانی متصل میشوند و موجب مرگ مستقیم سلول، فعالسازی سیستم ایمنی یا انتقال دارو به سلول هدف میشوند. برخی از این آنتیبادیها به عنوان Conjugated Antibodies دارو یا توکسین را به سلول سرطانی منتقل میکنند و اثربخشی درمان را افزایش میدهند. کاربرد بالینی این روش در سرطانهای پستان، ریه و کولورکتال بسیار گسترده است و باعث شده است که برخی سرطانها که پیشتر مقاوم به درمان بودند، پاسخ بهتری پیدا کنند.
ایمونوتراپی ترکیبی با شیمیدرمانی و پرتودرمانی
یکی از رویکردهای پیشرفته در ایمونوتراپی، ترکیب آن با درمانهای سنتی است. شیمیدرمانی و پرتودرمانی میتوانند باعث آزادسازی آنتیژنهای تومور شوند و به فعالسازی سیستم ایمنی کمک کنند. ایمونوتراپی ترکیبی، مانند شیمیدرمانی متروونومیک همراه با مهارکنندههای ایمنی یا پرتودرمانی همراه با CAR-T یا واکسنها، نشان داده است که میتواند اثر درمانی را به طور قابل توجهی افزایش دهد و حتی در سرطانهای مقاوم پاسخ ایجاد کند.
نانوذرات و سیستمهای تحویل هدفمند
با پیشرفت فناوری، سیستمهای نانو و حاملهای هدفمند دارو امکان رساندن ایمونوتراپی دقیق به محل تومور را فراهم کردهاند. این روشها نه تنها اثربخشی داروها را افزایش میدهند، بلکه عوارض جانبی سیستمیک را کاهش میدهند. نانوذرات میتوانند واکسنها، آنتیبادیها یا مولکولهای فعالکننده ایمنی را به طور مستقیم به محیط تومور منتقل کنند و پاسخ ایمنی موضعی و قوی ایجاد کنند.
کاربرد بالینی و موفقیتها
در عمل بالینی، انواع ایمونوتراپی توانستهاند اثرات چشمگیری در سرطانهای خاص داشته باشند. برای مثال، مهارکنندههای PD-1 در ملانوما، ریه و مثانه بهبود قابل توجهی در میزان بقا ایجاد کردهاند. CAR-T Therapy در لنفومهای مقاوم، نتایج درمانی چشمگیری نشان داده و برخی بیماران حتی پس از سالها همچنان بدون علائم بیماری باقی ماندهاند. ترکیب ایمونوتراپی با شیمیدرمانی یا پرتودرمانی نیز در سرطانهای جامد پیشرفته و مقاوم به درمانهای استاندارد، نتایج امیدوارکننده ارائه کرده است.
نتیجهگیری
انواع ایمونوتراپی شامل مهارکنندههای ایمنی، درمان سلول T adoptive، واکسنهای ضدسرطان، آنتیبادیهای منوکلونال و سیستمهای نانو، هر یک با مکانیسمهای اختصاصی، توانایی فعالسازی سیستم ایمنی و مقابله با سلولهای سرطانی را دارند. کاربردهای بالینی این روشها، از سرطانهای خون تا تومورهای جامد، نشاندهنده پتانسیل بالای ایمونوتراپی برای تغییر چشمانداز درمان سرطان است و پایهای برای توسعه درمانهای ترکیبی و شخصیسازی شده فراهم میکند.
ترکیب ایمونوتراپی با سایر روشها
با پیشرفتهای اخیر در حوزه درمان سرطان، مشخص شده است که ترکیب ایمونوتراپی با سایر روشهای درمانی میتواند اثربخشی درمان را به طور قابل توجهی افزایش دهد. هر یک از روشهای سنتی مانند شیمیدرمانی و پرتودرمانی، علاوه بر تأثیر مستقیم بر سلولهای سرطانی، میتوانند محیط میکروسکوپی تومور را تغییر داده و پاسخ ایمنی را تقویت کنند. ترکیب این درمانها با ایمونوتراپی، راهبردی قدرتمند برای غلبه بر مقاومت تومور و افزایش بقای بیماران ارائه میدهد.
شیمیدرمانی متروونومیک و ایمونوتراپی
شیمیدرمانی متروونومیک شامل استفاده از دوزهای کم و مداوم داروهای شیمیدرمانی است که علاوه بر اثر مستقیم روی سلولهای سرطانی، میتواند باعث فعالسازی سیستم ایمنی و کاهش سلولهای سرکوبگر ایمنی در محیط تومور شود. مطالعات نشان دادهاند که ترکیب شیمیدرمانی متروونومیک با مهارکنندههای ایمنی یا واکسنهای ضدسرطان، اثرات ضدتوموری سینرژیک ایجاد میکند. این رویکرد به ویژه در سرطانهای مقاوم به دوزهای بالای شیمیدرمانی سنتی مؤثر است و میتواند باعث کاهش عوارض جانبی شود.
پرتودرمانی و ایمونوتراپی
پرتودرمانی نه تنها باعث تخریب مستقیم DNA سلولهای سرطانی میشود، بلکه میتواند آنتیژنهای تومور را آزاد کرده و سیستم ایمنی را تحریک کند. این پدیده، به عنوان اثر ابوتوپیک یا abscopal effect شناخته میشود، که در آن پرتودرمانی موضعی تومور، پاسخ ایمنی سیستمیک ایجاد میکند و سلولهای سرطانی در سایر نقاط بدن نیز تحت تأثیر قرار میگیرند. ترکیب پرتودرمانی با ایمونوتراپی مانند مهارکنندههای PD-1 یا CTLA-4، این اثر را تقویت کرده و نرخ پاسخ درمانی بیماران را افزایش میدهد. تحقیقات اخیر نشان دادهاند که این ترکیب میتواند در سرطانهای جامد پیشرفته، نتایج قابل توجهی ایجاد کند و بقای طولانیمدت بیماران را بهبود دهد.
فوتودینامیک و فوتوترمال همراه با ایمونوتراپی
در سالهای اخیر، درمانهای فوتودینامیک و فوتوترمال به عنوان رویکردهای نوین برای تخریب سلولهای سرطانی مطرح شدهاند. این روشها با استفاده از نور، حرارت یا ترکیبی از هر دو، باعث آسیب مستقیم به سلولهای سرطانی میشوند و همچنین میتوانند آنتیژنهای تومور را برای فعالسازی سیستم ایمنی آزاد کنند. وقتی این روشها با ایمونوتراپی ترکیب میشوند، پاسخ ایمنی ضدتوموری قویتر میشود و احتمال ایجاد حافظه ایمنی طولانیمدت افزایش مییابد. این رویکرد به خصوص در سرطانهای جامد و مقاوم، نویدبخش نتایج بالینی موفق است و در مطالعات پیشبالینی اثرات سینرژیک چشمگیری نشان داده است.
ترکیب درمان هدفمند با ایمونوتراپی
درمانهای هدفمند شامل داروهایی هستند که مسیرهای سیگنالینگ خاص سلولهای سرطانی را مهار میکنند و رشد و تکثیر تومور را کاهش میدهند. این داروها میتوانند محیط میکروسکوپی تومور را تغییر داده و سلولهای سرکوبگر ایمنی را کاهش دهند، بنابراین ترکیب آنها با ایمونوتراپی، پاسخ ایمنی را بهبود میبخشد. مطالعات اخیر نشان دادهاند که این ترکیب در سرطانهای مقاوم، مانند پانکراس و گلیوبلاستوم، میتواند اثرات درمانی قابل توجهی ایجاد کند و باعث افزایش بقای بیماران شود.
مزایای ترکیب ایمونوتراپی با سایر درمانها
ترکیب ایمونوتراپی با سایر روشهای درمانی چندین مزیت کلیدی دارد:
-
افزایش اثر درمانی: استفاده همزمان از چند روش میتواند مقاومت تومور را کاهش دهد و سلولهای سرطانی را به طور مؤثرتری هدف قرار دهد.
-
ایجاد پاسخ ایمنی سیستمیک: درمانهای موضعی مانند پرتودرمانی یا فوتودینامیک با ایمونوتراپی، میتوانند پاسخ ایمنی سرتاسری ایجاد کنند که تومورهای دور از محل درمان را نیز تحت تأثیر قرار دهد.
-
کاهش عوارض جانبی سیستمیک: استفاده از دوزهای پایینتر شیمیدرمانی یا پرتودرمانی در ترکیب با ایمونوتراپی، باعث کاهش آسیب به سلولهای سالم و بهبود کیفیت زندگی بیماران میشود.
-
افزایش پایداری و حافظه ایمنی: ترکیب این روشها میتواند پاسخ ایمنی طولانیمدت ایجاد کند و از عود سرطان جلوگیری نماید.
چالشها و محدودیتهای ترکیبی
با وجود مزایای قابل توجه، ترکیب ایمونوتراپی با سایر درمانها چالشهایی نیز دارد. تعامل پیچیده بین مسیرهای ایمنی، مقاومت تومور و شرایط میکروسکوپی تومور ممکن است باعث پاسخ ضعیف یا بروز عوارض جانبی شود. همچنین، انتخاب دوز مناسب و زمانبندی دقیق هر درمان برای ایجاد اثر سینرژیک، نیازمند بررسیهای بالینی دقیق است. تحقیقات در حال حاضر بر روی شناسایی بهترین ترکیبها، زمانبندی و شاخصهای پیشبینیکننده پاسخ تمرکز دارد تا بتوان این روشها را به صورت استاندارد در بالین به کار برد.
نتیجهگیری
ترکیب ایمونوتراپی با شیمیدرمانی، پرتودرمانی، درمانهای فوتودینامیک و فوتوترمال، و درمان هدفمند، یک استراتژی پیشرفته برای افزایش اثربخشی درمان سرطان است. این رویکرد چندگانه، با فعالسازی سیستم ایمنی، کاهش مقاومت تومور و ایجاد پاسخ ایمنی طولانیمدت، توانسته است چشمانداز درمان سرطان را تغییر دهد و پایهای برای توسعه استراتژیهای شخصیسازی شده فراهم کند. تحقیقات بالینی ادامه دارد تا بهترین ترکیبها و زمانبندیهای درمانی مشخص شوند و این رویکرد به صورت گسترده در سرطانهای مقاوم به درمانهای سنتی استفاده شود.
محدودیتها و چالشها
با وجود پیشرفتهای چشمگیر در زمینه ایمونوتراپی و موفقیتهای بالینی متعدد، این روش درمانی همچنان با محدودیتها و چالشهای قابل توجهی مواجه است. شناخت دقیق این موانع، برای بهبود طراحی درمانها و افزایش اثر بالینی حیاتی است.
مقاومت اولیه و ثانویه تومور
یکی از اصلیترین چالشها در ایمونوتراپی، مقاومت تومور به درمان است. مقاومت میتواند به صورت اولیه باشد، یعنی برخی تومورها از ابتدا به ایمونوتراپی پاسخ نمیدهند، یا به صورت ثانویه، یعنی پس از یک دوره پاسخدهی، تومور مجدداً رشد میکند. مکانیسمهای مقاومت شامل تغییر در بیان آنتیژنهای توموری، کاهش گیرندههای فعالکننده سلولهای T و تغییر مسیرهای سیگنالینگ سلولی است. علاوه بر آن، برخی تومورها با افزایش سلولهای سرکوبگر ایمنی مانند Treg و Myeloid-Derived Suppressor Cells (MDSCs) محیط میکروسکوپی خود را ضد پاسخ ایمنی میکنند. این مقاومتها باعث میشوند که تنها درصدی از بیماران پاسخ قابل توجهی به ایمونوتراپی داشته باشند.
محدودیتهای محیط میکروسکوپی تومور
تومورها محیط پیچیدهای دارند که شامل سلولهای سرکوبگر، ماتریکس خارج سلولی متراکم و شرایط هیپوکسی است. محیط هیپوکسی، با کاهش عملکرد سلولهای ایمنی و افزایش تولید عوامل سرکوبگر، یکی از موانع اصلی ایمونوتراپی به شمار میرود. مطالعات نشان دادهاند که تومورهای هیپوکسی، پاسخ به مهارکنندههای PD-1 و سایر ایمونوتراپیها را کاهش میدهند. همچنین چگالی بالای ماتریکس خارج سلولی میتواند مانع نفوذ سلولهای T به داخل تومور شود و اثربخشی درمان را محدود کند.
عوارض جانبی و سمیت سیستمیک
ایمونوتراپی ممکن است با عوارض جانبی قابل توجهی همراه باشد. این عوارض به دلیل فعالسازی سیستم ایمنی و حمله به بافتهای سالم ایجاد میشوند و به آنها Immune-Related Adverse Events (irAEs) گفته میشود. شایعترین این عوارض شامل التهاب روده، کبد و تیروئید، بثورات پوستی، و نارساییهای قلبی یا ریوی است. برخی بیماران ممکن است نیاز به درمان با کورتیکواستروئیدها یا توقف موقت درمان داشته باشند. مدیریت مناسب این عوارض و شناسایی زودهنگام آنها، بخش حیاتی مراقبتهای بالینی است.
پاسخ متغیر بیماران
یکی از چالشهای بزرگ در ایمونوتراپی، پاسخ متغیر بیماران است. عواملی مانند پروفایل ژنتیکی تومور، وضعیت سیستم ایمنی بیمار، سن، و وجود بیماریهای زمینهای نقش مهمی در میزان پاسخ دارند. به همین دلیل، برخی بیماران پاسخهای فوقالعاده طولانی دارند، در حالی که برخی دیگر به درمان پاسخ نمیدهند. توسعه بیومارکرهای پیشبینیکننده پاسخ یکی از اهداف اصلی تحقیقات کنونی است تا بتوان بیماران را بر اساس احتمال پاسخ به درمان دستهبندی کرد و درمان شخصیسازی شود.
محدودیتهای فناوری و هزینهها
روشهایی مانند CAR-T Therapy و واکسنهای سلولی نیاز به فناوری پیشرفته، تیمهای تخصصی و زیرساختهای گرانقیمت دارند. این موضوع باعث میشود که دسترسی گسترده به این درمانها محدود باشد و هزینههای بالای درمان، یکی از موانع اصلی در دسترسی بیماران به ایمونوتراپی محسوب شود. علاوه بر آن، طراحی و تولید شخصیسازی شده سلولها یا واکسنها زمانبر و پیچیده است و میتواند باعث تاخیر در شروع درمان شود.
چالشهای ترکیبی و تداخل با سایر درمانها
ترکیب ایمونوتراپی با شیمیدرمانی، پرتودرمانی یا درمان هدفمند مزایای زیادی دارد، اما این ترکیبها پیچیدگی درمان و خطر عوارض جانبی را افزایش میدهند. انتخاب دوز مناسب، زمانبندی دقیق و مدیریت عوارض جانبی ترکیبی، نیازمند تحقیقات بالینی گسترده است. علاوه بر آن، تعامل پیچیده بین مسیرهای ایمنی و مسیرهای سیگنالینگ سلولهای سرطانی میتواند باعث کاهش اثر درمان یا ایجاد پاسخ غیرمنتظره شود.
نیاز به بیومارکرها و شخصیسازی درمان
به دلیل پیچیدگی پاسخهای ایمنی و تفاوتهای فردی بیماران، یکی از چالشهای اصلی، شخصیسازی ایمونوتراپی است. تعیین بیومارکرهای پیشبینیکننده پاسخ، مانند سطح بیان PD-L1، بار موتاسیونی تومور و ویژگیهای محیط میکروسکوپی تومور، میتواند به شناسایی بیماران مناسب و افزایش موفقیت درمان کمک کند. تحقیقات اخیر بر روی میانجیهای مولکولی و مولکولهای سیگنالینگ ایمنی تمرکز دارند تا بتوانند پیشبینی دقیقتری از پاسخ بیماران ارائه دهند.
نتیجهگیری
با وجود مزایای چشمگیر ایمونوتراپی در درمان سرطان، محدودیتها و چالشهای متعددی همچنان وجود دارند. مقاومت تومور، شرایط محیط میکروسکوپی، عوارض جانبی سیستمیک، پاسخ متغیر بیماران و هزینههای بالای درمان، از مهمترین موانع بالینی به شمار میروند. غلبه بر این چالشها نیازمند تحقیقات پیشرفته، توسعه بیومارکرهای پیشبینیکننده، شخصیسازی درمانها و مدیریت دقیق بالینی است. تنها با رفع این محدودیتها میتوان پتانسیل کامل ایمونوتراپی را در کنترل و درمان سرطان محقق ساخت.
پیشرفتهای نوین و رویکردهای آینده
ایمونوتراپی به عنوان یکی از پیشرفتهترین و تحولآفرینترین حوزههای درمان سرطان، همواره در حال تکامل است. تحقیقات اخیر نه تنها به بهبود روشهای موجود پرداختهاند، بلکه رویکردهای نوین و فناوریهای پیشرفته را معرفی کردهاند که میتوانند چشمانداز درمان سرطان را به طور بنیادین تغییر دهند.
ایمونوتراپی ترکیبی و شخصیسازی درمان
یکی از مهمترین روندهای آینده، ترکیب ایمونوتراپی با سایر درمانها و شخصیسازی آن برای هر بیمار است. پژوهشها نشان میدهند که ترکیب مهارکنندههای ایمنی با شیمیدرمانی متروونومیک، پرتودرمانی، درمان هدفمند یا درمانهای فوتودینامیک، اثر سینرژیک ایجاد میکند و میتواند مقاومت تومور را کاهش دهد. علاوه بر این، شخصیسازی درمان با توجه به بیومارکرهای تومور، پروفایل ژنتیکی بیمار و ویژگیهای محیط میکروسکوپی تومور، امکان شناسایی بهترین ترکیبها و زمانبندیها را فراهم میکند. این رویکردها باعث افزایش اثربخشی و کاهش عوارض جانبی میشوند و نقش کلیدی در موفقیت ایمونوتراپی آینده دارند.
نانوذرات و فناوریهای تحویل هدفمند
یکی از نوآوریهای مهم در ایمونوتراپی، استفاده از نانوذرات و حاملهای دارویی هدفمند است. این فناوریها قادرند واکسنها، آنتیبادیها و مولکولهای فعالکننده ایمنی را به طور مستقیم به محیط تومور منتقل کنند و پاسخ ایمنی موضعی و قوی ایجاد کنند. نانوذرات همچنین میتوانند عوارض جانبی سیستمیک را کاهش داده و امکان ترکیب چند درمان را به طور مؤثر فراهم سازند. تحقیقات نشان میدهند که استفاده از نانوذرات میتواند مقاومت تومور را کاهش دهد و اثربخشی درمانهای ترکیبی را افزایش دهد.
مهندسی سلول و ژن درمانی
پیشرفتهای اخیر در مهندسی سلول و ژن درمانی، امکان ایجاد سلولهای T اختصاصی و مهندسیشده با گیرندههای CAR-T و TCR-T را فراهم کرده است. این سلولها قادرند سلولهای سرطانی را با دقت بالا شناسایی و تخریب کنند. علاوه بر این، مهندسی ژنتیک میتواند ویژگیهای حافظه ایمنی طولانیمدت و مقاومت در برابر محیط سرکوبگر تومور را به سلولهای T اضافه کند. فناوریهای آینده شامل ترکیب CAR-T با مهارکنندههای ایمنی، نانوذرات و درمانهای هدفمند است تا پاسخ ایمنی جامعتر و پایدار ایجاد شود.
واکسنهای نسل جدید و ایمونوتراپی مبتنی بر آنتیژن
واکسنهای درمانی ضدسرطان نسل جدید، شامل واکسنهای پپتیدی، سلولی، دیانای و آرانای هستند که قابلیت ایجاد پاسخ ایمنی اختصاصی و حافظه طولانیمدت را دارند. با پیشرفت فناوری، این واکسنها میتوانند متناسب با پروفایل ژنتیکی تومور هر بیمار طراحی شوند و پاسخ ایمنی بسیار قوی و هدفمند ایجاد کنند. این رویکرد به خصوص در سرطانهای مقاوم و تومورهای جامد، امیدبخش نتایج بالینی بهتر است.
ایمونوتراپی مبتنی بر اگزوزومها و حاملهای بیولوژیکی
استفاده از اگزوزومها و حاملهای بیولوژیکی به عنوان سیستمهای طبیعی انتقال دارو، یکی از نوآوریهای اخیر است. اگزوزومها میتوانند مولکولهای فعالکننده ایمنی را به سلولهای هدف منتقل کنند و به دلیل سازگاری بالای بیولوژیکی، عوارض جانبی بسیار کمی ایجاد میکنند. این روشها امکان انتقال ایمونوتراپی به تومورهای جامد و محیطهای پیچیده میکروسکوپی را فراهم کرده و اثر درمانی را افزایش میدهند.
ترکیب با درمانهای فوتودینامیک و فوتوترمال
ترکیب ایمونوتراپی با درمانهای فوتودینامیک و فوتوترمال یکی از رویکردهای نوین برای ایجاد پاسخ ایمنی سیستمیک و تقویت تخریب تومور است. این روشها با آسیب مستقیم به سلولهای سرطانی و آزادسازی آنتیژنها، پاسخ ایمنی را فعال میکنند و وقتی با ایمونوتراپی ترکیب شوند، حافظه ایمنی طولانیمدت و پاسخ سیستمیک ضدتوموری ایجاد میکنند. این رویکرد به خصوص در سرطانهای مقاوم و جامد، نتایج پیشبینیکننده و امیدوارکننده داشته است.
چشمانداز استفاده از هوش مصنوعی و یادگیری ماشین
یکی از روندهای آینده و نوآوریهای مهم، استفاده از هوش مصنوعی و یادگیری ماشین برای پیشبینی پاسخ بیماران به ایمونوتراپی است. این فناوریها قادرند دادههای بالینی، ژنتیکی و ایمنی را تحلیل کنند و مدلهای پیشبینیکننده پاسخ ایجاد نمایند. با کمک هوش مصنوعی، میتوان ترکیب درمانها، دوز و زمانبندی بهینه را تعیین کرده و درمانهای شخصیسازی شده ارائه داد.
چالشها و فرصتهای آینده
با وجود نوآوریهای متعدد، چالشهایی همچنان باقی است. این شامل مدیریت عوارض جانبی ترکیبی، هزینههای بالای فناوریهای پیشرفته و محدودیت دسترسی به درمانهای شخصیسازی شده است. با این حال، فرصتها برای ایجاد درمانهای دقیق، پایدار و مؤثرتر بسیار زیاد است و پیشرفتهای نوین نویدبخش آیندهای است که ایمونوتراپی میتواند به عنوان ستون اصلی درمان سرطان مطرح شود.
نتیجهگیری
پیشرفتهای نوین در ایمونوتراپی، شامل ترکیب درمانها، نانوذرات، مهندسی سلول و ژن، واکسنهای نسل جدید و استفاده از هوش مصنوعی، چشمانداز درمان سرطان را به طور بنیادین تغییر دادهاند. این رویکردها نه تنها اثربخشی درمان را افزایش میدهند، بلکه امکان شخصیسازی درمان، کاهش مقاومت تومور و ایجاد پاسخ ایمنی طولانیمدت را فراهم میکنند. آینده ایمونوتراپی، مبتنی بر نوآوری، ترکیب هوشمندانه درمانها و فناوریهای پیشرفته است و میتواند نقش کلیدی در کنترل و درمان سرطانهای مقاوم و پیچیده ایفا کند.
جمعبندی و نتیجهگیری
ایمونوتراپی به عنوان یک رویکرد نوین و تحولآفرین در درمان سرطان، توانسته است چشمانداز درمانهای کلاسیک سرطان را به طور بنیادین تغییر دهد. این روش، بر مبنای فعالسازی سیستم ایمنی بیمار برای شناسایی و تخریب سلولهای سرطانی عمل میکند و تفاوت اساسی با درمانهای سنتی مانند شیمیدرمانی و پرتودرمانی دارد. در طول سالهای اخیر، توسعه انواع ایمونوتراپی، از مهارکنندههای ایمنی و CAR-T گرفته تا واکسنهای درمانی و فناوریهای مبتنی بر نانوذرات، نشان داده است که این روش میتواند اثربخشی درمان، بقای طولانیمدت بیماران و کیفیت زندگی آنها را بهبود بخشد.
یکی از مهمترین دستاوردها در این حوزه، شناخت مکانیسمهای مولکولی و مسیرهای ایمنی است که پاسخ به ایمونوتراپی را تنظیم میکنند. این شناخت، امکان طراحی روشهای ترکیبی و شخصیسازی درمانها را فراهم کرده است. ترکیب ایمونوتراپی با شیمیدرمانی متروونومیک، پرتودرمانی، درمان هدفمند و درمانهای فوتودینامیک و فوتوترمال، نشان داده است که میتوان مقاومت تومور را کاهش داد و پاسخ سیستمیک ایمنی را افزایش داد. این رویکردها، به ویژه در سرطانهای مقاوم و پیشرفته، نویدبخش نتایج بالینی امیدوارکننده هستند.
با وجود مزایا و پیشرفتها، ایمونوتراپی با محدودیتها و چالشهای مهمی نیز مواجه است. مقاومت اولیه و ثانویه تومور، محیط هیپوکسی و سرکوبگر تومور، پاسخ متغیر بیماران و عوارض جانبی سیستمیک، از مهمترین موانع بالینی به شمار میروند. همچنین، هزینههای بالای فناوریهای پیشرفته و محدودیت دسترسی، چالشی برای استفاده گسترده از ایمونوتراپی ایجاد کرده است. برای غلبه بر این محدودیتها، تحقیقات کنونی بر روی شخصیسازی درمانها، توسعه بیومارکرهای پیشبینیکننده پاسخ و بهبود مدیریت بالینی عوارض جانبی متمرکز است.
پیشرفتهای نوین، شامل مهندسی سلول، ژن درمانی، نانوذرات، واکسنهای نسل جدید، ایمونوتراپی مبتنی بر اگزوزومها و استفاده از هوش مصنوعی، افق جدیدی برای ایمونوتراپی ایجاد کردهاند. این فناوریها نه تنها اثرات درمانی را افزایش میدهند، بلکه امکان شخصیسازی درمانها و ایجاد پاسخ ایمنی طولانیمدت را فراهم میکنند. آینده ایمونوتراپی، مبتنی بر ترکیب هوشمندانه درمانها، فناوریهای پیشرفته و رویکردهای مبتنی بر دادههای دقیق بیماران است و میتواند به عنوان ستون اصلی درمان سرطانهای مقاوم و پیچیده مطرح شود.
در نهایت، ایمونوتراپی نه تنها یک ابزار درمانی است، بلکه نمایانگر تغییر پارادایم در مدیریت سرطان است. این روش، با تمرکز بر سیستم ایمنی بدن و استفاده از فناوریهای نوین، مسیر جدیدی برای کنترل و درمان سرطانهای مقاوم، کاهش عوارض جانبی و بهبود کیفیت زندگی بیماران فراهم کرده است. با ادامه تحقیقات پیشرفته و توسعه استراتژیهای شخصیسازی شده، آیندهای روشن برای بیماران سرطانی پیشبینی میشود که در آن ایمونوتراپی نقش کلیدی و غیرقابل جایگزینی خواهد داشت.
جمعبندی نهایی
-
ایمونوتراپی بر مبنای فعالسازی سیستم ایمنی عمل میکند و تفاوت اساسی با درمانهای سنتی دارد.
-
ترکیب ایمونوتراپی با شیمیدرمانی، پرتودرمانی، درمان هدفمند و درمانهای نوین، اثر سینرژیک ایجاد میکند.
-
محدودیتها شامل مقاومت تومور، محیط هیپوکسی، عوارض جانبی و هزینههای بالاست.
-
پیشرفتهای نوین شامل مهندسی سلول، ژن درمانی، نانوذرات، واکسنهای نسل جدید و هوش مصنوعی، چشمانداز آینده ایمونوتراپی را شکل میدهند.
-
آینده درمان سرطان مبتنی بر شخصیسازی، ترکیب هوشمندانه درمانها و فناوریهای پیشرفته خواهد بود.
با توجه به پیشرفتهای علمی و بالینی، ایمونوتراپی به عنوان یک رویکرد انقلابی در درمان سرطان مطرح است و نقش محوری در مدیریت سرطانهای مقاوم و پیچیده خواهد داشت. ادامه تحقیقات و توسعه روشهای نوین، امید به افزایش نرخ درمان موفق، کاهش عوارض جانبی و بهبود کیفیت زندگی بیماران را افزایش میدهد و مسیر درمان سرطان را به سوی آیندهای پایدار و مؤثر هدایت میکند.