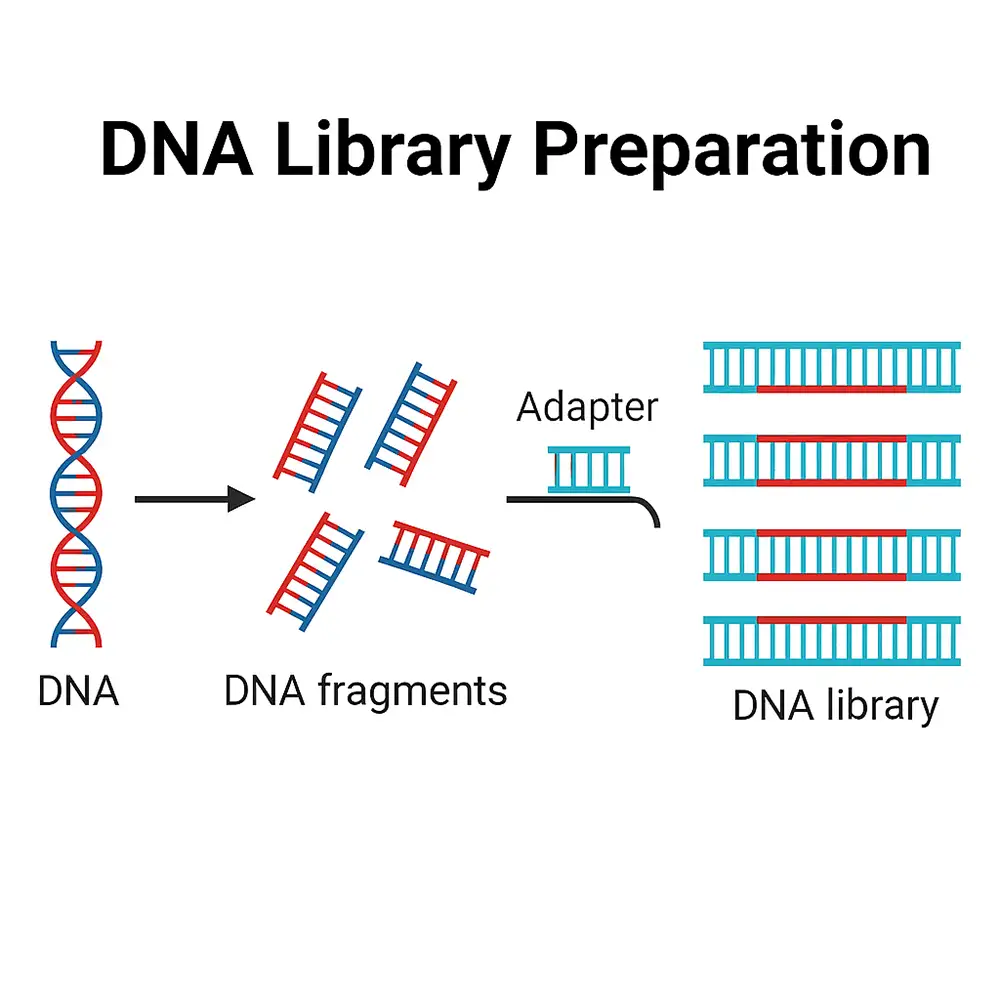
تبدیل زباله پلاستیکی به داروی استامینوفن
چکیده
محققان دریافتهاند که میتوان از باکتریها برای تبدیل زباله پلاستیکی به مسکنها استفاده کرد، که این موضوع امکان توسعه یک فرآیند پایدارتر برای تولید داروها را باز میکند.
شیمیدانها کشف کردهاند که باکتری E. coli میتواند پاراستامول (acetaminophen) را از مادهای که در آزمایشگاه از بطریهای پلاستیکی ساخته شده است تولید کند.
«مردم معمولاً نمیدانند که پاراستامول در حال حاضر از نفت تولید میشود»، پروفسور استیون والاس (Stephen Wallace)، نویسنده اصلی این تحقیق از دانشگاه ادینبورگ، گفت.
«این فناوری نشان میدهد که با ادغام شیمی و زیستشناسی به این شکل برای اولین بار، میتوانیم پاراستامول را بهصورت پایدارتر تولید کنیم و همزمان زباله پلاستیکی را از محیط زیست پاکسازی کنیم.»
🔹 کشف واکنش لاسن زیستسازگار
در مقاله منتشر شده در مجله Nature Chemistry، والاس و همکارانش گزارش دادند که نوعی واکنش شیمیایی به نام واکنش لاسن (Lossen rearrangement) که تا کنون در طبیعت مشاهده نشده است، زیستسازگار است.
به عبارت دیگر، میتوان این واکنش را در حضور سلولهای زنده انجام داد بدون اینکه به آنها آسیب برسد.
🔹 تبدیل PET به PABA
تیم تحقیقاتی این کشف را زمانی انجام داد که پلیاتیلن ترفتالات (PET) – نوعی پلاستیک که اغلب در بستهبندی مواد غذایی و بطریها یافت میشود – را با استفاده از روشهای شیمیایی پایدار به یک ماده جدید تبدیل کردند.
وقتی این ماده با یک سویه بیضرر از E. coli انکوبه شد، مشاهده شد که به مادهای به نام PABA تبدیل شد.
🔹 واکنش لاسن در شرایط ملایم و خودکاتالیز شده
نکته کلیدی این است که در حالی که واکنش لاسِن معمولاً نیازمند شرایط سخت آزمایشگاهی است، در حضور E. coli به صورت خودبهخود رخ داد.
محققان دریافتند که این واکنش توسط فسفات موجود در خود سلولها کاتالیز میشود.
🔹 اهمیت PABA برای رشد باکتری
تیم تحقیقاتی افزود که PABA یک ماده ضروری برای رشد باکتریها است، بهویژه در سنتز DNA، و معمولاً درون سلول از مواد دیگر تولید میشود.
با این حال، E. coli مورد استفاده در آزمایشها بهصورت ژنتیکی تغییر یافته بود تا این مسیرهای تولید PABA را مسدود کند،
به این معنا که باکتری مجبور بود از ماده مبتنی بر PET استفاده کند.
🔹 تبدیل زباله پلاستیکی به بیوماس
محققان میگویند که نتایج بسیار هیجانانگیز هستند زیرا نشان میدهند زباله پلاستیکی میتواند به ماده بیولوژیکی تبدیل شود.
«این یک راه برای کاملاً پاکسازی زباله پلاستیکی است»، والاس گفت.
🔹 مهندسی ژنتیکی برای تولید پاراستامول
محققان سپس E. coli را بیشتر دستکاری ژنتیکی کردند و دو ژن – یکی از قارچها و یکی از باکتریهای خاکی – وارد کردند،
که این امکان را فراهم میکرد باکتریها PABA را به پاراستامول تبدیل کنند.
تیم تحقیقاتی میگوید که با استفاده از این نوع E. coli، آنها توانستند ماده شروع مبتنی بر PET را در کمتر از ۲۴ ساعت به پاراستامول تبدیل کنند،
با انتشار گازهای کم و بازدهی تا ۹۲٪.
🔹 پتانسیل تجاری و اهمیت علمی
اگرچه کارهای بیشتری لازم است تا تولید پاراستامول به این روش در مقیاس تجاری ممکن شود،
اما این نتایج میتوانند کاربرد عملی داشته باشند.
«این برای اولین بار مسیر تولید پاراستامول از زباله پلاستیکی را ممکن میکند، که با زیستشناسی تنها ممکن نیست و با شیمی تنها نیز ممکن نیست»، والاس گفت.
محققان میگویند که روش جدید تقریباً هیچ انتشار کربنی ندارد و نسبت به روشهای فعلی تولید دارو پایدارتر است.
پاراستامول بهطور سنتی از منابع در حال کاهش سوختهای فسیلی از جمله نفت خام تولید میشود.
کارشناسان میگویند که هزاران تن سوخت فسیلی سالانه برای تأمین انرژی کارخانههایی که این دارو و سایر داروها و مواد شیمیایی را تولید میکنند مصرف میشود، و این مسئله تأثیر قابل توجهی در تغییرات اقلیمی دارد.
🔹 مقابله با آلودگی
این دستاورد به نیاز فوری برای بازیافت پلاستیک پرمصرفی به نام پلیاتیلن ترفتالات (PET) پاسخ میدهد،
که در نهایت به زبالهدانها فرستاده میشود یا اقیانوسها را آلوده میکند.
این پلاستیک سبک و مقاوم برای بطری آب و بستهبندی مواد غذایی استفاده میشود و سالانه بیش از ۳۵۰ میلیون تن زباله ایجاد میکند که باعث آسیب جدی محیطزیستی در سراسر جهان میشود.
محققان میگویند که بازیافت PET امکانپذیر است، اما فرآیندهای موجود محصولاتی ایجاد میکنند که همچنان به آلودگی پلاستیکی در جهان کمک میکنند.
🔹 تولید بدون انتشار کربن
تیمی از دانشمندان لابراتوار والاس در دانشگاه ادینبورگ از باکتری E. coli بازبرنامهریزی ژنتیکی شده و بیضرر استفاده کردند تا مولکولی مشتقشده از PET به نام ترفتالات اسید (terephthalic acid) را به ماده فعال پاراستامول تبدیل کنند.
محققان از یک فرآیند تخمیری (fermentation) مشابه فرآیندی که در تولید آبجو استفاده میشود بهره بردند تا تبدیل زباله صنعتی PET به پاراستامول در کمتر از ۲۴ ساعت انجام شود.
این تکنیک جدید در دمای محیط انجام شد و تقریباً هیچ انتشار کربنی ایجاد نکرد،
و نشان داد که میتوان پاراستامول را بهصورت پایدار تولید کرد.
محققان افزودند که برای تولید این دارو در مقیاس تجاری، نیاز به توسعه بیشتر است.
🔹 بازده و اهمیت علمی
حدود ۹۰ درصد محصول حاصل از واکنش ترفتالات اسید با E. coli بازبرنامهریزی شده، پاراستامول بود.
این کار نشان میدهد که پلاستیک PET فقط زباله یا مادهای برای تولید پلاستیک بیشتر نیست،
بلکه میتواند توسط میکروارگانیسمها به محصولات ارزشمند جدید تبدیل شود،
از جمله محصولاتی که پتانسیل درمان بیماریها را دارند.
🔹 دانشگاه ادینبورگ و رهبری جهانی در مهندسی زیستی
پروفسور استیون والاس، عضو UKRI Future Leaders Fellow و رئیس بیوتکنولوژی شیمیایی (Chemical Biotechnology) گفت:
دانشگاه ادینبورگ یکی از رهبران جهان در مهندسی زیستی است، که از اصول مهندسی برای بهرهگیری از فرآیندهای زیستی به منظور ایجاد محصولات و خدمات جدید استفاده میکند.
این دانشگاه بزرگترین و جامعترین گروه پژوهشی کشور را در این زمینه میزبانی میکند.
کارشناسان میگویند که این رویکرد جدید نشان میدهد که چگونه شیمی سنتی میتواند با مهندسی زیستی همکاری کند تا کارخانههای میکروبی زنده ایجاد شود که قادر به تولید مواد شیمیایی پایدار، کاهش زباله، کاهش انتشار گازهای گلخانهای و کاهش وابستگی به سوختهای فسیلی باشند.
🔹 حمایت مالی و همکاریها
تحقیق منتشر شده در Nature Chemistry توسط جایزه EPSRC CASE و شرکت داروسازی بیوفارماسوتیک آسترازنکا حمایت شد و توسط Edinburgh Innovations (EI)، سرویس تجاریسازی دانشگاه، پشتیبانی شد.
ما شرکتهای استثنایی مانند آسترازنکا را وارد همکاری با استیون و دیگران در دانشگاه میکنیم تا این کشفهای پیشرفته را به نوآوریهای جهانی تبدیل کنند.
مهندسی زیستی پتانسیل عظیمی دارد تا وابستگی ما به سوختهای فسیلی را کاهش دهد، اقتصاد چرخشی ایجاد کند و مواد و شیمیهای پایدار تولید کند.
تیم دانشگاه از همکاران بالقوه دعوت میکند با آنها تماس بگیرند تا در این مسیر همکاری کنند.
..................................................
طبیعت مجموعهای شگفتانگیز اما محدود از واکنشهای شیمیایی را تکامل داده است که پایه و اساس عملکرد تمام موجودات زنده را تشکیل میدهند. در مقابل، شیمی آلی سنتزی قادر است به واکنشهایی دسترسی پیدا کند که در طبیعت وجود ندارند. ادغام این واکنشهای غیرزیستی (abiotic) درون سیستمهای زنده، راهکاری زیبا و کارآمد برای تولید پایدار مواد شیمیایی صنعتی از منابع تجدیدپذیر ارائه میدهد.
در این پژوهش، ما یک واکنش بازآرایی لاسن (Lossen rearrangement) را معرفی میکنیم که به صورت زیستسازگار (biocompatible) درون باکتری اشرشیا کلی (Escherichia coli) انجام میشود. این واکنش بهوسیلهی یون فسفات (phosphate) کاتالیز میشود و باعث تبدیل ترکیبات فعالشدهی آسیل هیدروکساماتها (activated acyl hydroxamates) به متابولیتهای حاوی گروه آمین اولیه (primary amine-containing metabolites) درون سلولهای زنده میگردد.
با استفاده از روشی به نام auxotroph rescue ، نشان دادیم که چگونه این واکنش جدید و بیسابقه در طبیعت (new-to-nature reaction) میتواند برای کنترل رشد و فعالیت شیمیایی میکروارگانیسمها مورد استفاده قرار گیرد. در این روش، با اجرای واکنش لاسن درون سلول، میتوان متابولیت ضروری "پارا-آمینوبنزوئیک اسید" (para-aminobenzoic acid, PABA) را تولید کرد؛ مولکولی که برای ادامهی حیات باکتریهای خاص ضروری است.
علاوه بر این، بستر (substrate) واکنش لاسن را میتوان از پلیاتیلن ترفتالات (polyethylene terephthalate, PET)، یعنی همان پلاستیک متداول بطریها و بستهبندیها، سنتز کرد. این بستر قابل استفاده در واکنشهای بیوکاتالیزوری سلول کامل (whole-cell biocatalytic reactions) و فرآیندهای تخمیری (fermentations) است که منجر به تولید مولکولهای کوچک صنعتی از جمله داروی پاراستامول (paracetamol) میشود.
این یافتهها مسیر جدیدی برای زیستتصفیه (bioremediation) و بازیافت و ارتقای پلاستیکهای ضایعاتی (upcycling of plastic waste) در سیستمهای زیستی طبیعی و مهندسیشده فراهم میکند.
توسعهی واکنشهای زیستسازگار (biocompatible reactions) — یعنی تبدیلات شیمیایی غیرآنزیمی (non-enzymatic chemical transformations) که میتوانند با متابولیسم سلولی ترکیب شوند — رویکردی نوظهور برای گسترش توانایی سنتزی سیستمهای زنده است.
با استفاده از راهبردهای سنتزی شیمی آلی مدرن، واکنشهای زیستسازگار میتوانند برای کنترل عملکرد سلولی، افزایش تنوع متابولیتها در درون سلول (in vivo)، و نیز برای دسترسی زیستی به مواد اولیه دشوار یا غیرقابل تجزیه برای بیوتکنولوژی صنعتی به کار گرفته شوند.
این روش مکمل فناوریهای فعلی در زمینهی کاتالیز غیربیولوژیک درون سلولها (abiotic catalysis) است، از جمله:
-
تکامل هدایتشده (directed evolution)،
-
ایجاد جایگاههای فعال غیرطبیعی (non-native active sites) با استفاده از کو فاکتورهای مصنوعی یا آمینواسیدهای غیرطبیعی (unnatural amino acids)،
-
و طراحی آنزیمها از پایه به کمک روشهای محاسباتی (computational enzyme design).
با این حال، بازسازی آنزیمهای جدید و غیرطبیعی (new-to-nature biocatalysts) در محیط زنده بسیار چالشبرانگیز است و معمولاً کاربرد آنها به واکنشهای درون لوله آزمایش (in vitro) محدود میشود.
ادغام شیمیهای غیرطبیعی درون سلولهای زنده، و بهویژه در بستر متابولیسم سلولی، یکی از چالشهای بزرگ در زیستفناوری شیمیایی محسوب میشود.
راهبردهایی که بتوانند جعبهابزار محدود شیمی متابولیک را گسترش دهند، این امکان را فراهم میکنند که با استفاده از زیستشناسی مهندسیشده (engineered biology)، تولید زیستی مولکولهای صنعتی کوچک (industrial small molecules) از منابع تجدیدپذیر افزایش یابد. این امر میتواند وابستگی مسیرهای فعلی تولید شیمیایی به سوختهای فسیلی در حال کاهش را کم کند.
در حال حاضر، بیشتر پژوهشها در این زمینه محدود به استفاده از متالوآنزیمهای مصنوعی (artificial metalloenzymes) درون سلولهای میکروبی مهندسیشده است؛ در این سلولها بستر (substrate) و آپوآنزیم (apoenzyme) از طریق مسیرهای متابولیکی تولید میشوند و سپس یک کو فاکتور غیرطبیعی (non-native cofactor) برای انجام بیوسنتز به درون سلول منتقل میگردد.
به عنوان نمونه، Huang و همکاران واکنش سیکلوپروپاندار کردن غیرطبیعی (non-natural cyclopropanation) را بر روی لیمونن حاصل از متابولیسم در باکتری مهندسیشدهی E. coli گزارش کردند. در این سیستم از یک متالوآنزیم درونسلولی Ir-CYP119 و اتیلدیازواستات (ethyl diazoacetate) خارجی استفاده شد.
برای اینکه کوفاکتور Ir-porphyrin بتواند وارد سلول شود، پژوهشگران اپرون انتقال هم (hug operon haem transport system) را از باکتری Plesiomonas shigelloides همزمان با مسیر بیوسنتزی لیمونن بیان کردند.
در نهایت، این روش توانست ترکیب ترپنوئیدی غیرطبیعی حاوی حلقه سیکلوپروپان را در غلظت 0.25 میلیگرم بر لیتر و نسبت دیاستریومری 1:7.0:2.3:1.5 تولید کند.
علاوه بر این، سیکلوپروپاندار کردن طبیعی در غشای بیرونی E. coli و نیز در مایسلهای غشایی با استفاده از کاتالیزور غیرآنزیمی Fe-phthalocyanine نیز به نمایش درآمده است؛ در این حالت، استیرن (styrene) حاصل از متابولیسم گلوکز (D-glucose) توسط متابولیسم مهندسیشده درون سلول تولید شد و سپس در واکنش شرکت کرد. این واکنش بازدهی ۹۵٪ (۵۵۳ میلیگرم بر لیتر) داشت.
بهتازگی، Huang و همکاران توانستند ادغام کامل واکنشهای انتقال کاربن غیرطبیعی (non-native carbene-transfer cyclopropanation) را در متابولیسم میکروبی با استفاده از باکتری Streptomyces albus J1074 به انجام رسانند. در این سامانه، مسیر بیوسنتز استیرن از L-فنیلآلانین با مسیر طبیعی تولید آزاسرین (azaserine) (یک ترکیب طبیعی حاوی دیازو) ترکیب شد و همراه با متالوآنزیم مصنوعی Ir(Me)MPIX، تولید درونسلولی یک متابولیت غیرطبیعی حاوی سیکلوپروپان از بلوکهای سازندهی کاملاً زیستی را ممکن ساخت (با بازدهی 0.22 میلیگرم بر لیتر).
در پژوهش دیگری، Liu و همکاران از واکنش دکربوکسیلاسیون اکسایشی (oxidative decarboxylation) کاتالیزشده توسط همین (hemin) استفاده کردند تا ترکیب آلفا-استواکتولات (α-acetolactate) حاصل از متابولیسم را به دیاستیل (diacetyl) و در ادامه به (S,S)-۲٬۳-بوتاندیال ((S,S)-2,3-butanediol) در باکتری مهندسیشده Lactococcus lactis تبدیل کنند.
در مطالعهای جدیدتر، Dennis و همکاران واکنش آلفا-متیلندار کردن (α-methylenation) زیستسازگار را بر روی بوتیرآلدهید حاصل از متابولیسم نشان دادند، که در نهایت به تولید ۲-متیلبوتانال (2-methylbutanal) در E. coli مهندسیشده انجامید.
این مطالعات به طور کلی نشان میدهند که ریزسازوارهها (microorganisms) دارای انعطافپذیری متابولیکی بالا هستند و اصول شیمیایی میتوانند در مسیرهای متابولیکی سلولی با استفاده از کاتالیز غیرزیستی (abiotic catalysis) به کار گرفته شوند تا مولکولهای جدید و غیرطبیعی (new-to-nature small molecules) درون سلولها تولید گردند.
یکی از حوزههای تاکنون ناشناخته در شیمی زیستسازگار، بازآرایی غیرآنزیمی (non-enzymatic rearrangement) بسترهای کربوکسیلات فعالشده (activated carboxylate substrates) و ادغام آنها با مسیرهای متابولیکی طبیعی یا مهندسیشده در سلولها است.
این واکنش نخستینبار در سال ۱۸۷۲ توسط ویلهلم لاسن (Wilhelm Lossen) کشف شد.
بازآرایی لاسن (Lossen rearrangement) با دفع حرارتی یا فلزی یک گروه کربوکسیلات از یک بستر بیس-آسیل هیدروکسیلآمین (bis-acylated hydroxylamine substrate) مشخص میشود.
این واکنش معمولاً شامل یک استر فنیل هیدروکسامات (phenyl hydroxamate ester) است و در شرایط قلیایی از طریق مهاجرت آرایل 1,2- (1,2-aryl migration) انجام میشود.
در این فرآیند، ابتدا ایزوسیانات (isocyanate) تشکیل میشود که بهسرعت در محیط آبی با آب واکنش داده و اسید کاربامیک (carbamic acid) تولید میکند و سپس این ترکیب دکربوکسیله (decarboxylate) شده و آمین اولیه (primary amine) ایجاد میگردد.
از نظر سنتزی، این واکنش بسیار مفید است زیرا:
-
بستر واکنش لاسن را میتوان از اسیدهای کربوکسیلیک ساده و در دسترس تهیه کرد،
-
نیاز به استفاده از آزیدها (azides) را حذف میکند (برخلاف بازآرایی کرتیوس (Curtius rearrangement))،
-
و در شرایط ملایم قابل انجام است.
در مجموع، واکنش لاسن باعث تبدیل کربوکسیلاتها به آمینهای اولیه میشود و در این فرآیند یک اتم کربن از ساختار حذف میشود (one-carbon contraction). این ویژگی در تضاد با مسیرهای آنزیمی معمول مانند آمونیا لیازها (ammonia lyases) و آمینوترانسفرازها (aminotransferases) است.
واکنشهای نوع لاسن در برخی موارد در محیط درونلولهای (in vitro) مشاهده شدهاند؛ برای مثال به عنوان بسترهای غیرمولد (unproductive substrates) برای آنزیم کیموتریپسین (chymotrypsin)، یا به عنوان واسطههایی مسئول سمیت هیدروکسامیک اسیدها در باکتری Salmonella typhimurium TA98.
اما تا آنجا که ما میدانیم، بازآرایی لاسن تاکنون هرگز با متابولیسم میکروبی ترکیب نشده و در نتیجه هنوز هم واکنشی منحصر به شیمی آلی سنتزی به شمار میرود.
در این پژوهش، ما واکنش جابجایی سازگار با زیست (biocompatible Lossen rearrangement) را برای آسیل هیدروکزاماتها (acyl hydroxamates) درون سلولهای زنده گزارش میکنیم و این واکنش غیرزیستی (abiotic reaction) را با متابولیسم سلولی برای زیستسنتز طبیعی (native) و زیستسنتز نو (de novo) در باکتری Escherichia coli ترکیب کردهایم.
این واکنش درونزنده (in vivo)، در شرایط محیطی (دمای اتاق و فشار معمولی) انجام میشود، برای E. coli غیرسمی است و بهوسیله یون فسفات درون سلولها کاتالیز میشود.
سپس ما بستر واکنش جابجایی لاسن را از پلیاتیلن ترفتالات (PET)، یعنی همان پلاستیکی که در بطریها به کار میرود، سنتز کردیم و از طریق آزمایش نجات اکسوتروف (auxotroph rescue) نشان دادیم که رشد و متابولیسم E. coli میتواند به یک مولکول کوچک مشتقشده از بطری پلاستیکی وابسته باشد (شکل 1b).
در نهایت، همکاری متابولیکی (metabolic cooperation) با واکنش لاسن از طریق بیوترانسفورماسیون شرطی (conditional biotransformation) آلکنهای خارجی و پاراآمینوبنزوات (PABA) مشتقشده از PET به داروی ضد درد و تببر پاراستامول (para-hydroxyacetanilide) نشان داده شد.
در مجموع، این تحقیق جعبهابزار شیمی متابولیکی را برای سنتز مولکولهای کوچک در سلولهای طبیعی و مهندسیشده گسترش میدهد.
غربالگری واکنش از طریق نجات اکسوتروف (Reaction screening via auxotroph rescue)
با الهام از کار Li و همکاران درباره جابجایی لاسن کاتالیزشده توسط کمپلکس آهن–فنانترولین (Fe-phenanthroline) روی بسترهای مشتقشده از هتروآوکسین در دیکلرومتان و در دمای اتاق، و همچنین از گزارشهای مربوط به واکنش درج N–O کاتالیزشده توسط هِمین (hemin-catalysed N–O insertion) در آنزیمهای مصنوعی، ما فرض کردیم که کاتالیزور فلزی سازگار با زیست میتواند در شرایط آبی، نیتروئید میانمرحلهای (nitrenoid intermediate) را از یک بنزهیدروکزامات دارای جانشین O-پیوالویل (O-Piv) تولید کند.
بنابراین هدف ما بررسی این بود که آیا واکنش جابجایی لاسن واقعاً زیستسازگار است و آیا میتواند با متابولیسم میکروبی ترکیب شود تا زیستسنتز غیرطبیعی (non-natural biosynthesis) را ممکن کند.
برای ارزیابی همزمان فعالیت کاتالیزور و زیستسازگاری آن، ما آزمایش نجات اکسوتروف (auxotroph rescue experiment) طراحی کردیم، به این صورت که بستر جابجایی لاسن با ساختار پارا-کربوکسیل O-پیوالویلهیدروکزامات (شماره 1) باید درون محیط، متابولیت ضروری PABA (پاراآمینوبنزوییک اسید) را تولید کند.
PABA یک متابولیت حیاتی برای سنتز اسید فولیک در باکتریهاست، و ارگانیسمهایی که توانایی تولید آن را ندارند نمیتوانند رشد کنند زیرا در متابولیسم نوکلئوتید و DNA دچار اختلال میشوند.
بنابراین، آرگانیسمهای اکسوتروف (از جمله انسان) باید این مواد مغذی ضروری را از محیط اطراف یا از سایر ریزاندامگان مجاور دریافت کنند.
در نتیجه، اگر واکنش لاسن موفقیتآمیز باشد و بستر 1 به PABA تبدیل شود، سلولهای اکسوتروف قادر به رشد خواهند بود، و این رشد را میتوان از طریق اندازهگیری چگالی نوری در طولموج 600 نانومتر (OD600) ردیابی کرد (شکل 2a).
از سوی دیگر، اگر کاتالیزور سمی باشد، رشد سلولها متوقف میشود، حتی اگر PABA تشکیل شده باشد؛ بنابراین رشد سلولها شاخصی مثبت از فعالیت کاتالیزور و سازگاری زیستی آن خواهد بود.
برای انجام این آزمایش، بنزهیدروکزامات O-پیوالویل (شماره 1) را در دو مرحله از 4-فورمیل بنزوئیک اسید سنتز کردیم:
-
تشکیل پیوند آمیدی با O-پیوالویلهیدروکسیلآمین
-
اکسیداسیون گروه آلدئیدی با استفاده از اسید پِریودیک و کاتالیزور پیریدینیوم کلروکرومات (PCC)
(طرح واکنش در ضمیمه ارائه شده است).
برای آزمون، از چندین سویه E. coli K-12 از مجموعه Keio Collection استفاده شد، از جمله E. coli BW25113ΔpabB که در زیرواحد کاتالیتیک آنزیم آمینودئوکسیکوریزمات سنتاز (aminodeoxychorismate synthase) دچار حذف ژنی است. این آنزیم در مرحله ماقبل آخر سنتز PABA نقش دارد (شکل 1a و شکل مکمل 1).
سپس، مجموعهای از کاتالیزورهای فلزی که در مقالات قبلی برای واکنشهای جابجایی لاسن یا کورتيوس (Curtius rearrangement) و واکنشهای مشابه در شرایط ملایم یا آبی معرفی شده بودند، انتخاب شد. این کاتالیزورها شامل موارد زیر بودند:
-
FeCl₂ (کلرید آهن II)
-
هِمین (hemin)
-
آهن فتالوسیانین (iron phthalocyanine)
-
فروئین (ferroin)
-
ZnTPP (زینک تترافنیلپورفیرین)
-
Zn(PPIX)
-
Zn(acac)₂ (زینک استیلاستواتونات)
در این مرحله از آزمایش، بستر واکنش لاسن شماره ۱ (به غلظت ۱۰ میکرومولار) به لولههای رشد حاوی محیط M9–گلیسرول و کاتالیزور (به میزان ۱۰ مول درصد) افزوده شد. سپس، باکتری E. coli BW25113ΔpabB از یک کشت اولیه اشباعشده که در محیط M9–گلیسرول حاوی PABA رشد کرده بود (با رقت 10510^5105) به این لولهها تلقیح شد.
کشتها به مدت ۷۲ ساعت در دمای ۳۷ درجه سانتیگراد و با سرعت ۲۲۰ دور در دقیقه (r.p.m.) انکوبه شدند (شکل 2a).
همانطور که انتظار میرفت، در نبود PABA هیچ رشدی مشاهده نشد.
اما بهطور غیرمنتظره، رشد سلولی در تمامی لولههای دیگر دیده شد (شکلهای 2b و 2c).
نکتهی بسیار مهم این بود که حتی در کشتهای کنترل که فقط بستر شماره ۱ وجود داشت و هیچ کاتالیزوری افزوده نشده بود نیز رشد سلولی رخ داد.این مشاهده نشان میدهد که واکنش جابجایی لاسن برای بستر شماره ۱ زیستسازگار (biocompatible) است و احتمالاً به یکی از سه حالت زیر رخ میدهد:
-
بهصورت خودبهخود در محیط رشد (spontaneously)،
-
با کمک اجزای سلولی (مثلاً غشاء سلولی)،
-
یا بهوسیلهی یک آنزیم طبیعی موجود در E. coli کاتالیز میشود (شکلهای 2d و 2e).
-
برای حذف دو احتمال آخر (یعنی نقش سلول یا آنزیم طبیعی)، مقدار PABA تولیدشده به روش آزمون رنگسنجی با معرف N-(1-naphthyl)ethylenediamine در واکنشهای کنترل انجامشده در محیط M9–گلیسرول بدون سلول اندازهگیری شد (شکل 2f و شکل مکمل 2).
نتایج نشان داد که: -
PABA حتی در غیاب سلولها نیز تشکیل میشود،
-
اما وقتی بستر ۱ در آب فوق خالص (ultrapure H₂O) انکوبه شد، هیچ PABA تولید نشد.
-
برای شناسایی دقیق عامل واکنش، هر یک از اجزای محیط M9 (شامل NH₄Cl، CaCl₂، MgSO₄ و HPO₄²⁻) بهصورت جداگانه حذف شدند و میزان تشکیل PABA در هر حالت با محلول بافر فسفات (PBS) مقایسه شد.
نتیجهی این بررسیها نشان داد که واکنش لاسن برای بستر شماره ۱ توسط یون فسفات (phosphate) کاتالیز میشود.
در ادامه، مشاهده شد که تشکیل آنیلین (aniline) از دو ترکیب دیگر یعنی
-
N-متیل O-استیل بنزهیدروکزامیک اسید (ترکیب ۳) و
-
بنزهیدروکزامیک اسید (ترکیب ۴)
در همین شرایط کاملاً متوقف میشود (شکل 2g و شکل مکمل 3).
این یافته نشان میدهد که واکنش احتمالاً از طریق دیپروتونه شدن اولیه گروه N–H و سپس جابجایی 1,2–آریل (1,2-aryl migration) پیش میرود،
نه از طریق هیدرولیز استر و پس از آن جابجایی کاتالیزشده توسط فسفات در هیدروکزامیک اسید مربوطه (شکل 2g). -
نتایج آنالیز طیفسنجی نوری (spectrophotometric analysis) نشان داد که بیشترین چگالی نوری (OD600) در کشتهایی مشاهده شد که در آنها بستر ۱ همراه با یکی از ترکیبات زیر حضور داشت:
-
FeCl₂
-
فروئین (ferroin)
-
یا Fe(acac)₃ (آهن استیلاستونات)
(شکل 2c). -
جالب آنکه این ترکیبات، ضعیفترین کمپلکسهای پیونددهنده آهن (Fe binders) هستند.
بنابراین، رشد بیشتر این کشتها احتمالاً ناشی از واکنش لاسن کاتالیزشده توسط فسفات بهصورت غیرآنزیمی است، که در ادامه موجب افزایش دسترسی آهن برای باکتری در فاز لگاریتمی رشد میشود — فازی که در این شرایط محدودکننده رشد است.
آزمایش نجات اکسوتروف (auxotroph rescue) همچنین در دو سویهی دیگر از مجموعه Keio، یعنی
-
E. coli BW25113ΔpabA
-
و E. coli BW25113ΔaroC
نیز تأیید شد.
هر دو سویه نسبت به E. coli BW25113ΔpabB که در حضور PABA یا بستر ۱ رشد کرده بود،
یا فاز تأخیر طولانیتر (extended lag phase)
و یا تراکم نهایی سلولی پایینتری (lower final cell density) نشان دادند (شکل مکمل 1). -
برای ارزیابی سمیت، آزمون رقت سریالی و شمارش کلنی (plate count assay) انجام شد.
نتایج نشان داد که تمام بسترها در بازهی غلظتی ۱۰ تا ۱۰۰۰ میکرومولار،
هم در سنجش OD600 و هم در شمارش واحدهای تشکیلدهنده کلنی (CFU/mL)،
برای رشد E. coli غیرسمی و زیستسازگار هستند (شکل 2e و شکل مکمل 4).
در مرحلهی بعد، مجموعهای از بسترهای O-آسیل (O-acyl substrates) با گروههای آبدوست (hydrophilic) و آبگریز (hydrophobic) مورد بررسی قرار گرفتند.
تمامی آنها به آمینهای آروماتیک تبدیل شدند، اما افزایش قابل توجهی در سرعت واکنش مشاهده نشد،
بهجز در مورد بستر پنتافلوروبنزیل (S2) که تشکیل محصول بسیار سریع بود (شکل مکمل 3).
در مقابل، در مورد بستر آبدوست O-سوکسیلیل (S6)، فعالیت واکنش لاسن بهکلی از بین رفت (شکل مکمل 3).همچنین در مورد بستر O-Ac (استیله)، واکنش رقابتی هیدرولیز به بنزهیدروکزامیک اسید ۴ مشاهده شد؛
بنابراین، بستر شماره ۱ برای ادامه مطالعات انتخاب شد.
در پایان، اندازهگیری کمی توسط HPLC (کروماتوگرافی مایع با کارایی بالا) در طول زمان و در حضور و غیاب سلولهای E. coli BW25113ΔpabB در حال تکثیر انجام شد.
نتایج نشان داد که پس از ۲۴ ساعت، همزمان با ورود سلولها به فاز رشد لگاریتمی، مصرف بستر افزایش مییابد.این دادهها نشان میدهد که واکنش جابجایی لاسن برای بستر ۱ نه تنها زیستسازگار است، بلکه احتمالاً در حضور سلولهای متابولیک فعال تسریع نیز میشود (شکل 2h).
-
-
زیستپالایی (Bioremediation) پلاستیک PET
با وجود اینکه تمرکز اولیه ما بر توسعه واکنشهای زیستسازگار برای سنتز درون سلولهای میکروبی بود،
اما این مشاهده جالب (زیستسازگاری واکنش لاسن) یک مسیر جدید را نشان داد:
یعنی امکان زیستپالایی (bioremediation) ترکیب شماره ۱ که میتواند از مواد زاید (waste materials) مشتق شود.
به عنوان مثال، میتوان تصور کرد که بستر ۱ از «اسید ترفتالیک» (terephthalic acid) ساخته شود —
مادهای که تکتک واحدهای مونومری حاصل از «دیپلیمریزاسیون پلاستیک PET» (پلیاتیلن ترفتالات) را تشکیل میدهد.
بنابراین، ما این فرض را مطرح کردیم که:
میتوانیم ترکیب ۱ را از زبالههای پلاستیکی PET سنتز کنیم و سپس با ایجاد کمبود تغذیهای (auxotrophy) برای PABA در یک سویه میکروبی،
رشد آن سلولها را مشروط به حضور مولکولهای کوچک مشتق از PET کنیم.
به این ترتیب، یک راهبرد زیستفناورانه برای حذف و تبدیل این زبالهی پلاستیکی فراوان و آلاینده محیطزیست به زیستتودهی میکروبی ارائه میشود.
در حال حاضر، تولید صنعتی جهانی PET حدود ۵۶ میلیون تُن در سال است،
که حدود ۸۰٪ از آن برای مصارف یکبار مصرف طراحی شده است.
در نتیجه، حدود ۲۴ میلیون تُن زباله PET در هر سال تولید میشود که یا سوزانده میشود یا در محل دفن زباله (landfill) انباشته میگردد.
برای بررسی این ایده، سنتز بستر ۱ از بطری پلاستیکی دورریختهشده در دو مرحله بهینهسازی شد:
-
هیدرولیز تکههای پلاستیک PET به اسید ترفتالیک (terephthalic acid)،
-
سپس واکنش جفت شدن آمیدی (amide coupling) بین اسید ترفتالیک و ترکیب
O-Piv hydroxylammonium triflate در حضور پروپیلفسفونیک انیدرید (T3P).
این واکنش دو مرحلهای منجر به تولید ترکیب PET-1 شد
(مطابق شکل 3a و طرح مکمل شماره 1).
در آزمایشهای بعدی، احیای سویه اکسوتروف E. coli BW25113ΔpabB و رشد آن در حضور ترکیب PET-1 مشاهده شد.
این رشد همراه بود با:
-
کاهش کمی در غلظت بستر (substrate concentration)،
-
و عدم شناسایی هیچ مقدار قابلتشخیص از PABA پس از ۴۸ ساعت (شکلهای 3b–d).
نرخ رشد سلولها در حضور PET-1 نیز با رشد در حضور PABA قابل مقایسه بود:
-
نرخ رشد برای PABA برابر با ۰٫۲۵ ساعت⁻¹،
-
و برای PET-1 برابر با ۰٫۳۳ ساعت⁻¹ پس از ۴۰ ساعت انکوباسیون.
همچنین:
-
چگالی نهایی سلولی (OD600)،
-
و شمارش زندهمانی (CFU/ml) در فاز سکون (stationary phase)،
در هر دو حالت (PABA و PET-1) تقریباً مشابه بود.
در نهایت، میزان کاهش بستر در حضور PET-1 نیز مشابه مقدار کاهش بستر ۱ بود
(شکل 3d و شکل مکمل 5).
🧬 سنتز متابولیکی ترکیبی (Interfaced Metabolic Synthesis)
پس از آنکه پژوهشگران تأیید کردند که واکنش "بازآرایی لاسن" (Lossen rearrangement) یک واکنش زیستسازگار (biocompatible reaction) است و میتواند برای زیستپالایی (bioremediation) بسترهای مشتقشده از پلاستیک PET استفاده شود،
گام بعدی آنها بررسی این بود که آیا سلولهای نجاتیافته (rescued cells) میتوانند در واکنشهای بیوکاتالیتیکی (biocatalytic reactions) مورد استفاده قرار گیرند یا خیر (شکل 4a).
🔹 استفاده از سلول کامل در واکنشهای احیایی (C=C bond reduction)
در آغاز، تمرکز مطالعه روی احیای پیوند دوگانه C=C در مالئاتها (maleates) و کتو-آکریلاتها (keto-acrylates) بود.
این واکنشها پیشتر توسط Brewster و همکارانش در شرایط تخمیری با استفاده از آنزیمهای ردوکتاز طبیعی (native reductases) در E. coli گزارش شده بودند.
بنابراین، ترکیبات دیمتیل مالئات (dimethyl maleate, DMM, 5) و کتو-آکریلاتهای (E)-7 و (Z)-7 سنتز شدند و به محیط کشت E. coli BW25113ΔpabB که در حضور ترکیب ۱ رشد کرده بود افزوده شدند.
نتیجه بسیار جالب بود:
تمامی این بسترها پس از ۲۴ ساعت در دمای ۳۷ درجه سانتیگراد به طور کامل به دیمتیل سوکسینات (dimethyl succinate, 6) یا γ-کتواستر (γ-ketoester, 8) تبدیل شدند که با طیفسنجی رزونانس مغناطیسی هستهای پروتون (^1H NMR) تأیید گردید.
تشکیل محصول تنها در حضور PABA یا ۱ مشاهده شد، که نشان داد واکنش زیستسازگار لاسن میتواند برای کنترل خروجی شیمیایی یک فرآیند تخمیری میکروبی استفاده شود (شکل 4b).
🔹 اتصال واکنش لاسن به مسیرهای متابولیکی و سنتزی سلولی
پس از آنکه پژوهشگران واکنش لاسن را با رشد سلولی، متابولیسم و مسیرهای زیستی طبیعی ترکیب کردند، تصمیم گرفتند بررسی کنند که آیا محصول واکنش لاسن میتواند وارد یک مسیر متابولیکی نوین (de novo metabolic pathway) درون سلول شود یا خیر.
برای آزمودن این فرض، هدف آنها سنتز داروی پاراستامول (para-hydroxyacetanilide, 10) از ترکیب ۱ در E. coli مهندسیشده بود.
💊 سنتز پاراستامول در E. coli مهندسیشده
هر دو ترکیب ۱ و ۱۰ (پاراستامول) برای E. coli BW25113ΔpabB تا غلظتهای به ترتیب ۱ میلیمولار (۲۶۵ mg/L) و ۶.۶ میلیمولار (۱ g/L) غیرسمی بودند (شکل تکمیلی ۸).
پاراستامول یکی از داروهای توصیهشده توسط سازمان بهداشت جهانی (WHO) بهعنوان خط اول درمان درد و تب در سراسر جهان است.
در حال حاضر، این دارو از فنول (phenol) که از سوختهای فسیلی و از طریق فرآیند کومن (cumene process) به دست میآید، تولید میشود. این مسیر شامل مراحل نیترهکردن، کاهش، و N-استیلاسیون با انیدرید استیک (acetic anhydride) است تا در نهایت شکل دارویی خوراکی آن ساخته شود.
در مقابل، پاراستامول (۱۰) میتواند درون سلولها از PABA (پاراآمینوبنزوئیک اسید) از طریق ۴-آمینوفنول (4-AP, 9) و با دو آنزیم سنتز شود:
-
آمینوبنزوئات هیدروکسیلاز (ABH60) وابسته به O₂ و NADH از قارچ Agaricus bisporus،
-
موتانت K211G از آنزیم آریلآمین N-آسیلترانسفراز وابسته به استیلکوآنزیم A (PANAT) از باکتری Pseudomonas aeruginosa (شکل 4c).
پیش از این، سنتز پاراستامول از D-گلوکز در E. coli گزارش شده بود، اما نه از بسترهای حاصل از زباله یا مشتقات PET.
🧫 طراحی و مهندسی مسیر زیستی
برای این هدف، ژنهای abh60 و panat سنتز و در یک وکتور JUMP (Joint Universal Modular Plasmid) کلون شدند و پلاسمید حاصل pSWL112 نام گرفت.
ژن مقاومت به کانامایسین از سویه E. coli BW25113ΔpabB با آنزیم فلپیاز (Flippase) حذف شد تا سلول آمادهی دریافت پلاسمید جدید و تبدیل به سویهای مهندسیشده و آکسوتروفیک برای تولید پاراستامول شود که رشدش با ترکیب ۱ بازیابی میشد.
با این حال، آنالیز HPLC نشان داد که این سلول مهندسیشده در حضور ۱ تنها ترکیب ۴-استامیدوبنزوئیک اسید (4-AB, 31 mg/L) را تولید میکند،
که حاصل استیلاسیون غیربهینه PABA توسط PANAT و استیلکوآنزیم A بود — یعنی واکنش بهدرستی به سمت پاراستامول پیش نرفت (شکل 4c).
⚙️ بهینهسازی مسیر سنتز پاراستامول
برای رفع این مشکل، مجموعهای از پلاسمیدهای اصلاحشده JUMP ساخته شدند که ژنهای abh60 و panat را تحت کنترل پروموترهای القایی و دائمی (constitutive/inducible promoters) داشتند تا جریان متابولیکی (flux) از PABA به پاراستامول را بهینه کنند.
دو استراتژی آزمایش شد:
-
استراتژی نخست: رشد سویههای
E. coli BW25113ΔpabB_pSWL156_pSWL354 و E. coli BW25113ΔpabB_pSWL156_pSWL355
در حضور ترکیب ۱، با بیان دائمی abh60 (پلاسمید pSWL156, J23100-abh60)
و بیان القایی panat تحت پروموترهای /Pbad و /Ptet که پس از ۷۲ ساعت القا شدند. -
استراتژی دوم: جداسازی واکنشهای کاتالیزشده توسط ABH60 و PANAT در دو سویه متفاوت از E. coli:
یکی BW25113ΔpabB_pSWL156 یا BW25113ΔpabB_pSWL350 برای ABH60،
و دیگری BL21(DE3)_pSWL157 (/T7-IPTG-panat) برای PANAT.
سلولهای حاوی PANAT پس از رشد سویه اول به محیط اضافه شدند (OD600 = 20).
نتایج هر دو روش بسیار موفق بود:
تولید 4-AB حذف شد و پاراستامول با بازدههای ۱۲ mg/L و ۱۹ mg/L (معادل ۲۹٪ بازده) از ترکیب ۱ حاصل شد (شکل 4c).
🧪 بهینهسازی نهایی واکنش دو مرحلهای (one-pot two-step)
برای افزایش کارایی سنتز پاراستامول از ترکیب ۱ و PET-1، یک واکنش دو مرحلهای در یک ظرف (one-pot) طراحی شد:
-
ابتدا واکنش لاسن در بافر فسفات آبی (pH 8.0، 200 mM) در ۵۰°C انجام شد.
-
سپس سلولهای کامل E. coli BW25113ΔpabB_p354 و E. coli BW25113ΔpabB_p350
که به ترتیب panat و abh60 را بیان میکردند، افزوده شدند (نسبت 1:200، دمای ۳۷°C، چگالی نوری OD600 بین 12.5 تا 25).
در این شرایط، بازده تولید پاراستامول از PABA برابر ۱۰۰٪ و از ترکیب ۱ برابر ۸۶٪ بود (شکل 4d).
استفاده از بستر مشتق از پلاستیک یعنی PET-1 نیز بازدهی ۸۳٪ داشت.
با کاهش غلظت آرابینوز در مرحله بیان پروتئین، نسبت دو سویهی بیانکننده panat و abh60 به ۱:۱۰۰ کاهش یافت و بازده نهایی سنتز پاراستامول از PET-1 به ۹۲٪ رسید (شکل 4d).
🌍 گامهای آینده: زیستپالایی و پایداری صنعتی
مرحله بعدی توسعه این فرایند شامل افزایش مقیاس واکنش (bioreactor scale-up) و تجزیه زیستی درجا (in situ depolymerization) پلاستیک PET صنعتی برای دستیابی همزمان به زیستپالایی (bioremediation) و بازیافت زیستی پیشرفته (bio-upcycling) است.
همچنین، برای سنجش پایداری زیستمحیطی، تحلیلهای چرخه عمر (life cycle assessment) انجام خواهد شد تا اطمینان حاصل شود که هر بهینهسازی موجب حداکثر صرفهجویی و بهره زیستپایدار میشود.
در آینده، پژوهشگران قصد دارند مسیر متابولیکی de novo را بیشتر بهینه کنند تا جریان متابولیکی به سمت سنتز پاراستامول حداکثر شود و نیز واکنش زیستسازگار لاسن را در مسیرهای شیمی-آنزیمی دیگر به کار گیرند و در نهایت آن را بهطور کامل در میکروارگانیسمهای مهندسیشده متابولیکی ادغام کنند.
🧪 نتیجهگیری (Conclusions)
این مطالعه کشف یک واکنش زیستسازگار لاسن (biocompatible Lossen rearrangement) را گزارش میکند که میتواند با متابولیسم سلولی در باکتری E. coli ترکیب شود.
این واکنش غیرآنزیمی (non-enzymatic reaction) در حضور سلولهای باکتریایی انجام میشود، سمی نیست و توسط فسفاتهای مونو- یا دیبازیک (mono- or di-basic phosphate) در pH خنثی کاتالیز میشود.
این موضوع نقش چندجانبه یونهای فسفات در سلولهای زنده را برجسته میکند، که تاکنون در هومئوستازی pH، سنتز غشاء و اکنون در شیمی غیرآنزیمی زیستسازگار دیده شده است.
🔹 تولید آمینهای اولیه به روش غیرمعمول
واکنش زیستسازگار لاسن همچنین محصولات آمین اولیه (primary amine products) را درون سلولها ایجاد میکند،
که مکانیزم آن متفاوت از منطق سنتزی شناختهشده (known biosynthetic logic) است.
بنابراین، این واکنش یک ابزار مفید در مهندسی متابولیک (metabolic engineering) برای تولید متابولیتهای حاوی آمین فراهم میکند.
🔹 کنترل رشد میکروبی و واکنشهای سلولی
با استفاده از تست بازیابی آکسوتروف (auxotroph rescue) نشان داده شد که PABA میتواند توسط واکنش لاسن درون سلولی تولید شود و برای کنترل رشد میکروبی و واکنشهای شیمیایی در فرآیندهای تخمیری و واکنشهای سلول کامل مورد استفاده قرار گیرد.
🔹 استفاده از زبالههای PET برای سنتز بستر واکنش
سنتز بستر واکنش لاسن از بطری پلاستیکی PET ضایعاتی انجام شد و این بستر بهصورت متابولیکی وارد مسیر سلولی شد تا هم بیوماس تولید شود و هم واکنشهای بیوکاتالیتیکی سلول کامل کنترل شوند.
🔹 مسیر زیستی نوین برای تولید پاراستامول
این بستر سپس به یک مسیر زیستی نوین (de novo biosynthetic pathway) برای تولید پاراستامول (paracetamol) منتقل شد،
که نشاندهنده تولید این داروی ضروری از زباله پلاستیکی است،
و این استراتژی تنها با شیمی سنتزی یا زیستشناختی بهتنهایی قابل دسترسی نیست.
🔹 چشمانداز شیمی زیستسازگار
از این رو، شیمی زیستسازگار (biocompatible chemistry) باید بهعنوان ابزاری مکمل در کنار کارهای نوظهور در طراحی و مهندسی آنزیمها برای شیمی غیرزیستی (abiotic chemistry) در نظر گرفته شود،
و بهطور همکارانه در سلولهای زنده ادغام شود تا افقهای سنتز شیمیایی در سیستمهای زیستی مهندسیشده گسترش یابد.