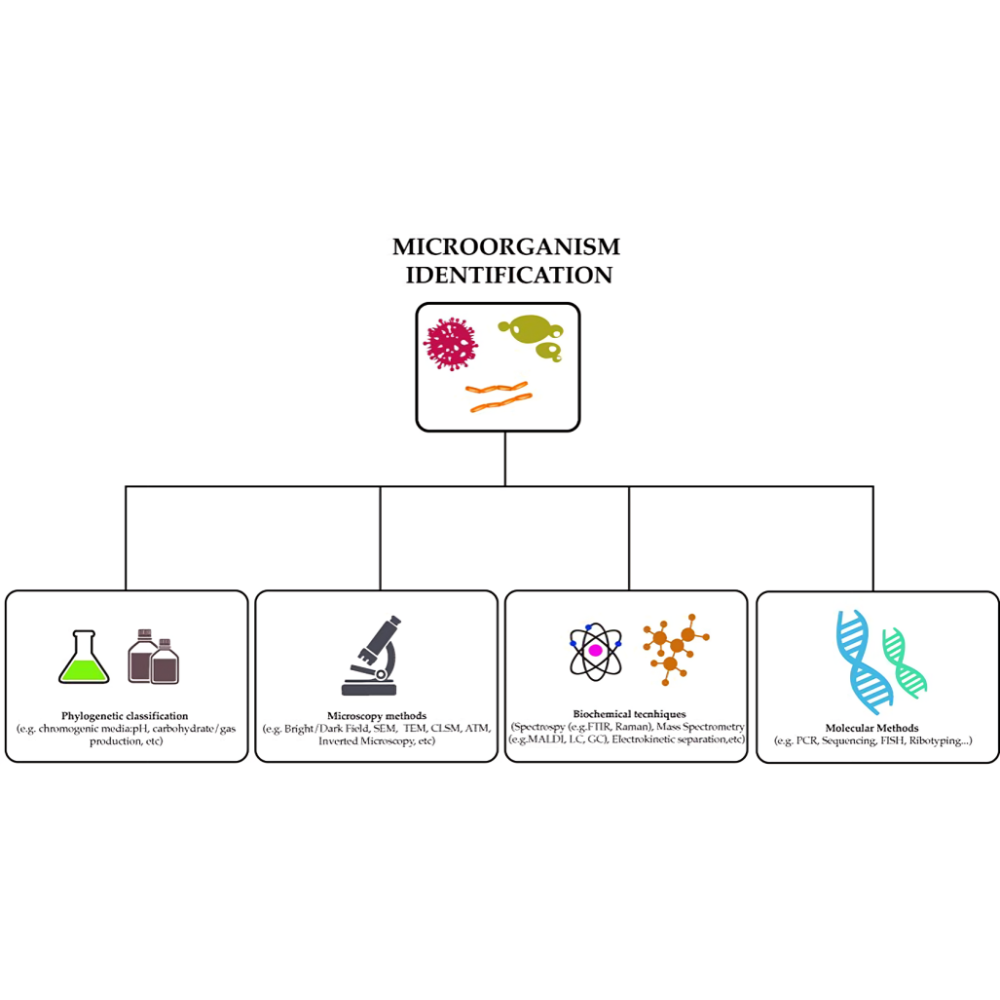
شناسایی میکروب ها با تستهای بیوشیمیایی
مقدمه
شناسایی میکروبها یکی از پایهایترین و حیاتیترین فعالیتها در میکروبیولوژی بالینی، صنعتی و محیطی است. میکروبها، از باکتریها و قارچها گرفته تا ویروسها و پروتوزوآها، در بسیاری از فرآیندهای زیستی نقش دارند و سلامت انسان، حیوان و محیط را تحت تاثیر قرار میدهند. بنابراین، توانایی شناسایی دقیق این موجودات میکروسکوپی، نه تنها برای تشخیص بیماریها و انتخاب درمان مناسب، بلکه برای پیشگیری از انتشار عفونتها و کنترل کیفیت محصولات غذایی و دارویی ضروری است. در دهههای گذشته، روشهای مختلفی برای شناسایی میکروبها توسعه یافتهاند، که از شیوههای کلاسیک کشت و مورفولوژی تا تکنیکهای مولکولی و پروتئومیکس مدرن را شامل میشوند. با این حال، تستهای بیوشیمیایی همچنان به عنوان ستون فقرات میکروبیولوژی بالینی و تحقیقاتی مورد استفاده قرار میگیرند و اهمیت آنها با گذر زمان کاهش نیافته است.
تستهای بیوشیمیایی، بر اساس فعالیتهای آنزیمی و مسیرهای متابولیکی باکتریها و سایر میکروبها طراحی شدهاند. این روشها به محققان و متخصصان اجازه میدهند تا با بررسی توانایی یک میکروب در تجزیه مواد مغذی خاص، تولید گاز یا اسید، یا واکنش با معرفهای شیمیایی مشخص، هویت آن را به دقت تعیین کنند. برای مثال، آزمایش کاتالاز و اکسیداز از جمله تستهای ابتدایی هستند که در بسیاری از آزمایشگاههای بالینی برای تمایز بین گونههای باکتریایی مورد استفاده قرار میگیرند. تستهای پیچیدهتر شامل بررسی توانایی میکروبها در مصرف قندهای مختلف، تولید آنزیمهای خاص مانند اورهآز یا لیپاز، و استفاده از سیستمهای نیمهخودکار و کیتهای استاندارد میشوند.
اهمیت بالینی شناسایی دقیق میکروبها از چند جهت قابل توجه است. نخست، تشخیص سریع و صحیح عامل عفونت به پزشکان کمک میکند تا درمان هدفمند و مناسب انتخاب کنند، که این امر نقش حیاتی در کاهش مقاومت آنتیبیوتیکی و افزایش موفقیت درمان دارد. دوم، در محیطهای بیمارستانی و مراکز بهداشتی، شناسایی دقیق میکروبها کمک میکند تا اپیدمیهای بیمارستانی به موقع شناسایی و کنترل شوند، به ویژه گونههایی که قابلیت انتشار سریع یا مقاومت دارویی دارند. سوم، از نظر تحقیقاتی، شناخت دقیق میکروبها به درک تعاملات پیچیده میکروبی با میزبان، محیط و سایر میکروارگانیسمها کمک میکند و پایهای برای توسعه درمانهای نوین، پروبیوتیکها و استراتژیهای بیوسنتز صنعتی فراهم میآورد.
با وجود پیشرفتهای تکنولوژی، همچنان تستهای بیوشیمیایی به دلیل سهولت اجرا، هزینه مناسب و قابلیت تطبیق با آزمایشگاههای مختلف، یکی از پرکاربردترین ابزارهای شناسایی میکروبها هستند. این تستها به ویژه در کشورهای در حال توسعه، آزمایشگاههای تشخیصی کوچک و محیطهایی که دسترسی به تجهیزات پیشرفته محدود است، نقش بسیار مهمی دارند. همچنین، این روشها پایهای برای آموزش میکروبیولوژی و درک مفاهیم پایه متابولیکی و آنزیمی میکروبها فراهم میکنند و به محققان کمک میکنند تا توانایی تحلیل دادهها و تشخیص دقیق میکروبها را بدون وابستگی کامل به تجهیزات پیشرفته کسب کنند.
در طول تاریخ، شناسایی میکروبها تحول عظیمی را تجربه کرده است. از مشاهده میکروسکوپی و تفکیک اولیه بر اساس شکل و رنگ گرفته تا معرفی تستهای بیوشیمیایی استاندارد در قرن بیستم، و در نهایت ورود روشهای مولکولی، طیفسنجی جرمی و متاژنومیک در قرن بیستویکم، هر مرحله توانسته دقت، سرعت و قابلیت اطمینان تشخیص میکروبها را افزایش دهد. با این حال، تستهای بیوشیمیایی هنوز به عنوان یک مرجع استاندارد و قابل اعتماد برای تایید هویت میکروبها مورد استفاده قرار میگیرند، زیرا این تستها اطلاعات جامع و کاربردی درباره رفتار متابولیکی میکروبها ارائه میدهند که هیچ روش مولکولی به تنهایی قادر به ارائه کامل آن نیست.
در این مقاله، قصد داریم یک مرور جامع و علمی بر تستهای بیوشیمیایی برای شناسایی میکروبها ارائه دهیم. این مقاله تمامی جنبههای مهم شامل اصول پایه، روشهای کلاسیک و مدرن، سیستمهای تجاری، کاربردهای بالینی و صنعتی، محدودیتها و چالشها، و چشمانداز آینده شناسایی میکروبها را بررسی خواهد کرد. هدف این است که متخصصان، پژوهشگران و علاقهمندان بتوانند با مطالعه این مقاله، دانش جامع و بهروزی از تستهای بیوشیمیایی و جایگاه آنها در میکروبیولوژی مدرن کسب کنند و از آن در کارهای تحقیقاتی و تشخیصی بهرهمند شوند.
اصول و مفاهیم پایهای شناسایی میکروبها
شناسایی میکروبها یک فرآیند چندبعدی است که ترکیبی از دانشهای مورفولوژی، متابولیسم، ژنتیک و محیط زیست را در بر میگیرد. پیش از آنکه بتوان یک میکروب را به صورت دقیق شناسایی کرد، لازم است با مفاهیم پایهای و اصولی که مسیر تشخیص را هدایت میکنند، آشنا شویم. این اصول نه تنها برای اجرای تستهای بیوشیمیایی ضروری هستند، بلکه به درک محدودیتها و کاربردهای هر روش نیز کمک میکنند.
تعریف و دستهبندی میکروبها
میکروبها موجودات بسیار کوچک و غالباً تکسلولی هستند که قادر به زندگی مستقل یا وابسته به میزبان میباشند. این گروه شامل باکتریها، آرکیها، قارچها، پروتوزوآها و ویروسها میشود. در زمینه شناسایی میکروبها، تمرکز اغلب بر باکتریها و قارچهای بیماریزا است، زیرا این گروهها بیشترین ارتباط بالینی و صنعتی را دارند.
باکتریها بر اساس شکل سلولی، ویژگیهای دیواره سلولی و متابولیسم دستهبندی میشوند. شکل سلول میتواند کوکسی (گرد)، باسیل (میلهای)، اسپیریل (مارپیچی) یا سایر فرمهای غیرمعمول باشد. دیواره سلولی، که شامل ترکیبات پپتیدوگلیکان است، مبنای آزمایشهای رنگآمیزی گرم و سایر تستهای شیمیایی است. متابولیسم باکتریها، که شامل مسیرهای انرژیزایی، تخمیر و تنفس است، پایه اصلی تستهای بیوشیمیایی محسوب میشود.
قارچها، به ویژه مخمرها و کپکها، از دیگر گروههای مهم میکروبی هستند که شناسایی آنها نیز نیازمند بررسی مورفولوژی کلنی، خصوصیات سلولی و فعالیتهای آنزیمی است. برخلاف باکتریها، بسیاری از قارچها در شرایط آزمایشگاهی کندتر رشد میکنند و نیاز به محیطهای تغذیهای خاص دارند.
روشهای شناسایی بر اساس ویژگیهای مورفولوژیک
یکی از نخستین قدمها در شناسایی میکروبها، بررسی ویژگیهای مورفولوژیک و میکروسکوپی است. مشاهده شکل سلول، اندازه، توانایی ایجاد کلنی و رنگ آن میتواند سرنخهای اولیه درباره جنس و گونه میکروب ارائه دهد. رنگآمیزی گرم، رنگآمیزی اسید-سریع و استفاده از فلورسانس، نمونهای از روشهای مرسوم در این مرحله هستند. با وجود این که روشهای مورفولوژیک سریع و ارزان هستند، دقت آنها محدود است و اغلب برای تعیین گونه دقیق کافی نمیباشند.
تفاوت شناسایی بر اساس متابولیسم و ژنتیک
تستهای بیوشیمیایی به بررسی فعالیتهای آنزیمی و مسیرهای متابولیکی میکروبها میپردازند. این فعالیتها شامل توانایی تجزیه قندها، پروتئینها، لیپیدها و ترکیبات نیتروژنی است. هر میکروب، الگوی متابولیکی منحصر به فردی دارد که میتواند به عنوان "اثر انگشت بیوشیمیایی" عمل کند و شناسایی دقیق آن را ممکن سازد.
روشهای ژنتیکی، از جمله توالییابی ژن 16S rRNA و تکنیکهای PCR، امکان شناسایی مستقیم بر اساس ترتیب نوکلئوتیدها را فراهم میکنند. این روشها به ویژه در مواردی که مشخصههای مورفولوژیک یا متابولیک مشابه هستند، کارآمد هستند و میتوانند نتایج تستهای بیوشیمیایی را تایید کنند. با این حال، آزمایشهای ژنتیکی نیازمند تجهیزات تخصصی و هزینه بالاتر هستند و همیشه دسترسی به آنها در همه آزمایشگاهها ممکن نیست.
اهمیت محیط کشت و شرایط آزمایشگاهی
شناسایی دقیق میکروبها بدون فراهم کردن شرایط رشد بهینه ممکن نیست. محیط کشت انتخاب شده باید حاوی مواد مغذی لازم، pH مناسب، شرایط اکسیژنی و دما باشد تا میکروب بتواند فعالیتهای متابولیکی خود را به طور کامل نشان دهد. برای مثال، برخی باکتریهای بیهوازی، تنها در محیط فاقد اکسیژن رشد میکنند و تستهای بیوشیمیایی بر روی آنها تنها در شرایط خاص قابل انجام است. همچنین، مدت زمان رشد و تراکم سلولی میتواند بر شدت واکنشهای بیوشیمیایی تاثیر بگذارد و بنابراین استانداردسازی شرایط آزمایشگاهی ضروری است.
اهمیت شناسایی دقیق در تشخیص بالینی و صنعتی
شناخت دقیق میکروبها، فراتر از یک فعالیت آزمایشگاهی صرف، نقش حیاتی در زندگی روزمره و سلامت عمومی دارد. در حوزه بالینی، شناسایی صحیح میکروبهای بیماریزا به انتخاب درمان هدفمند و کاهش مقاومت آنتیبیوتیکی کمک میکند. در صنایع غذایی و دارویی، شناسایی میکروبها تضمین میکند که محصولات فاقد عوامل بیماریزا هستند و کیفیت آنها حفظ میشود. همچنین، در تحقیقات محیطی و بیوتکنولوژی، شناسایی صحیح میکروبها به درک چرخههای بیوشیمیایی و اکولوژیک آنها کمک میکند و زمینهساز نوآوریهای علمی میشود.
پیشزمینه تاریخی و تکامل روشهای شناسایی
از زمان لوئی پاستور و رابرت کوخ، شناسایی میکروبها به سرعت تکامل یافته است. در ابتدا، روشها مبتنی بر مشاهده میکروسکوپی و الگوهای رشد بودند. در دهههای بعد، تستهای بیوشیمیایی استاندارد شد و ابزارهای نیمهخودکار مانند کیتهای API و Enterotube ظهور کردند. با ورود فناوریهای مولکولی و طیفسنجی جرمی در قرن بیستویکم، دقت و سرعت شناسایی به میزان چشمگیری افزایش یافت، اما اصول پایه و مفاهیم متابولیکی که تستهای بیوشیمیایی بر آنها متکی هستند، همچنان به عنوان ستون فقرات شناسایی میکروبها حفظ شدهاند.
جمعبندی مفاهیم پایهای
درک اصول پایهای شناسایی میکروبها، شامل شناخت مورفولوژی، متابولیسم، ژنتیک و محیط رشد، برای اجرای موفقیتآمیز تستهای بیوشیمیایی ضروری است. این دانش به متخصصان کمک میکند تا انتخاب روش مناسب، تفسیر نتایج و تصمیمگیری بالینی و صنعتی را به دقت انجام دهند. همچنین، این مفاهیم پایهای مسیر را برای درک روشهای مدرن و ترکیبی شناسایی میکروبها هموار میسازند و نقش تستهای بیوشیمیایی را در میکروبیولوژی مدرن برجسته میکنند.
تستهای بیوشیمیایی کلاسیک
تستهای بیوشیمیایی کلاسیک پایهایترین ابزارها برای شناسایی میکروبها در آزمایشگاههای تشخیصی و تحقیقاتی هستند. این تستها بر اساس فعالیتهای آنزیمی و مسیرهای متابولیکی میکروبها طراحی شدهاند و امکان شناسایی دقیق گونهها و تمایز بین گروههای میکروبی را فراهم میکنند. با وجود پیشرفتهای تکنولوژی و ظهور روشهای مولکولی و طیفسنجی، تستهای بیوشیمیایی سنتی همچنان در بسیاری از آزمایشگاهها به دلیل سهولت اجرا، هزینه پایین و قابلیت اطمینان بالا کاربرد دارند.
تستهای تخمیر قندها
یکی از شناختهشدهترین و پرکاربردترین تستهای بیوشیمیایی، بررسی توانایی میکروبها در تخمیر قندها و تولید اسید یا گاز است. در این آزمایشها، میکروبها در محیط حاوی یک نوع قند خاص کشت داده میشوند و تغییرات pH یا تولید گاز به کمک معرفهای شیمیایی مشخص میشود. این تست به ویژه برای شناسایی باکتریهای رودهای، مانند اشرشیا کلی و سالمونلا، کاربرد دارد. الگوی تخمیر قندها به عنوان یک اثر انگشت بیوشیمیایی برای هر گونه عمل میکند و امکان تمایز بین گونههای نزدیک را فراهم میآورد.
تستهای اکسیداز و کاتالاز
تست اکسیداز و کاتالاز از جمله تستهای سریع و ابتدایی هستند که برای تفکیک جنسهای باکتریایی مورد استفاده قرار میگیرند.
-
تست کاتالاز به بررسی توانایی میکروبها در تجزیه هیدروژن پراکسید به آب و اکسیژن میپردازد. تولید حباب در حضور H2O2 نشاندهنده مثبت بودن تست است. این تست برای تمایز بین استافیلوکوکها و استرپتوکوکها بسیار مفید است.
-
تست اکسیداز توانایی میکروبها در تولید آنزیم سیتوکروم اکسیداز را بررسی میکند. این تست معمولاً برای شناسایی باکتریهای گرم منفی مانند گونههای سودوموناس استفاده میشود.
تستهای تجزیه اوره، سیترات و لیتیک
-
تست اورهآز بررسی میکند که آیا میکروب قادر به تجزیه اوره به آمونیاک و CO2 است یا خیر. این تست برای شناسایی جنسهایی مانند پروتئوس و هلیکوباکتر پیلوری کاربرد دارد.
-
تست سیترات توانایی استفاده میکروبها از سیترات به عنوان تنها منبع کربن را میسنجد. تغییر رنگ محیط به سبز یا آبی نشاندهنده مثبت بودن تست است و معمولاً برای تمایز گونههای خانواده انتروباکتریاسه به کار میرود.
-
تستهای تجزیه لیتیک شامل بررسی توانایی هیدرولیز پروتئینها مانند ژلاتین، کازئین یا اوره است. این تستها به شناسایی گونههایی کمک میکنند که توانایی تولید آنزیمهای پروتئولیتیک دارند.
تستهای تجزیه پروتئینها و لیپیدها
میکروبها قادر به تولید آنزیمهایی هستند که پروتئینها و لیپیدهای محیط را تجزیه میکنند. این تستها شامل بررسی فعالیت لیپاز، پروتئاز، آمینوپپتیداز و دیگر آنزیمهای مشابه است. برای مثال، تست هیدرولیز ژلاتین نشان میدهد که آیا میکروب قادر به تجزیه ژلاتین و آزادسازی آمینو اسیدها است یا خیر. این تستها به ویژه برای شناسایی گونههای پسودوموناس، باسیلوس و استرپتوکوکها کاربرد دارند.
تستهای اختصاصی برای گروههای خاص باکتریها
تعدادی از تستهای بیوشیمیایی برای شناسایی گونهها یا جنسهای خاص طراحی شدهاند:
-
: Corynebacteriaتوانایی تولید دیهیدروکسی استیک اسید و فعالیت دکربوکسیلازها از مشخصههای کلیدی این جنس است.
-
: Aeromonasاین جنس با تولید آنزیمهای همولیزین، لیپاز و اکسیداز مشخص میشود و تستهای بیوشیمیایی خاصی برای تمایز آنها از سایر باکتریهای گرم منفی ارائه شده است.
-
: Enterobacteriaceaeاستفاده از پنلهای قندهای مختلف، تولید ایندول و آزمایشهای اوره و سیترات، برای تمایز گونهها بسیار مفید است.
استانداردسازی و اهمیت کنترل کیفیت در تستهای بیوشیمیایی
اجرای صحیح تستهای بیوشیمیایی نیازمند استانداردسازی شرایط آزمایشگاهی است. این شامل انتخاب محیط کشت مناسب، تنظیم pH و دما، مدت زمان رشد و تراکم سلولی میشود. هر گونه خطا در این مراحل میتواند منجر به نتایج غلط و تشخیص نادرست شود. همچنین، استفاده از کنترلهای مثبت و منفی برای هر تست ضروری است تا دقت و صحت نتایج تضمین شود.
تستهای ترکیبی و کیتهای نیمهخودکار
برای سادهتر کردن شناسایی، کیتهای استاندارد مانند API و Enterotube طراحی شدهاند که چندین تست بیوشیمیایی را در یک واحد ارائه میکنند. این کیتها امکان شناسایی سریع و قابل اعتماد را فراهم میکنند و اغلب با نرمافزارهای تحلیلی همراه هستند تا نتایج به سرعت تفسیر شوند. علاوه بر این، سیستمهای نیمهخودکار مانند VITEK و MicroScan امکان انجام تعداد زیادی تست را با سرعت بالا فراهم میکنند و در مراکز بالینی بزرگ کاربرد دارند.
مزایا و محدودیتهای تستهای بیوشیمیایی کلاسیک
مزایای اصلی تستهای بیوشیمیایی شامل هزینه پایین، قابلیت اجرا در آزمایشگاههای کوچک، و ارائه اطلاعات متابولیکی جامع درباره میکروبها است. با این حال، محدودیتهایی نیز وجود دارد: برخی گونهها ممکن است واکنشهای مشابه نشان دهند، برخی باکتریها به شرایط محیطی حساس هستند و زمان لازم برای رشد و انجام تستها میتواند طولانی باشد. بنابراین، در بسیاری از موارد، ترکیب تستهای بیوشیمیایی با روشهای مولکولی یا طیفسنجی جرمی، نتایج دقیقتر و قابل اعتمادتر ارائه میدهد.
جمعبندی تستهای بیوشیمیایی کلاسیک
تستهای بیوشیمیایی کلاسیک، با وجود ظهور تکنولوژیهای جدید، همچنان یک ابزار اصلی، قابل اعتماد و کاربردی در شناسایی میکروبها هستند. این تستها اطلاعات متابولیکی و آنزیمی مفیدی ارائه میدهند که نه تنها به شناسایی دقیق گونهها کمک میکند، بلکه درک عمیقتری از رفتار میکروبها و تعامل آنها با محیط و میزبان فراهم میآورد. ترکیب این تستها با روشهای مدرن، مسیر تشخیص سریع، دقیق و جامع میکروبها را هموار میسازد و پایهای محکم برای کاربردهای بالینی و صنعتی ایجاد میکند.
سیستمهای تجاری و نیمهخودکار برای شناسایی بیوشیمیایی
با پیشرفت علوم میکروبیولوژی و افزایش نیاز به تشخیص سریع و دقیق میکروبها، سیستمهای تجاری و نیمهخودکار برای اجرای تستهای بیوشیمیایی توسعه یافتهاند. این سیستمها، ترکیبی از کیتهای استاندارد، نرمافزارهای تحلیلی و تجهیزات نیمهخودکار هستند که فرآیند شناسایی میکروبها را سادهتر، سریعتر و با دقت بالاتر انجام میدهند. استفاده از این سیستمها به ویژه در آزمایشگاههای بالینی، مراکز تحقیقاتی و صنایع غذایی و دارویی که حجم نمونه بالاست، اهمیت ویژهای دارد.
کیتهای استاندارد API و Enterotube
یکی از شناختهشدهترین و پراستفادهترین ابزارها برای شناسایی بیوشیمیایی، کیتهای API (Analytical Profile Index) و Enterotube هستند. این کیتها حاوی چندین چاهک کوچک هستند که هر کدام یک تست بیوشیمیایی خاص را انجام میدهد. میکروب مورد نظر در هر چاهک رشد کرده و واکنشهای آن ثبت میشود. سپس الگوی پاسخها با استفاده از دفترچه راهنما یا نرمافزار تحلیلی با بانک اطلاعاتی مقایسه میشود و هویت میکروب تعیین میگردد.
مزیت اصلی کیتهای API و Enterotube این است که چندین تست بیوشیمیایی را در یک واحد ارائه میدهند و نیاز به تجهیزات پیچیده را کاهش میدهند. این کیتها برای تشخیص گونههای خانواده انتروباکتریاسه، استافیلوکوکها، استرپتوکوکها و برخی باکتریهای غیرمعمول کاربرد دارند. محدودیت اصلی آنها شامل نیاز به شرایط رشد استاندارد و زمان رشد نسبی میکروبهاست که ممکن است چند ساعت تا یک روز طول بکشد.
سیستمهای نیمهخودکار VITEK و MicroScan
برای افزایش سرعت و دقت شناسایی، سیستمهای نیمهخودکار مانند VITEK و MicroScan توسعه یافتهاند. این سیستمها مجهز به کارتهای تست بیوشیمیایی استاندارد و نرمافزارهای تحلیلی پیشرفته هستند که امکان پردازش خودکار نتایج و ارائه هویت میکروب را فراهم میکنند.
سیستم VITEK از کارتهای حاوی محیطهای اختصاصی و معرفهای شیمیایی استفاده میکند و توانایی شناسایی سریع باکتریها و قارچها را دارد. پس از افزودن نمونه میکروبی به کارت، دستگاه رشد و واکنشها را اندازهگیری میکند و نرمافزار نتایج را با بانک اطلاعاتی داخلی مقایسه میکند. این فرآیند باعث کاهش خطاهای انسانی و افزایش سرعت تشخیص میشود.
سیستم MicroScan نیز عملکرد مشابهی دارد و بیشتر در مراکز بالینی بزرگ و آزمایشگاههای تحقیقاتی استفاده میشود. این سیستم امکان تعیین حساسیت آنتیبیوتیکی همراه با شناسایی میکروب را نیز فراهم میکند، که در انتخاب درمان هدفمند بسیار حیاتی است.
مزایای استفاده از سیستمهای تجاری و نیمهخودکار
استفاده از این سیستمها مزایای متعددی دارد:
-
سرعت بالا : کاهش زمان شناسایی از چند روز به چند ساعت.
-
دقت بیشتر : کاهش خطاهای انسانی و افزایش قابلیت اطمینان نتایج.
-
قابلیت استانداردسازی : امکان اجرای تستهای یکسان در آزمایشگاههای مختلف با نتایج قابل مقایسه.
-
قابلیت ترکیب با نرمافزارهای تحلیلی : تحلیل دادهها، ارائه گزارش و اتصال به بانکهای اطلاعاتی.
-
تعیین حساسیت دارویی همزمان: در برخی سیستمها، شناسایی میکروب همراه با پروفایل مقاومت آنتیبیوتیکی انجام میشود.
محدودیتها و چالشهای سیستمهای تجاری و نیمهخودکار
با وجود مزایا، این سیستمها محدودیتهایی نیز دارند که باید مدنظر قرار گیرد. یکی از چالشها هزینه بالای تجهیزات و مصرفیها است، که ممکن است استفاده از آنها را در آزمایشگاههای کوچک یا مراکز با بودجه محدود دشوار کند. علاوه بر این، این سیستمها به بانک اطلاعاتی داخلی وابسته هستند و ممکن است در شناسایی گونههای نادر یا تازه کشفشده محدود باشند. همچنین، برخی میکروبها به شرایط رشد خاص نیاز دارند و در محیط استاندارد کارتهای سیستم رشد نمیکنند، که میتواند منجر به نتایج منفی کاذب شود.
نقش سیستمهای تجاری در شناسایی سریع و کنترل عفونت
یکی از مهمترین کاربردهای این سیستمها، شناسایی سریع میکروبهای بیماریزا در محیطهای بالینی است. تشخیص سریع و دقیق به پزشکان این امکان را میدهد که درمان هدفمند و مناسب را در کوتاهترین زمان ممکن آغاز کنند، که این امر باعث کاهش مقاومت دارویی و جلوگیری از گسترش عفونتها میشود. علاوه بر این، در صنایع غذایی و دارویی، این سیستمها به حفظ کیفیت و ایمنی محصولات کمک میکنند و از ورود میکروبهای بیماریزا به زنجیره تولید جلوگیری میکنند.
جمعبندی سیستمهای تجاری و نیمهخودکار
سیستمهای تجاری و نیمهخودکار برای شناسایی بیوشیمیایی میکروبها، یک پل بین روشهای سنتی و تکنولوژیهای مدرن محسوب میشوند. این سیستمها با ارائه تستهای استاندارد، تحلیل خودکار دادهها و سرعت بالای تشخیص، نقش حیاتی در آزمایشگاههای بالینی، تحقیقاتی و صنعتی ایفا میکنند. با وجود محدودیتهایی مانند هزینه و وابستگی به بانک اطلاعاتی، ترکیب این سیستمها با روشهای مولکولی و طیفسنجی، میتواند تشخیص سریع، دقیق و قابل اعتماد میکروبها را تضمین کند و به بهبود سلامت عمومی و کیفیت محصولات کمک کند.
روشهای مولکولی و جایگزینهای مدرن شناسایی میکروبها
با پیشرفت سریع علوم میکروبیولوژی و زیستشناسی مولکولی، روشهای سنتی بیوشیمیایی به تنهایی برای تشخیص سریع و دقیق میکروبها کافی نیستند. به همین دلیل، روشهای مولکولی و تکنولوژیهای نوین به عنوان مکمل یا جایگزین برای شناسایی میکروبها توسعه یافتهاند. این روشها امکان تشخیص مستقیم بر اساس ژنوم، RNA، پروتئینها و دیگر مولکولهای شاخص میکروب را فراهم میکنند و دقت، سرعت و توانایی تمایز بین گونههای نزدیک را افزایش میدهند.
توالییابی ژن 16S rRNA
یکی از پرکاربردترین و دقیقترین روشهای مولکولی، توالییابی ژن 16S rRNA است. این ژن، به دلیل داشتن مناطق محافظتشده و مناطق متغیر، برای شناسایی و تمایز گونههای باکتریایی ایدهآل است. در این روش، DNA استخراج شده از نمونه مورد نظر با استفاده از پرایمرهای خاص تکثیر میشود و سپس توالییابی انجام میگیرد. توالی بهدستآمده با بانکهای اطلاعاتی ژنتیکی مقایسه شده و گونه میکروب مشخص میشود. این روش به ویژه برای شناسایی باکتریهای غیرقابل کشت، گونههای نادر یا میکروبهایی که نتایج تستهای بیوشیمیایی آنها مشابه است، بسیار ارزشمند است.
PCR و Real-Time PCR
واکنش زنجیرهای پلیمراز (PCR) و نسخه پیشرفته آن، Real-Time PCR، روشهای قدرتمندی برای شناسایی سریع میکروبها هستند. در PCR، بخش مشخصی از DNA یا RNA هدف تکثیر میشود و وجود آن با استفاده از الکتروفورز یا سایر تکنیکهای تشخیصی تأیید میگردد. Real-Time PCR علاوه بر شناسایی، امکان کمّیسازی بار میکروبی را نیز فراهم میکند، که در تشخیص شدت عفونت و پایش پاسخ به درمان اهمیت دارد. این روشها به دلیل سرعت بالا، حساسیت و اختصاصیت زیاد، در آزمایشگاههای بالینی و تحقیقاتی کاربرد وسیع دارند.
Next-Generation Sequencing (NGS)
روشهای توالییابی نسل بعد یا NGS، یک انقلاب در شناسایی میکروبها ایجاد کردهاند. NGS امکان شناسایی همزمان هزاران گونه در یک نمونه را فراهم میکند و میتواند تغییرات ژنتیکی، مقاومت دارویی و تنوع میکروبی را با دقت بالا مشخص کند. این تکنولوژی به ویژه در تحقیقات محیطی، بررسی میکروبیوم انسان و پایش میکروبهای بیماریزا کاربرد دارد. با استفاده از NGS، حتی گونههای غیرقابل کشت نیز قابل شناسایی هستند، که یک محدودیت اصلی روشهای سنتی و کیتهای بیوشیمیایی را رفع میکند.
متدهای طیفسنجی جرمی و MALDI-TOF MS
یکی دیگر از تکنولوژیهای نوین، طیفسنجی جرمی ماتریس-کمکدار تفکیک یون با زمان پرواز (MALDI-TOF MS) است. در این روش، نمونه میکروبی در حضور ماتریس مخصوص یونیزه میشود و طیف جرمی پروتئینهای شاخص سلولی بهدست میآید. این طیف با بانک اطلاعاتی استاندارد مقایسه میشود و هویت میکروب تعیین میشود. مزیت اصلی MALDI-TOF MS سرعت بسیار بالا و نیاز به حداقل آمادهسازی نمونه است. همچنین، امکان تمایز سریع بین گونهها و حتی زیرگونهها فراهم میشود. این روش به ویژه در شناسایی باکتریها، قارچها و برخی گونههای نادر ارزشمند است.
متاژنومیکس و تجزیه مولکولی کل جامعه میکروبی
متاژنومیکس به بررسی مجموعه ژنهای میکروبی موجود در یک محیط مشخص میپردازد. برخلاف روشهای هدفمند مانند PCR، متاژنومیکس بدون نیاز به کشت میتواند کل جامعه میکروبی را شناسایی کند. این روش به ویژه برای نمونههای پیچیده مانند میکروبیوم روده، محیطهای زیستی صنعتی و نمونههای بالینی با جمعیت میکروبی متنوع کاربرد دارد. اطلاعات بهدستآمده از متاژنومیکس میتواند ترکیب گونهای، توانایی متابولیکی و الگوی مقاومت دارویی میکروبها را نشان دهد.
مزایا و محدودیتهای روشهای مولکولی و مدرن
مزایای اصلی این روشها شامل:
-
سرعت بالای شناسایی حتی برای گونههای غیرقابل کشت.
-
دقت و اختصاصیت بسیار بالا، حتی در مواردی که تستهای بیوشیمیایی نامشخص هستند.
-
توانایی شناسایی گونههای جدید یا نادر با تطبیق با بانکهای داده ژنتیکی.
-
امکان شناسایی همزمان چندین گونه و بررسی تنوع میکروبی.
با این حال، محدودیتهایی نیز وجود دارد:
-
هزینه بالای تجهیزات و مصرفیها، که مانع استفاده در آزمایشگاههای کوچک میشود.
-
نیاز به تخصص و آموزش پیشرفته برای اجرای آزمایش و تحلیل دادهها.
-
وابستگی به بانکهای اطلاعاتی، که در صورت ناقص بودن یا بهروز نبودن، میتواند شناسایی را محدود کند.
-
احتمال شناسایی DNA مرده یا قطعات ژنتیکی غیر فعال، که ممکن است اطلاعات بالینی را دچار ابهام کند.
ترکیب روشهای سنتی و مدرن برای شناسایی دقیق
بهترین رویکرد در شناسایی میکروبها، ترکیب روشهای بیوشیمیایی سنتی با تکنولوژیهای مولکولی و طیفسنجی جرمی است. این ترکیب امکان تأیید نتایج، افزایش دقت و سرعت تشخیص، و ارائه اطلاعات جامع درباره فعالیتهای متابولیکی، ویژگیهای ژنتیکی و پروتئومی میکروبها را فراهم میکند. در عمل، یک نمونه بالینی میتواند ابتدا با تستهای سریع و نیمهخودکار بررسی شود و در موارد نیاز به شناسایی دقیقتر، از تکنولوژیهای مولکولی یا MALDI-TOF MS استفاده شود.
جمعبندی روشهای مولکولی و جایگزینهای مدرن
روشهای مولکولی و تکنولوژیهای نوین، انقلاب عظیمی در شناسایی میکروبها ایجاد کردهاند. این روشها با ارائه تشخیص سریع، دقیق و قابل اعتماد حتی برای میکروبهای غیرقابل کشت یا گونههای نادر، محدودیتهای روشهای سنتی را رفع کردهاند و به متخصصان این امکان را میدهند که تصمیمگیری بالینی، تحقیقاتی و صنعتی را با اطمینان بیشتری انجام دهند. ترکیب این تکنولوژیها با تستهای بیوشیمیایی، مسیر شناسایی جامع، چندبعدی و بهینه میکروبها را هموار میکند.
شناسایی میکروبها با طیفسنجی و پروتئومیکس
در دهههای اخیر، پیشرفت چشمگیری در روشهای طیفسنجی جرمی و پروتئومیکس رخ داده است که بهطور قابل توجهی فرآیند شناسایی میکروبها را متحول کرده است. برخلاف تستهای بیوشیمیایی که بر فعالیتهای متابولیکی میکروبها تکیه دارند، و روشهای مولکولی که بر اساس DNA یا RNA عمل میکنند، طیفسنجی و پروتئومیکس بر ترکیب پروتئینی و پروفایل مولکولی میکروبها تمرکز میکنند. این رویکرد به دلیل سرعت بالا، دقت زیاد و توانایی تمایز بین گونههای بسیار نزدیک، جایگاه ویژهای در میکروبیولوژی تشخیصی پیدا کرده است.
MALDI-TOF MS بهعنوان انقلاب در شناسایی میکروبها
یکی از مهمترین ابزارهای طیفسنجی که در سالهای اخیر بهطور گسترده مورد استفاده قرار گرفته، MALDI-TOF MS (Matrix-Assisted Laser Desorption/Ionization–Time of Flight Mass Spectrometry) است. در این روش، نمونه میکروبی در حضور یک ماتریس شیمیایی قرار میگیرد و با استفاده از لیزر یونیزه میشود. سپس یونها با سرعتهای متفاوت در یک لوله خلأ حرکت کرده و بر اساس نسبت جرم به بارشان شناسایی میشوند. خروجی نهایی، یک طیف جرمی منحصر بهفرد است که مانند اثر انگشت پروتئینی برای هر میکروب عمل میکند.
این طیفها با بانکهای اطلاعاتی مرجع مقایسه میشوند و گونه میکروبی در کمتر از چند دقیقه مشخص میشود. سرعت و دقت این روش به حدی است که در بسیاری از آزمایشگاههای بالینی جایگزین تستهای کلاسیک شده است. مزیت مهم MALDI-TOF MS این است که نیاز به آمادهسازی طولانی یا کشت پیچیده ندارد و حتی از کلنیهای تازه رشد کرده میتوان نمونه تهیه کرد.
پروتئومیکس و بررسی جامع پروتئینها
فراتر از MALDI-TOF MS، علم پروتئومیکس به مطالعه جامع پروتئینهای تولید شده توسط یک میکروب میپردازد. این پروتئینها شامل آنزیمها، فاکتورهای بیماریزایی، پروتئینهای غشایی و سایر اجزای عملکردی هستند. بررسی پروتئوم به دانشمندان امکان میدهد نه تنها هویت میکروب را مشخص کنند، بلکه درک عمیقتری از مکانیسمهای بیماریزایی، مقاومت دارویی و تعامل با میزبان بهدست آورند. روشهای پروتئومیکس اغلب با تکنیکهای LC-MS/MS (Liquid Chromatography-Tandem Mass Spectrometry) ترکیب میشوند که قادر به شناسایی هزاران پروتئین در یک نمونه است.
مزایا و قابلیتهای منحصر به فرد طیفسنجی و پروتئومیکس
این رویکردها چندین مزیت کلیدی دارند:
-
سرعت بسیار بالا در شناسایی، بهویژه در مقایسه با تستهای بیوشیمیایی کلاسیک.
-
توانایی تمایز بین گونههای بسیار نزدیک، حتی زمانی که روشهای مولکولی یا بیوشیمیایی قادر به این کار نیستند.
-
کاربرد گسترده در تشخیص باکتریها، قارچها و حتی برخی ویروسها.
-
امکان شناسایی مارکرهای مقاومت دارویی یا فاکتورهای بیماریزایی که در درمان بیماران نقش حیاتی دارند.
چالشها و محدودیتهای استفاده از طیفسنجی و پروتئومیکس
با وجود مزایا، این فناوریها محدودیتهایی نیز دارند. تجهیزات مورد نیاز مانند MALDI-TOF MS و LC-MS/MS بسیار گرانقیمت هستند و نیاز به زیرساخت آزمایشگاهی پیشرفته دارند. همچنین، موفقیت این روشها به شدت به کیفیت بانکهای اطلاعاتی پروتئینی وابسته است؛ اگر یک گونه نادر یا جدید در بانک داده موجود نباشد، شناسایی آن دشوار میشود. علاوه بر این، برای تحلیل دادههای پیچیده پروتئومیکس، به تخصص در بیوانفورماتیک و پردازش دادههای حجیم نیاز است.
کاربردهای بالینی و تحقیقاتی طیفسنجی و پروتئومیکس
این تکنولوژیها در بسیاری از زمینهها ارزشمند هستند. در تشخیص بالینی، میتوان عفونتهای بیمارستانی، عفونتهای مقاوم به دارو و بیماریهای ناشی از قارچها را با سرعت و دقت بالا شناسایی کرد. در تحقیقات بنیادی، پروتئومیکس امکان مطالعه تعامل میکروبها با میزبان، کشف اهداف دارویی جدید و درک سازوکارهای مقاومت آنتیبیوتیکی را فراهم میکند. در صنایع غذایی و دارویی، طیفسنجی برای پایش آلودگی میکروبی و کنترل کیفیت استفاده میشود.
چشمانداز آینده در شناسایی با طیفسنجی و پروتئومیکس
آینده این حوزه بسیار روشن است. انتظار میرود با پیشرفت در مینیاتوریزهکردن تجهیزات، کاهش هزینهها و بهبود الگوریتمهای پردازش داده، این روشها در آینده نزدیک به صورت ابزارهای استاندارد و در دسترستر در همه آزمایشگاهها به کار گرفته شوند. همچنین ترکیب پروتئومیکس با ژنتیک، متابولومیکس و بیوانفورماتیک میتواند دیدگاهی چندلایه از میکروبها ارائه دهد و فرآیند شناسایی و طبقهبندی آنها را به سطحی بیسابقه برساند.
جمعبندی نقش طیفسنجی و پروتئومیکس در شناسایی میکروبها
به طور کلی، طیفسنجی و پروتئومیکس بهعنوان یکی از پیشرفتهترین و کارآمدترین ابزارها در شناسایی میکروبها شناخته میشوند. این فناوریها با سرعت، دقت و قابلیت ارائه اطلاعات عمیق درباره پروتئینها و فرآیندهای سلولی، چشمانداز جدیدی در میکروبیولوژی مدرن گشودهاند. هرچند هزینه و نیاز به زیرساختهای پیشرفته، چالشهای فعلی هستند، اما روند رو به رشد استفاده از این روشها نشان میدهد که در آینده، ترکیب آنها با روشهای مولکولی و بیوشیمیایی، رویکردی جامع، سریع و دقیق در شناسایی میکروبها فراهم خواهد کرد.
کاربردهای بالینی و صنعتی شناسایی میکروبها
شناسایی دقیق و سریع میکروبها نه تنها در تحقیقات پایه میکروبیولوژی اهمیت دارد بلکه در عرصههای بالینی و صنعتی نیز نقشی حیاتی ایفا میکند. پیشرفت روشهای کلاسیک، مولکولی و فناوریهای نوین مانند طیفسنجی جرمی و پروتئومیکس، این امکان را فراهم کرده است که حضور میکروبها در محیطهای مختلف با دقت بالا، سرعت قابل توجه و هزینهای بهصرفه شناسایی شوند. در این بخش به بررسی کاربردهای بالینی و صنعتی شناسایی میکروبها پرداخته میشود و نشان داده میشود که چگونه این فرآیندها به ارتقای سلامت انسان، کیفیت محصولات و پیشگیری از بیماریها کمک میکنند.
یکی از مهمترین زمینههای استفاده از شناسایی میکروبها، تشخیص بیماریهای عفونی در پزشکی بالینی است. در گذشته تأخیر در شناسایی عامل عفونت، منجر به مصرف نابجای آنتیبیوتیکها و گسترش مقاومت دارویی میشد. امروزه با بهرهگیری از روشهای سریع و دقیق مانند PCR، MALDI-TOF MS و توالییابی ژنومی، امکان شناسایی میکروبها در کمتر از چند ساعت وجود دارد. این موضوع باعث میشود که پزشکان بتوانند درمانی هدفمند و بر اساس ویژگیهای میکروب تجویز کنند و از مصرف بیرویه دارو جلوگیری شود. علاوه بر این، در بخشهای مراقبتهای ویژه مانند ICU، شناسایی سریع میکروبها میتواند نقش حیاتی در نجات جان بیماران ایفا کند.
از سوی دیگر، شناسایی میکروبها در حوزه کنترل عفونتهای بیمارستانی نیز اهمیت فراوان دارد. بسیاری از بیمارستانها مجهز به آزمایشگاههایی هستند که بهطور مداوم نمونههای محیطی و بالینی را بررسی میکنند تا از شیوع پاتوژنهای مقاوم مانند MRSA یا کلبسیلا مقاوم به کارباپنم جلوگیری شود. پایش مداوم این عوامل با کمک فناوریهای نوین باعث کاهش انتقال عفونت و افزایش ایمنی بیماران میشود.
در حوزه ایمنی غذایی، شناسایی میکروبها جایگاهی بسیار ویژه دارد. آلودگی مواد غذایی با باکتریهایی مانند سالمونلا، لیستریا مونوسیتوژنز و اشرشیاکلی O157:H7 میتواند پیامدهای جدی برای سلامت عمومی ایجاد کند. صنایع غذایی با استفاده از روشهای مدرن شناسایی، از جمله کیتهای تشخیص سریع ایمنی-مولکولی و سیستمهای خودکار آنالیز میکروبی، قادر هستند آلودگیهای میکروبی را در مراحل اولیه شناسایی و اقدامات اصلاحی فوری انجام دهند. این کار نه تنها از بروز اپیدمیهای غذایی جلوگیری میکند بلکه باعث افزایش اعتماد مصرفکنندگان به محصولات غذایی میشود.
یکی دیگر از حوزههای پرکاربرد، صنایع داروسازی و بیوتکنولوژی است. در این صنایع، آلودگی میکروبی در فرآیند تولید میتواند خسارتهای هنگفتی وارد کند. شناسایی دقیق میکروبها در خطوط تولید دارو و محصولات بیولوژیک مانند واکسنها و پروتئینهای نوترکیب، تضمینکننده کیفیت و ایمنی محصولات نهایی است. برای مثال، استفاده از فناوری qPCR و NGS در پایش آلودگی خطوط تولید، به شرکتها کمک میکند تا حتی مقادیر بسیار ناچیز میکروبها را شناسایی کرده و اقدامات اصلاحی سریع انجام دهند.
در کنار این موارد، شناسایی میکروبها در صنایع محیطی و انرژی نیز اهمیت دارد. میکروبها در تصفیه فاضلاب، تولید بیوگاز و حتی استخراج زیستی فلزات نقش اساسی دارند. شناسایی گونههای میکروبی فعال در این فرایندها به مهندسان کمک میکند تا کارایی سیستمهای زیستمحیطی را بهینه کنند و تولید انرژیهای پایدار را افزایش دهند.
همچنین در کشاورزی و دامپروری، شناسایی میکروبها به کنترل بیماریهای گیاهی و دامی کمک میکند. بیماریهایی مانند بلاست برنج، پوسیدگی ریشه یا عفونتهای دامی ناشی از باکتریها و ویروسها، میتوانند به سرعت شیوع پیدا کنند و خسارتهای اقتصادی بزرگی به همراه داشته باشند. فناوریهای شناسایی سریع این امکان را فراهم میکنند که بیماریها در مراحل اولیه تشخیص داده شده و با روشهای مناسب کنترل شوند.
در مجموع، شناسایی میکروبها در عرصههای بالینی و صنعتی، پلی میان علم پایه و کاربردهای عملی محسوب میشود. این فرآیند باعث ارتقای سلامت عمومی، تضمین کیفیت محصولات، بهبود فرایندهای صنعتی و کاهش خطرات زیستمحیطی میشود. آینده این حوزه نیز با ورود فناوریهای پیشرفتهتر مانند هوش مصنوعی در تحلیل دادههای میکروبی، نانوسنسورها و ابزارهای تشخیص در محل روشنتر خواهد بود و میتواند تحولی بنیادین در مدیریت بیماریها و افزایش بهرهوری صنایع ایجاد کند.
چالشها و محدودیتهای تستهای بیوشیمیایی
تستهای بیوشیمیایی از دیرباز بهعنوان یکی از ابزارهای اصلی برای شناسایی میکروبها در آزمایشگاههای میکروبیولوژی مورد استفاده قرار گرفتهاند. این روشها بر اساس بررسی فعالیتهای متابولیک و آنزیمی میکروبها طراحی شدهاند و در بسیاری از موارد توانستهاند اطلاعات ارزشمندی در مورد هویت میکروارگانیسمها ارائه دهند. با این حال، علیرغم کاربرد گسترده، این تستها دارای چالشها و محدودیتهای قابل توجهی هستند که استفاده از آنها را در برخی زمینهها دشوار یا حتی ناکافی میسازد.
یکی از مهمترین محدودیتهای تستهای بیوشیمیایی، طولانی بودن زمان مورد نیاز برای انجام آزمایشها است. اغلب این تستها مستلزم کشت دادن باکتریها در محیطهای اختصاصی و انتظار برای ظهور واکنشهای متابولیکی هستند که ممکن است از چند ساعت تا چند روز به طول بیانجامد. در شرایط بالینی که تشخیص سریع برای نجات جان بیمار حیاتی است، این تأخیر میتواند پیامدهای جدی داشته باشد. بهعنوان مثال، در عفونتهای حاد خونی یا عفونتهای بیمارستانی، تأخیر در شناسایی دقیق پاتوژنها ممکن است منجر به انتخاب نادرست دارو و در نتیجه تشدید بیماری شود.
چالش دیگر به تفسیر نتایج تستهای بیوشیمیایی مربوط میشود. بسیاری از واکنشهای بیوشیمیایی بهصورت تغییر رنگ یا تولید گاز بروز میکنند که ممکن است تحت تأثیر عوامل محیطی، غلظت مواد مغذی یا حتی خطای انسانی در مشاهده قرار گیرند. در چنین شرایطی احتمال بروز خطاهای تشخیصی افزایش مییابد. بهویژه زمانی که گونههای باکتریایی بسیار نزدیک به هم از نظر فنوتیپی بررسی میشوند، ممکن است نتایج بیوشیمیایی قادر به ایجاد تمایز دقیق نباشند.
یکی دیگر از محدودیتهای عمده، تنوع بالای سویههای میکروبی است. بسیاری از گونههای باکتریایی دارای سویههایی هستند که الگوهای متابولیکی متفاوتی از خود نشان میدهند. این ناهمگونی درونگونهای موجب میشود که یک تست بیوشیمیایی خاص نتواند بهطور قطعی هویت میکروب را مشخص کند. برای مثال، برخی سویههای اشرشیاکلی ممکن است نتیجه مثبت در تست تخمیر لاکتوز نشان دهند، در حالی که برخی سویههای دیگر نتیجه منفی دارند. چنین تغییراتی باعث ایجاد ابهام در نتایج میشوند و نیاز به تأیید توسط روشهای مکمل را افزایش میدهند.
از دیگر محدودیتهای تستهای بیوشیمیایی، نیاز به مهارت بالای پرسنل آزمایشگاهی است. تفسیر درست نتایج نیازمند تجربه و آشنایی کامل با الگوهای واکنشهای مختلف است. در بسیاری از آزمایشگاههای کوچک یا مناطق کمبرخوردار که متخصصان آموزشدیده به تعداد کافی وجود ندارند، احتمال خطای تشخیصی بالاتر میرود. این موضوع بهویژه در کشورهایی که منابع محدود دارند، میتواند چالشبرانگیز باشد.
عامل دیگری که دقت این تستها را تحت تأثیر قرار میدهد، شرایط محیطی و کیفیت محیطهای کشت است. تغییر در ترکیب مواد مغذی، دمای انکوباسیون، pH محیط و حتی آلودگیهای احتمالی میتوانند منجر به نتایج نادرست شوند. به همین دلیل، استانداردسازی این تستها یک موضوع پیچیده و پرهزینه است که همواره دغدغه آزمایشگاههای تشخیصی به شمار میآید.
از نظر اقتصادی نیز، هرچند تستهای بیوشیمیایی در مقایسه با روشهای مولکولی یا طیفسنجی مقرونبهصرفهتر به نظر میرسند، اما در عمل میتوانند هزینهبر و زمانبر باشند. این امر بهویژه زمانی اهمیت دارد که حجم بالایی از نمونهها باید بررسی شوند. نیاز به چندین محیط کشت، انکوباسیونهای متعدد و زمان طولانی برای هر آزمایش، موجب میشود کارایی این روشها در سیستمهای بزرگ و پرحجم کاهش یابد.
در کنار این مسائل، باید به محدودیت در شناسایی برخی گروههای میکروبی نیز اشاره کرد. تستهای بیوشیمیایی عمدتاً برای شناسایی باکتریهای هوازی و بیهوازی اختیاری طراحی شدهاند و در مورد بسیاری از میکروبهای غیرقابل کشت یا باکتریهای نیازمند شرایط خاص، عملاً کارایی ندارند. برای نمونه، شناسایی برخی ویروسها و مایکوباکتریها با روشهای بیوشیمیایی غیرممکن یا بسیار دشوار است.
در نهایت، باید گفت که تستهای بیوشیمیایی علیرغم داشتن جایگاهی تاریخی و کاربردی در شناسایی میکروبها، در مواجهه با نیازهای نوین پزشکی و صنعتی محدودیتهای زیادی دارند. سرعت پایین، حساسیت و اختصاصیت محدود، تأثیرپذیری از شرایط محیطی و نیاز به تخصص بالا، از جمله عواملی هستند که سبب شدهاند این روشها بهتنهایی کافی نباشند. به همین دلیل در سالهای اخیر شاهد گرایش روزافزون به سمت روشهای مولکولی، پروتئومیکس و فناوریهای نوین هستیم که بتوانند این کاستیها را جبران کنند.
چشمانداز آینده و نوآوریها در شناسایی میکروبها
روند شناسایی میکروبها در طول تاریخ میکروبیولوژی از روشهای ساده کشت و مشاهده مستقیم آغاز شد و امروز به فناوریهای پیشرفتهای همچون توالییابی نسل جدید، طیفسنجی جرمی و پروتئومیکس پیشرفته رسیده است. با وجود این پیشرفتها، نیاز به نوآوریهای بیشتر همچنان وجود دارد، زیرا میکروارگانیسمها پیوسته در حال تحول و سازگاری با محیط هستند و بیماریهای عفونی جدید نیز بهطور مستمر ظهور میکنند. آینده این حوزه به سمت استفاده از روشهایی میرود که ترکیبی از سرعت بالا، دقت زیاد، قابلیت حمل، هزینه مناسب و کاربرد در شرایط واقعی بالینی و صنعتی را فراهم سازند.
یکی از چشماندازهای مهم در این زمینه، استفاده گسترده از توالییابی کل ژنوم (WGS) است. این فناوری نه تنها امکان شناسایی دقیق گونهها و سویهها را فراهم میکند بلکه اطلاعات ارزشمندی درباره ژنهای مقاومت دارویی، فاکتورهای بیماریزایی و روابط اپیدمیولوژیک در اختیار میگذارد. انتظار میرود در آینده نزدیک، توالییابی ژنومی به بخشی جداییناپذیر از سیستمهای مراقبت بالینی و کنترل بیماریهای عفونی تبدیل شود و با کمک پایگاههای داده جهانی، امکان ردیابی سریع شیوعها و طراحی درمانهای هدفمند فراهم آید.
نوآوری دیگر در حوزه شناسایی میکروبها، ادغام فناوریهای نانو با روشهای تشخیصی است. نانوسنسورها با قابلیت تشخیص بسیار حساس مولکولهای اختصاصی میکروبی، این پتانسیل را دارند که شناسایی میکروبها را در چند دقیقه و بدون نیاز به فرآیندهای پیچیده آزمایشگاهی امکانپذیر کنند. بهویژه در شرایط اورژانسی یا مناطق دورافتاده، استفاده از کیتهای نانوبنیاد میتواند تحولی بزرگ در مدیریت بیماریهای عفونی ایجاد کند.
علاوه بر این، آینده شناسایی میکروبها بهطور جدی با هوش مصنوعی و یادگیری ماشینی گره خورده است. حجم عظیم دادههایی که از طریق توالییابی، پروتئومیکس و متاژنومیکس به دست میآید، بدون ابزارهای تحلیلی هوشمند قابل مدیریت نیست. الگوریتمهای هوش مصنوعی میتوانند الگوهای پنهان در دادهها را شناسایی کرده و پیشبینی کنند که کدام میکروبها مسئول بیماریهای خاص یا مقاومتهای دارویی جدید هستند. استفاده از این فناوریها باعث میشود فرآیند شناسایی نه تنها سریعتر بلکه هوشمندانهتر نیز باشد.
در حوزه ابزارهای قابل حمل و تشخیص در محل (Point-of-Care) نیز پیشرفتهای چشمگیری در حال وقوع است. دستگاههای کوچک و قابل حمل که توانایی شناسایی میکروبها را با استفاده از فناوریهای میکروفلوئیدیک، نانوسنسور و بیوسنسور دارند، میتوانند در محیطهای بالینی، صنایع غذایی و حتی میدانهای نبرد یا مناطق بحران مورد استفاده قرار گیرند. این ابزارها آیندهای را ترسیم میکنند که در آن نیازی به ارسال نمونهها به آزمایشگاههای مرکزی و انتظار برای نتایج طولانیمدت وجود نخواهد داشت.
از سوی دیگر، یکپارچهسازی دادههای میکروبی با پزشکی شخصی یکی از نوآوریهای آیندهنگرانه است. در این رویکرد، شناسایی میکروبها تنها به تعیین هویت عامل بیماریزا محدود نمیشود، بلکه الگوی کامل میکروبیوم فردی بیمار نیز بررسی میشود. این اطلاعات میتواند به پزشکان کمک کند تا درمانهایی شخصیسازیشده و بر اساس ویژگیهای میکروبی و ژنتیکی هر فرد طراحی کنند. چنین رویکردی در درمان بیماریهای پیچیده مانند سرطان، بیماریهای خودایمنی و اختلالات متابولیک میتواند تأثیرات شگرفی داشته باشد.
در صنایع مختلف نیز، نوآوریها مسیر آینده را روشنتر میسازند. در صنایع غذایی، استفاده از سیستمهای تشخیص سریع مبتنی بر بیوسنسورها میتواند از بروز اپیدمیهای غذایی جلوگیری کند. در صنایع داروسازی، بهکارگیری فناوریهای نوین در شناسایی آلودگیهای میکروبی خطوط تولید، کیفیت و ایمنی محصولات را تضمین میکند. حتی در صنایع محیطی و انرژی، شناسایی سریع و دقیق میکروبهای مؤثر در تصفیه فاضلاب یا تولید بیوگاز میتواند بازدهی فرایندها را افزایش دهد.
از منظر آیندهپژوهی، باید گفت که ترکیب فناوریهای مختلف بهترین مسیر برای غلبه بر محدودیتهای فعلی است. برای مثال، استفاده همزمان از توالییابی ژنومی، طیفسنجی جرمی و الگوریتمهای هوش مصنوعی میتواند شناسایی میکروبها را به سطحی فراتر از آنچه امروز وجود دارد برساند. همچنین توسعه شبکههای جهانی اشتراکگذاری دادههای میکروبی میتواند منجر به واکنش سریعتر در برابر بحرانهای بهداشتی جهانی، مانند پاندمیها، شود.
در مجموع، چشمانداز آینده شناسایی میکروبها به سمت دقت بالاتر، سرعت بیشتر، هزینه کمتر، قابلیت حمل و استفاده آسانتر در حال حرکت است. این مسیر نه تنها علم میکروبیولوژی را متحول خواهد کرد بلکه تأثیرات عمیقی بر سلامت عمومی، امنیت غذایی، صنایع داروسازی و حفاظت از محیط زیست خواهد داشت. آیندهای که در آن شناسایی میکروبها به یک فرآیند روزمره، سریع و قابل اعتماد تبدیل شود، چندان دور نیست و نوآوریهای علمی و فناورانه در حال رقم زدن آن هستند.
جمعبندی و نتیجهگیری
بررسی پروبیوتیکها، پریبیوتیکها و سینبیوتیکها در سالهای اخیر نشان داده است که این ترکیبات نه تنها در سطح تغذیهای و بهبود سلامت عمومی اهمیت دارند، بلکه در پیشگیری، کنترل و حتی درمان بسیاری از بیماریها نیز نقشی تعیینکننده ایفا میکنند. این اهمیت ناشی از توانایی منحصر به فرد آنها در تعدیل میکروبیوتای روده، بهبود عملکرد سیستم ایمنی، تنظیم مسیرهای متابولیک و کاهش التهاب است.
از یک سو، پروبیوتیکها به عنوان میکروارگانیسمهای زنده، توانایی دارند تعادل میکروبی طبیعی را در بدن بازگردانند و در برابر کلونیزاسیون باکتریهای بیماریزا مقاومت ایجاد کنند. مطالعات نشان داده است که مصرف منظم پروبیوتیکها میتواند در درمان اسهالهای عفونی، کاهش اثرات جانبی آنتیبیوتیکها، بهبود علائم سندرم روده تحریکپذیر و حتی ارتقای سلامت روان از طریق محور روده–مغز نقشآفرین باشد.
از سوی دیگر، پریبیوتیکها با فراهم کردن بستر تغذیهای مناسب برای رشد و فعالیت میکروبیوتای مفید، به طور غیرمستقیم در بهبود سلامت انسان اثرگذار هستند. آنها با افزایش تولید اسیدهای چرب کوتاهزنجیر، تقویت سد اپیتلیالی روده و تعدیل سیستم ایمنی، میتوانند به عنوان مکملهای ارزشمند در برنامههای غذایی مورد استفاده قرار گیرند.
در این میان، سینبیوتیکها به دلیل ترکیب همافزای پروبیوتیکها و پریبیوتیکها، بالاترین سطح اثربخشی را نشان دادهاند. این ترکیبات با تضمین بقا و فعالیت میکروارگانیسمهای مفید در دستگاه گوارش، اثربخشی درمانی و پیشگیرانه را تقویت میکنند. پژوهشها نشان دادهاند که مصرف سینبیوتیکها میتواند در بهبود شرایط التهابی مزمن، پیشگیری از بیماریهای متابولیک مانند دیابت نوع ۲، و حتی کاهش ریسک بروز سرطانهای گوارشی نقش داشته باشد.
با وجود این دستاوردها، هنوز چالشهایی اساسی در مسیر توسعه و استفاده گسترده از این ترکیبات وجود دارد. از جمله میتوان به تعیین دقیق گونههای پروبیوتیکی موثر، انتخاب پریبیوتیکهای مناسب، پایداری محصولات در شرایط صنعتی و اثبات بالینی کارایی آنها در جمعیتهای متنوع انسانی اشاره کرد. علاوه بر این، مکانیسمهای دقیق اثرگذاری بسیاری از ترکیبات همچنان به طور کامل روشن نشده و نیازمند تحقیقات ژنومیک، متابولومیک و پروتئومیک گستردهتر است.
در نهایت میتوان گفت که آینده پژوهش در حوزه پروبیوتیکها، پریبیوتیکها و سینبیوتیکها، به سمت شخصیسازی درمانها و تغذیهها پیش خواهد رفت؛ به گونهای که بر اساس ترکیب میکروبیوتای هر فرد، رژیمهای خاصی از این ترکیبات طراحی و توصیه شوند. چنین رویکردی میتواند به تحقق پزشکی و تغذیه دقیق کمک کند و گامی مهم در جهت ارتقای کیفیت زندگی بشر باشد.
به طور کلی، آنچه از مرور یافتههای علمی به دست میآید این است که این ترکیبات نه تنها مکملهای ساده غذایی محسوب نمیشوند، بلکه ابزاری کارآمد برای بهبود سلامت فردی و جمعی، پیشگیری از بیماریها و کاهش بار درمانی در سطح جامعه هستند. بنابراین، گسترش تحقیقات بنیادی و کاربردی در این حوزه، توسعه فناوریهای نوین برای تولید محصولات پایدارتر و ایمنتر، و نیز ارتقای آگاهی عمومی درباره مصرف صحیح این ترکیبات، ضرورتی انکارناپذیر برای نظامهای سلامت در سراسر جهان به شمار میرود.