چطور جهش های خاموش هم در تکامل تأثیر دارند؟
تأثیر جهشهای خاموش (Silent Mutations) در تکامل و پاتوژنز
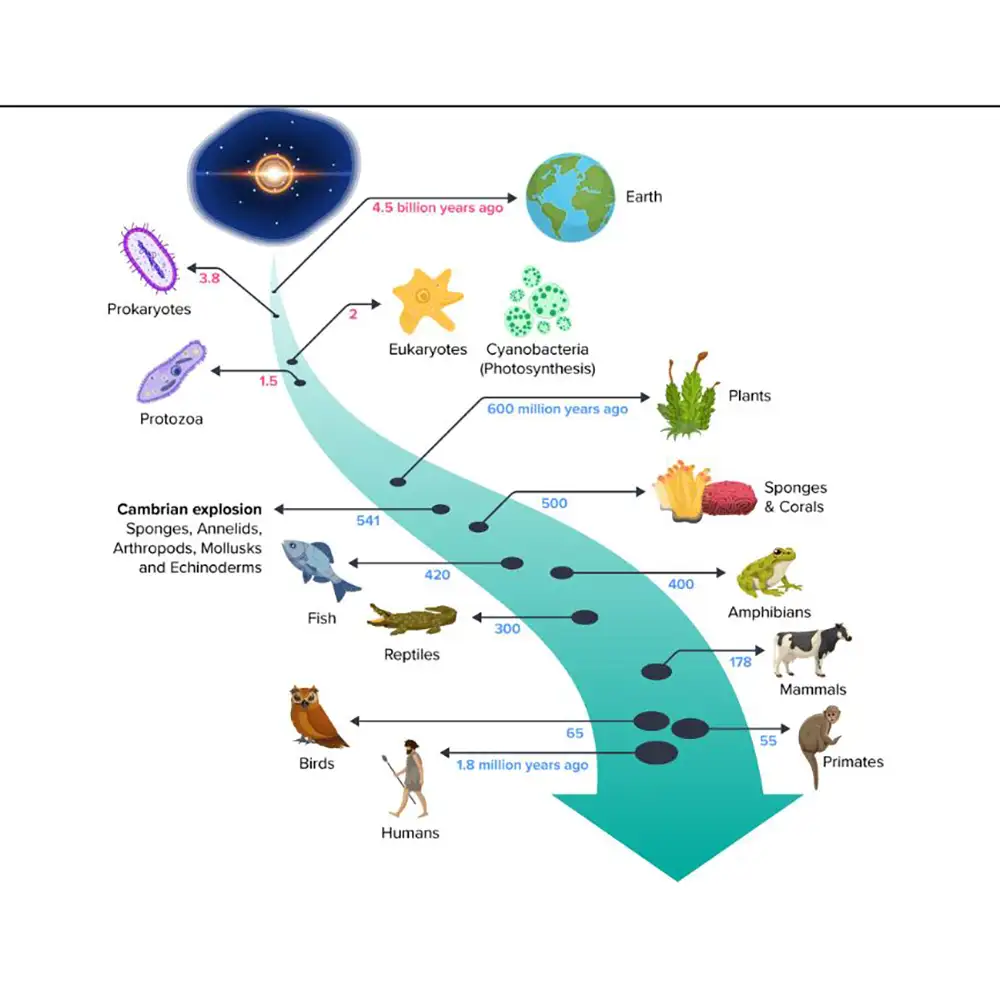
تکامل موجودات زنده، فرآیندی پیچیده است که تحت تأثیر نیروهای گوناگون انتخاب طبیعی، جهش، رانش ژنتیکی و جریان ژنی قرار دارد. درک دقیق این فرآیندها نیازمند بررسی تمام انواع جهشهای ژنتیکی است، از جمله آنهایی که ممکن است بهظاهر بیاثر به نظر برسند. جهشهای خاموش (Silent Mutations)، که توالی نوکلئوتیدی را تغییر میدهند اما توالی آمینواسیدی پروتئین را دستنخورده باقی میگذارند، از دیرباز به عنوان تغییراتی خنثی یا تقریباً خنثی (neutral or nearly neutral) در نظر گرفته میشدند. این نوع جهشها برخلاف جهشهای نامعنا (missense mutations) یا جهشهای حذف/درج (indels)، تصور میشد که تأثیری بر عملکرد پروتئین و ویژگیهای فنوتیپی سلول ندارند.
با این حال، شواهد علمی جدید نشان میدهد که این نوع جهشها ممکن است اثرات غیرمنتظره و مهمی بر روند تکامل، بقا، و حتی پاتوژنز بیماریها بهویژه سرطانها داشته باشند. تحقیقات اخیر نشان دادهاند که جهشهای خاموش میتوانند کارایی ترجمه، پایداری mRNA، ساختار و عملکرد پروتئین، و حتی الگوهای بیان ژنی را تغییر دهند. این اثرات غیرمستقیم اما حیاتی میتوانند فشار انتخابی ایجاد کنند و بنابراین در مسیر تکامل و سازگاری ارگانیسمها نقش داشته باشند.
هدف این مقاله بررسی مکانیزمهای تأثیر جهشهای خاموش در تکامل، رابطه آنها با کارایی ژنی و رشد سلولهای سرطانی، و تحلیل دادههای ژنومی است. این بررسی نشان میدهد که جهشهای خاموش نه تنها خنثی نیستند، بلکه به طور فعال میتوانند مسیر تکامل را شکل دهند و به سازگاری و بقا کمک کنند.
تعریف جهش خاموش و ماهیت آن
جهشهای خاموش (Silent mutations) به تغییرات نوکلئوتیدی گفته میشود که توالی دیانای (DNA) را تغییر میدهد اما توالی آمینواسیدهای پروتئین (amino acid sequence of protein) را دستنخورده باقی میگذارد. برای مثال، کدونهای مختلفی میتوانند یک آمینواسید واحد را رمز کنند؛ تغییر یک کدون به کدون مترادف آن، یک جهش خاموش ایجاد میکند.
در ابتدا، این نوع جهشها به دلیل عدم تأثیر مستقیم بر پروتئین، به عنوان خنثی یا تقریباً خنثی شناخته میشدند و توجه زیادی از نظر تکاملی به آنها نمیشد. با این حال، مطالعات اخیر نشان دادهاند که جهشهای خاموش میتوانند بر مراحل مختلف بیان ژن اثر بگذارند:
-
پایداری mRNA: برخی جهشهای خاموش میتوانند پایداری پیامرسان RNA را کاهش یا افزایش دهند، که این امر به طور مستقیم بر مقدار پروتئین تولید شده تأثیر میگذارد.
-
کارایی ترجمه (Translation efficiency): جهشهای خاموش میتوانند سرعت ترجمه توسط ریبوزومها را تغییر دهند، به ویژه با توجه به فراوانی tRNAهای مربوط به کدونها.
-
برش و چسباندن RNA (Splicing regulation): برخی جهشهای خاموش میتوانند محلهای تنظیم برش RNA را تحت تأثیر قرار دهند و در نتیجه ساختار نهایی پروتئین را تغییر دهند.
-
محلهای اتصال miRNA: تغییرات نوکلئوتیدی میتوانند سایتهای اتصال miRNA را مختل کنند و بیان ژن را از طریق مکانیسمهای پس از رونویسی تغییر دهند.
این مکانیسمها نشان میدهند که جهشهای خاموش میتوانند اثرات قابل توجهی بر سطح پروتئین و عملکرد سلول داشته باشند، حتی اگر توالی آمینواسیدی بدون تغییر باقی بماند.
کدون بهینه و نقش آن در تکامل
یکی از مفاهیم کلیدی در بررسی تأثیر جهشهای خاموش، بهینگی کدون (Codon Optimality) است. هر آمینواسید میتواند توسط چندین کدون رمزگذاری شود، اما این کدونها به صورت یکنواخت در سلولها وجود ندارند. برخی کدونها فراوانی tRNA بیشتری دارند و در نتیجه ترجمه سریعتر و دقیقتری ایجاد میکنند، که به آنها کدونهای بهینه (Optimal Codons) گفته میشود. کدونهای کمبهینه (Non-optimal Codons) با سرعت پایین ترجمه، کاهش پایداری mRNA، و خطای بیشتر در تاخوردگی پروتئین (protein folding errors) همراه هستند.
مطالعات تجربی نشان دادهاند که وارد کردن کدونهای غیر بهینه به ژنهای مخمر باعث کاهش سرعت ترجمه و پایداری mRNA میشود، و این موضوع ارتباطی مستقیم بین دینامیک ترجمه و تخریب mRNA را نشان میدهد. این یافتهها اهمیت بهینگی کدون را در سازگاری و تکامل سلولی مشخص میکند.
در زمینه سرطان، جهشهای خاموش میتوانند کدونهای بهینه را در انکوژنها (oncogenes) افزایش دهند و کارایی ترجمه آنها را بالا ببرند، یا کدونهای غیر بهینه را در ژنهای سرکوبگر تومور (tumor suppressor genes) ایجاد کنند و کارایی ترجمه را کاهش دهند. این تغییرات میتوانند رشد و تکثیر سلولی غیرطبیعی را تسهیل کنند و بنابراین فشار انتخابی بر سلولهای سرطانی اعمال کنند.
شواهد تجربی تأثیر جهشهای خاموش
تحقیقات گستردهای با استفاده از دادههای ژنومی کل اگزوم (Whole Exome Sequencing; WES) و پایگاههای داده سرطان مانند TCGA انجام شده است. یکی از این مطالعات نشان داد که در ۱۰٬۴۳۷ نمونه از ۳۳ نوع سرطان، تعداد جهشهای خاموش تقریباً ۱٬۲۳۸٬۷۲۵ و تعداد جهشهای نامعنا تقریباً ۲٬۸۸۸٬۶۴۹ بود. نسبت میان تعداد جهشهای خاموش به جهشهای نامعنا برای انواع سرطان بین ۰٫۳۲۰ تا ۰٫۵۲۳ بود، که نشاندهنده فراوانی قابل توجه جهشهای خاموش در ژنومهای سرطانی است.
در این مطالعه، جهشهای خاموش با امتیاز بهینگی کدون بالاتر بیشتر در مراحل دیرتر سرطانزایی رخ دادند و در ژنهای مرتبط با چرخه سلولی و تقسیم سلولی غنی شده بودند. در مقابل، جهشهایی با امتیاز پایینتر در ژنهای مرتبط با آپوپتوز و پیری سلولی بیشتر مشاهده شدند. این الگو نشان میدهد که جهشهای خاموش میتوانند در فرایند تکامل سلولی و پیشرفت سرطان نقش فعالی داشته باشند.
مثال بارز دیگر در ژن BRCA1، یک ژن سرکوبگر تومور، مشاهده شد. جهشهای خاموشی که در BRCA1 ایجاد شده بودند، بهینگی کدون آن را کاهش دادند و در نتیجه فعالیت پروتئین کاهش یافت. این یافتهها نشان میدهد که جهشهای خاموش میتوانند بهطور مستقیم بر فعالیت ژنها و مسیرهای سلولی مؤثر باشند.
مکانیسمهای مولکولی اثر جهشهای خاموش
۱. تغییر در پایداری mRNA
پایداری پیامرسان RNA مستقیماً بر مقدار پروتئین تولید شده تأثیر میگذارد. جهشهای خاموش میتوانند ساختار ثانویه RNA را تغییر دهند و باعث افزایش یا کاهش تخریب mRNA شوند. کاهش پایداری mRNA میتواند منجر به کاهش تولید پروتئینهای سرکوبگر تومور و تسهیل رشد سلولهای سرطانی شود.
۲. تغییر در سرعت و کارایی ترجمه
جهشهای خاموش میتوانند کدونهای بهینه را جایگزین یا حذف کنند. از آنجایی که ریبوزومها کدونهای بهینه را سریعتر ترجمه میکنند، جایگزینی کدونهای بهینه با کدونهای غیر بهینه میتواند سرعت ترجمه را کاهش داده و تاخوردگی پروتئین را مختل کند. برعکس، افزایش کدونهای بهینه در انکوژنها میتواند سرعت ترجمه را افزایش دهد و تولید پروتئینهای محرک رشد را تسهیل کند.
۳. اثر بر برش و چسباندن RNA
برخی جهشهای خاموش میتوانند سایتهای تنظیم برش RNA (splicing regulatory sites) را تغییر دهند. این تغییرات ممکن است منجر به ترکیبهای غیرمعمول mRNA و تولید پروتئینهایی با ساختار و عملکرد متفاوت شوند.
۴. تغییر در تعامل با miRNA
جهشهای خاموش میتوانند محلهای اتصال miRNA را مختل کنند. از آنجایی که miRNAها نقش مهمی در تنظیم پسارونویسی ژنها دارند، چنین تغییراتی میتواند بیان ژن را افزایش یا کاهش دهد و در مسیرهای سیگنالدهی سلولی تغییر ایجاد کند.
نقش جهشهای خاموش در تکامل
با توجه به شواهد ارائه شده، میتوان نتیجه گرفت که جهشهای خاموش در تکامل نقش فعال دارند، حتی اگر توالی آمینواسیدی پروتئین را تغییر ندهند. این نقشها شامل موارد زیر هستند:
-
ایجاد فشار انتخابی غیرمستقیم: تغییر در کارایی ترجمه و پایداری mRNA میتواند منجر به مزیت بقا یا افزایش توانایی تولید پروتئینهای مفید شود.
-
تسهیل سازگاری سلولی: جهشهای خاموش میتوانند سرعت و کیفیت ترجمه پروتئینها را تنظیم کنند و سلول را با شرایط محیطی تطبیق دهند.
-
تأثیر بر مسیرهای رشد و تقسیم سلولی: در سرطان، جهشهای خاموش میتوانند مسیرهای تقسیم و چرخه سلولی را به نفع رشد سریع سلول تغییر دهند.
-
تنوع ژنتیکی و فنوتیپی: حتی بدون تغییر توالی پروتئین، جهشهای خاموش میتوانند باعث تغییر بیان ژن و تولید پروتئین با کیفیت متفاوت شوند، که منجر به تنوع فنوتیپی قابل توجهی میشود.
جمعبندی و نتیجهگیری
جهشهای خاموش، برخلاف باور قدیمی مبنی بر خنثی بودن آنها، تأثیرات عمیق و گستردهای بر تکامل و پاتوژنز دارند. این جهشها میتوانند پایداری mRNA، سرعت ترجمه، تاخوردگی پروتئین و بیان ژن را تغییر دهند و در نتیجه فشار انتخابی، سازگاری سلولی و رشد سلولی را تحت تأثیر قرار دهند.
در سرطان، جهشهای خاموش میتوانند به صورت انتخابی در انکوژنها یا ژنهای سرکوبگر تومور رخ دهند و مسیرهای سلولی را به نفع رشد سریع و پیشرفت تومور تغییر دهند. این یافتهها نشان میدهند که جهشهای خاموش نه تنها بیاثر نیستند بلکه یک ابزار تکاملی مهم هستند که میتواند مسیر تکامل را شکل دهد.
مطالعات آینده میتوانند با تمرکز بر توالییابی کامل ژنوم، تحلیل بهینگی کدون و مدلسازی دینامیک ترجمه، نقش دقیق جهشهای خاموش در تکامل موجودات زنده و بیماریها را روشنتر کنند. شناخت این مکانیسمها میتواند درک ما از انتخاب طبیعی، سازگاری ژنتیکی و توسعه استراتژیهای درمانی نوین را بهبود بخشد.
جهشهای ساکت (Silent mutations) که با نام جهشهای هممعنی (Synonymous mutations) نیز شناخته میشوند، تغییرات در توالی DNA هستند که به دلیل واژگان تکراری کد ژنتیکی (redundancy of the genetic code) منجر به تغییر در توالی اسیدآمینهای پروتئین نمیشوند. برای دههها پس از کشف ساختار مارپیچ دوگانه DNA و رمز سهتایی (triplet code)، این نوع جهشها از نظر تکاملی خنثی (neutral) در نظر گرفته میشدند. استدلال غالب ساده بود: تا زمانی که توالی اسیدآمینه پروتئین تغییر نکند، انتخاب طبیعی (natural selection) دلیلی برای «اهمیت دادن» ندارد و سرنوشت جهش کاملاً تحت تأثیر رانش ژنتیکی (genetic drift) خواهد بود.
این استدلال به یکی از ارکان اصلی نظریه خنثی تکامل مولکولی (neutral theory of molecular evolution) تبدیل شد که توسط موتوئو کیمورا (Motoo Kimura) در اواخر دهه 1960 مطرح گردید و بر نقش غالب جهشهای انتخابی خنثی در شکلگیری تنوع ژنتیکی تأکید داشت.
با این حال، در سه دهه گذشته، شواهد تجربی، محاسباتی و مقایسهای فزاینده نشان دادهاند که این دیدگاه سنتی ناکامل است. جهشهای ساکت میتوانند پیامدهای فنوتیپی (phenotypic) و تکاملی قابلتوجهی داشته باشند و فرآیندهایی نظیر پایداری mRNA، اتصال (splicing)، کارایی ترجمه (translation efficiency) و حتی تاخوردگی پروتئین (protein folding) را تحت تأثیر قرار دهند. این اثرات، هرچند گاهی ظریف، میتوانند تناسب اندام موجود زنده (organismal fitness) را تغییر دهند و مسیرهای تکاملی را تحت نفوذ قرار دهند. درک این که جهشهای ساکت الزاماً «ساکت» نیستند، پیامدهای عمیقی برای ژنتیک جمعیت (population genetics)، تکامل مولکولی (molecular evolution)، فناوری زیستی (biotechnology) و سلامت انسان دارد.
شناخت مکانیزمهای اثرگذاری جهشهای هممعنی نیازمند دیدگاهی میانرشتهای است که زیستشناسی مولکولی، بیوشیمی و نظریه تکاملی را در هم میآمیزد. این مقاله مرجع به بررسی پایههای مولکولی جهشهای ساکت، مرور چارچوبهای کلاسیک و مدرن، و تحلیل مکانیسمهای گوناگونی میپردازد که از طریق آنها این تغییرات ظاهراً بیضرر میتوانند تکامل را شکل دهند.
2. پایه مولکولی جهشهای ساکت (Molecular Basis of Silent Mutations)
2.1 واژگان تکراری کد ژنتیکی (Redundancy of the Genetic Code)
کد ژنتیکی (genetic code) دارای ویژگی تکراری یا دژنراسی (degeneracy) است: ۶۴ کدون (codon) تنها ۲۰ اسیدآمینه استاندارد و علائم پایان را رمزگذاری میکنند. بهعنوان مثال، شش کدون مختلف لوسین (leucine) و چهار کدون گلیسین (glycine) را رمز میکنند. جهشهای ساکت معمولاً در موقعیت سوم یک کدون (به نام جایگاه واوبل – wobble position) رخ میدهند، جایی که تغییر نوکلئوتیدی اغلب باعث تغییر اسیدآمینه نمیشود. این تکرار باعث شد در ابتدا تصور شود که چنین جهشهایی از نظر انتخاب طبیعی نامرئی (invisible to selection) هستند.
با این حال، کدونهای هممعنی (synonymous codons) درون یک گونه یا میان گونهها بهطور مساوی استفاده نمیشوند. این سوگیری استفاده از کدون (codon usage bias) نشان میدهد که برخی کدونهای هممعنی ممکن است به دلیل محدودیتهای عملکردی ترجیح داده شوند. این الگوی غیرتصادفی اولین شواهد را ارائه کرد که حتی در جایگاههای ساکت نیز انتخاب طبیعی، هرچند ضعیف، وجود دارد.
2.2 رونویسی و پردازش mRNA (Transcription and mRNA Processing)
پس از رونویسی (transcription)، mRNA تحت کَپینگ (capping)، اتصال یا اسپلایسینگ (splicing) و پلیآدنیلاسیون (polyadenylation) قرار میگیرد. تغییرات هممعنی میتوانند عناصر تقویتکننده یا خاموشکننده اتصال (exonic splicing enhancers/silencers) را که ماشین اتصال را هدایت میکنند، تغییر دهند. یک جایگزینی تکنوکلئوتیدی که توالی اسیدآمینه را حفظ میکند ممکن است این سیگنالهای تنظیمی را مختل کند و منجر به پرش اگزون (exon skipping) یا ورود توالیهای اینترونی شود. در نتیجه، mRNA عملکردی و در پی آن محصول پروتئینی میتواند به شدت تحت تأثیر قرار گیرد.
2.3 ترجمه و ریبوزوم (Translation and the Ribosome)
در طول ترجمه (translation)، tRNAها با آنتیکدونهای مکمل (complementary anticodons) به کدونهای mRNA متصل میشوند. کدونهای هممعنی ممکن است با سرعتهای متفاوتی ترجمه شوند که این امر به وفور tRNA، کارایی جفت شدن واوبل (wobble pairing efficiency) و پویایی ریبوزوم (ribosome dynamics) وابسته است. تغییرات در سرعت ترجمه میتواند تاخوردگی همزمان پروتئین (co-translational protein folding) را تحت تأثیر قرار دهد و ساختار سهبعدی نهایی پروتئین را حتی با وجود یکسان بودن توالی اسیدآمینه تغییر دهد. این پدیده یک پیوند مکانیکی مستقیم میان جهشهای ساکت و پیامدهای فنوتیپی فراهم میکند.
3. دیدگاه کلاسیک: نظریه خنثی (Classical Perspective: The Neutral Theory)
3.1 ریشههای نظریه خنثی (Origins of the Neutral Theory)
در دهه 1960، موتوئو کیمورا (Motoo Kimura) پیشنهاد داد که اکثریت جانشینیهای مولکولی (molecular substitutions) از نظر انتخاب طبیعی خنثی هستند. بر اساس این دیدگاه، بیشتر چندشکلیها (polymorphisms) در سطح DNA—بهویژه در جایگاههای هممعنی—عملاً از دید انتخاب طبیعی پنهاناند و بنابراین کاملاً تحت تأثیر رانش ژنتیکی (genetic drift) قرار دارند. این نظریه توضیح داد که چرا نرخ تکامل مولکولی میان تبارهای مختلف نسبتاً ثابت است و پیشبینی کرد که نرخ جانشینی خنثی برابر است با نرخ جهش خنثی (neutral mutation rate)، مستقل از اندازه جمعیت.
3.2 شواهد اولیه پشتیبان (Early Supporting Evidence)
چندین خط شواهد از این چارچوب حمایت کردند. تحلیلهای مقایسهای نشان داد که نرخ تکامل در جایگاههای هممعنی سریعتر از جایگاههای غیرهممعنی (nonsynonymous) است، که با کاهش محدودیت انتخابی (relaxed selective constraint) سازگار است. دادههای چندشکلی نشان دادند که تنوع در جایگاههای ساکت نسبت به جایگاههای تغییردهنده پروتئین بسیار بالاست. این الگوها بهعنوان دلیلی برای خنثی بودن جهشهای هممعنی در تکامل تفسیر شدند.
3.3 محدودیتها و چالشها (Limitations and Challenges)
با وجود موفقیتهای نظریه خنثی، برخی مشاهدات توضیح داده نمیشدند. سوگیری چشمگیر استفاده از کدونها (pronounced codon usage biases) در میان گونهها نشان میداد که انتخاب—even اگر ضعیف باشد—بر جایگاههای ساکت اثر میگذارد. ارتباط میان سرعت رشد و سوگیری کدونی در میکروبها نشان داد که کارایی و دقت ترجمه (translational efficiency and accuracy) فشارهای انتخابی بر کدونهای هممعنی وارد میکند. با گسترش فناوری توالییابی و تکامل سیستمهای آزمایشی، موارد بیشتری مشاهده شد که در آنها جهشهای هممعنی بر بیان ژن، پایداری mRNA یا عملکرد پروتئین تأثیر داشتند—پدیدههایی که با خنثی بودن مطلق ناسازگارند.
این یافتهها به اصلاحاتی مانند نظریه تقریباً خنثی (nearly neutral theory) منجر شدند که بیان میکند بسیاری از جهشها دارای اثرات کوچک بر تناسب (very small fitness effects) هستند. در این دیدگاه، سرنوشت یک جهش هممعنی به برهمکنش میان ضریب انتخابی اندک (slight selective coefficient) و اندازه مؤثر جمعیت (effective population size – Ne) بستگی دارد. جمعیتهای بزرگ میتوانند حتی تفاوتهای بسیار جزئی در تناسب را انتخاب کنند یا حذف نمایند، در حالی که جمعیتهای کوچک تحت رانش ژنتیکی قویتر قرار دارند و امکان میدهند جهشهای هممعنی اندکی زیانآور باقی بمانند.
4. مکانیسمهای اثرگذاری جهشهای ساکت بر تکامل (Mechanisms by Which Silent Mutations Influence Evolution)
جهشهای ساکت (Silent mutations) میتوانند از طریق طیف گستردهای از فرآیندهای مولکولی بر تکامل اثر بگذارند. اگرچه توالی اسیدآمینه تغییری نمیکند، اما تغییر در توالی نوکلئوتیدی میتواند بر نحوهی رونویسی (transcription)، پردازش (processing)، ترجمه (translation) و نهایتاً تاخوردگی و عملکرد پروتئین اثر بگذارد. در ادامه، مکانیسمهای اصلی شناختهشده آورده شده است:
4.1 سوگیری استفاده از کدون و کارایی ترجمه (Codon Usage Bias and Translational Efficiency)
رایجترین مکانیسم شامل سوگیری استفاده از کدون (codon usage bias) است—ترجیح استفاده از برخی کدونهای هممعنی (synonymous codons) نسبت به سایرین. ارگانیسمها اغلب الگوهای خاصگونهای از ترجیح کدون دارند که منعکسکننده تفاوت در وفور مولکولهای tRNA است. کدونهایی که با tRNAهای فراوان مطابقت دارند سریعتر و دقیقتر ترجمه میشوند و کارایی ترجمه را افزایش میدهند.
جهشهای هممعنی که یک کدون بهینه را با یک کدون نادر جایگزین کنند میتوانند حرکت ریبوزوم (ribosome movement) را کند، بازده پروتئین را کاهش دهند یا احتمال خطاهای ترجمه را بالا ببرند. برعکس، جایگزینی یک کدون نادر با کدون رایج میتواند سطح بیان پروتئین (protein expression level) را افزایش دهد.
شواهد تجربی: در اشرشیا کلی (Escherichia coli)، بهینهسازی استفاده از کدونهای یک ژن بیگانه تولید پروتئین را بهطور چشمگیری افزایش میدهد؛ اصلی که در زیستفناوری (biotechnology) و زیستشناسی ترکیبی (synthetic biology) بهرهبرداری میشود. در ویروسها که به ماشین ترجمه میزبان وابستهاند، سوگیری کدون میتواند بر تناسب ویروسی (viral fitness) و اختصاصیت میزبان (host specificity) اثر بگذارد. نمونه مهم آن کاهش بهینهسازی کدون (codon deoptimization) در ویروس پولیو (poliovirus) است که برای ساخت واکسنهای ضعیفشده استفاده میشود.
4.2 ساختار ثانویه mRNA و پایداری (mRNA Secondary Structure and Stability)
جهشهای ساکت میتوانند ساختار ثانویه mRNA را با تغییر الگوهای جفتشدن بازها تغییر دهند و در نتیجه بر پایداری نسخه رونویسی شده (transcript stability) و فرآیند ترجمه اثر بگذارند. این ساختارهای تغییر یافته ممکن است اتصال یا حرکت ریبوزوم را مختل کنند، شناسایی توسط پروتئینهای متصل شونده به RNA (RNA-binding proteins) را تحت تأثیر قرار دهند، یا نیمهعمر mRNA را تغییر دهند. مطالعات نشان دادهاند که حتی یک جایگزینی هممعنی (synonymous substitution) میتواند به طور قابلتوجهی نرخ تخریب mRNA (mRNA degradation rate) را تغییر دهد و مقدار پروتئین را بدون تغییر در توالی اسیدآمینه تحت تأثیر قرار دهد.
4.3 تنظیم اتصال (Regulation of Splicing)
در یوکاریوتها، پیشmRNA (pre-mRNA) باید برای حذف اینترونها اتصال (splicing) شود. جهشهای هممعنی در درون اگزونها میتوانند عناصر تقویتکننده یا خاموشکننده اتصال (exonic splicing enhancers/silencers) را که ماشین اتصال را هدایت میکنند، مختل یا ایجاد کنند. این تغییرات میتوانند به پرش اگزون (exon skipping)، حفظ اینترون (intron retention) یا استفاده از محلهای اتصال جایگزین (alternative splice sites) منجر شوند. یک نمونه شناختهشده مربوط به ژن CFTR در انسان است که در آن یک جهش هممعنی در اگزون 12 اتصال طبیعی را مختل کرده و به بیماری فیبروز کیستیک (cystic fibrosis) کمک میکند.
4.4 انتقال و مکانیابی mRNA (mRNA Transport and Localization)
تغییرات هممعنی میتوانند عناصر تنظیمی cis را که مکانیابی mRNA در سلول (mRNA localization) را تعیین میکنند، تغییر دهند. ترجمه موضعی (localized translation) در فرآیندهایی مانند توسعه نورونی (neuronal development) و رویانزایی (embryogenesis) حیاتی است. تغییر در این سیگنالهای مکانیابی ممکن است انتقال mRNA را مختل کرده و باعث بیان نابجای پروتئین شود.
4.5 تاخوردگی همزمان پروتئین (Co-translational Protein Folding)
تاخوردگی پروتئین (protein folding) اغلب در حالی آغاز میشود که زنجیره پلیپپتیدی هنوز از ریبوزوم خارج نشده است. سرعت ترجمه در کدونهای مختلف بر چگونگی تاخوردگی دامنههای پروتئینی نسبت به یکدیگر اثر دارد. کدونهای نادر میتوانند توقفهای مفیدی ایجاد کنند که امکان تاخوردگی صحیح را میدهد؛ جایگزینی آنها با کدونهای رایج ممکن است این زمانبندی را مختل کرده و پروتئینهای بدتاخورده (misfolded proteins) ایجاد کند. در مگس سرکه (Drosophila)، تغییر کدونهای هممعنی در ژن period ریتم شبانهروزی (circadian rhythm) را تغییر میدهد که ظاهراً ناشی از تأثیر بر تاخوردگی همزمان (co-translational folding) است.
4.6 تعاملات با RNAهای تنظیمی (Regulatory RNA Interactions)
جهشهای ساکت میتوانند محلهای اتصال (binding sites) برای میکروRNAها (microRNAs – miRNAs) یا سایر RNAهای تنظیمی را ایجاد یا نابود کنند و بدین ترتیب تنظیم پسارونویسی (post-transcriptional regulation) را تغییر دهند. یک نمونه کلاسیک، جهش هممعنی در ژن سرطانی KRAS است که یک محل اتصال جدید برای خانواده miRNA let-7 ایجاد میکند و بیان ژن را تعدیل کرده و بر پیشرفت سرطان (cancer progression) اثر میگذارد.
5. شواهد حاصل از ژنومیک مقایسهای (Evidence from Comparative Genomics)
ژنومیک مقایسهای (Comparative genomics) ابزار مهمی برای آشکار ساختن اهمیت تکاملی جهشهای هممعنی بوده است. با بررسی توالیهای DNA در میان گونهها و جمعیتها، پژوهشگران میتوانند الگوهایی ناسازگار با خنثی بودن (non-neutrality) را شناسایی کرده و نشانههای انتخاب طبیعی در جایگاههای ساکت را کشف کنند.
5.1 الگوهای استفاده از کدون در سطح ژنوم (Genome-wide Codon Usage Patterns)
تحلیلهای گسترده نشان میدهد که استفاده از کدون در سراسر باکتریها، آرکیها و یوکاریوتها به شدت غیرتصادفی (non-random) است. در باکتریهای سریعالرشد مانند E. coli، ژنهای با بیان بالا از کدونهای متناسب با tRNAهای فراوان استفاده میکنند که بازتاب انتخاب برای کارایی ترجمه (selection for translational efficiency) است. بهطور مشابه، مخمر (yeast) و بسیاری از یوکاریوتهای پرسلولی نیز ترجیح کدونی دارند که با سطوح بیان ژن همبستگی دارد. این همبستگی حتی پس از کنترل ترکیب نوکلئوتیدی پسزمینه ادامه دارد و نشان میدهد که انتخاب طبیعی—و نه صرفاً سوگیری جهشی—راننده اصلی استفاده از کدون است.
5.2 همبستگی با محتوای GC و شیوه زندگی (Correlations with GC Content and Lifestyle)
در برخی تبارها، سوگیری کدون (codon bias) با محتوای GC ژنوم (genomic GC content) همبستگی دارد که نشانگر برهمکنش پیچیده جهش، انتخاب و تبدیل ژن سوگیرانه (biased gene conversion) است. ارگانیسمهای انگلی اغلب نسبت به خویشاوندان آزادزی خود، سوگیری کدونی کمتری دارند که با کاهش فشار انتخابی به دلیل اندازه مؤثر جمعیت (effective population size – Ne) کوچکتر سازگار است. این الگوهای مقایسهای از مدل تقریباً خنثی (nearly neutral model) پشتیبانی میکنند که در آن قدرت انتخاب در جایگاههای هممعنی توسط اندازه جمعیت تعدیل میشود.
5.3 ردپای فیلوژنتیکی و حفاظت (Phylogenetic Footprinting and Conservation)
مناطق با حفاظت غیرمنتظره بالا در موقعیتهای هممعنی اغلب عناصر تنظیمی نهفته در توالیهای کدکننده را نشان میدهند، مانند تقویتکنندههای اتصال (splicing enhancers) یا ساختارهای RNA. این توالیهای دوکاربردی (dual-function sequences) تحت انتخاب پاککننده (purifying selection) قرار دارند که هویت نوکلئوتیدی را حفظ میکند، با وجود آنکه کد ژنتیکی دژنره امکان تغییر فراهم میآورد.
6. ژنتیک جمعیت جایگاههای هممعنی (Population Genetics of Synonymous Sites)
برای درک اینکه چگونه جهشهای ساکت گسترش مییابند یا حذف میشوند، باید مکانیسمهای مولکولی را با نظریه ژنتیک جمعیت (population-genetic theory) ترکیب کرد. برخلاف جایگاههای کلاسیک خنثی، جایگاههای هممعنی ممکن است انتخاب ضعیف (weak selection) را تجربه کنند که ضریب انتخابی (selection coefficient) آنها در حدود 10⁻⁵ تا 10⁻³ است. تأثیر این اثرات ضعیف بر فرکانس آللی به شدت به اندازه مؤثر جمعیت (effective population size – Ne) وابسته است.
6.1 پویایی تقریباً خنثی (Nearly Neutral Dynamics)
بر اساس نظریه تقریباً خنثی توموکو اوتا (Tomoko Ohta’s nearly neutral theory)، جهشهایی با اثرهای بسیار کوچک بر تناسب (very small fitness effects) در جمعیتهای کوچک که رانش ژنتیکی (genetic drift) غالب است، تقریباً خنثی رفتار میکنند. در جمعیتهای بزرگ، همین جهشها میتوانند به طور مؤثر تحت انتخاب (selected for or against) قرار گیرند. این امر توضیح میدهد که چرا گونههای با Ne بزرگ مانند میکروبها سوگیری کدونی آشکار دارند، در حالی که گونههای با Ne کوچک، از جمله بسیاری از مهرهداران، سوگیری کدونی ضعیفتر نشان میدهند.
6.2 تعادل جهش–انتخاب–رانش (Mutation–Selection–Drift Balance)
چندشکلیهای هممعنی اغلب با تعادلی میان جهش (mutation) که واریانتهای جدید را معرفی میکند، انتخاب (selection) که کدونهای بهینه را ترجیح میدهد، و رانش (drift) که فرکانسها را تصادفی میکند، حفظ میشوند. مدلهای ریاضی که این نیروها را در نظر میگیرند، توزیع تعادلی استفاده از کدون را پیشبینی میکنند که با مشاهدات تجربی در بسیاری از تاکسا مطابقت دارد.
6.3 برآورد انتخاب در جایگاههای ساکت (Estimating Selection on Silent Sites)
روشهای آماری مدرن مانند آزمون مکدونالد-کریتمن (McDonald–Kreitman test)، نسبت چندشکلی–واگرایی (polymorphism–divergence ratios) و تحلیل طیف فرکانس جایگاهی (site-frequency spectrum analysis) امکان برآورد ضرایب انتخاب (selection coefficients) در جایگاههای هممعنی را فراهم میکنند. مطالعات متعدد شواهدی از انتخاب پاککننده (purifying selection) و انتخاب مثبت (positive selection) گزارش کردهاند، که نشان میدهد جهشهای ساکت در فرآیندهای انطباقی (adaptive) و محدودکننده (constraining) تکامل ژنوم نقش دارند.
7. مطالعات تجربی و نمونههای موردی (Experimental Studies and Case Examples)
در حالی که ژنومیک تطبیقی (Comparative Genomics) الگوهای جمعیتی را آشکار میکند، مطالعات تجربی (Experimental Studies) شواهد مستقیمی ارائه میدهند که نشان میدهد جهشهای خاموش (Silent Mutations / Synonymous Mutations) چگونه میتوانند بر تناسب مولکولی و ارگانیسمی (Molecular and Organismal Fitness) اثر بگذارند. تکامل آزمایشگاهی (Laboratory Evolution)، جهشزایی هدفمند (Site-directed Mutagenesis) و زیستفناوری سنتتیک (Synthetic Biology) مثالهای قانعکنندهٔ بسیاری تولید کردهاند.
7.1 سیستمهای ویروسی (Viral Systems)
ویروسها به دلیل ژنومهای فشرده (Compact Genomes) و تکثیر سریع (Rapid Replication)، سامانههای ایدهآلی برای مطالعهٔ تغییرات مترادف هستند. پژوهشگران بارها نشان دادهاند که وارد کردن تعداد زیادی جایگزینی مترادف (Synonymous Substitutions) میتواند به شدت تناسب ویروس (Viral Fitness) را کاهش دهد.
بهعنوان نمونه، زمانی که ویروس فلج اطفال (Poliovirus) دچار کاهش بهینهسازی جفتکدونی (Codon-Pair Deoptimization) شد، نرخ همانندسازی (Replication Rate) و بیماریزایی (Pathogenicity) آن افت کرد، در حالی که توالی اسیدآمینهای پروتئینها (Amino Acid Sequence) بدون تغییر باقی ماند.
مشاهدات مشابهی در آنفلوآنزا (Influenza)، اچآیوی (HIV) و SARS-CoV-2 گزارش شده است که نشان میدهد تغییرات خاموش میتوانند بر رشد ویروس، دامنهٔ میزبانی (Host Range) و تشخیص ایمنی (Immune Recognition) اثر بگذارند. این یافتهها پایهٔ راهبردهای نوین ساخت واکسن (Vaccine Development Strategies) هستند، جایی که تغییرات مترادف عمدی (Deliberate Synonymous Changes) ویروس را بدون تغییر در پروتئینهای آنتیژنی تضعیف میکند.
7.2 مدلهای باکتری و مخمر (Bacterial and Yeast Models)
در باکتریهایی مانند اشرشیاکلی (Escherichia coli) و سالمونلا انتریکا (Salmonella enterica)، تغییر در کدونهای مترادف (Synonymous Codons) در ژنهای متابولیک کلیدی بر نرخ رشد (Growth Rate) و پاسخهای استرسی (Stress Responses) اثر میگذارد.
خطوط تکامل آزمایشگاهی (Experimental Evolution Lines) نشان دادهاند که واریانتهای مترادف در شرایط خاص میتوانند بهطور مکرر تحت انتخاب (Favored by Selection) قرار گیرند، که بیانگر عمل مستقیم انتخاب طبیعی بر استفاده از کدون (Codon Usage) یا ساختار mRNA است.
در مخمر ساکارومایسس سرویزیه (Saccharomyces cerevisiae)، جایگزینی کدونهای ترجیحی (Preferred Codons) با کدونهای کمیاب باعث کاهش سطح پروتئین (Protein Level) و تناسب (Fitness) شده است و این اثرات در آزمونهای رشد رقابتی (Competitive Growth Assays) قابل اندازهگیری هستند.
7.3 یوکاریوتهای پرسلولی (Multicellular Eukaryotes)
تأثیر جهشهای خاموش در موجودات عالی (Higher Organisms) نیز مشهود است.
در مگس میوه (Drosophila melanogaster)، جهشهای مترادف در ژن period (ژن ساعت شبانهروزی)، ریتمهای روزانه (Circadian Rhythms) را تغییر میدهند؛ احتمالاً از طریق اثر بر تاخوردگی همزمان با ترجمه (Co-translational Folding) یا پایداری mRNA.
در گیاهانی مانند Arabidopsis thaliana، تغییرات خاموش میتوانند پاسخ به استرس محیطی (Environmental Stress Responses) و زمانبندی رشد (Developmental Timing) را تنظیم کنند. این نمونهها نشان میدهند که انتخاب در جایگاههای مترادف (Selection on Synonymous Sites) در سراسر درخت حیات (Tree of Life) عمل میکند.
7.4 زیستفناوری سنتتیک و طراحی ژن (Synthetic Biology and Gene Design)
زیستفناوران (Biotechnologists) به طور روتین بهینهسازی استفاده از کدون (Codon Optimization) را برای افزایش بیان پروتئینهای خارجی در میزبانهای مختلف، از باکتریها تا سلولهای پستانداران به کار میبرند.
بهینهسازی کدون (Codon Optimization) میتواند بازده پروتئین (Protein Yield) را به طور چشمگیری افزایش دهد.
برعکس، معرفی عمدی کدونهای کمیاب (Deliberate Introduction of Rare Codons) میتواند تاخوردگی پروتئین (Protein Folding) را تنظیم کرده یا بار متابولیکی (Metabolic Burden) را کاهش دهد. این نشان میدهد که درک دقیق از جهشهای خاموش (Silent Mutations) کاربردهای عملی مهمی دارد.
8. جهشهای خاموش در سلامت و بیماری انسان (Silent Mutations in Human Health and Disease)
جهشهای خاموش زمانی به عنوان از نظر بالینی بیاهمیت (Clinically Irrelevant) تلقی میشدند، اما ژنومیک پزشکی (Medical Genomics) اهمیت آنها را در بسیاری از بیماریها آشکار کرده است.
چون این جهشها توالی اسیدآمینه (Amino Acid Sequence) را تغییر نمیدهند، اغلب از فیلترهای تشخیصی سنتی (Traditional Diagnostic Filters) میگریزند، اما اثرات آنها بر اتصال، ترجمه و پایداری mRNA میتواند بسیار چشمگیر باشد.
8.1 بیماریهای تکژنی (Monogenic Disorders)
چندین بیماری ارثی اکنون شناخته شدهاند که توسط جهشهای مترادف (Synonymous Mutations) که بر فرایند برش RNA (Splicing) اثر میگذارند، ایجاد میشوند.
بهعنوان نمونه، یک تغییر مترادف در ژن CFTR یک محل برش غیرطبیعی (Aberrant Splice Site) ایجاد میکند و منجر به فیبروز کیستیک (Cystic Fibrosis) میشود.
نمونهٔ دیگر مربوط به ژن G6PD است که در آن واریانتهای خاموش بر پایداری mRNA (mRNA Stability) و فعالیت آنزیم (Enzyme Activity) تأثیر میگذارند و موجب کمخونی همولیتیک (Hemolytic Anemia) میشوند.
8.2 سرطان (Cancer)
ژنومیک سرطان (Cancer Genomics) جهشهای مترادف متعددی با نقش بالقوهٔ رانشگر (Driver Roles) شناسایی کرده است.
برخی از این جهشها تقویتکنندهها یا خاموشکنندههای برش (Splicing Enhancers or Silencers) را تغییر میدهند و ایزوفرمهای سرطانی (Oncogenic Isoforms) تولید میکنند.
برخی دیگر بر کینتیک ترجمه (Translation Kinetics) اثر میگذارند و بر تاخوردگی یا فراوانی (Folding or Abundance) پروتئینهای مهارکننده تومور (Tumor Suppressors) و انکوژنها (Oncogenes) تأثیر میگذارند.
ژن KRAS نمونهٔ برجستهای است: برخی جهشهای مترادف در آن محلهای اتصال جدید برای میکروRNA خانوادهٔ let-7 (Novel microRNA Binding Sites) ایجاد میکنند، سطح پروتئین را کاهش میدهند و بر پیشرفت تومور (Tumor Progression) اثر میگذارند.
8.3 فارماکوژنومیک (Pharmacogenomics)
واریانتهای خاموش میتوانند متابولیسم دارو (Drug Metabolism) را از طریق تغییر در بیان آنزیمهای سیتوکروم P450 (Cytochrome P450 Enzymes) و ترانسپورترها (Transporters) تحت تأثیر قرار دهند.
برای مثال، یک SNP مترادف (Synonymous SNP) در ژن MDR1 (همچنین با نام ABCB1) که پروتئین P-glycoprotein را کد میکند، اختصاصیت بستر (Substrate Specificity) و کارایی پمپاژ دارو (Drug Efflux Efficiency) را تغییر میدهد و بر پاسخ به داروهای شیمیدرمانی (Chemotherapeutic Agents) اثر میگذارد.
8.4 پاتوژنز ویروسی و تعامل میزبان (Viral Pathogenesis and Host Interaction)
واریانتهای خاموش میزبان میتوانند حساسیت به بیماریهای عفونی (Susceptibility to Infectious Diseases) را نیز تعدیل کنند.
چندریختیهایی که الگوی استفاده از کدون (Codon Usage Pattern) را در ژنهای مرتبط با ایمنی تغییر میدهند، ممکن است بر تولید پروتئین در طول عفونت (Protein Production During Infection) اثر بگذارند و به شکل ظریفی نتایج بیماری (Disease Outcomes) را تغییر دهند.
9. تعامل با سایر نیروهای تکاملی (Interactions with Other Evolutionary Forces)
جهشهای خاموش بهصورت جداگانه عمل نمیکنند. سرنوشت و پیامدهای تکاملی آنها به تعامل با سایر فرایندهای ژنتیکی و تکاملی (Genetic and Evolutionary Processes) بستگی دارد.
9.1 اپیستاز (Epistasis)
اثر یک جهش مترادف میتواند به وجود سایر واریانتها در همان ژن یا ژنوم وابسته باشد.
برای مثال، یک تغییر مترادف که سرعت ترجمه (Translation Speed) را کاهش میدهد ممکن است در یک زمینه ژنتیکی (Genetic Background) مفید باشد اما در دیگری، در صورت نبود مکانیسمهای جبرانی، مضر واقع شود.
این برهمکنشهای اپیستاتیک (Epistatic Interactions) پیشبینی اثرات جهشهای خاموش (Prediction of Silent Mutation Effects) را پیچیده میکند و میتواند چشماندازهای تناسب پرفراز و نشیب (Rugged Fitness Landscapes) ایجاد کند.
9.2 عدم تعادل پیوستگی و همراهی (Linkage Disequilibrium and Hitchhiking)
مکانهای مترادف اغلب با جهشهای غیرمترادف مجاور (Nearby Nonsynonymous Mutations) که تحت انتخاب مثبت (Positive Selection) هستند، همراهی (Hitchhiking) میکنند.
در چنین مواردی، یک آلل مترادف خنثی یا کمی زیانآور (Neutral or Slightly Deleterious) ممکن است صرفاً به دلیل ارتباط فیزیکی (Physical Linkage) با یک واریانت مفید، به فراوانی بالا برسد.
تشخیص انتخاب مستقیم (Direct Selection) بر مکانهای خاموش از همراهی ژنتیکی (Hitchhiking) نیاز به تحلیل دقیق ژنتیک جمعیت (Population Genetics Analysis) دارد.
9.3 رانش ژنتیکی (Genetic Drift)
از آنجا که بسیاری از جهشهای خاموش دارای ضریب انتخابی کوچک (Small Selection Coefficients) هستند، رانش ژنتیکی (Genetic Drift) میتواند به شدت بر مسیر آنها اثر بگذارد، بهویژه در جمعیتهای کوچک (Small Populations).
یک واریانت مترادف اندکی زیانآور (Weakly Deleterious) ممکن است به تثبیت (Fixation) برسد، در حالی که یک واریانت اندکی سودمند (Weakly Advantageous) ممکن است از بین برود. این نکته تعامل میان رانش و انتخاب ضعیف (Interplay Between Drift and Weak Selection) را که در نظریه تقریباً خنثی (Nearly Neutral Theory) توصیف شده است، برجسته میکند.
9.4 انتقال افقی ژن و نوترکیبی (Horizontal Gene Transfer and Recombination)
در باکتریها و آرکیها، انتقال افقی ژن (Horizontal Gene Transfer) توالیهایی را وارد میکند که الگوی استفاده از کدون (Codon Usage Pattern) متفاوتی از میزبان دارند.
انتخاب پس از آن میتواند باعث همسازسازی کدون (Codon Amelioration) شود و بهتدریج استخر tRNA میزبان (Host tRNA Pool) را تطبیق دهد.
نوترکیبی (Recombination) نیز میتواند واریانتهای مترادف را جابهجا (Shuffle) کند و بر الگوهای محلی استفاده از کدون (Local Patterns of Codon Bias) و پیوستگی (Linkage) اثر بگذارد.