روشهای کشت میکروبی: محیطهای کشت انتخابی، افتراقی و غنی
مقدمه
کشت میکروبی به عنوان یکی از ارکان اصلی میکروبیولوژی، از زمان کشف میکروبها تا امروز، نقشی بیبدیل در شناسایی، مطالعه و استفاده از میکروارگانیسمها ایفا کرده است. این فرآیند، که شامل رشد و تکثیر میکروبها در شرایط کنترلشده آزمایشگاهی است، به دانشمندان اجازه میدهد تا رفتار، نیازهای تغذیهای، مقاومتها و ویژگیهای زیستی میکروبها را با دقت بالا مورد بررسی قرار دهند. اهمیت کشت میکروبی نه تنها در حوزه تحقیقات پایه، بلکه در کاربردهای بالینی، صنعتی، محیطی و غذایی نیز قابل توجه است.
در میکروبیولوژی بالینی، تشخیص سریع و دقیق عوامل بیماریزا مستقیماً به انتخاب محیط کشت مناسب بستگی دارد. برای مثال، در شناسایی باکتریهای بیماریزا مانند Listeria monocytogenes یا قارچهای نوظهور مثل Candida auris، استفاده از محیطهای کشت تخصصی میتواند سرعت تشخیص و دقت نتایج را به طرز چشمگیری افزایش دهد. همینطور، در صنایع غذایی و دارویی، کنترل میکروبی محصولات با استفاده از محیطهای مناسب، تضمینکننده سلامت مصرفکننده و کیفیت محصول است.
تکامل محیطهای کشت طی سالها، نشاندهنده پیشرفت علمی در فهم نیازهای میکروبها و تعامل آنها با محیط است. در اوایل، محیطهای سادهای شامل عصاره گوشت و مواد مغذی پایهای به کار گرفته میشد، اما با پیشرفت علم، محیطهای غنی، انتخابی و افتراقی طراحی شدند تا نیازهای خاص میکروبها را برطرف کنند و امکان شناسایی و جداسازی دقیق آنها را فراهم سازند. این محیطها، علاوه بر فراهم کردن شرایط رشد، قادر به محدود کردن رشد میکروبهای ناخواسته و متمایز کردن گونههای مختلف هستند، که این امر در تشخیص بالینی و تحقیقات میکروبی اهمیت بالایی دارد.
علاوه بر کاربردهای عملی، مطالعه کشت میکروبی پنجرهای به سوی درک عمیقتری از زیستشناسی میکروبها باز میکند. میکروبها در محیطهای طبیعی خود اغلب در شرایط پیچیده و محدود رشد میکنند و بسیاری از آنها قادر به رشد در محیط آزمایشگاهی نیستند؛ این پدیده که تحت عنوان "dark microbial matter" یا میکروبهای غیرقابل کشت شناخته میشود، باعث شده است که دانشمندان به طراحی محیطهای تخصصی و پیشرفتهتر روی آورند. مطالعه این میکروبها میتواند افقهای تازهای در زمینه داروسازی، بیوتکنولوژی و حفاظت محیط زیست باز کند.
هدف این مقاله، ارائه یک مرور جامع و کاربردی بر روشهای کشت میکروبی و محیطهای کشت مختلف، شامل محیطهای غنی، انتخابی و افتراقی، است. در این مقاله تلاش شده است که تمامی نکات مرتبط با ترکیبات محیطهای کشت، اصول طراحی، کاربردها، مزایا و محدودیتها و همچنین پیشرفتهای نوین در این حوزه به صورت دقیق و کامل پوشش داده شود. این متن برای متخصصان میکروبیولوژی، دانشجویان، پژوهشگران و علاقهمندان به علوم زیستی طراحی شده است تا نه تنها دانش پایهای خود را تقویت کنند، بلکه بتوانند در عمل نیز انتخاب محیط کشت مناسب و بهرهگیری از روشهای پیشرفته را درک و اجرا کنند.
با پیشرفت فناوری و افزایش شناخت از زیستشناسی میکروبها، اهمیت انتخاب محیط کشت مناسب و همچنین ترکیب روشهای سنتی با تکنیکهای مولکولی و پیشرفته، بیش از پیش آشکار شده است. محیطهای کشت دیگر صرفاً مکانی برای رشد نیستند؛ بلکه ابزارهایی قدرتمند برای کنترل، هدایت و شناسایی میکروبها به شمار میآیند.
در ادامه این مقاله، ابتدا به مبانی و اصول کلی کشت میکروبی پرداخته خواهد شد، سپس انواع محیطهای کشت شامل محیطهای غنی، انتخابی و افتراقی به صورت کامل بررسی میشوند، و در نهایت روشهای نوین و چالشهای موجود در این حوزه مورد بحث قرار خواهد گرفت تا تصویری جامع و کاربردی از این موضوع ارائه گردد.
مبانی و اصول کشت میکروبی
برای درک عمیق محیطهای کشت و روشهای مختلف کشت میکروبی، ابتدا باید مبانی زیستشناسی میکروبها و اصول رشد آنها را بررسی کنیم. میکروبها، شامل باکتریها، قارچها و بعضی پروتوزوآها، موجوداتی هستند که برای رشد و تکثیر به شرایط خاصی نیاز دارند. این شرایط شامل مواد مغذی، دما، pH، میزان اکسیژن و دیگر عوامل محیطی است که بسته به گونه میکروبی، متفاوت هستند.
کشت میکروبی به معنای فراهم آوردن شرایطی است که میکروبها بتوانند در آن به طور مستقل رشد کنند و جمعیت خود را افزایش دهند. این فرآیند میتواند به دو شکل کلی انجام شود: کشت مخلوط، که شامل رشد همزمان چند گونه میکروبی است، و کشت خالص، که تنها یک گونه مشخص در محیط رشد میکند. کشت خالص برای مطالعات دقیق، شناسایی ویژگیهای زیستی، ارزیابی حساسیت به آنتیبیوتیکها و تولید متابولیتهای مفید بسیار حیاتی است.
یکی از اصول پایهای در کشت میکروبی، شناخت نیازهای تغذیهای میکروبها است. میکروبها بسته به نوع خود، نیاز به منابع کربن، نیتروژن، ویتامینها و عناصر معدنی دارند. به عنوان مثال، باکتریهای معمولی مانند Escherichia coli برای رشد سریع به منبع کربن ساده مانند گلوکز نیاز دارند، در حالی که برخی باکتریهای محیطی و یا میکروبهای غیرکشتپذیر به ترکیبات پیچیدهتر و شرایط ویژه رشد نیازمندند. همچنین، شرایط فیزیکی محیط از جمله دما، رطوبت، pH و میزان اکسیژن نقش حیاتی در موفقیت کشت ایفا میکنند. برخی میکروبها هوازی هستند و برای رشد به اکسیژن نیاز دارند، در حالی که برخی دیگر بیهوازی هستند و وجود اکسیژن میتواند برای آنها سمی باشد.
علاوه بر این، رفتار میکروبها در محیط کشت میتواند تحت تأثیر پدیدههایی مانند dormancy و persistence باشد. بسیاری از باکتریها میتوانند در شرایط نامساعد وارد حالت غیر فعال شوند که رشد آنها متوقف میشود، اما در صورت فراهم شدن شرایط مناسب، دوباره فعال شده و تکثیر مییابند. این پدیده در میکروبهای محیطی، بالینی و صنعتی مشاهده میشود و طراحی محیط کشت مناسب برای بازیابی آنها اهمیت بسیاری دارد.
انتخاب نوع محیط کشت نیز براساس هدف آزمایش و ویژگیهای میکروب انجام میشود. محیطهای غنی برای رشد عمومی و افزایش سریع جمعیت میکروبها طراحی شدهاند، در حالی که محیطهای انتخابی با افزودن عوامل مهارکننده، رشد گونههای خاص را ترجیح میدهند و محیطهای افتراقی با استفاده از نشانگرهای متابولیک، امکان تمایز گونهها را فراهم میکنند. برای مثال، در شناسایی باکتریهای رودهای، محیط MacConkey Agar هم ویژگی انتخابی دارد و هم به صورت افتراقی عمل میکند.
یکی دیگر از اصول مهم، پاکیزگی و کنترل شرایط محیطی در طول کشت است. استفاده از تکنیکهای استریل و ابزارهای مناسب مانند اتوکلاو، هود لامینار و میکروسکوپ، احتمال آلودگی نمونهها را کاهش داده و نتایج دقیقتر و قابل اطمینانتری را تضمین میکند. همچنین، آمادهسازی محیطها با دقت و رعایت استانداردهای کیفیت، پایه موفقیت هر فرآیند کشت میکروبی است.
در نهایت، کشت میکروبی نه تنها به رشد میکروبها محدود میشود، بلکه ابزار مطالعه رفتار آنها نیز هست. با بررسی رشد، شکل کولونی، تغییرات رنگی، تولید متابولیتها و واکنشهای بیوشیمیایی میتوان ویژگیهای میکروبها را شناسایی و مطالعه کرد. این اطلاعات، از جمله حساسیت به داروها، توانایی تولید مواد مفید یا پاتوژنیسیته، نقش حیاتی در تحقیقات بالینی و صنعتی دارند.
با درک عمیق این اصول، محقق میتواند انتخاب محیط کشت مناسب، طراحی آزمایش و تحلیل نتایج را به شکل موثری انجام دهد. این مبانی پایهای، مسیر را برای بررسی محیطهای کشت غنی، انتخابی و افتراقی هموار میسازد و امکان کاربرد دقیق و علمی آنها را در میکروبیولوژی بالینی، صنعتی و تحقیقاتی فراهم میکند.
محیطهای کشت غنی (Rich Media)
محیطهای کشت غنی، یکی از پایهایترین و پراستفادهترین انواع محیطهای کشت در میکروبیولوژی هستند. این محیطها به گونهای طراحی شدهاند که حداکثر مواد مغذی مورد نیاز برای رشد میکروبها را فراهم کنند و امکان تکثیر سریع و گسترده جمعیت میکروبها را ایجاد نمایند. برخلاف محیطهای انتخابی و افتراقی که برای محدود کردن یا تمایز گونهها طراحی شدهاند، محیطهای غنی بیشتر به منظور فراهم کردن شرایط بهینه برای رشد عمومی و حمایت از میکروبهای با نیازهای پیچیده مورد استفاده قرار میگیرند.
ترکیبات و ویژگیهای محیطهای کشت غنی
محیطهای غنی معمولاً شامل مجموعهای از پروتئینها، کربوهیدراتها، ویتامینها، عناصر معدنی و منابع نیتروژنی هستند که میکروبها برای رشد به آنها نیاز دارند. منابع پروتئینی میتوانند به صورت عصاره گوشت، عصاره مخمر یا پپتونهای گیاهی و حیوانی ارائه شوند. این ترکیبات نه تنها اسیدهای آمینه و نیتروژن لازم را تأمین میکنند، بلکه ویتامینها و سایر عوامل رشد را نیز در اختیار میکروبها قرار میدهند.
کربوهیدراتها، به ویژه گلوکز و سایر قندهای ساده، منبع اصلی انرژی برای میکروبها هستند و رشد سریع را ممکن میسازند. همچنین، محیطهای غنی اغلب دارای عوامل بافرکننده هستند تا pH محیط را در محدوده مطلوب حفظ کنند، زیرا تغییرات اسیدی یا قلیایی میتواند رشد میکروبها را متوقف سازد یا باعث مرگ آنها شود.
کاربردهای محیطهای کشت غنی
یکی از مهمترین کاربردهای محیطهای غنی، پرورش میکروبهای سریع و آهسته رشد است. میکروبهای آهسته رشد که در محیط طبیعی خود ممکن است به سختی قابل مشاهده باشند، در این محیطها میتوانند رشد کنند و امکان مطالعه آنها فراهم شود. برای مثال، برخی از لاکتوباسیلها و باکتریهای تولیدکننده آنتیبیوتیکها در محیطهای غنی رشد مطلوب دارند و میتوانند به عنوان منابع صنعتی استفاده شوند.
در میکروبیولوژی بالینی، محیطهای غنی به عنوان محیط پایه برای کشت نمونههای بالینی مورد استفاده قرار میگیرند، زیرا این محیطها به میکروبهای موجود در نمونه اجازه میدهند بدون محدودیت رشد کنند و بنابراین شناسایی و بررسی دقیق آنها ممکن میشود. محیطهای غنی همچنین برای تکثیر اولیه میکروبهای غیرکشتپذیر یا حساس کاربرد دارند، به طوری که فراهم کردن مواد مغذی گسترده میتواند رشد آنها را تحریک کند.
مثالهای عملی محیطهای غنی
چندین محیط کشت شناخته شده به عنوان محیطهای غنی در میکروبیولوژی وجود دارند که هر کدام ویژگیها و کاربردهای خاص خود را دارند:
-
: LB Broth (Luria-Bertani Broth) یکی از پرکاربردترین محیطها در آزمایشگاههای تحقیقاتی، به ویژه برای رشد باکتریهای گرم منفی مانند E. coli. این محیط شامل پپتون، عصاره مخمر و نمک است و رشد سریع و متراکم باکتریها را فراهم میکند.
-
: TSB (Tryptic Soy Broth) محیطی غنی و چندمنظوره است که برای رشد باکتریهای گرم مثبت و منفی استفاده میشود. این محیط به دلیل توانایی پشتیبانی از طیف گستردهای از میکروبها، در میکروبیولوژی بالینی و تحقیقاتی بسیار محبوب است.
-
: BHI (Brain Heart Infusion) محیط بسیار غنی که حاوی عصاره مغز و قلب گاوی است. این محیط به ویژه برای میکروبهای سختکشت و میکروبهایی که به ترکیبات پیچیده نیاز دارند، مناسب است.
مزایا و محدودیتهای محیطهای کشت غنی
مزیت اصلی محیطهای غنی، توانایی آنها در حمایت از رشد سریع و فراوان میکروبها است. این ویژگی باعث میشود که تحقیقات پایه، تولید متابولیتها، و شناسایی میکروبها به شکل موثری انجام شود. همچنین، محیطهای غنی میتوانند رشد میکروبهای ضعیف و آهسته را ممکن کنند، که این امر در مطالعه میکروبهای غیرکشتپذیر یا حساس اهمیت دارد.
با این حال، محیطهای غنی دارای محدودیتهایی نیز هستند. از جمله اینکه این محیطها تمایز یا انتخاب گونههای خاص را فراهم نمیکنند و بنابراین در شناسایی گونهها و جداسازی آنها از نمونههای مخلوط، کارایی محدودی دارند. علاوه بر این، استفاده از محیطهای غنی میتواند رشد میکروبهای مزاحم یا غیر هدف را نیز تشویق کند و باعث پیچیدگی در تحلیل نتایج شود.
در نهایت، محیطهای غنی پایهای برای توسعه محیطهای تخصصیتر هستند. بسیاری از محیطهای انتخابی و افتراقی، پایه ترکیبات خود را از محیطهای غنی میگیرند و سپس با افزودن عوامل انتخابی یا نشانگرهای متابولیک، ویژگیهای اختصاصی خود را پیدا میکنند. به همین دلیل، شناخت کامل ترکیبات، کاربردها و محدودیتهای محیطهای غنی برای هر محقق و متخصص میکروبیولوژی ضروری است.
محیطهای کشت انتخابی (Selective Media)
محیطهای کشت انتخابی یکی از ابزارهای قدرتمند میکروبیولوژی برای جدا کردن گونههای خاص میکروبی از نمونههای پیچیده هستند. این محیطها به گونهای طراحی شدهاند که تنها رشد میکروبهای دارای ویژگیهای خاص را ممکن میسازند و سایر گونهها را محدود یا مهار میکنند. این ویژگی، محیطهای انتخابی را به یک ابزار کلیدی در میکروبیولوژی بالینی، صنعتی و تحقیقاتی تبدیل کرده است.
مکانیزم عملکرد محیطهای انتخابی
محیطهای انتخابی معمولاً شامل ترکیباتی هستند که رشد میکروبهای ناخواسته را مهار میکنند، در حالی که گونههای هدف قادر به رشد هستند. این ترکیبات میتوانند شامل آنتیبیوتیکها، رنگها، قندهای خاص، یونها یا سایر عوامل شیمیایی باشند. برای مثال، محیطی که حاوی نمک زیاد باشد، میتواند رشد باکتریهای حساس به فشار اسمزی را مهار کند و در عین حال باکتریهای مقاوم به نمک، مانند Staphylococcus aureus، رشد کنند.
یکی از اصول کلیدی محیطهای انتخابی، تعادل بین مهار میکروبهای ناخواسته و حمایت از رشد گونه هدف است. اگر غلظت عوامل مهارکننده بیش از حد باشد، حتی گونه هدف نیز ممکن است رشد نکند و اگر غلظت ناکافی باشد، میکروبهای غیر هدف رشد کرده و جداسازی دقیق دشوار میشود. بنابراین، طراحی محیطهای انتخابی نیازمند دقت بالا و آزمایشهای کنترلشده است.
ترکیبات و عوامل انتخابی رایج
محیطهای انتخابی از مواد پایه محیطهای غنی بهره میگیرند و سپس با افزودن عوامل خاص، ویژگی انتخابی خود را پیدا میکنند. از جمله ترکیبات رایج میتوان به موارد زیر اشاره کرد:
-
آنتیبیوتیکها : بسیاری از محیطهای انتخابی حاوی آنتیبیوتیکهایی مانند آمپیسیلین، نئومایسین یا کلرامفنیکل هستند که باکتریهای حساس را مهار میکنند و تنها باکتریهای مقاوم رشد میکنند. این روش در میکروبیولوژی تحقیقاتی و صنعتی برای انتخاب گونههای مهندسیشده کاربرد دارد.
-
نمک و عوامل اسمزی : محیطهای حاوی غلظت بالای نمک میتوانند رشد میکروبهای حساس به فشار اسمزی را محدود کنند و رشد گونههای مقاوم مانند میکروبهای پوست انسان را ممکن سازند.
-
قندها و مواد متابولیک خاص : بعضی محیطها شامل قندها یا مواد مغذی خاص هستند که تنها گونههای توانمند در استفاده از آنها میتوانند رشد کنند. این مکانیزم به ویژه در جداسازی باکتریهای رودهای و لاکتیک اسید باکتریها کاربرد دارد.
-
pH و عوامل شیمیایی : تغییر pH محیط یا افزودن ترکیبات شیمیایی خاص میتواند رشد میکروبهای ناخواسته را مهار کند و تنها میکروبهای مقاوم یا تطبیقیافته را قادر به رشد نماید.
کاربردهای محیطهای کشت انتخابی
محیطهای انتخابی در میکروبیولوژی بالینی نقش حیاتی دارند. برای مثال، در نمونههای بالینی حاوی میکروبهای متنوع، محیط انتخابی میتواند رشد عوامل بیماریزا مانند Salmonella، Shigella یا قارچهای خاص را تسهیل کند و میکروبهای غیر هدف را مهار نماید. این امر باعث افزایش سرعت تشخیص و کاهش احتمال خطا در شناسایی میشود.
در صنایع غذایی و دارویی، محیطهای انتخابی برای کنترل میکروبهای هدف و حذف آلودگیهای ناخواسته استفاده میشوند. به عنوان مثال، در تولید لبنیات، استفاده از محیط انتخابی مناسب میتواند رشد باکتریهای مفید لاکتیک اسید را ممکن کند و رشد میکروبهای مضر را محدود نماید.
در تحقیقات محیطی و صنعتی، محیطهای انتخابی امکان مطالعه میکروبهای خاص مانند میکروبهای الکترو اکتیو یا میکروبهای مقاوم به شرایط محیطی سخت را فراهم میکنند. این کاربردها به توسعه بیوتکنولوژی، تولید آنتیبیوتیکها و متابولیتهای صنعتی کمک میکنند.
مثالهای عملی محیطهای انتخابی
چند محیط کشت شناخته شده که به عنوان محیطهای انتخابی استفاده میشوند عبارتند از:
-
:MacConkey Agarمحیطی انتخابی برای باکتریهای گرم منفی و همزمان افتراقی بر اساس توانایی تخمیر لاکتوز. در این محیط، باکتریهای لاکتوز مثبت به رنگ صورتی دیده میشوند، در حالی که باکتریهای لاکتوز منفی بیرنگ باقی میمانند.
-
:Mannitol Salt Agarحاوی درصد بالای نمک است و برای رشد باکتریهای مقاوم به نمک مانند Staphylococcus aureus مناسب است. این محیط هم ویژگی انتخابی دارد و هم افتراقی بر اساس تخمیر مانیتول عمل میکند.
-
:Sabouraud Dextrose Agarمحیط انتخابی برای قارچها که رشد باکتریها را محدود میکند و به قارچها اجازه میدهد به طور اختصاصی رشد کنند.
مزایا و محدودیتهای محیطهای انتخابی
مزیت اصلی محیطهای انتخابی، توانایی جداسازی گونههای خاص از نمونههای پیچیده و افزایش دقت شناسایی میکروبها است. این محیطها نقش مهمی در تشخیص بالینی سریع، کنترل کیفیت صنعتی و مطالعات تحقیقاتی ایفا میکنند.
با این حال، محیطهای انتخابی محدودیتهایی نیز دارند. اگر ترکیبات انتخابی نامناسب یا بیش از حد قوی باشند، حتی گونه هدف ممکن است رشد نکند و نتیجه آزمایش تحت تأثیر قرار گیرد. همچنین، برخی میکروبها ممکن است توانایی مقاومت یا سازگاری با عوامل انتخابی را نداشته باشند و بنابراین در این محیطها قابل رشد نباشند. این محدودیتها باعث شده است که طراحی و استفاده از محیطهای انتخابی نیازمند دانش تخصصی و آزمایشهای کنترلشده باشد.
به طور کلی، محیطهای انتخابی، مکمل محیطهای غنی هستند و پایهای برای توسعه محیطهای افتراقی و تخصصی فراهم میکنند. شناخت دقیق ترکیبات، مکانیزم عملکرد و محدودیتهای این محیطها برای موفقیت در شناسایی و جداسازی میکروبها ضروری است و نقش مهمی در پیشرفت میکروبیولوژی بالینی و تحقیقاتی دارد.
محیطهای کشت افتراقی (Differential Media)
محیطهای کشت افتراقی یکی از ابزارهای اساسی در میکروبیولوژی هستند که به محققان امکان میدهند گونههای مختلف میکروبی را بر اساس ویژگیهای متابولیک یا بیوشیمیایی آنها تمایز دهند. در حالی که محیطهای انتخابی رشد میکروبهای ناخواسته را محدود میکنند، محیطهای افتراقی نشانگرهایی را ارائه میدهند که تغییرات ظاهری یا شیمیایی در سطح محیط ایجاد میکند و تفاوت بین گونهها را قابل مشاهده میسازد.
مکانیزم عملکرد محیطهای افتراقی
محیطهای افتراقی معمولاً حاوی ترکیبات خاصی هستند که توسط میکروبها متابولیزه میشوند و واکنشهای قابل مشاهدهای مانند تغییر رنگ، ایجاد رسوب یا شفافیت در محیط ایجاد میکنند. این واکنشها به محقق اجازه میدهند که گونههای مختلف را بدون نیاز به آزمونهای پیچیده بیوشیمیایی تشخیص دهند.
یکی از اصول کلیدی محیطهای افتراقی، استفاده از نشانگرهای متابولیک یا pH indicators است. برای مثال، محیطهایی که شامل قندهای تخمیرپذیر هستند، در صورت تخمیر توسط میکروب، اسید تولید میکنند و باعث تغییر رنگ نشانگر pH در محیط میشوند. این تغییر رنگ، تمایز بین گونههای توانمند در تخمیر قند و گونههای غیرتوانمند را ممکن میسازد.
ترکیبات رایج محیطهای افتراقی
محیطهای افتراقی معمولاً شامل ترکیبی از مواد مغذی پایه، نشانگرهای pH و ترکیبات متابولیکی هستند که واکنشهای اختصاصی گونهها را آشکار میکنند. برخی از ترکیبات رایج عبارتند از:
-
کربوهیدراتهای قابل تخمیر : مانند لاکتوز، مانیتول یا ساکارز، که توسط میکروبها متابولیزه میشوند و در نتیجه تولید اسید باعث تغییر رنگ محیط میگردد.
-
نمایانگرهای : pH مانند فنول رد یا بروم تیمول بلو که تغییرات اسیدی یا قلیایی را به صورت تغییر رنگ نشان میدهند.
-
مواد فیزیکی یا شیمیایی : که با فعالیت آنزیمی میکروبها تغییر میکنند، مانند تولید گاز یا رسوب در محیط.
کاربردهای محیطهای کشت افتراقی
محیطهای افتراقی در بسیاری از زمینهها کاربرد دارند، به ویژه در میکروبیولوژی بالینی برای تشخیص سریع و تمایز بین گونههای بیماریزا. برای مثال، در نمونههای رودهای، محیط EMB Agar میتواند باکتریهای گرم منفی تخمیرکننده لاکتوز را از باکتریهای غیر تخمیرکننده متمایز کند، و در نتیجه شناسایی عوامل بیماریزا مانند Escherichia coli یا Salmonella سادهتر میشود.
در صنایع غذایی، محیطهای افتراقی برای کنترل کیفیت و شناسایی آلودگیهای خاص استفاده میشوند. با استفاده از این محیطها، میتوان گونههای مضر را از باکتریهای مفید تمایز داد و محصولات غذایی ایمنتری تولید کرد.
در تحقیقات محیطی و صنعتی، محیطهای افتراقی امکان بررسی رفتار متابولیک میکروبها و شناسایی تولیدکنندگان متابولیتهای خاص مانند آنتیبیوتیکها یا سورفاکتانتها را فراهم میکنند. این کاربردها به توسعه بیوتکنولوژی و تولید صنعتی مواد میکروبی کمک میکنند.
مثالهای عملی محیطهای افتراقی
چند محیط کشت شناخته شده و پرکاربرد که به عنوان محیطهای افتراقی استفاده میشوند عبارتند از:
-
:Blood Agar محیطی غنی که توانایی همولیز باکتریها را نشان میدهد. باکتریهای همولیتیک موجب تجزیه گلبولهای قرمز شده و تغییر رنگ یا شفافیت در محیط ایجاد میکنند، که به تمایز بین گونهها کمک میکند.
-
: Eosin Methylene Blue (EMB) Agarبرای شناسایی باکتریهای گرم منفی و تمایز بین باکتریهای تخمیرکننده لاکتوز و غیر تخمیرکننده. گونههای تخمیرکننده لاکتوز اغلب کلونیهای رنگی فلورسانس ایجاد میکنند.
-
: Xylose Lysine Deoxycholate (XLD) Agar محیطی افتراقی برای شناسایی سالمونلا و شیگلا، که تغییرات رنگی و تولید گاز را بر اساس متابولیسم قندها نشان میدهد.
مزایا و محدودیتهای محیطهای کشت افتراقی
مزیت اصلی محیطهای افتراقی، توانایی شناسایی سریع و تمایز گونهها بدون نیاز به آزمایشهای بیوشیمیایی طولانی است. این محیطها باعث صرفهجویی در زمان و هزینه و افزایش دقت تشخیص میشوند.
با این حال، محدودیتهایی نیز وجود دارد. برخی میکروبها ممکن است توانایی واکنش به نشانگرها یا متابولیسم ترکیبات موجود در محیط را نداشته باشند، یا واکنشهای مشابه ممکن است توسط گونههای غیرهدف ایجاد شود، که منجر به اشتباه در تفسیر نتایج میشود. به همین دلیل، استفاده از محیطهای افتراقی نیازمند تجربه و دانش تخصصی است و اغلب با سایر روشها مانند محیطهای انتخابی و آزمونهای مولکولی ترکیب میشود تا دقت تشخیص افزایش یابد.
به طور کلی، محیطهای افتراقی مکمل محیطهای غنی و انتخابی هستند و نقش مهمی در شناسایی دقیق و سریع میکروبها دارند. آشنایی با ترکیبات، مکانیزم عملکرد و محدودیتهای این محیطها برای محققان و متخصصان میکروبیولوژی ضروری است و به آنها امکان میدهد نمونهها را به بهترین نحو تحلیل و نتایج قابل اعتماد ارائه دهند.
محیطهای تخصصی و پیشرفته
با پیشرفت علم میکروبیولوژی و گسترش کاربردهای صنعتی، بالینی و تحقیقاتی، نیاز به محیطهای کشت تخصصی و پیشرفته افزایش یافته است. این محیطها برای رشد میکروبهایی طراحی شدهاند که در شرایط محیطهای غنی، انتخابی یا افتراقی معمولی قادر به رشد نیستند. میکروبهای سختکشت، سلولهای حیوانی و میکروبهای الکترو اکتیو نمونههایی از این گروه هستند که نیازمند محیطهای خاص و شرایط کنترلشده هستند.
محیطهای کشت میکروبهای سختکشت
بسیاری از میکروبهای محیطی، بالینی و صنعتی به دلیل نیاز به ترکیبات پیچیده و حساسیت به شرایط محیطی، در محیطهای سنتی رشد نمیکنند. این میکروبها تحت عنوان “microbial dark matter” یا میکروبهای غیرقابل کشت کلاسیک شناخته میشوند. محیطهای تخصصی برای این گروه معمولاً شامل:
-
ترکیبات پیچیده تغذیهای: عصاره مخمر، پپتونهای گیاهی و حیوانی، اسیدهای آمینه آزاد و ویتامینها.
-
شرایط فیزیکی ویژه : دما، رطوبت، فشار اسمزی و pH دقیق و کنترلشده.
-
همراهی با دیگر میکروبها یا : co-culture در برخی موارد، میکروبهای سختکشت تنها در حضور گونههای دیگر قادر به رشد هستند، زیرا تعاملات متابولیک بین آنها ضروری است.
مطالعات نشان دادهاند که محیطهای تخصصی میتوانند باعث بازسازی میکروبهای محیطی و کشف گونههای جدید شوند، که این امر در توسعه داروها، آنتیبیوتیکها و بیوتکنولوژی صنعتی اهمیت دارد.
محیطهای کشت میکروبهای رودهای و لاکتیک اسید باکتریها
میکروبهای رودهای و لاکتیک اسید باکتریها، به ویژه در صنایع غذایی و پروبیوتیک، نیازمند محیطهای غنی و کنترلشده هستند. این محیطها معمولاً ترکیبی از قندهای تخمیرپذیر، مواد مغذی خاص و بافرهای مناسب برای حفظ pH هستند.
برای مثال:
-
MRS Agar و : MRS Broth محیطی غنی و تخصصی برای لاکتوباسیلها، که شامل عصاره مخمر، پپتون، گلوکز و عوامل بافر است و محیطی مناسب برای رشد و تولید متابولیتهای مفید ایجاد میکند.
-
: Bifidobacterium-selective Media محیطهای تخصصی برای انتخاب و رشد بیفیدوباکتریها که با افزودن عوامل مهارکننده باکتریهای ناخواسته و تامین ترکیبات ویژه، رشد گونههای هدف را تسهیل میکنند.
استفاده از این محیطها در تولید پروبیوتیکها، محصولات لبنی و تحقیقات مرتبط با میکروبیوتای روده ضروری است و باعث افزایش بازده و کیفیت محصولات میشود.
محیطهای کشت سلولهای حیوانی و بافتی
در زیستشناسی سلولی و بیوتکنولوژی، کشت سلولهای حیوانی یکی از ابزارهای اصلی است. محیطهای این نوع کشت باید تمامی نیازهای سلولی شامل منابع انرژی، اسیدهای آمینه، ویتامینها، یونها و فاکتورهای رشد را فراهم کنند.
-
DMEM (Dulbecco's Modified Eagle Medium) و : RPMI 1640 محیطهای استاندارد برای کشت سلولهای حیوانی و انسانی، که حاوی گلوکز، آمینو اسیدها، ویتامینها و بافرهای مناسب هستند.
-
: FBS (Fetal Bovine Serum) اغلب به عنوان افزودنی برای تامین فاکتورهای رشد و پروتئینهای ضروری استفاده میشود.
این محیطها باید در شرایط کاملاً استریل و با کنترل دما، CO2 و رطوبت نگهداری شوند تا سلولها سالم بمانند و رشد مطلوب داشته باشند.
محیطهای کشت میکروبهای الکترو اکتیو
میکروبهای الکترو اکتیو، که قادر به تبادل الکترون با الکترودها هستند، در بیوالکتروشیمی و بیوژنراتورها کاربرد دارند. رشد این میکروبها نیازمند شرایط تخصصی، منابع کربنی مناسب، یونهای معدنی و محیطهای الکتروشیمیایی کنترلشده است.
-
محیطهای غنی با منابع انرژی قابل اکسیداسیون : گلوکز، استات، لاکتات و سایر ترکیبات کربنی که الکترون آزاد میکنند.
-
کنترل شرایط الکتروشیمیایی : پتانسیل اکسایش-کاهش، pH و جریان الکتریکی که رشد و فعالیت الکتریکی میکروبها را بهینه میکند.
این محیطها در تحقیقاتی که به تولید بیوفیلمهای الکتریکی، میکروبهای سوختی و سیستمهای بیو الکتروشیمیایی مرتبط است، کاربرد دارند و امکان استفاده صنعتی از این میکروبها را فراهم میکنند.
مزایا و محدودیتهای محیطهای تخصصی و پیشرفته
مزیت اصلی محیطهای تخصصی، توانایی رشد میکروبها و سلولهایی است که در محیطهای استاندارد قابل کشت نیستند و امکان مطالعه، شناسایی و بهرهبرداری صنعتی از آنها را فراهم میکنند. این محیطها پایهای برای توسعه داروها، پروبیوتیکها، متابولیتهای صنعتی و فناوریهای نوین بیوتکنولوژیک هستند.
با این حال، محدودیتهایی نیز وجود دارد. محیطهای تخصصی معمولاً هزینه بالاتر، نیاز به کنترل دقیق شرایط و پیچیدگی آمادهسازی دارند و کار با آنها نیازمند دانش تخصصی است. همچنین، برخی میکروبها ممکن است نیاز به تعاملات پیچیده با سایر گونهها داشته باشند و تنها با کشت co-culture قابل رشد باشند.
به طور کلی، محیطهای تخصصی و پیشرفته مکمل محیطهای غنی، انتخابی و افتراقی هستند و امکان مطالعه جامع و دقیق میکروبها و سلولها را فراهم میآورند. آشنایی با ترکیبات، شرایط رشد، کاربردها و محدودیتهای این محیطها برای هر متخصص میکروبیولوژی و بیوتکنولوژی ضروری است.
چالشها و محدودیتهای روشهای کشت سنتی
با وجود اهمیت بالای محیطهای کشت در میکروبیولوژی، روشهای سنتی کشت میکروبی محدودیتها و چالشهای قابل توجهی دارند که بر دقت، سرعت و قابلیت استفاده آنها تأثیر میگذارد. این محدودیتها هم در زمینه تحقیقات پایه و هم در کاربردهای بالینی و صنعتی اهمیت دارند و باعث شدهاند محققان به دنبال توسعه روشهای نوین و مکمل باشند.
عدم توانایی کشت میکروبهای سختکشت و غیرقابل کشت
یکی از بزرگترین چالشهای روشهای سنتی، ناتوانی در پرورش تعداد زیادی از میکروبهای محیطی و بالینی است. بسیاری از گونهها به دلیل نیاز به ترکیبات تغذیهای خاص، شرایط فیزیکی و شیمیایی دقیق یا تعامل با سایر میکروبها، در محیطهای غنی، انتخابی یا افتراقی کلاسیک رشد نمیکنند. این محدودیت منجر به مفهوم معروف “microbial dark matter” شده است؛ یعنی بخش بزرگی از میکروبهای موجود در محیط طبیعی و نمونههای بالینی قابل کشت با روشهای سنتی نیستند.
این چالش تأثیر زیادی بر تحقیقات زیستمحیطی، شناسایی عوامل بیماریزا و توسعه داروهای جدید دارد، زیرا میکروبهای غیرقابل کشت ممکن است حاوی متابولیتهای مفید، آنتیبیوتیکها یا فاکتورهای رشد نوین باشند که کشف آنها بدون روشهای جایگزین ممکن نیست.
زمانبر بودن و نیاز به کار فیزیکی گسترده
روشهای سنتی کشت معمولاً زمانبر و نیازمند کار دقیق و مداوم هستند. برای رشد کامل میکروبها، بسته به گونه، ممکن است چند ساعت تا چند روز لازم باشد. در محیطهای بالینی، این تاخیر میتواند بر تشخیص سریع بیماریها و تصمیمگیری درمانی تأثیر بگذارد.
علاوه بر زمان رشد، مراحل آمادهسازی محیط، سترون کردن ابزار، انجام آزمایشهای متعدد و بررسی نتایج به صورت دستی، نیاز به دقت و نیروی انسانی ماهر دارد. این مسئله در مقیاس صنعتی یا مراکز تشخیصی پرجمعیت، چالشبرانگیز و پرهزینه است.
مشکلات در جداسازی و تشخیص دقیق میکروبها
روشهای سنتی ممکن است در جداسازی گونههای مشابه یا همزیست محدود باشند. در نمونههای پیچیده مانند مدفوع، خون یا مواد غذایی، میکروبها به صورت مجتمع رشد میکنند و ممکن است تشخیص و جداسازی دقیق گونه هدف دشوار شود.
علاوه بر این، برخی میکروبها واکنشهای مشابه در محیطهای انتخابی یا افتراقی نشان میدهند و این شباهتها میتواند منجر به تفسیر اشتباه نتایج شود. به همین دلیل، اغلب نیاز به آزمونهای مکمل بیوشیمیایی، مولکولی یا امیکروبیولوژی پیشرفته وجود دارد.
حساسیت به شرایط محیطی و خطاهای انسانی
روشهای سنتی حساس به شرایط دما، رطوبت، pH و کیفیت مواد اولیه هستند. کوچکترین تغییر در یکی از این پارامترها میتواند رشد میکروبها را مهار کرده یا نتایج را تغییر دهد. همچنین، خطاهای انسانی در آمادهسازی محیط، سترون کردن ابزار یا برداشت نمونه میتواند باعث آلودگی یا نتایج نادرست شود.
عدم توانایی در بررسی میکروبها در شرایط طبیعی خود
روشهای سنتی اغلب میکروبها را در محیط مصنوعی رشد میدهند که ممکن است با شرایط طبیعی زیستگاه آنها تفاوت داشته باشد. این مسئله باعث میشود که برخی ویژگیهای متابولیک، رفتاری یا پاسخ به محیط توسط میکروبها در آزمایشگاه به درستی مشاهده نشود. به عنوان مثال، تولید متابولیتهای ثانویه، تعامل با دیگر میکروبها یا پاسخ به تنشهای محیطی ممکن است در محیط کشت سنتی متفاوت باشد.
محدودیت در تشخیص سریع و فوری
روشهای سنتی، علیرغم دقت، در زمینه تشخیص سریع بیماریها یا آلودگیها محدودیت دارند. رشد کامل کلونیها و مشاهده تغییرات رنگ یا شکل ممکن است ساعتها یا روزها طول بکشد. در برخی شرایط بالینی، این تأخیر میتواند بر درمان فوری بیماران تأثیرگذار باشد و نیاز به روشهای سریع جایگزین مانند PCR، تکنیکهای مولتیاومیکس و سنجشهای بیوشیمیایی سریع را ایجاد میکند.
هزینههای بالای آمادهسازی و نگهداری محیطها
تهیه محیطهای غنی، انتخابی یا افتراقی، به ویژه محیطهای تخصصی، هزینه بالایی دارد. نگهداری محیطها در شرایط استریل و کنترلشده نیز مستلزم تجهیزات پیشرفته و نیروی متخصص است. در مقیاس صنعتی یا مراکز تشخیصی بزرگ، این هزینهها میتواند به چالش اقتصادی تبدیل شود.
جمعبندی چالشها
به طور کلی، روشهای سنتی کشت میکروبی با وجود اهمیت بالای خود، دارای محدودیتهایی در سرعت، دقت، توانایی کشت میکروبهای سختکشت، حساسیت به شرایط محیطی و هزینهها هستند. این محدودیتها باعث شدهاند که روشهای نوین مولکولی، محیطهای پیشرفته و تکنیکهای تکثیر جایگزین به طور مکمل و گاهی جایگزین روشهای سنتی استفاده شوند تا مشکلات یادشده رفع گردد.
شناخت دقیق این چالشها برای هر متخصص میکروبیولوژی، پژوهشگر محیطی یا صنعتی ضروری است تا بتواند روش مناسب برای نمونه مورد نظر را انتخاب کرده و نتایج قابل اعتماد به دست آورد.
روشهای نوین و جایگزینها در کشت میکروبی
با وجود اهمیت روشهای سنتی کشت میکروبی، محدودیتهای این روشها باعث شده است که محققان و متخصصان به دنبال توسعه تکنیکهای نوین و جایگزینهایی برای افزایش سرعت، دقت و توانایی کشت میکروبها باشند. این رویکردها نه تنها مشکلات روشهای سنتی را کاهش میدهند بلکه امکان شناسایی میکروبهای سختکشت و کشف گونههای جدید را نیز فراهم میکنند.
کشت مبتنی بر میکروفلوئیدیک و سیستمهای میکروبی شبیهسازی شده
یکی از روشهای نوین، استفاده از تکنولوژی میکروفلوئیدیک است که امکان ایجاد محیطهای کوچک و کنترلشده برای رشد میکروبها را فراهم میکند. در این سیستمها:
-
جریان مایعات، ترکیبات غذایی و عوامل شیمیایی به دقت کنترل میشوند،
-
محیطها در مقیاس میکرو یا نانو طراحی میشوند تا تجارب رشد مشابه زیستگاه طبیعی میکروبها فراهم شود،
-
امکان بررسی چندین پارامتر همزمان وجود دارد و رشد میکروبها در شرایط متفاوت قابل مشاهده است.
این روشها به ویژه برای میکروبهای محیطی و میکروبهایی که نیاز به تعامل با گونههای دیگر دارند، اهمیت دارند و میتوانند رشد گونههای غیرقابل کشت سنتی را ممکن سازند.
روشهای co-culture و تعامل میکروبی
مطالعات نشان دادهاند که بسیاری از میکروبهای محیطی و سختکشت، تنها در حضور گونههای دیگر قادر به رشد هستند. روشهای co-culture به محققان امکان میدهند که میکروبها را در همزیستی کنترلشده کشت دهند و از متابولیتها و سیگنالهای شیمیایی دیگر میکروبها بهرهمند شوند.
این رویکرد باعث افزایش توانایی شناسایی گونههای جدید و مطالعه تعاملات متابولیک میشود و در حوزه کشف داروها و متابولیتهای صنعتی کاربردهای فراوان دارد.
تکنیکهای مولتیاومیکس و جایگزینی کشت سنتی
تکنیکهای مولتیاومیکس شامل متاژنومیکس، متاترانسکریپتومیکس، متاپروتئومیکس و متابولومیکس هستند و امکان بررسی میکروبها بدون نیاز به کشت مستقیم را فراهم میکنند. این تکنیکها مزایای زیر را دارند:
-
شناسایی میکروبهای غیرقابل کشت،
-
بررسی فعالیت متابولیک و ژنتیکی در محیط طبیعی،
-
کشف گونههای جدید و مسیرهای متابولیک نوین.
به کمک مولتیاومیکس، محققان میتوانند ترکیبات محیطی و شرایط مناسب برای کشت هدفمند میکروبها را پیشبینی کرده و محیطهای تخصصی طراحی کنند. این روشها مکمل محیطهای سنتی هستند و دقت و سرعت شناسایی را افزایش میدهند.
تکنیکهای تشخیص سریع و سنجش مستقیم
برای افزایش سرعت و کاهش وابستگی به رشد کامل کلونیها، تکنیکهای نوین شامل PCR، LAMP، فلوسایتومتری و روشهای ایمیونولوژیک استفاده میشوند. این روشها امکان تشخیص سریع میکروبها و حتی تعیین ویژگیهای متابولیک یا مقاومت به آنتیبیوتیکها را فراهم میکنند.
این تکنیکها علاوه بر سرعت، دقت بالایی دارند و میتوانند در نمونههای پیچیده با تعداد بالای گونهها استفاده شوند. ترکیب این روشها با محیطهای افتراقی و انتخابی، کارایی تشخیص میکروبها را به طرز قابل توجهی افزایش میدهد.
محیطهای کشت هوشمند و شبیهساز زیستگاه طبیعی
توسعه محیطهای هوشمند شامل محیطهای شبیهساز زیستگاه طبیعی، افزودنیهای سیگنالدهنده و کنترل شرایط فیزیکی دقیق است. این محیطها به میکروبها اجازه میدهند که در شرایطی مشابه محیط طبیعی خود رشد کنند و ویژگیهای واقعی متابولیک و رفتاری آنها حفظ شود.
به عنوان مثال، محیطهایی برای میکروبهای الکترو اکتیو طراحی شدهاند که پتانسیل اکسایش-کاهش، جریان الکتریکی و منابع انرژی مناسب را فراهم میکنند و فعالیت الکتریکی طبیعی میکروبها را حفظ مینمایند.
مزایا و محدودیتهای روشهای نوین
مزایای روشهای نوین و جایگزینها شامل:
-
توانایی کشت میکروبهای سختکشت و غیرقابل کشت،
-
تشخیص سریع و دقیق میکروبها،
-
کاهش وابستگی به محیطهای غنی و سنتی،
-
امکان مطالعه رفتار طبیعی و تعاملات میکروبها،
-
کشف گونههای جدید و متابولیتهای کاربردی.
با این حال، محدودیتهایی نیز وجود دارد:
-
نیاز به تجهیزات پیشرفته و تخصصی،
-
هزینههای بالای آمادهسازی و اجرای آزمایشها،
-
پیچیدگی روشها و نیاز به دانش مولتیدیسپلینری.
به طور کلی، روشهای نوین و جایگزینها مکمل روشهای سنتی کشت هستند و با ترکیب این دو رویکرد، میتوان یک تصویر جامع، دقیق و کاربردی از جامعه میکروبی نمونهها ارائه داد. این رویکردها به ویژه در میکروبیولوژی بالینی، صنعتی، محیطی و تحقیقاتی اهمیت دارند و امکان توسعه داروها، پروبیوتیکها و فناوریهای بیوتکنولوژیک را فراهم میکنند.
راهنمای عملی برای متخصصان میکروبیولوژی
برای متخصصان میکروبیولوژی، موفقیت در کشت میکروبها تنها به شناخت نظری محیطها و روشهای کشت محدود نمیشود، بلکه توانایی اجرای عملی، رعایت اصول ایمنی و انتخاب محیط مناسب نقش کلیدی در دستیابی به نتایج دقیق و قابل اعتماد دارد. این بخش به بررسی نکات عملی و توصیههای تخصصی میپردازد که در فعالیتهای روزمره آزمایشگاهی اهمیت دارند.
انتخاب محیط مناسب برای میکروب مورد نظر
یکی از مهمترین مراحل در کشت میکروبی، انتخاب محیط مناسب است. متخصصان باید پیش از آغاز کار، نوع میکروب، ویژگیهای متابولیک، شرایط رشد و هدف آزمایش را بررسی کنند:
-
برای رشد سریع و کلی اکثر باکتریها، محیطهای غنی و عمومی مانند Nutrient Agar یا Tryptic Soy Agar مناسب هستند.
-
در صورت نیاز به تمایز بین گونهها، محیطهای افتراقی مانند Blood Agar یا EMB Agar توصیه میشوند.
-
برای انتخاب و رشد گونههای خاص یا سختکشت، محیطهای تخصصی یا پیشرفته طراحی شده برای آن گروه باید استفاده شود.
انتخاب دقیق محیط نه تنها باعث رشد بهینه میکروبها میشود بلکه از اتلاف وقت و منابع جلوگیری میکند.
رعایت اصول ایمنی زیستی و سترونسازی
کار با میکروبها نیازمند رعایت استانداردهای ایمنی زیستی (Biosafety) است تا از آلودگی نمونهها و خطرات برای کارکنان جلوگیری شود:
-
همیشه از جعبه لامینار، دستکش و روپوش آزمایشگاهی استفاده کنید.
-
ابزار و محیطهای کشت قبل و بعد از استفاده باید استریل شوند.
-
نمونهها و محیطهای آلوده باید مطابق با روشهای دفع ایمن زیستی دفع شوند.
-
به ویژه در کار با میکروبهای بیماریزا، رعایت سطح BSL مناسب الزامی است.
رعایت دقیق این اصول تضمین میکند که محیط آزمایشگاه پاک و ایمن باقی بماند و نتایج حاصل قابل اعتماد باشند.
کنترل شرایط رشد و پارامترهای محیطی
یکی از عوامل کلیدی در موفقیت کشت میکروبها، کنترل دقیق شرایط رشد است:
-
دمای مناسب: بسیاری از باکتریها در دمای 37 درجه سانتیگراد رشد مطلوب دارند، در حالی که میکروبهای محیطی ممکن است نیاز به دماهای پایینتر یا بالاتر داشته باشند.
-
pH محیط: برای جلوگیری از توقف رشد، pH محیط باید متناسب با گونه میکروبی تنظیم شود.
-
رطوبت و آلودگی: حفظ رطوبت مناسب و جلوگیری از آلودگی محیط با میکروبهای ناخواسته اهمیت بالایی دارد.
کنترل این پارامترها به ویژه در کشت میکروبهای سختکشت، سلولهای حیوانی و میکروبهای الکترو اکتیو بسیار حیاتی است.
تکنیکهای جداسازی و تصفیه نمونه
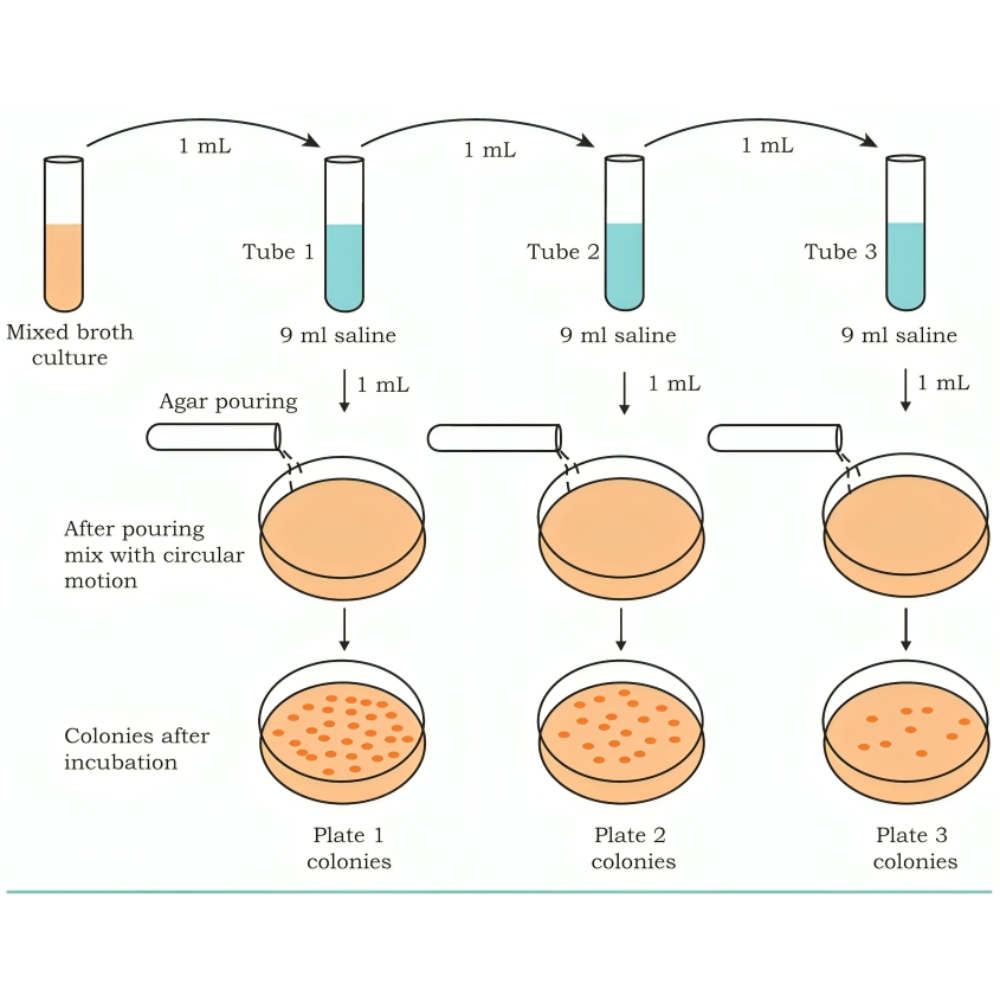
برای اطمینان از دقت نتایج، متخصصان باید روشهای جداسازی مناسب را به کار گیرند:
-
استفاده از استریک پلیتینگ (Streak Plating) برای جداسازی کلونیهای خالص،
-
تکنیکهای dilution و spread plating برای شمارش میکروبها و ارزیابی تراکم،
-
استفاده از محیطهای انتخابی و افتراقی برای حذف گونههای ناخواسته و تمایز بین کلونیها.
اجرای دقیق این تکنیکها باعث میشود نمونهها خالص و قابل تحلیل باقی بمانند.
ثبت دادهها و تحلیل نتایج
یکی از نکات مهم در کار عملی، ثبت دقیق دادهها و مستندسازی مراحل آزمایش است:
-
یادداشتبرداری از نوع محیط، ترکیبات، شرایط رشد و زمانهای برداشت،
-
ثبت تغییرات رنگ، شکل کلونی و واکنشهای متابولیک،
-
استفاده از نرمافزارهای مدیریت دادهها برای مقایسه نتایج و تحلیل آماری.
این کار به محققان امکان میدهد نتایج قابل اعتماد و قابل بازتولید ارائه دهند و از خطاهای انسانی جلوگیری کنند.
ترکیب روشهای سنتی و نوین برای افزایش دقت
متخصصان باید از ترکیب روشهای سنتی و نوین بهره ببرند:
-
استفاده از محیطهای غنی، انتخابی و افتراقی برای رشد و تمایز میکروبها،
-
استفاده از تکنیکهای PCR، مولتیاومیکس و روشهای تشخیص سریع برای تایید هویت گونهها،
-
بهکارگیری محیطهای تخصصی برای میکروبهای سختکشت و سلولهای حیوانی.
این رویکرد ترکیبی باعث افزایش دقت، سرعت و قابلیت شناسایی میکروبها میشود و به متخصصان امکان میدهد تصویر جامع و دقیقی از جامعه میکروبی نمونهها به دست آورند.
نکات کلیدی برای موفقیت عملی
-
همیشه محیط مناسب را بر اساس هدف و نوع میکروب انتخاب کنید.
-
رعایت اصول ایمنی زیستی و سترونسازی را جدی بگیرید.
-
کنترل دقیق دما، pH، رطوبت و سایر پارامترهای رشد را فراموش نکنید.
-
از تکنیکهای جداسازی دقیق برای حفظ خلوص نمونه استفاده کنید.
-
دادهها را به دقت ثبت کرده و تحلیل کنید.
-
روشهای سنتی و نوین را به صورت مکمل استفاده کنید تا دقت و سرعت افزایش یابد.
با رعایت این اصول، متخصصان میتوانند بهترین نتیجه ممکن از کشت میکروبها به دست آورند، نمونهها را به درستی شناسایی کنند و خطرات زیستی و خطاهای آزمایشگاهی را به حداقل برسانند.
جمعبندی و چشمانداز آینده در کشت میکروبی
در طول این مقاله، به بررسی جامع روشهای کشت میکروبی، محیطهای غنی، انتخابی و افتراقی، محیطهای تخصصی و پیشرفته، چالشها و محدودیتها و روشهای نوین و جایگزینها پرداخته شد. از آنچه که در این مقاله بیان شد، چند نکته کلیدی بهطور واضح مشخص است:
اهمیت کشت میکروبی در تحقیقات و کاربردهای صنعتی و بالینی
کشت میکروبی، پایه و اساس تشخیص میکروبها، مطالعه رفتار و متابولیسم آنها و توسعه محصولات بیوتکنولوژیک است. محیطهای کشت متنوع، از محیطهای غنی تا محیطهای تخصصی، امکان رشد و شناسایی گونههای مختلف را فراهم میکنند و هر یک مزایا و محدودیتهای خاص خود را دارند. متخصصان با درک دقیق این محیطها میتوانند نتایج قابل اعتماد و کاربردی به دست آورند.
چالشها و محدودیتهای روشهای سنتی و ضرورت نوآوری
روشهای سنتی کشت میکروبی، با وجود قدمت و دقت، دارای محدودیتهایی هستند که شامل ناتوانی در کشت میکروبهای سختکشت، زمانبر بودن، حساسیت به شرایط محیطی، مشکلات جداسازی و هزینههای بالا میشوند. این محدودیتها ضرورت توسعه روشهای نوین، محیطهای پیشرفته و تکنیکهای جایگزین را روشن میکنند.
روشهای نوین و رویکردهای مولتیاومیکس
استفاده از تکنولوژی میکروفلوئیدیک، co-culture، محیطهای هوشمند و مولتیاومیکس امکان مطالعه میکروبها در شرایط نزدیک به محیط طبیعی را فراهم کرده است. این رویکردها:
-
میتوانند میکروبهای سختکشت و غیرقابل کشت را شناسایی کنند،
-
تشخیص سریع و دقیق را ممکن میسازند،
-
امکان کشف گونههای جدید و متابولیتهای کاربردی را فراهم میآورند،
-
به طراحی محیطهای کشت هدفمند و بهینه کمک میکنند.
به کمک این تکنیکها، میتوان ترکیب محیطهای سنتی و پیشرفته را به گونهای به کار گرفت که نتایج دقیق، قابل بازتولید و سریع به دست آید.
راهنمای عملی برای متخصصان و اهمیت ترکیب دانش و تجربه
یکی از نتایج مهم این مقاله، ضرورت ترکیب دانش تئوری، تجربه عملی و استفاده از روشهای نوین است. متخصصان باید با رعایت اصول ایمنی، انتخاب محیط مناسب، کنترل شرایط رشد، ثبت دادهها و استفاده از روشهای مکمل، تصویر جامع و دقیقی از جامعه میکروبی نمونهها به دست آورند. این راهکارها علاوه بر افزایش دقت، امنیت آزمایشگاه و کیفیت نتایج را تضمین میکنند.
چشمانداز آینده در کشت میکروبی
چشمانداز آینده کشت میکروبی بر پایه ادغام روشهای سنتی و نوین، استفاده از محیطهای هوشمند و توسعه تکنیکهای مولتیاومیکس قرار دارد. برخی روندهای کلیدی که میتوانند آینده این حوزه را شکل دهند عبارتند از:
-
کشف و مطالعه میکروبهای غیرقابل کشت و محیطهای متنوع زیستمحیطی،
-
توسعه محیطهای شبیهساز طبیعی و هوشمند برای حفظ رفتار و متابولیسم واقعی میکروبها،
-
ادغام ابزارهای تشخیص سریع و روشهای مولکولی با محیطهای کشت سنتی،
-
کاهش هزینهها و زمان انجام آزمایشها با اتوماسیون و فناوریهای میکروفلوئیدیک،
-
استفاده از دادههای مولتیاومیکس برای طراحی محیطهای کشت هدفمند و بهینه،
-
افزایش کاربردهای صنعتی و بالینی، از جمله تولید پروبیوتیکها، متابولیتهای صنعتی، داروها و سیستمهای بیوالکتروشیمیایی.
با توجه به روندهای ذکر شده، کشت میکروبی نه تنها همچنان یک ابزار اساسی در میکروبیولوژی است، بلکه با توسعه فناوریهای نوین به یک حوزه پویا و چندبعدی تبدیل شده است که میتواند فرصتهای جدیدی در تحقیقات زیستمحیطی، بالینی و صنعتی ایجاد کند.
نتیجهگیری نهایی
به طور خلاصه، کشت میکروبی یک رشته علمی پیچیده، چندوجهی و کاربردی است که با شناخت دقیق محیطها، رعایت اصول عملی، ترکیب روشهای سنتی و نوین و بهرهگیری از تکنیکهای مولتیاومیکس، میتواند:
-
رشد میکروبهای سختکشت و غیرقابل کشت را ممکن سازد،
-
تشخیص سریع و دقیق میکروبها را تضمین کند،
-
تعاملات میکروبی و رفتار طبیعی آنها را آشکار سازد،
-
زمینهساز توسعه داروها، پروبیوتیکها، محصولات صنعتی و فناوریهای نوین بیوتکنولوژیک شود.
با ادامه تحقیقات و توسعه فناوریهای پیشرفته، آینده کشت میکروبی روشن، پویا و پر از فرصتهای نوین خواهد بود و متخصصان با بهرهگیری از این دانش میتوانند دستاوردهای مهمی در حوزههای علمی، صنعتی و بالینی حاصل کنند.