ELISA چیست و چگونه کار میکند؟
مقدمه
ELISA (Enzyme-Linked Immunosorbent Assay)، که به فارسی معمولاً «آزمایش ایمنیسنجی متصل به آنزیم» نامیده میشود، یکی از قدرتمندترین و پرکاربردترین روشهای تشخیصی و تحقیقاتی در علوم پزشکی، بیوشیمی، داروسازی و علوم زیستی است. این روش به دلیل دقت بالا، حساسیت قابل توجه و قابلیت کمیسازی مقادیر بسیار کم آنتیژنها و آنتیبادیها، به سرعت جایگاه خود را در آزمایشگاههای بالینی و تحقیقاتی تثبیت کرده است. ELISA به متخصصان و پژوهشگران امکان میدهد تا با استفاده از یک واکنش ساده اما دقیق، سطح ایمنی یا حضور مولکولهای خاص در نمونههای زیستی را تعیین کنند، که این ویژگی در تشخیص زودهنگام بیماریها، پایش پاسخهای ایمنی و بررسی کارایی داروها حیاتی است.
تاریخچه و تکامل روش ELISA
روش ELISA نخستین بار در دهه ۱۹۷۰ میلادی معرفی شد و با گذشت زمان، به یکی از استانداردهای طلایی در آزمایشگاهها تبدیل گردید. قبل از ظهور ELISA، بسیاری از روشهای تشخیصی متکی بر تستهای آگلوتیناسیون یا رسوب بودند که اغلب از حساسیت و دقت کافی برخوردار نبودند و نیازمند حجم نمونه زیاد و زمان طولانی بودند. ظهور ELISA این محدودیتها را به طور چشمگیری کاهش داد و امکان سنجش مقادیر بسیار کم پروتئینها، هورمونها، آنتیبادیها و دیگر مولکولهای زیستی را فراهم کرد. مزیت اصلی ELISA در قابلیت کمیسازی دقیق و قابل اعتماد آن است، که آن را از بسیاری از تکنیکهای پیشین متمایز میکند.
با گذشت سالها، تکنولوژی ELISA به مرور توسعه یافته و تغییرات متعددی در طراحی آن ایجاد شده است. از نسخههای اولیه که تنها امکان تشخیص حضور یا عدم حضور آنتیژن را داشتند، اکنون به روشهای چندگانه و فوق حساس (Multiplex و Ultrasensitive ELISA) رسیدهایم که میتوانند چندین هدف را همزمان در یک نمونه اندازهگیری کنند و اطلاعات گستردهای از وضعیت بیولوژیکی بیمار یا نمونه ارائه دهند. این پیشرفتها موجب شده است که ELISA در عرصههای متنوعی از جمله تشخیص بیماریهای عفونی، پایش پاسخهای ایمنی، بررسی بیماریهای خودایمنی، و حتی تحقیقات دارویی و محیطزیستی مورد استفاده قرار گیرد.
اهمیت ELISA در علوم پزشکی و تحقیقاتی
یکی از دلایل اصلی محبوبیت ELISA، توانایی آن در ارائه دادههای دقیق، تکرارپذیر و قابل استانداردسازی است. در بسیاری از بیماریها، تشخیص زودهنگام و پایش سطح آنتیبادیها یا پروتئینهای مشخص میتواند تفاوت بین بهبود سریع بیمار و پیشرفت بیماری را رقم بزند. به عنوان مثال، در بیماریهای عفونی مانند سرخک، هاری یا کرونا، سنجش سطح آنتیبادیها با ELISA به متخصصان امکان میدهد تا وضعیت ایمنی فرد را ارزیابی کرده و تصمیمات درمانی یا پیشگیری مناسبی اتخاذ کنند. همچنین، در زمینه بیماریهای خودایمنی و التهابی، ELISA به شناسایی آنتیبادیهای خودی و مارکرهای التهابی کمک میکند و در نتیجه مسیر درمان و مدیریت بیماریها را بهبود میبخشد.
علاوه بر کاربردهای بالینی، ELISA نقش بسیار مهمی در تحقیقات علمی دارد. پژوهشگران میتوانند با استفاده از این تکنیک، پروتئینها و مولکولهای زیستی را به دقت شناسایی و کمیسازی کنند، عملکرد داروهای جدید را ارزیابی کنند و حتی تغییرات زیستمحیطی یا اثرات مواد شیمیایی را بر سیستمهای بیولوژیکی بررسی نمایند. این ویژگیها موجب شده است که ELISA به عنوان یک ابزار پایه در مطالعات دارویی، تحقیقات زیستمحیطی و بررسی مکانیسمهای مولکولی به کار گرفته شود.
هدف مقاله و اهمیت آن برای مخاطب
هدف از نگارش این مقاله، ارائه مروری جامع و کامل بر روش ELISA، اصول عملکرد، انواع مختلف آن، کاربردهای بالینی و تحقیقاتی، پیشرفتهای مدرن و محدودیتها است. این مقاله به گونهای طراحی شده است که بتواند پرسشهای تخصصی و فنی هر مخاطب، از محقق گرفته تا پزشک و دانشجوی علوم پزشکی، را پاسخ دهد. همچنین با تمرکز بر بهینهسازی سئو و ساختار مناسب برای وبسایت، تلاش شده است تا خوانندگان از تمام سطوح تخصصی بتوانند به راحتی مفاهیم پیچیده ELISA را درک کنند و کاربردهای عملی آن را در زمینههای مختلف مشاهده نمایند.
نتیجهگیری مقدماتی
در مجموع، ELISA به دلیل دقت، حساسیت و قابلیت کمیسازی آن، یکی از ستونهای اصلی تشخیص آزمایشگاهی و تحقیقات بیولوژیک محسوب میشود. تاریخچه طولانی و تحولات مستمر این روش نشاندهنده اهمیت آن در علم و پزشکی مدرن است. در ادامه این مقاله، به بررسی دقیق اصول عملکرد ELISA، انواع روشها، پیشرفتهای تکنیکی، کاربردهای بالینی و تحقیقاتی، مزایا و محدودیتها، و نکات فنی برای بهینهسازی عملکرد این تکنیک پرداخته خواهد شد تا تصویر جامع و کاملی از این ابزار کلیدی ارائه گردد.
اصول و مبانی روش ELISA
ELISA، یا آزمایش ایمنیسنجی متصل به آنزیم، بر پایه تعاملات خاص بین آنتیبادیها و آنتیژنها شکل گرفته است. این روش، ترکیبی هوشمندانه از بیوشیمی آنزیمی و ایمنیشناسی مولکولی است که امکان تشخیص و کمیسازی دقیق مولکولهای زیستی را فراهم میکند. اساس ELISA بر تشخیص واکنشهای اختصاصی بین یک آنتیبادی و آنتیژن هدف استوار است، به طوری که تنها مولکولی که از نظر ساختاری با آنتیبادی مکمل است، شناسایی و سنجش میشود. این ویژگی باعث میشود که ELISA از حساسیت و اختصاصیت بالایی برخوردار باشد، که در مقایسه با بسیاری از روشهای سنتی تشخیصی مزیت قابل توجهی ایجاد میکند.
ساختار و عملکرد پایهای آنزیمها در ELISA
در ELISA، آنزیمها نقش واسطه تبدیل سیگنال بیولوژیک به سیگنال قابل اندازهگیری را ایفا میکنند. به طور معمول، یک آنزیم به آنتیبادی متصل میشود و پس از اتصال به آنتیژن، با افزودن سوبسترا واکنش شیمیایی انجام میدهد که منجر به تغییر رنگ، تولید نور یا سیگنال فلورسانس میشود. شدت این سیگنال با مقدار آنتیژن موجود در نمونه رابطه مستقیم دارد و میتوان با استفاده از استانداردهای کمی، غلظت واقعی مولکول مورد نظر را تعیین کرد. از جمله آنزیمهای رایج در ELISA میتوان به هورسرادیش پراکسیداز (HRP) و آلکالاین فسفاتاز (AP) اشاره کرد که به دلیل فعالیت بالا و پایداری شیمیایی، کاربرد گستردهای دارند.
آنتیبادیها و آنتیژنها: نقش و مکانیزم
آنتیبادیها، پروتئینهای تخصصی سیستم ایمنی هستند که به طور اختصاصی به یک اپیتوپ مشخص روی آنتیژن متصل میشوند. این ویژگی باعث ایجاد ویژگی اختصاصیت بسیار بالا در ELISA میشود. آنتیژنها، مولکولهای هدف در نمونه زیستی، میتوانند پروتئینها، هورمونها، پاتوژنها یا حتی مواد شیمیایی خاص باشند. زمانی که آنتیبادی به آنتیژن متصل میشود، موقعیت مناسبی برای آنزیم فراهم میشود تا با سوبسترا واکنش دهد و سیگنال قابل اندازهگیری ایجاد شود. این مکانیسم، اساس کار ELISA را شکل میدهد و به پژوهشگر امکان میدهد که حتی مقادیر بسیار کم مولکولها را تشخیص دهد.
انواع واکنشهای رنگی و شیمیایی
یکی از ویژگیهای مهم ELISA، استفاده از سیستمهای آنزیمی و سوبستراهای رنگی یا فلورسانس است که تغییرات آنها قابل مشاهده و اندازهگیری است. در روشهای کلاسیک، با افزودن سوبسترا به محلول، تغییر رنگ رخ میدهد که میتواند به صورت بصری یا با دستگاه اسپکتروفتومتر اندازهگیری شود. در تکنیکهای پیشرفته، از سیگنالهای شیمیلومینسانس یا فلورسانس استفاده میشود که حساسیت را تا چندین برابر افزایش میدهد و امکان تشخیص مولکولها در غلظتهای پیکوگرمی یا حتی کمتر را فراهم میکند. شدت سیگنال ایجاد شده نه تنها حضور آنتیژن را تایید میکند، بلکه به پژوهشگر امکان تعیین دقیق غلظت آن را نیز میدهد.
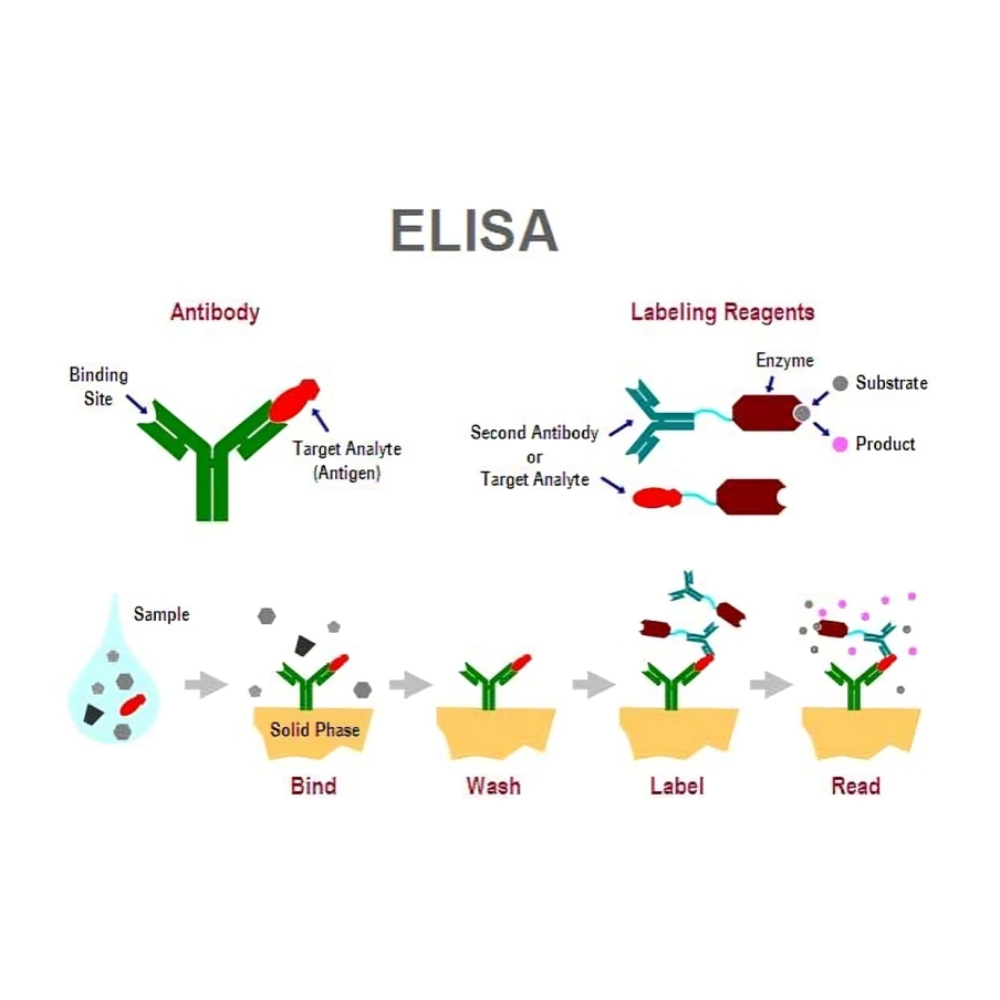
مکانیزم پایه عملکرد ELISA
به طور کلی، ELISA بر پایه چهار مرحله اصلی عمل میکند:
-
پوششدهی سطح با آنتیژن یا آنتیبادی : در این مرحله، آنتیژن یا آنتیبادی به سطح جامد (مانند چاهکهای پلاستیکی) متصل میشود و پایهای برای واکنش فراهم میکند.
-
مسدودسازی سطح : برای جلوگیری از اتصال غیر اختصاصی مولکولها به سطح، از محلولهای مسدودکننده استفاده میشود. این مرحله دقت و اختصاصیت ELISA را افزایش میدهد.
-
واکنش اختصاصی بین آنتیبادی و آنتیژن : نمونه به چاهکها اضافه میشود و مولکول هدف با آنتیبادی یا آنتیژن متصل شده واکنش اختصاصی انجام میدهد.
-
تولید سیگنال : با افزودن سوبسترا به آنزیم متصل به آنتیبادی، واکنش شیمیایی رخ میدهد و سیگنال قابل اندازهگیری تولید میشود که شدت آن با غلظت مولکول هدف در نمونه رابطه مستقیم دارد.
این چهار مرحله ساده، پایه و اساس همه انواع ELISA را تشکیل میدهند و انعطافپذیری این روش به پژوهشگر امکان میدهد تا بسته به نیاز خود، طراحیهای متنوعی را برای تشخیص و کمیسازی مولکولها به کار گیرد.
اهمیت اختصاصیت و حساسیت در ELISA
یکی از نکات کلیدی در ELISA، تعادل بین اختصاصیت و حساسیت است. اختصاصیت به توانایی روش برای تشخیص دقیق مولکول هدف بدون تداخل مولکولهای مشابه اشاره دارد و حساسیت، توانایی تشخیص مقادیر بسیار کم مولکولها را مشخص میکند. با انتخاب آنتیبادیهای مناسب، استفاده از کنترلهای کیفی و بهینهسازی شرایط واکنش، پژوهشگر میتواند دقت و قابلیت تکرارپذیری ELISA را به حداکثر برساند. این ویژگیها موجب شده است که ELISA به یک ابزار مطمئن برای تشخیصهای بالینی و مطالعات تحقیقاتی تبدیل شود.
نتیجهگیری بخش اصول و مبانی
در مجموع، ELISA ترکیبی هوشمندانه از اصول ایمنیشناسی و بیوشیمی آنزیمی است که امکان تشخیص اختصاصی و کمیسازی دقیق مولکولهای زیستی را فراهم میکند. شناخت پایههای آنزیمی، نقش آنتیبادیها و آنتیژنها، مکانیزم تولید سیگنال و اهمیت اختصاصیت و حساسیت، اساس موفقیت در کاربردهای بالینی و تحقیقاتی ELISA را تشکیل میدهد. بدون درک عمیق این اصول، استفاده بهینه از ELISA در تشخیصهای بالینی، پایش ایمنی یا تحقیقات مولکولی ممکن نخواهد بود.
انواع روشهای ELISA
روش ELISA به دلیل انعطافپذیری و قابلیتهای بالایش در طراحیهای مختلف، به چند دسته اصلی تقسیم میشود. هر یک از این روشها دارای ویژگیها و کاربردهای خاصی هستند که با شناخت دقیق آنها میتوان تصمیم گرفت کدام روش برای سنجش مولکول هدف مناسبتر است. این روشها شامل ELISA مستقیم، غیرمستقیم، ساندویچ و رقابتی هستند که هر کدام با اصول پایه مشابه عمل میکنند اما در طراحی و مکانیزم تفاوت دارند.
ELISA مستقیم
در روش مستقیم ELISA، آنتیبادی متصل به آنزیم مستقیماً به آنتیژن هدف در سطح جامد (مانند چاهکهای پلاستیکی) متصل میشود. این روش سادهترین فرم ELISA است و نیاز به مراحل اضافی ندارد. پس از اتصال آنتیبادی به آنتیژن، سوبسترا به آنزیم اضافه میشود و تغییر رنگ یا سیگنال دیگر تولید میشود که قابل اندازهگیری است.
مزایای ELISA مستقیم شامل سرعت بالا و نیاز کمتر به مواد آزمایشگاهی است. این روش برای تشخیص سریع مولکولها یا بررسی حضور یک آنتیژن خاص در نمونهها بسیار مناسب است. با این حال، محدودیت اصلی آن، حساسیت کمتر و امکان تداخل بالاتر است، زیرا هر گونه اتصال غیرمستقیم یا غیر اختصاصی به سطح میتواند سیگنال ایجاد کند. همچنین در مواردی که نیاز به تشخیص چندین مولکول همزمان باشد، ELISA مستقیم محدودیت دارد، زیرا هر آنتیبادی نیاز به اتصال مستقیم به آنزیم دارد و طراحی چندگانه پیچیده میشود.
ELISA غیرمستقیم
در روش غیرمستقیم ELISA، ابتدا آنتیژن به سطح جامد متصل میشود و سپس آنتیبادی اصلی (Primary Antibody) که نسبت به آنتیژن اختصاصی است، به سطح اضافه میشود. پس از اتصال، آنتیبادی ثانویه (Secondary Antibody) متصل به آنزیم اضافه میشود که به آنتیبادی اصلی متصل میشود و سیگنال قابل اندازهگیری تولید میکند.
این روش به دلیل استفاده از آنتیبادی ثانویه، حساسیت بیشتری نسبت به ELISA مستقیم دارد، زیرا چندین آنتیبادی ثانویه میتوانند به یک آنتیبادی اصلی متصل شوند و شدت سیگنال را افزایش دهند. همچنین، هزینه آزمایش کاهش مییابد، زیرا یک آنتیبادی ثانویه آنزیمدار میتواند برای چندین آنتیبادی اصلی مختلف استفاده شود. از سوی دیگر، این روش به دلیل مراحل بیشتر، زمان بیشتری نیاز دارد و احتمال خطا در مراحل شستوشو یا اتصال غیر اختصاصی افزایش مییابد.
ELISA ساندویچ
روش ساندویچ ELISA یکی از رایجترین و دقیقترین روشها برای تشخیص آنتیژنهای خاص است. در این روش، آنتیبادی اولیه به سطح جامد متصل میشود و آنتیژن نمونه بین این آنتیبادی و آنتیبادی ثانویه قرار میگیرد، که شبیه به قرار گرفتن آنتیژن در یک ساندویچ است. سپس آنتیبادی ثانویه متصل به آنزیم به آنتیژن متصل میشود و سیگنال تولید میکند.
مزیت اصلی این روش، اختصاصیت بسیار بالا و کاهش تداخل سیگنال ناشی از مولکولهای غیرهدف است. این روش برای نمونههای پیچیده زیستی، مانند سرم خون یا پلاسما، بسیار مناسب است، زیرا احتمال تشخیص نادرست یا تداخل به حداقل میرسد. با این حال، محدودیت آن، پیچیدگی بیشتر و نیاز به انتخاب دقیق آنتیبادیهای متناسب برای تشکیل ساندویچ است. موفقیت در این روش به کیفیت و اختصاصیت هر دو آنتیبادی بستگی دارد و طراحی مناسب آنها حیاتی است.
ELISA رقابتی
در روش رقابتی ELISA، نمونه حاوی آنتیژن با مقدار مشخصی از آنتیژن علامتگذاری شده (تگ دار یا آنزیمدار) رقابت میکند تا به آنتیبادی سطح جامد متصل شود. در این روش، شدت سیگنال تولید شده با مقدار آنتیژن موجود در نمونه رابطه معکوس دارد؛ یعنی هرچه نمونه حاوی مقدار بیشتری آنتیژن باشد، سیگنال کمتر خواهد بود.
مزیت اصلی ELISA رقابتی، توانایی تشخیص دقیق آنتیژنهای کوچک یا مولکولهایی که تنها یک اپیتوپ دارند است، که در روشهای ساندویچ امکان سنجش آنها محدود است. این روش در تعیین سطح داروها، هورمونها و مولکولهای کوچک زیستی بسیار کاربرد دارد. محدودیتهای آن شامل پیچیدگی طراحی، نیاز به استانداردهای دقیق و رابطه معکوس سیگنال است که تفسیر نتایج را نسبت به سایر روشها کمی دشوارتر میکند.
مقایسه مزایا و معایب هر نوع ELISA
هر یک از انواع ELISA ویژگیها و کاربردهای خاص خود را دارند. ELISA مستقیم سریع و ساده است، اما حساسیت و اختصاصیت آن پایینتر است. ELISA غیرمستقیم حساسیت بالاتری دارد و استفاده از آنتیبادیهای ثانویه هزینهها را کاهش میدهد، اما زمانبر است. ELISA ساندویچ به دلیل اختصاصیت بسیار بالا و مناسب بودن برای نمونههای پیچیده، در کاربردهای بالینی بسیار رایج است، اما طراحی آن پیچیده است. ELISA رقابتی برای مولکولهای کوچک و داروها مناسب است، اما تفسیر سیگنال معکوس آن نیاز به دقت دارد.
نتیجهگیری بخش انواع روشها
در مجموع، انواع مختلف ELISA انعطافپذیری این تکنیک را در کاربردهای بالینی و تحقیقاتی نشان میدهند. شناخت دقیق مکانیسم، مزایا و محدودیتهای هر روش به پژوهشگر یا متخصص بالینی امکان میدهد تا بهترین روش را برای هدف مورد نظر انتخاب کند و دقت و حساسیت نتایج را به حداکثر برساند. این بخش پایهای برای درک پیشرفتهای مدرن در ELISA و کاربردهای تخصصی آن در زمینههای بالینی و تحقیقاتی است.
پیشرفتها و تکنیکهای مدرن در ELISA
با گذشت بیش از پنج دهه از معرفی ELISA، این روش همچنان یکی از ستونهای اصلی تشخیص مولکولی و تحقیقات بیولوژیکی محسوب میشود. با پیشرفت تکنولوژیهای آنالیز و نیاز به افزایش حساسیت و اختصاصیت، ELISA نیز تغییرات و پیشرفتهای متعددی را تجربه کرده است. این پیشرفتها شامل ELISA چندگانه (Multiplex ELISA)، ELISA فوق حساس (Ultrasensitive ELISA)، و استفاده از نشانگرهای جدید مانند شیمیلومینسانس و فلورسانس است که قابلیتهای سنتی این روش را به طرز قابل توجهی گسترش دادهاند.
ELISA چندگانه (Multiplex ELISA)
یکی از محدودیتهای سنتی ELISA، توانایی اندازهگیری تنها یک مولکول در هر واکنش بود. در کاربردهای بالینی و تحقیقاتی، نیاز به سنجش چندین مولکول به طور همزمان، مانند چندین سیتوکین یا پروتئین، احساس میشد. ELISA چندگانه این محدودیت را با استفاده از سیستمهای پیشرفته برطرف کرده است. در این روش، چندین آنتیبادی اولیه با مشخصههای متفاوت بر روی یک سطح جامد یا میکرواُرگانیسمها قرار میگیرند و امکان اندازهگیری همزمان چند هدف را فراهم میکنند.
مزیت اصلی ELISA چندگانه، کاهش حجم نمونه و زمان واکنش و افزایش اطلاعات دریافتی از یک نمونه واحد است. این روش به ویژه در مطالعاتی که حجم نمونه محدود است، مانند نمونههای انسانی یا حیوانی با حجم کم، بسیار کاربرد دارد. با این حال، طراحی و استانداردسازی ELISA چندگانه پیچیدهتر است و نیازمند کنترلهای دقیق برای جلوگیری از تداخل بین سیگنالهاست.
ELISA فوق حساس (Ultrasensitive ELISA)
در بسیاری از بیماریها یا شرایط بیولوژیکی، غلظت آنتیژنها یا پروتئینهای هدف در نمونهها بسیار پایین است و روشهای سنتی ELISA قادر به تشخیص آن نیستند. برای پاسخ به این نیاز، تکنیکهای ELISA فوق حساس توسعه یافتهاند که میتوانند حتی مقادیر پیکوگرمی یا کمتر از یک مولکول را در نمونه تشخیص دهند.
این پیشرفتها معمولاً با استفاده از سیستمهای آنزیمی با فعالیت بالا، سیگنالهای شیمیلومینسانس یا فلورسانس تقویت شده، و میکروفلوئیدیکها امکانپذیر شدهاند. ELISA فوق حساس کاربردهای گستردهای در تشخیص زودهنگام بیماریهای عفونی، پایش پاسخهای ایمنی، و سنجش مارکرهای بیماریهای مزمن و نادر دارد. با افزایش حساسیت، دقت و قابلیت تکرارپذیری این روش نیز بهبود یافته و امکان پایش دقیق تغییرات مولکولی فراهم میشود.
استفاده از نشانگرهای جدید: شیمیلومینسانس و فلورسانس
تکنولوژیهای مدرن ELISA تنها به تغییر طراحی واکنش محدود نمیشوند؛ بلکه سیستمهای سیگنالدهی نیز تحول یافتهاند. در روشهای کلاسیک، تغییر رنگ ناشی از واکنش آنزیمی به صورت بصری یا با اسپکتروفتومتر اندازهگیری میشد. اما با معرفی سیستمهای شیمیلومینسانس و فلورسانس، حساسیت و محدوده دینامیکی ELISA به طور قابل توجهی افزایش یافته است.
در شیمیلومینسانس ELISA، واکنش آنزیمی منجر به تولید نور میشود و شدت نور با غلظت مولکول هدف رابطه مستقیم دارد. این روش مزایای متعددی از جمله افزایش حساسیت، کاهش پسزمینه و امکان سنجش در نمونههای پیچیده دارد. در فلورسانس ELISA، مولکولهای فلورسانس به آنتیبادی یا آنتیژن متصل میشوند و با استفاده از دستگاههای فلوریمتری، سیگنال تولید شده اندازهگیری میشود. این تکنیک امکان اندازهگیری چندین هدف به طور همزمان با رنگهای مختلف را فراهم میکند و برای مطالعات چندپارامتری بسیار مفید است.
ادغام ELISA با تکنولوژیهای میکروفلوئیدیک و نانو
یکی دیگر از پیشرفتهای مهم در ELISA، ادغام آن با تکنولوژیهای میکروفلوئیدیک و نانو است. استفاده از چاهکهای بسیار کوچک و ساختارهای نانو، حجم نمونه مورد نیاز را به حداقل رسانده و سرعت واکنش را افزایش میدهد. این تکنولوژیها همچنین قابلیت تولید سیگنال قویتر و کاهش اثرات پسزمینه را دارند و امکان تشخیص مولکولهای نادر در نمونههای بسیار کوچک را فراهم میکنند.
ELISA دیجیتال و اتوماسیون
با پیشرفت علوم محاسباتی و رباتیک، ELISA به سمت اتوماسیون و دیجیتالیزه شدن حرکت کرده است. دستگاههای اتوماتیک قادرند تمام مراحل واکنش، از پوششدهی سطح تا افزودن سوبسترا و اندازهگیری سیگنال را بدون دخالت انسان انجام دهند. این پیشرفت باعث کاهش خطای انسانی، افزایش تکرارپذیری و سرعت بالاتر انجام آزمایشها شده است. همچنین، ELISA دیجیتال با تکنیکهای شمارش تک مولکول یا آنالیزهای مبتنی بر تصویر، امکان ارائه دادههای کمی بسیار دقیق و حساس را فراهم میکند.
مزایا و محدودیتهای تکنیکهای مدرن ELISA
تکنیکهای پیشرفته ELISA مزایای قابل توجهی از جمله افزایش حساسیت و اختصاصیت، کاهش حجم نمونه، امکان سنجش همزمان چندین هدف و بهبود تکرارپذیری دارند. با این حال، محدودیتهایی نیز دارند، از جمله پیچیدگی طراحی، هزینه بالاتر تجهیزات و نیاز به کنترلهای کیفی دقیق. موفقیت در استفاده از تکنیکهای مدرن ELISA مستلزم درک کامل اصول پایه، انتخاب مناسب آنتیبادیها و آنزیمها، و استانداردسازی دقیق فرآیندهای آزمایشگاهی است.
نتیجهگیری بخش پیشرفتها و تکنیکهای مدرن
پیشرفتهای مدرن در ELISA نشاندهنده توانایی بینظیر این روش در پاسخ به نیازهای پیچیده تشخیص و تحقیقاتی است. از ELISA چندگانه و فوق حساس گرفته تا استفاده از نشانگرهای فلورسانس و شیمیلومینسانس و ادغام با تکنولوژیهای میکروفلوئیدیک، همه این نوآوریها، ELISA را به یک ابزار انعطافپذیر، دقیق و کاربردی در علوم پزشکی و تحقیقاتی تبدیل کردهاند. درک این پیشرفتها برای متخصصان، پژوهشگران و کاربران آزمایشگاهی حیاتی است، زیرا انتخاب روش مناسب و بهرهبرداری کامل از قابلیتهای آن، مستقیماً بر کیفیت و دقت نتایج تأثیر میگذارد.
کاربردهای بالینی ELISA
روش ELISA به دلیل حساسیت بالا، اختصاصیت دقیق و قابلیت کمیسازی مولکولهای زیستی، یکی از ابزارهای کلیدی در آزمایشگاههای بالینی و مراکز تشخیصی محسوب میشود. کاربردهای ELISA گسترده و متنوع هستند و در زمینههای تشخیص بیماریهای عفونی، پایش ایمنی، بررسی بیماریهای خودایمنی، پایش درمان دارویی و سنجش مارکرهای بیولوژیک مورد استفاده قرار میگیرند. توانایی این روش در ارائه دادههای کمی و تکرارپذیر، آن را به یک ابزار مطمئن برای پزشکان و محققان تبدیل کرده است.
تشخیص بیماریهای عفونی
یکی از مهمترین کاربردهای بالینی ELISA، شناسایی و پایش بیماریهای عفونی است. این روش میتواند حضور آنتیبادیها یا آنتیژنهای خاص پاتوژنها را در نمونههای بیمار تشخیص دهد و اطلاعات دقیق درباره وضعیت عفونی فرد ارائه کند. به عنوان مثال، در بیماریهای ویروسی مانند هاری، سرخک، هپاتیت B و C، و کووید-۱۹، ELISA به شناسایی آنتیبادیهای ضد ویروس و تعیین سطح ایمنی بیماران کمک میکند.
در مطالعهای درباره آنتیبادیهای خنثیکننده ویروس هاری، مشخص شد که ELISA قادر است حضور آنتیبادیهای محافظتی حتی در افراد واکسینه نشده را شناسایی کند، که این امر برای ارزیابی وضعیت اپیدمیولوژیک جامعه و تصمیمگیریهای بهداشتی بسیار مهم است. این مثال نشان میدهد که ELISA نه تنها برای تشخیص فردی کاربرد دارد، بلکه میتواند به عنوان یک ابزار نظارتی و اپیدمیولوژیک نیز عمل کند.
پایش ایمنی و پاسخ واکسیناسیون
ELISA نقش مهمی در پایش وضعیت ایمنی افراد پس از واکسیناسیون ایفا میکند. اندازهگیری سطح آنتیبادیها پس از دریافت واکسن، مشخص میکند که آیا فرد به طور موثر ایمن شده است یا نیاز به دوز تقویتی دارد. در واکسیناسیونهای گسترده جمعیتی، استفاده از ELISA امکان بررسی سطح ایمنی در گروههای مختلف سنی و جمعیتی را فراهم میکند و اطلاعات حیاتی برای برنامهریزی بهداشت عمومی ارائه میدهد.
مثلاً در مورد واکسن سرخک، مطالعات سیستماتیک نشان دادهاند که ELISA قادر است سطح آنتیبادیهای خنثیکننده را با دقت بالا تعیین کرده و به عنوان یک شاخص قابل اعتماد برای محافظت فردی و جمعیتی عمل کند. این توانایی، ELISA را به ابزاری ضروری برای مدیریت برنامههای واکسیناسیون و جلوگیری از شیوع بیماریها تبدیل کرده است.
تشخیص بیماریهای خودایمنی و التهابی
در بیماریهای خودایمنی مانند لوپوس اریتماتوز سیستمیک، آرتریت روماتوئید، سندرم شوگرن و بیماریهای کلیوی اتوایمیون، تشخیص و پایش سطح آنتیبادیهای خودی اهمیت ویژهای دارد. ELISA امکان شناسایی و کمیسازی آنتیبادیهای ضد پروتئینها یا بافتهای خودی را فراهم میکند و به پزشکان کمک میکند تا پیشرفت بیماری، شدت التهاب و پاسخ به درمان را ارزیابی کنند.
به عنوان مثال، پایش آنتیبادیهای ضد PLA2R در بیماران مبتلا به نفروپاتی غشایی با ELISA، به تشخیص دقیق وضعیت بیماری و تصمیمگیری برای درمان کمک میکند. این مثال نشان میدهد که ELISA میتواند تفاوتهای جزئی در سطح آنتیبادیها را با دقت بالا تشخیص دهد و مسیر درمان را بهینه سازد.
سنجش مارکرهای بیماریهای مزمن و نئوپلاستیک
ELISA همچنین در تشخیص و پایش بیماریهای مزمن و سرطانها کاربرد دارد. بسیاری از پروتئینها و آنتیژنهای سلولی که نشانگرهای بیماری هستند، توسط ELISA قابل سنجش هستند. این روش امکان پایش پاسخ به درمان، پیشبینی پیشرفت بیماری و بررسی اثر داروهای جدید را فراهم میکند.
در مطالعههای اخیر، استفاده از ELISA برای اندازهگیری مارکرهای زیستی عصبی مانند Neurofilament Light Chain در بیماران مبتلا به آسیبهای عصبی و اختلالات نورودژنراتیو، نشان داده است که این روش میتواند ابزاری دقیق برای پایش آسیبهای عصبی و مدیریت بالینی بیماران باشد.
تشخیص و پایش بیماریهای عفونی غیر ویروسی
ELISA در زمینه بیماریهای باکتریایی و انگلی نیز کاربرد گسترده دارد. برای مثال، در لیشمانیوز گربهای یا بروسلوز کانیس، ELISA به تشخیص عفونت و پایش بار میکروبی کمک میکند. با استفاده از این روش، پزشکان میتوانند سطح آنتیبادیها یا آنتیژنهای پاتوژن را اندازهگیری کرده و وضعیت بالینی بیمار را ارزیابی کنند. همچنین در بیماریهایی مانند تب مالت و عفونتهای مزمن، ELISA میتواند به تشخیص زودهنگام و جلوگیری از شیوع بیماری در جمعیتهای انسانی و حیوانی کمک کند.
پایش داروها و درمانهای هدفمند
یکی دیگر از کاربردهای مهم ELISA در بالین، پایش سطح داروها و بررسی اثربخشی درمانهای هدفمند است. این روش قادر است غلظت داروها، هورمونها یا آنتیبادیهای درمانی را در نمونههای بیمار به دقت اندازهگیری کند. به عنوان مثال، پایش سطح داروهای ایمونوساپرسیو یا درمانهای بیولوژیک در بیماران مبتلا به بیماریهای خودایمنی، امکان بهینهسازی دوز دارو و کاهش عوارض جانبی را فراهم میکند.
نتیجهگیری بخش کاربردهای بالینی
در مجموع، ELISA به دلیل قابلیت کمیسازی دقیق، اختصاصیت بالا و انعطافپذیری گسترده، در طیف وسیعی از کاربردهای بالینی حیاتی است. این روش نه تنها در تشخیص بیماریهای عفونی و پایش ایمنی، بلکه در تشخیص و مدیریت بیماریهای خودایمنی، پایش مارکرهای زیستی، بررسی پاسخ به درمان و مدیریت برنامههای واکسیناسیون نقش اساسی دارد. شناخت دقیق کاربردهای بالینی ELISA به پزشکان و پژوهشگران کمک میکند تا از تواناییهای این روش در تصمیمگیریهای بالینی و تحقیقات مولکولی به بهترین شکل استفاده کنند و کیفیت مراقبت از بیماران را بهبود دهند.
کاربردهای تحقیقاتی و صنعتی ELISA
ELISA به دلیل حساسیت بالا، اختصاصیت دقیق و انعطافپذیری بینظیر، تنها محدود به کاربردهای بالینی نمیشود، بلکه در حوزههای تحقیقاتی و صنعتی نیز نقش کلیدی دارد. در این زمینهها، ELISA به عنوان یک ابزار کمی و کیفی برای سنجش پروتئینها، هورمونها، پاتوژنها و مولکولهای کوچک مورد استفاده قرار میگیرد و امکان بررسی فرآیندهای بیولوژیکی، کیفیت محصولات و پایش محیط زیست را فراهم میآورد.
کاربرد در تحقیقات زیستشناسی مولکولی و سلولی
در مطالعات پایهای علوم زیستی، ELISA ابزاری بسیار مفید برای اندازهگیری پروتئینها و مولکولهای سیگنالدهنده سلولی است. محققان میتوانند با استفاده از ELISA، سطح سیتوکینها، فاکتورهای رشد، آنتیبادیها و سایر پروتئینهای کلیدی سلولی را در نمونههای سلولی یا حیوانی اندازهگیری کنند. این اطلاعات برای درک مکانیسمهای سلولی، مسیرهای سیگنالدهی و پاسخهای ایمنی بسیار حیاتی هستند.
برای مثال، در مطالعات مربوط به التهاب و بیماریهای نورودژنراتیو، سنجش دقیق سیتوکینها و مارکرهای پروتئینی توسط ELISA امکان تحلیل وضعیت سلولهای ایمنی و پیشبینی مسیر بیماری را فراهم میآورد. همچنین، در مطالعات رفتار سلولی، ELISA میتواند پاسخهای سلول به محرکهای محیطی یا دارویی را به شکل کمی تحلیل کند، که این دادهها برای طراحی داروها و درمانهای هدفمند ضروری است.
کاربرد در تحقیقات دارویی و توسعه دارو
ELISA یکی از ابزارهای پایه در توسعه دارو و مطالعات فارماکولوژیک محسوب میشود. در مراحل پیشبالینی و بالینی، ELISA برای پایش سطح داروها، سنجش آنتیبادیهای درمانی و ارزیابی اثرات بیولوژیک داروها استفاده میشود.
به عنوان مثال، در توسعه داروهای بیولوژیک و ایمونوساپرسیو، ELISA امکان اندازهگیری دقیق غلظت دارو در سرم، ارزیابی پاسخ ایمنی و پایش عوارض جانبی را فراهم میکند. همچنین، با استفاده از تکنیکهای فوق حساس و چندگانه ELISA، پژوهشگران میتوانند تغییرات کوچک در سطح مولکولهای هدف را در طول زمان رصد کنند و بر اساس آن، طراحی دقیقتری برای دوز دارو و زمانبندی درمان ارائه دهند.
کاربرد در صنایع غذایی و کشاورزی
در صنایع غذایی، ELISA به عنوان یک ابزار سنجش کیفیت و ایمنی محصول کاربرد دارد. این روش برای تشخیص آلرژنها، مواد افزودنی غیرمجاز، سموم و پاتوژنهای غذایی استفاده میشود. به عنوان مثال، ELISA قادر است حتی مقادیر بسیار کم پروتئینهای آلرژیک مانند بادام زمینی، سویا یا گندم را شناسایی کند و به تولیدکنندگان کمک کند تا محصولات خود را با استانداردهای ایمنی غذایی منطبق سازند.
در کشاورزی و دامپروری نیز، ELISA برای پایش سلامت حیوانات، تشخیص بیماریهای عفونی و بررسی پاسخ ایمنی به واکسنها مورد استفاده قرار میگیرد. این کاربردها به کاهش خطر انتشار بیماریها، افزایش بهرهوری و اطمینان از کیفیت محصولات کشاورزی و دامی کمک میکنند.
کاربرد در پایش محیط زیست و زیستدارویی
ELISA به دلیل حساسیت بالا و قابلیت اندازهگیری کمیمولکولها، در پایش محیط زیست نیز بسیار مفید است. این روش برای تشخیص آلایندههای شیمیایی، داروها و سموم در آب، خاک و نمونههای بیولوژیک استفاده میشود. مطالعات نشان دادهاند که ELISA قادر است مقادیر کم داروها یا مواد شیمیایی باقیمانده در محیط را شناسایی کرده و روند آلودهسازی را پایش کند.
به عنوان مثال، پایش سطح داروهای ضدالتهاب یا آنتیبیوتیکها در منابع آبی با استفاده از ELISA، اطلاعات حیاتی برای مدیریت منابع آب و کاهش اثرات زیستمحیطی داروها فراهم میکند. این کاربرد به ویژه در زمینه زیستشناسی محیط زیست، ایمنی غذایی و بهداشت عمومی اهمیت فراوان دارد.
کاربرد در تحقیقات بیماریهای نادر و مولکولهای کموفور
یکی از زمینههای نوظهور در کاربردهای صنعتی و تحقیقاتی ELISA، تشخیص و پایش مولکولها یا آنتیبادیهای نادر در نمونههای محدود است. با تکنیکهای ELISA فوق حساس و دیجیتال، پژوهشگران میتوانند مقادیر بسیار کم مولکولهای هدف را اندازهگیری کرده و دادههای دقیق برای تحقیقات بنیادی و بالینی تولید کنند. این قابلیت در مطالعات نادر و بیماریهای خاص، جایی که نمونهها محدود و اطلاعات حیاتی هستند، بسیار ارزشمند است.
نتیجهگیری بخش کاربردهای تحقیقاتی و صنعتی
در مجموع، ELISA در زمینههای تحقیقاتی و صنعتی، ابزاری جامع و منعطف برای بررسی فرآیندهای بیولوژیکی، پایش کیفیت محصولات و ارزیابی اثرات محیطی است. توانایی این روش در ارائه دادههای کمی و کیفی، حساسیت بالا و اختصاصیت دقیق، آن را به یک ابزار ضروری در تحقیقات زیستشناسی، توسعه دارو، صنایع غذایی و پایش محیط زیست تبدیل کرده است. آشنایی کامل با این کاربردها به پژوهشگران و متخصصان صنعتی امکان میدهد تا از قابلیتهای ELISA به بهترین شکل برای بهبود تحقیقات، افزایش کیفیت محصولات و ارتقای ایمنی بهرهبرداری کنند.
مزایا و محدودیتهای ELISA
ELISA به دلیل ساده بودن، حساسیت بالا و انعطافپذیری قابل توجه، در طیف وسیعی از کاربردهای بالینی، تحقیقاتی و صنعتی مورد استفاده قرار میگیرد. با این حال، مانند هر روش آزمایشگاهی، محدودیتهایی نیز دارد که شناخت دقیق آنها برای بهینهسازی استفاده از ELISA و تفسیر درست نتایج ضروری است.
مزایای ELISA
یکی از بزرگترین مزایای ELISA، حساسیت و اختصاصیت بالای آن است. با استفاده از آنتیبادیهای اختصاصی و روشهای سیگنالدهی پیشرفته مانند شیمیلومینسانس یا فلورسانس، ELISA قادر است حتی مقادیر بسیار کم آنتیژن یا آنتیبادی را در نمونهها تشخیص دهد. این ویژگی برای تشخیص زودهنگام بیماریها، پایش پاسخ ایمنی و سنجش مولکولهای نادر در نمونههای محدود حیاتی است.
مزیت دیگر، انعطافپذیری در طراحی واکنش است. انواع مختلف ELISA مانند مستقیم، غیرمستقیم، ساندویچ و رقابتی، امکان سنجش مولکولهای متنوع با ویژگیهای متفاوت را فراهم میکنند. این انعطافپذیری به پژوهشگران اجازه میدهد که روش مناسب برای نمونه و هدف مورد نظر را انتخاب کنند و دقت نتایج را افزایش دهند.
سادگی نسبی و قابلیت اتوماسیون نیز یکی دیگر از نقاط قوت ELISA است. بسیاری از مراحل واکنش قابل استانداردسازی و خودکارسازی هستند و دستگاههای اتوماتیک میتوانند پوششدهی سطح، افزودن آنتیبادیها و اندازهگیری سیگنال را بدون دخالت انسان انجام دهند. این امر باعث افزایش تکرارپذیری، کاهش خطای انسانی و سرعت بالاتر انجام آزمایشها میشود.
ELISA همچنین دارای توانایی کمیسازی دقیق و ارائه دادههای کمی و کیفی است. این ویژگی امکان مقایسه نمونهها، پایش تغییرات مولکولی در طول زمان و تولید دادههای قابل اعتماد برای تحقیقات و تصمیمگیریهای بالینی را فراهم میکند. از نظر اقتصادی، بسیاری از انواع ELISA به دلیل نیاز کم به تجهیزات پیچیده و حجم نمونه محدود، نسبت به روشهای پیشرفتهتر آزمایشگاهی مقرون به صرفه هستند.
محدودیتهای ELISA
با وجود مزایای متعدد، ELISA دارای محدودیتهایی نیز است که شناخت آنها برای جلوگیری از خطا و بهبود کیفیت نتایج اهمیت دارد. یکی از محدودیتها، احتمال ایجاد سیگنال پسزمینه و اتصال غیر اختصاصی است. در نمونههای پیچیده مانند سرم یا پلاسما، مولکولهای غیر هدف ممکن است به سطح جامد یا آنتیبادیها متصل شوند و باعث افزایش پسزمینه شوند. این مشکل میتواند حساسیت و دقت تشخیص را کاهش دهد.
محدودیت دیگر، نیاز به انتخاب دقیق آنتیبادیها و طراحی مناسب واکنش است. در روشهای ساندویچ و رقابتی، کیفیت و اختصاصیت آنتیبادیها تعیینکننده موفقیت آزمایش است و انتخاب نادرست میتواند نتایج غیر دقیق یا مثبت کاذب ایجاد کند. علاوه بر این، در ELISA رقابتی، تفسیر سیگنال معکوس ممکن است پیچیده باشد و نیازمند استانداردسازی دقیق است.
زمان انجام آزمایش یکی دیگر از محدودیتهای ELISA است. مراحل مختلف مانند پوششدهی سطح، انسداد، شستوشو و افزودن آنتیبادیها ممکن است چند ساعت تا یک روز طول بکشد، به ویژه در روشهای غیرمستقیم یا ساندویچ که مراحل بیشتری دارند. این موضوع در شرایطی که تشخیص فوری مورد نیاز است، محدودیت ایجاد میکند.
حساسیت ELISA ممکن است در مواردی که غلظت مولکول هدف بسیار پایین است یا نمونه دارای مواد مهارکننده باشد کاهش یابد. اگرچه تکنیکهای مدرن مانند ELISA فوق حساس و شیمیلومینسانس این محدودیت را کاهش دادهاند، اما در نمونههای بسیار پیچیده یا دارای آلودگی بالا، چالشهای فنی باقی میمانند.
علاوه بر این، امکان خطای انسانی و نیاز به کنترلهای کیفی دقیق همواره وجود دارد. اشتباه در آمادهسازی محلولها، زمانبندی واکنش یا شستوشو میتواند منجر به نتایج نادرست یا تکرارپذیری پایین شود. بنابراین، اجرای دقیق پروتکل و آموزش کارشناسان آزمایشگاه برای استفاده صحیح از ELISA ضروری است.
نتیجهگیری بخش مزایا و محدودیتها
در مجموع، ELISA یک ابزار قدرتمند، حساس و انعطافپذیر برای تشخیص و پایش مولکولهای زیستی است که مزایای فراوانی از جمله حساسیت و اختصاصیت بالا، انعطافپذیری در طراحی، قابلیت اتوماسیون و ارائه دادههای کمی دقیق دارد. با این حال، محدودیتهایی مانند پسزمینه بالا، نیاز به انتخاب دقیق آنتیبادیها، زمانبر بودن مراحل و احتمال خطای انسانی باید در نظر گرفته شوند. شناخت کامل مزایا و محدودیتها، به پژوهشگران و متخصصان بالینی امکان میدهد نتایج قابل اعتماد و دقیق از ELISA به دست آورند و از آن به عنوان یک ابزار موثر در تحقیقات و تشخیص استفاده کنند.
بهینهسازی و نکات فنی در انجام ELISA
اجرای موفق ELISA نه تنها به درک اصول پایه و انتخاب نوع مناسب روش وابسته است، بلکه نیازمند توجه دقیق به جزئیات فنی و بهینهسازی مراحل آزمایشگاهی میباشد. رعایت این نکات تضمین میکند که نتایج به دست آمده دقیق، تکرارپذیر و قابل اعتماد باشند. در این بخش، نکات کلیدی برای بهینهسازی ELISA و کاهش منابع خطا به طور جامع بررسی میشود.
انتخاب مناسب نوع ELISA و طراحی آزمایش
اولین گام در بهینهسازی ELISA، انتخاب نوع مناسب روش است. بسته به هدف آزمایش، غلظت مولکول هدف، و پیچیدگی نمونه، باید از میان روشهای مستقیم، غیرمستقیم، ساندویچ و رقابتی، گزینه مناسب انتخاب شود. برای نمونههایی با آنتیژنهای کموفور، روش ساندویچ یا ELISA فوق حساس توصیه میشود، زیرا این روشها حساسیت بالاتر و پسزمینه کمتر ارائه میدهند.
طراحی آزمایش شامل انتخاب آنتیبادیها، سطح جامد مناسب، و شرایط واکنش است. آنتیبادیها باید اختصاصی و خالص باشند تا از اتصال غیر اختصاصی جلوگیری شود. همچنین، سطح جامد (مانند میکروپلیتهای پوششدهی شده با پروتئین یا نایلون) باید با نوع نمونه و آنتیبادی سازگار باشد تا چسبندگی مطلوب و سیگنال قوی ایجاد شود.
کنترلهای کیفی و استانداردسازی
یکی از نکات کلیدی برای بهینهسازی ELISA، استفاده از کنترلهای کیفی مناسب است. کنترلهای مثبت و منفی برای هر واکنش الزامی هستند تا درستی عملکرد آزمایش و اختصاصیت سیگنال تایید شود.
همچنین، استانداردسازی شامل تهیه منحنی استاندارد برای کمیسازی دقیق مولکول هدف و تعیین محدوده دینامیکی آزمایش است. این کار به محققان امکان میدهد که نتایج نمونهها را به طور کمی و قابل تکرار مقایسه کنند و از صحت سنجش اطمینان حاصل نمایند.
بهینهسازی شرایط واکنش
شرایط واکنش مانند غلظت آنتیبادیها، زمان انکوباسیون، دما و pH محیط واکنش نقش مهمی در دقت ELISA دارند. بهینهسازی این پارامترها باعث میشود که سیگنال مطلوب ایجاد شده و پسزمینه کاهش یابد. برای مثال، زمان طولانی انکوباسیون ممکن است باعث افزایش اتصال غیر اختصاصی شود، در حالی که زمان کوتاه ممکن است سیگنال کافی تولید نکند. بنابراین، تعادل بین حساسیت و اختصاصیت از طریق آزمایشهای پیشآزمایشی و تنظیم شرایط واکنش قابل دستیابی است.
شستوشوی دقیق و کاهش پسزمینه
یکی از منابع عمده خطا در ELISA، پسزمینه بالا ناشی از اتصال غیر اختصاصی مولکولها به سطح جامد است. برای کاهش این مشکل، شستوشوی دقیق بین مراحل واکنش ضروری است. استفاده از محلولهای شستوشوی مناسب با Tween یا سایر عوامل کاهشدهنده اتصال غیر اختصاصی و تعداد شستوشوهای کافی میتواند پسزمینه را به طور قابل توجهی کاهش دهد و حساسیت و تکرارپذیری را افزایش دهد.
بهینهسازی سوبسترا و سیستم سیگنالدهی
انتخاب مناسب سوبسترا برای آنزیم متصل به آنتیبادی، نقش حیاتی در کیفیت سیگنال دارد. برای مثال، تبدیل رنگ با آنزیم HRP و سوبستراهای TMB یا OPD باعث تولید سیگنال قوی و پایدار میشود. در ELISA شیمیلومینسانس، انتخاب سوبستراهای نوری با شدت مناسب و پایداری طولانی، افزایش حساسیت و کاهش خطاهای مشاهدهای را تضمین میکند.
مدیریت نمونهها و جلوگیری از تخریب
حفظ کیفیت نمونهها از مراحل جمعآوری تا ذخیرهسازی و آمادهسازی برای ELISA بسیار حیاتی است. نمونهها باید به درستی جمعآوری، فیلتر یا سانتریفیوژ شوند و در دما و شرایط مناسب ذخیره شوند تا از تخریب مولکولهای هدف جلوگیری شود. همچنین، اجتناب از چرخههای متعدد انجماد و ذوب، حفظ پایداری آنتیبادیها و آنتیژنها را تضمین میکند.
اتوماسیون و تکرارپذیری آزمایش
برای کاهش خطای انسانی و افزایش تکرارپذیری، استفاده از دستگاههای اتوماتیک ELISA توصیه میشود. این دستگاهها میتوانند تمام مراحل از افزودن نمونه و آنتیبادی تا شستوشو و اندازهگیری سیگنال را بدون دخالت مستقیم انسان انجام دهند. اتوماسیون علاوه بر افزایش دقت، سرعت انجام آزمایشها را نیز به طور قابل توجهی افزایش میدهد.
ملاحظات مربوط به ELISA چندگانه و فوق حساس
در روشهای پیشرفته مانند ELISA چندگانه و فوق حساس، نیاز به کنترل دقیق تداخل سیگنالها، بهینهسازی منحنی استاندارد و تنظیم شرایط واکنش وجود دارد. طراحی مناسب چاهکها، آنتیبادیها و سیستمهای سیگنالدهی باعث میشود که هر مولکول هدف به طور مستقل و با حساسیت بالا اندازهگیری شود. این نکات فنی برای موفقیت در آزمایشهای پیچیده و تحقیقات پیشرفته بسیار حیاتی هستند.
نتیجهگیری بخش بهینهسازی و نکات فنی
در نهایت، بهینهسازی ELISA نیازمند توجه دقیق به طراحی آزمایش، انتخاب آنتیبادیها، شرایط واکنش، شستوشوی مناسب، انتخاب سوبسترا و مدیریت نمونهها است. رعایت این نکات فنی باعث میشود که نتایج دقیق، حساس و تکرارپذیر باشند و کاربردهای بالینی، تحقیقاتی و صنعتی ELISA به حداکثر کارایی برسند. شناخت کامل این نکات برای پژوهشگران و متخصصان آزمایشگاهی، اطمینان از صحت نتایج و بهرهبرداری کامل از قابلیتهای ELISA را تضمین میکند.
چالشها و آینده ELISA
با وجود محبوبیت و کاربرد گسترده ELISA در حوزههای بالینی، تحقیقاتی و صنعتی، این روش همچنان با چالشها و محدودیتهای فنی، عملی و تفسیر نتایج مواجه است. درک این چالشها برای توسعه تکنیکهای جدید، بهبود حساسیت و اختصاصیت و طراحی نسل بعدی ELISA ضروری است.
چالشهای فنی و عملی
یکی از مهمترین چالشهای ELISA، پسزمینه و اتصال غیر اختصاصی است که میتواند باعث کاهش حساسیت و دقت نتایج شود. نمونههای پیچیده مانند سرم و پلاسما شامل مولکولهای متعدد هستند که ممکن است به سطح جامد یا آنتیبادیها متصل شده و سیگنال غیر هدف تولید کنند. هرچند تکنیکهایی مانند بلوکینگ با پروتئینهای بیاثر یا شستوشوی دقیق میتوانند این مشکل را کاهش دهند، اما حذف کامل پسزمینه هنوز یک چالش فنی باقی مانده است.
محدودیت حساسیت در نمونههای کموفور و پیچیده نیز یکی دیگر از مسائل مهم است. در برخی از مطالعات بالینی و تحقیقاتی، غلظت مولکول هدف ممکن است بسیار پایین باشد و حتی تکنیکهای ELISA استاندارد قادر به تشخیص آن نباشند. پیشرفتهایی مانند ELISA فوق حساس، شیمیلومینسانس و دیجیتال ELISA این مشکل را کاهش دادهاند، اما هنوز در نمونههای بسیار پیچیده یا با تداخل مولکولی، نیاز به بهینهسازی دقیق وجود دارد.
اختلافات بین آزمایشگاهها و استانداردسازی جهانی یکی دیگر از چالشهای ELISA است. روشها، آنتیبادیها، سیستمهای سیگنالدهی و شرایط واکنش میتوانند بین مراکز مختلف متفاوت باشند، که باعث اختلاف در نتایج و دشواری مقایسه دادهها میشود. این محدودیت در مطالعات اپیدمیولوژیک و توسعه دارو اهمیت بیشتری دارد، زیرا نیازمند دادههای قابل مقایسه و تکرارپذیر است.
تفسیر نتایج و محدودیتهای کمیسازی نیز چالش قابل توجهی است. برخی از ELISAها، به ویژه روشهای رقابتی و ساندویچ، ممکن است نتایج کمیبا دقت نسبی ارائه دهند و تفسیر دقیق سطح مولکول هدف نیازمند منحنی استاندارد دقیق، کنترلهای کیفی متعدد و تجربه کارشناسان آزمایشگاه است. عدم رعایت این نکات میتواند منجر به خطاهای بالینی یا تحقیقاتی شود.
چالشهای عملیاتی و زمانی نیز در برخی کاربردها مشاهده میشود. مراحل متعدد ELISA شامل پوششدهی، بلوکینگ، انکوباسیون، شستوشو و توسعه سیگنال، میتواند زمانبر باشد و نیازمند دقت بالا در هر مرحله باشد. در محیطهای بالینی که تشخیص فوری مورد نیاز است، این محدودیت میتواند مانع استفاده گسترده از ELISA شود.
چشمانداز آینده ELISA
با وجود این چالشها، افقهای روشنی برای توسعه و بهبود ELISA وجود دارد. یکی از مهمترین روندها، افزایش حساسیت و کاهش زمان انجام آزمایش از طریق تکنیکهای فوق حساس و دیجیتال است. ELISAهای دیجیتال قادرند حتی مقادیر تک مولکولی را تشخیص دهند و کاربردهای بالینی و تحقیقاتی ELISA را گسترش دهند.
توسعه ELISA چندگانه و ترکیبی نیز از دیگر روندهای آینده است. با استفاده از سیستمهای چندگانه، امکان سنجش همزمان چندین مولکول هدف در یک نمونه واحد فراهم میشود که میتواند زمان و هزینه آزمایشها را کاهش داده و اطلاعات جامعتری ارائه دهد. این ویژگی به ویژه در مطالعات پیچیده زیستشناسی مولکولی، پایش اپیدمیولوژیک و توسعه دارو اهمیت دارد.
اتوماسیون و هوشمندسازی ELISA نیز به عنوان یک مسیر توسعه آینده مطرح است. استفاده از دستگاههای اتوماتیک، روباتیک و تحلیل دادههای نرمافزاری باعث افزایش تکرارپذیری، کاهش خطای انسانی و تسریع انجام آزمایشها میشود. در آینده، ترکیب ELISA با سیستمهای هوش مصنوعی و الگوریتمهای تحلیل داده میتواند نتایج دقیقتر و پیشبینیهای بالینی بهتری ارائه کند.
توسعه آنتیبادیهای نوین و مواد فعال نیز یکی از راهکارهای آینده برای بهبود ELISA است. آنتیبادیهای مهندسی شده با اختصاصیت بالا و پایداری طولانی، میتوانند سیگنال غیر اختصاصی را کاهش داده و حساسیت آزمایش را افزایش دهند. همچنین، مواد جدید برای پوششدهی سطح و سوبستراهای نوری یا شیمیلومینسانس با بازده بالاتر، کیفیت نتایج را بهبود میبخشند.
کاربرد ELISA در بیماریهای نوظهور و پایش اپیدمیولوژیک نیز آینده بسیار روشنی دارد. با توجه به شیوع بیماریهای جدید مانند کووید-۱۹ و سایر عفونتهای نوظهور، ELISA میتواند به عنوان ابزاری سریع، حساس و کمهزینه برای پایش جمعیتی و شناسایی سریع موارد جدید عمل کند. این امر امکان تصمیمگیری سریع در بحرانهای بهداشتی و کنترل شیوع بیماری را فراهم میکند.
نتیجهگیری بخش چالشها و آینده
در جمعبندی، ELISA با وجود مزایای بیشمار و کاربردهای گسترده، با چالشهای فنی، عملی و تفسیر نتایج مواجه است. محدودیتهایی مانند پسزمینه بالا، حساسیت محدود در نمونههای پیچیده، اختلاف بین آزمایشگاهها و زمانبر بودن مراحل، نیازمند بهینهسازی مداوم و توسعه تکنیکهای نوین است. با این حال، روندهای آینده شامل تکنیکهای فوق حساس، ELISA چندگانه، اتوماسیون پیشرفته، آنتیبادیهای مهندسی شده و کاربردهای اپیدمیولوژیک نشان میدهد که ELISA همچنان یک ابزار کلیدی و رو به رشد در تشخیص، تحقیق و صنعت باقی خواهد ماند. این چشمانداز نویدبخش افزایش دقت، سرعت و کاربردهای گستردهتر ELISA در دهههای آینده است.
جمعبندی و نتیجهگیری
روش ELISA یا Enzyme-Linked Immunosorbent Assay به عنوان یک ابزار بینظیر در تشخیص، تحقیق و صنعت، طی دهههای اخیر جایگاه خود را تثبیت کرده است. این تکنیک با بهرهگیری از اختصاصیت آنتیبادیها و سیگنالدهی آنزیمی، امکان سنجش دقیق و کمی مولکولهای هدف را در نمونههای بیولوژیک و محیطی فراهم میکند. از تشخیص بیماریهای عفونی و پایش ایمنی جمعیتی گرفته تا کاربردهای تحقیقاتی در بیولوژی سلولی و مولکولی، ELISA یک ابزار همهکاره و ارزشمند محسوب میشود.
یکی از مهمترین دستاوردهای ELISA، حساسیت و اختصاصیت بالا است که باعث شده این روش به یک استاندارد طلایی در اندازهگیری پروتئینها، آنتیبادیها، هورمونها و سایر مولکولهای زیستی تبدیل شود. این ویژگی به همراه انعطافپذیری در طراحی واکنشها و امکان اتوماسیون، ELISA را به ابزاری ایدهآل برای کاربردهای بالینی، تحقیقاتی و صنعتی تبدیل کرده است.
در حوزه بالینی، ELISA نقش اساسی در تشخیص سریع و دقیق بیماریها، پایش پاسخ ایمنی و تعیین اثربخشی درمانها دارد. این روش به پزشکان امکان میدهد که تصمیمگیریهای بالینی را با دادههای کمی و قابل اعتماد انجام دهند و به تشخیص زودهنگام بیماریها کمک کند. همچنین، در تحقیقات زیستشناسی و دارویی، ELISA به پژوهشگران اجازه میدهد که پاسخهای سلولی، مسیرهای سیگنالدهی و اثرات داروها را با دقت بالا تحلیل کنند و به توسعه داروهای هدفمند کمک کنند.
در صنایع غذایی و محیط زیست، ELISA با توانایی تشخیص آلرژنها، سموم، داروها و آلایندهها در نمونههای پیچیده، امنیت و کیفیت محصولات را تضمین میکند. به ویژه در پایش محیط زیست، ELISA ابزار ارزشمندی برای شناسایی و مدیریت آلودگیها و مواد دارویی باقیمانده در آب و خاک است.
با این حال، ELISA محدودیتهایی نیز دارد که شامل پسزمینه بالا، نیاز به انتخاب دقیق آنتیبادیها، زمانبر بودن مراحل و احتمال خطای انسانی میشود. شناخت این محدودیتها و رعایت نکات فنی مانند بهینهسازی شرایط واکنش، شستوشوی دقیق، استفاده از کنترلهای کیفی و مدیریت نمونهها، کیفیت نتایج را افزایش میدهد و امکان استفاده بهینه از ELISA را فراهم میکند.
چشمانداز آینده ELISA روشن است و شامل تکنیکهای فوق حساس و دیجیتال، ELISA چندگانه، اتوماسیون پیشرفته، آنتیبادیهای مهندسی شده و کاربردهای اپیدمیولوژیک میشود. این پیشرفتها باعث میشوند که ELISA حساستر، سریعتر و دقیقتر شده و دامنه کاربرد آن در علوم زیستی، پزشکی، صنعت و محیط زیست گسترش یابد.
در نهایت، ELISA نه تنها یک روش آزمایشگاهی بلکه یک ابزار راهبردی در علوم زیستی و پزشکی مدرن است. توانایی آن در ارائه دادههای کمی و کیفی دقیق، انعطافپذیری در طراحی واکنش و کاربردهای گسترده در حوزههای مختلف، این تکنیک را به یک ستون مهم در تشخیص، تحقیق و توسعه صنعتی تبدیل کرده است. به همین دلیل، آشنایی کامل با اصول، کاربردها، مزایا، محدودیتها و نکات فنی ELISA برای متخصصان بالینی، پژوهشگران و فعالان صنعتی ضروری است تا بتوانند از قابلیتهای این روش به بهترین شکل استفاده کرده و نتایج قابل اعتماد و ارزشمندی تولید کنند.