تکنیکهای مولکولی در میکروبیولوژی
مقدمه
در دنیای امروز که بیماریهای عفونی همچنان تهدیدی جدی برای سلامت انسان، حیوان و حتی محیط زیست به شمار میروند، تشخیص دقیق و سریع عوامل میکروبی بیش از هر زمان دیگری اهمیت یافته است. روشهای سنتی در میکروبیولوژی مانند کشت میکروارگانیسمها، رنگآمیزیهای میکروسکوپی و تستهای بیوشیمیایی طی سالها ابزار اصلی شناسایی پاتوژنها بودهاند و بدون شک سهم بزرگی در پیشرفت علم و پزشکی داشتهاند. با این حال، این روشها محدودیتهای متعددی دارند؛ از جمله زمانبر بودن فرایند، نیاز به شرایط ویژه کشت، احتمال آلودگی متقاطع و ناتوانی در شناسایی برخی از میکروارگانیسمهای غیرقابل کشت. همین نقاط ضعف سبب شد که نگاه پژوهشگران و پزشکان به سوی روشهای پیشرفتهتری جلب شود که بتوانند با سرعت، دقت و حساسیت بالا اطلاعات مورد نیاز را در اختیار قرار دهند.
تکنیکهای مولکولی دقیقاً در پاسخ به این نیاز ظهور پیدا کردند. این روشها با بهرهگیری از دانش ژنتیک، بیوشیمی و فناوریهای نوین زیستشناسی مولکولی، امکان شناسایی میکروارگانیسمها در سطح ماده ژنتیکی آنها یعنی DNA و RNA را فراهم میآورند. مهمترین ویژگی این تکنیکها آن است که برخلاف روشهای سنتی نیازی به رشد و تکثیر میکروب در محیط کشت ندارند و میتوانند حضور یک پاتوژن را حتی در مقادیر بسیار اندک تشخیص دهند. این ویژگی بهویژه در مواردی که بیماری نیازمند درمان فوری است یا زمانی که میکروارگانیسمها در شرایط خاص قادر به رشد نیستند، ارزش فوقالعادهای دارد.
یکی از برجستهترین و پرکاربردترین تکنیکهای مولکولی در میکروبیولوژی واکنش زنجیرهای پلیمراز (PCR) است. معرفی این روش انقلابی در سال 1983 توسط کارل مولیس، نقطه عطفی در تاریخ میکروبیولوژی و پزشکی محسوب میشود. PCR توانست با الگوبرداری از فرایندهای طبیعی همانندسازی DNA درون سلول، روشی آزمایشگاهی ارائه دهد که امکان تکثیر میلیونها نسخه از یک قطعه DNA خاص را در مدت زمانی کوتاه فراهم میسازد. این تحول، دریچهای تازه به روی پژوهشها و کاربردهای بالینی گشود و به سرعت جایگاه ویژهای در آزمایشگاههای تحقیقاتی و تشخیصی پیدا کرد.
امروزه PCR تنها یکی از اعضای خانواده بزرگ تکنیکهای مولکولی است. روشهای متنوع دیگری همچون Real-Time PCR، Digital PCR، RT-PCR، متاژنومیک، توالییابی نسل جدید (NGS) و حتی فناوریهای نوینی مانند CRISPR-Cas در کنار PCR توسعه یافتهاند و هر یک پاسخگوی نیازهای خاصی در تشخیص بیماریهای عفونی، بررسی جوامع میکروبی، پایش کیفیت آب و مواد غذایی، و حتی مطالعات پیچیده زیستمحیطی هستند. این ابزارها نه تنها تشخیص سریعتر و دقیقتر بیماریها را امکانپذیر کردهاند، بلکه به درک عمیقتر ما از تنوع ژنتیکی و اکولوژی میکروبها نیز کمک شایانی کردهاند.
از دیگر جنبههای مهم مقدمه این بحث، نقش روزافزون تکنیکهای مولکولی در پزشکی شخصی و درمانهای هدفمند است. زمانی که میتوان به کمک این ابزارها ژنهای مقاومت آنتیبیوتیکی یا فاکتورهای ویرولانس پاتوژنها را شناسایی کرد، پزشکان قادر خواهند بود بهترین گزینه درمانی را انتخاب کنند و از مصرف بیرویه آنتیبیوتیکها جلوگیری نمایند. این موضوع نه تنها به بهبود وضعیت بیماران منجر میشود، بلکه در کنترل بحران جهانی مقاومت دارویی نیز تأثیرگذار است.
در همین راستا، هدف این مقاله ارائه یک مرور جامع بر روی PCR و تکنیکهای مولکولی در میکروبیولوژی است تا هم متخصصان بالینی و هم پژوهشگران حوزه علوم زیستی بتوانند دیدی عمیق و یکپارچه نسبت به این فناوریها به دست آورند. در ادامه، به بررسی تاریخچه و توسعه این تکنیکها، اصول پایهای و انواع مختلف PCR، تکنیکهای مکمل و نوین، کاربردهای بالینی و محیطی، مزایا و محدودیتها، و در نهایت چشمانداز آینده این حوزه پرداخته خواهد شد. این مقاله به گونهای تدوین شده است که نه تنها پرسشهای متداول متخصصان را پاسخ دهد، بلکه به عنوان یک مرجع علمی کامل و سئو شده بتواند برای خوانندگان وبسایت آریا طب جذاب و کاربردی باشد.
تاریخچه و توسعه تکنیکهای مولکولی در میکروبیولوژی
شناخت میکروارگانیسمها همواره یکی از دغدغههای اصلی علم پزشکی و زیستشناسی بوده است. از قرن نوزدهم که لوئی پاستور و رابرت کخ پایههای نظریه میکروبی بیماریها را بنا نهادند، تلاش برای شناسایی عوامل عفونی آغاز شد. در آن دوران، ابزارهای موجود محدود به میکروسکوپهای نوری و روشهای کشت در محیطهای مصنوعی بود. این ابزارها توانستند انقلابی در درک ما از بیماریها ایجاد کنند و راه را برای کشف عوامل بیماریزا هموار نمایند، اما محدودیتهای آشکاری داشتند. بسیاری از میکروارگانیسمها قادر به رشد در شرایط آزمایشگاهی نبودند و شناسایی آنها گاهی هفتهها یا حتی ماهها به طول میانجامید. همین مشکلات باعث شد دانشمندان به دنبال روشهایی باشند که بتوانند به جای بررسی خصوصیات فنوتیپی، ماهیت ژنتیکی میکروبها را مورد مطالعه قرار دهند.
تحولات واقعی در این زمینه با کشف ساختار DNA توسط واتسون و کریک در سال 1953 آغاز شد. این کشف مسیر تازهای را برای زیستشناسی مولکولی گشود و امکان درک عمیقتر از اطلاعات ژنتیکی میکروبها را فراهم کرد. در دهههای بعدی، تکنیکهای متعددی مانند الکتروفورز ژل آگاروز، هیبریداسیون نوکلئیک اسیدی و بلاتینگ توسعه یافتند که ابزارهای اولیه در مطالعه ژنها و نوکلئیک اسیدها محسوب میشدند. این روشها اگرچه کاربردهای زیادی داشتند، اما هنوز محدودیتهای زیادی در حساسیت، سرعت و گستره شناسایی نشان میدادند.
یکی از بزرگترین نقاط عطف در تاریخ میکروبیولوژی مولکولی، معرفی واکنش زنجیرهای پلیمراز (PCR) توسط کارل مولیس در سال 1983 بود. این نوآوری امکان تکثیر سریع و هدفمند قطعات DNA را در شرایط آزمایشگاهی فراهم ساخت. PCR به سرعت جای خود را در تحقیقات پزشکی، کشاورزی، علوم محیطی و بهویژه میکروبیولوژی باز کرد. پیش از PCR، تشخیص بسیاری از میکروبها نیازمند کشت طولانیمدت یا تستهای پیچیده بود، اما این روش انقلابی، شرایطی فراهم کرد تا حضور یک عامل بیماریزا حتی از روی مقادیر بسیار اندک DNA در نمونههای بالینی یا محیطی شناسایی شود.
پس از معرفی PCR، دهههای پایانی قرن بیستم شاهد توسعه نسخههای پیشرفتهتر این تکنیک بود. Real-Time PCR یا qPCR امکان اندازهگیری کمی بار میکروبی و بررسی بیان ژنها را فراهم آورد. Nested PCR حساسیت و اختصاصیت بیشتری به دست داد و Multiplex PCR امکان شناسایی همزمان چندین عامل بیماریزا را فراهم ساخت. در ادامه، با پیشرفت فناوریهای دیجیتال، Digital PCR معرفی شد که دقت بیسابقهای در شناسایی مقادیر بسیار اندک DNA داشت و توانست محدودیتهای روشهای قبلی را برطرف کند.
همزمان با تکامل PCR، سایر تکنیکهای مولکولی نیز وارد عرصه شدند. توالییابی DNA از روشهای کلاسیک مانند Sanger sequencing آغاز شد و سپس با ظهور توالییابی نسل جدید (NGS) سرعت و دقتی بینظیر پیدا کرد. این فناوریها امکان مطالعه مستقیم ژنوم کامل میکروبها یا حتی جوامع میکروبی پیچیده را بدون نیاز به کشت در محیط آزمایشگاهی فراهم ساختند. به همین دلیل، متاژنومیک بهعنوان یکی از شاخههای نوین، نقش حیاتی در کشف میکروبهای ناشناخته و بررسی اکوسیستمهای میکروبی ایفا کرد.
یکی دیگر از دستاوردهای مهم در این تاریخچه، توسعه روشهای ایزوترمال مانند LAMP (Loop-mediated isothermal amplification) بود که بدون نیاز به دستگاههای پیچیده ترموسایکلر، امکان تکثیر DNA در شرایط ثابت دمایی را فراهم میکرد. این روشها بهویژه در کشورهای در حال توسعه یا در محیطهایی که دسترسی به تجهیزات پیشرفته محدود است، کاربرد گستردهای پیدا کردند.
با ورود به قرن بیستویکم، شاهد ظهور فناوریهای هوشمندتر مانند سیستمهای مبتنی بر CRISPR-Cas در تشخیص بیماریها هستیم. این فناوری که ابتدا بهعنوان یک ابزار ویرایش ژن شناخته شد، اکنون به ابزاری قدرتمند برای شناسایی دقیق و سریع پاتوژنها تبدیل شده است. ترکیب CRISPR با سیستمهای قابل حمل و ارزانقیمت، انقلابی در تشخیص بیماریهای عفونی به وجود آورده و چشمانداز آینده را به سوی دسترسی همگانی به فناوریهای تشخیصی باز کرده است.
به طور کلی، تاریخچه توسعه تکنیکهای مولکولی در میکروبیولوژی داستانی از تلاشهای مداوم دانشمندان برای غلبه بر محدودیتهای روشهای سنتی است. از میکروسکوپهای ابتدایی تا فناوریهای دیجیتال و هوشمند امروزی، هر مرحله گامی به سوی دقت بیشتر، سرعت بالاتر و شناسایی جامعتر میکروارگانیسمها بوده است. این پیشرفتها نه تنها در عرصه پژوهشهای بنیادی، بلکه در بهبود تشخیص بالینی، مدیریت بیماریهای عفونی و پایش محیط زیست تأثیرات شگرفی بر جای گذاشتهاند و پایهگذار آیندهای روشن در علم میکروبیولوژی محسوب میشوند.
پایه و اصول PCR
واکنش زنجیرهای پلیمراز یا همان PCR یکی از بنیادیترین و در عین حال تحولآفرینترین تکنیکهای مولکولی در علوم زیستی و بهویژه میکروبیولوژی است. این روش با الگوبرداری از روند طبیعی همانندسازی DNA در سلولها طراحی شد و هدف آن تکثیر یک قطعه خاص از DNA در شرایط آزمایشگاهی است. اهمیت PCR از آنجا ناشی میشود که با استفاده از این تکنیک میتوان حتی از یک نسخه منفرد DNA یا مقادیر بسیار اندک ماده ژنتیکی، میلیونها نسخه مشابه تولید کرد و این ویژگی امکان مطالعه و شناسایی دقیق عوامل میکروبی را فراهم میسازد.
برای درک بهتر اصول PCR باید ابتدا به ساختار کلی DNA اشاره کرد. DNA از دو رشته مکمل تشکیل شده است که با پیوندهای هیدروژنی میان بازهای آدنین-تیمین و گوانین-سیتوزین به یکدیگر متصل میشوند. کلید موفقیت PCR بر پایه توانایی جداسازی این دو رشته و سپس سنتز رشته مکمل جدید با کمک آنزیم DNA پلیمراز است. آنزیمی که بیشترین کاربرد را در PCR دارد، Taq polymerase نام دارد که از باکتری ترموفیل Thermus aquaticus استخراج شده است. این آنزیم به دلیل مقاومت بالا در برابر دماهای بالا میتواند در چرخههای مکرر حرارتی PCR بدون تخریب عملکرد داشته باشد.
فرایند PCR به صورت متوالی و در چرخههای تکراری انجام میشود. هر چرخه شامل سه مرحله اساسی است: دناتوراسیون، آنیلینگ و طویلسازی. در مرحله دناتوراسیون، نمونه DNA در دمای بالا (معمولاً حدود 94 تا 96 درجه سانتیگراد) قرار میگیرد و دو رشته DNA از هم جدا میشوند. در مرحله بعد یعنی آنیلینگ، دما به میزان مناسب کاهش مییابد تا پرایمرها که توالیهای کوتاه از نوکلئوتیدها هستند، به بخشهای مکمل خود روی DNA متصل شوند. پرایمرها نقشی حیاتی در PCR دارند زیرا تعیین میکنند کدام بخش از DNA تکثیر شود. در نهایت، مرحله طویلسازی در دمایی نزدیک به 72 درجه سانتیگراد انجام میشود که در آن DNA پلیمراز با استفاده از پرایمر به عنوان نقطه شروع، رشته جدید DNA را بر اساس توالی الگو سنتز میکند.
این چرخهها معمولاً بین 25 تا 40 بار تکرار میشوند و در هر بار، مقدار DNA هدف به صورت نمایی افزایش مییابد. به عنوان مثال، پس از 30 چرخه، یک قطعه منفرد DNA میتواند به بیش از یک میلیارد نسخه افزایش یابد. این ویژگی باعث شده است که PCR ابزاری بسیار قدرتمند برای شناسایی حتی کمترین مقادیر DNA در نمونههای بالینی یا محیطی باشد.
یکی از مهمترین مزیتهای PCR اختصاصیت بالا در شناسایی توالیهای هدف است. با طراحی دقیق پرایمرها میتوان تنها بخش خاصی از DNA را تکثیر کرد و همین موضوع سبب میشود این روش برای تشخیص عوامل بیماریزا که ممکن است در حضور سایر میکروارگانیسمها وجود داشته باشند، بسیار مؤثر باشد. از سوی دیگر، حساسیت بالای PCR موجب میشود بتوان حتی حضور چند نسخه محدود از ژنوم یک پاتوژن را در نمونههای پیچیده مانند خون، بافت، ادرار یا محیط زیست شناسایی کرد.
با وجود این، اجرای موفق PCR نیازمند شرایط دقیق و کنترلشده است. انتخاب مناسب پرایمرها، کیفیت ماده ژنتیکی استخراجشده، جلوگیری از آلودگی نمونهها و تنظیم دقیق دماها از عوامل حیاتی در عملکرد صحیح این واکنش به شمار میروند. آلودگیهای اندک میتوانند منجر به نتایج مثبت کاذب شوند و نقص در طراحی پرایمرها یا کیفیت DNA نیز میتواند نتایج منفی کاذب ایجاد کند. به همین دلیل، آزمایشگاههای مولکولی که از PCR استفاده میکنند باید از استانداردهای سختگیرانهای در زمینه کنترل کیفی و ایمنی برخوردار باشند.
کاربردهای PCR در میکروبیولوژی بسیار گسترده است. این تکنیک نه تنها برای شناسایی مستقیم عوامل بیماریزا به کار میرود، بلکه در بررسی ژنهای مقاومت دارویی، مطالعه تنوع ژنتیکی میکروارگانیسمها، ردیابی اپیدمیولوژیک سویههای پاتوژن و حتی شناسایی میکروبهای غیرقابل کشت نیز نقش کلیدی ایفا میکند. به طور مثال، در تشخیص سریع بیماریهای ویروسی نظیر آنفلوآنزا یا کروناویروسها، PCR نخستین و اصلیترین ابزار مورد استفاده آزمایشگاهها بوده است. همچنین در بیماریهای باکتریایی مانند سل، این روش توانسته زمان تشخیص را از هفتهها به چند ساعت کاهش دهد.
بنابراین میتوان گفت PCR به عنوان یک فناوری بنیادی، نقطه اتصال علم کلاسیک میکروبیولوژی با عصر مدرن زیستشناسی مولکولی است. اصول ساده اما قدرتمند این روش، پایهای برای توسعه نسلهای بعدی تکنیکهای مولکولی فراهم کرده و همچنان نیز بهعنوان ستون اصلی تشخیصهای میکروبیولوژیک باقی مانده است.
تکنیکهای مولکولی مکمل PCR
با وجود اینکه PCR بهعنوان یکی از ستونهای اصلی زیستمولکولی و میکروبیولوژی مدرن شناخته میشود، اما بهتنهایی نمیتواند تمامی نیازهای پژوهشگران و متخصصان تشخیص را برآورده کند. به همین دلیل، در طول سه دهه گذشته مجموعهای از روشهای مکمل توسعه یافتهاند که یا محدودیتهای PCR را برطرف میسازند، یا امکان بررسی دقیقتر و عمیقتر مولکولهای ژنتیکی را فراهم میکنند. این روشها نهتنها در تحقیقات پایه بلکه در زمینههای تشخیصی، اپیدمیولوژیک و حتی درمانی نیز جایگاه ویژهای پیدا کردهاند.
یکی از مهمترین این تکنیکها الکتروفورز ژل آگارز است که بهعنوان یک ابزار سنتی اما همچنان پرکاربرد برای جداسازی و مشاهده محصولات PCR استفاده میشود. این روش امکان تأیید اندازه قطعات DNA تکثیرشده را فراهم میسازد و به پژوهشگر اطمینان میدهد که واکنش تکثیر بهدرستی انجام شده است. علاوه بر آن، الکتروفورز کاپیلاری نیز در سالهای اخیر بهعنوان جایگزینی با دقت بالاتر معرفی شده که توانایی جداسازی قطعات DNA با تفاوتهای بسیار جزئی را دارد.
روش دیگر که بهطور گسترده همراه با PCR بهکار گرفته میشود، توالییابی DNA است. توالییابی نهتنها ماهیت دقیق بازهای نوکلئوتیدی یک قطعه ژنومی را آشکار میسازد، بلکه امکان مقایسه بین سویههای مختلف یک میکروارگانیسم و شناسایی جهشهای کلیدی را فراهم میکند. تکنیکهای کلاسیک مانند روش سنگر و نسلهای جدیدتر توالییابی با توان عملیاتی بالا، بهعنوان مکملی ضروری برای PCR عمل میکنند و از محدودیت آن در تعیین دقیق توالی بازها عبور مینمایند.
از دیگر تکنیکهای مکمل میتوان به کلونینگ مولکولی اشاره کرد. در این روش، محصولات PCR در ناقلهای پلاسمیدی یا ویروسی وارد میشوند و سپس درون سلولهای میزبان تکثیر میگردند. این فرایند علاوه بر تولید مقادیر زیادی از قطعه ژنتیکی مورد نظر، امکان مطالعه عملکرد ژنها، بررسی بیان پروتئینها و حتی ایجاد تغییرات هدفمند در توالی DNA را نیز فراهم میسازد. بهاین ترتیب، کلونینگ یک مسیر تحقیقاتی گسترده را در کنار PCR باز میکند.
تکنیک هی브ریداسیون مولکولی نیز از جمله روشهایی است که در کنار PCR کاربرد دارد. در این روش، از پروبهای نوکلئیک اسیدی برچسبدار برای شناسایی توالیهای خاص استفاده میشود. روشهایی مانند Southern blot و Northern blot به پژوهشگران اجازه میدهند تا حضور یا غیاب یک ژن یا RNA خاص را بررسی کنند. این شیوهها بهویژه در شرایطی که PCR قادر به ارائه اطلاعات کمی یا مکانی نیست، بسیار ارزشمند هستند.
همچنین باید به تکنیکهای ایزوترمال تکثیر اسیدهای نوکلئیک اشاره کرد که امروزه بهعنوان جایگزین یا مکمل PCR توسعه یافتهاند. روشهایی مانند LAMP (Loop-mediated Isothermal Amplification) یا NASBA (Nucleic Acid Sequence-Based Amplification) بدون نیاز به چرخههای دمایی پیچیده، امکان تکثیر سریع و حساس توالیهای ژنی را فراهم میآورند. این فناوریها بهویژه در محیطهای کمامکانات یا برای تشخیصهای سریع در میدان (Point-of-Care) اهمیت بالایی پیدا کردهاند و تا حد زیادی محدودیت تجهیزات پیشرفته مورد نیاز PCR را جبران میکنند.
در کنار این موارد، روشهای پروتئومیکس و بیوانفورماتیک نیز نقش مکمل برای PCR ایفا میکنند. با وجود اینکه PCR در سطح DNA و RNA عمل میکند، اما بسیاری از ویژگیهای میکروارگانیسمها در سطح پروتئین یا شبکههای تنظیمی ژنی آشکار میشود. بنابراین، اتصال دادههای حاصل از PCR به تحلیلهای پروتئینی و بیوانفورماتیکی امکان تفسیر جامعتر نتایج را فراهم میسازد و قدرت پیشبینی پژوهشها را افزایش میدهد.
در مجموع، میتوان گفت که تکنیکهای مولکولی مکمل PCR بهعنوان ابزاری ضروری برای رفع کاستیهای این روش و گسترش دامنه کاربردهای آن مطرح هستند. این روشها در کنار یکدیگر یک جعبهابزار قدرتمند برای میکروبیولوژی مدرن شکل دادهاند که هم در پژوهشهای بنیادی و هم در حوزههای تشخیص بالینی و اپیدمیولوژی جایگاه انکارناپذیری دارند.
تکنیکهای پیشرفته و نوین
رشد روزافزون فناوریهای زیستمولکولی باعث شده است که روشهای کلاسیک مانند PCR و الکتروفورز ژل بهتنهایی پاسخگوی نیازهای پژوهشگران و متخصصان نباشند. در دهههای اخیر مجموعهای از تکنیکهای پیشرفته و نوین توسعه یافتهاند که نهتنها بر محدودیتهای روشهای سنتی غلبه کردهاند، بلکه امکان بررسیهای عمیقتر و دقیقتر را در زمینه میکروبیولوژی فراهم ساختهاند. این تکنیکها با بهرهگیری از پیشرفتهای مهندسی ژنتیک، فناوری نانو، بیوانفورماتیک و رباتیک، انقلابی در تشخیص سریع، تحلیل جامع و مطالعه تعاملات پیچیده میکروارگانیسمها ایجاد کردهاند.
یکی از شاخصترین این فناوریها، Real-Time PCR یا qPCR است که امکان پایش لحظهای تکثیر DNA را فراهم میسازد. این روش برخلاف PCR کلاسیک که تنها در پایان واکنش نتیجه نهایی را نشان میدهد، قادر است در هر چرخه تکثیر میزان محصول تولیدی را اندازهگیری کند. این ویژگی، qPCR را به ابزاری ارزشمند برای تشخیص کمی میکروارگانیسمها، بررسی بار ویروسی و تحلیل سطح بیان ژنها تبدیل کرده است. استفاده از رنگهای فلورسنت یا پروبهای اختصاصی، حساسیت و دقت این تکنیک را تا حد چشمگیری افزایش داده است.
روش دیگر که از جمله دستاوردهای مهم در حوزه تکثیر انتخابی به شمار میرود، Nested PCR است. در این تکنیک دو مجموعه آغازگر متفاوت بهکار میرود که در دو مرحله متوالی عمل میکنند. مرحله نخست موجب تکثیر قطعه هدف اصلی میشود و مرحله دوم با استفاده از آغازگرهای داخلی، قطعه کوتاهتر و اختصاصیتری را تکثیر میکند. این رویکرد، ویژگی اختصاصی بودن و حساسیت PCR را افزایش میدهد و احتمال تولید محصولات غیراختصاصی را به حداقل میرساند. Nested PCR بهویژه در شناسایی میکروارگانیسمهایی با بار میکروبی بسیار پایین یا نمونههایی که دارای DNA آلوده هستند، ارزش بالایی دارد.
یکی دیگر از تکنیکهای نوین، Multiplex PCR است که امکان تکثیر همزمان چندین ژن یا توالی مختلف را در یک واکنش واحد فراهم میآورد. این قابلیت، زمان و هزینه آزمایشها را کاهش داده و باعث میشود که پژوهشگران بتوانند اطلاعات گستردهتری را از یک نمونه منفرد بهدست آورند. این روش در تشخیص همزمان چندین پاتوژن، بررسی ژنهای مقاومت آنتیبیوتیکی و مطالعه تنوع ژنتیکی میکروبی بسیار کاربرد دارد. طراحی دقیق آغازگرها و کنترل شرایط واکنش از الزامات کلیدی برای موفقیت Multiplex PCR بهشمار میرود.
از دیگر تکنیکهای پیشرفته میتوان به Digital PCR (dPCR) اشاره کرد که نسبت به روشهای قبلی دقت بسیار بالاتری دارد. در این فناوری، نمونه به هزاران یا حتی میلیونها واکنش میکروسکوپی تقسیم میشود و سپس تکثیر در سطح تکمولکولی مورد بررسی قرار میگیرد. این ویژگی به پژوهشگران امکان میدهد تا شمارش مطلق مولکولهای DNA یا RNA را انجام دهند، بدون اینکه به منحنیهای استاندارد نیاز داشته باشند. Digital PCR بهخصوص در حوزههایی مانند تشخیص جهشهای نادر، پایش بیماریهای سرطانی و تشخیص ویروسها با بار ویروسی بسیار کم جایگاه ویژهای پیدا کرده است.
پیشرفت دیگر، روشهای ایزوترمال نوین مانند RPA (Recombinase Polymerase Amplification) و HDA (Helicase-dependent Amplification) است که توانایی تکثیر DNA در دمای ثابت را دارند. این تکنیکها بدون نیاز به دستگاه ترموسایکلر، امکان تشخیص سریع و پرتابل را در محیطهای خارج از آزمایشگاه فراهم میسازند. از آنجایی که این روشها در مدت زمان بسیار کوتاه (اغلب کمتر از ۳۰ دقیقه) نتایج را ارائه میدهند، در کنترل عفونتهای واگیر، تستهای بالینی سریع و حتی غربالگری در شرایط میدانی اهمیت بالایی یافتهاند.
توسعه تکنیکهای مبتنی بر ریزتراشههای زیستی (Microarray) نیز انقلابی در مطالعه همزمان هزاران ژن ایجاد کرده است. در این فناوری، هزاران پروب نوکلئیک اسیدی روی یک سطح جامد تثبیت میشوند و امکان شناسایی حضور یا غیاب توالیهای متعدد ژنی در یک آزمایش فراهم میشود. این روش نهتنها برای شناسایی گونههای میکروبی مختلف بلکه برای بررسی الگوهای بیان ژنها در شرایط متفاوت بهکار میرود. با وجود آنکه توالییابی نسل جدید تا حدی جایگزین این تکنیک شده، اما Microarray همچنان در بسیاری از آزمایشگاهها بهعنوان ابزاری ارزشمند باقی مانده است.
در سالهای اخیر، تکنیکهای مبتنی بر CRISPR-Cas نیز بهعنوان روشی نوین در تشخیص مولکولی مطرح شدهاند. این فناوری که در ابتدا برای ویرایش ژنوم توسعه یافت، اکنون بهطور گسترده در زمینه تشخیص سریع و دقیق DNA و RNA بهکار گرفته میشود. سامانههای CRISPR میتوانند با حساسیت بسیار بالا توالیهای هدف را شناسایی کرده و با استفاده از پروتئینهای گزارشگر، سیگنالهای قابل شناسایی ایجاد کنند. این روشها به دلیل سرعت بالا، سادگی و توانایی تشخیص توالیهای بسیار خاص، در حال تبدیل شدن به یکی از ارکان آینده تشخیص مولکولی هستند.
همچنین باید به توالییابی نسل جدید (NGS) بهعنوان یکی از نوآورانهترین ابزارهای امروزی اشاره کرد. این فناوری امکان توالییابی کل ژنوم یا ترانسکریپتوم را با دقت و سرعت بسیار بالا فراهم میسازد. NGS برخلاف روشهای محدود PCR، میتواند اطلاعات جامع و چندبعدی از ساختار و عملکرد میکروارگانیسمها بهدست دهد. استفاده از این تکنیک در مطالعات میکروبیوم، ردیابی تکامل پاتوژنها، شناسایی جهشهای ژنی و اپیدمیولوژی مولکولی اهمیت بیبدیلی دارد.
به طور کلی، میتوان گفت که تکنیکهای پیشرفته و نوین، افقهای جدیدی را در علم میکروبیولوژی گشودهاند. این روشها نهتنها دقت و سرعت تشخیص را ارتقا دادهاند، بلکه امکان درک عمیقتر از پیچیدگیهای ژنتیکی و عملکردی میکروارگانیسمها را نیز فراهم کردهاند. آینده این حوزه بدون شک با ترکیب این فناوریها با هوش مصنوعی، نانوفناوری و سیستمهای خودکار آزمایشگاهی، به سمت تشخیصهای هوشمند و درمانهای شخصیسازیشده حرکت خواهد کرد.
کاربردهای بالینی تکنیکهای مولکولی
تکنیکهای مولکولی، به ویژه PCR و فناوریهای نوین تکثیر و تحلیل DNA و RNA، انقلابی در تشخیص بالینی بیماریها ایجاد کردهاند. این روشها امکان شناسایی دقیق و سریع میکروارگانیسمها را فراهم میکنند و در بسیاری از زمینههای پزشکی نقش حیاتی دارند. کاربردهای بالینی این تکنیکها گسترده است و شامل شناسایی بیماریهای عفونی، بررسی مقاومت دارویی، پایش اپیدمیولوژیک، تشخیص زودهنگام و حتی هدایت درمانهای شخصیسازیشده میشود.
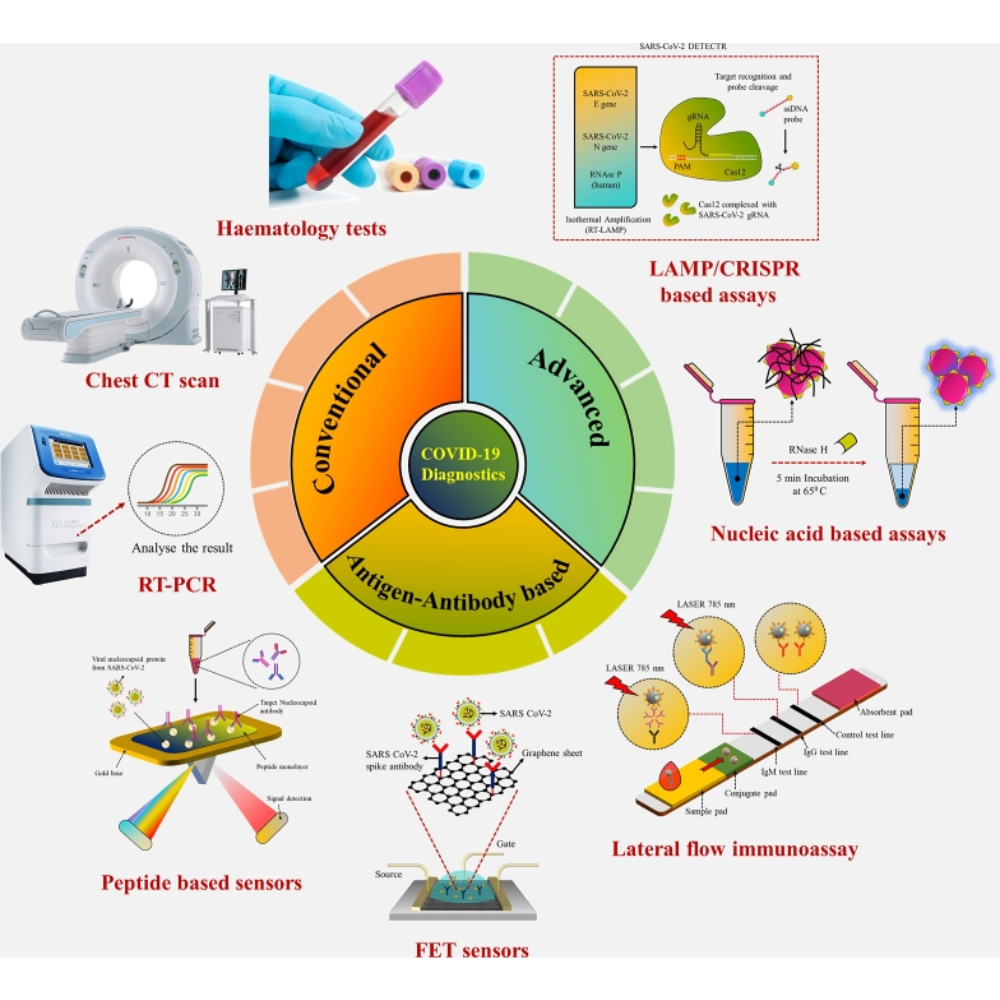
یکی از اصلیترین کاربردها، تشخیص سریع عفونتهای ویروسی و باکتریایی است. در مواردی مانند بیماریهای ویروسی حاد از جمله آنفلوآنزا، HIV و SARS-CoV-2، PCR و تکنیکهای پیشرفته مانند Real-Time PCR توانستهاند زمان تشخیص را از روزها یا هفتهها به چند ساعت کاهش دهند. این سرعت بالا، نه تنها در آغاز درمان مؤثر است بلکه از گسترش بیماری نیز جلوگیری میکند. علاوه بر این، این روشها امکان شناسایی سویههای جدید ویروسی و جهشهای ژنتیکی را نیز فراهم میآورند، که برای برنامهریزی واکسیناسیون و کنترل اپیدمیها حیاتی است.
در زمینه بیماریهای باکتریایی، تکنیکهای مولکولی قادرند پاتوژنهایی که به سختی در محیط کشت رشد میکنند یا در نمونههای پیچیده مانند خون، بافت یا ادرار حضور دارند را شناسایی کنند. به عنوان مثال، در تشخیص سل، که روشهای سنتی آن بسیار زمانبر هستند، PCR توانسته است تشخیص سریع و حساس را ممکن سازد و امکان درمان زودهنگام و کنترل بیماری را افزایش دهد. همچنین، این روشها در تشخیص باکتریهای مقاوم به آنتیبیوتیکها، مانند استافیلوکوکوس اورئوس مقاوم به متیسیلین (MRSA)، کاربرد گستردهای دارند و به انتخاب درمان هدفمند کمک میکنند.
یکی دیگر از کاربردهای حیاتی، بررسی بار میکروبی و سطح بیان ژنهای پاتوژنها است. با استفاده از Real-Time PCR میتوان میزان DNA یا RNA موجود در نمونهها را بهصورت کمی اندازهگیری کرد، که این اطلاعات برای ارزیابی شدت عفونت، پیشبینی پاسخ به درمان و تصمیمگیری در مورد ادامه یا تغییر درمان بسیار مهم است. این کاربرد بهویژه در بیماران با نقص ایمنی یا مبتلایان به بیماریهای مزمن ارزشمند است.
تکنیکهای مولکولی همچنین در تشخیص عفونتهای زخمهای مزمن مانند زخمهای دیابتی پا کاربرد فراوان دارند. این زخمها اغلب دارای میکروارگانیسمهای پیچیده و با بار پایین هستند که تشخیص آنها با روشهای سنتی دشوار است. مطالعات نشان دادهاند که استفاده از PCR و تکنیکهای توالییابی، شناسایی دقیقتر و سریعتر باکتریها و قارچهای موجود در این زخمها را ممکن میسازد و از این طریق باعث بهبود درمان و کاهش خطر عفونتهای سیستمیک میشود.
تکنیکهای مولکولی همچنین در ردیابی و کنترل اپیدمیها نقش کلیدی دارند. با شناسایی ژنهای مقاوم و سویههای خاص میکروارگانیسمها، پژوهشگران و متخصصان بهداشت عمومی میتوانند مسیر انتشار بیماری را ردیابی کنند و اقدامات پیشگیرانه مناسبی را اتخاذ نمایند. این کاربرد در بیمارستانها، مراکز درمانی و محیطهای عمومی اهمیت ویژهای دارد و به کاهش شیوع عفونتهای بیمارستانی کمک میکند.
از دیگر کاربردهای مهم، تشخیص سریع عفونتهای ناشی از میکروارگانیسمهای غیرقابل کشت است. برخی باکتریها و ویروسها بهدلیل نیاز به شرایط خاص یا آهسته رشد بودن، با روشهای کلاسیک قابل شناسایی نیستند. تکنیکهای مولکولی امکان شناسایی این عوامل را بدون نیاز به کشت فراهم میآورند و در نتیجه تشخیص به موقع و درمان مناسب امکانپذیر میشود.
علاوه بر کاربردهای مستقیم در تشخیص، تکنیکهای مولکولی در مدیریت مقاومت دارویی و هدایت درمانهای شخصیسازیشده نیز نقش دارند. با شناسایی ژنهای مقاومت در پاتوژنها، پزشکان میتوانند از انتخاب داروهای غیرموثر جلوگیری کنند و استراتژی درمانی مناسب را اتخاذ نمایند. این کاربرد به کاهش مصرف بیرویه آنتیبیوتیکها و جلوگیری از رشد سویههای مقاوم کمک شایانی میکند.
در نهایت، تکنیکهای مولکولی در پایش عفونتهای سیستمیک، بررسی تعاملات میکروبیوم بدن و مطالعه تغییرات ژنتیکی پاتوژنها نیز کاربرد دارند. این اطلاعات به درک بهتر فرآیند بیماری، شناسایی عوامل خطر و طراحی برنامههای درمانی هدفمند کمک میکنند. استفاده از تکنیکهایی مانند Digital PCR و NGS در این زمینهها به پژوهشگران امکان میدهد تا تحلیلهای بسیار دقیق و چندبعدی انجام دهند و به تصمیمگیریهای بالینی هوشمندانه برسند.
به طور خلاصه، تکنیکهای مولکولی در حوزه بالینی، از تشخیص سریع و دقیق عفونتها گرفته تا مدیریت مقاومت دارویی و هدایت درمانهای شخصیسازیشده، یک ابزار حیاتی محسوب میشوند. این فناوریها نه تنها دقت تشخیص را افزایش میدهند، بلکه زمان درمان را کاهش داده و به کاهش شیوع بیماریها و بهبود نتایج بالینی کمک میکنند.
کاربردهای محیط زیستی و صنعتی
تکنیکهای مولکولی فراتر از کاربردهای بالینی، نقش مهمی در محیط زیست، صنعت و پایش منابع طبیعی ایفا میکنند. این روشها با توانایی شناسایی و اندازهگیری دقیق میکروارگانیسمها و توالیهای ژنتیکی در نمونههای پیچیده، امکان بررسی سلامت محیط، کنترل فرآیندهای صنعتی و ارزیابی ریسکهای زیستی را فراهم کردهاند.
یکی از مهمترین کاربردها، پایش کیفیت آب و منابع آبی است. آبهای سطحی و زیرزمینی میتوانند مخازن پاتوژنهای مختلفی مانند باکتریها، ویروسها و جلبکهای سمی باشند. استفاده از تکنیکهای مولکولی مانند PCR و qPCR، امکان شناسایی سریع این عوامل حتی در غلظتهای بسیار پایین را فراهم میکند. برای مثال، در بررسی انواع جلبکهای مضر (Harmful Algal Bloom) در محیطهای آبی، روشهای مولکولی توانستهاند با دقت بالایی حضور گونههای خاص را پیش از بروز علائم محیطی آشکار کنند و از وقوع حوادث زیستمحیطی پیشگیری نمایند.
در صنایع غذایی و دارویی، تکنیکهای مولکولی کاربردهای گستردهای دارند. شناسایی آلودگی میکروبی در محصولات غذایی، بررسی وجود ژنهای مقاومت دارویی در باکتریها و ارزیابی ایمنی میکروبی فرآوردهها از جمله کاربردهای حیاتی هستند. PCR و تکنیکهای نوین قادرند بدون نیاز به کشت طولانی، حضور پاتوژنها یا میکروارگانیسمهای نامطلوب را در سطح محصول شناسایی کنند. این امر به تولید ایمنتر و کاهش خطرات بهداشتی برای مصرفکنندگان منجر میشود.
یکی دیگر از کاربردهای مهم، کنترل فرآیندهای صنعتی و بیوتکنولوژی است. در صنایع تخمیری، تولید آنتیبیوتیک، آنزیمها و سایر محصولات بیولوژیک، بررسی جمعیت میکروبی و شناسایی گونههای کلیدی اهمیت دارد. استفاده از تکنیکهای مولکولی باعث میشود فرآیندها بهینهسازی شوند، آلودگیهای ناخواسته شناسایی و مدیریت شوند و کیفیت محصول نهایی تضمین شود.
تکنیکهای مولکولی همچنین در پایش خاک و کشاورزی نقش دارند. میکروبهای خاک در چرخههای زیستی و حاصلخیزی زمین اهمیت دارند و شناسایی گونههای مفید یا پاتوژنیک، میتواند به برنامهریزی بهینه مدیریت خاک، استفاده از کودهای زیستی و کاهش خسارتهای ناشی از بیماریهای گیاهی کمک کند. روشهایی مانند qPCR و توالییابی نسل جدید امکان شناسایی دقیق تنوع میکروبی و ارتباط آن با عملکرد محصولات کشاورزی را فراهم میکنند.
در حوزه محیط زیست و اکوسیستمها، تکنیکهای مولکولی امکان شناسایی گونههای نادر، بررسی تنوع میکروبی و پایش تغییرات اکوسیستم را فراهم میکنند. این کاربردها به ویژه در مطالعات میکروبیوم محیطی، پایش آلایندهها و شناسایی میکروبهای زیستتخریبکننده اهمیت دارد. استفاده از PCR و متاژنومیک امکان تشخیص گونههای ناپیدا و ارزیابی سلامت محیط را بدون نیاز به نمونهبرداری گسترده فراهم میسازد.
علاوه بر این، تکنیکهای نوین مانند Digital PCR و روشهای ایزوترمال، امکان تشخیص سریع و قابل حمل در محیطهای دشوار را فراهم کردهاند. این قابلیت در مواقع بحران، مانند ردیابی عوامل بیماریزا در منابع آب، پایش فاضلابها و ارزیابی ریسک زیستی، اهمیت بسیار بالایی دارد و میتواند به تصمیمگیریهای فوری و علمی کمک کند.
در صنایع زیستمحیطی و انرژی نیز کاربردهای گستردهای وجود دارد. شناسایی میکروارگانیسمهای موثر در تولید بیوگاز، تجزیه پسماندها و کاهش آلایندهها، با استفاده از تکنیکهای مولکولی قابل انجام است. این روشها به شناسایی گونههای کلیدی، پایش فرآیندهای زیستی و بهبود عملکرد سیستمهای صنعتی کمک میکنند.
به طور کلی، تکنیکهای مولکولی در محیط زیست و صنعت ابزارهایی ضروری برای پایش سلامت اکوسیستمها، کنترل کیفیت محصولات و بهبود فرآیندهای صنعتی هستند. این فناوریها امکان تصمیمگیری سریع، دقیق و علمی را فراهم میکنند و نقش حیاتی در حفاظت از سلامت عمومی و محیط زیست ایفا میکنند.
مزایا و محدودیتهای تکنیکهای مولکولی
تکنیکهای مولکولی در میکروبیولوژی، به ویژه روشهایی مانند PCR و تکنیکهای پیشرفته آن، انقلابی در تشخیص، پژوهش و پایش محیطی و بالینی ایجاد کردهاند. این روشها مزایای فراوانی دارند که باعث شدهاند به ابزار اصلی در آزمایشگاههای مدرن تبدیل شوند، اما در عین حال محدودیتهایی نیز وجود دارند که باید مد نظر قرار گیرند.
مزایای تکنیکهای مولکولی بسیار گسترده و تاثیرگذار هستند. یکی از مهمترین این مزایا، حساسیت و دقت بالا در تشخیص میکروارگانیسمها است. حتی در نمونههایی با مقدار بسیار اندک DNA یا RNA، این روشها قادر به شناسایی عوامل بیماریزا هستند. حساسیت بالای PCR و تکنیکهای نوین مانند Real-Time PCR و Digital PCR، امکان تشخیص زودهنگام عفونتها و بار ویروسی پایین را فراهم میکند، که در درمانهای بالینی و کنترل اپیدمیها اهمیت حیاتی دارد.
مزیت دیگر، اختصاصیت بالا است. با طراحی دقیق پرایمرها و پروبها، امکان شناسایی توالیهای ژنتیکی خاص فراهم میشود. این ویژگی موجب میشود که PCR و سایر تکنیکهای مولکولی، حتی در حضور میکروبهای متعدد و نمونههای پیچیده، توانایی شناسایی عامل هدف را داشته باشند. این اختصاصیت بالا باعث کاهش نتایج مثبت کاذب و افزایش اعتماد به تشخیص میشود.
تکنیکهای مولکولی همچنین سرعت بالا در تشخیص را ارائه میدهند. برخلاف روشهای سنتی کشت که ممکن است روزها تا هفتهها طول بکشند، PCR و تکنیکهای پیشرفته قادرند در عرض چند ساعت نتایج دقیق ارائه دهند. این سرعت در بیماریهای واگیر و عفونتهای حاد اهمیت حیاتی دارد، زیرا میتواند مسیر درمانی و تصمیمات بالینی را تسریع کند.
یکی دیگر از مزایای برجسته، انعطافپذیری و گستردگی کاربردها است. تکنیکهای مولکولی نه تنها در زمینه تشخیص بالینی کاربرد دارند، بلکه در محیط زیست، صنایع غذایی، صنایع دارویی، کشاورزی و بیوتکنولوژی نیز مورد استفاده قرار میگیرند. قابلیت تطبیق با نمونههای مختلف و محیطهای گوناگون، این روشها را به ابزاری همهجانبه تبدیل کرده است.
با وجود این مزایا، محدودیتهایی نیز وجود دارد که باید مدنظر قرار گیرد. یکی از اصلیترین محدودیتها، نیاز به تجهیزات و زیرساختهای پیشرفته است. اجرای PCR و تکنیکهای نوین نیازمند ترموسایکلر، دستگاههای Real-Time PCR، سیستمهای کنترل کیفی و محیطهای ایزوله برای جلوگیری از آلودگی است. در محیطهای با امکانات محدود، این مسئله میتواند محدودیت ایجاد کند.
محدودیت دیگر، حساسیت زیاد به آلودگی است. حتی وجود مقادیر ناچیز DNA یا RNA خارجی میتواند منجر به تولید نتایج مثبت کاذب شود. بنابراین، رعایت استانداردهای سختگیرانه کنترل کیفی، استفاده از تجهیزات تمیز و محیطهای جداگانه برای آمادهسازی و تکثیر نمونهها الزامی است.
یکی دیگر از محدودیتها، هزینه بالای برخی تکنیکها است. تجهیز آزمایشگاه به دستگاههای پیشرفته، خرید کیتها و مواد شیمیایی تخصصی و استخدام نیروی متخصص، هزینههای قابل توجهی ایجاد میکند. به همین دلیل، در برخی مناطق و مراکز درمانی با منابع محدود، اجرای گسترده تکنیکهای مولکولی ممکن است دشوار باشد.
محدودیت دیگر، نیاز به طراحی دقیق آغازگرها و پروبها است. طراحی ناکافی میتواند منجر به تولید محصولات غیر اختصاصی، کاهش حساسیت یا ایجاد نتایج منفی کاذب شود. این موضوع به تجربه و دانش متخصصان در زمینه ژنتیک مولکولی وابسته است و نیازمند آزمون و خطا و بهینهسازی مکرر است.
در نهایت، باید توجه داشت که تکنیکهای مولکولی اطلاعات زیستی محدود به سطح ژنتیکی و مولکولی ارائه میدهند. این روشها نمیتوانند مستقیماً وضعیت بالینی بیمار، میزان التهاب یا پاسخ ایمنی را اندازهگیری کنند و در بسیاری از موارد نیاز به ترکیب با روشهای بالینی و پاراکلینیکی دارند.
با وجود محدودیتها، مزایا و قابلیتهای تکنیکهای مولکولی باعث شدهاند که این روشها به ستون فقرات آزمایشگاههای میکروبیولوژی مدرن تبدیل شوند و همچنان به توسعه و نوآوری در این حوزه ادامه دهند. با پیشرفت فناوری، بسیاری از محدودیتهای فعلی مانند نیاز به تجهیزات پیشرفته، هزینه و حساسیت به آلودگی در حال کاهش هستند و آیندهای روشن برای کاربرد گستردهتر این تکنیکها پیشبینی میشود.
راهاندازی و توسعه آزمایشگاههای مولکولی
راهاندازی یک آزمایشگاه مولکولی مدرن، به ویژه برای کاربردهای میکروبیولوژی بالینی، محیط زیستی و صنعتی، نیازمند برنامهریزی دقیق، زیرساختهای مناسب و رعایت استانداردهای ایمنی و کیفی است. با توجه به اهمیت تشخیص سریع و دقیق میکروارگانیسمها و همچنین توسعه تحقیقات ژنتیکی، ایجاد یک مرکز مولکولی کارآمد میتواند نقش حیاتی در سلامت عمومی، صنعت و پژوهش ایفا کند.
اولین گام در راهاندازی آزمایشگاه مولکولی، تعیین هدف و دامنه فعالیتها است. آزمایشگاهها میتوانند بر تشخیص بالینی متمرکز باشند، یا در حوزه پایش محیط زیست، صنایع غذایی و دارویی فعالیت کنند. تعیین هدف، تاثیر مستقیمی بر انتخاب تجهیزات، نوع تکنیکها، نیروی انسانی و بودجه مورد نیاز دارد. به عنوان مثال، آزمایشگاهی که تمرکز آن روی تشخیص عفونتهای بیمارستانی است، نیازمند دستگاههای Real-Time PCR، Digital PCR و تجهیزات کنترل کیفی دقیق است، در حالی که آزمایشگاه محیط زیستی ممکن است نیاز به میکروآرایهها، متاژنومیک و سیستمهای نمونهبرداری میدانی داشته باشد.
گام بعدی، طراحی فیزیکی آزمایشگاه و تفکیک مناطق کاری است. یکی از اصول اساسی در میکروبیولوژی مولکولی، جلوگیری از آلودگی نمونهها و تولید نتایج مثبت کاذب است. بنابراین، آزمایشگاه باید به صورت منطقی به بخشهای مختلف تقسیم شود: منطقه آمادهسازی نمونه، منطقه تکثیر و واکنش، و منطقه آنالیز و جمعآوری دادهها. استفاده از هودهای لامینار، تجهیزات ضدآلودگی و سیستمهای تهویه مناسب از الزامات ضروری است.
انتخاب تجهیزات و مواد مصرفی نیز از اهمیت بالایی برخوردار است. تجهیزات اساسی شامل ترموسایکلرهای استاندارد و Real-Time، سیستمهای الکتروفورز، میکروسکوپ، تجهیزات ایزولهکننده، سیستمهای خنککننده و یخچالهای مخصوص نمونهها هستند. همچنین، استفاده از کیتها و مواد مصرفی با کیفیت، پروبها و پرایمرهای اختصاصی و محلولهای بافر استاندارد، حساسیت و دقت آزمایشها را تضمین میکند.
یکی دیگر از مؤلفههای کلیدی، نیروی انسانی متخصص است. کار با تکنیکهای مولکولی نیازمند دانش عمیق در زمینه ژنتیک، میکروبیولوژی، بیوشیمی و ایمنی زیستی است. آموزش مستمر کارکنان برای بهکارگیری تکنیکهای جدید، رعایت استانداردهای کیفیت و کنترل آلودگی، و توانایی تحلیل دادهها، موفقیت و اعتبار آزمایشگاه را تضمین میکند.
کنترل کیفیت و تضمین دقت آزمایشها بخش جداییناپذیر از توسعه آزمایشگاه مولکولی است. این شامل استفاده از نمونههای کنترل مثبت و منفی، اجرای آزمونهای اعتبارسنجی، رعایت پروتکلهای استاندارد و نظارت مستمر بر تجهیزات میشود. آزمایشگاههای موفق، برنامههای کنترل کیفیت داخلی و خارجی را به طور منظم اجرا میکنند تا قابلیت اطمینان نتایج و صحت تشخیص تضمین شود.
در کنار جنبههای فنی، ایمنی زیستی و مدیریت پسماندها از اهمیت ویژهای برخوردار است. نمونههای بالینی و محیطی ممکن است حاوی پاتوژنهای بالقوه خطرناک باشند. بنابراین، رعایت سطوح ایمنی زیستی، استفاده از تجهیزات حفاظت فردی، و مدیریت صحیح پسماندهای عفونی از اصول ضروری محسوب میشوند. استانداردهای جهانی مانند BSL-2 و BSL-3 میتوانند راهنمای مفیدی برای طراحی ایمنی آزمایشگاهها باشند.
علاوه بر راهاندازی اولیه، توسعه آزمایشگاه به فناوریهای نوین اهمیت دارد. ارتقاء تجهیزات به دستگاههای Digital PCR، توالییابی نسل جدید، سامانههای اتوماتیک و نرمافزارهای پیشرفته تحلیل داده، باعث افزایش دقت، کاهش خطاهای انسانی و تسریع روند آزمایشها میشود. همچنین، ایجاد ارتباط با مراکز تحقیقاتی و شبکههای اپیدمیولوژیک، امکان بهاشتراکگذاری دادهها و بهرهگیری از تجربیات جهانی را فراهم میکند.
یکی از چالشهای عمده، هزینههای بالای راهاندازی و نگهداری است. به همین دلیل، برنامهریزی بودجهای دقیق، اولویتبندی تجهیزات و بررسی منابع تامین مالی از اهمیت بالایی برخوردار است. در بسیاری از کشورها، همکاری با دانشگاهها، مراکز تحقیقاتی و صنایع مرتبط میتواند به کاهش هزینهها و تسهیل توسعه آزمایشگاه کمک کند.
در نهایت، راهاندازی و توسعه آزمایشگاههای مولکولی نه تنها نیازمند دانش فنی و سرمایهگذاری مالی است، بلکه به برنامهریزی استراتژیک، رعایت استانداردهای ایمنی و کیفیت، و بهرهگیری از نیروهای متخصص متعهد نیز وابسته است. آزمایشگاههای موفق، با رعایت این اصول، قادر خواهند بود به طور مؤثر در حوزه تشخیص بالینی، پایش محیط زیست، کنترل کیفیت صنعتی و پژوهشهای علمی فعالیت کنند و نقش حیاتی در سلامت عمومی و توسعه علم میکروبیولوژی ایفا نمایند.
آینده تکنیکهای مولکولی در میکروبیولوژی
با پیشرفت سریع علوم زیستی و فناوریهای مولکولی، آینده میکروبیولوژی مولکولی نویدبخش تغییرات اساسی در نحوه تشخیص، مطالعه و مدیریت میکروارگانیسمها است. تکنیکهای مولکولی همچنان در حال تکامل هستند و با ترکیب نوآوریهای بیوتکنولوژی، نانوفناوری، هوش مصنوعی و دادهکاوی، افقهای جدیدی در زمینه تشخیص سریع، تحلیل دقیق و درک عمیق از سیستمهای میکروبی ایجاد میکنند.
یکی از مهمترین روندها در آینده، ادغام فناوریهای مولکولی با هوش مصنوعی و یادگیری ماشین است. حجم عظیمی از دادههای ژنتیکی و مولکولی که توسط PCR، qPCR، Digital PCR و NGS تولید میشود، نیازمند تحلیل دقیق و سریع است. الگوریتمهای پیشرفته میتوانند الگوهای پیچیده دادهها را شناسایی کنند، نتایج آزمایشها را تفسیر کرده و حتی پیشبینیهای بالینی و محیطی ارائه دهند. این رویکرد نه تنها دقت تشخیص را افزایش میدهد، بلکه تصمیمگیری بالینی و مدیریتی را سریعتر و علمیتر میکند.
توسعه تکنیکهای قابل حمل و ایزوترمال، مانند RPA و LAMP، آینده تشخیص مولکولی را به سمت دستگاههای میدانی و Point-of-Care هدایت میکند. این فناوریها قادرند بدون نیاز به تجهیزات پیچیده، در محیطهای خارج از آزمایشگاه و مناطق با منابع محدود، تشخیص سریع و دقیق ارائه دهند. انتظار میرود که در آینده، این ابزارها به صورت موبایل و کوچکشده در دسترس پزشکان، متخصصان محیط زیست و صنایع قرار گیرند.
Digital PCR و تکنیکهای تکمولکولی نیز در حال توسعه هستند تا حساسیت و دقت تشخیص را بیش از پیش افزایش دهند. با قابلیت شمارش مطلق مولکولها، این روشها به ویژه در تشخیص جهشهای ژنتیکی نادر، پایش عفونتهای کمبار و مطالعات میکروبیوم بدن کاربرد گسترده خواهند داشت. انتظار میرود که نسخههای خودکار و ترکیبشده با نرمافزارهای هوشمند، توانایی انجام آزمایشهای دقیق با حداقل خطای انسانی را فراهم کنند.
توالییابی نسل جدید (NGS) و متاژنومیک نیز آیندهای درخشان دارند. این فناوریها امکان شناسایی کامل میکروارگانیسمها، بررسی تنوع ژنتیکی و مطالعه تعاملات پیچیده بین گونهها را فراهم میکنند. انتظار میرود که NGS به سمت تشخیص بالینی استاندارد و روتین حرکت کند و اطلاعات جامع ژنتیکی و اپیدمیولوژیک را در زمان کوتاه ارائه دهد. با کاهش هزینهها و افزایش سرعت، این تکنیکها میتوانند به ابزار روزمره آزمایشگاهها تبدیل شوند.
در آینده، ترکیب CRISPR-Cas با تشخیص مولکولی نقش بسیار مهمی ایفا خواهد کرد. سیستمهای مبتنی بر CRISPR میتوانند با دقت بالا توالیهای خاص DNA و RNA را شناسایی کرده و پاسخهای فلورسانت یا الکتریکی تولید کنند. این تکنولوژی، تشخیص سریع، اختصاصی و مقرونبهصرفه را ممکن میسازد و حتی در تشخیص ویروسها، جهشهای ژنتیکی و بیماریهای نادر کاربرد خواهد داشت.
یکی دیگر از پیشرفتهای آینده، اتوماسیون و رباتیک در آزمایشگاههای مولکولی است. سیستمهای خودکار قادر خواهند بود نمونهها را آمادهسازی، واکنشها را انجام و دادهها را تحلیل کنند. این اتوماسیون، علاوه بر افزایش سرعت و دقت، خطاهای انسانی را کاهش داده و قابلیت پردازش حجم بالای نمونهها را فراهم میکند.
از منظر محیط زیستی و صنعتی، تکنیکهای مولکولی در آینده میتوانند پایش هوشمند اکوسیستمها، شناسایی سریع آلایندهها و بهینهسازی فرآیندهای صنعتی را ممکن سازند. ترکیب سنسورهای بیولوژیکی با PCR و سایر روشهای مولکولی، امکان پایش لحظهای میکروارگانیسمها و شرایط محیطی را فراهم خواهد کرد. این قابلیت میتواند به پیشگیری از بحرانهای زیستی و بهبود بهرهوری صنعتی کمک کند.
چالشهای آینده شامل مدیریت حجم عظیم دادهها، هزینههای تجهیزات پیشرفته، نیاز به نیروی متخصص و ایجاد استانداردهای بینالمللی برای تضمین کیفیت و صحت نتایج است. با این حال، روند فعلی نویدبخش کاهش این محدودیتها است، بهویژه با کاهش هزینه دستگاهها، گسترش آموزشهای تخصصی و توسعه پروتکلهای استاندارد.
به طور خلاصه، آینده تکنیکهای مولکولی در میکروبیولوژی با ترکیب نوآوریهای فناوری، هوش مصنوعی و اتوماسیون، منجر به تشخیصهای سریعتر، دقیقتر و هوشمندتر خواهد شد. این پیشرفتها امکان مطالعه جامع میکروارگانیسمها، بهبود درمانهای بالینی، پایش محیط زیست و مدیریت فرآیندهای صنعتی را فراهم میکنند و جایگاه مولکولی میکروبیولوژی را به عنوان ستون فقرات علم زیستشناسی مدرن تثبیت میسازد.
جمعبندی و نتیجهگیری
تکنیکهای مولکولی، به ویژه PCR و فناوریهای تکمیلی آن، تحولی بنیادین در میکروبیولوژی و تشخیص بیماریها ایجاد کردهاند. این روشها با فراهم آوردن امکان شناسایی دقیق و سریع میکروارگانیسمها، جایگزین روشهای سنتی کشت و شناسایی شدهاند و در بسیاری از حوزهها از جمله بالینی، محیط زیستی و صنعتی کاربرد فراوان دارند.
در این مقاله، ابتدا به تاریخچه و توسعه تکنیکهای مولکولی پرداختیم و دیدیم که چگونه از کشف DNA و RNA تا اختراع PCR و تکامل فناوریهای Real-Time، Digital PCR و توالییابی نسل جدید، مسیر طولانی و در عین حال پرشتابی طی شده است. این پیشرفتها نشاندهنده نقش محوری تحقیقات پایه در توسعه ابزارهای کاربردی و تأثیر آنها بر سلامت و صنعت است.
بخش بعدی، اصول و پایههای PCR را بررسی کرد و نشان داد که چگونه فرآیندهای ساده تکثیر DNA، با طراحی دقیق پرایمرها و چرخههای حرارتی، به ابزاری قدرتمند برای تشخیص و شناسایی میکروبها تبدیل شدهاند. این اصول پایه، اساس بسیاری از روشهای پیشرفتهتر و نوین مولکولی را تشکیل میدهند.
همچنین، در بخش تکنیکهای مولکولی مکمل PCR، روشهایی مانند RT-PCR، Nested PCR، Multiplex PCR و تکنیکهای ایزوتورمال معرفی شدند. این روشها با افزایش حساسیت، اختصاصیت و سرعت تشخیص، امکان شناسایی پیچیدهترین نمونهها و عوامل بیماریزا را فراهم کردهاند و در پژوهشها و تشخیصهای بالینی، جایگاه ویژهای دارند.
در بخش تکنیکهای پیشرفته و نوین، ابزارهایی مانند Digital PCR، توالییابی نسل جدید، متاژنومیک و CRISPR-Cas معرفی شدند که افقهای جدیدی برای تحلیل دقیق ژنتیکی، شناسایی جهشهای نادر و پایش میکروبیوم ارائه میدهند. این پیشرفتها امکان تشخیص زودهنگام، پایش مقاومها و تحلیلهای جامع محیطی و بالینی را فراهم میکنند.
کاربردهای بالینی تکنیکهای مولکولی نشان داد که این روشها میتوانند عفونتهای حاد و مزمن، بیماریهای نادر و مقاوم به دارو را سریع و دقیق تشخیص دهند و به تصمیمگیری درمانی بهینه کمک کنند. تشخیص سریع و اختصاصی، پایش بار میکروبی و ردیابی سویهها، امکان مدیریت بهتر بیمار و کاهش گسترش بیماریها را فراهم میآورد.
در بخش کاربردهای محیط زیستی و صنعتی، نشان داده شد که تکنیکهای مولکولی نه تنها در محیطهای آزمایشگاهی بلکه در پایش آب، خاک، صنایع غذایی و فرآیندهای بیوتکنولوژیک نیز نقش حیاتی دارند. این روشها امکان ارزیابی سلامت اکوسیستمها، شناسایی آلایندهها و کنترل کیفیت محصولات صنعتی را فراهم کردهاند و با افزایش دقت و سرعت، به ابزارهای کلیدی در مدیریت محیط زیست و صنعت تبدیل شدهاند.
بخش مزایا و محدودیتهای تکنیکهای مولکولی به درک عمیق از توانمندیها و محدودیتهای این روشها کمک کرد. مزایای اصلی شامل حساسیت و اختصاصیت بالا، سرعت تشخیص و قابلیت تطبیق با نمونهها و محیطهای مختلف بود، در حالی که محدودیتها شامل هزینه، نیاز به تجهیزات پیشرفته، حساسیت به آلودگی و نیاز به نیروی متخصص بود. شناخت این مزایا و محدودیتها، راهگشای تصمیمگیریهای بالینی و توسعه آزمایشگاهها است.
در ادامه، راهاندازی و توسعه آزمایشگاههای مولکولی تشریح شد و نشان داده شد که موفقیت یک آزمایشگاه مولکولی به برنامهریزی دقیق، طراحی فیزیکی مناسب، تجهیزات پیشرفته، نیروی انسانی متخصص و رعایت استانداردهای ایمنی و کیفیت وابسته است. این اصول، پایهای برای تولید نتایج قابل اعتماد و قابل اتکا در حوزههای بالینی، پژوهشی و صنعتی فراهم میآورند.
در بخش آینده تکنیکهای مولکولی، روندهای نوین مانند ترکیب با هوش مصنوعی، توسعه ابزارهای قابل حمل، Digital PCR، توالییابی نسل جدید، CRISPR و اتوماسیون رباتیک بررسی شد. این پیشرفتها آینده میکروبیولوژی مولکولی را به سمت تشخیصهای سریعتر، دقیقتر، هوشمندتر و گستردهتر سوق میدهند و نشاندهنده نقش پایدار و رو به رشد این فناوریها در علم و صنعت هستند.
به طور خلاصه، تکنیکهای مولکولی ستون فقرات میکروبیولوژی مدرن به شمار میآیند. این روشها با افزایش دقت، سرعت و اختصاصیت، نقش کلیدی در تشخیص بیماریها، پایش محیط زیست و بهبود فرآیندهای صنعتی ایفا میکنند. با پیشرفت فناوری، کاهش محدودیتها و توسعه تجهیزات و آموزش متخصصان، انتظار میرود که کاربردهای این تکنیکها گستردهتر، دقیقتر و مقرونبهصرفهتر شوند و جایگاه آنها به عنوان ابزار اصلی میکروبیولوژی در قرن بیست و یکم تثبیت گردد.
نتیجهگیری نهایی این است که تکنیکهای مولکولی، با توجه به حساسیت بالا، سرعت تشخیص، انعطافپذیری و قابلیت توسعه، ابزار بیبدیلی برای میکروبیولوژی بالینی، محیط زیستی و صنعتی هستند. سرمایهگذاری در توسعه این فناوریها، آموزش متخصصان و ایجاد زیرساختهای مناسب، موجب افزایش کیفیت تشخیص، مدیریت بهتر بیماریها و حفاظت از محیط زیست خواهد شد.