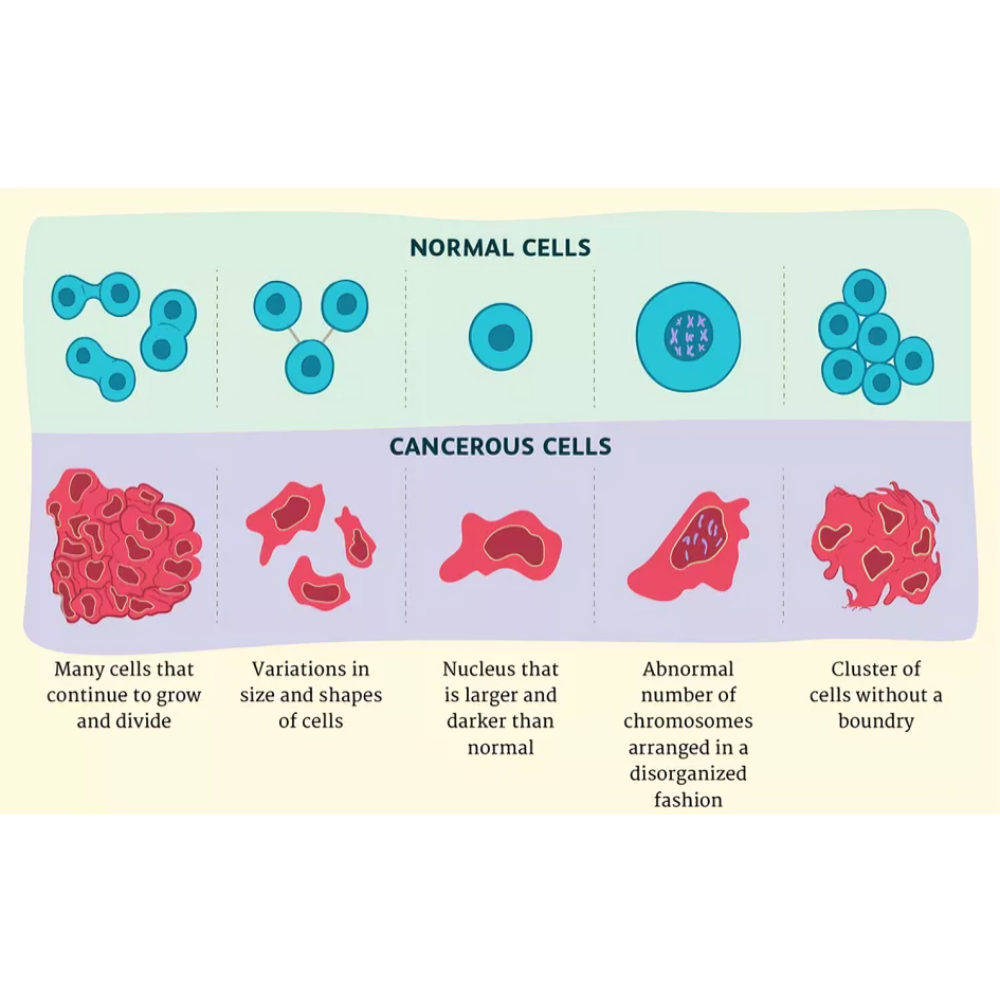
مقایسه ساختار سلولی در سرطان و سلول طبیعی
مقدمه
سرطان یکی از پیچیدهترین و مرموزترین بیماریهای انسان است که هر ساله میلیونها نفر را در سراسر جهان تحت تأثیر قرار میدهد. این بیماری ناشی از تغییرات کنترلنشده در سلولها است، بهگونهای که سلولهای طبیعی، که به طور معمول دارای چرخه رشد و تقسیم منظم هستند، دچار اختلال شده و شروع به تکثیر بیرویه میکنند. مطالعه سلولهای سرطانی و مقایسه آنها با سلولهای طبیعی نه تنها به درک بهتر مکانیسمهای بیماری کمک میکند، بلکه پایهای برای توسعه درمانهای هدفمند و پیشگیری از پیشرفت سرطان فراهم میسازد.
سلولهای طبیعی به گونهای طراحی شدهاند که تعادل بین تقسیم سلولی، مرگ سلولی برنامهریزی شده (اپوپتوز) و عملکردهای متابولیک را حفظ کنند. این تعادل برای حفظ سلامت بافتها و عملکرد کلی اندامها حیاتی است. در مقابل، سلولهای سرطانی ویژگیهای بسیار متفاوتی دارند؛ آنها نه تنها به تقسیم غیرقابل کنترل میپردازند، بلکه توانایی مهاجرت، بقا در محیطهای نامطلوب و مقاومت در برابر داروهای شیمیدرمانی را نیز کسب میکنند.
یکی از نکات کلیدی در مطالعه سرطان، تغییرات ساختاری و مورفولوژیک سلولهای سرطانی است. این تغییرات شامل تغییر در اندازه و شکل سلول، اختلال در اسکلت سلولی، تغییرات هستهای و کروموزومی و همچنین تغییرات در غشای سلولی میشوند. این ویژگیها باعث میشوند سلولهای سرطانی انعطافپذیری بیشتری داشته باشند و بتوانند از بافتهای اطراف عبور کرده و به سایر اندامها منتقل شوند.
علاوه بر تغییرات داخلی سلول، میکرو محیط تومور نقش حیاتی در بازبرنامهریزی سلولهای سرطانی ایفا میکند. این محیط شامل ماتریکس خارج سلولی، سلولهای ایمنی، رگهای خونی و پیامرسانهای شیمیایی است که همگی در رشد، بقا و مهاجرت سلولهای سرطانی مؤثرند. تعامل بین سلولهای سرطانی و میکرو محیط آنها، فرآیندی پیچیده و پویا است که مطالعه آن به فهم بهتر مکانیزمهای متاستاز و مقاومت درمانی کمک میکند.
هدف این مقاله ارائه یک مرور جامع و علمی بر تفاوتهای ساختاری و عملکردی سلولهای طبیعی و سرطانی است. در این مقاله، خواننده با ویژگیهای مورفولوژیک، مولکولی و بیومکانیکی سلولهای سرطانی، تغییرات ناشی از میکرو محیط تومور و روشهای مدرن آنالیز سلولی آشنا خواهد شد. همچنین، چشماندازهای آینده در تحقیقات سلول سرطانی و کاربردهای بالینی این دانش نیز بررسی خواهد شد.
با مطالعه این مقاله، پژوهشگران، پزشکان و مخاطبان علاقهمند قادر خواهند بود تا تصویر کاملی از تفاوتهای سلول طبیعی و سرطانی و مکانیسمهای تغییرات سلولی به دست آورند، که این امر میتواند به توسعه راهکارهای درمانی مؤثر و شخصیسازیشده کمک کند.
اصول ساختار سلولی در سلولهای طبیعی
سلولهای طبیعی واحدهای بنیادی زندگی هستند و سالم بودن ساختار آنها برای حفظ عملکرد مناسب بافتها و اندامها ضروری است. هر سلول طبیعی دارای اجزای مشخص و سازمانیافتهای است که در هماهنگی کامل با یکدیگر عمل میکنند. این ساختار به سلول اجازه میدهد تا چرخه سلولی، متابولیسم، ارتباط با سلولهای دیگر و پاسخ به محیط را به طور بهینه مدیریت کند.
هسته و کنترل ژنتیکی
هسته به عنوان مرکز فرماندهی سلول، مسئول ذخیره و انتقال اطلاعات ژنتیکی است. DNA موجود در هسته به شکل کروماتین سازماندهی شده و با پروتئینهای مختلف مانند هیستونها تعامل دارد تا رونویسی ژنها و تکثیر سلولی تحت کنترل دقیق باشد. هسته سلول طبیعی دارای ساختاری منظم است که شامل غشای هستهای، کروموزومها و نوکلئولوس میشود. این ساختار به سلول امکان میدهد تا پاسخهای سریع به سیگنالهای محیطی داشته باشد و از تغییرات غیرقابل کنترل ژنتیکی جلوگیری کند.
سیتوپلاسم و اندامکها
سیتوپلاسم محیطی است که تمام اندامکهای سلول در آن قرار دارند و محل اصلی فرآیندهای متابولیک، تولید انرژی و سنتز پروتئینها است. اندامکهای کلیدی سلول شامل:
-
میتوکندری: مسئول تولید انرژی به شکل ATP و تنظیم متابولیسم سلولی است.
-
شبکه آندوپلاسمی : شامل شبکه صاف و خشن است و در سنتز پروتئینها و چربیها نقش دارد.
-
دستگاه گلژی : مسئول پردازش، بستهبندی و انتقال مولکولها به نقاط مختلف سلول است.
-
لیزوزومها و پروتئازومها: نقش مهمی در هضم مواد زائد و تجزیه پروتئینهای آسیبدیده دارند.
اسکلت سلولی
یکی از اجزای حیاتی سلولهای طبیعی، اسکلت سلولی است که شامل میکروفیلامنتها، میکروتوبولها و فیلامنتهای میانی میشود. این ساختار سه بعدی به سلول امکان میدهد تا:
-
شکل خود را حفظ کند.
-
مواد داخل سلول را جابهجا کند.
-
تقسیم سلولی منظم داشته باشد.
-
به محرکهای مکانیکی و شیمیایی پاسخ دهد.
میکروتوبولها به ویژه در تقسیم کروموزومها در طول میتوز نقش کلیدی دارند، در حالی که میکروفیلامنتها مسئول حرکت و تغییر شکل سلول هستند. فیلامنتهای میانی نیز به حفظ یکپارچگی ساختاری و مقاومت سلول در برابر فشارهای مکانیکی کمک میکنند.
غشای سلولی و ارتباط با محیط
غشای سلولی یک سد نیمهتراوا است که سلول را از محیط بیرونی جدا میکند و ارتباط و تبادل مواد با محیط را ممکن میسازد. این غشا شامل لیپیدها، پروتئینهای غشایی و گلیکوپروتئینها است که در:
-
انتقال یونها و مولکولها
-
دریافت سیگنالهای شیمیایی و هورمونی
-
اتصال به سلولهای دیگر و ماتریکس خارج سلولی
نقش حیاتی دارند. همچنین، غشای سلولی طبیعی قابلیت تنظیم و پاسخ به تغییرات محیطی را دارد، به طوری که سلول تنها در شرایط مناسب تقسیم یا فعالیت میکند.
چرخه سلولی و کنترل رشد
سلولهای طبیعی چرخه سلولی منظم دارند که شامل فازهای G1، S، G2 و M میشود. در هر مرحله، چکپوینتهای کنترل کیفیت وجود دارد تا از تقسیم سلولهای آسیبدیده جلوگیری شود. این مکانیسمها باعث میشوند سلولهای طبیعی رشد کنترلشده، تعمیر DNA و تقسیم صحیح کروموزومها را تجربه کنند.
ارتباط سلول با ماتریکس خارج سلولی و سلولهای اطراف
سلولهای طبیعی با ماتریکس خارج سلولی (ECM) و سلولهای همسایه ارتباط مستمر دارند. این ارتباط از طریق:
-
گیرندههای چسبندگی سلولی مانند اینترگرینها
-
پیامرسانهای شیمیایی
-
سیگنالهای مکانیکی
صورت میگیرد. این تعاملها باعث میشوند سلولها از نظر مکان، شکل و عملکرد بافتی هماهنگ باقی بمانند و از رشد غیرطبیعی جلوگیری کنند.
خلاصه بخش:
سلولهای طبیعی دارای سازماندهی دقیق و هماهنگ در هسته، سیتوپلاسم، اسکلت سلولی و غشا هستند و از طریق چرخه سلولی کنترلشده و ارتباط با محیط، عملکرد بهینه خود را حفظ میکنند. هر گونه اختلال در این سیستمها میتواند زمینهساز بیماریهایی مانند سرطان شود.
ویژگیهای ساختاری سلولهای سرطانی
سلولهای سرطانی با سلولهای طبیعی تفاوتهای بنیادینی دارند که نه تنها در عملکرد، بلکه در ساختار سلولی و مورفولوژی آنها کاملاً مشهود است. این تغییرات ساختاری باعث میشود سلولهای سرطانی توانایی تکثیر غیرقابل کنترل، مهاجرت و مقاومت در برابر درمانها را پیدا کنند.
تغییر شکل و اندازه سلول
یکی از بارزترین ویژگیهای سلولهای سرطانی، تغییرات مورفولوژیک چشمگیر است. این سلولها معمولاً:
-
شکل نامنظم و غیرمتقارن دارند.
-
اندازه آنها نسبت به سلولهای طبیعی متغیر و اغلب بزرگتر است.
-
توانایی تغییر سریع شکل برای عبور از بافتها و ورود به گردش خون را دارند.
مطالعات نشان دادهاند که این تغییرات در شکل و اندازه، نقش مهمی در مهاجرت و متاستاز سلولهای سرطانی ایفا میکنند و انعطافپذیری آنها را افزایش میدهند.
نرمی و الاستیسیته سلولهای سرطانی
سلولهای سرطانی معمولاً از سلولهای طبیعی نرمتر هستند. این ویژگی به آنها اجازه میدهد تا راحتتر از موانع بافتی عبور کنند و در رگهای خونی یا لنفاوی حرکت کنند. تحقیقات اخیر با استفاده از روشهای میکروسکوپی نیروی اتمی (AFM) نشان داده است که کاهش سفتی سلولی با افزایش توانایی مهاجرت و متاستاز ارتباط مستقیم دارد.
تغییرات هستهای و کروموزومی
هسته سلولهای سرطانی بزرگتر، نامنظم و پر از کروماتین متراکم و پراکنده است. این سلولها معمولاً دارای نقص در کروموزومها، جهشهای ژنتیکی و ناپایداری ژنتیکی هستند که منجر به تقسیم غیرقابل کنترل میشود. چنین تغییراتی باعث میشوند سلولهای سرطانی:
-
چرخه سلولی را بدون کنترل طی کنند.
-
پاسخ طبیعی به سیگنالهای توقف رشد را نادیده بگیرند.
-
تمایل بیشتری به تکثیر سریع داشته باشند.
اختلال در اسکلت سلولی
اسکلت سلولی سلولهای سرطانی نیز دچار بازآرایی و ناپایداری میشود. تغییرات در میکروفیلامنتها، میکروتوبولها و فیلامنتهای میانی باعث میشود که:
-
سلولها انعطافپذیرتر و متحرکتر شوند.
-
قدرت چسبندگی به ماتریکس خارج سلولی کاهش یابد.
-
قابلیت عبور از سدهای بافتی و نفوذ به اندامهای دیگر افزایش یابد.
این تغییرات ساختاری در اسکلت سلولی، یکی از عوامل کلیدی در فرایند EMT (Epithelial-to-Mesenchymal Transition) و متاستاز است.
تغییرات در غشای سلولی و مقاومت دارویی
غشای سلولهای سرطانی نیز نسبت به سلولهای طبیعی متفاوت است. این تغییرات شامل:
-
افزایش غلظت و تغییر ترکیب لیپیدها و پروتئینها
-
حضور گیرندههای ویژه که سیگنالهای رشد و بقا را تقویت میکنند.
-
ایجاد موانع در برابر ورود داروها و ترکیبات سمی
است که باعث میشود سلولهای سرطانی در برابر شیمیدرمانی و استرسهای محیطی مقاوم باشند. به عنوان مثال، افزایش سنتز چربیهای غشایی (de novo lipogenesis) به سلولها کمک میکند تا از آزادسازی رادیکالهای آزاد و آسیبهای دارویی جلوگیری کنند.
تغییرات سیتوپلاسمی و اندامکی
در سلولهای سرطانی، اندامکها نیز تغییرات قابل توجهی دارند:
-
میتوکندریها : اغلب بزرگتر و پر از جهشهای متابولیک هستند که به تولید انرژی غیرمتعارف و مقاومت به استرس اکسیداتیو کمک میکنند.
-
لیزوزومها و پروتئازومها : فعالیت آنها افزایش مییابد تا سلولهای سرطانی بتوانند مواد زائد و داروهای شیمیدرمانی را بهتر دفع کنند.
-
شبکه آندوپلاسمی و دستگاه گلژی : بازآرایی شده و در مسیرهای رشد و مقاومت سلولی نقش دارند.
نکات کلیدی در تغییرات ساختاری سلولهای سرطانی
به طور خلاصه، ویژگیهای ساختاری سلولهای سرطانی عبارتند از:
-
تغییر شکل و اندازه نامنظم
-
کاهش سفتی و افزایش انعطافپذیری
-
اختلال در هسته و کروموزومها
-
بازآرایی اسکلت سلولی
-
تغییرات غشایی که منجر به مقاومت دارویی میشود
-
بازآرایی اندامکهای سیتوپلاسمی
این تغییرات در کنار یکدیگر باعث میشوند که سلولهای سرطانی توانایی تکثیر نامحدود، مهاجرت، بقا در محیطهای نامطلوب و مقاومت به درمان را پیدا کنند.
تغییرات سلول سرطانی در سطح مولکولی
سلولهای سرطانی نه تنها از نظر مورفولوژی و ساختار فیزیکی با سلولهای طبیعی متفاوتند، بلکه در سطح مولکولی نیز تغییرات گسترده و پیچیدهای دارند که اساس ویژگیهای تهاجمی و تکثیر غیرقابل کنترل آنها را تشکیل میدهد. این تغییرات شامل بازبرنامهریزی ژنتیکی، اختلال در مسیرهای مرگ سلولی، تغییرات متابولیک و بازآرایی مسیرهای سیگنالینگ است.
بازبرنامهریزی ژنتیکی و تغییرات رونویسی
یکی از مهمترین ویژگیهای سلولهای سرطانی، بازبرنامهریزی ژنتیکی است. سلولهای سرطانی اغلب دارای:
-
جهشهای ژنی متعدد در پروتئینهای کلیدی مانند TP53 ، RAS و MYC هستند.
-
تغییرات در رونویسی ژنها و بیان پروتئینها که به نفع رشد و بقا سلولهاست.
-
فعال شدن مسیرهای رشد و سرکوب مسیرهای مهارکننده تقسیم سلولی
این بازبرنامهریزی باعث میشود سلولهای سرطانی چرخه سلولی را بدون توقف طی کرده و از سیگنالهای توقف رشد طبیعی سلولها مستقل شوند. همچنین، شبکههای مشابه با سلولهای بنیادی جنینی در برخی سلولهای سرطانی فعال میشوند که توانایی تکثیر و بقا را افزایش میدهد.
اختلال در مرگ سلولی برنامهریزیشده (اپوپتوز(
سلولهای طبیعی دارای سیستمهای کنترل دقیق برای حذف سلولهای آسیبدیده هستند. در سلولهای سرطانی، این مکانیسمها دچار اختلال میشوند:
-
پروتئینهای مهارکننده مرگ سلولی مانند BCL-2 و survivin فعال میشوند.
-
مسیرهای کشنده مانند GPX4 ، که در کنترل مرگ سلولی ناشی از استرس اکسیداتیو نقش دارد، بازبرنامهریزی میشوند.
-
توانایی مقاومت در برابر داروها و رادیکالهای آزاد افزایش مییابد.
این اختلالات باعث میشود سلولهای سرطانی حتی در شرایط محیطی نامطلوب نیز زنده مانده و تکثیر کنند.
تغییرات متابولیک
متابولیسم سلولهای سرطانی به شدت از سلولهای طبیعی متمایز است. برخی از ویژگیهای برجسته شامل:
-
افزایش مصرف گلوکز و مسیر گلیکولیز هوازی (اثر واربورگ(
-
فعال شدن سنتز چربیهای غشایی (de novo lipogenesis) برای محافظت از غشا در برابر استرسهای اکسیداتیو
-
تغییر در فعالیت میتوکندری و مسیرهای تولید انرژی غیرمتعارف
-
توانایی استفاده از منابع جایگزین انرژی در شرایط کمبود مواد مغذی
این تغییرات متابولیک به سلولهای سرطانی اجازه میدهد تا در محیطهای پرچالش و کماکسیژن زنده بمانند و رشد سریع خود را حفظ کنند.
مسیرهای سیگنالینگ و بازآرایی مولکولی
سلولهای سرطانی مسیرهای سیگنالینگ متعددی را بازآرایی میکنند تا تکثیر، بقا و مهاجرت خود را تقویت کنند. برخی مسیرهای مهم شامل:
-
فعال شدن مسیرهای رشد و تقسیم سلولی مانند PI3K/AKT، MAPK و MYC
-
بازبرنامهریزی مسیرهای سیگنالینگ سلول به سلول و سلول به محیط
-
تغییر در مسیرهای کنترل استرس و اکسیداسیون
-
استفاده از اگزوزومها و میکرو RNAها برای ارسال پیام به سلولهای اطراف و ایجاد مقاومت دارویی
اختلال در چرخه سلولی و ناپایداری ژنتیکی
سلولهای سرطانی غالباً دارای ناپایداری ژنتیکی بالا هستند که منجر به:
-
افزایش جهشها و بازترکیبهای کروموزومی
-
عدم کارایی چکپوینتهای کنترل کیفیت چرخه سلولی
-
ایجاد جمعیتهای متنوع سلولی با تواناییهای مختلف
این تنوع ژنتیکی و سلولی باعث میشود که سلولهای سرطانی به سرعت با تغییرات محیطی سازگار شوند و مقاومت درمانی ایجاد کنند.
نکات کلیدی در تغییرات مولکولی سلولهای سرطانی
به طور خلاصه، سلولهای سرطانی در سطح مولکولی ویژگیهای زیر را نشان میدهند:
-
بازبرنامهریزی ژنتیکی و تغییرات رونویسی
-
اختلال در مسیرهای اپوپتوز و مرگ سلولی
-
تغییرات متابولیک برای بقا در شرایط نامطلوب
-
بازآرایی مسیرهای سیگنالینگ و ارتباط بین سلولی
-
ناپایداری ژنتیکی و ایجاد جمعیتهای سلولی متنوع
این تغییرات مولکولی در کنار تغییرات ساختاری، توانایی سلولهای سرطانی برای رشد نامحدود، مهاجرت، بقا و مقاومت در برابر درمانها را تقویت میکنند و یکی از عوامل کلیدی در پیشرفت سرطان و متاستاز به شمار میروند.
نقش میکرو محیط تومور در تغییرات سلولی
سلولهای سرطانی هرگز به صورت مستقل عمل نمیکنند؛ آنها در یک میکرو محیط پیچیده و پویا قرار دارند که شامل سلولهای ایمنی، ماتریکس خارج سلولی، رگهای خونی و پیامرسانهای شیمیایی است. این محیط نه تنها بر رشد و بقا سلولهای سرطانی تأثیر میگذارد، بلکه به بازبرنامهریزی ساختاری و مولکولی آنها نیز کمک میکند.
ماتریکس خارج سلولی و سفتی بافت
ماتریکس خارج سلولی (ECM) شامل پروتئینها، کلاژنها، گلیکوپروتئینها و پروتئوگلیکانها است که ساختار سهبعدی بافتها را تشکیل میدهند. در تومورها:
-
ترکیب ECM تغییر میکند و باعث سفتی غیرطبیعی بافت میشود.
-
سفتی و تراکم ECM، سیگنالهای مکانیکی به سلولهای سرطانی میفرستد که موجب تقویت تکثیر و مهاجرت آنها میشود.
-
بازآرایی ECM به سلولها امکان میدهد تا راحتتر از بافتها عبور کنند و متاستاز ایجاد کنند.
مطالعات نشان دادهاند که تغییرات در ECM میتواند پاسخ سلولهای سرطانی به درمانها را نیز تغییر دهد و مقاومت دارویی را افزایش دهد.
سلولهای ایمنی و ماکروفاژهای مرتبط با تومور
میکرو محیط تومور شامل سلولهای ایمنی مانند ماکروفاژهای مرتبط با تومور (TAMs) است. این سلولها نقش دوگانه دارند:
-
در برخی شرایط، با آزادسازی سیتوکینها و فاکتورهای رشد، سلولهای سرطانی را حمایت میکنند.
-
در شرایط دیگر، با تغییر قطبیت عملکردی تحت تأثیر متابولیتها مانند لاکتات تولید شده توسط سلولهای سرطانی، مسیرهای رشد و مهاجرت را تقویت میکنند.
تعامل بین سلولهای سرطانی و TAMها باعث میشود تومور محیطی مناسب برای بقا و متاستاز ایجاد کند و پاسخ سیستم ایمنی میزبان را کاهش دهد.
انتقال اگزوزومها و پیامرسانی بین سلولی
اگزوزومها وزیکولهای کوچک ترشح شده توسط سلولها هستند که حاوی پروتئینها، میکرو RNAها و مولکولهای سیگنالینگ میباشند. سلولهای سرطانی از اگزوزومها برای:
-
ارسال پیام به سلولهای همسایه و سلولهای ایمنی
-
ایجاد مقاومت دارویی در سلولهای اطراف
-
تقویت فرآیندهای مهاجرت و متاستاز
استفاده میکنند. به عنوان مثال، انتقال میکرو RNAهای آنژیژنیک میتواند رگزایی و تغذیه سلولهای سرطانی را افزایش دهد و مسیرهای مقاومت به درمان را فعال کند.
نقش اکسیژن، لاکتات و مواد مغذی
میکرو محیط تومور غالباً دارای مناطق کماکسیژن و محدودیت غذایی است. سلولهای سرطانی با استفاده از بازبرنامهریزی متابولیک:
-
تولید لاکتات برای بازسازی محیط و تغییر قطبیت ماکروفاژها
-
استفاده از منابع جایگزین انرژی
-
فعال کردن مسیرهای بقا و مقاومت در برابر استرس اکسیداتیو
این تغییرات باعث میشود سلولهای سرطانی در شرایط سخت زنده بمانند و رشد خود را حفظ کنند.
بازخورد بین سلولها و محیط
تغییرات سلولهای سرطانی و میکرو محیط یک فرآیند دوطرفه و پویا است:
-
سلولهای سرطانی با تغییر ماتریکس و ترشح فاکتورهای رشد، محیط خود را بازآرایی میکنند.
-
محیط بازآراییشده سیگنالهایی به سلولها ارسال میکند که رشد، مهاجرت و مقاومت آنها را تقویت میکند.
این تعامل پیچیده باعث میشود که تومورها به سیستمهای درمانی مقاوم شوند و فرایند متاستاز سریعتر اتفاق بیفتد.
نکات کلیدی در نقش میکرو محیط تومور
به طور خلاصه، میکرو محیط تومور شامل ماتریکس خارج سلولی، سلولهای ایمنی، اگزوزومها و مواد مغذی است که:
-
رشد و تکثیر سلولهای سرطانی را حمایت میکند.
-
مهاجرت و متاستاز را تسهیل میکند.
-
مقاومت دارویی و بازبرنامهریزی مولکولی را تقویت میکند.
این ویژگیها نشان میدهد که درک میکرو محیط تومور برای توسعه درمانهای هدفمند و موفقیتآمیز سرطان ضروری است.
سازگاری و مهاجرت سلولهای سرطانی
یکی از مهمترین ویژگیهای سلولهای سرطانی، توانایی سازگاری با محیطهای مختلف و مهاجرت به اندامهای دیگر است. این فرآیند، پایه اصلی متاستاز محسوب میشود و نقش تعیینکنندهای در پیشرفت و مرگ و میر ناشی از سرطان دارد.
بازبرنامهریزی اپیتلیال به مزانشیم (EMT)
فرآیند Epithelial-to-Mesenchymal Transition (EMT) یکی از مکانیزمهای کلیدی در مهاجرت سلولهای سرطانی است. در این فرآیند:
-
سلولهای اپیتلیال با ویژگیهای چسبندگی بالا و نظم بافتی، به سلولهای مزانشیمال با انعطافپذیری و تحرک بیشتر تبدیل میشوند.
-
اتصال به ماتریکس خارج سلولی کاهش مییابد و سلولها توانایی حرکت آزادانه و نفوذ به بافتهای اطراف را پیدا میکنند.
-
بیان پروتئینهای چسبندگی مانند E-cadherin کاهش و N-cadherin افزایش مییابد، که به آزادسازی سلول از بافت اصلی کمک میکند.
این تغییرات ساختاری و مولکولی باعث میشوند سلولهای سرطانی انعطافپذیر و مقاوم به فشار مکانیکی شوند و مهاجرت خود را آغاز کنند.
بازآرایی اسکلت سلولی و انعطافپذیری
سازگاری و مهاجرت سلولهای سرطانی نیازمند بازآرایی کامل اسکلت سلولی است. تغییرات شامل:
-
افزایش انعطاف میکروفیلامنتها و میکروتوبولها
-
بازسازی فیلامنتهای میانی برای تحمل فشار مکانیکی
-
ایجاد قطبیت سلولی جهت حرکت هدفمند
این بازآرایی به سلولها امکان میدهد تا از فضای بین سلولی عبور کنند و وارد رگهای خونی یا لنفاوی شوند.
مهاجرت آمیبی و تجمع خوشهای
سلولهای سرطانی میتوانند به دو شکل مهاجرت کنند:
-
مهاجرت آمیبی: سلولها به صورت مستقل حرکت میکنند و با تغییر شکل سریع از موانع عبور میکنند
-
تجمع خوشهای: سلولها به صورت گروهی حرکت میکنند و با ایجاد خوشههای توموری یا CTC clusters، مقاومت بیشتری نسبت به تنشهای مکانیکی و سیستم ایمنی دارند
این استراتژیها باعث میشوند سلولهای سرطانی موثرتر متاستاز کنند و شانس بقای بیشتری در محیطهای غیرمطلوب داشته باشند.
نقش اگزوزومها و مسیرهای سیگنالینگ
مهاجرت سلولهای سرطانی توسط سیگنالهای محیطی و اگزوزومها هدایت میشود:
-
اگزوزومها شامل میکرو RNA ها و پروتئینهای آنژیژنیک هستند که مسیرهای مهاجرت و رگزایی را فعال میکنند.
-
مسیرهای سیگنالینگ مانند PI3K/AKT، MAPK و Rho GTPase در هدایت حرکت و بازسازی اسکلت سلولی نقش دارند.
-
سلولهای سرطانی با ارسال پیام به سلولهای همسایه و سلولهای ایمنی، محیط مهاجرتی خود را بهینه و محافظتشده میکنند.
تغییرات متابولیک مرتبط با مهاجرت
سلولهای سرطانی برای مهاجرت موفق نیاز به انرژی و انعطافپذیری متابولیک دارند. تغییرات شامل:
-
افزایش گلیکولیز و تولید ATP سریع
-
فعال شدن مسیرهای سنتز چربی برای حفظ انعطاف غشای سلولی
-
استفاده از منابع جایگزین انرژی در محیطهای کماکسیژن
این تغییرات باعث میشوند سلولها حتی در شرایط نامطلوب بافتی بتوانند حرکت کنند و به بافتهای جدید نفوذ کنند.
نکات کلیدی در سازگاری و مهاجرت سلولهای سرطانی
به طور خلاصه، سازگاری و مهاجرت سلولهای سرطانی وابسته به:
-
بازبرنامهریزی اپیتلیال به مزانشیم (EMT)
-
بازآرایی اسکلت سلولی و انعطافپذیری
-
مهاجرت مستقل یا خوشهای
-
هدایت توسط اگزوزومها و مسیرهای سیگنالینگ
-
تغییرات متابولیک برای تأمین انرژی و حفظ انعطاف
این ویژگیها، سلولهای سرطانی را قادر میسازند تا از بافت اصلی خارج شوند، وارد گردش خون شوند و در اندامهای دوردست مستقر شوند. شناخت دقیق این مکانیسمها، پایهای برای توسعه درمانهای ضدمتاستاز و مهار مهاجرت سلولهای سرطانی فراهم میکند.
تفاوتهای عملکردی بین سلولهای طبیعی و سرطانی
سلولهای طبیعی و سلولهای سرطانی علاوه بر تفاوتهای ساختاری و مولکولی، دارای ویژگیهای عملکردی بسیار متفاوتی هستند. این تفاوتها اساس رفتار غیرطبیعی سلولهای سرطانی را تشکیل میدهند و توضیحدهنده سرعت تکثیر، مهاجرت، مقاومت دارویی و تغییرات متابولیک آنها در بافتهای بدن هستند.
چرخه سلولی و تکثیر
سلولهای طبیعی دارای چرخه سلولی کنترلشده هستند و با استفاده از چکپوینتهای متعدد، سلامت DNA و تکثیر دقیق کروموزومها را تضمین میکنند.
در مقابل، سلولهای سرطانی:
-
چرخه سلولی خود را بدون کنترل طی میکنند.
-
چکپوینتها را دور میزنند و تقسیم غیرقابل کنترل دارند.
-
توانایی تکثیر سریع و نامحدود دارند که منجر به رشد تومور و افزایش جمعیت سلولی میشود.
این تفاوت، پایه اصلی رشد سریع تومورها و پیشرفت سرطان است.
متابولیسم و تولید انرژی
سلولهای طبیعی عمدتاً از مسیرهای هوازی و متابولیسم متعادل برای تولید انرژی استفاده میکنند.
اما سلولهای سرطانی دارای متابولیسم بازبرنامهریزیشده هستند که شامل:
-
افزایش گلیکولیز حتی در حضور اکسیژن ) اثر واربورگ)
-
فعال شدن مسیرهای سنتز چربی برای حفظ غشای انعطافپذیر
-
استفاده از منابع جایگزین انرژی در شرایط کمبود مواد مغذی یا کماکسیژن
این تغییرات متابولیک، سلولهای سرطانی را قادر میسازد تا در محیطهای نامطلوب و تحت فشار دارویی بقا یابند.
پاسخ به سیگنالهای محیطی
سلولهای طبیعی به طور دقیق به سیگنالهای رشد و توقف پاسخ میدهند و در بافتها هماهنگی عملکردی ایجاد میکنند.
سلولهای سرطانی:
-
مستقل از سیگنالهای توقف رشد عمل میکنند.
-
مسیرهای سیگنالینگ رشد و بقا را بازبرنامهریزی میکنند.
-
با تغییر محیط، به سرعت سازگار میشوند و مهاجرت میکنند.
این ویژگی باعث میشود سلولهای سرطانی بتوانند در بافتهای دوردست مستقر شده و متاستاز ایجاد کنند.
مرگ سلولی و مقاومت
سلولهای طبیعی در مواجهه با آسیب DNA یا شرایط استرسزا وارد اپوپتوز یا مرگ سلولی برنامهریزیشده میشوند.
سلولهای سرطانی:
-
مسیرهای اپوپتوز را مهار میکنند و از مرگ سلولی فرار میکنند.
-
پروتئینهای مهارکننده مرگ مانند BCL-2 و survivin فعال میشوند.
-
مقاومت به شیمیدرمانی و رادیکالهای آزاد افزایش مییابد.
این تفاوتها باعث میشود درمان سرطان با سلولهای مقاوم و بازبرنامهریزیشده مواجه شود.
مهاجرت و متاستاز
سلولهای طبیعی معمولاً در مکانهای مشخص بافتی باقی میمانند و توانایی مهاجرت ندارند.
سلولهای سرطانی:
-
از طریق فرآیند EMT انعطافپذیری پیدا میکنند.
-
قادر به مهاجرت مستقل یا خوشهای هستند.
-
با بازآرایی اسکلت سلولی و تغییر متابولیک، به اندامهای دیگر نفوذ میکنند.
این تفاوت عملکردی، اصلیترین عامل پیشرفت سرطان و ایجاد متاستازهای خطرناک است.
تعامل با میکرو محیط
سلولهای طبیعی با میکرو محیط همخوانی کامل دارند و هماهنگی با سلولهای همسایه و ماتریکس خارج سلولی حفظ میشود.
سلولهای سرطانی:
-
محیط خود را با ترشح فاکتورهای رشد، اگزوزومها و میکرو RNAها بازآرایی میکنند.
-
تعامل با سلولهای ایمنی را تغییر میدهند تا مهاجرت و مقاومت خود را افزایش دهند.
-
میکرو محیط تومور را به فضایی حمایتکننده و محافظتشده برای رشد و متاستاز تبدیل میکنند.
نکات کلیدی در تفاوتهای عملکردی
به طور خلاصه، تفاوتهای عملکردی سلولهای طبیعی و سرطانی شامل:
-
کنترل دقیق چرخه سلولی در مقابل تقسیم غیرقابل کنترل
-
متابولیسم متعادل در مقابل متابولیسم بازبرنامهریزیشده
-
پاسخ دقیق به سیگنالهای محیطی در مقابل مستقل بودن از سیگنالها
-
مرگ سلولی برنامهریزیشده در مقابل مقاومت به مرگ
-
عدم مهاجرت در مقابل توانایی مهاجرت و متاستاز
-
هماهنگی با محیط در مقابل بازآرایی میکرو محیط تومور
این تفاوتهای عملکردی نشان میدهد که سلولهای سرطانی نه تنها از نظر ساختاری و مولکولی، بلکه از نظر رفتار و عملکرد نیز کاملاً متفاوتند و نیازمند درک عمیق برای طراحی درمانهای هدفمند هستند.
تکنیکهای بررسی و آنالیز سلولهای سرطانی
برای درک دقیق ویژگیهای سلولهای سرطانی، تعیین تفاوتهای ساختاری و عملکردی نسبت به سلولهای طبیعی، و طراحی درمانهای هدفمند، استفاده از تکنیکهای پیشرفته آزمایشگاهی و تصویربرداری ضروری است. این تکنیکها به محققان امکان میدهند تا مورفولوژی، متابولیسم، مسیرهای سیگنالینگ و تعامل سلول با میکرو محیط را به صورت دقیق بررسی کنند.
تصویربرداری میکروسکوپی
میکروسکوپی نوری و فلورسانس از رایجترین روشها برای بررسی سلولهای سرطانی است:
-
میکروسکوپی نوری : بررسی شکل، اندازه و تراکم سلولی
-
میکروسکوپی فلورسانس : شناسایی پروتئینها، ساختارهای اسکلت سلولی و مسیرهای سیگنالینگ با استفاده از رنگآمیزی اختصاصی
-
میکروسکوپی الکترونی : ارائه تصاویر بسیار با وضوح بالا از غشای سلولی، میتوکندری و ساختار هسته
این تکنیکها امکان مشاهده تغییرات مورفولوژیک و ساختاری سلولهای سرطانی را با دقت بالا فراهم میکنند.
آنالیز مکانیکی و بیوفیزیکی
سلولهای سرطانی ویژگیهای مکانیکی متفاوتی نسبت به سلولهای طبیعی دارند که میتواند با روشهای زیر سنجیده شود:
-
: Atomic Force Microscopy (AFM) اندازهگیری انعطافپذیری و سختی سلول
-
: Micropipette Aspiration بررسی مقاومت سلول در برابر فشار و تغییر شکل
-
: Microfluidics شبیهسازی محیط جریان خون و بررسی توانایی عبور سلولها از فضاهای محدود
این دادهها به محققان امکان میدهند تا سفتی سلول، انعطاف و توانایی مهاجرت را با دقت کمی بسنجند.
آنالیز مولکولی و ژنتیکی
برای درک تغییرات ژنتیکی و مولکولی سلولهای سرطانی، تکنیکهای متعددی به کار میروند:
-
: RNA Sequencing (RNA-seq) شناسایی تغییرات در بیان ژنها و مسیرهای رونویسی
-
: Single-cell RNA-seq بررسی هتروژنیته سلولی در تومورهای پیچیده
-
: DNA methylation arraysبررسی الگوهای اپیژنتیکی و تنوع سلولی
-
CRISPR/Cas9 و شناسایی جهشها : مطالعه اثر ژنهای خاص در رشد و متاستاز
این روشها امکان تعیین مسیرهای مولکولی بازبرنامهریزی شده و شناسایی اهداف درمانی جدید را فراهم میکنند.
آنالیز متابولیک و انرژی سلولی
سلولهای سرطانی دارای متابولیسم تغییر یافته هستند که با روشهای زیر قابل بررسی است:
-
: Seahorse Analyzer اندازهگیری مصرف اکسیژن و تولید ATP
-
Tracer Studies با ایزوتوپهای رادیواکتیو یا پایدار : بررسی مسیرهای گلیکولیز و سنتز چربی
-
Mass Spectrometry و : Metabolomics شناسایی تغییرات متابولیتها و مسیرهای انرژی
این تکنیکها به درک سازگاری متابولیک سلولهای سرطانی کمک کرده و میتوانند به توسعه داروهای هدفمند منجر شوند.
بررسی تعامل سلول با محیط
میکرو محیط تومور نقش کلیدی در رفتار سلولهای سرطانی دارد و تکنیکهای زیر آن را آشکار میسازند:
-
3D Cell Culture و : Spheroids شبیهسازی محیط سهبعدی و بررسی مهاجرت و تعامل سلولها
-
: Co-culture Systems مطالعه تعامل سلولهای سرطانی با سلولهای ایمنی یا فیبروبلاستها
-
Exosome Isolation و : Analysis بررسی پیامرسانی بین سلولی و مقاومت دارویی
این روشها نشان میدهند که سلولهای سرطانی چگونه محیط خود را بازآرایی کرده و مهاجرت و متاستاز را تقویت میکنند.
تکنیکهای ترکیبی و پیشرفته
امروزه تکنیکهای چندمتدی و ترکیبی مانند Single-cell multi-omics و High-content Imaging برای بررسی همزمان جنبههای ساختاری، مولکولی و عملکردی سلولها استفاده میشوند. این روشها امکان ارائه تصویر جامع و کامل از ویژگیهای سلولهای سرطانی را فراهم میکنند.
نکات کلیدی در تکنیکهای بررسی
-
تصویربرداری و میکروسکوپی : بررسی مورفولوژی و اسکلت سلولی
-
آنالیز مکانیکی : سنجش سختی، انعطاف و مهاجرت
-
آنالیز مولکولی و ژنتیکی : شناسایی بازبرنامهریزی ژنتیکی و مسیرهای سیگنالینگ
-
آنالیز متابولیک : درک تغییرات انرژی و مسیرهای متابولیک
-
بررسی تعامل با محیط : مطالعه مهاجرت، متاستاز و ارتباط با میکرو محیط
استفاده از این تکنیکها باعث میشود که رفتار سلولهای سرطانی در شرایط طبیعی و درمانی به طور دقیق شناسایی شده و استراتژیهای درمانی هدفمند طراحی شود.
چشماندازهای آینده در مطالعه سلولهای سرطانی
مطالعه سلولهای سرطانی در چند دهه اخیر به پیشرفتهای چشمگیری دست یافته است، اما هنوز بسیاری از جنبههای رفتار، سازگاری و تعامل سلولهای سرطانی با میکرو محیط به طور کامل درک نشدهاند. چشماندازهای آینده در این حوزه بر پایه فناوریهای نوین، مدلهای سهبعدی و بررسی دقیق سلولهای منفرد قرار دارد.
تمرکز بر هتروژنیته سلولی و تکسلولی
یکی از مهمترین رویکردهای آینده، بررسی هتروژنیته سلولی تومور با تکنیکهای Single-cell RNA-seq و multi-omics است. این روشها امکان میدهند تا:
-
تفاوتهای ژنتیکی، اپیژنتیکی و متابولیک بین سلولها شناسایی شود.
-
سلولهای مقاوم به درمان و مهاجم از سایر سلولها تمیز داده شوند.
-
مسیرهای بازبرنامهریزی مولکولی که باعث رشد و متاستاز میشوند، مشخص شوند.
این دیدگاه، راه را برای درمانهای دقیقتر و هدفمندتر هموار میکند.
مدلهای سهبعدی و شبیهسازی میکرو محیط
استفاده از 3D Cell Culture، Organoids و Spheroids به مطالعه سلولهای سرطانی در محیطی شبیه بافت طبیعی کمک میکند:
-
بازآفرینی میکرو محیط پیچیده تومور و تعامل با سلولهای ایمنی
-
بررسی مهاجرت، متاستاز و پاسخ به دارو در شرایط واقعیتر
-
امکان آزمایش داروهای هدفمند و ترکیبی پیش از ورود به مطالعات حیوانی و بالینی
این مدلها، فاصله بین یافتههای آزمایشگاهی و واقعیت بالینی را کاهش میدهند.
فناوریهای پیشرفته تصویربرداری و تحلیل داده
چشمانداز آینده شامل استفاده گسترده از فناوریهای پیشرفته تصویربرداری و هوش مصنوعی در تحلیل دادهها است:
-
High-content Imaging و Multiplexed Imaging برای مشاهده همزمان چندین ویژگی سلولی
-
تحلیلهای هوش مصنوعی برای شناسایی الگوهای مهاجرت، تقسیم و بازبرنامهریزی سلولی
-
پیشبینی پاسخ به درمان و مسیرهای مقاومت با استفاده از دادههای بزرگ
این رویکردها، امکان بررسی رفتار سلولها در مقیاس بزرگ و با دقت بالا را فراهم میکنند.
هدفگیری مسیرهای بازبرنامهریزی و متابولیک
مطالعات آینده به سمت هدفگیری مسیرهای بازبرنامهریزی مولکولی و متابولیک سلولهای سرطانی حرکت میکنند:
-
مهار مسیرهای EMT و مهاجرت سلولی
-
دستکاری متابولیسم گلیکولیتیک و سنتز چربی برای کاهش انعطاف و مقاومت سلولی
-
استفاده از داروهای ترکیبی و هدفمند که میکرو محیط تومور را نیز تغییر دهند.
این استراتژیها میتوانند منجر به کاهش رشد تومور و متاستاز شوند و درمان سرطان را موثرتر کنند.
پزشکی دقیق و درمان شخصیسازیشده
با شناخت دقیق ویژگیهای ساختاری، مولکولی و عملکردی سلولهای سرطانی، چشمانداز آینده شامل:
-
طراحی درمانهای شخصیسازیشده بر اساس ویژگیهای تومور هر بیمار
-
شناسایی بیومارکرهای قابل اعتماد برای پیشبینی پاسخ به درمان
-
کاهش اثرات جانبی و افزایش اثربخشی داروها
این رویکردها میتوانند تحولی در پیشگیری، تشخیص و درمان سرطان ایجاد کنند.
نکات کلیدی در چشماندازهای آینده
-
تمرکز بر هتروژنیته و تحلیل تکسلولی
-
استفاده از مدلهای سهبعدی و شبیهسازی میکرو محیط
-
کاربرد فناوریهای تصویربرداری پیشرفته و هوش مصنوعی
-
هدفگیری مسیرهای بازبرنامهریزی و متابولیک
-
توسعه پزشکی دقیق و درمان شخصیسازیشده
مطالعه سلولهای سرطانی در این مسیر، نه تنها دانش بنیادی سرطان را گسترش میدهد، بلکه مسیرهای جدیدی برای توسعه درمانهای نوین و کاهش مرگ و میر ناشی از سرطان فراهم میکند.
نتیجهگیری
بررسی ساختار و عملکرد سلولهای سرطانی در مقایسه با سلولهای طبیعی نشان میدهد که سرطان یک بیماری چندوجهی و پیچیده است که نه تنها با تکثیر غیرقابل کنترل سلولها مشخص میشود، بلکه شامل تغییرات گسترده در مورفولوژی، مسیرهای مولکولی، متابولیسم و تعامل با میکرو محیط نیز میباشد.
تفاوتهای کلیدی سلولهای سرطانی با سلولهای طبیعی شامل موارد زیر است:
-
چرخه سلولی غیرقابل کنترل و تکثیر سریع که منجر به رشد تومور میشود.
-
بازبرنامهریزی متابولیک و افزایش گلیکولیز و سنتز چربی برای بقا در محیطهای نامطلوب
-
مهاجرت و متاستاز از طریق فرآیندهای EMT، بازآرایی اسکلت سلولی و سازگاری با محیط
-
مقاومت در برابر مرگ سلولی و درمانهای دارویی با فعالسازی مسیرهای مهارکننده اپوپتوز
-
تعامل پیچیده با میکرو محیط تومور که شرایط رشد و مهاجرت را تسهیل میکند.
مطالعات اخیر نشان دادهاند که هتروژنیته سلولی و بازبرنامهریزی مولکولی در تومورها نقش تعیینکنندهای در پاسخ به درمان و پیشآگهی بیماری دارند. تکنیکهای پیشرفته مانند Single-cell RNA-seq، مدلهای سهبعدی، آنالیز مکانیکی و تصویربرداری پیشرفته امکان شناسایی دقیق ویژگیهای سلولهای سرطانی و طراحی درمانهای هدفمند را فراهم میکنند.
چشمانداز آینده در مطالعه سلولهای سرطانی بر درک هتروژنیته تومور، تحلیل تکسلولی، پزشکی دقیق و طراحی درمانهای شخصیسازیشده متمرکز است. این رویکردها نه تنها دانش بنیادی سرطان را گسترش میدهند، بلکه مسیر توسعه درمانهای نوین، کاهش مرگ و میر و بهبود کیفیت زندگی بیماران را هموار میکنند.
در نهایت، شناخت دقیق تفاوتهای سلولهای طبیعی و سرطانی و به کارگیری تکنیکهای پیشرفته برای بررسی ساختار، عملکرد و تعامل با محیط، پایهای است برای موفقیت در پیشگیری، تشخیص و درمان سرطان. این دانش، امکان طراحی استراتژیهای درمانی هدفمند، کاهش مقاومت دارویی و کنترل بهتر پیشرفت بیماری را فراهم میکند و نقش کلیدی در بهبود نتایج بالینی بیماران مبتلا به سرطان دارد.

