غشا سلولی و انتقال مواد
مقدمه کلی درباره غشای سلولی و اهمیت آن در زیستشناسی و پزشکی
غشای سلولی یا همان غشای پلاسمایی یکی از بنیادیترین ساختارهای حیات است؛ ساختاری نازک اما فوقالعاده پیچیده که همانند مرزی ظریف، سلول را از محیط اطراف جدا میسازد و در عین حال امکان تعامل فعال و هوشمند سلول با جهان بیرونی را فراهم میکند. شاید در نگاه نخست این لایه تنها یک دیواره ساده بهنظر برسد، اما حقیقت این است که غشا یک سامانه زنده و پویا است که هزاران فرآیند حیاتی از جمله تبادل مواد، انتقال پیامهای شیمیایی، حفظ تعادل یونی، و حتی ارتباطات بینسلولی را مدیریت میکند.
اگر DNA را کتاب دستورالعمل زندگی بدانیم، غشا را میتوان دروازهبان حیات نامید؛ زیرا بدون وجود این ساختار، هیچ سلولی قادر به حفظ یکپارچگی خود، تنظیم متابولیسم یا پاسخ به محیط نخواهد بود.
نگاه تاریخی به مطالعات غشای سلولی
مطالعهی غشای سلولی از قرن نوزدهم آغاز شد. دانشمندان در ابتدا تصور میکردند که غشا صرفاً یک لایه نفوذناپذیر است که از خروج و ورود مواد جلوگیری میکند. اما با پیشرفت فناوریهای میکروسکوپی و بیوشیمیایی، مشخص شد که غشا بسیار پیچیدهتر از آن چیزی است که گمان میرفت. نقطه عطف این کشف در دهه ۱۹۷۰ بود، زمانی که «سینگر» و «نیکلسون» مدل مشهور موزاییک سیال (Fluid Mosaic Model) را معرفی کردند؛ مدلی که غشا را به صورت یک ماتریس دینامیک متشکل از لیپیدها و پروتئینها توصیف میکرد. از آن زمان تاکنون، پژوهشها نشان دادهاند که غشا نهتنها یک ساختار فیزیکی، بلکه یک پلتفرم عملکردی برای تنظیم فرآیندهای حیاتی است.
نقش غشا در تنظیم حیات سلولی
غشا مانند یک سپر انتخابی (Selective Barrier) عمل میکند. این سپر به سلول امکان میدهد تا تنها مواد موردنیاز خود مانند مواد غذایی، یونها و پیامرسانها را وارد کرده و محصولات زائد یا مولکولهای سیگنالینگ را صادر کند. در واقع غشا یک «سامانه حمل و نقل هوشمند» است که براساس ویژگیهای شیمیایی و فیزیکی مولکولها، آنها را غربال میکند.
از سوی دیگر، غشا بستری برای پروتئینهای غشایی است که در فرآیندهایی چون انتقال فعال، تشکیل سیگنالهای سلولی، اتصال به ماتریکس خارج سلولی و حتی پاسخهای ایمنی نقشآفرین هستند. بنابراین میتوان گفت غشا چیزی فراتر از یک دیواره است؛ غشا یک مرکز تصمیمگیری سلولی محسوب میشود.
اهمیت پزشکی و دارویی غشای سلولی
در دنیای پزشکی و داروسازی، درک غشای سلولی اهمیتی حیاتی دارد. بسیاری از داروها باید از این مانع عبور کنند تا به مقصد درونسلولی برسند. همچنین پدیدههایی مانند مقاومت دارویی در سلولهای سرطانی، عملکرد سد خونی–مغزی (BBB) و حتی ورود ویروسها مانند HIV یا SARS-CoV-2 به درون سلول، همگی ارتباط مستقیم با غشا دارند.
امروزه، پژوهشگران با الهام از ساختار و عملکرد غشا، در حال طراحی نانوذرات پوشیدهشده با غشای سلولی هستند که میتوانند داروها را به طور هدفمند به بافتهای خاص منتقل کنند. این فناوری انقلابی در حوزه دارورسانی هوشمند به شمار میرود.
غشا بهعنوان پل میان علوم مختلف
مطالعه غشای سلولی نهتنها به زیستشناسی سلولی محدود نمیشود، بلکه ارتباط عمیقی با رشتههایی مانند نانوتکنولوژی، بیوفیزیک، مهندسی پزشکی، ایمنیشناسی و علوم اعصاب دارد. برای مثال، درک مکانیزم انتقال مواد از طریق غشا میتواند به توسعه داروهای ضدسرطانی، بهبود کارایی واکسنها، طراحی حسگرهای زیستی و حتی درمان بیماریهای عصبی مانند آلزایمر کمک کند.
چرا مطالعه غشا همچنان ادامه دارد؟
با وجود بیش از یک قرن مطالعه، غشای سلولی هنوز رازهای زیادی در دل خود نهفته دارد. هرچه فناوریهای نوین مانند میکروسکوپهای فوق رزولوشن، مدلسازی مولکولی، و هوش مصنوعی پیشرفت میکنند، ابعاد تازهای از رفتار غشا آشکار میشود. پرسشهای مهمی مانند «چگونه پروتئینهای غشایی با یکدیگر همکاری میکنند؟»، «نقش دقیق لیپید رَفتها در بیماریها چیست؟»، یا «چطور میتوانیم سدهای زیستی را برای دارورسانی هدفمند بشکنیم؟» همچنان در صدر تحقیقات علمی قرار دارند.
در نتیجه، غشای سلولی را میتوان مرکز حیات و نقطه اتصال زیستشناسی با فناوریهای نوین دانست. پرداختن به ساختار و فرآیندهای انتقال در این غشا نهتنها به درک بهتر زندگی در سطح سلولی کمک میکند، بلکه مسیرهای جدیدی برای درمان بیماریها، طراحی داروها و توسعه فناوریهای زیستی پیش روی بشر میگشاید.
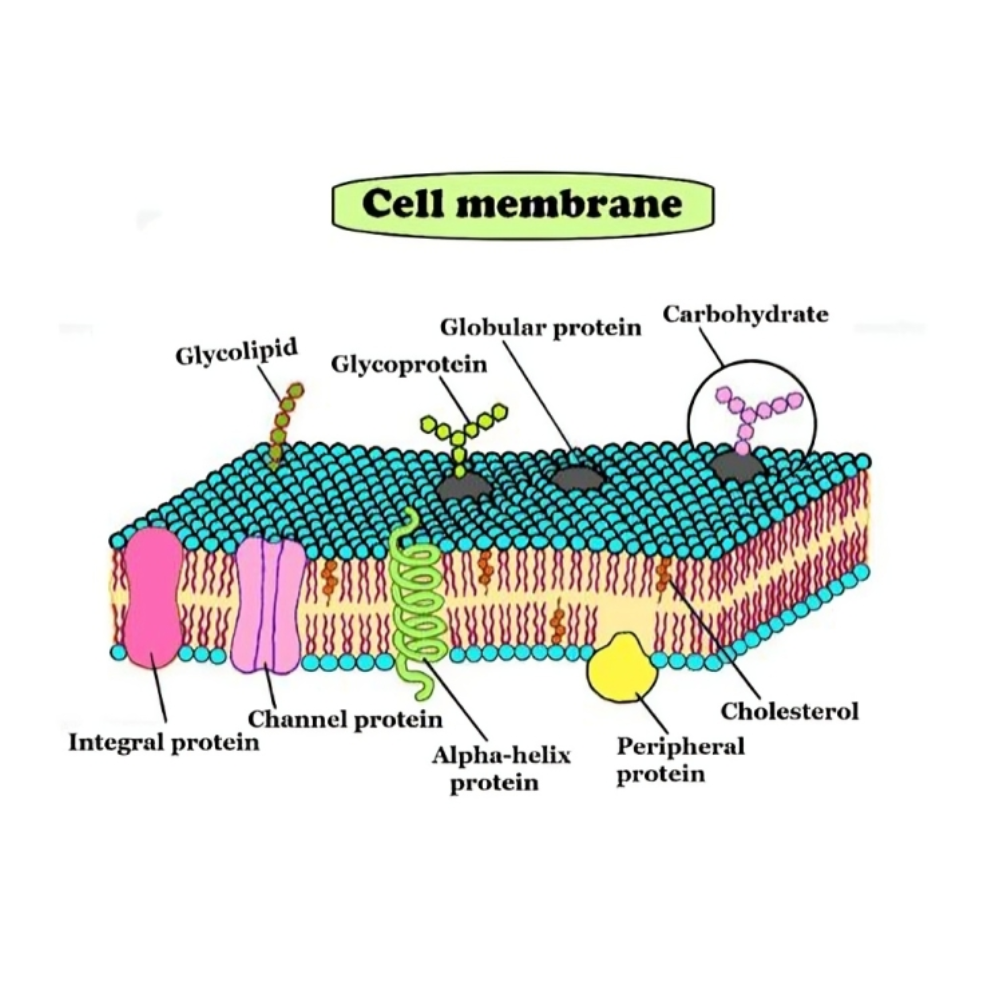
مروری بر ساختار غشای سلولی: مدل موزاییک سیال
غشای سلولی، برخلاف ظاهر ساده و نازک خود، ساختاری پیچیده، دینامیک و سازمانیافته است که نقش کلیدی در حیات سلول ایفا میکند. برای توصیف این ساختار در دههی ۱۹۷۰، «سینگر» و «نیکلسون» مدلی را پیشنهاد کردند که بعدها با عنوان مدل موزاییک سیال (Fluid Mosaic Model) شناخته شد. این مدل نقطه عطفی در زیستشناسی سلولی محسوب میشود، زیرا برای نخستین بار توانست ترکیب، آرایش و رفتار اجزای غشا را به شکل جامع توضیح دهد.
مفهوم موزاییک سیال
اصطلاح «موزاییک» به این دلیل انتخاب شد که غشا مانند یک تصویر موزاییکی از اجزای مختلف ساخته شده است؛ ترکیبی از لیپیدها، پروتئینها و کربوهیدراتها که در کنار هم آرایشی متنوع و نامتقارن دارند. واژهی «سیال» نیز به پویایی غشا اشاره دارد؛ اجزای غشا در جای خود ثابت نیستند، بلکه میتوانند بهطور جانبی حرکت کنند، با یکدیگر تعامل داشته باشند و ساختارهای موقتی تشکیل دهند. این ویژگی باعث میشود غشا بتواند خود را با شرایط محیطی و نیازهای سلولی وفق دهد.
ترکیب اصلی غشا
غشای سلولی عمدتاً از سه جزء اصلی ساخته شده است:
-
لیپیدها: حدود ۴۰ تا ۵۰ درصد وزن غشا را تشکیل میدهند. مهمترین انواع آنها شامل فسفولیپیدها، کلسترول و گلیکولیپیدها هستند. فسفولیپیدها به صورت دو لایه (Lipid Bilayer) آرایش مییابند که اسکلت اصلی غشا را تشکیل میدهد. این دو لایه دارای خاصیت قطبی و غیرقطبی همزمان هستند؛ بخش سر آبدوست (هیدروفیلیک) به سمت محیط آبی و دمهای آبگریز (هیدروفوبیک) به سمت داخل لایه رویهم قرار میگیرند.
-
پروتئینها : حدود ۵۰ تا ۶۰ درصد وزن غشا را شامل میشوند. این پروتئینها به دو دسته تقسیم میشوند: پروتئینهای محیطی که به سطح داخلی یا خارجی غشا متصل هستند و پروتئینهای انتگرال (Integral proteins) که به درون دو لایه لیپیدی نفوذ کرده یا حتی آن را بهطور کامل قطع میکنند. پروتئینهای غشایی وظایف گوناگونی مانند انتقال مواد، عمل به عنوان گیرنده، اتصال سلول به ماتریکس خارج سلولی و آنزیمهای کاتالیزوری بر عهده دارند.
-
کربوهیدراتها : به صورت زنجیرههایی بر سطح خارجی غشا وجود دارند و معمولاً به پروتئینها (گلیکوپروتئین) یا لیپیدها (گلیکولیپید) متصل میشوند. این کربوهیدراتها در شناسایی سلولها، ایمنی، و ارتباطات بینسلولی نقش حیاتی دارند.
نقش کلسترول در پایداری غشا
یکی از اجزای مهم غشا، کلسترول است. برخلاف تصور عمومی که کلسترول را همواره بهعنوان یک ترکیب مضر میشناسند، در غشاهای زیستی نقش مثبت و حیاتی ایفا میکند. کلسترول با قرار گرفتن میان دمهای فسفولیپیدی، انعطافپذیری و پایداری غشا را تنظیم میکند. این مولکول مانع از آن میشود که غشا در دماهای بالا بیش از حد سیال و در دماهای پایین بیش از حد سفت و شکننده شود.
نامتقارن بودن غشا
یکی از ویژگیهای مهم غشا، نامتقارن بودن آن است. توزیع لیپیدها و پروتئینها در لایه داخلی و خارجی یکسان نیست. برای مثال، فسفاتیدیلسرین و فسفاتیدیلاتانولآمین بیشتر در لایه داخلی یافت میشوند، در حالیکه فسفاتیدیلکولین و اسفنگومیلین در لایه خارجی غشا غالب هستند. این نامتقارن بودن برای فرآیندهایی مانند سیگنالدهی سلولی، آپوپتوز (مرگ برنامهریزیشده سلول) و شناسایی توسط سیستم ایمنی اهمیت دارد.
لیپید رَفتها و میکرو دومینها
برخلاف تصور اولیه که غشا بهطور یکنواخت سیال است، مطالعات جدید نشان دادهاند که غشا دارای میکرودومینها یا نواحی ویژهای به نام لیپید رَفتها (Lipid Rafts) است. این نواحی غنی از کلسترول و اسفنگولیپیدها هستند و نقش سازماندهنده در تجمع پروتئینهای خاص ایفا میکنند. لیپید رَفتها در فرآیندهایی مانند انتقال پیامهای سیگنالینگ، اندوسیتوز، و پاتوژنز برخی ویروسها نقش کلیدی دارند.
پویایی غشا و مفهوم سیالیت
یکی از ویژگیهای منحصربهفرد غشا، قابلیت حرکت جانبی اجزا درون لایه لیپیدی است. فسفولیپیدها میتوانند در محدودهی خود آزادانه حرکت کنند، اما جابهجایی از یک لایه به لایه دیگر (Flip-flop) به ندرت رخ میدهد و معمولاً نیازمند آنزیمهایی به نام فلپازها و اسکرامبلازها است. این پویایی باعث میشود غشا بتواند بهسرعت به تغییرات محیطی واکنش نشان دهد و ساختارهای جدیدی برای فرآیندهایی مانند اندوسیتوز و اگزوسیتوز ایجاد کند.
تفاوت غشا در سلولهای مختلف
گرچه ساختار کلی غشا در تمامی سلولهای زنده مشابه است، اما ترکیب دقیق آن بسته به نوع سلول و اندامک متفاوت است. برای نمونه:
-
غشای میتوکندری غنی از پروتئینهای زنجیره انتقال الکترون است.
-
غشای گلبول قرمز حاوی مقادیر زیادی پروتئینهای ساختاری مانند اسپکتـرین است که انعطافپذیری سلول را تضمین میکند.
-
غشای نورونها دارای کانالهای یونی تخصصی برای هدایت پیامهای الکتریکی است.
این تفاوتها نشان میدهد که غشا نهتنها یک ساختار عمومی، بلکه یک بستر تخصصی برای هر سلول است.
اهمیت مدل موزاییک سیال در پژوهشهای امروزی
مدل موزاییک سیال، علیرغم گذشت پنج دهه از معرفی آن، همچنان معتبرترین و پذیرفتهشدهترین مدل توصیفی غشای سلولی است. هرچند امروزه میدانیم که غشا پیچیدهتر از نسخهی کلاسیک این مدل است، اما اساس درک ما از ساختار، پویایی و عملکرد غشا بر پایه همین مدل بنا شده است. این مدل راه را برای توسعه ابزارهای دارورسانی، مهندسی غشاهای مصنوعی، و بررسی بیماریهایی که با نقص در پروتئینهای غشایی همراه هستند هموار ساخته است.
در یک نگاه کلی، مدل موزاییک سیال غشا را نه بهعنوان یک دیواره ساده، بلکه بهعنوان یک بافت زنده و متحرک معرفی میکند که با ترکیب پیچیدهای از لیپیدها، پروتئینها و کربوهیدراتها، تمامی فرآیندهای حیاتی سلول را هدایت مینماید. این مدل، زیربنای درک مکانیسمهای انتقال مواد است که در بخشهای بعدی به تفصیل به آن پرداخته خواهد شد.
انتشار ساده: عبور مواد بدون کمک
انتشار ساده یکی از ابتداییترین و در عین حال حیاتیترین مکانیزمهای عبور مواد از غشای سلولی است. در این نوع انتقال، مولکولها بدون نیاز به انرژی اضافی و بدون دخالت مستقیم پروتئینهای ناقل، از ناحیهای با غلظت بالاتر به ناحیهای با غلظت پایینتر حرکت میکنند. این فرایند بر اساس اصل کلی گرادیان غلظت و قوانین فیزیکی حرکت مولکولها انجام میشود.
اصل فیزیکی انتشار
انتشار ساده نتیجهی حرکت تصادفی مولکولها (Brownian motion) است. زمانی که اختلاف غلظت میان دو طرف غشا وجود داشته باشد، مولکولها تمایل دارند از ناحیه با غلظت زیاد به ناحیه با غلظت کم حرکت کنند تا تعادل دینامیک برقرار شود. این اصل را میتوان با قانون فیک (Fick’s law) توضیح داد که بیان میکند:
-
شدت جریان انتشار (Flux) با اختلاف غلظت مستقیم و با ضخامت غشا و مقاومت محیطی معکوس است.
-
در نتیجه، هرچه اختلاف غلظت بیشتر باشد، سرعت انتشار هم افزایش مییابد.
ویژگیهای انتشار ساده
انتشار ساده چند ویژگی اساسی دارد که آن را از سایر روشهای انتقال متمایز میکند:
-
بدون مصرف انرژی : این فرآیند به ATP یا انرژی متابولیکی نیاز ندارد.
-
بدون واسطه پروتئینی : برخلاف انتشار تسهیلشده یا انتقال فعال، در انتشار ساده نیازی به پروتئینهای ناقل یا کانالها نیست.
-
غیر اشباعشونده: چون به پروتئین خاصی وابسته نیست، با افزایش غلظت ماده، سرعت انتشار هم افزایش مییابد تا زمانی که به حالت تعادل برسد.
-
وابسته به ویژگیهای شیمیایی مولکول : تنها مولکولهایی میتوانند با انتشار ساده عبور کنند که کوچک، غیرقطبی و محلول در چربی باشند.
مولکولهایی که با انتشار ساده عبور میکنند
غشا به دلیل ماهیت دوگانهی لیپیدی خود، نسبت به بسیاری از مواد نفوذناپذیر است. با این حال، برخی مولکولها بهراحتی از طریق انتشار ساده عبور میکنند:
-
گازهای تنفسی : اکسیژن (O₂) و دیاکسید کربن (CO₂) به دلیل غیرقطبی بودن و اندازه کوچک، بهسرعت از غشا عبور میکنند.
-
مولکولهای آبگریز کوچک : نیتروژن (N₂)، اتانول و برخی داروهای چربیدوست میتوانند بهراحتی نفوذ کنند.
-
مولکولهای آب در حدی محدود : آب با وجود قطبی بودن، به دلیل اندازه کوچک، قادر است تا حدی از غشا عبور کند؛ هرچند مسیر اصلی آب در سلول از طریق کانالهای آکواپورین است.
عوامل مؤثر بر سرعت انتشار
چند عامل مهم بر سرعت انتشار ساده اثرگذار هستند:
-
شیب غلظت : هرچه اختلاف غلظت دو طرف بیشتر باشد، انتشار سریعتر است.
-
اندازه مولکول : مولکولهای کوچکتر سریعتر از مولکولهای بزرگتر منتشر میشوند.
-
حلالیت در چربی : هرچه مولکول چربیدوستتر باشد، راحتتر از لایه لیپیدی عبور میکند.
-
ضخامت و ترکیب غشا: غشاهایی که حاوی کلسترول بیشتری هستند، ممکن است سیالیت متفاوتی داشته باشند و این بر سرعت انتشار اثر بگذارد.
مثالهای زیستی انتشار ساده
در سیستمهای زنده، انتشار ساده نقشی اساسی دارد:
-
در تنفس سلولی، اکسیژن از خون به داخل سلولها منتشر میشود، در حالیکه دیاکسید کربن در مسیر معکوس حرکت میکند.
-
در گلبولهای قرمز خون، تبادل سریع گازها از طریق انتشار ساده انجام میشود که برای زنده ماندن سلولها ضروری است.
-
بسیاری از داروهای لیپوفیلیک از همین مسیر وارد سلولها میشوند، چراکه میتوانند از لایه لیپیدی عبور کنند.
اهمیت پزشکی و بالینی انتشار ساده
انتشار ساده صرفاً یک پدیده زیستی نیست، بلکه پیامدهای بالینی مهمی نیز دارد:
-
تأثیر بر طراحی داروها : داروهایی که باید وارد سلول شوند، اگر چربیدوست باشند، میتوانند از طریق انتشار ساده عبور کنند و اثرگذاری سریعتری داشته باشند.
-
سمیت و نفوذ مواد شیمیایی : برخی مواد سمی مانند حلالهای آلی به دلیل حلالیت بالا در چربی، میتوانند بهسرعت وارد سلولها شوند و اثرات تخریبی ایجاد کنند.
-
بیماریهای ریوی : اختلال در انتشار ساده گازها میتواند منجر به بیماریهایی مانند فیبروز ریوی یا ادم ریه شود، زیرا تبادل گاز بهدرستی انجام نمیگیرد.
محدودیتهای انتشار ساده
با وجود اهمیت بالا، انتشار ساده محدودیتهایی دارد:
-
فقط برای مولکولهای کوچک و غیرقطبی کارآمد است.
-
سرعت آن در مقایسه با انتقال فعال یا تسهیلشده پایینتر است.
-
سلول نمیتواند بهطور مستقیم آن را کنترل کند، زیرا فرآیندی منفعل است.
در جمعبندی، انتشار ساده را میتوان پایهایترین و قدیمیترین روش انتقال مواد در زیستشناسی دانست؛ روشی که با قوانین فیزیک کنترل میشود و به سلول اجازه میدهد گازها و مولکولهای کوچک را بدون صرف انرژی وارد یا خارج کند. این مکانیزم، با وجود سادگی، نقش اساسی در بقای موجودات زنده دارد و بسیاری از فرآیندهای حیاتی بدون آن امکانپذیر نیست.
انتشار تسهیل شده: عبور با کمک پروتئینها
انتشار تسهیلشده یکی از اساسیترین مکانیسمهای انتقال غشایی است که به سلولها امکان میدهد مولکولهایی را که به دلیل اندازه یا ماهیت قطبی نمیتوانند از غشا عبور کنند، با کمک پروتئینهای ویژه جابهجا کنند. این فرآیند، همچون انتشار ساده، غیر فعال است؛ یعنی به مصرف مستقیم انرژی نیاز ندارد و همچنان تحت کنترل گرادیان غلظت انجام میشود.
ماهیت انتشار تسهیلشده
غشای سلولی به دلیل ساختار دوگانهی لیپیدی خود، نسبت به بیشتر مولکولهای قطبی و بزرگ نفوذناپذیر است. بنابراین برای ورود یا خروج این مواد، سلول از پروتئینهای غشایی استفاده میکند که مانند دروازهها یا کانالهای انتخابی عمل میکنند.
در انتشار تسهیلشده:
-
مولکولها از ناحیه با غلظت بالا به سمت ناحیه با غلظت پایین حرکت میکنند.
-
انرژی مصرف نمیشود.
-
سرعت انتقال به ظرفیت پروتئینهای حامل بستگی دارد و میتواند اشباعپذیر باشد.
انواع پروتئینهای درگیر در انتشار تسهیلشده
انتقال تسهیلشده از طریق دو گروه اصلی پروتئین انجام میشود:
-
پروتئینهای کانالی (Channel proteins)
این پروتئینها مانند تونلهای آبی یا کانالهای یونی عمل میکنند و مسیر مستقیم و سریع برای عبور مواد فراهم میآورند. ویژگی مهم آنها اختصاصی بودن است؛ مثلاً کانال سدیم فقط یونهای سدیم را عبور میدهد. کانالها میتوانند باز و بسته شوند (gated channels) و در پاسخ به محرکهایی مثل تغییر ولتاژ غشا یا اتصال لیگاند فعال گردند. -
پروتئینهای ناقل یا حامل (Carrier proteins)
این پروتئینها مولکول مورد نظر را بهطور اختصاصی شناسایی کرده و پس از اتصال، تغییر شکل فضایی میدهند تا آن را از سمت دیگر غشا آزاد کنند. برخلاف کانالها که مسیر باز دارند، پروتئینهای حامل بهصورت گامبهگام عمل میکنند.
ویژگیهای انتشار تسهیلشده
چند ویژگی اساسی انتشار تسهیلشده را از انتشار ساده متمایز میکند:
-
اختصاصی بودن: هر پروتئین فقط برای یک یا چند مولکول خاص عمل میکند.
-
اشباع پذیری : وقتی تمام پروتئینهای ناقل مشغول انتقال باشند، افزایش غلظت ماده دیگر سرعت انتقال را افزایش نمیدهد.
-
قابل تنظیم بودن : بسیاری از کانالها و ناقلها توسط سیگنالهای درونسلولی یا بیرونسلولی تنظیم میشوند.
-
سرعت بالاتر نسبت به انتشار ساده: بهویژه برای مولکولهای قطبی که بدون کمک نمیتوانند از غشا عبور کنند.
مولکولهایی که با انتشار تسهیلشده منتقل میشوند
-
یونها : سدیم (Na⁺)، پتاسیم (K⁺)، کلسیم (Ca²⁺) و کلر (Cl⁻) از طریق کانالهای یونی جابهجا میشوند.
-
قندها : گلوکز نمونه بارز است که توسط ناقلهای ویژه مانند GLUT وارد سلول میشود.
-
آمینو اسیدها: که برای سنتز پروتئین ضروریاند و از طریق ناقلهای خاص وارد سلول میشوند.
عوامل مؤثر بر سرعت انتشار تسهیلشده
-
تعداد پروتئینهای ناقل یا کانالی در غشا.
-
اشباع ناقلها در غلظتهای بالا.
-
شرایط فیزیولوژیک مانند تغییر pH یا غلظت یونها.
-
تنظیم هورمونی؛ برای مثال، هورمون انسولین باعث افزایش تعداد ناقلهای گلوکز (GLUT4) در سطح سلولهای ماهیچهای و چربی میشود.
مثالهای زیستی انتشار تسهیلشده
-
انتقال گلوکز به داخل سلولهای بدن توسط پروتئینهای GLUT، نمونهای کلاسیک از انتشار تسهیلشده است.
-
انتقال یونها در نورونها از طریق کانالهای ولتاژ-وابسته که برای تولید پتانسیل عمل ضروریاند.
-
تنظیم آب سلولی توسط پروتئینهای آکواپورین که عبور سریع و انتخابی مولکولهای آب را ممکن میسازند.
اهمیت پزشکی و بالینی انتشار تسهیلشده
انتشار تسهیلشده اهمیت زیادی در پزشکی دارد و اختلال در آن میتواند زمینهساز بیماریهای جدی باشد:
-
در دیابت نوع ۲، حساسیت سلولها به انسولین کاهش مییابد و ورود گلوکز از طریق ناقلهای GLUT دچار اختلال میشود.
-
برخی بیماریهای ژنتیکی ناشی از نقص در کانالهای یونی هستند؛ بهعنوان نمونه، فیبروز کیستیک (Cystic Fibrosis) به دلیل جهش در ژن کانال کلر (CFTR) رخ میدهد.
-
بسیاری از داروهای مدرن برای اثرگذاری باید از طریق انتشار تسهیلشده وارد سلول یا اندامکها شوند.
محدودیتهای انتشار تسهیلشده
-
این فرآیند همچنان منفعل است و سلول قادر نیست مواد را بر خلاف گرادیان غلظت منتقل کند.
-
سرعت آن محدود به ظرفیت پروتئینهای ناقل است.
-
آسیب یا مهار این پروتئینها میتواند به اختلال شدید در هموستاز سلولی منجر شود.
در جمعبندی، انتشار تسهیلشده را میتوان ابزاری هوشمندانه برای عبور انتخابی مواد دانست که به سلولها امکان میدهد مولکولهای حیاتی را با سرعت و دقت بیشتری دریافت یا دفع کنند. این فرآیند، پلی میان انتشار ساده و انتقال فعال است و نقش بیبدیلی در بقای سلولی و کارکرد سیستمهای زیستی دارد.
انتقال فعال: جابهجایی بر خلاف گرادیان غلظت
انتقال فعال فرآیندی است که طی آن سلولها مواد را بر خلاف گرادیان غلظت یا گرادیان الکتروشیمیایی جابهجا میکنند. برخلاف انتشار ساده یا انتشار تسهیلشده که به انرژی نیاز ندارند، این مکانیسم وابسته به مصرف انرژی است؛ چرا که مولکولها از ناحیه با غلظت پایین به سمت ناحیه با غلظت بالا منتقل میشوند.
ماهیت انتقال فعال
غشای سلولی بهصورت طبیعی تمایل دارد مولکولها را در جهت کاهش اختلاف غلظت جابهجا کند، اما بسیاری از فرآیندهای حیاتی نیازمند آن هستند که سلول مواد را در خلاف جهت طبیعی انتشار منتقل کند. برای نمونه:
-
تجمع یونهای سدیم در خارج سلول و پتاسیم در داخل سلول، که برای ایجاد و حفظ پتانسیل غشایی ضروری است.
-
جذب مواد مغذی نادر در محیطی که غلظت آنها بسیار پایینتر از درون سلول است.
برای غلبه بر این مانع طبیعی، سلولها از انرژی شیمیایی (مانند ATP) یا انرژی حاصل از گرادیانهای یونی استفاده میکنند.
انواع انتقال فعال
انتقال فعال را میتوان به دو دسته اصلی تقسیم کرد:
-
انتقال فعال اولیه
در این نوع، انرژی مستقیماً از تجزیه ATP یا سایر ترکیبات پرانرژی تأمین میشود. پروتئینهای حامل یا پمپهای غشایی با مصرف ATP تغییر شکل داده و یونها یا مولکولها را بر خلاف گرادیان غلظت حرکت میدهند.
نمونه بارز آن، پمپ سدیم – پتاسیم (Na⁺/K⁺ ATPase) است که یون سدیم را به خارج و یون پتاسیم را به داخل سلول میراند و بدین وسیله پتانسیل الکتروشیمیایی و تعادل اسمزی سلول را حفظ میکند. -
انتقال فعال ثانویه
در این نوع، انرژی مستقیماً از ATP تأمین نمیشود بلکه از گرادیان یونی ایجاد شده توسط انتقال فعال اولیه استفاده میشود. به عبارت دیگر، انرژی حاصل از حرکت یونها در جهت گرادیان غلظت خودشان، برای جابهجایی همزمان مولکولهای دیگر در خلاف جهتشان بهکار میرود.
این مکانیسم به دو شکل اصلی عمل میکند:-
همانتقال : (Symport) انتقال همزمان دو ماده در یک جهت. برای مثال، ورود گلوکز به سلولهای روده به همراه سدیم.
-
پادانتقال : (Antiport) انتقال همزمان دو ماده در جهت مخالف. مانند تبادل یون کلسیم و سدیم در برخی سلولهای عضلانی.
-
پروتئینهای درگیر در انتقال فعال
انتقال فعال توسط پروتئینهای غشایی ویژهای انجام میشود که اغلب با نام پمپهای غشایی شناخته میشوند. این پمپها ویژگیهای زیر را دارند:
-
اختصاصی بودن برای یون یا مولکول خاص.
-
نیاز به تغییرات ساختاری در پروتئین طی هر چرخه انتقال.
-
وابستگی به منابع انرژی، چه ATP و چه گرادیان یونی.
اهمیت زیستی انتقال فعال
انتقال فعال برای حیات سلولی اهمیت بنیادین دارد و بدون آن بقای سلولها غیرممکن است. نقشهای کلیدی آن شامل موارد زیر است:
-
حفظ پتانسیل غشایی در سلولهای عصبی و ماهیچهای که برای ایجاد پیامهای عصبی و انقباض عضلانی حیاتی است.
-
تنظیم حجم سلولی و جلوگیری از تورم یا چروکیده شدن سلولها.
-
جذب مواد مغذی ضروری مانند اسیدهای آمینه، گلوکز و یونها حتی زمانی که غلظت آنها در محیط خارجی پایینتر است.
-
خروج مواد زائد یا یونهای سمی از داخل سلول برای حفظ هموستاز.
مثالهای برجسته انتقال فعال
-
پمپ سدیم – پتاسیم : (Na⁺/K⁺ ATPase) انتقال سه یون سدیم به بیرون و دو یون پتاسیم به درون سلول در هر چرخه، با مصرف یک مولکول ATP.
-
پمپ پروتون : (H⁺ ATPase) در میتوکندری و لیزوزومها نقش کلیدی در ایجاد گرادیان پروتونی دارد.
-
پمپ کلسیم : (Ca²⁺ ATPase) یون کلسیم را از سیتوپلاسم به شبکه آندوپلاسمی یا خارج سلول منتقل میکند تا غلظت پایین کلسیم درون سلولی حفظ شود.
عوامل مؤثر بر انتقال فعال
-
سطح انرژی سلولی : (ATP) هرگونه کاهش در تولید ATP مانند هیپوکسی میتواند عملکرد انتقال فعال را مختل کند.
-
تعداد و فعالیت پمپهای غشایی : سلولها میتوانند بسته به شرایط محیطی بیان پروتئینهای پمپ را افزایش یا کاهش دهند.
-
تنظیم هورمونی : برخی هورمونها مانند تیروکسین یا انسولین میتوانند فعالیت پمپها را تعدیل کنند.
اهمیت پزشکی انتقال فعال
اختلال در انتقال فعال با بیماریهای متعددی ارتباط دارد:
-
در مسمومیت با گلیکوزیدهای قلبی مانند دیژیتالیس، مهار پمپ سدیم – پتاسیم منجر به افزایش کلسیم درونسلولی و تقویت انقباض قلب میشود.
-
بیماریهای ژنتیکی ناشی از نقص در پمپهای یونی، مانند بعضی انواع فشار خون ارثی یا اختلالات عصبی.
-
هدف بسیاری از داروها، تنظیم فعالیت پمپهای غشایی است؛ برای نمونه مهارکنندههای پمپ پروتون (PPI) که در درمان زخم معده بهکار میروند.
در جمعبندی، انتقال فعال را میتوان موتور پرانرژی سلول دانست که امکان جابهجایی انتخابی مواد را فراتر از محدودیتهای طبیعی انتشار فراهم میآورد. این مکانیسم، پایهگذار حفظ هموستاز، ارسال پیامهای عصبی، انقباض عضلات، و تنظیمات حیاتی در سطح سلولی است. بدون آن، حیات پیچیده سلولی و عملکرد اندامها غیرقابل تصور خواهد بود.
اندوسیتوز: ورود مواد به درون سلول
اندوسیتوز فرآیندی است که طی آن سلول مواد را در مقیاس بزرگ از محیط بیرونی به درون خود وارد میکند. برخلاف انتشار یا انتقال فعال که معمولاً شامل جابهجایی یونها و مولکولهای کوچک از طریق پروتئینهای غشایی هستند، در اندوسیتوز غشای پلاسمایی دچار تغییر شکل شده و بخشی از مواد محیطی را درون وزیکولهایی محصور میسازد.
این مکانیسم برای ورود مولکولهای بزرگ، ذرات جامد، و حتی میکروارگانیسمها به درون سلول حیاتی است و به سلولها اجازه میدهد علاوه بر تأمین مواد مغذی، در دفاع ایمنی و تنظیم سیگنالهای سلولی نیز نقشآفرینی کنند.
ماهیت اندوسیتوز
در طی اندوسیتوز، غشای پلاسمایی در محل تماس با ماده خارجی فرو میرود و پس از احاطه کردن آن، بستهای به نام وزیکول اندوسیتیک تشکیل میدهد. این وزیکولها سپس به سمت داخل سلول حرکت کرده و به اندامکهایی مانند لیزوزوم متصل میشوند تا محتوای خود را تجزیه یا پردازش کنند.
اندوسیتوز به انرژی نیاز دارد، زیرا شامل بازآرایی اسکلت سلولی و تغییر شکل غشا است. بنابراین نوعی فرآیند فعال محسوب میشود.
انواع اندوسیتوز
اندوسیتوز به چندین شکل مختلف رخ میدهد که هرکدام برای اهداف خاصی طراحی شدهاند:
-
فاگوسیتوز (Phagocytosis)
به معنای «سلولخواری» است و در آن سلول ذرات جامد بزرگ مانند باکتریها، بقایای سلولی یا ذرات غیرآلی را به درون خود میکشد. این نوع بیشتر در سلولهای ایمنی مانند ماکروفاژها و نوتروفیلها دیده میشود. در فاگوسیتوز، زوائد غشایی به نام پایای کاذب (Pseudopodia) ذره را احاطه کرده و سپس وزیکول بزرگی به نام فاگوزوم تشکیل میدهند.
فاگوزوم معمولاً با لیزوزوم ادغام شده و محتوای آن هضم میشود. این فرآیند یکی از مهمترین مکانیسمهای دفاعی بدن در برابر عوامل بیماریزا است. -
پینوسیتوز (Pinocytosis)
به معنای «نوشیدن سلول» است و شامل ورود قطرات کوچک مایع خارج سلولی به همراه مولکولهای محلول در آن میشود. در این حالت، غشا بهصورت یکنواخت فرورفته و وزیکولهای کوچک متعددی ایجاد میکند. این مکانیسم در بیشتر سلولهای بدن رخ میدهد و راهی برای ورود مداوم مواد مغذی و تنظیم ترکیب مایع درونسلولی محسوب میشود. -
اندوسیتوز وابسته به گیرنده (Receptor-mediated endocytosis)
این نوع تخصصیترین و کارآمدترین شکل اندوسیتوز است. در این مکانیسم، سلولها تنها مولکولهایی را وارد میکنند که به گیرندههای خاص غشایی متصل شوند.
پس از اتصال لیگاند (مانند کلسترول، فاکتورهای رشد یا هورمونها) به گیرنده، غشا فرورفته و وزیکولی پوشیده از پروتئینی به نام کلترین (Clathrin-coated vesicle) تشکیل میشود. این وزیکولها سپس محتوای خود را به اندامکهای داخلی تحویل میدهند.
این فرآیند موجب میشود که سلولها بتوانند مواد را بهطور انتخابی و با دقت بالا جذب کنند.
اهمیت اندوسیتوز
اندوسیتوز نقشی اساسی در زندگی سلول ایفا میکند و برخی از مهمترین عملکردهای آن عبارتند از:
-
تأمین مواد مغذی : سلولها از طریق اندوسیتوز، مولکولهای حیاتی مانند لیپیدها، پروتئینها و ویتامینها را جذب میکنند.
-
تنظیم سیگنالینگ سلولی : بسیاری از گیرندههای غشایی پس از اتصال به لیگاند خود، از طریق اندوسیتوز به داخل سلول وارد شده و مسیرهای پیامرسانی را فعال یا غیرفعال میکنند.
-
دفاع ایمنی : سلولهای فاگوسیتکننده با بلعیدن باکتریها و ویروسها نخستین خط دفاعی بدن در برابر عفونتها هستند.
-
کنترل ترکیب غشای پلاسمایی : با ورود بخشهایی از غشا به داخل سلول، اندوسیتوز به بازسازی و تنظیم ترکیب غشا کمک میکند.
مثالهای مهم اندوسیتوز در بدن
-
جذب کلسترول توسط سلولها از طریق اندوسیتوز وابسته به گیرنده، که نقص در آن منجر به بیماریهای ارثی مانند هیپرکلسترولمی خانوادگی میشود.
-
فاگوسیتوز باکتریها توسط ماکروفاژها که نقش حیاتی در ایمنی ذاتی دارد.
-
ورود ویروسها مانند HIV و آنفلوآنزا به درون سلولها، که از مسیر اندوسیتوز برای ورود به میزبان استفاده میکنند.
در جمعبندی، اندوسیتوز را میتوان دروازه ورود انتخابی و سازمانیافته مواد به درون سلول دانست. این فرآیند به سلولها امکان میدهد مواد بزرگ و پیچیده را دریافت کنند، دفاع ایمنی را فعال سازند و مسیرهای سیگنالینگ خود را تنظیم نمایند. اهمیت این مکانیسم تا جایی است که اختلال در آن میتواند منجر به بیماریهای متابولیک، ایمنی یا حتی تسهیل عفونتهای ویروسی شود.
اگزوسیتوز: خروج مواد از سلول
اگزوسیتوز فرآیندی است که طی آن سلولها مواد را درون وزیکولها بستهبندی کرده و سپس به خارج از محیط سلولی ترشح میکنند. این مکانیزم در تقابل با اندوسیتوز قرار دارد، بهگونهای که در حالی که اندوسیتوز ورود مواد به درون سلول را ممکن میسازد، اگزوسیتوز راه خروج و ترشح مواد به فضای خارج سلول را فراهم میآورد.
این فرآیند برای بسیاری از عملکردهای حیاتی از جمله ترشح هورمونها، آزادسازی ناقلهای عصبی، دفع مواد زائد و بازسازی غشای پلاسمایی ضروری است.
ماهیت اگزوسیتوز
در طی اگزوسیتوز، وزیکولهایی که در اندامکهایی مانند دستگاه گلژی یا اندوزومها شکل گرفتهاند، به سمت غشای پلاسمایی حرکت میکنند. این حرکت اغلب توسط اسکلت سلولی (ریز لولهها و فیلامانهای اکتین) هدایت میشود. پس از رسیدن وزیکول به سطح غشا، دو غشا با کمک پروتئینهای تخصصی با یکدیگر ادغام شده و محتوای وزیکول به بیرون سلول تخلیه میگردد.
این عمل نه تنها به ترشح مواد کمک میکند بلکه بخشی از غشای وزیکول نیز به غشای پلاسمایی اضافه شده و در بازسازی و گسترش غشا نقش ایفا میکند.
انواع اگزوسیتوز
اگزوسیتوز به طور کلی به دو دسته اصلی تقسیم میشود:
-
اگزوسیتوز تنظیمشده (Regulated exocytosis)
این نوع در سلولهایی رخ میدهد که مواد خاصی مانند هورمونها، آنزیمها یا ناقلهای عصبی را در وزیکولهای ترشحی ذخیره کردهاند. این وزیکولها تنها در پاسخ به یک سیگنال خاص (مانند افزایش غلظت یون کلسیم یا تحریک عصبی) با غشا ادغام شده و محتوای خود را آزاد میکنند.
نمونه بارز این نوع، ترشح انسولین توسط سلولهای بتای پانکراس یا آزادسازی ناقلهای عصبی در سیناپسها است. -
اگزوسیتوز غیرتنظیمشده (Constitutive exocytosis)
این نوع به صورت پیوسته و بدون نیاز به محرک خاص در بیشتر سلولها رخ میدهد. هدف اصلی آن تأمین پروتئینها و لیپیدهای لازم برای بازسازی غشای پلاسمایی و نیز ترشح پروتئینهای عمومی است.
به عنوان مثال، سلولهای کبدی به طور مداوم پروتئینهای پلاسما مانند آلبومین را از این مسیر ترشح میکنند.
پروتئینها و مولکولهای کلیدی در اگزوسیتوز
اگزوسیتوز فرآیندی بسیار سازمانیافته و وابسته به پروتئینهای اختصاصی است. برخی از مهمترین آنها عبارتند از:
-
پروتئینهای : SNARE این پروتئینها در هر دو غشای وزیکول و غشای پلاسمایی قرار دارند و باعث اتصال و ادغام دقیق وزیکول با غشا میشوند.
-
کلسیم یونها : افزایش ناگهانی غلظت کلسیم داخل سلولی معمولاً محرک اصلی شروع فرایند اگزوسیتوز تنظیمشده است.
-
Rab GTPase ها : این پروتئینها در هدایت وزیکولها به مقصد صحیح و کنترل مراحل اتصال نقش اساسی دارند.
اهمیت اگزوسیتوز در سلولها
اگزوسیتوز تنها یک روش دفع ساده مواد نیست، بلکه در بسیاری از عملکردهای حیاتی بدن نقش کلیدی دارد:
-
ترشح هورمونها و پیامرسانهای شیمیایی : بدون اگزوسیتوز، غدد درونریز قادر به انتقال پیامهای حیاتی به سایر بخشهای بدن نخواهند بود.
-
ارتباط عصبی : اگزوسیتوز ناقلهای عصبی در سیناپسها را آزاد کرده و امکان انتقال سیگنال بین نورونها را فراهم میسازد.
-
دفع مواد زائد : سلولها از طریق اگزوسیتوز، فرآوردههای ناخواسته متابولیسمی یا بقایای اندوسیتوز را به بیرون انتقال میدهند.
-
بازسازی و گسترش غشا : هر بار که وزیکولی با غشا ادغام میشود، بخشی از غشای آن به غشای سلول افزوده شده و موجب افزایش سطح و بازسازی آن میگردد.
مثالهای بارز اگزوسیتوز در بدن
-
آزادسازی ناقل عصبی دوپامین یا استیلکولین در پایانههای عصبی برای انتقال پیامهای عصبی.
-
ترشح انسولین و گلوکاگون توسط پانکراس برای تنظیم سطح قند خون.
-
ترشح پروتئینهای آنتیبادی توسط سلولهای پلاسمایی در سیستم ایمنی.
-
دفع بقایای فاگوسیتوز شده پس از هضم باکتریها توسط ماکروفاژها.
در جمعبندی، اگزوسیتوز را میتوان راه ارتباطی سلول با محیط اطراف و سایر سلولها دانست. این فرآیند نه تنها در دفع و ترشح مواد نقش دارد، بلکه برای حیات، رشد، ارتباط و دفاع سلولی نیز کاملاً ضروری است. اختلال در مکانیزمهای اگزوسیتوز میتواند با بیماریهایی مانند دیابت، اختلالات عصبی و ضعف سیستم ایمنی همراه باشد.
غشا و دارورسانی: از سیستمهای نانو تا غشاهای مصنوعی
پیشرفتهای علوم زیستی و فناوری نانو در دهههای اخیر موجب شدهاند که غشاهای زیستی و مصنوعی جایگاهی کلیدی در سامانههای دارورسانی هدفمند و کنترلشده پیدا کنند. غشا نه تنها به عنوان یک مانع انتخابی در تبادل مواد نقش ایفا میکند، بلکه میتواند به عنوان یک پلتفرم هوشمند برای حمل و رهاسازی دارو مورد استفاده قرار گیرد.
نقش غشاهای زیستی در دارورسانی
غشای پلاسمایی سلول اولین سد در برابر ورود داروها به محیط داخل سلولی است. دارورسانی مؤثر نیازمند طراحی دارو یا حاملهایی است که بتوانند به طور انتخابی و ایمن از این مانع عبور کنند. بسیاری از داروهای مدرن با الهام از مکانیسمهای طبیعی انتقال طراحی میشوند، به گونهای که از مسیرهای انتشار ساده، انتشار تسهیلشده، انتقال فعال یا اندوسیتوز تقلید کنند.
نانوذرات و تعامل آنها با غشا
ورود فناوری نانو، انقلابی در شیوه طراحی داروها ایجاد کرده است. نانوذرات لیپیدی، پلیمری، فلزی و هیبریدی قادرند به صورت کنترلشده با غشای سلولی برهمکنش داشته باشند. برخی از مهمترین ویژگیهای این سامانهها عبارتند از:
-
عبور هدفمند از غشا با استفاده از لیگاندهایی که به گیرندههای خاص روی سلول متصل میشوند.
-
افزایش پایداری دارو در برابر تخریب آنزیمی یا شیمیایی.
-
رهاسازی تدریجی و کنترلشده که مانع از افزایش ناگهانی غلظت دارو و عوارض جانبی میشود.
-
امکان عبور از موانع پیچیده زیستی مانند سد خونی–مغزی که به طور طبیعی نفوذناپذیر است.
لیپوزومها: الگوبرداری از غشاهای زیستی
یکی از موفقترین سامانههای دارورسانی نانویی، لیپوزومها هستند. لیپوزومها وزیکولهای کروی هستند که از یک یا چند لایه دوگانه لیپیدی تشکیل شدهاند. این ساختار به آنها اجازه میدهد تا هم داروهای محلول در آب (درون محفظه آبی) و هم داروهای محلول در چربی (در لایه لیپیدی) را حمل کنند.
لیپوزومها از نظر ساختاری شباهت زیادی به غشای سلولی دارند، بنابراین میتوانند به راحتی با غشا ادغام شوند یا از طریق اندوسیتوز وارد سلول شوند. برخی از داروهای ضدسرطان و ضدعفونیکنندهها در قالب لیپوزومهای دارورسانی به کار میروند.
غشاهای پلیمری و دارورسانی کنترلشده
علاوه بر نانوذرات، غشاهای پلیمری مصنوعی نیز به عنوان سامانههای دارورسانی نوین توسعه یافتهاند. این غشاها میتوانند به گونهای طراحی شوند که دارای تخلخلهای کنترلشده، بار سطحی خاص یا حساسیت به محرکهای محیطی باشند.
برای نمونه:
-
غشاهای حساس به : pH در محیط اسیدی یا قلیایی خاصی تغییر شکل داده و دارو را آزاد میکنند.
-
غشاهای حساس به دما: در دمایی بالاتر یا پایینتر از حد معین نفوذپذیریشان افزایش مییابد.
-
غشاهای پاسخدهنده به میدانهای مغناطیسی یا نوری : با تحریک خارجی باز شده و دارو را بهصورت انتخابی رها میکنند.
این ویژگیها امکان ایجاد سامانههای هوشمند دارورسانی را فراهم کرده است که تنها در شرایط خاصی دارو را فعال میسازند، در نتیجه اثرگذاری دارو افزایش یافته و عوارض جانبی کاهش مییابد.
عبور از سد خونی–مغزی
یکی از چالشهای اساسی در دارورسانی، عبور از سد خونی–مغزی است. این سد به دلیل ساختار بسیار فشرده سلولهای اندوتلیال، مانع ورود اکثر داروها به مغز میشود. استفاده از نانوذرات لیپیدی و پلیمرهای زیستتخریبپذیر که توانایی ادغام با غشای اندوتلیال یا عبور از طریق گیرندههای سطحی دارند، راهکار نوینی برای درمان بیماریهای عصبی مانند آلزایمر و پارکینسون فراهم کرده است.
غشاهای مصنوعی در پزشکی بازساختی
غشاهای مصنوعی تنها به دارورسانی محدود نمیشوند، بلکه در حوزههایی مانند مهندسی بافت و پزشکی بازساختی نیز کاربرد دارند. این غشاها میتوانند:
-
به عنوان داربستهای زیستی برای رشد سلولها به کار روند.
-
داروها یا فاکتورهای رشد را به صورت تدریجی آزاد کنند و فرآیند ترمیم را تسریع نمایند.
-
نقش جایگزین غشاهای آسیبدیده را ایفا کنند، مانند غشاهای مصنوعی در پانسمانهای پیشرفته زخم.
مثالهای عملی و کاربردی
-
داروهای ضدسرطان مانند دوکسوروبیسین در قالب لیپوزومها برای افزایش کارایی و کاهش سمیت تجویز میشوند.
-
واکسنهای نانویی با استفاده از نانوذرات لیپیدی طراحی شدهاند که کارایی سیستم ایمنی را افزایش میدهند.
-
پچهای دارویی مبتنی بر غشاهای پلیمری که دارو را از طریق پوست به طور تدریجی آزاد میکنند.
-
غشاهای زیستتقلیدی برای رهایش آنزیمها یا فاکتورهای رشد در درمانهای بازساختی.
در جمعبندی، میتوان گفت که غشاها از سدهای ساده زیستی فراتر رفته و امروزه به ابزارهایی کاربردی و هوشمند در مهندسی دارورسانی تبدیل شدهاند. چه در مقیاس نانو و چه در قالب غشاهای مصنوعی پیشرفته، این سامانهها توانستهاند چشماندازهای تازهای در درمان بیماریهای پیچیده و مزمن ایجاد کنند. آینده پزشکی نوین به سمت طراحی غشاهایی پیش میرود که نه تنها دارو را منتقل میکنند، بلکه بهطور فعال با بدن ارتباط برقرار کرده و درمان شخصیسازیشده را امکانپذیر میسازند.
مدلسازی محاسباتی و بیوفیزیکی غشا
غشاهای زیستی به دلیل ساختار پیچیده و رفتار پویا، مطالعه و درک عمیقی را میطلبند. روشهای تجربی اگرچه اطلاعات ارزشمندی درباره ترکیب شیمیایی، دینامیک و نقش عملکردی غشاها ارائه میدهند، اما محدودیتهایی در مشاهده جزئیات در مقیاس اتمی یا زمانهای طولانی دارند. به همین دلیل، مدلسازی محاسباتی و بیوفیزیکی به عنوان ابزاری قدرتمند در کنار آزمایشهای تجربی توسعه یافته است تا بتواند دیدگاهی جامع از ویژگیهای غشا ارائه کند.
اهمیت مدلسازی در مطالعه غشا
مدلسازیهای کامپیوتری امکان بررسی رفتار مولکولی غشاها را در شرایطی فراهم میکنند که در آزمایشگاه بهسختی قابل دستیابی است. برای نمونه:
-
مشاهده نحوه آرایش فسفولیپیدها در لایه دوگانه لیپیدی.
-
بررسی تعامل پروتئینهای غشایی با لیپیدها.
-
شبیهسازی فرآیندهای اندوسیتوز، اگزوسیتوز و انتقال فعال در سطح مولکولی.
-
پیشبینی اثر داروها و نانوذرات بر ساختار و پایداری غشا.
این مدلها به محققان کمک میکنند تا فراتر از مشاهدات مستقیم، به تحلیلهای پیشبینیکننده دست یابند و مسیرهای احتمالی برای طراحی دارو یا توسعه غشاهای مصنوعی را ارزیابی کنند.
روشهای مدلسازی محاسباتی
مدلسازی غشاها بر اساس مقیاسهای مختلف زمانی و مکانی انجام میشود و هر روش دقت و توانایی خاص خود را دارد. مهمترین رویکردها عبارتند از:
-
دینامیک مولکولی (MD)
این روش پرکاربردترین مدلسازی در سطح اتمی است. در دینامیک مولکولی، حرکت اتمها و مولکولها تحت قوانین مکانیک کلاسیک شبیهسازی میشود. با استفاده از این روش میتوان تغییرات ساختاری غشا، نفوذپذیری مولکولها، و پایداری پروتئینهای غشایی را در بازههای زمانی نانوثانیه تا میکروثانیه بررسی کرد. -
مدلهای همنهشتی (Coarse-grained)
در این روش، گروهی از اتمها به صورت یک واحد سادهتر مدل میشوند تا امکان شبیهسازی سیستمهای بزرگتر و زمانهای طولانیتر فراهم شود. این مدل به ویژه برای بررسی پدیدههایی مانند ادغام وزیکولها با غشا یا تشکیل ریزدامنههای لیپیدی اهمیت دارد. -
مدلهای پیوسته (Continuum Models)
این مدلها بر اساس قوانین فیزیک کلاسیک و معادلات ریاضی، رفتار کلی غشا را در مقیاس ماکروسکوپی بررسی میکنند. برای مثال، معادلات الاستیسیته و مکانیک سیالات برای تحلیل خمیدگی غشا یا پایداری وزیکولها به کار میروند. -
شبیهسازی کوانتومی
در مواردی که نیاز به بررسی برهمکنشهای الکترونی یا واکنشهای شیمیایی دقیق داریم (مانند اتصال دارو به پروتئینهای غشایی(، از مدلسازی کوانتومی بهره گرفته میشود.
مدلسازی بیوفیزیکی
علاوه بر محاسبات کامپیوتری، مدلسازی بیوفیزیکی با استفاده از قوانین فیزیک و ریاضیات تلاش میکند تا رفتار غشا را توضیح دهد. برخی از محورهای اصلی در این زمینه عبارتند از:
-
مدل موزاییک سیال : که پایهای برای درک پویایی لیپیدها و پروتئینها در غشا است.
-
مدلهای خمیدگی غشا : (Helfrich model) برای توضیح پدیدههایی مانند جوانهزنی وزیکولها یا تغییر شکل در اندوسیتوز.
-
مدلهای الکترواستاتیک: که نقش بارهای سطحی و میدانهای الکتریکی را در پایداری و انتقال یونها تحلیل میکنند.
-
مدلهای نفوذ و انتقال : که چگونگی حرکت مولکولها از میان غشا بر اساس گرادیان غلظت و انرژی را بررسی میکنند.
کاربردهای مدلسازی در پزشکی و فناوری
مدلسازی محاسباتی و بیوفیزیکی غشاها کاربردهای گستردهای در علوم زیستی و مهندسی پزشکی دارد:
-
دارورسانی هدفمند : با پیشبینی نحوه تعامل نانوذرات با غشا میتوان کارایی و ایمنی دارورسانی را بهبود بخشید.
-
درک بیماریها : بسیاری از اختلالات مانند آلزایمر، پارکینسون یا بیماریهای ویروسی با تغییر در غشا همراه هستند. مدلسازی میتواند مکانیسمهای این تغییرات را آشکار سازد.
-
طراحی غشاهای مصنوعی : برای تولید بیوسنسورها، پانسمانهای هوشمند یا سامانههای کنترل رهایش دارو، مدلسازی کمک میکند بهترین ساختار و ترکیب انتخاب شود.
-
زیستفناوری و نانوفناوری : مدلسازی به مهندسان کمک میکند تا سامانههایی الهامگرفته از غشاهای طبیعی طراحی کنند.
چالشها و چشمانداز آینده
اگرچه مدلسازی محاسباتی ابزار قدرتمندی است، اما محدودیتهایی نیز دارد. دقت پیشبینیها وابسته به کیفیت دادههای ورودی، قدرت محاسباتی و صحت الگوریتمهاست. همچنین، بسیاری از فرآیندهای زیستی در مقیاسهای زمانی طولانیتر از محدوده شبیهسازیهای فعلی رخ میدهند.
با این حال، پیشرفتهای روزافزون در هوش مصنوعی، یادگیری ماشین و پردازش موازی نویدبخش آیندهای است که در آن بتوان مدلهایی چندمقیاسی و دقیق ایجاد کرد. این مدلها قادر خواهند بود رفتار غشا را در مقیاس اتمی تا بافتی پیشبینی کرده و در نهایت به طراحی درمانهای شخصیسازیشده کمک کنند.
در یک نگاه کلی، مدلسازی محاسباتی و بیوفیزیکی غشا به پلی میان مشاهدات تجربی و تفسیر نظری تبدیل شده است. این رویکردها نه تنها درک ما از ساختار و عملکرد غشا را عمیقتر میکنند، بلکه زمینهساز نوآوریهای مهم در پزشکی و فناوری خواهند بود.
کاربردهای صنعتی، مهندسی و پزشکی غشاهای زیستی و مصنوعی
غشاها، چه طبیعی و چه مصنوعی، نقش حیاتی در فرآیندهای زیستی و صنعتی دارند. ساختار پویا و انتخابپذیر غشاها، امکان جداسازی مولکولها، انتقال هدفمند مواد و حفاظت سلولی را فراهم میکند. در نتیجه، غشاها در حوزههای مختلف علمی و کاربردی بهصورت گسترده مورد استفاده قرار میگیرند.
کاربردهای صنعتی
در صنعت، غشاهای مصنوعی ابزار مهمی برای جداسازی و تصفیه محسوب میشوند:
-
تصفیه آب و فاضلاب : غشاهای نیمهتراوا قادر به حذف یونها، باکتریها و ذرات معلق هستند. فناوریهایی مانند اسمز معکوس (RO) و نانوفیلتراسیون بر پایه غشاهای پلیمری طراحی شدهاند.
-
صنایع غذایی و نوشیدنی : غشاها برای کنسانترهسازی شیر، آب میوه و محصولات لبنی و همچنین حذف باکتریها و آلایندهها به کار میروند.
-
صنایع شیمیایی و پتروشیمی : جداسازی حلالها، گازها و ترکیبات آلی از طریق غشاهای انتخابپذیر باعث کاهش مصرف انرژی و بهبود کارایی فرآیندها میشود.
کاربردهای مهندسی و بیوفیزیکی
غشاهای زیستی و مصنوعی در حوزه مهندسی به عنوان المانهای طراحی سامانههای پیچیده مورد استفاده قرار میگیرند:
-
بیوراکتورها و سامانههای زیستمهندسی: غشاها امکان کنترل محیط سلولی و حذف محصولات جانبی را فراهم میکنند.
-
بیوسنسورها : غشاهای مصنوعی با قابلیت انتخابپذیری بالا برای تشخیص بیومولکولها و آنالیتها در محیطهای پیچیده استفاده میشوند.
-
نانوفناوری : در طراحی نانوذرات و وزیکولهای دارورسان، غشاهای لیپیدی یا پلیمری امکان هدفمندسازی و محافظت داروها را فراهم میکنند.
کاربردهای پزشکی
در پزشکی، غشاها نقش اساسی در درمان، تشخیص و مهندسی بافت دارند:
-
دارورسانی هدفمند: غشاهای نانوذرات و وزیکولهای لیپیدی امکان ورود دارو به سلولهای هدف بدون آسیب به سلولهای سالم را فراهم میکنند.
-
پانسمانهای هوشمند و زخمپوشها : غشاهای پلیمری و هیدروژلی قادر به کنترل رهایش دارو، حفظ رطوبت و جلوگیری از عفونت هستند.
-
تصفیه خون و دیالیز: غشاهای نیمهتراوا در دستگاههای دیالیز برای حذف سموم و متابولیتها به کار میروند.
-
مهندسی بافت : غشاهای زیستی و مصنوعی به عنوان اسکافولدها برای رشد سلولها و بازسازی بافتها استفاده میشوند.
-
حاملهای دارویی نانو: طراحی غشاهای لیپیدی یا پلیمری با قابلیت نفوذپذیری کنترل شده، امکان انتقال داروهای ضدسرطان یا آنتیبادیها به بافت هدف را فراهم میکند.
مزایا و محدودیتهای کاربردی
مزایا:
-
افزایش کارایی فرآیندها در صنایع و پزشکی.
-
امکان هدفمند کردن انتقال مواد و داروها.
-
کنترل دقیق محیط سلولی و شرایط بیوشیمیایی.
محدودیتها:
-
حساسیت برخی غشاهای مصنوعی به شرایط شیمیایی و حرارتی.
-
هزینه بالای تولید غشاهای با کارایی بسیار بالا.
-
نیاز به اصلاح و طراحی بهینه برای کاربردهای خاص در پزشکی و صنعت.
چشمانداز آینده
پیشرفت در مواد نوین، نانوفناوری و هوش مصنوعی نویدبخش توسعه نسل جدید غشاها است که همزمان دارای انتخابپذیری بالا، پایداری شیمیایی و مکانیکی و قابلیت زیستسازگاری هستند. این غشاها میتوانند به طور گسترده در درمان بیماریها، تولید مواد با کیفیت بالا و کاهش مصرف انرژی در فرآیندهای صنعتی به کار گرفته شوند.
جمعبندی نهایی و چشمانداز آینده
غشاها، به عنوان یکی از بنیادیترین ساختارهای سلولی و مهندسی، نقش کلیدی در حفظ هموستازی، انتقال مواد و ارتباط سلولی ایفا میکنند. مطالعه غشاها نه تنها بینش عمیقی از عملکردهای زیستی به ما میدهد، بلکه امکان طراحی سیستمهای مصنوعی با قابلیتهای پیشرفته را نیز فراهم میآورد. در این مقاله، با بررسی سازوکارهای مختلف انتقال مواد از جمله انتشار ساده، انتشار تسهیلشده، انتقال فعال، اندوسیتوز و اگزوسیتوز، همچنین کاربردهای غشاهای طبیعی و مصنوعی در صنعت، مهندسی و پزشکی، تصویری جامع از اهمیت غشاها ارائه شد.
جمعبندی نکات کلیدی
-
غشاها با ساختار دو لایه فسفولیپیدی و پروتئینهای مرتبط، مرزهای انتخابپذیر بین محیط داخلی و خارجی سلول ایجاد میکنند و توانایی کنترل دقیق ورود و خروج مولکولها را دارند.
-
انتقال مواد از طریق غشا میتواند به صورت غیرفعال، تسهیلشده یا فعال انجام شود، که هر کدام مزایا و محدودیتهای خاص خود را دارند و بسته به نیاز سلول یا کاربرد صنعتی، انتخاب میشوند.
-
اندوسیتوز و اگزوسیتوز به سلولها امکان میدهد مواد بزرگ یا ذرات را به صورت وزیکولی وارد یا خارج کنند، امری حیاتی برای حفظ عملکرد سلولی و پاسخ به محیط.
-
غشاهای مصنوعی و نانوغشاها در دارورسانی، تصفیه آب، صنایع غذایی، بیوراکتورها و مهندسی بافت کاربرد گسترده دارند و توانایی کنترل دقیق انتقال مولکولها را فراهم میکنند.
-
مدلسازی محاسباتی و بیوفیزیکی غشا، ابزار قدرتمندی برای پیشبینی رفتار غشا، طراحی مواد نوین و بهینهسازی فرآیندها در کاربردهای صنعتی و پزشکی است.
چشمانداز آینده
با پیشرفت در مواد هوشمند، نانوفناوری و هوش مصنوعی، انتظار میرود نسل جدیدی از غشاها توسعه یابند که:
-
انتخابپذیری بالاتر و قابلیت هدفمندسازی دقیق در دارورسانی و مهندسی بافت داشته باشند.
-
پایداری شیمیایی و مکانیکی بهبود یافته داشته باشند تا در شرایط صنعتی و محیطهای چالشبرانگیز عملکرد خود را حفظ کنند.
-
تعامل هوشمند با محیط و سلولها داشته باشند، به گونهای که بتوانند پاسخ دینامیک به تغییرات محیطی و نیازهای سلولی بدهند.
-
کاربردهای چندمنظوره و ترکیبی در پزشکی، صنعت و مهندسی ارائه دهند؛ به طوری که یک غشا بتواند همزمان وظایف دارورسانی، حفاظت و جداسازی را انجام دهد.
پیشرفت در این حوزه میتواند افقهای نوینی در درمان بیماریها، تولید محصولات با کیفیت بالا و بهینهسازی فرآیندهای صنعتی ایجاد کند و نقش غشاها را از مرزهای سلولی فراتر ببرد و به ابزارهایی قدرتمند در مهندسی و فناوری تبدیل نماید.
در نهایت، مطالعه غشاها و کاربردهای آنها همچنان یکی از حوزههای پرپتانسیل تحقیقاتی است که نوآوریهای آینده را شکل خواهد داد و میتواند تعامل بین زیستشناسی، مهندسی و فناوری را به سطح جدیدی برساند.