انقلاب پزشکی هوشمند مبتنی بر mRNA: وقتی دارو فقط در سلول هدف فعال میشود
خلاصه مقاله
همهگیری کووید–۱۹ درهای تازهای به سوی فناوریهای mRNA گشود. این ویروس به جهان نشان داد که میتوان با سرعتی بیسابقه واکسنها و درمانهایی قدرتمند و ایمن تولید کرد. اما این تازه آغاز ماجرا بود. امروز پژوهشگران در پی آن هستند که نسل بعدی mRNAها را «هوشمند» کنند؛ مولکولهایی که تنها در سلولهای هدف و در زمان مناسب فعال شوند و تولید پروتئین درمانی را به شکل دقیق و برنامهریزیشده کنترل کنند.
تصور کنید یک مولکول mRNA که مانند یک سرباز دقیق، تنها سلولهای سرطانی یا سلولهای پیر را شناسایی و هدف میگیرد، بدون اینکه به بافت سالم آسیب برساند. یا درمانهایی که میتوانند سلولهای CAR-T را درون بدن شما مهندسی کنند، بدون نیاز به فرایند پیچیده و پرهزینهی خارجبدنی. این چشمانداز، دریچهای به سوی پزشکی شخصی و هوشمند باز میکند.
mRNA: کلید ورود به درمانهای هوشمند
تجربه کووید–۱۹ توجه جهان را به وکتورهای mRNA جلب کرد؛ وکتورهایی که میتوانند با سرعتی بیسابقه طراحی، تولید و توزیع شوند. برخلاف وکتورهای DNA، mRNA ایمنتر است؛ چرا که اساساً امکان ادغام در ژنوم انسان و ایجاد جهش را ندارد. همچنین، عمر کوتاه این مولکولها خطر بروز عوارض جانبی طولانیمدت را کاهش میدهد.
اما mRNA فراتر از واکسنها پتانسیل دارد. این فناوری میتواند گسترهی وسیعی از درمانهای ژنی و سلولی را فعال کند. برای مثال، میتوان مدارهای هوشمندی طراحی کرد که سلولهای سرطانی یا سلولهای پیر (senescent cells) را شناسایی و حذف کنند؛ کاربردهایی که میتوانند در حوزه جوانسازی یا درمان سرطانهای مقاوم انقلابی ایجاد کنند.
CAR-T: آینده درمان سرطان
سلولهای CAR-T نمونهای عالی از قدرت درمانهای سلولی هستند. این سلولها معمولاً خارجبدنی مهندسی میشوند و هزینهی بسیار بالایی دارند. اما اگر بتوان آنها را با استفاده از mRNA درون بدن مهندسی کرد، بسیاری از موانع لجستیکی و مالی برطرف میشود. تصور کنید آیندهای که در آن درمان سرطانهای مقاوم، تنها با تزریق یک «واکسن» به بدن شما ممکن شود.
واکسن کووید–۱۹ نمونهای ساده اما قدرتمند است: هرگاه وارد سلول میشود، تولید آنتیژن را آغاز میکند. اما سوال این است: چگونه میتوان این وکتورهای mRNA را هوشمندتر کرد؟ چگونه میتوان بار درمانی را تنها در سلول مناسب و در زمان مناسب فعال کرد؟
برای مثال، اگر mRNA بار درمانی را برای فعالسازی یک زیرنوع از سلولهای T تنظیمی در بیماری خودایمنی طراحی کند، تولید همان بار در سلولهای ایمنوتحریکی میتواند نه تنها ناکارآمد، بلکه حتی خطرناک باشد.
برخلاف کنترلهای سطح DNA که اختصاصیت سلولی و حالت سلولی را به خوبی مدیریت میکنند، روشهای کنترلی مناسب mRNA هنوز به طور کامل توسعه نیافتهاند. نانوذرات لیپیدی میتوانند بخشی از این اختصاصیت را فراهم کنند، اما به تنهایی کافی نیستند.
ظهور RNAهای نشانگر و حسگرهای برنامهپذیر
با پیشرفت تکنیکهای توالییابی، اکنون میتوان نشانگرهای RNA درونزاد را شناسایی کرد؛ RNAهایی که تقریباً در هر نوع سلول یا حالت سلولی به طور اختصاصی تولید میشوند. تنها چیزی که نیاز داریم، ابزاری است که بار درمانی را در پاسخ به این نشانگرهای اختصاصی فعال کند.
در دهه گذشته، پژوهشگران مولکولهای RNA را بر اساس اصول بیوفیزیکی طراحی کردهاند. این حسگرهای RNA مهندسیشده، وقتی با RNA نشانگر جفت میشوند، کانفورماسیونشان تغییر میکند و تولید بار درمانی آغاز میشود. موفقیت این روش در محیطهای آزمایشگاهی و باکتریها چشمگیر بود، اما در سلولهای پستانداران نیاز به مهندسی پیچیدهتری داشت.
چالش ایمنی: RNA دو رشتهای
یکی از عوامل سردرگمکننده، مسیرهای ایمنی طبیعی سلول است. RNA دو رشتهای (dsRNA) که هنگام عملکرد حسگر شکل میگیرد، بهعنوان نشانهی عفونت ویروسی شناسایی میشود. پروتئینهای خانهداری در سلول، این RNA را تشخیص داده و میتوانند عملکرد حسگر را به شکل غیرقابل پیشبینی مختل کنند. اما ما تصمیم گرفتیم این محدودیت را به یک ویژگی تبدیل کنیم.
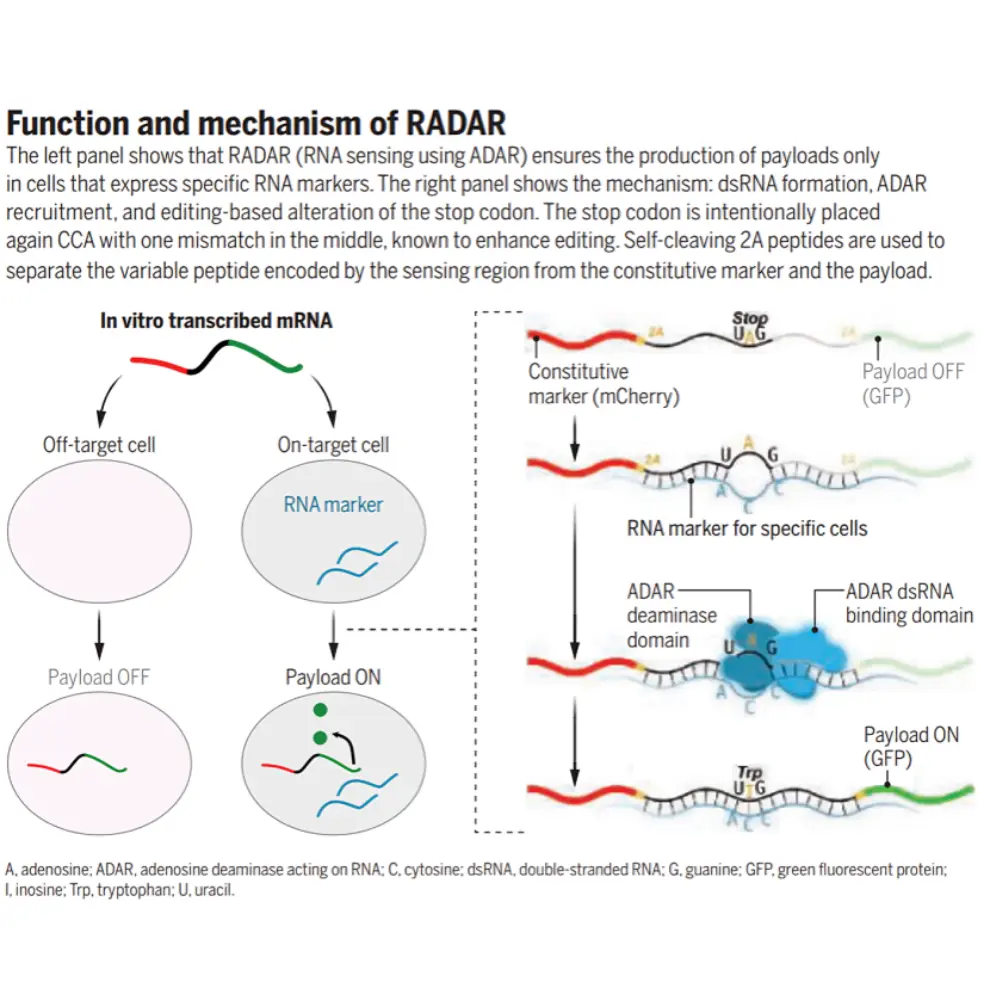
RADAR: حسگر RNA برنامهپذیر
راهکار ما حسگری به نام RADAR است. RADAR از آنزیمهای ADAR استفاده میکند، آنزیمهایی که باز آدنوزین (A) را به اینوزین (I) تبدیل میکنند. این تغییر کوچک مانند روشن شدن یک کلید عمل میکند و تولید بار درمانی را فعال میکند.
حسگر RADAR یک ناحیه کدکننده میانی دارد که بخشی از RNA نشانگر را تکمیل میکند و یک کدون توقف در چارچوب (in-frame stop codon) دارد. در غیاب RNA نشانگر، این کدون توقف مانع تولید پروتئین میشود. اما وقتی RNA هدف حاضر است، هیبریدسازی حسگر–نشانگر موجب ویرایش توسط ADAR میشود، کدون توقف به کدون تریپتوفان تبدیل میشود و چراغ سبز تولید بار درمانی روشن میشود.
ما عملکرد RADAR را در سلولهای سرطانی انسان، سیستم عصبی مرکزی موش، و حتی گیاهان بررسی کردهایم و ثابت شده است که این حسگر برنامهپذیر کاربردهای گستردهای دارد.
مسیر کارآفرینی
همزمان با پیشرفت RADAR، جهان بیرون نیز تغییرات شدیدی را تجربه میکرد. در سال ۲۰۲۲، سهام BioNTech و Moderna سقوط کرد و شاخص Nasdaq Biotechnology تقریباً ۳۰٪ افت داشت. در همین زمان، ما با همکاری همکارانمان شرکت Radar Therapeutics را تاسیس کردیم تا مسیر کارآفرینی، RADAR را سریعتر به پزشکی mRNA برساند.
با وجود دشواریها و دوران سخت «زمستان بیوتکنولوژی»، توانستیم تیمی برجسته از دانشمندان و مهندسان بسازیم، نسل دوم RADAR را توسعه دهیم و چالشهای کلیدی نسل اول را برطرف کنیم. این طراحی جدید قادر است RNAهای پیچیدهتر و گونههای مختلف اتصال RNA را تشخیص دهد و نسبت سیگنال به پسزمینه بهتری ارائه کند.
Radar Therapeutics موفق به جذب سرمایهی ۱۳٫۵ میلیون دلاری شد و جوایز متعددی از جمله جایزه Cell & Gene Therapy، Golden Ticket و Wacker Biotech Discovery دریافت کرد. این منابع امکان تشکیل تیمی پرتوان و مشتاق را فراهم کرد که در حال آمادهسازی RADAR برای کاربردهای بالینی هستند.
فراتر از RADAR
RADAR وضعیتهای درونسلولی را شناسایی میکند، اما پاسخ به محیط بیرون سلول نیز حیاتی است؛ مانند تولید سلول CAR-T تنها در میکروحیطهی تومور. به همین منظور حسگرهای مکمل و مدارهای سطحپروتئینی نیز طراحی شدهاند که با مسیرهای سیگنالدهی درونزاد تعامل دارند و اثرات درمانی را دقیقتر میکنند.
ما همچنین به خطرات ایمنیزایی عناصر ویروسی و باکتریایی توجه داریم و در حال «انسانیسازی» برخی اجزای رایج هستیم تا ایمنی و سازگاری آنها با بدن انسان افزایش یابد.
در نهایت، این تلاشها نوید میدهند که عصر جدیدی از پزشکی هوشمند مبتنی بر mRNA در راه است؛ عصری که در آن درمانها دقیقتر، ایمنتر و سریعتر از همیشه در دسترس خواهند بود، چه در مسیر دانشگاهی و چه از طریق نوآوریهای کارآفرینانه.
منابع و توضیحات:
https://www.science.org/doi/10.1126/science.adw0397