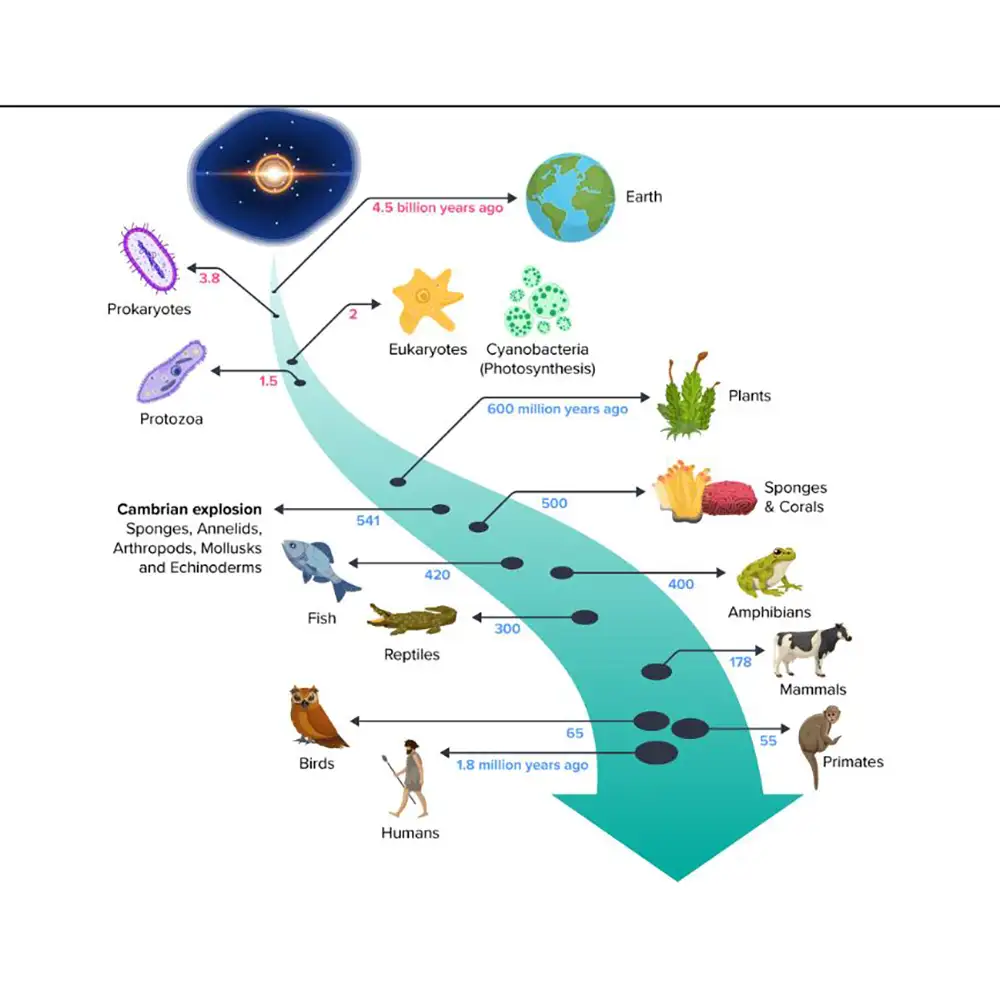
ژنتیک جمعیت چیست
ژنتیک جمعیت (Population Genetics) شاخهای از زیستشناسی است که ترکیب ژنتیکی جمعیتها و نحوه تغییر آنها در طول زمان تحت تأثیر نیروهای تکاملی مختلف (evolutionary forces) را مورد بررسی قرار میدهد. برخلاف ژنتیک کلاسیک (Classical Genetics) که بیشتر روی الگوهای وراثت در افراد (inheritance patterns in individuals) تمرکز دارد، ژنتیک جمعیت توزیع و فراوانی آلیلها (alleles) و ژنوتیپها (genotypes) را در سراسر یک جمعیت بررسی میکند. این شاخه، اصول ژنتیک مندلی (Mendelian Genetics)، نظریه تکامل (Evolutionary Theory) و مدلسازی آماری (Statistical Modeling) را در هم میآمیزد تا پدیدههایی مانند سازگاری (adaptation)، گونهزایی (speciation) و حفظ تنوع ژنتیکی (maintenance of genetic variation) را توضیح دهد.
ریشههای ژنتیک جمعیت (Origins of Population Genetics) به اوایل قرن بیستم بازمیگردد، دورهای که در آن کارهای گرگور مندل (Gregor Mendel) درباره وراثت دوباره کشف شد. در حالی که ژنتیک مندلی چارچوبی برای درک انتقال صفات در سطح فردی (trait transmission at the individual level) ارائه میداد، در ابتدا به نظر میرسید با تکامل داروینی (Darwinian Evolution) که بر تغییرات تدریجی (gradual variation) و انتخاب طبیعی (natural selection) تأکید داشت، ناسازگار است. توسعه ژنتیک جمعیت، عمدتاً توسط پیشگامانی مانند جی. اچ. هاردی (G. H. Hardy)، ویلهلم واینبرگ (Wilhelm Weinberg)، رونالد فیشر (Ronald Fisher)، جی. بی. اس. هالدین (J. B. S. Haldane) و سوول رایت (Sewall Wright)، این دیدگاهها را با هم ترکیب کرد و نشان داد که وراثت مندلی (Mendelian Inheritance) چگونه در سطح جمعیت عمل میکند. هاردی و واینبرگ به طور مستقل یک مدل ریاضی (mathematical model) برای پیشبینی فراوانی آلیلها و ژنوتیپها (allele and genotype frequencies) تحت شرایط ایدهآل ارائه دادند و پایهگذاری این رشته علمی را شکل دادند.
ژنتیک جمعیت به عنوان چارچوب مرکزی برای زیستشناسی تکاملی (Evolutionary Biology) عمل میکند. با کمی کردن تغییرات فراوانی آلیلها (quantifying changes in allele frequencies)، دانشمندان میتوانند فرآیندهایی که تنوع ژنتیکی را شکل میدهند شناسایی کنند، از جمله: انتخاب طبیعی (Natural Selection)، رانش ژنتیکی (Genetic Drift)، جهش (Mutation) و جریان ژنی (Gene Flow). این شاخه ابزارهایی را فراهم میکند تا فشارهای تکاملی (Evolutionary Pressures) را شناسایی، سازگاری (Adaptation) را مطالعه و واکنش جمعیتها به تغییرات محیطی (response to environmental changes) را در طول نسلها درک کنند. علاوه بر این، ژنتیک جمعیت امکان بررسی پیامدهای ژنتیکی رویدادهای جمعیتی (genetic consequences of demographic events)، شامل تنگنای جمعیتی (Population Bottlenecks)، اثر بنیانگذار (Founder Effects) و مهاجرت (Migration) را فراهم میکند و دیدگاههایی درباره پویاییهای تاریخی و معاصر جمعیتها (historical and contemporary population dynamics) ارائه میدهد.
کاربردهای ژنتیک جمعیت فراتر از نظریه تکامل است. در ژنتیک انسانی (Human Genetics)، این شاخه به مطالعات بیماریهای ژنتیکی (Genetic Diseases)، پیشبینی فراوانی ناقلین (Carrier Frequencies) و شناسایی آللهای پرخطر برای صفات پیچیده (Risk Alleles for Complex Traits) کمک میکند. در زیستشناسی حفاظتی (Conservation Biology)، ژنتیک جمعیت راهنمایی میکند برای حفظ تنوع ژنتیکی در گونههای در معرض خطر (Maintaining Genetic Diversity in Endangered Species) و مدیریت برنامههای پرورش برای جلوگیری از کاهش هتروزیگوتی (Inbreeding Depression). همچنین، این شاخه زیربنای علوم قانونی (Forensic Science)، کشاورزی (Agriculture) و اپیدمیولوژی (Epidemiology) است، زیرا مدلهایی برای تحلیل تنوع ژنتیکی و پیشبینی پیامدهای آن (analyze genetic variation and predict its consequences) ارائه میدهد.
در هسته خود، ژنتیک جمعیت بر مفهوم استخر ژنی (Gene Pool) متکی است که به مجموع کل آلیلهای موجود در یک جمعیت (total collection of alleles present in a population) اشاره دارد. فراوانی آلیلها (Allele Frequencies) میزان شایع بودن یک آلیل خاص را توصیف میکند، در حالی که فراوانی ژنوتیپها (Genotype Frequencies) نسبت افرادی که ترکیبهای خاصی از آلیلها را دارند نشان میدهد. با ردیابی این فراوانیها در طول نسلها، ژنتیکدانان جمعیت میتوانند اثر نیروهای تکاملی را اندازهگیری و تغییرات آینده را پیشبینی کنند. ابزارهایی مانند تعادل هاردی-واینبرگ (Hardy-Weinberg Equilibrium) یک مدل پایه (Null Model) ارائه میدهند که بر اساس آن هر گونه انحراف نشاندهنده عملکرد انتخاب، رانش یا سایر نیروها (action of selection, drift, or other forces) است.
تاریخچه ژنتیک جمعیت (Historical Significance) نشان میدهد که این شاخه چگونه درک ما از تکامل (Evolution) و سازگاری (Adaptation) را متحول کرده است. این رشته ایده تغییر تکاملی قابل اندازهگیری (Quantifiable Evolutionary Change) را رسمی کرد و امکان پیشبینی تنوع ژنتیکی در جمعیتها با هر اندازه (Genetic Variation in Populations of Any Size) را فراهم نمود. ادغام زیستشناسی مولکولی (Molecular Biology) در دهههای اخیر، تجزیه و تحلیل سلسله DNA (DNA Sequences)، پلیمورفیسم تک نوکلئوتیدی (Single Nucleotide Polymorphisms – SNPs) و الگوهای ژنومی (Genomic Patterns) را در جمعیتها ممکن کرده است. این پیشرفتها درک ما از تکامل انسانی (Human Evolution)، الگوهای مهاجرت (Migration Patterns) و پایه ژنتیکی صفات پیچیده (Genetic Basis of Complex Traits) را عمیقتر کرده و اهمیت و قدرت ژنتیک جمعیت را همچنان به عنوان یک رشته علمی نشان میدهد.
بخش ۲: مفاهیم اصلی در ژنتیک جمعیت (Core Concepts in Population Genetics)
ژنتیک جمعیت (Population Genetics) بر پایه مجموعهای از مفاهیم کلیدی (Key Concepts) بنا شده است که توضیح میدهند اطلاعات ژنتیکی چگونه در یک جمعیت سازماندهی و منتقل میشود (how genetic information is organized and transmitted within a population). این مفاهیم ابزارهای ریاضی و مفهومی (Mathematical and Conceptual Tools) لازم را برای تحلیل تنوع ژنتیکی (Analyze Genetic Variation) و پیشبینی تغییرات آن در طول نسلها (Predict Changes Across Generations) فراهم میکنند.
استخر ژنی و تنوع ژنتیکی (Gene Pool and Genetic Variation)
استخر ژنی (Gene Pool) یک جمعیت شامل تمام آلیلها (Alleles) موجود در همهی افراد آن جمعیت برای هر محل ژنی (Gene Locus) است. این مفهوم نمایی جامع از ماده وراثتی جمعیت (Population’s Hereditary Material) ارائه میدهد و به عنوان بستر خامی که فرایندهای تکاملی بر آن اثر میگذارند (Raw Substrate for Evolutionary Processes) عمل میکند.
تنوع ژنتیکی (Genetic Variation) درون استخر ژنی عمدتاً از جهشها (Mutations) سرچشمه میگیرد، اما از طریق فرایندهایی مانند نوترکیبی (Recombination) و مهاجرت (Migration) حفظ و بازآرایی میشود. اندازهگیری این تنوع (Measuring Variation) اساس درک تکامل جمعیت و چگونگی توزیع صفات است.
فراوانی آلیل و ژنوتیپ (Allele and Genotype Frequencies)
دو شاخص کلیدی برای توصیف ترکیب یک استخر ژنی وجود دارد:
-
فراوانی آلیل (Allele Frequency): نسبت یک آلیل خاص در میان همه نسخههای یک ژن در جمعیت.
-
فراوانی ژنوتیپ (Genotype Frequency): نسبت افرادی که یک جفت آلیل مشخص دارند.
این فراوانیها معمولاً به صورت عدد اعشاری یا درصد (Decimals or Percentages) بیان میشوند و با محاسبات ساده از دادههای نمونه (Sample Data) برآورد میگردند. پایش تغییرات این فراوانیها در نسلهای مختلف (Monitoring Changes Across Generations) به پژوهشگران امکان میدهد تغییر تکاملی را شناسایی کنند، زیرا در ژنتیک جمعیت، تکامل به عنوان تغییر در فراوانی آلیلها در طول زمان تعریف میشود (Evolution = Change in Allele Frequencies Over Time).
تعادل هاردی–واینبرگ به عنوان مدل صفر
(Hardy–Weinberg Equilibrium as a Null Model)
تعادل هاردی–واینبرگ (Hardy–Weinberg Equilibrium – HWE) یک مفهوم مرکزی (Central Concept) است که انتظار پایهای برای فراوانی آلیل و ژنوتیپ را در شرایط نبود نیروهای تکاملی (When No Evolutionary Forces Act) ارائه میدهد.
اگر یک جمعیت به طور نامتناهی بزرگ (Infinitely Large) باشد، جفتگیری تصادفی (Random Mating) داشته باشد، جهش (Mutation)، مهاجرت (Migration) یا انتخاب طبیعی (Natural Selection) رخ ندهد و نسلها با هم تداخل نکنند، فراوانی آلیل و ژنوتیپ ثابت باقی میماند (Remain Constant).
در این شرایط، رابطه بین فراوانی آلیل و ژنوتیپ با معادله ساده (Simple Equation) زیر توصیف میشود:
p² + 2pq + q² = 1
که در آن p و q فراوانی دو آلیل یک ژن هستند (p and q represent the frequencies of two alleles of a gene).
این مدل ارزشمند است زیرا استانداردی برای مقایسه با جمعیتهای واقعی (Baseline for Real Populations) فراهم میکند؛ انحراف از نسبتهای مورد انتظار (Deviation from Expected Ratios) نشان میدهد که حداقل یکی از فرضیات نقض شده و یک نیروی تکاملی (Evolutionary Force) در حال عمل است.
ساختار و زیرتقسیم جمعیت (Population Structure and Subdivision)
جمعیتهای واقعی به ندرت تمام شرایط سختگیرانه HWE را دارند. جمعیتهای طبیعی (Natural Populations) اغلب به زیرگروههای کوچکتر (Subdivided Groups) تقسیم میشوند که ممکن است به دلیل محدودیت مهاجرت (Limited Migration) یا انتخاب موضعی (Localized Selection) از نظر فراوانی آلیلها متفاوت باشند.
این ساختار جمعیتی (Population Structure) میتواند منجر به پدیدهای به نام اثر والوند (Wahlund Effect) شود، که در آن یک جمعیت ترکیبی نسبت به انتظار HWE کمبود هتروزیگوتها (Deficit of Heterozygotes) را نشان میدهد.
درک میزان این زیرتقسیم برای تفسیر دادههای ژنتیکی (Interpreting Genetic Data) ضروری است و روشهایی مانند آمار F (F-statistics) نشان میدهد که چگونه تنوع ژنتیکی در درون و میان زیرجمعیتها (Genetic Variation Within and Among Subpopulations) توزیع میشود.
اندازه مؤثر جمعیت (Effective Population Size – Ne)
مفهوم حیاتی دیگر اندازه مؤثر جمعیت (Effective Population Size – Ne) است که نشاندهنده تعداد افرادی در یک جمعیت ایدهآل (Idealized Population) است که همان میزان رانش ژنتیکی (Genetic Drift) را نشان میدهند که در جمعیت واقعی اتفاق میافتد.
Ne معمولاً بسیار کوچکتر از اندازه واقعی جمعیت (Census Population Size) است، زیرا عواملی مانند نسبتهای جنسی نابرابر (Unequal Sex Ratios)، تفاوت در موفقیت تولیدمثل (Variation in Reproductive Success) و نوسان اندازه جمعیت (Fluctuating Population Size) سهم ژنتیکی برخی افراد را کاهش میدهد.
اندازه مؤثر جمعیت (Ne) شدت رانش ژنتیکی و کارایی انتخاب طبیعی (Efficiency of Natural Selection) را تعیین میکند، و به همین دلیل پارامتر کلیدی در ژنتیک حفاظتی (Conservation Genetics) و مدلسازی تکاملی (Evolutionary Modeling) است.
بخش ۳: نیروهای تکاملی مؤثر بر ژنتیک جمعیت
(Evolutionary Forces Affecting Population Genetics)
در ژنتیک جمعیت (Population Genetics)، تکامل (Evolution) به عنوان تغییر در فراوانی آلیلها (Allele Frequencies) در یک جمعیت در طول نسلها تعریف میشود. پنج نیروی اصلی (Five Primary Forces) این تغییرات را هدایت میکنند:
جهش (Mutation)، انتخاب طبیعی (Natural Selection)، رانش ژنتیکی (Genetic Drift)، جریان ژنی یا مهاجرت (Gene Flow/Migration)، و جفتگیری غیرتصادفی (Non-Random Mating).
هر یک از این نیروها از طریق مکانیسمهای متفاوت (Different Mechanisms) عمل میکنند و قدرت نسبی آنها (Relative Strengths) تعیین میکند که ساختار ژنتیکی جمعیت چگونه در طول زمان تغییر خواهد کرد.
درک این نیروها برای تفسیر انحرافات از تعادل هاردی–واینبرگ (Hardy–Weinberg Equilibrium) و توضیح الگوهای تنوع ژنتیکی (Patterns of Genetic Diversity) ضروری است.
1. جهش (Mutation)
جهش منبع نهایی تنوع ژنتیکی (Ultimate Source of Genetic Variation) است. این فرایند با تغییر توالیهای DNA (Altering DNA Sequences) از طریق جایگزینی بازها (Base Substitutions)، درج یا حذف نوکلئوتیدها (Insertions/Deletions) یا بازآرایی کروموزومی (Chromosomal Rearrangements) آلیلهای جدیدی را به استخر ژنی (Gene Pool) وارد میکند.
-
نرخ جهش (Mutation Rate) در هر نسل در یک جایگاه نوکلئوتیدی معمولاً پایین است (حدود 10⁻⁹ تا 10⁻⁸ در بسیاری از یوکاریوتها)،
اما اندازه بزرگ ژنومها و جمعیتها تضمین میکند که جهشها به طور مداوم رخ میدهند (Occur Continually). -
بیشتر جهشها خنثی یا اندکی زیانآور (Neutral or Slightly Deleterious) هستند، اما گاهی جهشی رخ میدهد که مزیت انتخابی (Selective Advantage) ایجاد میکند و به ماده خام برای سازگاری (Raw Material for Adaptation) تبدیل میشود.
از دیدگاه ژنتیک جمعیت، جهش بهتنهایی آهسته فراوانی آلیلها را تغییر میدهد (Changes Allele Frequencies Slowly).
تغییر فراوانی آلیل در هر نسل را میتوان با رابطه زیر تقریب زد:
Δq = μ(p)
که در آن μ نرخ جهش (Mutation Rate) و p فراوانی آلیل بدون جهش (Frequency of Unmutated Allele) است.
گرچه این اثر در کوتاهمدت کم است، اما در مقیاسهای طولانی تکاملی، جهش حیاتی است (Indispensable) زیرا تنوعی را که نیروهای دیگر مانند انتخاب یا رانش حذف میکنند، تأمین و تجدید میکند (Replenishes Variation).
2. انتخاب طبیعی (Natural Selection)
انتخاب طبیعی بر تنوع فنوتیپی (Phenotypic Variation) که پایه ژنتیکی موروثی (Heritable Genetic Basis) دارد اثر میگذارد و آلیلهایی را که موفقیت تولیدمثلی (Reproductive Success) را بهبود میدهند، ترجیح میدهد (Favors).
انتخاب میتواند اشکال مختلفی داشته باشد:
-
انتخاب جهتدار (Directional Selection): فراوانی یک آلیل مطلوب را به سمت تثبیت (Fixation) سوق میدهد.
-
انتخاب تثبیتکننده (Stabilizing Selection): فنوتیپهای میانی (Intermediate Phenotypes) را حفظ و واریانس ژنتیکی (Genetic Variance) را کاهش میدهد.
-
انتخاب گسستی یا متنوعکننده (Disruptive/Diversifying Selection): فنوتیپهای افراطی را ترجیح میدهد (Favors) و میتواند منجر به چندریختی متعادل (Balanced Polymorphisms) شود.
شدت انتخاب (Intensity of Selection) اغلب با ضریب انتخاب (Selection Coefficient – s) بیان میشود که کاهش برازندگی یک ژنوتیپ (Fitness Disadvantage of a Genotype) را نسبت به برازندهترین ژنوتیپ نشان میدهد.
تغییر فراوانی آلیل ناشی از انتخاب را میتوان با رابطه زیر توصیف کرد:
Δp = (p q s) / w̄
که در آن w̄ میانگین برازندگی جمعیت (Mean Fitness of the Population) است.
این چارچوب به پژوهشگران امکان میدهد پیشبینی کنند که چقدر سریع آلیلهای سودمند گسترش مییابند (Spread of Advantageous Alleles) یا آلیلهای زیانآور کاهش مییابند.
انتخاب هرگز به تنهایی عمل نمیکند (Selection Does Not Operate in Isolation)؛ اثربخشی آن به عواملی مانند روابط غالبیت (Dominance Relationships)، پیوند ژنتیکی (Genetic Linkage) و قدرت رانش (Strength of Drift) بستگی دارد.
3. رانش ژنتیکی (Genetic Drift)
رانش ژنتیکی به نوسانات تصادفی فراوانی آلیلها (Random Fluctuations in Allele Frequencies) اشاره دارد که به دلیل محدود بودن اندازه جمعیت (Finite Populations) رخ میدهد.
حتی اگر همه ژنوتیپها برازندگی برابر (Equal Fitness) داشته باشند، اثرات نمونهگیری از یک نسل به نسل دیگر میتواند باعث شود برخی آلیلها فقط بهطور تصادفی افزایش یا کاهش یابند (Increase or Decrease by Chance).
-
رانش در جمعیتهای کوچک (Small Populations) که اندازه مؤثر (Effective Population Size – Ne) کم است، قویتر است.
-
پیامدهای رانش شامل کاهش تدریجی تنوع ژنتیکی (Gradual Loss of Genetic Variation) و تثبیت یا حذف تصادفی آلیلها (Random Fixation or Loss of Alleles) است.
-
احتمال تثبیت یک آلیل خنثی برابر با فراوانی کنونی آن (Equal to Its Current Frequency) و زمان مورد انتظار برای تثبیت حدود 4Ne نسل برای یک جمعیت دیپلوئید (≈4Ne Generations for a Diploid Population) است.
رانش با انتخاب تعامل مهمی دارد (Interacts with Selection):
در جمعیتهای کوچک، آلیلهای اندکی سودمند ممکن است از بین بروند (Loss of Weakly Advantageous Alleles)، در حالی که آلیلهای اندکی زیانآور ممکن است تثبیت شوند (Fixation of Slightly Deleterious Alleles) و توان سازگاری کلی را کاهش دهد (Reducing Adaptive Potential).
4. جریان ژنی یا مهاجرت (Gene Flow / Migration)
جریان ژنی زمانی رخ میدهد که افراد یا گامتها بین جمعیتها جابجا شوند (Movement of Individuals or Gametes between Populations) و آلیلهای جدیدی را معرفی کرده و فراوانی آلیلها را در مناطق مختلف یکنواخت (Homogenize) میکنند.
-
اثر آن با نرخ مهاجرت (Migration Rate – m) یعنی درصد مهاجران در هر نسل (Proportion of Migrants per Generation) سنجیده میشود.
-
تغییر فراوانی آلیل ناشی از مهاجرت با رابطه زیر بیان میشود:
Δp = m (pm − p)
که در آن pm فراوانی آلیل در جمعیت مهاجر (Allele Frequency in the Migrant Pool) و p فراوانی آلیل در جمعیت میزبان (Resident Frequency) است.
جریان ژنی اثرات تفکیککننده رانش و انتخاب محلی (Counteracts Differentiating Effects of Drift and Local Selection) را خنثی میکند.
-
مهاجرت زیاد (High Migration) شباهت ژنتیکی بین جمعیتها را حفظ میکند.
-
مهاجرت محدود (Limited Migration) باعث واگرایی و احتمال گونهزایی (Divergence and Potential Speciation) میشود.
در زیستشناسی حفاظتی، تسهیل جریان ژنی بین جمعیتهای تکهتکهشده (Facilitating Gene Flow among Fragmented Populations) برای حفظ تنوع ژنتیکی (Maintaining Genetic Diversity) و کاهش همخونی (Reducing Inbreeding) حیاتی است.
5. جفتگیری غیرتصادفی (Non-Random Mating)
اگرچه جفتگیری غیرتصادفی بهطور مستقیم فراوانی آلیلها را تغییر نمیدهد (Does Not Directly Change Allele Frequencies)، اما فراوانی ژنوتیپها (Genotype Frequencies) و در نتیجه توزیع تنوع ژنتیکی (Distribution of Genetic Variation) را تغییر میدهد.
-
همخونی (Inbreeding): جفتگیری بین افراد خویشاوند، هموزیگوتی (Homozygosity) را افزایش داده و میتواند آلیلهای مغلوب زیانآور (Deleterious Recessive Alleles) را آشکار کند و منجر به افسردگی همخونی (Inbreeding Depression) شود.
ضریب همخونی با F (Inbreeding Coefficient – F) اندازهگیری میشود که احتمال یکسان بودن دو آلیل در یک فرد به دلیل تبار مشترک (Identical by Descent) را نشان میدهد. -
جفتگیری همسان (Assortative Mating): زمانی رخ میدهد که افراد ترجیح میدهند با فنوتیپ مشابه جفت شوند.
-
جفتگیری ناهمسان (Disassortative Mating): ترجیح جفتگیری با افراد دارای فنوتیپ متفاوت.
جفتگیری همسان مثبت هموزیگوتی را برای صفات انتخابی افزایش میدهد (Increases Homozygosity)، در حالی که جفتگیری ناهمسان میتواند هتروزیگوتی را افزایش دهد (Increases Heterozygosity).
از آنجا که الگوهای جفتگیری (Mating Patterns) بر نحوه تأثیر انتخاب و رانش در جمعیتها اثر میگذارند، درک آنها برای پیشبینی نتایج ژنتیکی (Predicting Genetic Outcomes) کلیدی است.
برهمکنش میان نیروها (Interactions Among Forces)
در طبیعت، این نیروهای تکاملی به ندرت به تنهایی عمل میکنند.
-
جهش آلیلهای جدیدی را ایجاد میکند که انتخاب ممکن است آنها را ترجیح دهد یا حذف کند (Mutation Introduces Alleles that Selection Acts Upon).
-
رانش میتواند در جمعیتهای کوچک بر انتخاب غلبه کند (Drift Can Overpower Selection).
-
مهاجرت میتواند آلیلهایی را که توسط رانش از بین رفتهاند دوباره معرفی کند (Migration Reintroduces Alleles Lost to Drift).
-
جفتگیری غیرتصادفی میتواند اثر انتخاب بر صفات خاص را تقویت کند (Non-Random Mating Amplifies Selection Effects).
تعادل میان این نیروها، مسیر ژنتیکی یک جمعیت (Genetic Trajectory of a Population) را تعیین کرده و پتانسیل تکاملی آن (Evolutionary Potential) را شکل میدهد.
بخش ۴: رویکردهای مولکولی و ژنومی در ژنتیک جمعیت (Molecular and Genomic Approaches in Population Genetics)
ژنتیک جمعیت (Population Genetics) مدرن بهواسطهٔ ظهور زیستشناسی مولکولی (Molecular Biology) و فناوریهای توالییابی با توان بالا (High-Throughput Sequencing) دگرگون شده است. این ابزارها امکان بررسی مستقیم DNA و نشانگرهای مولکولی (Molecular Markers) در سراسر ژنوم را فراهم کرده و دقتی بیسابقه برای تشخیص تنوع ژنتیکی (Genetic Variation)، استنباط تاریخچه جمعیتها (Demographic History) و آزمودن فرضیههای مرتبط با نیروهای تکاملی (Evolutionary Forces) فراهم میکنند.
نشانگرهای مولکولی و تکنیکهای اولیه (Molecular Markers and Early Techniques)
پیش از آنکه توالییابی کل ژنوم به روشهای معمول بدل شود، پژوهشگران از نشانگرهای مولکولی (Molecular Markers) زیر استفاده میکردند:
-
آلوزایمها (Allozymes): شکلهای الکتروفورزی متفاوت آنزیمها که توسط آللهای (Alleles) مختلف رمزگذاری میشوند و از نخستین ابزارهای اندازهگیری تنوع ژنتیکی در جمعیتهای طبیعی بودند.
-
میکروساتلایتها (Microsatellites): تکرارهای کوتاه و پشتسرهم در DNA که بهدلیل نرخ جهش بالا (High Mutation Rate) و وراثت همغالب (Codominant Inheritance)، قدرت تفکیک بالایی برای مطالعه ساختار جمعیت (Population Structure) ارائه میکنند.
-
چندشکلی طول قطعههای محدودشده (Restriction Fragment Length Polymorphisms – RFLPs): روشی که از آنزیمهای برشدهنده و هیبریداسیون برای آشکارسازی تنوع در لوکوسهای خاص استفاده میکرد.
این نشانگرها پایهای برای برآورد پارامترهای کلیدی همچون ناهموزیگوتی (Heterozygosity)، آمار F (F-statistics) و نرخ مهاجرت (Migration Rate) فراهم کردند و با وجود گسترش نسل جدید توالییابی، هنوز در برخی کاربردها مفید هستند.
توالییابی DNA و چندشکلی تکنوکلئوتیدی (DNA Sequencing and Single-Nucleotide Polymorphisms – SNPs)
توانایی توالییابی مستقیم DNA (Direct DNA Sequencing) انقلابی در ژنتیک جمعیت ایجاد کرد و امکان مطالعه تنوع در سطح نوکلئوتید منفرد (Single Nucleotide) را فراهم نمود.
-
چندشکلی تکنوکلئوتیدی (Single-Nucleotide Polymorphisms – SNPs) که تغییر تنها یک باز در میان افراد است، فراوانترین نوع تنوع ژنتیکی (Most Abundant Type of Genetic Variation) محسوب میشود.
-
استفاده از آرایههای SNP (SNP Arrays) و توالییابی با توان بالا، تحلیل همزمان صدها هزار لوکوس را ممکن میسازد و برآوردهای دقیق از ساختار جمعیت (Population Structure)، پیوند نامتعادل (Linkage Disequilibrium) و تاریخچه جمعیت (Demographic History) ارائه میدهد.
ژنتیک جمعیت ژنومی و تئوری همتبارشدگی (Genomic Population Genetics and the Coalescent)
اطلاعات کل ژنوم امکان تحلیل بر پایهٔ تئوری همتبارشدگی (Coalescent Theory) را فراهم میکند که روابط شجرهای آللها (Alleles) را مدلسازی میکند. این نظریه چارچوبی احتمالاتی برای استنباط اندازه تاریخی جمعیت (Historical Population Size)، رویدادهای مهاجرت (Migration Events) و جاروهای انتخابی (Selective Sweeps) ارائه میدهد. ابزارهایی چون:
-
طیف فراوانی جایگاه (Site-Frequency Spectrum)
-
مدل همتبارشدگی مارکوفی ترتیبی زوجی (Pairwise Sequentially Markovian Coalescent – PSMC)
-
مدل همتبارشدگی مارکوفی ترتیبی چندگانه (Multiple Sequentially Markovian Coalescent – MSMC)
از دادههای ژنومی برای بازسازی تاریخچه جمعیت در بازههای صدها هزار سال استفاده میکنند.
تشخیص انتخاب طبیعی (Detecting Natural Selection)
رویکردهای ژنومی آزمونهای قدرتمندی برای شناسایی انتخاب طبیعی (Natural Selection) ارائه میکنند:
-
تشخیص جارو انتخابی (Selective Sweep Detection): شناسایی نواحیای از ژنوم که تنوع ژنتیکی در آن بهدلیل افزایش سریع یک آلل مفید کاهش یافته است.
-
آزمونهای F_ST (F_ST Outlier Tests): برجسته کردن لوکوسهایی که تمایز ژنتیکی (Genetic Differentiation) بالایی میان جمعیتها نشان میدهند و احتمال انطباق محلی (Local Adaptation) را مطرح میکنند.
-
مطالعات همبستگی ژنوم-صفت (Genome-Wide Association Studies – GWAS): پیوند واریانتهای ژنتیکی با صفات فنوتیپی، که چگونگی عمل انتخاب بر ویژگیهای پیچیده را آشکار میسازد.
ساختار جمعیت و آمیختگی (Population Structure and Admixture)
ژنوتایپینگ با وضوح بالا (High-Resolution Genotyping) و توالییابی این امکان را میدهد که ساختارهای ظریف جمعیت و آمیختگی تاریخی (Historical Admixture) شناسایی شود. برنامههایی مانند STRUCTURE، ADMIXTURE و fineSTRUCTURE از دادههای چندلوکوسی برای تعیین تعداد جمعیتهای نیاکانی و برآورد سهم نیاکان در هر فرد استفاده میکنند. این تحلیلها:
-
منشأ جمعیتهای انسانی را روشن کرده،
-
مسیرهای مهاجرتی را ردیابی،
-
و رویدادهای جریان ژنی (Gene Flow) میان انسانهای باستان و مدرن را آشکار کردهاند.
DNA باستانی (Ancient DNA – aDNA)
تحلیل DNA باستانی (Ancient DNA) دریچهای مستقیم به گذشته میگشاید. پیشرفت در استخراج و توالییابی این امکان را میدهد که ماده ژنتیکی از بقایای باستانی هزاران ساله بازیابی شود. مقایسه ژنومهای باستانی و مدرن اطلاعات ارزشمندی درباره:
-
زمان اهلیسازی (Domestication Events)،
-
گسترش کشاورزی (Spread of Agriculture)،
-
و جایگزینی یا آمیختگی جمعیتهای انسانی در قارهها فراهم کرده است.
ژنتیک عملکردی و اپیژنتیک (Functional Genomics and Epigenetics)
فراتر از شناسایی واریانتهای ژنتیکی، ژنتیک عملکردی (Functional Genomics) با ادغام ترانسکریپتومیکس (Transcriptomics)، پروتئومیکس (Proteomics) و اپیژنتیک (Epigenetics) بررسی میکند که چگونه تنوع ژنتیکی به تفاوتهای فنوتیپی منجر میشود.
-
تغییرات اپیژنتیکی (Epigenetic Modifications) مانند متیلاسیون DNA (DNA Methylation) و تغییرات هیستونی (Histone Modification) میتوانند بیان ژن را بدون تغییر توالی DNA تحت تأثیر قرار دهند.
-
گنجاندن دادههای اپیژنتیکی برای فهم سازگاری جمعیتها با تغییرات محیطی روزبهروز مهمتر میشود.
ادغام بومشناسی و ژنومیکس (Integrating Ecology and Genomics)
ترکیب دادههای بومشناسی (Ecological Data) با اطلاعات ژنومی—که گاهی اِکوجنومیکس (Eco-Genomics) نامیده میشود—به پژوهشگران امکان میدهد عوامل محیطی مشخص را به الگوهای تنوع ژنتیکی پیوند دهند.
-
ژنومیکس منظر (Landscape Genomics) بهویژه، نشانگرهای ژنتیکی را با متغیرهای محیطی مکانی همبسته میکند تا امضاهای انطباق محلی (Signatures of Local Adaptation) را در زیستگاههای ناهمگون شناسایی کند.
بخش ۵: کاربردهای ژنتیک جمعیت (Applications of Population Genetics)
ژنتیک جمعیت (Population Genetics) صرفاً یک چارچوب نظری نیست؛ بلکه ابزارهای عملی قدرتمندی فراهم میآورد که پژوهش و تصمیمگیری در حوزههای گوناگون زیستشناسی و جامعه را هدایت میکند. با بررسی تغییر فراوانی آللها (Allele Frequencies) تحت تأثیر نیروهای تکاملی، پژوهشگران میتوانند به پرسشهایی در پزشکی (Medicine)، زیستشناسی حفاظتی (Conservation Biology)، کشاورزی (Agriculture)، علوم قضایی (Forensic Science) و همچنین انسانشناسی (Anthropology) و اپیدمیولوژی (Epidemiology) پاسخ دهند. هر کاربرد بر اصول بنیادی تنوع ژنتیکی (Genetic Variation)، جریان ژن (Gene Flow) و انتخاب طبیعی (Natural Selection) استوار است، اما این اصول را برای چالشهای زیستی و اجتماعی خاص به کار میگیرد.
سلامت انسان و ژنتیک پزشکی (Human Health and Medical Genetics)
در ژنتیک انسانی (Human Genetics) و پزشکی، روشهای ژنتیک جمعیت برای درک توزیع آللهای مرتبط با بیماری (Distribution of Disease-Related Alleles) ضروری است.
-
برآورد فراوانی ناقل (Carrier Frequency) برای اختلالات مغلوب (Recessive Disorders) مانند فیبروز کیستیک (Cystic Fibrosis) یا آنمی داسیشکل (Sickle-Cell Anemia) با استفاده از محاسبات هاردی-واینبرگ (Hardy–Weinberg Calculations) و نمونههای بزرگ جمعیتی انجام میشود.
-
مطالعات همبستگی ژنوم-صفت (Genome-Wide Association Studies – GWAS) بر پایهٔ همین اصول، چندشکلیهای تکنوکلئوتیدی (Single-Nucleotide Polymorphisms – SNPs) را شناسایی میکنند که با بیماریهای پیچیدهای چون دیابت (Diabetes) یا انواعی از سرطان (Cancer) مرتبطاند.
مدلهای ژنتیک جمعیت همچنین به پیشبینی گسترش مقاومت پاتوژنها (Spread of Pathogen Resistance) کمک میکنند. برای نمونه، ردیابی تغییرات فراوانی آلل در انگل مالاریا (Malaria Parasite) یا HIV تحت فشار دارویی نشان میدهد که سویههای مقاوم با چه سرعتی پدید میآیند و این امر در راهبردهای درمانی (Treatment Strategies) و سیاستهای بهداشت عمومی (Public-Health Policy) مؤثر است.
در فارماکوژنومیکس (Pharmacogenomics)، شناخت ساختار ژنتیکی جمعیتهای انسانی، طراحی پزشکی شخصی (Personalized Medicine) را ممکن میکند تا دوز و نوع دارو (Drug Dosage & Selection) متناسب با زمینه ژنتیکی متفاوت (Variable Genetic Backgrounds) افراد تعیین شود.
زیستشناسی حفاظتی و مدیریت حیات وحش (Conservation Biology and Wildlife Management)
برنامههای حفاظتی برای حفظ تنوع ژنتیکی (Genetic Diversity) که برای بقا حیاتی است، بهشدت به ژنتیک جمعیت وابستهاند.
-
با اندازهگیری ناهموزیگوتی (Heterozygosity)، اندازه مؤثر جمعیت (Effective Population Size – Ne) و جریان ژنی (Gene Flow) بین زیرجمعیتها، دانشمندان گونههای در معرض خطر افسردگی ناشی از همخویشی (Inbreeding Depression) یا رانش ژنتیکی (Genetic Drift) را شناسایی میکنند.
این تحلیلها راهنمای تصمیمهای عملی مانند:
-
انتقال فرد (Translocation) برای افزایش جریان ژنی،
-
ایجاد راهروهای حیات وحش (Wildlife Corridors) برای اتصال زیستگاههای جداافتاده،
-
یا اولویتبندی جمعیتها برای حفاظت (Population Prioritization) است.
برای نمونه، برنامههای احیای پلنگ فلوریدا (Florida Panther) و پاندا غولپیکر (Giant Panda) از پایش ژنتیکی (Genetic Monitoring) بهره بردهاند تا از کاهش بیشتر تنوع جلوگیری و قابلیت سازگاری بلندمدت را تقویت کنند.
کشاورزی و بهبود محصولات (Agriculture and Crop Improvement)
علم کشاورزی اصول ژنتیک جمعیت را برای گیاهان زراعی و دام به کار میگیرد.
-
بهنژادگران گیاهی (Plant Breeders) با ردیابی فراوانی آللها (Tracking Allele Frequencies) صفات مطلوب را حفظ، همخویشی (Inbreeding) را کنترل و قدرت دورگهای (Hybrid Vigor – Heterosis) را مدیریت میکنند.
-
نشانگرهای مولکولی (Molecular Markers) و نقشهیابی کمّی جایگاه صفات (Quantitative-Trait-Locus – QTL Mapping) برای شناسایی و نگهداری آللهای مقاوم به آفات (Pests)، خشکی (Drought) یا شوری (Salinity) به کار میرود.
در دامپروری (Animal Husbandry) نیز حفظ تنوع ژنتیکی در گلههای اصلاحنژادی (Breeding Stocks) خطر بروز اختلالات ارثی را کاهش داده و تولید پایدار (Sustainable Productivity) را تضمین میکند. پایش ژنتیک جمعیت (Population-Genetic Monitoring) از آمیختگی ناخواسته آللهای زیانآور جلوگیری کرده و به ترویج آللهای مفید کمک میکند.
علوم قضایی و کاربردهای حقوقی (Forensic Science and Legal Applications)
پایهٔ علمی پروفایلینگ DNA (DNA Profiling) در تحقیقات جنایی، ژنتیک جمعیت است.
-
احتمال اینکه دو فرد ژنوتیپ چندلوکوسی یکسان (Identical Multilocus Genotype) داشته باشند با استفاده از دادههای فراوانی آلل و انتظارات هاردی-واینبرگ (Hardy–Weinberg Expectations) و برآوردهای پیوند نامتعادل (Linkage Disequilibrium Estimates) محاسبه میشود.
این بنیان آماری، به دادگاهها برآوردی قابل اعتماد از احتمال انطباق نمونه DNA با مظنون (Reliable Match Probability) ارائه میدهد. افزون بر تحقیقات جنایی، روشهای مشابه در:
-
تعیین پدری (Paternity Testing)،
-
شناسایی قربانیان بلایا (Disaster Victim Identification)،
-
و ردیابی منشاء محصولات حیات وحش قاچاقی (Tracking Illegally Traded Wildlife Products) کاربرد دارند که مستقیماً با مسائل حقوقی و حفاظتی مرتبط است.
اپیدمیولوژی و بیماریهای نوظهور (Epidemiology and Emerging Diseases)
مطالعه چگونگی انتشار و تکامل پاتوژنها (Spread and Evolution of Pathogens) ذاتاً مسئلهای ژنتیک جمعیتی است.
-
با توالییابی ژنومهای ویروسی یا باکتریایی (Sequencing Viral/Bacterial Genomes) در طول زمان و مکان، پژوهشگران میتوانند تغییرات فراوانی آلل (Allele Frequency Changes) را که نشانهٔ سازگاری با میزبان (Host Adaptation) یا مقاومت دارویی (Drug Resistance) است، ردیابی کنند.
در جریان همهگیریهایی مانند آنفلوآنزا (Influenza) یا COVID-19، تحلیلهای بلادرنگ ژنتیک جمعیت اطلاعات حیاتی درباره مسیرهای انتقال (Transmission Pathways)، نرخ جهش (Mutation Rates) و ظهور واریانتهای جدید (Emergence of New Variants) ارائه داده و پاسخهای بهداشت عمومی (Public-Health Responses) را هدایت کرده است.
انسانشناسی و تکامل انسان (Anthropology and Human Evolution)
ژنتیک جمعیت همچنین تاریخچه گونهٔ ما را روشن میکند.
-
تحلیلهای DNA میتوکندری (Mitochondrial DNA)، هاپلوتایپ کروموزوم Y (Y-Chromosome Haplotypes) و SNPهای اتوزومی (Autosomal SNPs) الگوهای مهاجرتهای باستانی (Ancient Migrations)، آمیختگی با انسانتباران کهن (Admixture with Archaic Hominins) مانند نئاندرتالها (Neanderthals) و دنیسوانها (Denisovans)، و رویدادهای جمعیتی (Demographic Events) شکلدهندهٔ تنوع انسان مدرن را آشکار میکند.
این بینشها دادههای باستانشناسی (Archaeological Data) و زبانشناسی (Linguistic Data) را تکمیل کرده و چارچوبی کمی برای درک شکلگیری و تعامل جمعیتهای انسانی در دهها هزار سال گذشته فراهم میسازد.
بخش ۶: مطالعات موردی و مثالهای دقیق در ژنتیک جمعیت
(Case Studies and Detailed Examples in Population Genetics)
مثالهای عینی نشان میدهند که چگونه اصول ژنتیک جمعیت (Population-Genetic Principles) در دادههای واقعی و سیستمهای زنده به کار گرفته میشوند. مطالعات موردی زیر تنوع پرسشهایی را که با تحلیل فراوانی آللها (Allele Frequencies)، نیروهای تکاملی (Evolutionary Forces) و تاریخچههای جمعیتی (Demographic Histories) میتوان پاسخ داد، برجسته میکنند.
۱. صفت داسیشکل و مقاومت به مالاریا (Sickle-Cell Trait and Malaria Resistance)
یکی از مشهورترین مثالهای انتخاب طبیعی (Natural Selection) در انسان مربوط به آلل داسیشکل (Sickle-Cell Allele – HbS) ژن β-گلوبین (β-Globin Gene) است.
-
در مناطقی که مالاریای پلاسمودیوم فالسیپاروم (Plasmodium falciparum Malaria) شایع است، افراد هتروزیگوت (HbA/HbS) مقاومت نسبی به مالاریا دارند، در حالی که هموزیگوتهای آلل جهشیافته (HbS/HbS) اغلب به بیماری داسیشکل (Sickle-Cell Disease) مبتلا میشوند.
تحلیلهای ژنتیک جمعیت نشاندهنده نمونهای کلاسیک از پلیمورفیسم متوازن (Balanced Polymorphism) است، جایی که مزیت هتروزیگوت (Heterozygote Advantage) هر دو آلل را در فراوانیهای میانی (Intermediate Frequencies) حفظ میکند. انتظارات هاردی-واینبرگ (Hardy–Weinberg Expectations) میتوانند برای برآورد فرکانس تعادلی HbS (Equilibrium Frequency of HbS) استفاده شوند، با این فرض که تناسب Fitness هتروزیگوتها (Fitness of Heterozygotes) بالاتر از هر هموزیگوت باشد. این مثال نشان میدهد که انتخاب طبیعی چگونه میتواند تنوع ژنتیکی را در مواجهه با فشارهای محیطی متغیر حفظ کند.
۲. رنگپذیری صنعتی در پروانه فلفلی (Industrial Melanism in the Peppered Moth – Biston betularia)
افزایش و کاهش ناگهانی فرم تیره (Melanic Form) پروانه فلفلی در انگلستان صنعتی نمونهای آموزشی از تغییر تکاملی سریع (Rapid Evolutionary Change) تحت انتخاب قوی (Strong Selection) است.
-
پیش از انقلاب صنعتی، پروانههای روشن رایج بودند زیرا روی درختان پوشیده از جلبک استتار (Camouflage) میشدند.
-
با تیره شدن محیط به دلیل دود صنعتی (Soot)، شکارچیان فنوتیپ ملانیک (Melanic Phenotype) را ترجیح دادند و فراوانی آن افزایش یافت.
-
پس از بهبود کیفیت هوا، فرم روشن دوباره غالب شد.
مدلهای ژنتیک جمعیت که تغییرات فراوانی آلل (Allele Frequency Changes) را طی چند دهه ردیابی میکردند، نشان دادند که یک لوکوس ژنتیکی با اثر بزرگ (Single Locus of Large Effect) میتواند تغییرات سریع را توضیح دهد و قدرت انتخاب طبیعی در بازه زمانی قابل اندازهگیری (Measurable Timeframe) را به تصویر بکشد.
۳. اثر بنیانگذار در جمعیتهای جزیرهای (Founder Effects in Island Populations)
استعمار جزیرهها اغلب شامل تعداد اندکی از افراد (Small Number of Founders) است که باعث اثر بنیانگذار (Founder Effect) و کاهش تنوع ژنتیکی (Genetic Variation) نسبت به جمعیت مبدأ میشود.
-
نمونه کلاسیک، شیوع بالای برخی اختلالات ژنتیکی (High Frequency of Genetic Disorders) مانند سندروم الیس-ون کروولد (Ellis–van Creveld Syndrome) در آمیشهای قدیمی پنسیلوانیا (Old Order Amish) است، که اجداد خود را به گروه کوچکی از بنیانگذاران بازمیگردانند.
تحلیلهای فراوانی آلل (Allele Frequencies) و اندازه مؤثر جمعیت (Effective Population Size – Ne) نشان میدهند که رانش ژنتیکی (Genetic Drift) و همخویشی (Inbreeding) میتوانند آللهای نادر را به فراوانیهای قابل توجه برسانند. این مطالعات بینشهای مهمی برای حفاظت از تنوع ژنتیکی در جمعیتهای منزوی فراهم میکنند.
۴. پایداری لاکتاز در انسانها (Lactase Persistence in Humans)
توانایی برخی جمعیتهای انسانی بزرگسال برای هضم لاکتوز (Lactose) نمونهای شناختهشده از همتکامل ژن–فرهنگ (Gene–Culture Coevolution) است.
-
تغییرات در ناحیه تنظیمی ژن لاکتاز (LCT – Lactase Gene) باعث پایداری لاکتاز (Lactase Persistence) شده و بزرگسالان قادر به متابولیزه کردن قند شیر (Milk Sugar) هستند.
شواهد ژنتیک جمعیت نشاندهنده انتخاب مثبت قوی (Strong Positive Selection) برای این آللها در جوامع چراگاهدار (Pastoralist Societies) اروپا، آفریقا و خاورمیانه است، جایی که دامپروری (Dairy Farming) مزیت تغذیهای ایجاد کرده است. اسکنهای ژنومی برای هوموزیگوتی هپلوتایپ گسترشیافته (Extended Haplotype Homozygosity – EHH) اثرات تکانه انتخابی اخیر (Recent Selective Sweep) را نشان میدهند و برجستگی فشارهای انتخابی ناشی از فرهنگ (Cultural Selective Pressures) را نمایان میسازند.
۵. حفاظت از پلنگ فلوریدا (Conservation of the Florida Panther – Puma concolor coryi)
پلنگ فلوریدای در معرض خطر انقراض (Endangered) دچار گلوگاه جمعیتی شدید (Severe Population Bottleneck) شد که باعث افسردگی همخویشی (Inbreeding Depression) با نقایص قلبی (Heart Defects)، کیفیت پایین اسپرم (Low Sperm Quality) و دمهای پیچخورده (Kinked Tails) شد.
-
پایش ژنتیکی نشان داد که ناهموزیگوتی (Heterozygosity) به شدت پایین و ضریب همخویشی (Inbreeding Coefficient) بالا است.
استراتژی حفاظتی شامل معرفی پلنگهای تگزاس (Texas Pumas) برای بازگرداندن تنوع ژنتیکی (Genetic Diversity) بود. مطالعات پیگیری افزایش ناهموزیگوتی (Increased Heterozygosity) و بهبود تناسب عمومی (Improved Overall Fitness) را نشان داد، نمونهای از نجات ژنتیکی (Genetic Rescue) که بر اساس تحلیلهای ژنتیک جمعیت برنامهریزی شده است.
۶. ردیابی تکامل پاتوژنها: آنفلوآنزا و SARS-CoV-2 (Tracking Pathogen Evolution: Influenza and SARS-CoV-2)
ژنتیک جمعیت نقش مرکزی در پایش بلادرنگ تکامل ویروسی (Real-Time Monitoring of Viral Evolution) دارد.
-
برای ویروسهای آنفلوآنزا، توالییابی ایزولههای جهانی (Sequencing Global Isolates) به پژوهشگران اجازه میدهد نرخ جهش (Mutation Rates) را تخمین زده و رانش آنتیژنی (Antigenic Drift) را ردیابی کنند، که ترکیب واکسن سالانه (Annual Flu Vaccine Composition) را اطلاع میدهد.
-
در همهگیری COVID-19، توالییابی سریع ژنوم SARS-CoV-2 شناسایی واریانتهای نوظهور (Emerging Variants) مانند Alpha, Delta, Omicron را ممکن کرد.
-
روشهای ژنتیک جمعیت شامل تحلیلهای کوآل سنت (Coalescent Analysis) و اندازهگیری انتخاب بر پروتئین اسپایک (Selection on Spike Protein) به تعیین زمان ظهور واریانتها (Timing of Variant Emergence) و شدت انتخاب مثبت (Degree of Positive Selection) کمک کردند.
ادغام درسها در سیستمهای مختلف (Integrating Lessons Across Systems)
این مطالعات موردی چند موضوع مشترک دارند:
-
تغییرات فراوانی آلل (Allele Frequency Changes)، چه ناشی از انتخاب (Selection)، رانش ژنتیکی (Drift)، جریان ژن (Migration) یا رفتارهای فرهنگی (Cultural Practices) باشند، در مقیاسهای زمانی معاصر (Contemporary Timescales) قابل اندازهگیری هستند.
-
مدلهای ژنتیک جمعیت (Population-Genetic Models) قدرت پیشبینی برای مدیریت حفاظتی (Conservation Management)، راهبردهای بهداشت عمومی (Public-Health Strategies) و درک تکامل انسان (Human Evolution) فراهم میکنند.
-
همان اصول در ارگانیسمها و زمینههای بسیار متفاوت (Widely Different Organisms and Contexts) اعمال میشوند، که عمومیت نظریه ژنتیک جمعیت (Universality of Population-Genetic Theory) را تأیید میکند.