وکتور های کلونینگ Cloning Vectors
وکتورهای کلونینگ (Cloning vectors) یکی از سنگبنای اصلی زیستشناسی مولکولی (Molecular Biology)، ژنتیک (Genetics) و بیوتکنولوژی (Biotechnology) مدرن به شمار میروند. بهطور ساده، وکتور کلونینگ یک مولکول DNA کوچک و خودتکثیرشونده (Self-replicating DNA molecule) است که میتواند بهگونهای مهندسی شود تا قطعات DNA خارجی (Foreign DNA fragments) را حمل کند و آنها را در یک میزبان (Host organism) تکثیر کند. وکتورها با ایفای نقش بهعنوان وسیلهای برای وارد کردن ژنها، تکثیر آنها و مطالعهشان، به دانشمندان اجازه دادهاند تا ژنومها را بررسی کنند، پروتئینهای نوترکیب (Recombinant proteins) تولید کنند، ارگانیسمهای ترانسژنیک (Transgenic organisms) بسازند و درمانهایی توسعه دهند که پیش از انقلاب مولکولی در اواخر قرن بیستم غیرقابل تصور بودند.
تاریخچه وکتورهای کلونینگ به کشف پلاسمیدها (Plasmids) در باکتریها و شناسایی باکتریوفاژها (Bacteriophages) در اوایل قرن بیستم بازمیگردد. پژوهشگران به سرعت دریافتند که این مولکولهای DNA طبیعی توانایی دارند به طور مستقل تکثیر شوند و مواد ژنتیکی را بین سلولها منتقل کنند. با توسعه فناوری DNA نوترکیب (Recombinant DNA technology) در دهه ۱۹۷۰، این پلاسمیدها و ویروسهای طبیعی به وکتورهایی مهندسی شدند که قادر به حمل DNA خارجی بودند. آزمایشهای پیشگامانه کوهن (Cohen)، بویِر (Boyer) و همکارانشان نشان داد که میتوان ژنهای خارجی را در پلاسمیدها وارد کرد و آنها را به اشرشیا کلی (Escherichia coli / E. coli) منتقل نمود و منجر به تکثیر پایدار DNA وارد شده شد. این دستاورد، پایه و اساس مهندسی ژنتیک مدرن را بنا نهاد.
اهمیت وکتورهای کلونینگ بسیار عظیم است. بدون وجود وکتورها، دستکاری روتین قطعات DNA امکانپذیر نبود. کلونینگ مولکولی به دانشمندان این امکان را میدهد که ژنهای مورد علاقه را جدا کنند، مکانیزمهای تنظیمی آنها را مطالعه کنند و محصولات ارزشمندی مانند انسولین (Insulin)، هورمونهای رشد (Growth hormones)، آنتیبادیهای مونوکلونال (Monoclonal antibodies) و واکسنها (Vaccines) تولید نمایند. علاوه بر این، توسعه سیستمهای وکتوری برای سلولهای یوکاریوتی (Eukaryotic cells) و حتی گیاهان، جعبهابزار مهندسی ژنتیک را بهطرز چشمگیری گسترش داده است و امکان ایجاد حیوانات ترانسژنیک، محصولات کشاورزی دستکاریشده ژنتیکی و اشکال نوآورانهای از ژندرمانی (Gene therapy) را فراهم کرده است.
در سطح مفهومی، وکتورهای کلونینگ تنها ابزارهای آزمایشگاهی نیستند بلکه عمیقاً در نحوه تفکر زیستشناسان مولکولی درباره ژنها و ژنومها ادغام شدهاند. طراحی ماژولار (Modular design) وکتورها — با مارکرهای انتخابی (Selectable markers)، محلهای کلونینگ چندگانه (Multiple Cloning Sites / MCS)، مبادی همانندسازی (Origins of replication / ori) و توالیهای تنظیمی (Regulatory sequences) — بازتابی از همین تفکر ماژولار در زیستشناسی مولکولی است. هر پیشرفت در فناوری وکتورها، از پلاسمیدهای ساده تا کروموزومهای مصنوعی، مرزهای تازهای در تحقیقات ژنتیک گشوده است.
2. ویژگیهای عمومی وکتورهای کلونینگ (General Properties of Cloning Vectors)
اگرچه وکتورهای کلونینگ از نظر ساختار، اندازه و کاربرد بسیار متنوعاند، اما مجموعهای از ویژگیهای اساسی را به اشتراک میگذارند که آنها را برای کلونینگ مولکولی مناسب میسازد. درک این ویژگیها پایهای برای فهم تنوع سیستمهای وکتوری فراهم میکند.
2.1 ویژگیهای ضروری (Essential Features)
-
مبدأ همانندسازی (Origin of replication / ori):
اولین ویژگی ضروری در یک وکتور کلونینگ، وجود یک مبدأ همانندسازی است. این یک توالی خاص DNA است که به ماشین همانندسازی میزبان سیگنال میدهد تا وکتور را کپی کند. مبدأ همانندسازی تعیین میکند که چه تعداد کپی از وکتور در یک سلول میزبان حفظ شود.-
وکتورهای با تعداد کپی بالا (High-copy-number vectors) مانند پلاسمیدهای pUC میتوانند به صدها کپی در هر سلول برسند و مقدار فراوانی DNA برای کاربردهای بعدی تولید کنند.
-
در مقابل، وکتورهای با تعداد کپی پایین (Low-copy-number vectors) برای کلونینگ قطعات بزرگ DNA پایدارترند زیرا بار متابولیک کمتری به میزبان وارد میکنند.
-
-
مارکرهای انتخابی (Selectable markers):
این مارکرها به پژوهشگران اجازه میدهند سلولهای میزبان حاوی وکتور را شناسایی کنند. رایجترین آنها ژنهای مقاومت به آنتیبیوتیک مانند آمپیسیلین (Ampicillin)، کانامایسین (Kanamycin) یا تتراسایکلین (Tetracycline) هستند. در محیطی حاوی آنتیبیوتیک، تنها سلولهایی که وکتور را دارند زنده میمانند.-
سیستمهای پیشرفتهتر از مارکرهای تغذیهای (Nutritional markers) یا ژنهای گزارشگر (Reporter genes) مانند lacZ استفاده میکنند که امکان غربالگری آبی-سفید (Blue-white screening) را روی محیطهای X-gal فراهم میسازد.
-
-
محل کلونینگ چندگانه (Multiple Cloning Site / MCS یا Polylinker):
یک توالی کوتاه DNA است که بهطور مهندسیشده حاوی چندین محل شناسایی آنزیمهای محدودکننده (Restriction enzyme recognition sites) است. این ناحیه معمولاً یکتا در پلاسمید است و انعطاف بالایی برای انتخاب آنزیمها جهت بریدن وکتور و قطعه DNA واردشونده فراهم میکند و اتصال (Ligation) را تسهیل میکند. -
عناصر تخصصی (Specialized elements):
بسیاری از وکتورها شامل اجزای اضافی هستند که برای کاربردهای خاص طراحی شدهاند:-
وکتورهای بیانی (Expression vectors) حاوی پراموترها (Promoters) در بالادست MCS هستند تا رونویسی ژن واردشده را فعال کنند.
-
برخی دارای برچسبهای پروتئینی (Protein tags) مانند His-tag یا GFP fusion برای خالصسازی و تصویربرداری پروتئین هستند.
-
بعضی وکتورها توالیهایی دارند که امکان ادغام در ژنوم میزبان (Integration into host genome) را فراهم میکنند.
-
گروهی دیگر عناصر لازم برای بستهبندی در ذرات ویروسی (Viral packaging) را در خود جای دادهاند.
-
2.2 دامنه میزبان و سازگاری (Host Range and Compatibility)
کاربرد یک وکتور تنها به ساختار آن وابسته نیست بلکه به میزبانهایی که میتواند در آنها همانندسازی شود نیز بستگی دارد. بسیاری از وکتورهای کلونینگ برای استفاده در E. coli طراحی شدهاند، که استاندارد طلایی زیستشناسی مولکولی است. با این حال، با گسترش مهندسی ژنتیک به سایر سیستمها، وکتورهایی توسعه یافتند که با مخمر (Yeast)، سلولهای پستانداران (Mammalian cells) و گیاهان (Plants) سازگارند. دامنه میزبان اغلب توسط مبدأ همانندسازی یا توالیهای تنظیمی خاص در وکتور تعیین میشود.
سازگاری بین وکتورها نیز اهمیت دارد، بهویژه در آزمایشهایی که شامل کوترانسفورماسیون (Co-transformation) با چندین پلاسمید است. پلاسمیدها به گروههای ناسازگاری (Incompatibility groups) تقسیم میشوند و دو پلاسمید از یک گروه معمولاً نمیتوانند در یک سلول با هم پایدار باقی بمانند. با انتخاب وکتورهایی از گروههای ناسازگار مختلف، پژوهشگران میتوانند چندین پلاسمید را در یک میزبان نگه دارند که هر کدام حامل ژنها یا عملکردهای متفاوتی باشند.
2.3 ملاحظات مربوط به تعداد کپی (Copy Number Considerations)
تعداد کپی (Copy number) اثرات عمیقی بر استراتژیهای کلونینگ دارد:
-
وکتورهای با تعداد کپی بالا عالی برای تولید مقادیر زیاد DNA یا پروتئین هستند.
-
اما هنگام کلونینگ قطعات بزرگ یا ناپایدار DNA، این تعداد زیاد میتواند مشکلساز شود و منجر به رخدادهای نوترکیبی (Recombination events) یا استرس متابولیکی (Metabolic stress) روی میزبان شود.
-
برای غلبه بر این مشکلات، وکتورهای با تعداد کپی پایین مانند BACها (Bacterial Artificial Chromosomes / BACs) یا فوزمیدها (Fosmids) طراحی شدهاند که پایداری را در طی نسلهای متعدد تضمین میکنند.
3. دستههای وکتورهای کلونینگ (Categories of Cloning Vectors)
وکتورهای کلونینگ (Cloning vectors) یک گروه یکپارچه یا یکنواخت نیستند؛ بلکه مجموعهای گسترده از مولکولهای DNA مهندسیشده (Engineered DNA molecules) را شامل میشوند که هر کدام برای کارکردهای خاص در کلونینگ مولکولی (Molecular cloning) و دستکاری ژنتیکی (Genetic manipulation) بهینهسازی شدهاند.
نیاز به وکتورهای متنوع از این واقعیت ناشی میشود که هیچ سیستم واحدی نمیتواند تمام نیازهای آزمایشی را برآورده کند. به عنوان مثال:
-
وکتورهایی که برای تکثیر سریع ژنها در باکتریها طراحی شدهاند، برای بیان پایدار و طولانیمدت در سلولهای یوکاریوتی (Eukaryotic cells) مناسب نیستند.
-
وکتورهایی که توانایی حمل قطعات بسیار بزرگ DNA را دارند، اغلب فاقد تعداد کپی بالا (High copy number) یا کارایی بالای ترانسفورماسیون (Efficient transformation rates) هستند.
در طول سالها، پژوهشگران طیف وسیعی از وکتورهای کلونینگ را توسعه دادهاند که هر کدام دارای ویژگیها، مزایا و محدودیتهای منحصربهفردی هستند. در ادامه، مهمترین دستهها بررسی میشوند؛ از وکتورهای مشتق از پلاسمید (Plasmid-derived vectors) گرفته تا سیستمهای مبتنی بر ویروس (Virus-based systems)، کروموزومهای مصنوعی (Artificial chromosomes) و وکتورهای ویژه گیاهان.
3.1 وکتورهای کلونینگ مشتق از پلاسمید (Plasmid-derived Cloning Vectors)
پلاسمیدها (Plasmids) نخستین مولکولهای DNA بودند که به عنوان وکتور کلونینگ مورد استفاده قرار گرفتند و همچنان پرکاربردترین سیستم در آزمایشگاههای سراسر جهان به شمار میروند. پلاسمیدهای طبیعی، مولکولهای DNA دوتایی حلقوی خارجکروموزومی (Extrachromosomal, double-stranded circular DNA molecules) هستند که به صورت مستقل از کروموزوم میزبان تکثیر میشوند. پلاسمیدها در بسیاری از گونههای باکتریایی یافت میشوند و اغلب ژنهایی را حمل میکنند که مزایای انتخابی مانند مقاومت به آنتیبیوتیکها (Antibiotic resistance) یا کارکردهای متابولیکی (Metabolic functions) را فراهم میکنند.
برای تبدیل پلاسمیدها به وکتورهای کلونینگ کارآمد، چندین اصلاح مهندسی (Engineering modifications) لازم بود:
-
حذف ژنهای غیرضروری به منظور کاهش اندازه پلاسمید و افزایش کارایی ترانسفورماسیون.
-
وارد کردن محلهای یکتای آنزیمهای محدودکننده (Unique restriction enzyme sites) برای درج دقیق DNA خارجی.
-
افزودن مارکرهای انتخابی (Selectable markers) مانند ژنهای مقاومت به آنتیبیوتیک برای تشخیص سلولهای ترانسفورمشده.
ویژگی متمایز پلاسمیدها سادگی و انعطافپذیری (Simplicity and versatility) آنها است. چون پلاسمیدها نسبتاً کوچک و آسان برای دستکاری هستند، به سرعت میتوان آنها را برای اهداف مختلف تغییر داد. آنها برای قطعات DNA کوتاه تا متوسط (چند صد جفتباز تا حدود ۱۰ کیلوباز) بسیار کارآمد هستند. به همین دلیل، وکتورهای پلاسمیدی در کلونینگ ژنها، سابکلونینگ (Subcloning)، موتاژنز (Mutagenesis) و کاربردهای روتین زیستشناسی مولکولی نقش اساسی دارند.
تکامل وکتورهای پلاسمیدی مسیر نیازهای علمی را دنبال کرده است:
-
پلاسمیدهای اولیه مانند pBR322 با مارکرهای مقاومت آنتیبیوتیکی متعدد و محلهای کلونینگ مختلف پایهگذار این حوزه شدند.
-
سپس سیستمهای بهینهشدهای مانند سری pUC معرفی شدند که تعداد کپی بالا و غربالگری آبی-سفید (Blue-white screening) کارآمدی داشتند.
-
امروزه پلاسمیدها در انواع بیشماری در دسترس هستند که هر کدام متناسب با میزبانها، پراموترها (Promoters) و استراتژیهای آزمایشی خاص طراحی شدهاند.
با وجود سیستمهای پیشرفتهتر، پلاسمیدها همچنان ستون فقرات کلونینگ باقی ماندهاند زیرا قابل اعتماد، کمهزینه و آسان در استفاده هستند.
3.2 سیستمهای انتخاب پلاسمید (Plasmid Selection Systems)
یکی از الزامات اساسی در هر آزمایش کلونینگ، توانایی شناسایی و جداسازی سلولهای حاوی DNA نوترکیب (Recombinant DNA) است. سیستمهای انتخابی که در وکتورهای کلونینگ تعبیه میشوند این کارکرد را فراهم میسازند.
روشهای اصلی انتخاب:
-
ژنهای مقاومت به آنتیبیوتیک (Antibiotic resistance genes):
-
ژن bla که آنزیم β-لاکتاماز (β-lactamase) را کد میکند → مقاومت به آمپیسیلین (Ampicillin).
-
ژن kan → مقاومت به کانامایسین (Kanamycin).
در محیط کشت حاوی آنتیبیوتیک، فقط سلولهایی که وکتور را دریافت کردهاند زنده میمانند.
-
-
مارکرهای تغذیهای (Nutritional markers):
بهویژه در مخمر (Yeast) و یوکاریوتهای دیگر استفاده میشوند. پلاسمیدهای حامل ژنهایی که کمبودهای متابولیکی خاص را جبران میکنند، امکان رشد در محیط انتخابی را به میزبانهای موتانت میدهند.
مثال: ژن URA3 که به سلولهای مخمر فاقد این ژن اجازه میدهد اوراسیل (Uracil) بسازند. -
ژنهای گزارشگر (Reporter genes):
-
lacZ → آنزیم β-گالاکتوزیداز (β-galactosidase) → اساس سیستم غربالگری آبی-سفید.
درج DNA خارجی در ناحیه lacZα این ژن را مختل میکند → کلونیهای آبی (ژن سالم) در برابر کلونیهای سفید (ژن مختلشده). -
پروتئینهای فلورسنت (Fluorescent proteins) مثل GFP برای تایید تصویری بیان ژن.
-
-
سیستمهای انتخاب مثبت-منفی (Positive-negative selection):
برخی وکتورهای پیشرفته از ترکیب دو مارکر استفاده میکنند؛ مثلاً یک ژن کشنده که تنها در صورت درج DNA خارجی غیرفعال میشود. در این حالت فقط کلونهای صحیح زنده میمانند.
👉 این سیستمهای انتخابی ستون فقرات کلونینگ مدرن هستند و با ترکیب آنها، پژوهشگران میتوانند دقت و کارایی بالایی در شناسایی کلونهای صحیح به دست آورند.
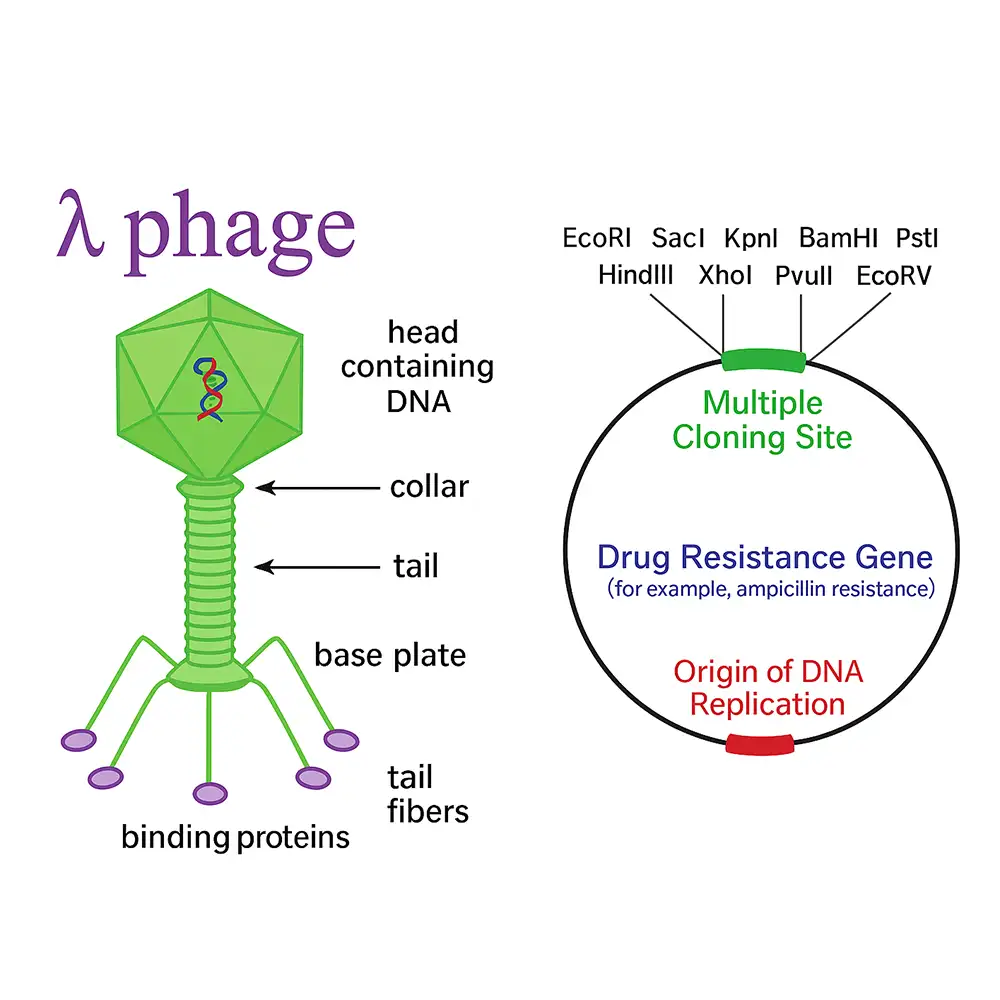
3.3 وکتورهای کلونینگ پلاسمیدی pUC (PUC Plasmid Cloning Vectors)
در میان انواع وکتورهای پلاسمیدی، سری pUC جایگاه ویژهای دارد. این وکتورها در دهه ۱۹۸۰ توسعه یافتند تا محدودیتهای پلاسمیدهای قبلی را برطرف کنند.
ویژگیها:
-
نام pUC = مخفف "Plasmid University of California".
-
دارای مبدأ همانندسازی مشتق از ColE1 → رسیدن به تعداد کپی بسیار بالا (بیش از ۵۰۰ نسخه در هر سلول).
-
این ویژگی باعث میشود pUC برای کاربردهایی که به مقادیر زیاد DNA نوترکیب نیاز دارند ایدهآل باشد.
-
ویژگی شاخص:
-
وجود محل کلونینگ چندگانه (MCS) در درون ژن lacZα.
-
درج DNA در این ناحیه ژن lacZ را مختل میکند.
-
در محیط حاوی X-gal و IPTG:
-
کلونیهای با ژن سالم → آبی.
-
کلونیهای نوترکیب (ژن مختلشده) → سفید.
-
-
→ این سیستم غربالگری آبی-سفید یک انقلاب در کلونینگ بود زیرا امکان شناسایی سریع و بصری کلونهای نوترکیب را فراهم کرد.
-
اندازه کوچک (~2.7 kb): → افزایش کارایی ترانسفورماسیون.
-
طراحی ماژولار (Modular design): قابلیت انطباق با سابکلونینگ، توالییابی، مطالعات بیان ژن.
👉 موفقیت pUC نشان میدهد که چگونه طراحی هوشمندانه وکتور میتواند نتایج آزمایشی را بهبود چشمگیری ببخشد. با وجود وکتورهای جدیدتر، pUC همچنان در آزمایشگاههای آموزشی و پژوهشی استفاده گستردهای دارد.
3.4 وکتورهای کلونینگ مبتنی بر ویروس (Virus-based Cloning Vectors)
هرچند پلاسمیدها سادهترین و رایجترین وکتورها هستند، اما ویروسها به دلیل توانایی طبیعی در آلودهسازی سلولها و انتقال مواد ژنتیکی، مزایای منحصربهفردی دارند.
-
ویروس λ (Lambda bacteriophage):
-
یکی از اولین و مهمترین وکتورهای ویروسی.
-
ویروس DNA دو رشتهای که E. coli را آلوده میکند.
-
میتوان بخشهای غیرضروری ژنوم را حذف و با DNA خارجی (تا 25 kb) جایگزین کرد.
-
انواع: Insertion vectors و Replacement vectors.
-
نقش کلیدی در ساخت اولین کتابخانههای ژنومی (Genomic libraries).
-
-
ویروسهای یوکاریوتی (Eukaryotic viruses):
-
آدنوویروسها (Adenoviruses): آلودهسازی سلولهای تقسیمشونده و تقسیمنشده → مناسب برای تحویل ژن در سلولهای پستانداران.
-
رتروویروسها (Retroviruses): ادغام پایدار در ژنوم میزبان → مناسب برای بیان طولانیمدت. (کاربرد اصلی: ژندرمانی).
-
باکولوویروسها (Baculoviruses):
-
وکتورهای ویژه برای سلولهای حشرات.
-
ظرفیت بالای درج DNA.
-
بیان سطح بالای پروتئینهای یوکاریوتی پیچیده → مخصوصاً پروتئینهای نیازمند اصلاحات پسترجمهای (Post-translational modifications).
-
-
👉 با وجود مزایا، وکتورهای ویروسی چالشهایی مانند ملاحظات ایمنی، ظرفیت محدود درج (در برخی موارد) و مشکلات تولید در مقیاس بزرگ دارند. اما کارایی بالای انتقال ژن آنها را به ابزارهای حیاتی برای تحقیقات پایه و بیوتکنولوژی کاربردی تبدیل کرده است.
3.5 وکتورهای درج و جایگزینی (Insertion and Replacement Cloning Vectors)
این وکتورها دو رویکرد متفاوت برای درج DNA خارجی در ژنوم ویروسها (بهویژه فاژ λ) هستند:
-
وکتورهای درج (Insertion vectors):
-
طراحی شده با یک محل برش یکتا در ناحیه غیرضروری ژنوم.
-
درج مستقیم DNA در این محل.
-
سادهتر در ساخت و استفاده.
-
ظرفیت: کمتر از 10 kb.
-
مناسب برای کلونینگ cDNA یا قطعات کوچک DNA.
-
-
وکتورهای جایگزینی (Replacement vectors):
-
بخشی از ژنوم ویروس که برای همانندسازی غیرضروری است → حذف میشود.
-
با DNA خارجی جایگزین میشود.
-
ظرفیت: تا 20–25 kb.
-
کاربرد: ساخت کتابخانههای ژنومی بزرگ.
-
👉 توسعه این وکتورها یک گام بزرگ در کلونینگ مولکولی بود چون پژوهشگران را قادر ساخت از پلاسمیدها فراتر روند و قطعات بزرگتر DNA را مدیریت کنند. همچنین پایهگذار نوآوریهایی مانند کاسمیدها (Cosmids) و کروموزومهای مصنوعی (Artificial chromosomes) شدند.
3.6 فاژمید (Phagemid) و وکتورهای کلونینگ M13
فاژمیدها (Phagemids) یک کلاس ترکیبی از وکتورها هستند که ویژگیهای پلاسمیدها (Plasmids) و باکتریوفاژها (Bacteriophages) رو با هم ترکیب میکنن. فاژمیدها در اصل پلاسمیدهایی هستن که یک مبدا همانندسازی فاژی (Phage origin of replication) دارن، که معمولاً از فاژهای رشتهای مثل M13 یا f1 مشتق میشه. این طراحی باعث میشه فاژمیدها هم بهصورت یک پلاسمید معمولی در باکتریها تکثیر بشن و هم در حضور پروتئینهای کمکی فاژ، قادر باشن DNA تکرشتهای (Single-stranded DNA) تولید کنن.
این ماهیت دوگانه فاژمیدها چند مزیت مهم ایجاد میکنه:
-
در شرایطی که بدون فاژ کمکی در باکتری تکثیر میشن، مثل یک پلاسمید با تعداد کپی بالا عمل میکنن و بهراحتی دستکاری و تکثیر میشن.
-
وقتی فاژ کمکی اضافه بشه، وکتور میتونه درون ذرات فاژی بستهبندی بشه و بهشکل DNA تکرشتهای از سلول خارج بشه.
این DNA تکرشتهای برای کاربردهایی مثل:
-
توالییابی سنگر (Sanger sequencing)
-
جهشزایی هدفمند (Mutagenesis)
-
ساخت پروبهای DNA (DNA probes)
بسیار مفید هست.
یکی دیگه از قابلیتهای فاژمیدها، پشتیبانی از استراتژیهای کلونینگیه که به DNA رشته-اختصاصی نیاز دارن. مثلاً در جهشزایی هدفمند (Site-directed mutagenesis)، یک الیگونوکلئوتید سنتزی روی الگوی DNA تکرشتهای متصل میشه و بعد توسط DNA پلیمراز (DNA polymerase) و لیگاز (Ligase) تکمیل میشه. همین ویژگی باعث شد فاژمیدها در دهههای ابتدایی زیستشناسی مولکولی، قبل از ظهور تکنیکهای توالییابی نسل جدید، ابزاری حیاتی باشن.
ارتباط نزدیک فاژمیدها با وکتورهای M13 هم اهمیت زیادی داره. M13 یک فاژ رشتهایه که باکتری E. coli حامل پیلی F رو آلوده میکنه. بر خلاف فاژهای لیتیک (Lytic phages)، M13 میزبان خودش رو نمیکشه، بلکه بهطور مداوم ذرات فاژی جدید حاوی DNA تکرشتهای آزاد میکنه.
با جایگزینی بخشهای غیرضروری ژنوم M13 با DNA خارجی، وکتورهایی ساخته شدن که میتونن چند کیلوباز DNA رو حمل کنن. این وکتورها در گذشته نقش کلیدی در توالییابی DNA داشتن، بهویژه در دوران پروژه ژنوم انسان (Human Genome Project). چون M13 میتونست الگوهای تکرشتهای تولید کنه، به شدت برای روش سنگر مناسب بود.
همچنین M13 در تکنولوژی نمایش فاژی (Phage display) کاربرد گستردهای پیدا کرد. در این روش، پپتیدها یا پروتئینها روی سطح فاژ بیان میشن و برای بررسی اتصال به اهداف خاص غربالگری میشن. این تکنولوژی کاربردهای وسیعی در:
-
مهندسی آنتیبادی (Antibody engineering)
-
کشف دارو (Drug discovery)
-
مطالعات شناسایی مولکولی (Molecular recognition)
داشته.
با اینکه ظهور روشهای مبتنی بر PCR و توالییابی مدرن نقش اصلی فاژمیدها و M13 رو کمتر کرده، ولی هنوز در کاربردهای تخصصی ارزشمند هستن. توانایی منحصر به فرد اونها در تولید DNA تکرشتهای همچنان باعث میشه جایگاه خودشون رو در جعبه ابزار زیستشناسی مولکولی حفظ کنن.
۴. سیستمهای انتخاب پلاسمید (Plasmid Selection Systems)
یکی از مهمترین جنبههای کار با وکتورهای کلونینگ (Cloning Vectors)، توانایی شناسایی و جداسازی سلولهای میزبان (Host Cells) است که با موفقیت DNA نوترکیبی (Recombinant DNA) را دریافت کردهاند. در عمل، وقتی یک وکتور پلاسمیدی (Plasmid Vector) وارد سلولهای باکتریایی میشود، تنها بخشی از آن سلولها واقعاً پلاسمید را دریافت میکنند. علاوه بر این، همه پلاسمیدهای وارد شده حاوی قطعه DNA دلخواه (Desired Insert) نیستند.
برای حل این مشکل، زیستشناسان مولکولی از سیستمهای انتخاب پلاسمید (Plasmid Selection Systems) استفاده میکنند که روشهایی برای تمایز بین سلولهای ترنسفورمشده و غیرترنسفورمشده فراهم میکنند و گاهی حتی بین پلاسمیدهای نوترکیبی و غیرنوترکیبی تمایز قائل میشوند.
۴.۱ مارکرهای قابل انتخاب (Selectable Marker Genes)
ستون فقرات (Cornerstone) سیستمهای انتخاب پلاسمید، ژن مارکر قابل انتخاب (Selectable Marker Gene) است که معمولاً ژن مقاومت به آنتیبیوتیک (Antibiotic Resistance Gene) میباشد. این ژنها به سلولهای ترنسفورمشده امکان میدهند در حضور یک آنتیبیوتیک خاص رشد کنند، در حالی که سلولهای غیرترنسفورمشده بدون پلاسمید قادر به زنده ماندن نیستند.
مثالها:
-
ژن bla: مقاومت به آمپیسیلین (Ampicillin) میدهد.
-
ژن kan: مقاومت به کانامایسین (Kanamycin) میدهد.
-
مقاومت به کلرامفنیکل (Chloramphenicol) یا تتراسایکلین (Tetracycline) نیز در وکتورهای مختلف استفاده شده است.
این سیستم تضمین میکند که تنها باکتریهایی که پلاسمید را دارند زنده میمانند و کار جداسازی ترنسفورمشدهها بسیار سادهتر میشود.
۴.۲ شناسایی پلاسمیدهای نوترکیبی (Recombinant Plasmids)
در حالی که مارکرهای قابل انتخاب سلولهای دارای پلاسمید را از سلولهای فاقد پلاسمید تمیز میدهند، برای تمایز بین پلاسمیدهای حاوی قطعه مورد نظر و پلاسمیدهایی که دوباره به هم متصل شدهاند بدون قطعه DNA، نیاز به سیستمهای اضافی است.
یکی از استراتژیهای رایج، غربالگری آبی-سفید (Blue-White Screening) است که مبتنی بر سیستم مکملسازی lacZα (lacZ α-complementation System) میباشد.
-
در پلاسمیدهایی مثل pUC و pBluescript، سایت چندگانه کلونینگ (Multiple Cloning Site, MCS) در قطعه ژن lacZα قرار دارد.
-
وقتی هیچ DNA خارجی وارد نشده باشد، قطعه lacZα سالم باقی میماند و فعالیت β-گالاکتوزیداز (β-galactosidase) بازسازی میشود و کلنیها آبی رنگ میشوند.
-
وقتی DNA خارجی وارد شود، ترکیب lacZα مختل میشود و کلنیها سفید خواهند بود.
بنابراین، کلنیهای سفید بهراحتی کلنیهای نوترکیبی محسوب میشوند.
۴.۳ مارکرهای شرطی و منشاء تکثیر شرطی
لایه دیگری از انتخاب شامل استفاده از:
-
مبداهای همانندسازی شرطی (Conditional Replication Origins)
-
مارکرهای کشنده شرطی (Conditional Lethal Markers)
مثالها:
-
مبداهای همانندسازی حساس به دما (Temperature-sensitive Origins): تنها در دمای مجاز تکثیر میشوند.
-
مارکرهای کشنده شرطی: ژنهایی که در شرایط خاص سمی هستند مگر اینکه توسط یک قطعه DNA وارد شده مختل شوند.
این سیستمها فشار انتخابی قوی ایجاد میکنند و اطمینان میدهند که تنها پلاسمیدهای نوترکیبی حفظ شوند.
۴.۴ ژنهای گزارشگر (Reporter Genes)
سیستمهای مدرنتر شامل ژنهای گزارشگر (Reporter Genes) مثل:
-
gfp (Green Fluorescent Protein)
-
luc (Luciferase)
-
cat (Chloramphenicol Acetyltransferase)
در صورتی که DNA خارجی وارد شود، فعالیت ژن گزارشگر مختل میشود و این به راحتی نشان میدهد که پلاسمید نوترکیبی است. گزارشگرهای فلورسنت امکان شناسایی سریع ترنسفورمشدهها با میکروسکوپی یا فلوسایتومتری را فراهم میکنند.
۴.۵ اهمیت سیستمهای انتخاب پلاسمید
سیستمهای انتخاب پلاسمید، ستون فقرات (Backbone) آزمایشهای کلونینگ محسوب میشوند و اطمینان میدهند که تنها کلنیهای نوترکیبی مورد نظر بازیابی و تکثیر شوند. با توسعه روشهای زیستشناسی سنتتیک (Synthetic Biology)، سیستمهای انتخابی امروزی بسیار قابل تنظیم، دقیق و کارآمد شدهاند.
۵. وکتورهای کلونینگ پلاسمیدی سری pUC (Plasmid Cloning Vectors of the pUC Series)
در میان وکتورهای پلاسمیدی، سری pUC نقش بسیار مهمی در شکلدهی عملیات کلونینگ مولکولی (Molecular Cloning Practice) ایفا کرده است. این وکتورها از پلاسمیدهای اولیه مثل pBR322 مشتق شده و به گونهای مهندسی شدهاند که:
-
تعداد کپی بالا (High Copy Number) داشته باشند،
-
سایتهای کلونینگ چندگانه (Multiple Cloning Sites) منعطف داشته باشند،
-
و سیستمهای انتخاب بهبود یافتهای ارائه دهند.
سری pUC به استانداردی در آزمایشگاههای زیستشناسی مولکولی تبدیل شده و تا امروز مورد استفاده قرار میگیرد.
۵.۱ تاریخچه توسعه وکتورهای pUC
-
معرفی سری pUC در اوایل دهه ۱۹۸۰ به عنوان بهبود بر وکتورهای قدیمی مانند pBR322.
-
مشکل اصلی پلاسمیدهای اولیه، تعداد کپی پایین بود که بازده DNA کلونشده را محدود میکرد.
-
برای حل این مشکل، مبدا همانندسازی (Origin of Replication) مشتق از ColE1 با جهش ایجاد شد تا تعداد کپی بسیار بالا (۵۰۰–۷۰۰ کپی در هر سلول) داشته باشد.
مزیت: بازده بالای DNA پلاسمیدی حتی از فرهنگهای کوچک.
-
موقعیت MCS در داخل ژن lacZα قرار گرفت، که هم امکان وارد کردن آسان قطعات DNA و هم غربالگری آبی-سفید را فراهم میکرد.
-
MCS دارای چندین سایت محدودکننده یکتا بود، که انعطاف زیادی در انتخاب آنزیمها و استراتژیهای کلونینگ ایجاد میکرد.
-
نام pUC اشاره به دانشگاه کالیفرنیا (University of California) دارد.
-
نسخههای مختلف مانند pUC18 و pUC19 عمدتاً در جهت MCS متفاوت بودند.
۵.۲ ویژگیهای ساختاری وکتورهای pUC
-
اندازه کوچک (~۲.۷ کیلوباز)، مناسب برای دستکاری سریع.
-
ویژگیهای کلیدی:
-
مبدا همانندسازی ColE1: برای تعداد کپی بالا.
-
ژن مقاومت به آمپیسیلین (bla): انتخاب سلولهای ترنسفورمشده.
-
سایت کلونینگ چندگانه (MCS): بیش از دوازده سایت یکتا، درون lacZα.
-
قطعه lacZα: برای غربالگری آبی-سفید با X-gal.
-
۵.۳ کاربردها و مزایا
-
مناسب برای کلونینگ قطعات DNA کوچک تا متوسط.
-
تعداد کپی بالا → بازده زیاد DNA برای توالییابی، زیرکلونینگ و کاربردهای بعدی.
-
غربالگری آبی-سفید → صرفهجویی در زمان و منابع.
-
اندازه کوچک → کاهش ریسک بازآرایی یا ناپایداری.
-
سادگی → ابزار آموزشی ایدهآل برای دانشجویان زیستشناسی مولکولی.
۶. وکتورهای کلونینگ مبتنی بر ویروس (Virus-based Cloning Vectors)
وکتورهای کلونینگ مبتنی بر ویروس از توانایی طبیعی ویروسها در انتقال ماده ژنتیکی (Genetic Material) به سلولهای میزبان (Host Cells) استفاده میکنند. برخلاف وکتورهای پلاسمیدی (Plasmid Vectors) که معمولاً در اندازه DNA قابل حمل محدودیت دارند، وکتورهای مشتق از ویروس میتوانند قطعات DNA بزرگتری را حمل کرده و آنها را به دامنه وسیعی از میزبانها (Wide Range of Host Organisms) منتقل کنند.
این وکتورها به ویژه در مواردی ارزشمند هستند که نیاز به سطح بالای بیان ژن (High Expression Levels) یا ادغام پایدار ژن مورد نظر (Stable Integration of Gene of Interest) وجود دارد.
انواع وکتورهای ویروسی
-
باكتریوفاژها (Bacteriophages):
-
مانند فاژ λ (Lambda Phage)، برای کلونینگ قطعات بزرگ DNA در سیستمهای باکتریایی استفاده میشوند.
-
مزیت: مکانیزمهای بستهبندی دقیق ژنوم (Precise Genome Packaging Mechanisms) دارند.
-
قادر به حمل قطعات DNA تا ۲۰ کیلوباز (Kilobases) هستند → مناسب برای ساخت کتابخانههای ژنومی (Genomic Libraries).
-
-
ویروسهای یوکاریوتی (Eukaryotic Viruses):
-
رتروویروسها (Retroviruses): ژن وارد شده را در ژنوم میزبان ادغام (Integrate into Host Genome) میکنند → بیان طولانیمدت (Long-term Expression).
-
آدنوویروسها (Adenoviruses): ژن خارجی را بهطور گذرا (Transient Expression) بیان میکنند بدون ادغام → مناسب در درمان ژنی (Gene Therapy) یا مطالعات آزمایشی خاص.
-
نکات ایمنی و مقرراتی
استفاده از وکتورهای ویروسی نیازمند توجه دقیق به مسائل ایمنی و مقرراتی (Safety and Regulatory Issues) است.
-
وکتورها باید از ویروسهای پاتوژنیک (Pathogenic Viruses) مشتق شده باشند.
-
مهندسی شوند تا توانایی تکثیر (Replication Capability) از بین برود، ولی توانایی انتقال ژن (Delivery Function) حفظ شود.
با وجود این چالشها، وکتورهای ویروسی هنوز ابزارهای ضروری (Indispensable Tools) در زیستشناسی مولکولی (Molecular Biology)، درمان ژنی (Gene Therapy) و ژنتیک عملکردی (Functional Genomics) هستند.
۷. وکتورهای درج و جایگزینی (Insertion and Replacement Vectors)
وکتورهای درج (Insertion Vectors) و وکتورهای جایگزینی (Replacement Vectors)، ابزارهای کلونینگ تخصصی هستند که برای انجام تغییرات دقیق ژنتیکی (Precise Genetic Manipulations) طراحی شدهاند.
هر دو استراتژی از بازترکیب همولوگ (Homologous Recombination) یا توالیهای مهندسی شده (Engineered Sequences) برای درج، حذف یا جایگزینی قطعات خاص DNA در ژنوم هدف یا پشتوانه وکتور (Vector Backbone) استفاده میکنند.
۷.۱ وکتورهای درج (Insertion Vectors)
-
طراحی شدهاند تا ژن یا قطعه DNA را در یک سایت از پیش تعیینشده (Predetermined Site) در ژنوم میزبان (Host Genome) یا وکتور بزرگتر وارد کنند.
-
معمولاً شامل:
-
مارکرهای انتخابی (Selectable Markers)
-
عناصر تنظیمی (Regulatory Elements)
-
توالیهای فلانکینگ (Flanking Sequences) برای افزایش بازترکیب (Enhance Recombination Efficiency)
-
-
DNA وارد شده بهطور پایدار (Stably) حفظ میشود و میتواند تحت کنترل پروموترهای مناسب (Appropriate Promoters) بیان شود → برای مطالعات عملکردی (Functional Studies) یا تولید پروتئینهای نوترکیبی (Recombinant Proteins) کاربرد دارد.
۷.۲ وکتورهای جایگزینی (Replacement Vectors)
-
امکان تبادل یک قطعه DNA با یک توالی جایگزین (Alternative Sequence) را فراهم میکنند.
-
کاربرد رایج: حذف ژن (Gene Knockouts) یا تجارب جایگزینی ژن (Gene Replacement Experiments) برای مطالعه عملکرد ژن با جانشینی آن با نسخه اصلاحشده.
-
طراحی شدهاند با توالیهای همولوگ بلند (Long Homologous Sequences) در دو سوی ناحیه هدف (Target Region) → تشویق بازترکیب دقیق (Promoting Precise Recombination).
-
در برخی سیستمها، از مارکرهای ضد انتخابی (Counter-Selectable Markers) برای افزایش فراوانی کلونهای بازترکیبشده صحیح (Correctly Recombinant Clones) استفاده میشود.
۷.۳ اهمیت و کاربردها
-
این وکتورها ابزار قدرتمند (Powerful Tools) برای دستکاری ژنوم با دقت بالا (High Specificity Genome Manipulation) هستند.
-
کاربردها شامل:
-
ژنتیک عملکردی (Functional Genomics)
-
زیستشناسی سنتتیک (Synthetic Biology)
-
توسعه موجودات اصلاحشده ژنتیکی (Genetically Modified Organisms, GMOs)
-
استراتژیهای درمانی (Therapeutic Strategies)
-
۸. کاربردهای وکتورهای کلونینگ (Applications of Cloning Vectors)
وکتورهای کلونینگ (Cloning Vectors) بهعنوان ابزارهای پایهای در زیستشناسی مولکولی (Molecular Biology) عمل میکنند و پلتفرمهای چندمنظوره (Versatile Platforms) برای دستکاری (Manipulation)، تحلیل (Analysis) و بیان ماده ژنتیکی (Expression of Genetic Material) فراهم میآورند.
کاربردهای آنها دامنه وسیعی دارد که شامل تحقیقات پایه (Basic Research)، بیوتکنولوژی (Biotechnology)، پزشکی (Medicine) و کشاورزی (Agriculture) میشود و نقش مرکزی آنها در علوم زیستی مدرن (Central Role in Modern Life Sciences) را نشان میدهد.
۸.۱ کلونینگ ژن و تحلیل عملکردی (Gene Cloning and Functional Analysis)
یکی از اصلیترین کاربردهای وکتورهای کلونینگ، جداسازی و تکثیر ژنها یا قطعات DNA خاص (Isolation and Replication of Specific Genes or DNA Fragments) است.
-
با درج یک ژن مورد نظر (Gene of Interest) در یک وکتور مناسب، پژوهشگران میتوانند آن را در سلولهای میزبان (Host Cells) تکثیر کنند.
-
این فرآیند امکان مطالعه جزئیات توالی ژن (Sequence)، عناصر تنظیمی (Regulatory Elements) و عملکرد ژن (Function) را فراهم میآورد.
تحلیل عملکردی (Functional Analysis) همچنین میتواند شامل:
-
ایجاد موتانتها (Mutants)
-
ایجاد فیوژنها (Fusions)
باشد تا رفتار ژن در شرایط مختلف (Gene Behavior Under Different Conditions) بررسی شود.
نکته مهم: این کاربرد برای درک بیان ژن (Gene Expression)، ساختار پروتئین (Protein Structure) و فعالیت آنزیمی (Enzymatic Activity) حیاتی است.
۸.۲ بیان و تولید پروتئین (Protein Expression and Production)
وکتورهای کلونینگ نقش اساسی در تولید پروتئینهای نوترکیبی (Recombinant Proteins) در:
-
باکتریها (Bacteria)
-
مخمر (Yeast)
-
سلولهای حشرهای (Insect Cells)
-
سلولهای پستانداران (Mammalian Cells)
دارند.
برای بهینهسازی بیان پروتئین و تسهیل تصفیه (Optimize Protein Expression and Facilitate Purification)، وکتورها میتوانند شامل:
-
پروموترهای قوی (Strong Promoters)
-
مکانهای اتصال ریبوزوم (Ribosome Binding Sites)
-
توالیهای سیگنال (Signal Sequences) باشند.
اهمیت: این کاربرد بیوتکنولوژی و پزشکی (Biotechnology and Medicine) را متحول کرده و امکان تولید انبوه آنزیمها، هورمونها، آنتیبادیها و واکسنها (Mass Production of Enzymes, Hormones, Antibodies, and Vaccines) را با کارایی و اختصاصیت بالا (High Efficiency and Specificity) فراهم میکند.
۸.۳ ساخت کتابخانه ژنومی (Genomic Library Construction)
-
وکتورها، بهویژه سیستمهای باکتریوفاژ (Bacteriophage Systems) و کازمیدها (Cosmid Systems)، برای ایجاد کتابخانههای ژنومی یا cDNA (Genomic or cDNA Libraries) استفاده میشوند.
-
این کتابخانهها مجموعههای جامعی از قطعات DNA (Comprehensive Collections of DNA Fragments) فراهم میکنند که ژنوم یا ترنسکریپتوم (Transcriptome) یک موجود را نمایندگی میکنند.
-
این منابع برای توالییابی ژنوم (Genome Sequencing)، کشف ژنها (Gene Discovery) و مطالعات ژنتیک مقایسهای (Comparative Genomics Studies) ضروری هستند.
۸.۴ درمان ژنی و کاربردهای پزشکی (Gene Therapy and Medical Applications)
-
وکتورهای مبتنی بر ویروس (Virus-based Vectors) ابزارهای مرکزی در درمان ژنی (Gene Therapy) هستند.
-
در این روش، ژنهای درمانی (Therapeutic Genes) به سلولهای بیمار منتقل میشوند تا اختلالات ژنتیکی (Genetic Disorders) اصلاح یا بیماریها درمان شوند.
-
وکتورهای آدنوویروس (Adenoviral Vectors)، رتروویروسها (Retroviral Vectors) و وکتورهای آدنو-مرتبط (Adeno-Associated Viral Vectors) به دقت مهندسی شدهاند تا انتقال ژن امن و کارآمد (Safe and Efficient Gene Transfer) فراهم شود.
علاوه بر درمان، وکتورها توسعه ابزارهای تشخیصی (Diagnostic Tools)، از جمله سیستمهای گزارشگر (Reporter Systems) برای شناسایی بیومارکرهای بیماری (Disease Biomarkers) را ممکن میسازند.
۸.۵ بیوتکنولوژی کشاورزی و صنعتی (Agricultural and Industrial Biotechnology)
-
در کشاورزی (Agriculture)، وکتورها برای ایجاد گیاهان اصلاحشده ژنتیکی (Genetically Modified Plants) با صفات مطلوب استفاده میشوند، مانند:
-
مقاومت به بیماریها (Disease Resistance)
-
بهبود تغذیه (Improved Nutrition)
-
افزایش تحمل به استرس (Enhanced Stress Tolerance)
-
-
در بیوتکنولوژی صنعتی (Industrial Biotechnology)، وکتورها امکان تولید:
-
سوختهای زیستی (Biofuels)
-
پلاستیکهای زیستتخریبپذیر (Biodegradable Plastics)
-
مواد شیمیایی با ارزش (High-Value Chemicals)
را توسط میکروارگانیسمهای مهندسیشده (Genetically Engineered Microorganisms) فراهم میکنند.
-
۸.۶ جمعبندی
-
کاربردهای وکتورهای کلونینگ وسیع و در حال گسترش هستند (Vast and Continually Expanding Applications).
-
با ارائه یک روش قابل کنترل برای تکثیر، تغییر و بیان DNA (Controllable Means to Replicate, Modify, and Express DNA)، این وکتورها به پژوهشگران و صنایع (Researchers and Industries) قدرت میدهند تا:
-
سیستمهای زیستی را بررسی کنند (Explore Biological Systems)
-
درمانهای جدید توسعه دهند (Develop New Therapies)
-
از موجودات زنده برای منافع انسانی بهرهبرداری کنند (Harness Living Organisms for Human Benefit)
-

