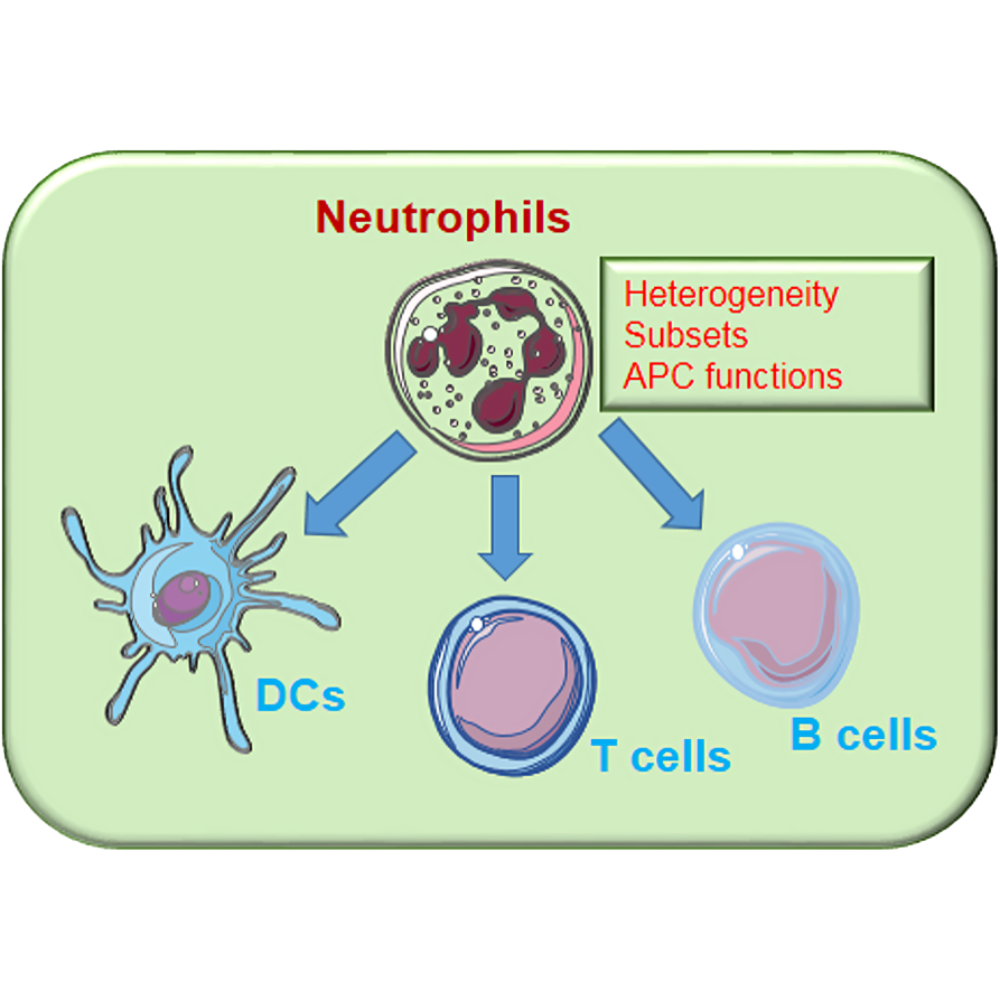
نقش ماکروفاژ، نوتروفیل، سلول T و B
مقدمه
سیستم ایمنی بدن یکی از پیچیدهترین و حیاتیترین سازوکارهای زیستی است که موجودات زنده را در برابر تهدیدهای محیطی و داخلی محافظت میکند. این سیستم با توانایی شناسایی و پاسخدهی به عوامل مهاجم مانند باکتریها، ویروسها، قارچها و حتی سلولهای سرطانی، نقش حیاتی در حفظ سلامت و بقا ایفا میکند. ایمنی بدن به دو بخش اصلی تقسیم میشود: ایمنی ذاتی و ایمنی اکتسابی. ایمنی ذاتی که توسط سلولهایی مانند ماکروفاژها و نوتروفیلها شکل میگیرد، اولین خط دفاعی بدن است و پاسخهای سریع و غیر اختصاصی ارائه میدهد. در مقابل، ایمنی اکتسابی یا تطبیقی شامل سلولهای T و B است که پاسخهای تخصصی و هدفمند ایجاد میکنند و میتوانند حافظه ایمنی ایجاد کنند تا بدن در مواجهه مجدد با همان عامل مهاجم پاسخ سریعتر و موثرتر نشان دهد.
ماکروفاژها و نوتروفیلها به عنوان ستونهای اصلی ایمنی ذاتی شناخته میشوند. ماکروفاژها نه تنها وظیفه بلع و تخریب میکروبها و سلولهای مرده را بر عهده دارند، بلکه نقش تنظیمکننده و هماهنگکننده پاسخهای ایمنی را نیز ایفا میکنند. آنها با ترشح سایتوکینها و مولکولهای سیگنالدهنده، فعالیت سلولهای دیگر سیستم ایمنی از جمله سلولهای T و B را تنظیم میکنند. نوتروفیلها نیز با سرعت عمل بالا و توانایی مهاجرت سریع به محل التهاب، اولین خط دفاعی در برابر عفونتها هستند و علاوه بر فعالیت میکروبکشی، به طور مستقیم در تنظیم فعالیت سلولهای ایمنی تطبیقی نقش دارند.
سلولهای T و B، اجزای اصلی ایمنی تطبیقی هستند که پاسخهای اختصاصی علیه پاتوژنها ارائه میدهند. سلولهای T با شناسایی آنتیژنهای ارائه شده توسط سلولهای دندریتیک و ماکروفاژها، فرآیند فعالسازی و هدایت پاسخ ایمنی را آغاز میکنند. آنها نه تنها سلولهای آلوده را از بین میبرند بلکه با ترشح سایتوکینها، فعالیت سلولهای B و ماکروفاژها را تنظیم میکنند. سلولهای B با تولید آنتیبادیها و ایجاد حافظه ایمنی، توانایی بدن را در شناسایی و حذف پاتوژنها در مواجهههای بعدی افزایش میدهند. ارتباط پیچیده بین سلولهای T و B و همچنین تعامل آنها با ماکروفاژها و نوتروفیلها، شبکهای پویا و هماهنگ ایجاد میکند که پاسخ ایمنی بدن را بهینه و موثر میسازد.
در سالهای اخیر، پژوهشهای متعددی نشان دادهاند که اختلال در عملکرد هر یک از این سلولها میتواند منجر به بروز بیماریهای خودایمنی، التهابی مزمن و حتی سرطان شود. به عنوان مثال، فعالیت بیش از حد ماکروفاژها و نوتروفیلها میتواند به آسیب بافتی و التهاب مزمن منجر شود، در حالی که نقص عملکرد سلولهای T و B، ایمنی تطبیقی را کاهش داده و بدن را در برابر عفونتها آسیبپذیر میکند. بنابراین، درک دقیق نقش هر یک از این سلولها و تعاملات بین آنها برای توسعه درمانهای هدفمند، واکسنها و داروهای ایمونومدولاتور حیاتی است.
هدف از این مقاله، ارائه یک مرور جامع و بهروز بر روی نقش ماکروفاژ، نوتروفیل، سلولهای T و B در سیستم ایمنی انسان است. این مقاله سعی دارد نه تنها عملکرد هر سلول را به طور کامل توضیح دهد، بلکه تعاملات پیچیده آنها با یکدیگر و تأثیرات این تعاملات در شرایط بیماری و درمان را بررسی کند. با مطالعه این مقاله، متخصصان و علاقهمندان به علوم پزشکی میتوانند دیدگاه جامعی نسبت به سیستم ایمنی بدن پیدا کنند و درک عمیقی از اهمیت هماهنگی بین سلولهای ایمنی برای حفظ سلامت و مقابله با بیماریها کسب کنند.
ماکروفاژها: نگهبانان و تنظیمکنندگان سیستم ایمنی
ماکروفاژها از مهمترین و چندمنظورهترین سلولهای سیستم ایمنی به شمار میآیند که در تمامی بافتهای بدن حضور دارند و نقش حیاتی در حفظ سلامت، هماهنگی پاسخ ایمنی و تنظیم التهاب ایفا میکنند. این سلولها از خط اولیه دفاع ذاتی بدن محسوب میشوند و علاوه بر فعالیتهای ضد میکروبی، به عنوان تنظیمکنندگان کلیدی ارتباط بین ایمنی ذاتی و تطبیقی شناخته میشوند. ماکروفاژها از پیشسازهای منوسیت در مغز استخوان مشتق میشوند و پس از ورود به بافتها، تحت تأثیر محیط میکروبی و سایتوکینها تمایز پیدا کرده و عملکردهای تخصصی خود را بر اساس نیاز بافتی شکل میدهند.
انواع ماکروفاژها و توزیع بافتی
ماکروفاژها به طور کلی به دو دسته اصلی تقسیم میشوند: ماکروفاژهای تاکیدی بافتی (tissue-resident macrophages) و ماکروفاژهای منتقلشده از خون (monocyte-derived macrophages). ماکروفاژهای بافتی، مانند کبدی (Kupffer cells)، ریوی (alveolar macrophages)، مغزی (microglia) و طحالی (splenic macrophages)، نقش ویژهای در حفظ هوموستاز و فیلتر کردن مواد زائد دارند. این سلولها علاوه بر پاکسازی سلولهای مرده و بقایای بافتی، با ترشح سایتوکینهای ضد التهابی و پروالتهابی، فعالیت سایر سلولهای ایمنی را تنظیم میکنند. ماکروفاژهای مشتقشده از منوسیتها، به ویژه در شرایط التهاب یا آسیب بافتی، به محل آسیب مهاجرت کرده و با تمایز به ماکروفاژهای فعال، نقش دفاعی و ترمیمی ایفا میکنند.
مکانیسمهای فعالسازی و عملکرد ضد میکروبی
ماکروفاژها با توانایی شناسایی مولکولهای مرتبط با پاتوژنها (PAMPs) و مولکولهای آسیب بافتی (DAMPs) از طریق گیرندههای اختصاصی مانند TLRها (Toll-like receptors) و NLRها (NOD-like receptors)، فرآیند فعالسازی خود را آغاز میکنند. این فعالسازی منجر به بلع و تخریب میکروبها، ترشح سایتوکینها و شیمیابها، و تولید گونههای فعال اکسیژن و نیتروژن میشود که میتوانند میکروبها و سلولهای آلوده را به طور موثر از بین ببرند. علاوه بر این، ماکروفاژها با فرآیند آنتیژن ارائه دادن (Antigen Presentation) به سلولهای T، پلیمرفیزم ایمنی ذاتی را به پاسخ تخصصی تطبیقی منتقل میکنند.
ماکروفاژها به دو حالت عملکردی شناخته شدهاند: ماکروفاژهای M1 (کلاسیک فعالشده) که پاسخهای پروالتهابی قوی ایجاد میکنند و در مقابله با میکروبها و سلولهای سرطانی مؤثر هستند، و ماکروفاژهای M2 )آزاد شده یا بازسازیکننده( که بیشتر در ترمیم بافت، مهار التهاب و تنظیم پاسخ ایمنی نقش دارند. تعادل بین این دو حالت، نقش حیاتی در جلوگیری از آسیب بافتی و التهاب مزمن ایفا میکند.
نقش ماکروفاژها در بیماریهای التهابی و خودایمنی
اختلال در عملکرد ماکروفاژها میتواند منجر به بیماریهای التهابی مزمن و خودایمنی شود. در بیماریهایی مانند آرتریت روماتوئید، اسکلروز چندگانه و بیماریهای التهابی روده، ماکروفاژها با ترشح بیش از حد سایتوکینهای پروالتهابی مانند TNF-α و IL-1β موجب آسیب بافتی و پیشرفت بیماری میشوند. از سوی دیگر، ماکروفاژهای M2 ناکارآمد ممکن است توانایی مهار التهاب و بازسازی بافت را از دست دهند، که به بروز اختلالات مزمن و تخریب بافتی منجر میشود. پژوهشهای اخیر نشان دادهاند که تنظیم ماکروفاژها به کمک داروهای ایمونومدولاتور یا فناوریهای سلولی میتواند یک رویکرد درمانی مؤثر در کنترل بیماریهای خودایمنی باشد.
تعامل با سلولهای دیگر سیستم ایمنی
یکی از ویژگیهای برجسته ماکروفاژها، توانایی آنها در تعامل با سایر سلولهای ایمنی است. ماکروفاژها با ارائه آنتیژن و ترشح سایتوکینها، سلولهای T را فعال کرده و مسیرهای تمایزی آنها را تنظیم میکنند. همچنین، ماکروفاژها با سلولهای B ارتباط برقرار کرده و میتوانند تولید آنتیبادی و پاسخ ایمنی تطبیقی را تقویت یا مهار کنند. این تعاملات باعث ایجاد شبکهای هماهنگ و پویا در سیستم ایمنی میشود که توانایی بدن را در پاسخ به پاتوژنها و تنظیم التهاب افزایش میدهد.
ماکروفاژها در سرطان و پیری
در زمینه سرطان، ماکروفاژها دو نقش متضاد دارند. ماکروفاژهای ضد تومور (M1) با تخریب سلولهای سرطانی و تقویت پاسخ ایمنی، اثر مهاری بر تومورها دارند، در حالی که ماکروفاژهای تومور-مرتبط (TAMs) میتوانند محیط توموری را سرکوب کنند و رشد و متاستاز سرطان را تسهیل نمایند. به همین دلیل، مطالعه و هدفگیری ماکروفاژها در درمان سرطان، یکی از حوزههای پیشرو در تحقیقات ایمونولوژی و درمانهای هدفمند محسوب میشود.
همچنین، با افزایش سن، عملکرد ماکروفاژها تحت تأثیر تغییرات متابولیک و رادیکالهای آزاد قرار میگیرد. کاهش توانایی بلع و ترشح سایتوکینها در ماکروفاژهای سالمند، منجر به ضعف پاسخ ایمنی، افزایش التهاب مزمن و حساسیت به عفونتها و سرطانها میشود. در نتیجه، ماکروفاژها نه تنها در شرایط طبیعی بلکه در پیری و بیماریهای مرتبط با سن نقش کلیدی دارند و هدفگیری آنها میتواند به بهبود سلامت سالمندان کمک کند.
نتیجهگیری بخش ماکروفاژها
به طور خلاصه، ماکروفاژها نه تنها نگهبانان ذاتی سیستم ایمنی هستند بلکه به عنوان تنظیمکنندگان کلیدی ارتباط بین ایمنی ذاتی و تطبیقی عمل میکنند. عملکرد صحیح ماکروفاژها برای حفظ تعادل ایمنی، کنترل التهاب، پیشگیری از بیماریهای خودایمنی و سرطان و همچنین بازسازی بافت حیاتی است. تعامل پیچیده آنها با سلولهای T و B، شبکهای پویا ایجاد میکند که پاسخ ایمنی را بهینه میسازد و بدن را قادر میسازد در برابر تهدیدهای متنوع محیطی و داخلی واکنش مؤثر نشان دهد.
نوتروفیلها: اولین خط دفاعی و تنظیمکننده ایمنی
نوتروفیلها یکی از حیاتیترین و سریعترین سلولهای دفاعی بدن هستند که به عنوان خط مقدم ایمنی ذاتی عمل میکنند. این سلولها در مغز استخوان تولید میشوند و سپس به جریان خون وارد میشوند تا در مواجهه با عفونتها، آسیب بافتی یا التهاب سریعاً واکنش نشان دهند. نوتروفیلها، با توانایی مهاجرت سریع به محل التهاب، توانایی بلع و تخریب میکروبها، و ایجاد پاسخهای التهابی قوی، نقش کلیدی در حفظ سلامت بدن ایفا میکنند.
ویژگیها و عملکردهای اصلی نوتروفیلها
نوتروفیلها با ویژگیهای منحصربهفرد خود، سیستم ایمنی را در مراحل اولیه مقابله با تهدیدات خارجی هدایت میکنند. این سلولها قادرند به سرعت از جریان خون به بافتهای آلوده مهاجرت کنند و با استفاده از فرآیندهای پیچیدهای مانند فتوتاکسی، دیاپدز و مهاجرت بین سلولی به محل التهاب برسند. پس از رسیدن، نوتروفیلها با فرآیندهای فاگوسیتوز، آزادسازی آنزیمهای هیدرولیتیک و تولید گونههای فعال اکسیژن و نیتروژن ROS) و (RNS میکروبها را از بین میبرند. علاوه بر این، نوتروفیلها میتوانند شبکههای NETs (Neutrophil Extracellular Traps) ایجاد کنند که شامل DNA، پروتئینهای ضد میکروبی و آنزیمها است و با به دام انداختن و خنثی کردن پاتوژنها، توانایی دفاعی بدن را افزایش میدهد.
نوتروفیلها و تنظیم ایمنی تطبیقی
اگرچه نوتروفیلها عمدتاً جزو ایمنی ذاتی محسوب میشوند، تحقیقات اخیر نشان دادهاند که آنها نقش مهمی در تنظیم ایمنی تطبیقی نیز دارند. نوتروفیلها با ترشح سایتوکینها و شیمیابها میتوانند فعالیت سلولهای T و B را تنظیم کنند و پاسخهای تخصصی ایمنی را تقویت یا تعدیل نمایند. برای مثال، نوتروفیلها میتوانند فعالسازی سلولهای B و تولید آنتیبادیها را تحریک کنند یا با ارائه آنتیژن به سلولهای T، مسیرهای تمایزی آنها را هدایت نمایند. این ویژگیها باعث شده است که نوتروفیلها نه تنها در مقابله مستقیم با پاتوژنها، بلکه در هماهنگی و هدایت شبکه ایمنی بدن نیز نقشی حیاتی ایفا کنند.
تعامل نوتروفیلها با سایر سلولهای ایمنی
نوتروفیلها با سلولهای دیگر سیستم ایمنی مانند ماکروفاژها، سلولهای T و سلولهای B در ارتباط نزدیک هستند. این تعاملات شامل ترشح سایتوکینهای پروالتهابی و ضدالتهابی، ارائه آنتیژن و ایجاد شبکههای سیگنالدهی پیچیده است. در برخی شرایط، نوتروفیلها میتوانند با تحریک سلولهای T حافظهای و سلولهای B، پاسخ ایمنی را تقویت کنند و در شرایط دیگر، با مهار فعالیت بیش از حد این سلولها، از آسیب بافتی جلوگیری نمایند. پژوهشها نشان دادهاند که تعادل فعالیت نوتروفیلها در محیطهای التهابی، عامل کلیدی در پیشگیری از بیماریهای خودایمنی و مزمن است.
نوتروفیلها در بیماریهای مزمن التهابی و خودایمنی
در بیماریهای مزمن التهابی مانند آرتریت روماتوئید، بیماری التهابی روده و لوپوس اریتماتوز سیستمیک، فعالیت بیش از حد یا کنترل نشده نوتروفیلها میتواند منجر به آسیب بافتی شود. نوتروفیلها با آزادسازی آنزیمها و مولکولهای پروالتهابی، التهاب پایدار ایجاد میکنند که باعث تخریب مفاصل، بافتها و اندامهای مختلف میشود. از سوی دیگر، نوتروفیلهای ناکارآمد ممکن است توانایی مقابله با عفونتها را از دست دهند و بدن را در برابر میکروبها آسیبپذیر کنند. بنابراین، تنظیم دقیق فعالیت نوتروفیلها یک هدف مهم در درمان بیماریهای التهابی و خودایمنی است.
نوتروفیلها و سرطان
نوتروفیلها نقش دوگانهای در سرطان دارند. نوتروفیلهای ضد تومور میتوانند با تخریب سلولهای سرطانی و تحریک پاسخهای ایمنی، پیشرفت تومور را مهار کنند، در حالی که نوتروفیلهای تومور-مرتبط (Tumor-Associated Neutrophils یا (TANs میتوانند محیط میکروتوموری را حمایت کرده و رشد و متاستاز سرطان را تسهیل کنند. تحقیقات اخیر نشان داده است که هدفگیری نوتروفیلها یا تغییر حالت آنها به فرم ضدتومور میتواند یک رویکرد نوین در درمان سرطان باشد و اثربخشی درمانهای ایمنی را افزایش دهد.
تأثیر نوتروفیلها در پیری و پاسخ به عفونتها
با افزایش سن، عملکرد نوتروفیلها تحت تأثیر تغییرات متابولیک و افزایش استرس اکسیداتیو و رادیکالهای آزاد کاهش مییابد. این کاهش عملکرد، توانایی بدن در مقابله با عفونتها را کاهش داده و زمینه را برای بروز التهاب مزمن و بیماریهای وابسته به سن فراهم میکند. مطالعات نشان دادهاند که تقویت فعالیت نوتروفیلها یا کاهش آسیب ناشی از رادیکالهای آزاد میتواند به بهبود ایمنی سالمندان و کاهش آسیبهای التهابی کمک کند.
نتیجهگیری بخش نوتروفیلها
به طور خلاصه، نوتروفیلها نه تنها خط دفاعی اولیه در مقابل عفونتها و آسیب بافتی هستند بلکه به عنوان تنظیمکنندگان کلیدی پاسخ ایمنی تطبیقی نیز عمل میکنند. توانایی آنها در بلع و تخریب میکروبها، ایجاد شبکههای NET و تعامل با سلولهای T و B، بدن را قادر میسازد تا در برابر طیف وسیعی از تهدیدها واکنش سریع و هماهنگ نشان دهد. درک دقیق نقش نوتروفیلها و مدیریت فعالیت آنها، کلید پیشگیری و درمان بیماریهای التهابی، خودایمنی و سرطان است و فرصتهای درمانی جدیدی را در پزشکی مدرن فراهم میآورد.
سلولهای T فرماندهان پاسخ ایمنی تطبیقی
سلولهای T به عنوان یکی از ستونهای اصلی ایمنی تطبیقی، نقش حیاتی در شناسایی، هدفگیری و حذف پاتوژنها و سلولهای آلوده دارند. این سلولها در مغز استخوان از پیشسازهای لنفوییدی مشتق میشوند و سپس در تیموس تمایز پیدا کرده و انواع مختلف سلولهای T را تشکیل میدهند. تنوع سلولهای T و توانایی آنها در پاسخ تخصصی به آنتیژنها، آنها را به فرماندهان واقعی سیستم ایمنی تبدیل کرده است.
انواع سلولهای T و ویژگیهای عملکردی آنها
سلولهای T به طور کلی به چند دسته اصلی تقسیم میشوند. سلولهای TCD4+ که به عنوان کمککنندهها (Helper T cells) شناخته میشوند، نقش تنظیم و هدایت سایر سلولهای ایمنی را ایفا میکنند. این سلولها با ترشح سایتوکینها مسیرهای تمایزی مختلفی را فعال میکنند و پاسخهای ایمنی مناسب با نوع پاتوژن را شکل میدهند. انواع مختلف سلولهای TCD4+ شامل Th1، Th2، Th17 و Treg هستند که هر کدام نقش خاصی در تنظیم التهاب، دفاع ضد میکروبی و حفظ خودتولیدی ایمنی دارند.
سلولهای TCD8+ یا سیتوتوکسیک مسئول شناسایی و تخریب مستقیم سلولهای آلوده به ویروس یا سلولهای سرطانی هستند. این سلولها با ترشح پروتئینهایی مانند پرفورین و گرانزیمها، سلولهای هدف را از بین میبرند و مانع از تکثیر پاتوژنها یا رشد تومور میشوند. عملکرد سلولهای TCD8+ برای کنترل عفونتهای ویروسی و برخی سرطانها حیاتی است.
سلولهای T تنظیمکننده (Treg) با نقش مهاری خود، از پاسخهای بیش از حد سیستم ایمنی جلوگیری میکنند و مانع آسیب بافتی و بروز بیماریهای خودایمنی میشوند. این سلولها با ترشح IL-10 و TGF-β و همچنین تعامل مستقیم با سلولهای T و B دیگر، تعادل ایمنی را حفظ میکنند و از التهاب مزمن جلوگیری مینمایند.
مکانیزم شناسایی آنتیژن و فعالسازی سلولهای T
فعالسازی سلولهای T مستلزم شناخت آنتیژن توسط گیرندههای TCR است. آنتیژنها توسط سلولهای ارائهدهنده آنتیژن (APCs) مانند ماکروفاژها و سلولهای دندریتیک پردازش شده و بر روی مولکولهای MHC کلاس I یا II ارائه میشوند. سلولهای TCD8+ آنتیژن را روی MHC کلاس I میبینند و سلولهای TCD4+ آنتیژن را روی MHC کلاس II شناسایی میکنند. پس از شناسایی، سلولهای T فعال شده تکثیر میشوند و مسیرهای عملکردی مخصوص به نوع سلول را آغاز میکنند.
فعالسازی سلولهای T با سیگنالهای کوستیمولاتور تقویت میشود و سپس آنها قادر به ترشح سایتوکینها و بیان مولکولهای سطحی مؤثر در هدایت پاسخ ایمنی میشوند. این فرآیند، هماهنگی بین ایمنی ذاتی و تطبیقی را تضمین میکند و بدن را قادر میسازد تا پاسخ هدفمند و متناسب با نوع پاتوژن ایجاد نماید.
تعامل سلولهای T با ماکروفاژها، نوتروفیلها و سلولهای B
سلولهای T با ماکروفاژها و نوتروفیلها ارتباط نزدیک دارند و مسیرهای ایمنی ذاتی را هدایت میکنند. آنها با ترشح سایتوکینها، فعالیت ماکروفاژها را تقویت یا مهار میکنند و پاسخ التهابی را تنظیم میکنند. همچنین، سلولهای TCD4+ با سلولهای B تعامل کرده و تولید آنتیبادیها را تقویت میکنند، که این تعامل برای ایجاد حافظه ایمنی و پاسخهای طولانی مدت علیه پاتوژنها حیاتی است.
سلولهای T در بیماریهای خودایمنی و سرطان
اختلال در عملکرد سلولهای T میتواند منجر به بیماریهای خودایمنی و مزمن شود. فعالیت بیش از حد سلولهای TCD4+ یا نقص عملکرد Treg، پاسخهای التهابی کنترل نشده ایجاد کرده و به تخریب بافتی و آسیب اندامها منجر میشود. در بیماریهایی مانند اماس، آرتریت روماتوئید و لوپوس، سلولهای T نقش مرکزی در پیشرفت بیماری دارند.
در سرطان، سلولهای TCD8+ مسئول شناسایی و تخریب سلولهای سرطانی هستند و میزان نفوذ آنها به تومور، پیشبینیکننده بقا و پاسخ به درمان ایمنی است. همچنین، سلولهای TCD4+ با حمایت از سلولهای B و تقویت پاسخ ایمنی سیتوتوکسیک، اثرات ضد توموری را افزایش میدهند. برهمین اساس، فناوریهای نوین مانند ایمونوتراپی سلولهای T و CAR-T بر پایه توانایی این سلولها طراحی شدهاند تا پاسخ ایمنی ضد تومور را تقویت کنند.
نقش سلولهای T در حافظه ایمنی و واکسیناسیون
یکی از ویژگیهای منحصر به فرد سلولهای T، توانایی ایجاد حافظه ایمنی است. پس از مواجهه با آنتیژن، سلولهای T حافظهای در بدن باقی میمانند و در مواجهههای بعدی پاسخ سریعتر و مؤثرتری ارائه میدهند. این ویژگی پایه علمی واکسیناسیون و ایجاد ایمنی طولانی مدت علیه بیماریها است و نشان میدهد که سلولهای T نه تنها در پاسخ اولیه، بلکه در حفظ سلامت طولانی مدت نیز نقش دارند.
نتیجهگیری بخش سلولهای T
به طور خلاصه، سلولهای T فرماندهان پاسخ ایمنی تطبیقی هستند که با شناسایی آنتیژن، فعالسازی سایر سلولها و هدایت پاسخ ایمنی، سلامت بدن را تضمین میکنند. تعامل آنها با ماکروفاژها، نوتروفیلها و سلولهای B، شبکهای پیچیده و پویا ایجاد میکند که پاسخ ایمنی را بهینه میسازد. درک عملکرد دقیق سلولهای T، کلید توسعه درمانهای هدفمند در بیماریهای خودایمنی، التهاب مزمن و سرطان است و فرصتهای درمانی نوین در پزشکی مدرن را فراهم میآورد.
سلولهای B و تولید آنتیبادیها
سلولهای B به عنوان یکی دیگر از ستونهای اصلی ایمنی تطبیقی، نقش حیاتی در تولید آنتیبادیها و ایجاد حافظه ایمنی ایفا میکنند. این سلولها در مغز استخوان از پیشسازهای لنفوییدی مشتق میشوند و پس از تکامل و تمایز، توانایی شناسایی آنتیژنهای مختلف و تولید آنتیبادیهای اختصاصی را پیدا میکنند. توانایی سلولهای B در تولید آنتیبادی و ایجاد حافظه ایمنی، یکی از اصلیترین مکانیسمهای دفاعی بدن در برابر عفونتها و پاتوژنها است.
تمایز و عملکرد سلولهای B
سلولهای B پس از شناسایی آنتیژن از طریق گیرندههای سطحی خود (BCR)، فعال میشوند و مسیرهای تمایزی متنوعی را طی میکنند. این مسیرها شامل تمایز به پلاسماسلها و تولید آنتیبادیهای اختصاصی، و تشکیل سلولهای B حافظهای است. پلاسماسلها مسئول تولید مقادیر بالای آنتیبادی هستند که میتوانند به صورت مستقیم با پاتوژنها تعامل کنند، آنها را خنثی و از تکثیر آنها جلوگیری کنند. سلولهای B حافظهای، با ماندگاری طولانی در بدن، پاسخ سریع و شدید به مواجهههای مجدد با همان آنتیژن ارائه میدهند، که پایه علمی حافظه ایمنی و واکسیناسیون محسوب میشود.
نقش آنتیبادیها در دفاع ایمنی
آنتیبادیها مولکولهای پروتئینی هستند که به طور اختصاصی به آنتیژنها متصل میشوند و نقشهای متعددی در دفاع ایمنی ایفا میکنند. آنها میتوانند با خنثیسازی مستقیم پاتوژنها، فعالسازی مسیر کمپلمان، و تسهیل فاگوسیتوز توسط ماکروفاژها و نوتروفیلها، پاسخ ایمنی را تقویت کنند. همچنین، آنتیبادیها میتوانند فعالیت سلولهای NK و سلولهای سیتوتوکسیک T را از طریق مکانیسم ADCC (Antibody-Dependent Cellular Cytotoxicity) تحریک کنند، که این امر اهمیت کلیدی سلولهای B را در هماهنگی پاسخ ایمنی نشان میدهد.
تعامل سلولهای B با سلولهای T و نوتروفیلها
سلولهای B علاوه بر فعالیت مستقل، با سلولهای T و نوتروفیلها تعامل دارند و شبکهای پویا در سیستم ایمنی ایجاد میکنند. سلولهای TCD4+ با ترشح سایتوکینها و ارائه آنتیژن، سلولهای B را فعال و تمایز آنها به پلاسماسلها را هدایت میکنند. همچنین، نوتروفیلها میتوانند با ترشح مولکولهای سیگنالدهنده، فعالیت سلولهای B و تولید آنتیبادیها را تقویت کنند. این تعاملات نشاندهنده شبکه پیچیده ارتباط بین ایمنی ذاتی و تطبیقی است که پاسخ ایمنی بدن را بهینه میسازد.
سلولهای B در بیماریهای خودایمنی و عفونتها
اختلال در عملکرد سلولهای B میتواند به بیماریهای خودایمنی، التهاب مزمن و عفونتهای مزمن منجر شود. در بیماریهای خودایمنی مانند لوپوس اریتماتوز سیستمیک، آرتریت روماتوئید و اسکلروز چندگانه، سلولهای B فعالیت بیش از حد داشته و تولید آنتیبادیهای خودیساز را افزایش میدهند، که به تخریب بافتی و التهاب مزمن منجر میشود. در عفونتهای باکتریایی و ویروسی، نقص عملکرد سلولهای B توانایی بدن در تولید آنتیبادیهای اختصاصی را کاهش داده و خطر بروز عفونتهای مزمن و شدید را افزایش میدهد.
کاربردهای درمانی هدفمند سلولهای B
پیشرفتهای علمی در زمینه ایمونولوژی، امکان هدفگیری سلولهای B را برای درمان بیماریهای خودایمنی و برخی اختلالات ایمنی فراهم کرده است. استفاده از آنتیبادیهای ضد CD20 برای کاهش سلولهای B در بیماران مبتلا به آرتریت روماتوئید و برخی لنفومها نمونهای از این رویکرد است. همچنین، داروهایی مانند Ibrutinib با مهار مسیرهای سیگنالدهی سلولهای B، توانستهاند درمانهای هدفمند و مؤثری در بیماریهای بدخیم و خودایمنی ایجاد کنند. این روشها نشان میدهند که درک دقیق عملکرد سلولهای B، کلید توسعه درمانهای نوین و شخصیسازی شده در پزشکی مدرن است.
سلولهای B در ایمنی ضد عفونت و واکسیناسیون
یکی از ویژگیهای برجسته سلولهای B، ایجاد حافظه ایمنی و تولید آنتیبادیهای طولانی مدت است که پایه علمی واکسیناسیون را شکل میدهد. واکسنها با تحریک سلولهای B حافظهای، پاسخ سریع و مؤثر در مواجهههای بعدی با پاتوژنها ایجاد میکنند. این ویژگی باعث میشود که سلولهای B نه تنها در پاسخ اولیه، بلکه در حفظ سلامت طولانی مدت و پیشگیری از بیماریها نیز نقش کلیدی داشته باشند.
نتیجهگیری بخش سلولهای B
به طور خلاصه، سلولهای B و آنتیبادیهای تولیدی آنها یکی از اصلیترین عناصر ایمنی تطبیقی هستند که با شناسایی اختصاصی پاتوژنها، هماهنگی با سلولهای T و نوتروفیلها و ایجاد حافظه ایمنی، بدن را قادر میسازند تا در برابر طیف گستردهای از تهدیدها واکنش مؤثر نشان دهد. فهم عمیق عملکرد سلولهای B، کلید توسعه واکسنهای مؤثر، درمانهای هدفمند و مهندسی پاسخ ایمنی است و نقش حیاتی در بهبود سلامت عمومی و مدیریت بیماریهای مزمن و خودایمنی دارد.
تعامل سلولها در سیستم ایمنی
سیستم ایمنی بدن یک شبکه پیچیده و پویا است که در آن سلولهای مختلف با یکدیگر تعامل میکنند تا پاسخ هماهنگ و مؤثری در برابر تهدیدهای خارجی و داخلی ایجاد شود. این شبکه شامل سلولهای ایمنی ذاتی مانند ماکروفاژها و نوتروفیلها و سلولهای ایمنی تطبیقی مانند سلولهای T و B است. تعامل مؤثر بین این سلولها برای حفظ سلامت بدن، جلوگیری از آسیب بافتی و کنترل التهاب حیاتی است.
ارتباط ماکروفاژها با سایر سلولها
ماکروفاژها به عنوان نگهبانان و تنظیمکنندگان ایمنی، نقش مرکزی در ایجاد ارتباط بین ایمنی ذاتی و تطبیقی دارند. آنها با شناسایی پاتوژنها و سلولهای آلوده، سایتوکینها و شیمیابهای پروالتهابی ترشح میکنند که فعالیت نوتروفیلها و سلولهای T را هدایت میکند. علاوه بر این، ماکروفاژها با ارائه آنتیژن به سلولهای TCD4+ مسیرهای تمایزی آنها را تنظیم کرده و سلولهای TCD8+ را برای مقابله با سلولهای آلوده یا سرطانی آماده میکنند. همچنین، ماکروفاژها با سلولهای B تعامل دارند و تولید آنتیبادی و پاسخ ایمنی تطبیقی را تقویت میکنند. این تعاملات باعث میشوند که ماکروفاژها نه تنها دفاع اولیه بلکه تنظیم طولانی مدت ایمنی را برعهده داشته باشند.
تعامل نوتروفیلها با سلولهای T و B
نوتروفیلها علاوه بر نقش خود به عنوان خط دفاعی اولیه، توانایی تنظیم پاسخ ایمنی تطبیقی را نیز دارند. آنها با ترشح سایتوکینها و فاکتورهای رشد، فعالیت سلولهای TCD4+ و سلولهای B را هدایت میکنند. نوتروفیلها میتوانند تولید آنتیبادیها توسط سلولهای B را افزایش دهند و پاسخهای Th1 و Th17 سلولهای T را تقویت کنند. از سوی دیگر، در شرایط التهاب مزمن، نوتروفیلها با فعالیت بیش از حد، میتوانند باعث آسیب بافتی شوند، که نشاندهنده اهمیت تنظیم دقیق فعالیت آنها در تعامل با سایر سلولها است.
همکاری سلولهای T و B
سلولهای T و B یک تعامل دوطرفه پیچیده دارند که برای پاسخ ایمنی تطبیقی ضروری است. سلولهای TCD4+ با ارائه کمک (Helper function) و ترشح سایتوکینها، سلولهای B را فعال کرده و تمایز آنها به پلاسماسلها و سلولهای حافظهای را هدایت میکنند. این فرآیند باعث تولید آنتیبادیهای اختصاصی و ایجاد حافظه ایمنی طولانی مدت میشود. همچنین، سلولهای B میتوانند با ارائه آنتیژن به سلولهای T و ترشح سایتوکینها، فعالیت آنها را تقویت کنند و شبکهای هماهنگ در پاسخ ایمنی ایجاد نمایند.
نقش تعاملات سلولی در بیماریها
اختلال در تعامل سلولهای ایمنی میتواند به بیماریهای خودایمنی، التهاب مزمن و اختلالات ایمنی پیچیده منجر شود. برای مثال، عدم تعادل بین سلولهای T و B در لوپوس یا فعالیت بیش از حد نوتروفیلها در آرتریت روماتوئید، موجب التهاب پایدار و آسیب بافتی میشود. از سوی دیگر، ضعف تعامل بین ماکروفاژها و سلولهای TCD8+ میتواند پاسخ ایمنی ضد ویروس یا ضد تومور را مختل کند. بنابراین، هماهنگی و تعامل دقیق سلولها برای حفظ تعادل ایمنی اهمیت حیاتی دارد.
مکانیسمهای مولکولی تعامل سلولها
تعامل سلولهای ایمنی از طریق سیگنالهای مستقیم سلول-به-سلول و ترشح مولکولهای محلول مانند سایتوکینها و شیمیابها انجام میشود. گیرندههای سطحی مانند CD40/CD40L و مسیرهای سیگنالدهی مانند NF-κB و JAK-STAT در انتقال سیگنالها و هدایت عملکرد سلولها نقش کلیدی دارند. این مکانیسمها باعث میشوند که سلولها قادر باشند به سرعت و با دقت به تغییرات محیطی پاسخ دهند و پاسخ ایمنی هماهنگ و مؤثری ارائه نمایند.
تعاملات سلولی در سرطان و عفونت
در محیط توموری، تعامل سلولهای ایمنی تعیینکننده پیشرفت سرطان و پاسخ به درمان است. سلولهای TCD8+ و نوتروفیلها با همکاری ماکروفاژها میتوانند سلولهای سرطانی را از بین ببرند، اما فعالیت سلولهای تومور-مرتبط TAMs) و( TANs ممکن است این پاسخ را سرکوب کند. همچنین، در عفونتهای مزمن، تعامل نامناسب سلولها میتواند باعث آسیب بافتی و عدم پاکسازی کامل پاتوژنها شود، که اهمیت تنظیم دقیق تعاملات سلولی را نشان میدهد.
نتیجهگیری بخش تعامل سلولها
به طور خلاصه، تعامل سلولهای ایمنی یک شبکه هماهنگ و پویا ایجاد میکند که پاسخ به پاتوژنها، حفظ هوموستاز و کنترل التهاب را ممکن میسازد. ماکروفاژها، نوتروفیلها، سلولهای T و B با ارتباط دوطرفه و تبادل سیگنالها، نقش یکدیگر را تقویت یا تعدیل میکنند و بدن را قادر میسازند تا پاسخ ایمنی مؤثر و متناسب با شرایط ایجاد نماید. درک دقیق این تعاملات، کلید توسعه درمانهای نوین برای بیماریهای التهابی، خودایمنی، عفونتها و سرطان است و فرصتهای بینظیری برای پزشکی شخصیسازی شده فراهم میآورد.
نقش سلولهای ایمنی در بیماریهای خاص
سلولهای ایمنی، شامل ماکروفاژها، نوتروفیلها، سلولهای T و سلولهای B، نقش محوری در ایجاد، پیشرفت و کنترل انواع بیماریها دارند. در بسیاری از شرایط پاتولوژیک، عملکرد بیش از حد یا ناکارآمد این سلولها میتواند موجب التهاب مزمن، آسیب بافتی، اختلالات خودایمنی و یا حتی رشد تومور شود. درک دقیق نقش سلولهای ایمنی در بیماریهای خاص، امکان طراحی درمانهای هدفمند و پیشبینی نتایج بالینی را فراهم میکند.
نقش سلولهای ایمنی در بیماریهای خودایمنی
در بیماریهای خودایمنی مانند لوپوس اریتماتوز سیستمیک، آرتریت روماتوئید و اسکلروز چندگانه، سیستم ایمنی بدن به سلولها و بافتهای خود حمله میکند. ماکروفاژها و نوتروفیلها با ترشح سایتوکینها و آنزیمهای التهابی، التهاب شدید ایجاد کرده و تخریب بافتها را افزایش میدهند. سلولهای TCD4+ بیش از حد فعال، سلولهای B را تحریک میکنند تا آنتیبادیهای خودیساز تولید کنند و چرخهای از التهاب و آسیب بافتی را ایجاد نمایند. Tregها که معمولاً نقش مهاری دارند، در این شرایط ناکارآمد هستند و نمیتوانند پاسخ التهابی را کنترل کنند. این بیتعادلی نشاندهنده اهمیت هماهنگی بین سلولهای ایمنی در حفظ سلامت بدن است.
نقش سلولهای ایمنی در بیماریهای التهابی مزمن
در بیماریهای التهابی مزمن مانند بیماری التهابی روده، آسم و بیماریهای ریوی مزمن، نوتروفیلها و ماکروفاژها به صورت پایدار فعال هستند و باعث التهاب طولانی مدت میشوند. نوتروفیلها با آزادسازی ROS، RNS و NETs، آسیب بافتی ایجاد میکنند، در حالی که ماکروفاژها با ترشح سایتوکینهای پروالتهابی و پروتئازها، التهاب را تشدید میکنند. تعامل این سلولها با سلولهای T و B باعث تقویت پاسخهای التهابی میشود و شرایط مزمن را پایدار میسازد. درمان این بیماریها اغلب شامل مهار فعالیت سلولهای ایمنی یا تعدیل پاسخهای التهابی است تا از آسیب بیشتر جلوگیری شود.
سلولهای ایمنی در عفونتهای مزمن و حاد
در مواجهه با عفونتهای باکتریایی، ویروسی و قارچی، سلولهای ایمنی نقشهای مکمل دارند. نوتروفیلها و ماکروفاژها اولین خط دفاعی را تشکیل میدهند و با بلع، تخریب و ترشح مولکولهای ضد میکروبی، عفونت را کنترل میکنند. سلولهای TCD8+ با شناسایی سلولهای آلوده، آنها را از بین میبرند و سلولهای TCD4+ و B پاسخ تطبیقی را هدایت میکنند. در عفونتهای مزمن، اختلال در این تعاملات میتواند باعث عدم پاکسازی کامل پاتوژنها، التهاب طولانی مدت و تخریب بافتی شود. مثالهای بارز شامل سل، HIV و هپاتیت مزمن هستند که در آنها عملکرد سلولهای ایمنی ناکارآمد یا بیش از حد باعث پیشرفت بیماری میشود.
نقش سلولهای ایمنی در سرطان
در سرطان، سلولهای ایمنی نقش دوگانه دارند. سلولهای TCD8+ و نوتروفیلهای ضد تومور میتوانند سلولهای سرطانی را شناسایی و تخریب کنند، اما سلولهای تومور-مرتبط TAMs) و (TANs با سرکوب پاسخ ایمنی و حمایت از رشد تومور، میتوانند پیشرفت سرطان را تسهیل کنند. سلولهای B نیز با تولید آنتیبادیهای خاص و تعامل با سلولهای T، میتوانند اثرات ضد توموری ایجاد کنند. موفقیت درمانهای نوین مانند ایمونوتراپی و CAR-T به توانایی هدایت و تقویت این تعاملات سلولی بستگی دارد.
سلولهای ایمنی در بیماریهای عصبی و نورودژنراتیو
تحقیقات اخیر نشان داده است که سلولهای ایمنی، به ویژه ماکروفاژها و سلولهای T، نقش کلیدی در بیماریهای عصبی و نورودژنراتیو دارند. در بیماریهایی مانند مولتیپل اسکلروزیس و بیماری آلزایمر، ورود سلولهای ایمنی به CNS باعث التهاب و آسیب عصبی میشود. سلولهای TCD4+ میتوانند التهاب مزمن ایجاد کنند، در حالی که میکروگلیاها و ماکروفاژهای CNS به تسریع تخریب نورونها کمک میکنند. از سوی دیگر، برخی سلولهای ایمنی میتوانند با ترشح فاکتورهای ضد التهابی و حمایت از بازسازی بافت، نقش محافظتی داشته باشند. این نشان میدهد که تعادل بین فعالیت پروالتهابی و ضدالتهابی سلولهای ایمنی در سلامت سیستم عصبی حیاتی است.
نقش سلولهای ایمنی در بیماریهای متابولیک
در بیماریهای متابولیک مانند دیابت نوع 2 و چاقی، سلولهای ایمنی به ویژه ماکروفاژهای بافت چربی و نوتروفیلها، با ترشح سایتوکینهای التهابی و اختلال در سیگنالینگ انسولین، نقش مهمی در ایجاد مقاومت به انسولین و التهاب مزمن ایفا میکنند. سلولهای B نیز با تولید آنتیبادیها و تعامل با سلولهای T، پاسخ التهابی را تقویت میکنند. بنابراین، سلولهای ایمنی نه تنها در ایمنی کلاسیک بلکه در تنظیم متابولیسم و ایجاد بیماریهای مرتبط با سبک زندگی نیز نقش دارند.
نتیجهگیری بخش نقش سلولهای ایمنی در بیماریهای خاص
به طور خلاصه، سلولهای ایمنی در بیماریهای مختلف نقشهای چندگانه دارند و عملکرد بیش از حد یا ناکارآمد آنها میتواند به التهاب مزمن، آسیب بافتی، بیماریهای خودایمنی، عفونتهای مزمن، سرطان و اختلالات عصبی و متابولیک منجر شود. درک دقیق نقش و تعامل این سلولها در بیماریهای خاص، کلید توسعه درمانهای هدفمند، پیشبینی پاسخ بالینی و مدیریت بیماریهای پیچیده است. این دانش، پایه علمی پزشکی نوین و شخصیسازی درمانها را فراهم میکند و امکان پیشگیری و بهبود سلامت عمومی را ارتقا میدهد.
چالشها و چشمانداز آینده
با وجود پیشرفتهای شگرف در درک عملکرد سلولهای ایمنی و نقش آنها در حفظ سلامت و مقابله با بیماریها، هنوز چالشها و پرسشهای مهمی در مسیر تحقیقات و کاربردهای بالینی وجود دارد. درک عمیق این چالشها و بررسی چشمانداز آینده، مسیر توسعه درمانهای نوین و بهبود سلامت جامعه را هموار میکند.
چالشهای موجود در مطالعه سلولهای ایمنی
یکی از مهمترین چالشها، پیچیدگی شبکههای سلولی و تعاملات آنها است. سلولهای ماکروفاژ، نوتروفیل، T و B با یکدیگر و با محیط اطراف خود ارتباط متقابل دارند، و تغییر در عملکرد یک سلول میتواند به صورت غیرمستقیم عملکرد سایر سلولها را نیز تحت تأثیر قرار دهد. این پیچیدگی، مدلسازی و پیشبینی پاسخهای ایمنی را دشوار میکند.
چالش دیگر، تفاوتهای فردی و محیطی در پاسخ ایمنی است. فاکتورهای ژنتیکی، سن، جنسیت، وضعیت متابولیک، وجود بیماریهای مزمن و حتی سبک زندگی، میتوانند پاسخ ایمنی را تغییر دهند. به عنوان مثال، عملکرد سلولهای T و B در افراد مسن یا بیماران مبتلا به دیابت تفاوت چشمگیری با افراد سالم و جوان دارد. این تغییرات نیازمند رویکردهای شخصیسازی شده در درمان و واکسیناسیون است.
محدودیتهای تکنیکی و روششناسی نیز چالش مهم دیگری است. هرچند روشهای پیشرفته مانند فلوسایتومتری، سیتومیکس، RNA-seq تکسلولی و تصویربرداری پیشرفته، اطلاعات دقیق و ارزشمندی ارائه میدهند، اما تجزیه و تحلیل حجم بالای دادهها و تفسیر نتایج پیچیده، نیازمند دانش تخصصی و ابزارهای پیشرفته است. علاوه بر این، ایجاد مدلهای حیوانی که دقیقاً بازتابدهنده پاسخ ایمنی انسان باشند، هنوز با محدودیتهایی همراه است.
چالش در درمانهای هدفمند و ایمونوتراپی
در زمینه درمانهای هدفمند، مانند ایمونوتراپی سرطان، مهار سلولهای B در بیماریهای خودایمنی و تنظیم فعالیت نوتروفیلها و ماکروفاژها، چالش اصلی، تنظیم دقیق فعالیت سلولهای ایمنی بدون ایجاد اثرات جانبی یا سرکوب بیش از حد سیستم ایمنی است. برای مثال، استفاده از آنتیبادیهای ضد CD20 ممکن است پاسخ ایمنی را در برابر عفونتها کاهش دهد، و ایمونوتراپی CAR-T میتواند موجب واکنشهای التهابی شدید و سندرم آزادسازی سایتوکین شود. این واقعیتها نشان میدهند که هر گونه مداخله باید با دقت و تحت پایش دقیق انجام شود.
چشمانداز آینده تحقیقات سلولهای ایمنی
با توجه به پیشرفتهای علمی و فناوری، چشمانداز آینده تحقیقات سلولهای ایمنی بسیار روشن و امیدوارکننده است. یکی از محورهای اصلی، ایمنی شخصیسازی شده (Personalized Immunity) است که در آن، ویژگیهای ژنتیکی، محیطی و بالینی هر فرد برای طراحی درمانها و واکسنهای اختصاصی مورد استفاده قرار میگیرد. این رویکرد میتواند اثرات جانبی درمانها را کاهش دهد و پاسخ ایمنی بهینه ایجاد کند.
استفاده از هوش مصنوعی و یادگیری ماشین برای تحلیل دادههای پیچیده ایمنی و پیشبینی پاسخ سلولها، یک چشمانداز مهم است. این فناوریها میتوانند با مدلسازی تعاملات سلولی و شناسایی الگوهای نهفته، راهنمای طراحی درمانها و پیشبینی پیشرفت بیماری باشند.
تحقیقات در زمینه تغییرات سلولهای ایمنی با سن، متابولیسم و محیط میکروبی نیز نقش کلیدی در پیشگیری و درمان بیماریهای مزمن دارد. درک نحوه تأثیر محیط و سبک زندگی بر عملکرد ماکروفاژها، نوتروفیلها، سلولهای T و B میتواند راهنمای بهبود سلامت جمعیت و کاهش بروز بیماریها باشد.
چشمانداز نوین ایمونوتراپی و دارورسانی هدفمند
در آینده نزدیک، توسعه داروها و واکسنهایی که به صورت هدفمند سلولهای خاص ایمنی را فعال یا مهار میکنند، امکانپذیر خواهد شد. استفاده از نانوذرات، مهندسی ژنتیک و ویرایش ژنوم سلولهای ایمنی، فرصتهای بینظیری برای کنترل دقیق پاسخ ایمنی فراهم میآورد. این رویکردها میتوانند بیماریهای خودایمنی، سرطان، عفونتهای مزمن و حتی اختلالات متابولیک را با دقت و کارایی بالاتر درمان کنند.
نتیجهگیری بخش چالشها و چشمانداز آینده
به طور خلاصه، با وجود چالشهای متعدد در درک و کنترل عملکرد سلولهای ایمنی، آینده تحقیقات و کاربردهای بالینی بسیار امیدوارکننده است. پیچیدگی شبکههای سلولی، تفاوتهای فردی و محدودیتهای تکنیکی، چالشهای اساسی محسوب میشوند، اما پیشرفتهای فناوری، هوش مصنوعی، ایمونوتراپی و دارورسانی هدفمند، مسیر توسعه درمانهای نوین و شخصیسازی شده را هموار میکند. نگاه به آینده نشان میدهد که با درک عمیقتر تعاملات سلولهای ایمنی و طراحی راهبردهای هدفمند، میتوان سلامت عمومی را بهبود بخشید و مدیریت بیماریهای مزمن، خودایمنی و سرطان را به سطحی بیسابقه ارتقا داد.
جمعبندی و نتیجهگیری
مطالعه و بررسی سلولهای ایمنی، شامل ماکروفاژها، نوتروفیلها، سلولهای T و سلولهای B، نشان میدهد که این سلولها نه تنها در دفاع اولیه و پاسخ ایمنی تطبیقی نقش دارند، بلکه در حفظ هوموستاز، کنترل التهاب و ایجاد حافظه ایمنی نیز اهمیت ویژهای دارند. هر یک از این سلولها عملکرد خاص و مکمل یکدیگر دارند و تعامل میان آنها، کلید ایجاد پاسخ ایمنی هماهنگ و مؤثر است.
ماکروفاژها به عنوان نگهبانان سیستم ایمنی، علاوه بر حذف پاتوژنها و سلولهای مرده، با ترشح سایتوکینها و ارائه آنتیژن، نقش تنظیمکننده و هدایتکننده فعالیت سایر سلولها را بر عهده دارند. آنها پل ارتباطی بین ایمنی ذاتی و تطبیقی هستند و توانایی تعدیل پاسخهای التهابی را دارا میباشند.
نوتروفیلها، خط مقدم دفاع ایمنی، با فعالیت فاگوسیتوزی و آزادسازی مولکولهای ضد میکروبی، مقابله سریع با تهدیدهای خارجی را ممکن میسازند. علاوه بر این، نوتروفیلها توانایی تنظیم فعالیت سلولهای T و B و مشارکت در ایجاد پاسخ ایمنی تطبیقی را دارند. این دو نقش، اهمیت آنها را در کنترل عفونت و التهاب مزمن به وضوح نشان میدهد.
سلولهای T با تقسیمبندی به انواع CD4+ و CD8+، فرماندهی پاسخ تطبیقی را به عهده دارند. سلولهای TCD4+ با ترشح سایتوکینها و کمک به سلولهای B، تولید آنتیبادیهای اختصاصی و ایجاد حافظه ایمنی را تضمین میکنند. سلولهای TCD8+ با شناسایی سلولهای آلوده یا سرطانی، آنها را تخریب میکنند و کنترل عفونتهای ویروسی و رشد تومور را بر عهده دارند.
سلولهای B نیز با تولید آنتیبادیها و ایجاد سلولهای حافظهای، دفاع تطبیقی را تقویت میکنند. تعامل آنها با سلولهای T و نوتروفیلها، پاسخ ایمنی را بهینه میسازد و امکان واکسیناسیون و ایجاد حافظه ایمنی طولانیمدت را فراهم میآورد.
تعاملات میان سلولهای ایمنی، محور اصلی هماهنگی پاسخ ایمنی است. ماکروفاژها، نوتروفیلها، سلولهای T و B با شبکهای از ارتباطات مستقیم و غیرمستقیم، فعالیت یکدیگر را هدایت و تعدیل میکنند. این تعاملات نه تنها در شرایط سلامت بلکه در بیماریهای خاص، از جمله بیماریهای خودایمنی، عفونتهای مزمن، سرطان، اختلالات عصبی و بیماریهای متابولیک، تعیینکننده پیشرفت یا کنترل بیماری هستند.
با این حال، چالشهای متعددی در مسیر تحقیقات و کاربردهای بالینی وجود دارد. پیچیدگی شبکههای سلولی، تفاوتهای فردی و محیطی، محدودیتهای تکنیکی و خطرات مرتبط با درمانهای هدفمند، از جمله مشکلاتی هستند که نیازمند رویکردهای دقیق و شخصیسازی شدهاند. پیشرفتهای فناوری، هوش مصنوعی، ایمونوتراپی و دارورسانی هدفمند، اما افق روشنی برای غلبه بر این چالشها ایجاد کردهاند و امکان توسعه درمانهای نوین و کارآمد را فراهم میکنند.
چشمانداز آینده بر پایه درک عمیقتر تعاملات سلولی، طراحی درمانهای هدفمند، توسعه واکسنهای اختصاصی و تنظیم دقیق پاسخهای ایمنی استوار است. این رویکردها میتوانند سلامت عمومی را بهبود بخشند، پیشگیری از بیماریهای مزمن و خودایمنی را ممکن سازند و درمانهای فردمحور و شخصیسازی شده را به واقعیت نزدیک کنند.
در نهایت، جمعبندی کلی نشان میدهد که سلولهای ایمنی نه تنها حافظ سلامت و کنترل بیماریها هستند، بلکه کلید توسعه پزشکی مدرن، واکسیناسیون هوشمند و درمانهای نوین ایمونولوژیک محسوب میشوند. شناخت دقیق عملکرد، تعاملات و نقش این سلولها، افق تازهای در تحقیقات بیولوژیک و بالینی گشوده و مسیر پیشگیری و درمان بیماریها را بهبود میبخشد.