سطح ایمنی بیولوژیکی (BSL1 تا BSL4) چیست؟
مقدمه
ایمنی زیستی یکی از مهمترین ارکان علوم زیستپزشکی و بهداشت عمومی است که در دهههای اخیر، اهمیت آن بیش از پیش در سطح جهانی مورد توجه قرار گرفته است. در دنیایی که بیماریهای عفونی نوپدید و بازپدید با سرعتی بیسابقه در حال گسترشاند و پاندمیهایی همچون کووید-19 چالشهای عمیقی را بر سیستمهای سلامت، اقتصاد و زندگی اجتماعی تحمیل کردهاند، موضوع ایمنی زیستی دیگر یک دغدغه صرفاً تخصصی در محیطهای آزمایشگاهی نیست، بلکه به یک ضرورت حیاتی برای حفاظت از سلامت عمومی و امنیت جهانی تبدیل شده است.
سطوح ایمنی بیولوژیکی یا همان Biosafety Levels (BSL) بهعنوان چارچوبی نظاممند و استاندارد برای مدیریت و کنترل خطرات زیستی طراحی شدهاند. این سطوح بر اساس شدت خطر عوامل میکروبی و بیماریزایی آنها، نوع فعالیتهای آزمایشگاهی و میزان احتمال انتقال بیماری به کارکنان یا جامعه تعیین میشوند. در واقع، این نظام طبقهبندی، پلی است میان دانش زیستشناسی و فناوریهای پیشرفته از یک سو، و اصول ایمنی و سلامت حرفهای از سوی دیگر. هدف اصلی این استانداردها، ایجاد توازنی است میان امکان انجام تحقیقات علمی پیشرفته و حفظ امنیت کارکنان، جامعه و محیطزیست.
آنچه اهمیت سطوح ایمنی بیولوژیکی را دوچندان میکند، ماهیت پیچیده و غیرقابل پیشبینی پاتوژنهایی است که در محیطهای آزمایشگاهی با آنها سروکار داریم. میکروارگانیسمها نهتنها از نظر شدت بیماریزایی تفاوت دارند، بلکه ممکن است تحت شرایط خاص دچار جهش یا تغییر رفتار شوند. به همین دلیل، وجود یک نظام چندسطحی برای کنترل و مدیریت این عوامل، تضمینکننده کاهش ریسک و پیشگیری از حوادث ناخواسته مانند عفونتهای آزمایشگاهی یا نشتهای زیستی است.
بررسی تاریخی نشان میدهد که ایجاد مفهوم BSL، واکنشی مستقیم به حوادث ناخواسته و اپیدمیهای گسترده بوده است. از جمله، در دهه ۱۹۷۰ و ۱۹۸۰ میلادی، افزایش تحقیقات روی ویروسهای خطرناک مانند ابولا و ماربورگ، توجه جامعه علمی را به ضرورت ایجاد زیرساختهای فوق ایمن جلب کرد. به تدریج، سازمانهای بینالمللی همچون سازمان جهانی بهداشت (WHO)، مراکز کنترل و پیشگیری بیماریها (CDC) در آمریکا و دیگر نهادهای نظارتی، اقدام به طراحی دستورالعملها و استانداردهای دقیق کردند تا هر کشور بتواند بر اساس آن، آزمایشگاههای خود را مدیریت و تجهیز نماید.
از سوی دیگر، توجه به ایمنی زیستی تنها محدود به کشورهای توسعهیافته نیست. در کشورهای در حال توسعه نیز، به دلیل شیوع بالای بیماریهای عفونی و کمبود منابع، موضوع بایوسکیوریتی و ارتقای استانداردهای ایمنی آزمایشگاهی به یک اولویت استراتژیک تبدیل شده است. زیرا هرگونه ضعف در این حوزه میتواند به بروز بحرانهای بهداشت عمومی و حتی تهدیدهای فرامرزی منجر شود.
آنچه این موضوع را جذابتر و در عین حال حساستر میکند، ارتباط تنگاتنگ آن با مسائل اخلاقی و امنیتی است. انجام تحقیقات موسوم به Gain-of-Function (GOF) که در آنها میکروارگانیسمها بهطور مصنوعی تغییر داده میشوند تا قدرت بیماریزایی یا انتقالپذیری بیشتری پیدا کنند، نمونهای از چالشهای اخلاقی و ایمنی در حوزه BSL است. چنین فعالیتهایی نیازمند آزمایشگاههای سطح بالای ایمنی و نظارتهای بسیار سختگیرانه هستند؛ چرا که کوچکترین خطا میتواند پیامدهایی غیرقابل کنترل برای بشریت داشته باشد.
بنابراین، درک دقیق از سطوح ایمنی بیولوژیکی نه تنها برای کارکنان آزمایشگاهها، پژوهشگران و پزشکان، بلکه برای سیاستگذاران، مسئولان بهداشت عمومی و حتی افکار عمومی حائز اهمیت است. چرا که شناخت و پایبندی به این استانداردها بهطور مستقیم با جلوگیری از اپیدمیهای جهانی، حفاظت از محیطزیست و توسعه پایدار ارتباط دارد.
این مقاله با هدف ارائه یک مرور جامع بر سطوح ایمنی بیولوژیکی، به بررسی همه ابعاد این موضوع از جمله مبانی نظری، ویژگیهای فنی هر سطح، تجهیزات و زیرساختهای مورد نیاز، آموزش پرسنل، مقایسه استانداردهای بینالمللی و چالشهای آینده میپردازد. تلاش شده است تا مطالب به گونهای ارائه شود که هم برای متخصصان حوزه زیستپزشکی و هم برای علاقهمندان عمومی به حوزه سلامت، قابل درک و کاربردی باشد.
در ادامه، ابتدا به بیان مفاهیم پایه و تفاوتهای کلیدی بین ایمنی زیستی و ایمنی زیستامنیتی پرداخته میشود تا چارچوب ذهنی لازم برای درک بهتر سطوح ایمنی بیولوژیکی فراهم گردد. سپس به معرفی هر یک از سطوح BSL (از یک تا چهار) پرداخته و با ذکر مثالهای واقعی، شرایط مورد نیاز و اهمیت آنها در دنیای امروز مورد تحلیل قرار خواهد گرفت. همچنین در بخشهای پایانی مقاله، به چالشها، رویکردهای جهانی و آیندهپژوهی در زمینه ایمنی زیستی پرداخته میشود.
به طور کلی، مقدمه حاضر تأکید میکند که شناخت BSLها تنها یک بحث آکادمیک یا فنی نیست، بلکه موضوعی حیاتی برای بقای جامعه انسانی در برابر تهدیدات میکروبی و زیستی به شمار میرود؛ موضوعی که در عصر حاضر بیش از هر زمان دیگری نیازمند توجه و سرمایهگذاری است.
مفاهیم پایه
برای درک درست سطوح ایمنی بیولوژیکی، ابتدا لازم است که به برخی مفاهیم بنیادین پرداخته شود. این مفاهیم چارچوبی نظری ایجاد میکنند که به ما کمک میکند تا منطق پشت طبقهبندی BSL را بهتر درک کنیم و تفاوتهای کلیدی بین ایمنی زیستی، ایمنی زیستامنیتی و گروههای ریسک را بهروشنی بشناسیم. بدون این پیشزمینه، توضیح در مورد الزامات هر سطح ایمنی صرفاً به فهرستی از تجهیزات و دستورالعملها محدود خواهد شد و ارتباط عمیق آن با سلامت عمومی، مدیریت خطر و توسعه پایدار روشن نمیشود.
نخست باید به تفاوت میان دو اصطلاح پرکاربرد در این حوزه توجه داشت: ایمنی زیستی (Biosafety) و ایمنی زیستامنیتی (Biosecurity). اگرچه این دو واژه گاهی به اشتباه به جای یکدیگر استفاده میشوند، اما در واقع بیانگر دو مفهوم متفاوت و مکمل هستند. ایمنی زیستی بیشتر بر روی اقدامات، تجهیزات و شیوههای کاری تمرکز دارد که با هدف پیشگیری از تماس ناخواسته کارکنان با عوامل بیولوژیکی خطرناک و جلوگیری از انتشار آنها به محیط طراحی میشوند. به بیان ساده، ایمنی زیستی یعنی کاهش احتمال بروز حادثه و کنترل عوامل در محیط آزمایشگاه. در مقابل، ایمنی زیستامنیتی معطوف به حفاظت از این عوامل در برابر سوءاستفاده عمدی، سرقت یا دسترسی غیرمجاز است. بنابراین میتوان گفت ایمنی زیستی بیشتر به جنبههای فنی و بهداشتی پرداخته و ایمنی زیستامنیتی به جنبههای حفاظتی و امنیتی.
در همین چارچوب، مفهوم دیگری که اهمیت بالایی دارد، گروههای ریسک (Risk Groups) است. سازمان جهانی بهداشت و دیگر نهادهای بینالمللی، میکروارگانیسمها را بر اساس خطر بالقوهای که برای انسان، حیوانات و محیطزیست ایجاد میکنند، در چهار گروه ریسک طبقهبندی کردهاند. این گروهها از سطح یک که شامل عوامل تقریباً بیخطر مانند بسیاری از باکتریهای محیطی است آغاز میشود و تا سطح چهار که شامل ویروسهای فوقالعاده خطرناک و بدون درمان مؤثر نظیر ابولا یا ماربورگ است ادامه مییابد. ارتباطی مستقیم بین گروههای ریسک و سطوح ایمنی بیولوژیکی وجود دارد، اما باید توجه داشت که این دو مفهوم کاملاً همپوشان نیستند. به طور مثال، یک عامل بیماریزا ممکن است بر اساس ویژگیهای خاص خود در گروه ریسک سه قرار گیرد، اما بسته به شرایط تحقیقاتی و میزان دسترسی به تجهیزات، بتوان در سطح ایمنی دو یا سه با آن کار کرد.
عامل دیگری که باید در مفاهیم پایه مورد توجه قرار گیرد، کنترل منبع خطر (Containment) است. کنترل منبع خطر به مجموعه اقداماتی گفته میشود که مانع خروج عوامل بیولوژیکی از محیط آزمایشگاهی به محیط بیرونی میشوند. این کنترل میتواند به صورت کنترل اولیه شامل استفاده از کابینتهای ایمنی بیولوژیکی، هودها، دستکش و روپوش باشد یا به صورت کنترل ثانویه که به طراحی فضا، سیستم تهویه، فشار منفی اتاقها و تجهیزات زیرساختی برمیگردد. هر چه سطح BSL بالاتر باشد، نیاز به کنترلهای ثانویه پیچیدهتر و پرهزینهتر خواهد بود.
در ادامه باید به مفهوم خطر زیستی یا Biohazard پرداخت. خطر زیستی در واقع هر منبع بیولوژیکی است که میتواند به انسان، حیوان یا محیط آسیب برساند. این خطر ممکن است ناشی از یک باکتری، ویروس، قارچ، انگل یا حتی یک محصول بیولوژیکی نوترکیب باشد. شناخت و شناسایی دقیق خطرات زیستی، اولین گام در طراحی هرگونه استراتژی ایمنی محسوب میشود. به همین دلیل، ارزیابی خطر یا Biorisk Assessment یکی از ارکان اصلی در مدیریت آزمایشگاهها به شمار میآید. این ارزیابی نه تنها میزان خطر عامل را بررسی میکند، بلکه به شرایط محیطی، سطح مهارت کارکنان و میزان دسترسی به تجهیزات حفاظتی نیز توجه دارد.
یکی دیگر از مفاهیم کلیدی، فرهنگ ایمنی (Safety Culture) است. وجود تجهیزات پیشرفته و دستورالعملهای مدون بدون پذیرش فرهنگ ایمنی در میان کارکنان عملاً ناکارآمد خواهد بود. فرهنگ ایمنی یعنی پذیرش مسئولیت فردی و جمعی برای حفاظت از خود و دیگران، پایبندی به اصول کاری و گزارش هرگونه حادثه یا خطای احتمالی بدون ترس از مجازات. بسیاری از حوادث آزمایشگاهی ناشی از نقص در فرهنگ ایمنی و بیتوجهی کارکنان به جزئیات بوده است، نه لزوماً نقص در زیرساختها.
از دیدگاه علمی، درک رابطه بین گروه ریسک، سطح ایمنی و پروتکلهای کاری اهمیت زیادی دارد. برای مثال، وقتی یک عامل در گروه ریسک دو طبقهبندی میشود، لزوماً به معنای نیاز به سطح ایمنی دو نیست؛ بلکه بسته به نوع فعالیت، ممکن است کار در سطح یک یا دو کافی باشد. این انعطافپذیری نشان میدهد که ایمنی زیستی یک علم پویا و مبتنی بر تحلیل شرایط واقعی است، نه صرفاً یک چارچوب خشک و غیرقابل تغییر.
همچنین باید به تفاوت بین ایمنی فردی و ایمنی جمعی در محیطهای زیستی اشاره کرد. ایمنی فردی با تجهیزات حفاظت شخصی مانند ماسک، دستکش، شیلد و گان ارتباط دارد، در حالیکه ایمنی جمعی بر طراحی فضا، کنترل جریان هوا و مدیریت ضایعات تمرکز میکند. سطوح ایمنی بیولوژیکی تلاش میکنند این دو بعد را به صورت همزمان در نظر بگیرند تا حداکثر حفاظت حاصل شود.
در نهایت، مفاهیم پایه به ما نشان میدهند که ایمنی زیستی تنها یک موضوع فنی نیست، بلکه یک رویکرد جامع مدیریتی، اخلاقی و فرهنگی است. این رویکرد باید در تمام سطوح سازمانی، از کارکنان آزمایشگاه گرفته تا مدیران و سیاستگذاران، جاری شود تا بتواند اثربخش باشد. وقتی این مفاهیم به درستی درک شوند، ورود به جزئیات سطوح مختلف BSL معنای واقعی پیدا میکند و خواننده متوجه میشود که چرا هر سطح، تجهیزات و پروتکلهای خاص خود را دارد.
تاریخچه و تکامل سطوح ایمنی بیولوژیکی
شناخت و توسعه سطوح ایمنی بیولوژیکی حاصل چند دهه تجربه، آزمون و خطا، و در عین حال واکنشهای مستقیم به بحرانهای زیستی در مقیاس ملی و جهانی بوده است. اگرچه مفهوم اولیه ایمنی زیستی از همان زمان که انسان شروع به مطالعه میکروارگانیسمها کرد مطرح بود، اما شکلگیری نظاممند و علمی آن به نیمه دوم قرن بیستم بازمیگردد. در این دوره، پیشرفتهای سریع در میکروبشناسی و ویروسشناسی، امکان مطالعه بر روی عوامل بیماریزای بسیار خطرناک را فراهم آورد و همین امر ضرورت طراحی چارچوبهای مشخص برای حفاظت از کارکنان و جامعه را آشکار ساخت.
نخستین ریشههای ایمنی زیستی مدرن را میتوان در دوران پس از جنگ جهانی دوم یافت. در این زمان، توجه گستردهای به تهدیدهای بیولوژیکی جلب شد؛ چرا که بسیاری از کشورها از جمله ایالات متحده و اتحاد جماهیر شوروی، پروژههای تحقیقاتی مخفیانهای در حوزه سلاحهای بیولوژیکی داشتند. این فعالیتها نگرانیهای جدی در سطح بینالمللی ایجاد کرد و به تدریج باعث شد تا همزمان با توسعه برنامههای تسلیحاتی، بحثهای گستردهای در مورد ضرورت ایمنی و امنیت آزمایشگاهی شکل گیرد. همین مسئله منجر به پایهگذاری نخستین استانداردهای ایمنی زیستی در مراکز تحقیقاتی نظامی و سپس در مراکز دانشگاهی و پزشکی شد.
یکی از نقاط عطف مهم در تاریخچه ایمنی زیستی، تأسیس مراکز کنترل و پیشگیری بیماریها (CDC) در ایالات متحده بود. این مرکز از دهه ۱۹۵۰ میلادی شروع به تدوین دستورالعملهای تخصصی برای کار با عوامل بیماریزا کرد. به مرور زمان، طبقهبندی چندسطحی ایمنی بیولوژیکی طراحی شد تا به آزمایشگاهها کمک کند بسته به نوع عامل میکروبی، میزان بیماریزایی و روشهای انتقال، سطح مناسبی از تجهیزات و پروتکلها را انتخاب کنند. این نظام در دهه ۱۹۷۰ به صورت رسمی تحت عنوان BSL1 تا BSL4 معرفی شد و به سرعت مورد پذیرش جهانی قرار گرفت.
دهههای ۱۹۷۰ و ۱۹۸۰ را میتوان دوران تثبیت مفهوم BSL دانست. در این دوران، وقوع چند حادثه آزمایشگاهی مانند انتشار تصادفی ویروس آبله از یک مرکز تحقیقاتی در انگلستان یا نشتهای محدود از آزمایشگاههای تحقیقاتی دیگر، نشان داد که خطر واقعی است و ایمنی زیستی باید بیش از پیش جدی گرفته شود. همزمان با این رویدادها، اپیدمیهایی چون ابولا در آفریقا و ظهور ویروسهای نوپدید توجه دانشمندان را به این نکته جلب کرد که برخی از عوامل بیماریزا نه تنها قابلیت ایجاد همهگیریهای محلی، بلکه توان بالقوه برای تبدیل شدن به بحرانهای جهانی را دارند. این تجربیات منجر شد تا سطح ایمنی چهارم (BSL-4) بهعنوان حداکثر سطح ایمنی برای کار با چنین عوامل فوق خطرناک، بهطور گسترده ایجاد و توسعه یابد.
در دهه ۱۹۹۰ و اوایل دهه ۲۰۰۰، با گسترش فناوریهای زیستی و ظهور روشهای مهندسی ژنتیک، ایمنی زیستی وارد مرحلهای جدید شد. در این دوره، بحثهای اخلاقی و علمی پیرامون آزمایشهایی که بهطور عمدی ویژگیهای بیماریزا را تغییر میدادند، شدت گرفت. این دسته از پژوهشها که به Gain-of-Function معروف شدند، باعث شد نگرانیهای تازهای در مورد احتمال نشت یا سوءاستفاده از این عوامل مطرح گردد. در واکنش به این نگرانیها، استانداردهای ایمنی بیولوژیکی در بسیاری از کشورها بازنگری و سختگیرانهتر شدند.
یکی از نقاط عطف دیگر در تاریخچه ایمنی زیستی، پاندمی سندرم تنفسی حاد (SARS) در سال ۲۰۰۳ بود. این بیماری که توسط یک ویروس کرونا ایجاد شد، چندین حادثه آزمایشگاهی در کشورهای مختلف به همراه داشت که در آنها ویروس بهطور تصادفی از مراکز تحقیقاتی نشت کرد. این حوادث، جامعه علمی را متوجه ضرورت ارتقای ایمنی در سطح BSL-3 و بازبینی جدی در آموزش پرسنل و پروتکلهای کاری نمود. پس از آن، سازمان جهانی بهداشت و دیگر نهادهای بینالمللی بر همسانسازی و هماهنگی استانداردهای ایمنی در سطح جهانی تأکید بیشتری کردند.
پاندمی کووید-۱۹ در سال ۲۰۱۹ را میتوان یکی از مهمترین آزمونهای تاریخ ایمنی زیستی دانست. این بحران جهانی نشان داد که حتی اگرچه استانداردهای BSL در بسیاری از کشورها وجود دارد، اما اجرای دقیق و هماهنگ آنها همچنان یک چالش جدی است. در جریان این پاندمی، توجه بیسابقهای به آزمایشگاههای سطح سه و چهار شد؛ چرا که آنها نقشی اساسی در شناسایی ویروس، انجام تحقیقات واکسن و توسعه داروها داشتند. در عین حال، شایعات و نگرانیهایی درباره احتمال نشت تصادفی ویروس از یک آزمایشگاه نیز به شدت در رسانهها مطرح شد که نشان داد اعتماد عمومی به سیستمهای ایمنی زیستی نیازمند شفافیت و پاسخگویی بیشتری است.
از منظر تکامل فنی، پیشرفتهای چشمگیری در طراحی و ساخت آزمایشگاههای ایمن صورت گرفته است. امروزه، آزمایشگاههای سطح چهار با استفاده از فناوریهای نوین تهویه، فیلتراسیون چندلایه، کنترل فشار منفی و لباسهای فشار مثبت ساخته میشوند که خطر هرگونه نشت یا آلودگی را به حداقل میرساند. در کنار این پیشرفتها، سیستمهای مدیریت اطلاعات آزمایشگاهی (LIMS)، ابزارهای دیجیتال مانیتورینگ و حتی هوش مصنوعی برای پایش رفتار کارکنان و ارزیابی ریسک به کار گرفته میشوند.
همچنین، تجربه نشان داده است که توسعه آزمایشگاههای سطح بالا تنها محدود به کشورهای پیشرفته نیست. بسیاری از کشورهای در حال توسعه نیز در سالهای اخیر اقدام به ایجاد مراکز BSL-3 و حتی BSL-4 کردهاند تا بتوانند به صورت مستقل به تهدیدات عفونی پاسخ دهند. این امر نشان میدهد که ایمنی زیستی به یک اولویت جهانی تبدیل شده و هر کشوری برای حفاظت از شهروندان خود ناگزیر به سرمایهگذاری در این حوزه است.
به طور کلی، تاریخچه سطوح ایمنی بیولوژیکی را میتوان داستانی از یادگیری مستمر، واکنش به بحرانها و تکامل تدریجی دانست. از اولین تلاشها برای محافظت کارکنان در برابر باکتریهای نسبتاً بیخطر تا ساخت آزمایشگاههای فوقپیشرفته برای کار با ویروسهای کشنده، این مسیر نشان میدهد که علم ایمنی زیستی همواره در تعامل مستقیم با واقعیتهای تهدیدات زیستی و نیازهای جامعه انسانی بوده است.
امروزه، مفهوم BSL دیگر صرفاً یک دستورالعمل فنی نیست، بلکه نمادی از مسئولیتپذیری جهانی در برابر تهدیدات مشترک بشریت محسوب میشود. نگاهی به گذشته نشان میدهد که هر بحران بزرگ منجر به اصلاح و ارتقای سطح ایمنی شده و این چرخه احتمالاً در آینده نیز ادامه خواهد داشت؛ چرا که دنیای میکروبی همواره در حال تغییر و تکامل است و انسان برای حفاظت از خود ناگزیر به بهبود مستمر استانداردهای ایمنی خواهد بود.
معرفی کلی سطوح ایمنی بیولوژیکی
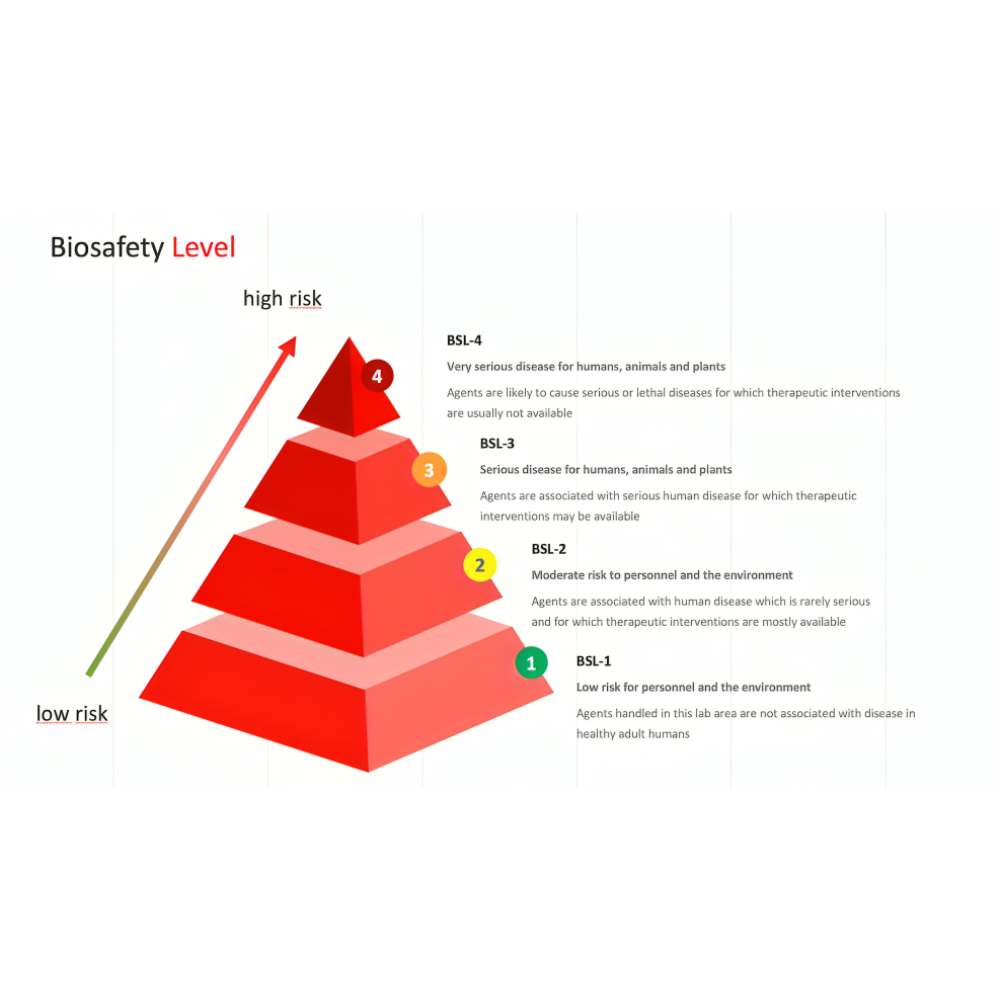
سطوح ایمنی بیولوژیکی که در ادبیات علمی با عنوان Biosafety Levels یا به اختصار BSL شناخته میشوند، چارچوبی جهانی و استاندارد شده برای مدیریت ایمنی در محیطهای تحقیقاتی و بالینی هستند که در آنها با میکروارگانیسمها و عوامل بیماریزا کار میشود. این سطوح نه تنها بیانگر میزان خطر احتمالی یک عامل زیستی برای سلامت انسان، حیوان و محیطزیست هستند، بلکه نشاندهنده مجموعهای از دستورالعملها، تجهیزات حفاظتی، طراحی فیزیکی آزمایشگاه و رویههای کاری به منظور کاهش یا حذف ریسک انتقال و انتشار عوامل بیماریزا میباشند.
به زبان ساده، میتوان گفت که سطوح ایمنی بیولوژیکی همانند یک نردبان حفاظتی عمل میکنند که هر پله آن برای یک سطح معین از خطر طراحی شده است. پایینترین سطح (BSL-1) برای میکروارگانیسمهایی است که کمترین تهدید را ایجاد میکنند و میتوان با حداقل اقدامات ایمنی با آنها کار کرد، در حالی که بالاترین سطح (BSL-4) برای کار با خطرناکترین و اغلب کشندهترین عوامل بیماریزا در نظر گرفته شده است که هیچ درمان یا واکسن موثری برای آنها وجود ندارد.
اهمیت معرفی این سطوح از آنجا ناشی میشود که در دنیای مدرن امروزی، تحقیقات زیستپزشکی و فناوریهای نوین زیستی نقشی کلیدی در توسعه داروها، واکسنها، و حتی مهندسی ژنتیک دارند. بدون وجود چارچوب مشخصی مانند BSLها، مدیریت چنین فعالیتهایی میتوانست منجر به وقوع خطرات فاجعهآمیز زیستی شود. به همین دلیل، سازمان بهداشت جهانی (WHO)، مراکز کنترل و پیشگیری بیماریها (CDC) و دیگر نهادهای بینالمللی بارها بر ضرورت رعایت این استانداردها تاکید کردهاند.
ویژگی کلیدی سطوح ایمنی بیولوژیکی آن است که هر سطح نه تنها بیانگر شدت خطر یک پاتوژن است، بلکه شامل الزامات عملیاتی مشخصی نیز میباشد. به عنوان مثال، در BSL-1 ممکن است تنها رعایت بهداشت فردی و استفاده از روپوش آزمایشگاهی کافی باشد، در حالی که در BSL-3 نیاز به طراحی خاص تهویه، استفاده از تجهیزات محافظت فردی پیشرفتهتر و محدودیتهای شدید ورود و خروج وجود دارد. در بالاترین سطح، یعنی BSL-4، کار تنها در آزمایشگاههای بسیار تخصصی با سیستمهای فیلتراسیون پیشرفته، لباسهای فشار مثبت و کنترل کامل جریان هوا امکانپذیر است.
آنچه این سطوح را متمایز میکند، یکپارچگی میان سه عنصر اصلی ایمنی است:
-
خصوصیات و میزان خطر عامل زیستی مورد مطالعه
-
طراحی و تجهیزات فیزیکی آزمایشگاه
-
رویههای کاری و مهارتهای پرسنل
این سه عامل در کنار هم چارچوبی را ایجاد میکنند که امکان انجام تحقیقات علمی را بدون به خطر انداختن سلامت کارکنان و جامعه فراهم میآورد.
در مقایسه جهانی، میتوان گفت که مفهوم سطوح ایمنی بیولوژیکی نه تنها به عنوان یک ابزار حفاظتی بلکه به عنوان یک زبان مشترک علمی عمل میکند. به بیان دیگر، وقتی یک محقق در هر نقطه دنیا به کار در BSL-3 اشاره میکند، سایر متخصصان دقیقا میدانند که این کار تحت چه شرایط، چه محدودیتها و چه الزامات ایمنی انجام میشود. این ویژگی، همکاریهای بینالمللی در زمینه بیماریهای عفونی، تحقیقات واکسن و پاسخ به بحرانهای جهانی مانند پاندمی کووید-19 را تسهیل کرده است.
به طور کلی، معرفی و استفاده از سطوح ایمنی بیولوژیکی، نه تنها پاسخی به نیازهای علمی و تحقیقاتی بشر بوده، بلکه به یک ضرورت اجتنابناپذیر برای حفاظت از سلامت عمومی تبدیل شده است. با توجه به رشد روزافزون فناوریهای زیستی و ظهور ویروسهای نوپدید، انتظار میرود که این چارچوبها در آینده بیش از پیش مورد بازنگری و تقویت قرار گیرند.
سطح ایمنی بیولوژیکی یک (BSL-1)
سطح ایمنی بیولوژیکی یک یا BSL-1 پایهایترین و در عین حال ضروریترین سطح ایمنی در آزمایشگاههای زیستی است. این سطح برای کار با میکروارگانیسمهایی طراحی شده است که کمترین تهدید را برای انسان، حیوان یا محیط زیست ایجاد میکنند. نمونههایی از این میکروارگانیسمها شامل گونههای غیر بیماریزا از باکتریها، قارچهای غیر پاتوژن و برخی ویروسهای ضعیف شده هستند. به عبارت دیگر، BSL-1 محیطی امن برای آموزش و پژوهشهای پایهای در زیستشناسی محسوب میشود، جایی که هدف اصلی یادگیری و کشف علمی است، بدون اینکه خطر جدی برای کارکنان یا جامعه وجود داشته باشد.
ویژگیهای کلیدی BSL-1 به وضوح نشان میدهد که این سطح چگونه با سطوح بالاتر تفاوت دارد. نخست، طراحی آزمایشگاه ساده و کمهزینه است و نیازمند تجهیزات پیچیده تهویه یا فیلتراسیون هوا نیست. اتاقها معمولاً شامل میزهای کار مقاوم در برابر مواد شیمیایی، سینک برای شستشوی دست و تجهیزات پایهای هستند. تجهیزات حفاظت فردی (PPE) محدود به روپوش آزمایشگاهی، دستکش و گاه عینک محافظ میشود. همچنین، در این سطح، کارکنان معمولاً با اصول پایهای بهداشت و روشهای جلوگیری از آلودگی آشنا هستند و رعایت این نکات برای حفاظت کافی است.
یکی از نکات مهم در BSL-1 تمرکز بر آموزش و فرهنگ ایمنی است. حتی اگر خطر میکروارگانیسمها کم باشد، آموزش مناسب در مورد دسترسی محدود، نحوه استفاده از تجهیزات و اقدامات پیشگیری از آلودگی، اساس کار ایمنی آزمایشگاه را شکل میدهد. در واقع، BSL-1 نقطه آغازین پرورش فرهنگ ایمنی در بین کارکنان آزمایشگاه محسوب میشود و پایهای برای حرکت به سطوح بالاتر ایمنی است.
از منظر عملیاتی، BSL-1 محدودیتهای شدیدی در دسترسی ندارد. معمولاً دانشجویان، پژوهشگران و کارکنان آزمایشگاه میتوانند به راحتی وارد این محیط شوند، اما باید قوانین سادهای مانند شستن دستها پیش و پس از انجام کار، خودداری از خوردن و نوشیدن در آزمایشگاه، و نگهداری مناسب نمونهها رعایت شود. از آنجا که این سطح با عوامل کمخطر سروکار دارد، نیاز به تجهیزات پیچیده کنترل منبع خطر مانند کابینتهای ایمنی بیولوژیکی وجود ندارد، مگر در موارد خاص که فعالیتها خطر پاشش یا انتشار ذرات را افزایش دهد.
یکی از نکات مهم دیگر در BSL-1، مدیریت ضایعات زیستی است. حتی میکروارگانیسمهای کمخطر نیز باید به صورت منظم و اصولی دفع شوند تا از هرگونه آلودگی محیطی جلوگیری شود. در این سطح، استفاده از اتوکلاو برای استریل کردن ابزارها و نمونهها توصیه میشود، اما پیچیدگی و الزامات فنی آن محدود است و معمولاً قابل مدیریت توسط خود کارکنان است.
با وجود اینکه BSL-1 به لحاظ تجهیزات و طراحی نسبت به سطوح بالاتر ساده است، اهمیت آن نباید دستکم گرفته شود. این سطح به عنوان پایه و اساس سیستم ایمنی زیستی عمل میکند و بدون وجود آن، حرکت به سمت آزمایشگاههای سطح دو و بالاتر ممکن نیست. بسیاری از دانشجویان زیستشناسی و پژوهشگران نوپا، نخستین تجربه عملی خود را در محیط BSL-1 کسب میکنند و یادگیری اصول پایه ایمنی در این سطح، سنگ بنای مهارتهای پیشرفته در سطوح بالاتر محسوب میشود.
از منظر تاریخی، BSL-1 همچنین محیطی بوده است که آزمایشگاهها و دانشگاهها توانستهاند با حداقل هزینه، روشهای آموزشی و تحقیقاتی را به دانشجویان ارائه دهند. این سطح، نمونهای از تعادل میان یادگیری علمی و ایمنی عملیاتی است که نشان میدهد ایمنی زیستی همیشه با پیچیدگی تجهیزات و زیرساختها تعیین نمیشود، بلکه با رعایت دقیق اصول و آموزش صحیح کارکنان شکل میگیرد.
در نهایت، BSL-1 علاوه بر آموزش و پژوهش پایه، اهمیت ویژهای در ایجاد فرهنگ گزارشدهی و نظارت دارد. حتی در سطح کمخطر، هر حادثه کوچک یا خطای انسانی میتواند درسهای ارزشمندی برای ارتقای ایمنی در سطوح بالاتر فراهم کند. بنابراین، BSL-1 نه تنها محیطی برای انجام فعالیتهای علمی ساده است، بلکه بستری برای پرورش مسئولیتپذیری، دقت و آشنایی با مفاهیم بنیادی ایمنی زیستی فراهم میکند.
سطح ایمنی بیولوژیکی دو (BSL-2)
سطح ایمنی بیولوژیکی دو یا BSL-2 یک گام مهم و حیاتی بالاتر از سطح پایه محسوب میشود و برای کار با میکروارگانیسمهایی طراحی شده است که قادرند بیماریهای خفیف تا متوسط ایجاد کنند و معمولاً راه انتقال آنها از طریق تماس مستقیم با مایعات بدن یا ذرات آلوده صورت میگیرد. این سطح برای تحقیقاتی مناسب است که نیاز به کار با پاتوژنهای انسان و حیوان دارند، اما خطر ابتلای گسترده و تهدید مستقیم برای جامعه پایین است. مثالهایی از میکروارگانیسمهای رایج در BSL-2 شامل استافیلوکوکوس اورئوس، سالمونلا، ویروسهای ضعیفشده و نمونههای بالینی انسانی هستند.
یکی از تفاوتهای اساسی بین BSL-1 و BSL-2، سطح بالاتر کنترل منبع خطر و الزامات حفاظتی است. در BSL-2، علاوه بر اقدامات استاندارد نظیر شستشوی دست و استفاده از روپوش آزمایشگاهی، استفاده از دستکش، عینک محافظ و در برخی موارد ماسک یا سپر صورت الزامی است. به علاوه، کارکنان موظفاند آموزش تخصصی در مورد رفتار با عوامل بیماریزا و نحوه پاسخ به حوادث احتمالی را گذرانده باشند. این آموزشها شامل شناخت مسیرهای انتقال، نحوه جلوگیری از تماس مستقیم با نمونهها و روشهای ضدعفونی تجهیزات و محیط است.
طراحی فیزیکی و زیرساختها نیز در BSL-2 پیچیدهتر از سطح یک است. در این سطح، آزمایشگاهها معمولاً مجهز به کابینتهای ایمنی بیولوژیکی کلاس II هستند که برای حفاظت از کارکنان، محیط و نمونهها طراحی شدهاند. سیستم تهویه آزمایشگاه ممکن است دارای فشار مثبت نسبت به محیط بیرون باشد و اغلب فیلترهای HEPA برای جلوگیری از انتشار ذرات معلق به کار گرفته میشوند. دربها و پنجرهها باید قابل کنترل و محکم بسته شوند و دسترسی به آزمایشگاه محدود به کارکنان مجاز است.
یکی از ویژگیهای برجسته BSL-2، مدیریت نمونههای بالینی و مواد زیستی خطرناک با دقت بالا است. در این سطح، نمونههای انسان یا حیوان ممکن است حاوی پاتوژنهای ناشناخته یا نیمهخطرناک باشند، بنابراین روشهای دقیق برچسبگذاری، ذخیرهسازی و دفع ضایعات زیستی الزامی است. نمونهها باید در ظروف مقاوم و ایمن نگهداری شوند و پس از پایان کار، تمامی مواد آلوده باید به روشهای استاندارد مانند اتوکلاو یا مواد ضدعفونیکننده با اثر گسترده از بین بروند.
از منظر عملیاتی، BSL-2 محدودیتهای دسترسی بیشتری نسبت به BSL-1 دارد. کارکنان باید از قبل آموزش دیده و صلاحیتهای لازم برای کار با پاتوژنهای سطح دو را کسب کرده باشند. ورود افراد غیرمجاز یا کسانی که آموزش کافی ندیدهاند، ممنوع است. همچنین، رعایت روشهای استاندارد برای جلوگیری از تولید آئروسل، مانند کار با پیپت دقیق و استفاده از تجهیزات مکانیکی، برای کاهش خطر انتقال عامل بیماریزا اهمیت ویژهای دارد.
یکی دیگر از نکات مهم، فرهنگ ایمنی و مدیریت ریسک است. در BSL-2، حوادث احتمالی میتوانند منجر به بیماریهای قابل درمان شوند، بنابراین گزارشدهی فوری و بدون ترس از مجازات، بهبود مستمر پروتکلها و نظارت دقیق بر رفتار کارکنان از اهمیت بالایی برخوردار است. بسیاری از آزمایشگاهها از مدلهای ارزیابی ریسک مانند SINS برای مدیریت خطرات و پیشگیری از بروز حوادث استفاده میکنند که به صورت سیستماتیک هرگونه فعالیت بالقوه خطرناک را شناسایی و اقدامات پیشگیرانه لازم را پیشنهاد میدهد.
در مقایسه با BSL-1، BSL-2 محیطی است که پژوهشگران میتوانند با طیف وسیعتری از میکروارگانیسمها کار کنند، اما همچنان نیاز به رعایت دقیق اصول ایمنی، استفاده از تجهیزات حفاظتی مناسب و آموزش تخصصی دارد. این سطح به طور ویژه در آزمایشگاههای بالینی، دانشگاهها و مراکز تحقیقاتی کاربرد دارد و به دانشمندان امکان میدهد که به طور ایمن نمونههای انسانی و حیوانی را مطالعه کنند، داروها و واکسنهای جدید را آزمایش کنند و مسیرهای انتقال بیماری را بررسی نمایند.
یکی از مثالهای کاربردی BSL-2 در زندگی واقعی، آزمایشگاههای تشخیص بالینی بیماریهای عفونی است که روزانه با نمونههای بیماران سر و کار دارند. این مراکز باید استانداردهای دقیق BSL-2 را رعایت کنند تا کارکنان، بیماران و محیط زیست از آلودگی محافظت شوند. رعایت دقیق روشهای ضدعفونی، استفاده از PPE مناسب، مدیریت ضایعات و محدودیت دسترسی، بخشهای حیاتی این سطح را تشکیل میدهند.
در نهایت، BSL-2 یک مرحله حیاتی در مسیر توسعه ایمنی زیستی است. این سطح نشان میدهد که چگونه با افزایش خطر میکروارگانیسمها، نیاز به آموزش، تجهیزات و کنترلها نیز افزایش مییابد و چگونه ایجاد یک محیط امن برای پژوهش، بدون کاهش کیفیت علمی، امکانپذیر است. این سطح، پلی است میان کارهای پایه در BSL-1 و تحقیقات پیشرفته و خطرناک در BSL-3 و BSL-4، و پایهای برای توسعه دانش و فرهنگ ایمنی در محیطهای آزمایشگاهی است.
سطح ایمنی بیولوژیکی سه (BSL-3)
سطح ایمنی بیولوژیکی سه یا BSL-3 مرحلهای حیاتی و پیشرفته در سیستمهای ایمنی زیستی محسوب میشود و برای کار با میکروارگانیسمهایی طراحی شده است که قادرند بیماریهای جدی و تهدیدکننده زندگی ایجاد کنند و معمولاً از طریق هوای معلق یا آئروسلها انتقال مییابند. در این سطح، خطر انتقال به کارکنان و حتی جامعه قابل توجه است، بنابراین مجموعهای از اقدامات پیشرفته حفاظتی و طراحیهای مهندسی برای کاهش ریسک الزامی میشود. نمونههایی از عوامل BSL-3 شامل مایکوباکتریوم توبرکلوزیس، ویروس سارس، ویروس نیپا و برخی ویروسهای آنفلوآنزا با پتانسیل بالا هستند.
ویژگیهای کلیدی BSL-3 شامل ترکیبی از تجهیزات حفاظتی، طراحی فیزیکی ویژه و پروتکلهای کاری دقیق است که با هدف محدود کردن انتشار میکروارگانیسمها و محافظت از کارکنان و محیط پیرامون ایجاد شدهاند. برخلاف BSL-1 و BSL-2، در این سطح کنترل منبع خطر و محدودیت دسترسی به طور جدی اجرا میشود و کارکنان باید آموزشهای تخصصی پیشرفته در زمینه مدیریت عوامل پاتوژن و پاسخ به حوادث اضطراری دیده باشند.
یکی از شاخصترین ویژگیهای فیزیکی آزمایشگاههای BSL-3، سیستم تهویه پیشرفته با فشار منفی است که جریان هوا را از محیطهای کمخطر به سمت محیط آزمایشگاه هدایت میکند تا از خروج هوای آلوده جلوگیری شود. همچنین، تمامی خروجیهای هوا از فیلترهای HEPA عبور داده میشوند تا هرگونه ذره معلق یا میکروارگانیسم از محیط خارج نشود. در این سطح، دربهای آزمایشگاه معمولاً مجهز به سیستمهای قفل خودکار هستند و ورود تنها برای کارکنان مجاز و آموزشدیده ممکن است.
استفاده از تجهیزات حفاظت فردی پیشرفته بخش دیگری از BSL-3 است. روپوش آزمایشگاهی مقاوم، دستکشهای چندلایه، عینکهای محافظ و در برخی موارد ماسکهای N95 یا استفاده از نیمماسک با فیلتر خاص برای جلوگیری از استنشاق آئروسلها الزامی است. برخی آزمایشگاهها حتی از لباسهای یکتکه فشار مثبت با تغذیه هوای پاک (Positive Pressure Suit) استفاده میکنند تا سطح حفاظت فردی به حداکثر برسد.
یکی از عناصر اساسی در BSL-3، کار با آئروسلها و نمونههای قابل انتشار از طریق هوا است. کارکنان موظفاند از روشهایی استفاده کنند که تولید ذرات معلق را به حداقل برسانند. این روشها شامل کار در کابینتهای ایمنی بیولوژیکی کلاس II یا III، استفاده از دستگاههای مکانیکی برای انتقال نمونه و عدم انجام عملیاتهای پرخطر بدون پوشش محافظ است. آموزش در این زمینه باید به صورت عملی و مستمر انجام شود تا ریسک بروز حوادث کاهش یابد.
مدیریت نمونهها و ضایعات زیستی در BSL-3 اهمیت حیاتی دارد. تمامی نمونههای آلوده باید به صورت ایمن ذخیره شوند و دفع ضایعات شامل اتوکلاو و استفاده از مواد ضدعفونیکننده با اثر گسترده الزامی است. علاوه بر این، روشهای شناسایی و برچسبگذاری نمونهها باید دقیق و استاندارد باشد تا از هرگونه اشتباه یا دسترسی غیرمجاز جلوگیری شود.
یک نکته مهم دیگر در BSL-3، فرهنگ ایمنی و پاسخ به حوادث است. با توجه به خطر بالای ابتلا به بیماریهای جدی، هرگونه حادثه یا نقض پروتکل باید فوراً گزارش شود و تیمهای اضطراری آموزش دیده آماده اقدام باشند. بسیاری از آزمایشگاهها از مدلهای ارزیابی ریسک و بایوریسک منجمله روشهای پیشرفته تحلیل سناریو استفاده میکنند تا فعالیتها پیش از انجام، خطرسنجی شوند.
BSL-3 در زمینههای تحقیقاتی و بالینی کاربرد گستردهای دارد. در تحقیقات اپیدمیولوژیک و توسعه واکسنها، این سطح ایمنی اجازه میدهد تا محققان بدون تهدید جدی، با ویروسهای بالقوه کشنده و عوامل بیماریزا کار کنند. همچنین، بسیاری از آزمایشگاههای تشخیصی پیشرفته از این سطح برای بررسی نمونههای بیماران مبتلا به بیماریهای عفونی جدی استفاده میکنند، که این امر اهمیت رعایت دقیق استانداردهای طراحی و پروتکلها را دوچندان میکند.
از منظر فناوری، آزمایشگاههای BSL-3 امروز با سیستمهای هوشمند مدیریت اطلاعات (LIMS) مجهز شدهاند که نظارت بر نمونهها، ردیابی کارکنان و مدیریت ریسک را آسان میکند. ترکیب تجهیزات مکانیکی پیشرفته، طراحی مهندسی و فناوریهای دیجیتال، BSL-3 را به یک محیط ایمن و کارآمد برای تحقیقات علمی حیاتی تبدیل کرده است.
یکی از چالشهای مهم در BSL-3، هماهنگی بین مقررات ملی و بینالمللی است. با توجه به اینکه برخی کشورها دارای استانداردهای متفاوت برای طراحی و عملیات آزمایشگاههای سطح سه هستند، برقراری همسانسازی بین کشورها و مراکز تحقیقاتی اهمیت دارد تا تحقیقات مشترک و انتقال نمونهها با کمترین ریسک ممکن انجام شود. این مسئله به ویژه در زمینه بیماریهای نوپدید و ویروسهای zoonotic که تهدید جهانی دارند، اهمیت دارد.
در نهایت، BSL-3 نقطهای است که در آن ایمنی زیستی، مهندسی، آموزش تخصصی و مدیریت ریسک به صورت یکپارچه و پیشرفته عمل میکنند. این سطح نشان میدهد که چگونه با افزایش خطر عامل زیستی، الزامات حفاظتی و پیچیدگیهای عملیاتی نیز افزایش مییابد و چگونه محیطی امن برای تحقیقات حیاتی بدون کاهش کیفیت علمی ایجاد میشود. BSL-3 پلی است بین محیطهای با خطر متوسط و محیطهای بسیار خطرناک BSL-4 و پایهای برای مقابله با تهدیدات زیستی بالقوه جهانی محسوب میشود.
سطح ایمنی بیولوژیکی چهار (BSL-4)
سطح ایمنی بیولوژیکی چهار یا BSL-4 بالاترین و پیچیدهترین سطح ایمنی در سیستمهای آزمایشگاهی زیستی است و برای کار با میکروارگانیسمها و ویروسهایی طراحی شده است که بسیار خطرناک، اغلب کشنده و بدون درمان یا واکسن مؤثر شناخته شده هستند. نمونههای رایج شامل ویروس ابولا، ماربورگ، لاسا و دیگر پاتوژنهای دسته چهار میباشند. این سطح به گونهای طراحی شده است که کوچکترین خطا یا نشت میتواند خطرات جبرانناپذیری برای کارکنان و جامعه به همراه داشته باشد.
ویژگیهای اساسی BSL-4 شامل مجموعهای یکپارچه از طراحی مهندسی، تجهیزات حفاظتی فردی، پروتکلهای کاری دقیق و مدیریت ریسک است که با هدف حفاظت کامل کارکنان و جلوگیری از انتشار عوامل بیماریزا به محیط ایجاد شده است. آزمایشگاههای BSL-4 معمولاً در ساختمانهای جداگانه با دسترسی محدود و کنترلشده واقع شدهاند و ورود به آن تنها برای افرادی امکانپذیر است که آموزش تخصصی دیده و صلاحیتهای کامل برای کار با عوامل دسته چهار را دارند.
یکی از برجستهترین ویژگیهای فیزیکی BSL-4، سیستمهای تهویه پیشرفته با فشار منفی است که جریان هوا را به صورت کاملاً کنترلشده از محیطهای کمخطر به داخل آزمایشگاه هدایت میکند و تمامی خروجیهای هوا از فیلترهای HEPA دوتایی یا سهگانه عبور میکند تا از انتشار هرگونه ذره آلوده جلوگیری شود. همچنین، تمام نقاط ورود و خروج دارای قفلهای الکترونیکی و سیستمهای ایمنی چندمرحلهای هستند تا فقط کارکنان مجاز بتوانند وارد یا خارج شوند.
در BSL-4، استفاده از لباسهای فشار مثبت یکتکه با تغذیه هوای پاک الزامی است. این لباسها یک سیستم حفاظت کامل برای کارکنان ایجاد میکنند و هرگونه تماس مستقیم با عامل بیماریزا را به حداقل میرسانند. دستکشهای مقاوم، کفشهای مخصوص و ابزارهای اضافی حفاظت فردی نیز به صورت استاندارد استفاده میشوند. کارکنان معمولاً با سیستمهای پیشرفته نظارت و ارتباط داخلی مجهز شدهاند تا در صورت بروز هرگونه حادثه بتوانند فوراً واکنش نشان دهند.
روشهای کار با نمونهها و جلوگیری از تولید آئروسلها در BSL-4 بسیار دقیق و استاندارد هستند. تمامی عملیاتها در داخل کابینتهای ایمنی بیولوژیکی کلاس III یا تجهیزات ویژه انجام میشوند تا هرگونه خطر انتشار عامل بیماریزا به حداقل برسد. حتی کوچکترین عملیاتهایی که در سطوح پایینتر خطر محسوب نمیشوند، در BSL-4 با پروتکلهای چندمرحلهای انجام میشوند.
مدیریت ضایعات و نمونهها در این سطح نیز بسیار حیاتی است. تمامی نمونهها و ضایعات آلوده باید به صورت سیستماتیک استریل شوند و خروج هرگونه ماده زیستی از محیط آزمایشگاه تحت نظارت دقیق انجام میشود. استفاده از اتوکلاوهای مخصوص، مواد ضدعفونیکننده با طیف اثر گسترده و روشهای تخلیه کنترلشده، جزو الزامات استاندارد BSL-4 هستند.
یکی از عناصر مهم دیگر، آموزش پیشرفته و تمرینهای اضطراری است. کارکنان BSL-4 باید با سناریوهای مختلف حوادث، اقدامات نجات و روشهای پاسخ سریع به نشت یا آلودگی آشنا باشند. این آموزشها شامل تمرینهای عملی، شبیهسازیهای حادثه و یادگیری نحوه استفاده کامل از تجهیزات فشار مثبت است.
از منظر عملیاتی، BSL-4 یک محیط با سطح بالای هماهنگی بین رشتهای است. تحقیقات در این سطح معمولاً شامل تیمهای چندرشتهای از میکروبیولوژی، مهندسی ایمنی، بهداشت حرفهای و مدیریت ریسک میشود تا تمامی جنبههای کار با عوامل کشنده به طور جامع مدیریت شود. این سطح، نه تنها حفاظت فیزیکی بلکه یکپارچگی دانش و مهارتهای انسانی را نیز در بر میگیرد.
BSL-4 در تحقیقات حیاتی برای بیماریهای نوپدید و ویروسهای zoonotic اهمیت دارد. آزمایشگاههای این سطح امکان مطالعه دقیق روی عوامل بسیار خطرناک، توسعه واکسنها و داروهای ضدویروس، و ارزیابی تهدیدات بالقوه جهانی را فراهم میکنند. در بحرانهای بهداشتی جهانی مانند شیوع ابولا یا ویروس نیپا، BSL-4 مرکز اصلی تحقیق و پاسخ علمی محسوب میشود.
یکی از چالشهای BSL-4، هزینههای بالای طراحی، نگهداری و عملیات است. ایجاد یک آزمایشگاه BSL-4 نیازمند سرمایهگذاری عظیم در زیرساختها، تجهیزات حفاظتی و آموزش کارکنان است. با این حال، اهمیت آن در محافظت از جامعه و امکان پیشگیری از بحرانهای زیستی جهانی، ارزش هزینههای صرف شده را توجیه میکند.
در نهایت، BSL-4 اوج استاندارد ایمنی زیستی را نمایش میدهد، جایی که ترکیب طراحی مهندسی، تجهیزات پیشرفته، آموزش تخصصی و مدیریت دقیق ریسک، محیطی امن برای کار با خطرناکترین عوامل زیستی فراهم میآورد. این سطح، نمایانگر تعهد جامعه علمی به حفاظت از انسانها، حیوانات و محیط زیست در مواجهه با شدیدترین تهدیدات زیستی است و نقطهای است که علم و ایمنی در بالاترین سطح ممکن به هم میپیوندند.
تجهیزات و زیرساختهای حیاتی در BSL
یکی از پایههای اصلی هر سطح ایمنی بیولوژیکی، تجهیزات و زیرساختهای فیزیکی است که ایمنی کارکنان، نمونهها و محیط اطراف را تضمین میکنند. بدون رعایت دقیق این اصول، حتی بهترین آموزشها و پروتکلهای کاری نیز قادر به جلوگیری از بروز حوادث زیستی نخواهند بود. تجهیزات و زیرساختها در هر سطح BSL با توجه به میزان خطر عامل زیستی، پیچیدگی و میزان محافظت مورد نیاز طراحی و انتخاب میشوند، و هر سطح از BSL-1 تا BSL-4 ویژگیها و الزامات خاص خود را دارد.
کابینتهای ایمنی بیولوژیکی (BSC) از مهمترین ابزارها در آزمایشگاههای BSL محسوب میشوند. این کابینتها طراحی شدهاند تا کاربر، نمونه و محیط را از آلودگی محافظت کنند. به طور کلی سه کلاس اصلی BSC وجود دارد: کلاس I، کلاس II و کلاس III. کابینتهای کلاس I بیشتر برای محافظت از کاربر و محیط کاربرد دارند، اما حفاظت نمونه کمتر است. کابینتهای کلاس II که در BSL-2 و BSL-3 رایج هستند، همزمان از کاربر و نمونه محافظت میکنند و جریان هوا با فیلتر HEPA کنترل میشود. کابینتهای کلاس III مخصوص BSL-3 و BSL-4 هستند و به صورت کاملاً محصور و گاه با دستکشهای یکپارچه طراحی میشوند تا هیچ تماس مستقیمی با عامل بیماریزا صورت نگیرد.
سیستمهای تهویه و کنترل هوا نیز یکی از ارکان حیاتی هر آزمایشگاه BSL است. آزمایشگاههای BSL-3 و BSL-4 به فشار منفی مجهز هستند تا جریان هوا همیشه از مناطق کمخطر به مناطق پرخطر حرکت کند و هرگونه انتشار میکروارگانیسمها به محیط خارجی محدود شود. علاوه بر این، هوا باید از فیلترهای HEPA عبور کند و در برخی موارد سیستمهای فیلتراسیون چندمرحلهای برای اطمینان از ایمنی کامل استفاده میشوند. کنترل دقیق دما، رطوبت و فشار هوا نیز به بهبود عملکرد سیستم تهویه و حفظ شرایط ایمن کمک میکند.
سیستمهای مدیریت ضایعات زیستی در BSL اهمیت حیاتی دارند. ضایعات آلوده شامل نمونهها، ابزارهای مصرفی و مواد شیمیایی باید از محیط جدا شده و به روش ایمن دفع شوند. استفاده از اتوکلاوها، مواد ضدعفونیکننده با اثر گسترده و روشهای کنترل شده برای تخلیه ضایعات بخش استانداردی از زیرساختها است. در BSL-4، حتی روند خروج ضایعات از آزمایشگاه تحت نظارت کامل و با کنترل چندمرحلهای انجام میشود تا کوچکترین احتمال انتشار عامل بیماریزا به حداقل برسد.
پوشش و تجهیزات حفاظت فردی (PPE) نیز بخش جداییناپذیر زیرساخت BSL است. در BSL-1 و BSL-2، استفاده از روپوش، دستکش و عینک محافظ کافی است، اما در BSL-3 و BSL-4، لباسهای یکپارچه فشار مثبت، ماسکهای تنفسی، دستکشهای چندلایه و کفشهای ویژه الزامی میشوند. این تجهیزات به گونهای طراحی شدهاند که تماس مستقیم با عوامل خطرناک را به صفر برسانند و کارکنان بتوانند در محیطهای بسیار خطرناک بدون نگرانی از ابتلا به بیماری فعالیت کنند.
یکی دیگر از عناصر زیرساختی مهم، سیستمهای دسترسی و امنیت فیزیکی هستند. آزمایشگاههای BSL-3 و BSL-4 مجهز به دربهای قفلشونده، سیستمهای شناسایی بیومتریک و مسیرهای ورود و خروج کنترلشده هستند تا ورود افراد غیرمجاز به محیط کاملاً محدود شود. این ویژگی، ترکیبی از امنیت فیزیکی و ایمنی زیستی را فراهم میآورد.
تجهیزات اضطراری و نظارت مداوم نیز در زیرساختهای BSL اهمیت ویژه دارند. وجود سنسورها برای تشخیص نشت مواد زیستی، سیستمهای اعلام حریق، تجهیزات اضطراری برای ضدعفونی سریع و مانیتورینگ آنلاین پارامترهای محیطی، بخشهای حیاتی هستند که عملکرد ایمن آزمایشگاه را تضمین میکنند. به عنوان مثال، در BSL-4، سیستمهای مانیتورینگ فشار هوا، جریان هوا و دما به صورت ۲۴ ساعته بررسی میشوند تا کوچکترین انحراف از استانداردها فوراً شناسایی شود.
زیرساخت فناوری اطلاعات و مدیریت دادهها نیز نقش کلیدی در ایمنی دارد. استفاده از سیستمهای مدیریت اطلاعات آزمایشگاهی (LIMS) باعث میشود نمونهها، دادهها و فرآیندهای کاری به صورت دقیق ثبت و پیگیری شوند و خطر اشتباهات انسانی کاهش یابد. این سیستمها امکان ردیابی کامل نمونهها و مدیریت پروتکلها را فراهم میکنند و به ویژه در محیطهای BSL-3 و BSL-4 اهمیت دارد، جایی که خطا میتواند پیامدهای جدی داشته باشد.
در نهایت، ترکیب این تجهیزات و زیرساختها نشاندهنده این است که ایمنی آزمایشگاهی تنها به آموزش کارکنان یا پروتکلهای کاری محدود نمیشود، بلکه یک سیستم یکپارچه شامل طراحی فیزیکی، تجهیزات حفاظتی، مدیریت ضایعات، کنترل دسترسی و نظارت دقیق است که محیط آزمایشگاه را به مکانی امن برای تحقیق و توسعه علمی تبدیل میکند. این سطح یکپارچگی، پایه و اساس تمامی سطوح BSL از یک تا چهار را شکل میدهد و امکان انجام پژوهشهای پیچیده و خطرناک را بدون تهدید سلامت کارکنان و جامعه فراهم میآورد.
مدیریت ریسک و بایوریسک
یکی از ستونهای اساسی ایمنی زیستی در آزمایشگاهها، مدیریت ریسک و بایوریسک است. این فرآیند شامل شناسایی، ارزیابی و کنترل خطرات مرتبط با عوامل زیستی و فعالیتهای آزمایشگاهی است تا خطر ابتلا به بیماری، انتشار عوامل زیستی یا آسیب به کارکنان و محیط کاهش یابد. مدیریت ریسک به عنوان یک ابزار پیشگیرانه نه تنها حفاظت فیزیکی و تجهیزات را در بر میگیرد، بلکه فرهنگ ایمنی، آموزش کارکنان و سیستمهای مدیریت اطلاعات را نیز شامل میشود.
شناسایی خطرات زیستی اولین مرحله در مدیریت بایوریسک است. این مرحله شامل بررسی انواع میکروارگانیسمها، ویروسها و نمونههای بالینی مورد استفاده در آزمایشگاه، مسیرهای انتقال آنها و پتانسیل ایجاد بیماری در انسان یا حیوانات میشود. در این مرحله، تمام عواملی که ممکن است موجب تولید آئروسل، تماس مستقیم یا انتشار عامل زیستی به محیط شوند، شناسایی میشوند. شناسایی دقیق خطرات، پایهای برای طراحی اقدامات حفاظتی و تعیین سطح BSL مناسب است.
پس از شناسایی، ارزیابی ریسک انجام میشود. این مرحله شامل تحلیل احتمال وقوع حادثه و شدت پیامدهای آن است. برای مثال، کار با ویروسهای کشنده مانند ابولا در محیط بدون حفاظت کامل، ریسک بسیار بالایی دارد، در حالی که کار با باکتریهای کمخطر مانند E. coli در سطح BSL-1 ریسک پایینی محسوب میشود. بسیاری از آزمایشگاهها از مدلهای ارزیابی ریسک سیستماتیک مانند SINS یا روشهای تحلیلی مبتنی بر ماتریس خطر استفاده میکنند تا به صورت کمی و کیفی، خطرات شناسایی شده را رتبهبندی و اقدامات مناسب را تعیین کنند.
یکی از بخشهای حیاتی مدیریت ریسک، کنترل و کاهش خطرات است. این کنترلها میتوانند شامل استفاده از تجهیزات حفاظتی فردی، کابینتهای ایمنی بیولوژیکی، روشهای استاندارد کار با نمونهها و تهویه مطبوع پیشرفته باشند. علاوه بر تجهیزات، اقدامات مدیریتی و آموزشی نیز نقش کلیدی دارند. آموزش مداوم کارکنان در زمینه رعایت پروتکلها، پاسخ به حوادث و استفاده صحیح از تجهیزات حفاظتی، از اصلیترین ابزارهای کاهش خطر است.
پایش مستمر و نظارت نیز جزء جداییناپذیر مدیریت بایوریسک است. آزمایشگاهها باید سیستمهای نظارتی برای بررسی عملکرد تجهیزات، جریان هوا، فشار محیط و کیفیت تهویه داشته باشند. نظارت بر رفتار کارکنان، رعایت پروتکلها و ثبت دقیق فعالیتها نیز در کاهش خطرهای انسانی بسیار مؤثر است. استفاده از سیستمهای مدیریت اطلاعات آزمایشگاهی (LIMS) امکان ردیابی کامل نمونهها، ثبت فعالیتها و تحلیل دادهها را فراهم میکند و باعث میشود کوچکترین انحراف از استانداردها فوراً شناسایی شود.
یکی دیگر از جنبههای مهم، مدیریت حوادث و برنامههای اضطراری است. این برنامهها شامل طراحی سناریوهای حادثه، تمرینهای عملی و تعیین مسیرهای خروج ایمن، اقدامات ضدعفونی فوری و هماهنگی با واحدهای اورژانس است. در سطحهای بالای BSL، هر حادثه حتی کوچکترین احتمال نشت عامل زیستی را باید جدی گرفت و کارکنان باید آموزش دیده باشند تا واکنش سریع و مؤثری انجام دهند.
فرهنگ ایمنی زیستی نیز یکی از ارکان اصلی بایوریسک است. حتی با وجود بهترین تجهیزات و پروتکلها، رعایت دقیق ایمنی و توجه به جزئیات عملیاتی توسط کارکنان است که محیط آزمایشگاه را امن نگه میدارد. این فرهنگ شامل گزارشدهی بدون ترس از مجازات، همکارانه عمل کردن در رعایت پروتکلها و ارتقای مستمر دانش کارکنان در زمینه ایمنی است.
از منظر علمی، مدیریت بایوریسک امکان تحقیقات پیشرفته در محیطهای امن را فراهم میکند. در BSL-3 و BSL-4، بدون ارزیابی دقیق ریسک، کار با ویروسهای کشنده یا عوامل بیماریزای جدید امکانپذیر نیست. فرآیند مدیریت ریسک تضمین میکند که پژوهشگران بتوانند به طور مؤثر به جمعآوری دادهها، توسعه واکسنها و مطالعه پاتوژنهای نوپدید بپردازند، بدون آنکه سلامت خود، جامعه و محیط زیست در خطر قرار گیرد.
هماهنگی بین مقررات ملی و بینالمللی یکی دیگر از جنبههای حیاتی مدیریت بایوریسک است. بسیاری از آزمایشگاهها با استانداردهای متفاوت بین کشورها مواجه هستند، و رعایت دستورالعملهای بینالمللی مانند WHO و CDC به ایجاد یک چارچوب هماهنگ کمک میکند. این هماهنگی برای آزمایشگاههای چندملیتی، پروژههای مشترک و تحقیقاتی که نیاز به انتقال نمونهها دارند، اهمیت بالایی دارد.
در نهایت، مدیریت ریسک و بایوریسک نشان میدهد که ایمنی آزمایشگاهی یک فرآیند پویا و جامع است که ترکیبی از شناسایی و ارزیابی خطرات، اعمال اقدامات حفاظتی، آموزش کارکنان، نظارت مستمر و توسعه فرهنگ ایمنی را در بر میگیرد. بدون این رویکرد یکپارچه، حتی پیشرفتهترین تجهیزات و پروتکلها نمیتوانند به طور کامل از خطرات زیستی جلوگیری کنند. این بخش، پایهای برای تمامی فعالیتهای علمی در سطوح BSL است و تضمین میکند که تحقیقات در محیطهای پرخطر با بیشترین میزان امنیت و کمترین ریسک برای انسان و جامعه انجام شود.
آموزش و صلاحیت پرسنل
یکی از اصول بنیادین در ایجاد و حفظ ایمنی زیستی در آزمایشگاهها، آموزش جامع و اطمینان از صلاحیت کامل پرسنل است. بدون داشتن دانش تخصصی، مهارتهای عملی و درک دقیق از خطرات، حتی بهترین تجهیزات و پروتکلهای ایمنی نیز نمیتوانند از بروز حوادث جلوگیری کنند. بنابراین، توسعه و اجرای برنامههای آموزشی منظم و ارزیابی مستمر کارکنان، بخش جداییناپذیر هر سطح BSL است و پایهای برای فرهنگ ایمنی پایدار به شمار میآید.
اهمیت آموزش در ایمنی زیستی فراتر از صرفاً یادگیری دستورالعملها است. کارکنان باید به طور عملی با فرآیندهای کاری، تجهیزات حفاظتی، روشهای جلوگیری از انتشار عوامل بیماریزا و پاسخ به حوادث اضطراری آشنا شوند. این آموزشها شامل مواردی مانند استفاده صحیح از کابینتهای ایمنی بیولوژیکی، لباسهای فشار مثبت، مدیریت ضایعات زیستی، کنترل دسترسی و پروتکلهای ضدعفونی میشوند.
یکی از مؤلفههای حیاتی، آموزش مبتنی بر سطح BSL است. به عنوان مثال، کارکنان BSL-1 نیازمند آشنایی با اصول پایه میکروبیولوژی، روشهای ساده حفاظت فردی و رعایت استانداردهای عمومی آزمایشگاه هستند. در مقابل، پرسنل BSL-3 و BSL-4 باید آموزشهای تخصصی پیشرفته دریافت کنند، شامل کار با ویروسها و باکتریهای کشنده، تکنیکهای کنترل آئروسل، استفاده از تجهیزات فشار مثبت و واکنش سریع در شرایط اضطراری.
برنامههای آموزش عملی و شبیهسازیهای حادثه بخش اساسی صلاحیت پرسنل است. در این روشها، کارکنان در محیط کنترلشده با سناریوهای بالقوه حادثه آشنا میشوند و توانایی واکنش سریع و درست در شرایط واقعی را تمرین میکنند. این تمرینها شامل شبیهسازی نشت نمونه، آلودگی تجهیزات، مشکلات تهویه یا خرابی PPE است و به کارکنان اعتماد و مهارت عملی لازم برای مواجهه با خطرات واقعی را میدهد.
یکی دیگر از ابعاد مهم، ارزیابی و تأیید صلاحیت است. پس از اتمام برنامههای آموزشی، کارکنان باید تحت آزمونهای عملی و نظری قرار گیرند تا میزان درک، توانایی و مهارتهای آنها ارزیابی شود. این ارزیابی میتواند شامل بررسی دانش پروتکلها، توانایی استفاده از تجهیزات حفاظتی، پاسخ به سناریوهای اضطراری و مدیریت نمونهها باشد. فقط کارکنانی که صلاحیت کافی را کسب کردهاند اجازه ورود به آزمایشگاههای سطح BSL بالاتر را خواهند داشت.
آموزش مستمر و ارتقای دانش نیز از الزامات حیاتی است. با پیشرفت علوم، ظهور عوامل زیستی نوپدید، تغییرات در دستورالعملهای ایمنی و توسعه فناوریهای جدید، برنامههای آموزشی باید به صورت دورهای بازنگری و بهروزرسانی شوند. این آموزشها میتواند شامل سمینارها، کارگاهها، جلسات آموزشی آنلاین و تمرینهای عملی باشد تا دانش و مهارت کارکنان همیشه با استانداردهای روز هماهنگ باشد.
فرهنگ ایمنی و روحیه مسئولیتپذیری نیز با آموزش پرسنل تقویت میشود. کارکنان باید ترغیب شوند که خطرات بالقوه را گزارش کنند، اشتباهات احتمالی را به سرعت اعلام کنند و در اجرای پروتکلها با دقت کامل عمل کنند. این رویکرد باعث میشود که محیط آزمایشگاه نه تنها فیزیکی بلکه فرهنگی نیز امن باشد.
توسعه مهارتهای بینرشتهای از دیگر جنبههای آموزش پرسنل است. کارکنان BSL-3 و BSL-4 نیازمند درک جامع از میکروبیولوژی، مهندسی ایمنی، مدیریت ریسک، بهداشت حرفهای و فناوریهای نوین آزمایشگاهی هستند. این دانش بینرشتهای به آنها امکان میدهد تصمیمات هوشمندانه در شرایط پیچیده بگیرند و ایمنی خود و دیگران را تضمین کنند.
مدیریت مستندات آموزشی و سوابق صلاحیت نیز اهمیت دارد. آزمایشگاهها باید سابقه کامل آموزشها، ارزیابیها و بازآموزیهای کارکنان را ثبت کنند تا در صورت نیاز، امکان پیگیری، بازبینی و بهبود مستمر وجود داشته باشد. این مستندسازی، علاوه بر رعایت الزامات قانونی، نقش مهمی در مدیریت ریسک و کیفیت عملیاتی دارد.
در نهایت، آموزش و صلاحیت پرسنل نه تنها یک الزام قانونی یا پروتکلی است، بلکه پایه اصلی فرهنگ ایمنی زیستی و عملکرد موثر آزمایشگاه محسوب میشود. ترکیب آموزش تخصصی، تمرین عملی، ارزیابی مداوم و توسعه مهارتهای بینرشتهای تضمین میکند که کارکنان قادر باشند با اطمینان و دانش کامل، فعالیتهای خود را در محیطهای با خطر زیستی متوسط تا بسیار بالا انجام دهند، و خطرات برای خود و جامعه به حداقل برسد.
مقایسه استانداردهای بینالمللی
در زمینه ایمنی زیستی، رعایت استانداردها و دستورالعملهای بینالمللی اهمیت حیاتی دارد. این استانداردها چارچوبی یکپارچه برای طراحی، عملکرد و مدیریت آزمایشگاهها فراهم میکنند و تضمین میکنند که فعالیتهای پژوهشی با حداقل ریسک برای کارکنان، جامعه و محیط زیست انجام شوند. با توجه به پیچیدگی عوامل زیستی و تنوع سطح خطر در آزمایشگاهها، کشورها و سازمانهای بینالمللی دستورالعملهایی را تدوین کردهاند که ممکن است در جزئیات متفاوت باشند، اما هدف نهایی آنها یکسان است: حفاظت حداکثری در برابر خطرات زیستی.
سازمان بهداشت جهانی (WHO) یکی از پیشگامان تدوین استانداردهای جهانی ایمنی زیستی است. دستورالعملهای WHO، شامل مفاهیم پایه، طراحی فیزیکی آزمایشگاه، تجهیزات حفاظتی، مدیریت ضایعات و آموزش پرسنل است. این دستورالعملها به عنوان مرجع اصلی برای کشورهایی که تازه وارد حوزه تحقیقات زیستی میشوند یا قصد ارتقای سطح BSL خود را دارند، مورد استفاده قرار میگیرند. WHO همچنین بر هماهنگی استانداردهای ایمنی و امنیت زیستی با نیازهای بهداشتی ملی و بینالمللی تأکید دارد.
مرکز کنترل و پیشگیری بیماریهای ایالات متحده (CDC) و موسسه ملی سلامت (NIH) نیز استانداردهای بسیار دقیقی برای ایمنی زیستی ارائه کردهاند. دستورالعملهای CDC/NIH، تحت عنوان Biosafety in Microbiological and Biomedical Laboratories (BMBL) منتشر میشوند و شامل جزئیات طراحی آزمایشگاه، طبقهبندی عوامل زیستی، پروتکلهای عملیاتی و مدیریت ریسک هستند. BMBL به صورت گسترده در آزمایشگاههای دانشگاهی، تحقیقاتی و صنعتی در سراسر جهان به عنوان استاندارد مرجع پذیرفته شده است.
در اروپا، دستورالعملهای کمیسیون اروپا و سازمانهای ملی ایمنی زیستی مانند EU-Biosafety Directive، استانداردهایی منطبق با اصول WHO و CDC ارائه میدهند، اما برخی تفاوتها در حوزه طراحی فیزیکی، الزامات تهویه و تجهیزات حفاظتی دیده میشود. این تفاوتها بیشتر ناشی از قوانین ملی، ساختارهای حقوقی و استانداردهای ساخت و ساز در کشورهای مختلف است. با این حال، اصول کلی یعنی حفاظت از کاربر، نمونه و محیط، مشترک و بدون تغییر است.
استانداردهای بینالمللی سازمان بهداشت حیوانات (OIE) نیز برای آزمایشگاههایی که با عوامل بیماریزای حیوانی کار میکنند، اهمیت دارند. این دستورالعملها شامل ارزیابی ریسک، کنترل انتقال عوامل بیماریزا به انسان و محیط و الزامات طراحی آزمایشگاه است و با استانداردهای WHO و CDC همراستا هستند، اما تمرکز ویژهای بر عوامل zoonotic و حفاظت از دامها دارند.
یکی از نقاط تفاوت بین استانداردها، تعیین سطوح BSL و الزامات فیزیکی آنها است. به عنوان مثال، در BSL-3، CDC تاکید بر استفاده از کابینتهای کلاس II و سیستم تهویه فشار منفی دارد، در حالی که برخی دستورالعملهای اروپایی ممکن است تمرکز بیشتری بر کنترل جریان هوا و فیلترهای چندمرحلهای داشته باشند. در BSL-4، همه استانداردها استفاده از لباسهای فشار مثبت و سیستمهای تهویه پیشرفته را الزامی میدانند، اما جزئیات طراحی ورود و خروج، اتوکلاوهای داخلی و مسیرهای اضطراری ممکن است متفاوت باشد.
هماهنگی بین استانداردها برای پروژههای چندملیتی و همکاریهای علمی اهمیت دارد. پژوهشگران و مدیران آزمایشگاهها باید تفاوتهای جزئی در دستورالعملها را شناسایی و در طراحی و عملکرد آزمایشگاههای خود اعمال کنند تا تمامی الزامات قانونی و ایمنی رعایت شود. به عنوان مثال، انتقال نمونههای BSL-3 یا BSL-4 بین کشورها نیازمند بررسی تطابق استانداردهای ملی و بینالمللی است تا خطر انتشار عامل زیستی به حداقل برسد.
یکی دیگر از محورهای مقایسه، فرآیند مدیریت ریسک و آموزش کارکنان است. همه استانداردها بر اهمیت ارزیابی ریسک سیستماتیک، شناسایی نقاط حساس و طراحی پروتکلهای کاری ایمن تأکید دارند، اما نوع و تعداد دورههای آموزشی، روشهای ارزیابی صلاحیت و تمرینهای شبیهسازی ممکن است در هر کشور متفاوت باشد. هماهنگی این فرآیندها در آزمایشگاههای بینالمللی باعث میشود کارکنان بتوانند بدون تردید با استانداردهای مختلف کار کنند و ایمنی حفظ شود.
جمعبندی تفاوتها و شباهتها نشان میدهد که اصول کلی ایمنی زیستی در تمامی دستورالعملها مشترک است: حفاظت از انسان، محیط و نمونه، مدیریت دقیق ریسک و آموزش کارکنان. تفاوتها بیشتر در جزئیات فنی، طراحی فیزیکی، تجهیزات حفاظتی و الزامات آموزشی است که میتواند براساس قوانین ملی، نیازهای پژوهشی و شرایط محلی تنظیم شود. این انعطاف، امکان پیادهسازی استانداردها در شرایط مختلف را فراهم میکند، در حالی که امنیت و حفاظت همواره حفظ میشود.
در نهایت، شناخت و مقایسه استانداردهای بینالمللی برای مدیران آزمایشگاه، پژوهشگران و سیاستگذاران ضروری است. این دانش کمک میکند تا آزمایشگاهها با رعایت بهترین شیوهها، ریسکهای زیستی را کاهش داده، تحقیقات علمی را ایمن انجام دهند و هماهنگی لازم برای پروژههای بینالمللی را حفظ کنند. همچنین، آشنایی با این استانداردها، مبنای تصمیمگیری در طراحی آزمایشگاه، انتخاب تجهیزات، برنامهریزی آموزش و توسعه سیاستهای ایمنی زیستی است.
چالشها و آینده سطوح ایمنی بیولوژیکی
با پیشرفت سریع علوم زیستی و ظهور عوامل بیماریزای جدید، مدیریت و بهبود سطوح ایمنی بیولوژیکی به یک ضرورت حیاتی تبدیل شده است. هرچند استانداردهای BSL-1 تا BSL-4 چارچوب مشخصی برای ایمنی ارائه میدهند، اما چالشهای عملی و فنی بسیاری وجود دارد که میتواند عملکرد آزمایشگاهها را تحت تأثیر قرار دهد. شناخت این چالشها و پیشبینی روندهای آینده، کلید ارتقای ایمنی و بهرهوری در تحقیقات زیستی است.
یکی از اصلیترین چالشها، هزینههای بالای ایجاد و نگهداری آزمایشگاههای BSL-3 و BSL-4 است. طراحی این آزمایشگاهها شامل سیستمهای تهویه پیشرفته، کابینتهای ایمنی، تجهیزات PPE فشار مثبت و اتاقهای کنترل شده فشار منفی است. علاوه بر تجهیزات فیزیکی، هزینه آموزش تخصصی پرسنل، نظارت مداوم و نگهداری سیستمهای اضطراری نیز قابل توجه است. این هزینهها ممکن است مانعی برای کشورهای با منابع محدود یا مؤسسات تحقیقاتی کوچک باشند و در نتیجه دسترسی به تحقیقات پیشرفته محدود شود.
کمبود نیروی انسانی متخصص نیز یکی از چالشهای جدی محسوب میشود. آزمایشگاههای سطح BSL-3 و BSL-4 نیازمند کارکنانی هستند که هم دانش تخصصی میکروبیولوژی و virology داشته باشند و هم مهارت عملی در کار با عوامل خطرناک را دارا باشند. آموزش این افراد زمانبر و پیچیده است و فقدان کارشناسان باتجربه میتواند امنیت و کارایی آزمایشگاه را تهدید کند.
چالش دیگر، مدیریت ایمنی در مواجهه با عوامل نوپدید و دستکاریشده ژنتیکی است. با ظهور ویروسها و باکتریهای جدید و همچنین انجام پروژههای gain-of-function، ریسکهای بالقوه افزایش یافته و استانداردهای موجود ممکن است نیاز به بهروزرسانی و توسعه داشته باشند. در این زمینه، ارزیابی ریسک دقیق، طراحی پروتکلهای پیشرفته و استفاده از تجهیزات نوین حیاتی هستند.
یکی از جنبههای مهم آینده ایمنی زیستی، همگرایی بین ایمنی و امنیت زیستی است. امنیت زیستی شامل جلوگیری از دسترسی غیرمجاز، سرقت نمونهها یا سوءاستفاده از عوامل بیماریزا میشود. با توجه به تهدیدات سایبری و حملات بیوتروریستی، آزمایشگاهها باید همزمان بر ایمنی و امنیت تمرکز داشته باشند. این موضوع نیازمند طراحی سیستمهای نظارتی یکپارچه، کنترل دسترسی فیزیکی و دیجیتال و آموزش کارکنان در زمینه تهدیدات امنیتی است.
نوآوریهای فناوری و دیجیتال نیز نقش حیاتی در آینده BSL ایفا میکنند. استفاده از سیستمهای مدیریت اطلاعات آزمایشگاهی (LIMS)، هوش مصنوعی در پایش تجهیزات، مانیتورینگ آنلاین فشار و جریان هوا و تجزیه و تحلیل دادههای بیوانفورماتیک میتواند به بهبود امنیت، کاهش خطاهای انسانی و افزایش بهرهوری کمک کند. این فناوریها امکان واکنش سریع به خطرات و بهبود مدیریت ریسک را فراهم میکنند.
استانداردسازی و هماهنگی بینالمللی یکی دیگر از مسیرهای حیاتی برای آینده سطوح ایمنی بیولوژیکی است. با افزایش همکاریهای علمی بین کشورها و تبادل نمونهها و دادههای حساس، هماهنگی در زمینه دستورالعملها، آموزش، مدیریت ضایعات و طراحی آزمایشگاه اهمیت پیدا کرده است. ایجاد شبکههای بینالمللی، مانند BSL4ZNet برای ویروسهای zoonotic، نمونهای از تلاش برای همگرایی جهانی در ایمنی و امنیت زیستی است.
توسعه فرهنگ ایمنی زیستی نیز آینده این حوزه را شکل میدهد. در کنار تجهیزات و استانداردها، رفتار کارکنان و مسئولیتپذیری فردی نقش کلیدی دارند. ایجاد محیطی که در آن گزارشدهی خطرات بدون ترس از مجازات تشویق شود، آموزش مستمر و تعامل بینرشتهای پرسنل توسعه یابد و اهمیت رعایت دقیق پروتکلها همواره برجسته باشد، میتواند به کاهش حوادث و افزایش ایمنی کمک کند.
چالشهای دیگر شامل پاسخ به بحرانهای اپیدمیولوژیک و پاندمیکها است. تجربه COVID-19 نشان داد که آزمایشگاهها باید قادر باشند سریعاً به عوامل نوظهور پاسخ دهند، سطح ایمنی خود را ارتقا دهند و در عین حال تحقیقات ضروری را بدون توقف ادامه دهند. این امر نیازمند برنامهریزی انعطافپذیر، طراحی آزمایشگاههای قابل تطبیق و زیرساختهای مقیاسپذیر است.
در نهایت، آینده سطوح ایمنی بیولوژیکی با ترکیب نوآوریهای فناوری، استانداردهای هماهنگ بینالمللی، توسعه نیروی انسانی متخصص و فرهنگ ایمنی پویا شکل میگیرد. این آینده تضمین میکند که تحقیقات علمی حتی در مواجهه با عوامل بسیار خطرناک، با بیشترین میزان ایمنی، امنیت و بهرهوری انجام شود و جامعه و محیط زیست در برابر تهدیدات زیستی محافظت شوند.
جمعبندی و نتیجهگیری
در پایان این مرور جامع، واضح است که سطوح ایمنی بیولوژیکی (BSL) پایه و ستون اصلی حفاظت در برابر خطرات زیستی در آزمایشگاهها هستند و هر سطح با توجه به میزان خطر و نوع عامل زیستی طراحی و مدیریت میشود. از BSL-1 تا BSL-4، هر مرحله شامل مجموعهای از اقدامات فنی، مدیریتی و آموزشی است که با هدف کاهش خطرات و حفاظت از کارکنان، جامعه و محیط زیست اجرا میشوند.
سطوح ایمنی بیولوژیکی نه تنها یک الزام قانونی یا پروتکلی هستند، بلکه چارچوبی علمی برای مدیریت ریسک، کنترل انتشار عوامل بیماریزا و ایجاد محیطهای امن برای تحقیقات علمی فراهم میکنند. سطح BSL-1 به عنوان پایهای برای کار با عوامل کمخطر، BSL-2 برای فعالیتهای با ریسک متوسط، BSL-3 برای عوامل تهدیدکننده سلامتی جدی و قابلیت انتشار تنفسی، و BSL-4 برای خطرناکترین عوامل با قابلیت مرگ و نبود درمان مؤثر طراحی شدهاند. هر سطح شامل استانداردهای تجهیزات، طراحی فیزیکی آزمایشگاه، اقدامات حفاظتی فردی و پروتکلهای کاری مشخص است که با دقت اجرا و نظارت میشوند.
یکی از اصول بنیادین موفقیت در ایمنی زیستی، مدیریت ریسک و بایوریسک است. شناسایی دقیق خطرات، ارزیابی علمی ریسک، اعمال کنترلهای مهندسی و مدیریتی، آموزش پرسنل و پایش مستمر محیط، تضمین میکند که خطرات بالقوه به حداقل ممکن کاهش یابند. بدون این رویکرد سیستماتیک، حتی پیشرفتهترین تجهیزات نمیتوانند ایمنی واقعی را تضمین کنند.
آموزش و صلاحیت پرسنل نیز نقش کلیدی در ایمنی آزمایشگاهی ایفا میکند. کارکنان باید نه تنها با دستورالعملها و پروتکلها آشنا باشند، بلکه مهارت عملی و توانایی واکنش به شرایط اضطراری را نیز داشته باشند. آموزشهای مبتنی بر سطح BSL، شبیهسازی حوادث، ارزیابی عملی و آموزش مستمر، پایهای برای ایجاد فرهنگ ایمنی زیستی و رفتار مسئولانه در محیط آزمایشگاه هستند.
مقایسه استانداردهای بینالمللی نشان میدهد که اصول ایمنی زیستی در تمام جهان مشترک است: حفاظت از انسان، نمونه و محیط، مدیریت دقیق ریسک و آموزش پرسنل. تفاوتها بیشتر در جزئیات فنی، طراحی فیزیکی و الزامات آموزشی است، که میتواند با قوانین ملی و شرایط محلی هماهنگ شود. این همگرایی بینالمللی، به ویژه برای پروژههای چندملیتی و انتقال نمونههای حساس، حیاتی است.
با این حال، چالشهای عملی همچنان وجود دارند. هزینههای بالای ایجاد و نگهداری آزمایشگاههای سطح بالا، کمبود نیروی انسانی متخصص، ظهور عوامل زیستی نوپدید و نیاز به هماهنگی ایمنی و امنیت زیستی، مسیر پیشرفت تحقیقات را پیچیده میکند. آینده ایمنی زیستی وابسته به نوآوریهای فناوری، استانداردسازی جهانی، توسعه نیروی انسانی و ارتقای فرهنگ ایمنی است تا آزمایشگاهها بتوانند با حداکثر ایمنی و بهرهوری به تحقیقات علمی ادامه دهند.
در جمعبندی، میتوان گفت که سطوح ایمنی بیولوژیکی یک چارچوب جامع و پویا هستند که ترکیبی از تجهیزات فنی، استانداردهای مدیریتی، آموزش پرسنل و فرهنگ ایمنی را در بر میگیرند. این سیستمها نه تنها مانع بروز حوادث و انتشار عوامل زیستی میشوند، بلکه امکان انجام تحقیقات پیشرفته در حوزههای میکروبیولوژی، ویروسشناسی، بیوتکنولوژی و سایر علوم زیستی را فراهم میکنند. رعایت دقیق این استانداردها، همراه با ارزیابی مستمر ریسک و آموزش تخصصی، کلید موفقیت و حفاظت در آزمایشگاههای BSL محسوب میشود و جامعه علمی را قادر میسازد تا در محیطی امن، پژوهشهای نوآورانه و حیاتی برای سلامت عمومی انجام دهد.
در نهایت، این مرور جامع نشان داد که ایمنی زیستی بیش از یک الزام قانونی، یک فرهنگ، یک روش علمی و یک ابزار مدیریتی است. حفظ و ارتقای آن نیازمند همکاری بین کارشناسان، پژوهشگران، مدیران آزمایشگاهها و سیاستگذاران است تا تحقیقات علمی بتوانند با حداکثر ایمنی و حداقل ریسک برای جامعه و محیط زیست انجام شوند.