جهش ژنتیکی
جهشهای ژنتیکی (Genetic Mutations) بهعنوان تغییرات دائمی در توالی نوکلئوتیدی ژنوم (Permanent Alterations in the Nucleotide Sequence of the Genome) تعریف میشوند و پایه مولکولی تنوع ژنتیکی، تکامل و طیف وسیعی از بیماریهای ارثی (Molecular Basis for Genetic Diversity, Evolution, and a Wide Range of Hereditary Diseases) را تشکیل میدهند.
این تغییرات میتوانند در مقیاسهای مختلف (Various Scales) رخ دهند؛ از یک جفت باز واحد در یک ژن (Single Base Pair in a Gene) تا قطعات بزرگ کروموزومی (Large Segments of Chromosomes)، و پیامدهای آنها میتواند از بیضرر (Benign) تا بسیار مضر (Profoundly Deleterious) متفاوت باشد.
جهشها (Mutations) زمانی که در سلولهای جنسی (Germ Cells) رخ دهند، میتوانند نسلها را از طریق ارث منتقل کنند (Inherited Through Generations)، یا بهصورت خودبهخودی در سلولهای سوماتیک (Somatic Cells) در طول زندگی فرد ایجاد شوند و بالقوه به سرطان (Cancer) یا سایر اختلالات اکتسابی (Acquired Disorders) منجر شوند.
بنابراین، درک مکانیسمها و پیامدهای جهشهای ژنتیکی (Understanding the Mechanisms and Outcomes of Genetic Mutations) یک سنگ بنای زیستشناسی مولکولی، پزشکی و علم تکامل (Cornerstone of Molecular Biology, Medicine, and Evolutionary Science) است.
مطالعه جهشها زمینه تاریخی غنی دارد (The Study of Mutations Has a Rich Historical Context).
مشاهدات اولیه تغییرات ارثی در ویژگیها (Heritable Changes in Traits) باعث شد دانشمندانی مانند هوگو د وریس (Hugo de Vries) مفهوم “جهش (Mutation)” را بهعنوان یک پدیده متمایز از تغییرات تدریجی (Distinct Phenomenon Separate from Gradual Variation) مطرح کنند.
پیشرفتهای بعدی در ژنتیک، به ویژه کشف DNA بهعنوان ماده وراثتی (DNA as the Hereditary Material) و کشف ساختار دو رشتهای مارپیچ آن توسط واتسون و کریک (Double-Helical Structure by Watson and Crick)، چارچوب مولکولی برای درک چگونگی ایجاد و انتشار جهشها (How Mutations Arise and Are Propagated) فراهم آورد.
امروزه، جهشها نه تنها بهعنوان منبع بیماریهای ژنتیکی (Source of Genetic Disorders) شناخته میشوند، بلکه بهعنوان محرک نوآوریهای تکاملی (Drivers of Evolutionary Innovation) عمل میکنند و به جمعیتها امکان میدهند تا با تغییرات محیطی سازگار شوند (Populations Adapt to Changing Environments Over Time).
جهشها از طریق مکانیسمهای مختلف ایجاد میشوند (Mutations Arise Through a Variety of Mechanisms)، از جمله:
-
خطاهای حین تکثیر DNA (Errors During DNA Replication)
-
تغییرات شیمیایی خودبهخودی نوکلئوتیدها (Spontaneous Chemical Alterations of Nucleotides)
-
قرارگیری در معرض عوامل فیزیکی یا شیمیایی جهشزا (Exposure to Physical or Chemical Mutagens)
-
فعالیت عناصر ژنتیکی متحرک (Activity of Mobile Genetic Elements)
در حالی که برخی جهشها هیچ تأثیری بر فنوتیپ ارگانیسم (Organism’s Phenotype) ندارند (جهشهای خاموش یا خنثی – Silent or Neutral Mutations)، سایر جهشها میتوانند باعث تغییر در عملکرد پروتئینها (Changes in Protein Function)، اختلال در شبکههای تنظیمی (Disruption of Regulatory Networks) یا ناهنجاریهای کروموزومی (Chromosomal Abnormalities) شوند.
این اثرات دوگانگی ماهیت جهشها (Dual Nature of Mutations) را نشان میدهند: آنها هم ضروری برای تنوع زیستی (Essential for Biological Diversity) هستند و هم میتوانند برای سلامت فردی مضر باشند (Potentially Harmful to Individual Health).
اهمیت مطالعه جهشها در حوزههای مختلف زیستشناسی و پزشکی گسترده است (The Significance of Studying Mutations Extends Across Multiple Fields of Biology and Medicine):
-
ژنتیک پزشکی (Medical Genetics): شناسایی جهشهای بیماریزا به تشخیص (Diagnosis)، پیشآگهی (Prognosis) و توسعه درمانهای هدفمند (Targeted Therapies) کمک میکند.
-
زیستشناسی تکاملی (Evolutionary Biology): درک نرخها و الگوهای جهش (Mutation Rates and Patterns) به توضیح منشأ تنوع ژنتیکی (Origin of Genetic Variation)، رویدادهای گونهزایی (Speciation Events) و سازگاری (Adaptation) کمک میکند.
-
بیوتکنولوژی و کشاورزی (Biotechnology and Agriculture): ایجاد جهشهای کنترلشده (Controlled Induction of Mutations) به پژوهشگران اجازه میدهد ارگانیسمهایی با ویژگیهای بهبود یافته (Improved Traits) مانند محصولات مقاوم به بیماری (Disease-Resistant Crops) یا میکروبهای تولیدکننده آنزیمهای ارزشمند (Microbes Producing Valuable Enzymes) بسازند.
-
تحقیقات سرطان (Cancer Research): مطالعه جهشهای سوماتیک (Somatic Mutations) محرکهای مولکولی تومورزایی (Molecular Drivers of Tumorigenesis) را روشن میکند و هم استراتژیهای پیشگیری (Preventative Strategies) و هم مداخلات درمانی (Therapeutic Interventions) را راهنمایی میکند.
به طور کلی، جهشها صرفاً خطاهای تصادفی در ژنوم نیستند (Mutations Are Not Merely Random Errors in the Genome)؛ آنها رویدادهای بنیادی زیستی (Fundamental Biological Events) هستند که مسیر زندگی را شکل میدهند (Shape the Trajectory of Life).
با بررسی علل مولکولی، انواع و پیامدهای جهشهای ژنتیکی (Molecular Causes, Types, and Consequences of Genetic Mutations)، دانشمندان میتوانند بینشهای ارزشمندی درباره:
-
فرآیندهای تکاملی که تنوع زندگی روی زمین را ایجاد کردهاند (Evolutionary Processes Producing the Diversity of Life on Earth)
-
مکانیزمهای مولکولی سلامت و بیماری انسان (Molecular Underpinnings of Human Health and Disease)
به دست آورند.
این مقاله مروری جامع بر جهشهای ژنتیکی، طبقهبندی آنها، مکانیسمهای مولکولی، مثالها و اهمیتشان در زیستشناسی و پزشکی (Comprehensive Overview of Genetic Mutations, Their Classification, Molecular Mechanisms, Examples, and Significance in Biology and Medicine) ارائه میدهد.
۲. مکانیسمهای مولکولی جهش (Molecular Mechanisms of Mutation)
جهشها (Mutations) از مجموعهای از فرآیندهای مولکولی سرچشمه میگیرند که ساختار یا توالی طبیعی DNA را تغییر میدهند (Alter the Normal Structure or Sequence of DNA). این فرآیندها به طور کلی به دو گروه تقسیم میشوند:
-
خودبهخودی (Spontaneous): جهشهایی که ناشی از ویژگیهای بیوشیمیایی ذاتی نوکلئیک اسیدها و ماشین تکثیر (Replication Machinery) هستند.
-
القایی (Induced): جهشهایی که در اثر عوامل فیزیکی یا شیمیایی خارجی بهوجود میآیند و به DNA آسیب میزنند یا تکثیر دقیق آن را مختل میکنند (Damage DNA or Interfere with Accurate Duplication).
درک این مکانیسمها (Understanding These Mechanisms) برای تفسیر الگوهای جهشی در بیماریها (Interpreting Mutational Patterns in Disease)، تخمین نرخهای جهش تکاملی (Estimating Evolutionary Mutation Rates) و طراحی راهبردهای مؤثر در مهندسی ژنتیک و پزشکی (Designing Effective Strategies in Genetic Engineering and Medicine) ضروری است.
۲.۱ جهشهای خودبهخودی (Spontaneous Mutations)
جهشهای خودبهخودی (Spontaneous Mutations) بدون حضور یک عامل جهشزای خارجی رخ میدهند و نشاندهندهٔ ناپایداری ذاتی DNA (Intrinsic Instability of DNA) هستند. اگرچه سیستمهای ترمیم سلولی (Cellular Repair Systems) بیشتر خطاها را اصلاح میکنند، بخش کوچکی از آنها از نظارت میگریزد و در ژنوم تثبیت میشود (Becomes Fixed in the Genome).
خطاهای تکثیر (Replication Errors) مهمترین منبع جهشهای خودبهخودی هستند.
-
پلیمرازهای DNA (DNA Polymerases) دارای دقت فوقالعادهاند و فعالیت بازخوانی (Proofreading) دارند، اما کاملاً بیخطا نیستند.
-
احتمال جایگذاری اشتباه یک باز (Misincorporation of a Single Base) تقریباً یکبار در هر ۱۰⁷ تا ۱۰⁸ نوکلئوتید (Once in Every 10⁷ to 10⁸ Nucleotides) است.
-
نواحی حاوی تکرارهای کوتاه پشتسرهم (Short Tandem Repeats) یا رشتههای همولوپلیمری (Homopolymeric Runs) بهویژه در برابر لغزش پلیمراز (Polymerase Slippage) آسیبپذیرند که منجر به درج یا حذف واحدهای تکراری (Insertions or Deletions of Repeat Units) میشود—پدیدهای که بهعنوان لغزش همانندسازی (Replication Slippage) شناخته میشود.
-
چنین رخدادهایی علت بسیاری از بیثباتیهای میکروساتلایت (Microsatellite Instabilities) مشاهدهشده در برخی سرطانها (Cancers) هستند.
مکانیسم مهم دیگر جابجایی تاتومری (Tautomeric Shifting) است که در آن بازهای نوکلئوتیدی (Nucleotide Bases) بهطور موقت اشکال شیمیایی جایگزین یا تاتومرها (Tautomers) را میپذیرند و در طول همانندسازی با بازهای غیر مکمل (Non-Complementary Bases) جفت میشوند.
-
بهعنوان مثال، فرم نادر ایمینو آدنین (Rare Imino Form of Adenine) میتواند با سیتوزین (Cytosine) به جای تیمین (Thymine) جفت شود و پس از دور بعدی همانندسازی یک جهش انتقالی (Transition Mutation) ایجاد کند.
-
اگرچه این تغییرات تاتومری کوتاهعمر هستند، وقوع آنها شیمی پویای نوکلئوتیدها (Dynamic Chemistry of Nucleotides) را نشان میدهد که میتواند به تغییرات ژنتیکی پایدار (Stable Genetic Change) منجر شود.
تغییرات شیمیایی خودبهخودی بازها (Spontaneous Chemical Alterations of Bases) نیز به جهشزایی (Mutagenesis) کمک میکنند:
-
دیپوریناسیون (Depurination): حذف هیدرولیتیک یک باز پورینی که یک محل بدون باز (Abasic Site) ایجاد میکند و میتواند در هنگام ترمیم باعث درج تصادفی نوکلئوتید (Random Nucleotide Insertion) شود.
-
دیآمیناسیون (Deamination): سیتوزین را به یوراسیل (Uracil) تبدیل میکند که با آدنین (Adenine) جفت میشود و پس از همانندسازی منجر به یک انتقال C→T (C→T Transition) میگردد.
-
سیتوزینهای متیله (Methylated Cytosines) که در ژنومهای یوکاریوتی شایع هستند، بهویژه مستعد دیآمیناسیون به تیمین (Deamination to Thymine) هستند و بنابراین کانونهای داغ جهش (Hotspots for Mutation) ایجاد میکنند.
خطاهای حین نوترکیبی و ترمیم DNA (Errors During DNA Recombination and Repair) نیز میتوانند جهش ایجاد کنند.
-
ناهماهنگی کروموزومهای همولوگ در میوز (Misalignment of Homologous Chromosomes During Meiosis) میتواند منجر به تبادل نامساوی (Unequal Crossing-Over) شود و باعث تکثیر یا حذف بخشهای بزرگ ژنومی (Duplications or Deletions of Large Genomic Segments) گردد.
-
همچنین، عناصر ژنتیکی متحرک درونزا (Endogenous Mobile Genetic Elements) مانند رتروترانسپوزونها (Retrotransposons) میتوانند هنگام درج در مکانهای جدید ژنوم، توالیهای کدکننده یا تنظیمی (Coding or Regulatory Sequences) را مختل کنند.
۲.۲ جهشهای القایی (Induced Mutations)
جهشهای القایی (Induced Mutations) در اثر قرارگیری در معرض عوامل محیطی (Exposure to Environmental Agents) که به DNA آسیب میزنند یا دقت همانندسازی را تغییر میدهند (Alter Its Replication Fidelity) ایجاد میشوند. این جهشزاها میتوانند شیمیایی، فیزیکی یا زیستی (Chemical, Physical, or Biological) باشند.
جهشزاهای شیمیایی (Chemical Mutagens):
-
عوامل آلکیلهکننده (Alkylating Agents) مانند اتیل متانسولفونات – EMS (Ethyl Methanesulfonate) گروههای آلکیل را به بازها اضافه میکنند و اغلب ضایعاتی مانند O⁶-اتیلگوانین (O⁶-Ethylguanine) ایجاد میکنند که با تیمین (Thymine) به جای سیتوزین (Cytosine) جفت میشود.
-
آنالوگهای باز (Base Analogs) مانند ۵-برومواوراسیل (5-Bromouracil) بهاندازه کافی شبیه بازهای طبیعی هستند که در همانندسازی وارد میشوند، اما دارای خواص جفتشدن غیرطبیعی بوده و احتمال جهشهای انتقالی (Increase Transition Mutations) را بالا میبرند.
-
عوامل بینلایهای (Intercalating Agents) مانند اتیدیوم بروماید (Ethidium Bromide) یا آکرییدینها (Acridines) بین جفت بازهای پشتهای وارد میشوند و مارپیچ DNA را دچار اعوجاج (Distorting the Helix) کرده و اغلب منجر به درج یا حذف تکباز (Single-Base Insertions or Deletions) میشوند.
جهشزاهای فیزیکی (Physical Mutagens):
-
نور فرابنفش – UV (Ultraviolet Light) باعث ایجاد پیوندهای کووالانسی بین بازهای پیریمیدینی مجاور (Covalent Bonds Between Adjacent Pyrimidine Bases) شده و دایمرهای پیریمیدینی سیکلوبوتان (Cyclobutane Pyrimidine Dimers) و محصولات نوری 6-4 (6-4 Photoproducts) ایجاد میکند. در صورت عدم ترمیم، این آسیبها منجر به انتقالات مشخص C→T (Characteristic C→T Transitions) میشوند.
-
پرتوهای یونیزهکننده (Ionizing Radiation) مانند اشعه ایکس (X-Rays) و گاما (Gamma Rays) به عمق بافت نفوذ میکنند و گونههای فعال اکسیژن (Reactive Oxygen Species) تولید میکنند که به ستون فقرات DNA (DNA Backbone) حمله کرده و باعث شکستهای تکرشتهای و دورشتهای (Single- and Double-Strand Breaks)، حذفهای بزرگ (Large Deletions) و بازآراییهای کروموزومی (Chromosomal Rearrangements) میشوند.
عوامل زیستی (Biological Agents):
-
برخی ویروسها (Viruses) ژنوم خود را در DNA میزبان ادغام میکنند و گاهی ژنهای میزبان یا نواحی تنظیمی (Host Genes or Regulatory Regions) را مختل کرده و جهشزایی درج (Insertional Mutagenesis) را آغاز میکنند.
-
رتروویروسها (Retroviruses) از آنزیم ترانسکریپتاز معکوس (Reverse Transcriptase) استفاده میکنند که دقت پایینی (Relatively Low Fidelity) دارد و میتواند جهشهای بیشتری را حین ادغام ایجاد کند.
-
ترانسپوزونهای باکتریایی (Bacterial Transposons) و رتروالمانهای درونزا (Endogenous Retroelements) نیز در ژنوم جابهجا میشوند و گاهی موجب اختلال ژنی یا تغییر الگوهای بیان ژن (Gene Disruption or Altering Gene Expression Patterns) میشوند.
۲.۳ دفاع سلولی و ترمیم DNA (Cellular Defense and DNA Repair)
با وجود تعداد زیاد تهدیدات جهشزا، سلولها دارای سیستمهای ترمیم DNA پیچیده (Sophisticated DNA Repair Systems) هستند که پایداری ژنومی (Maintain Genomic Stability) را حفظ میکنند:
-
بازخوانی پلیمراز DNA (Proofreading by DNA Polymerase) بسیاری از جایگذاریهای اشتباه را بلافاصله شناسایی و اصلاح میکند.
-
ترمیم عدم تطابق پس از همانندسازی (Post-Replicative Mismatch Repair) خطاهایی را که از بازخوانی فرار میکنند با تشخیص اعوجاجهای مارپیچ DNA (Distortions in the DNA Helix) اصلاح میکند.
-
ترمیم برش بازها (Base-Excision Repair) بازهای آسیبدیده مانند یوراسیل (Uracil) یا گوانین اکسیدشده (Oxidized Guanine) را حذف میکند.
-
ترمیم برش نوکلئوتیدی (Nucleotide-Excision Repair) آدکتهای حجیم مانند دایمرهای پیریمیدینی ناشی از UV (UV-Induced Pyrimidine Dimers) را برمیدارد.
-
شکستهای دو رشتهای (Double-Strand Breaks) از طریق نوترکیبی همولوگ (Homologous Recombination) یا اتصال انتهای غیرهمولوگ (Non-Homologous End Joining) ترمیم میشوند.
زمانی که این مکانیسمها شکست بخورند یا تحت فشار شدید قرار گیرند (Fail or Are Overwhelmed)، جهشها به ویژگیهای دائمی ژنوم تبدیل شده و به تنوع ژنتیکی (Genetic Diversity) و بیماری (Disease) کمک میکنند.
۳. انواع جهشهای ژنتیکی (Types of Genetic Mutations)
جهشهای ژنتیکی (Genetic mutations) را میتوان از چندین دیدگاه مکمل دستهبندی کرد؛ از جمله مقیاس تغییر در DNA، اثر آن بر محصول ژنی و زمینهٔ ساختاری کروموزوم. این دستهبندیها اگرچه ممکن است همپوشانی داشته باشند، اما درک منظمی از نحوهٔ تغییر اطلاعات ژنتیکی و پیامدهای فنوتیپی آن فراهم میکنند. به طور کلی، جهشها از جایگزینی یک نوکلئوتید واحد تا بازآراییهای بزرگ کروموزومی متغیرند و هر دسته مکانیسمها، نتایج زیستی و نمونههای خاصی در سلامت انسان و تکامل دارد.
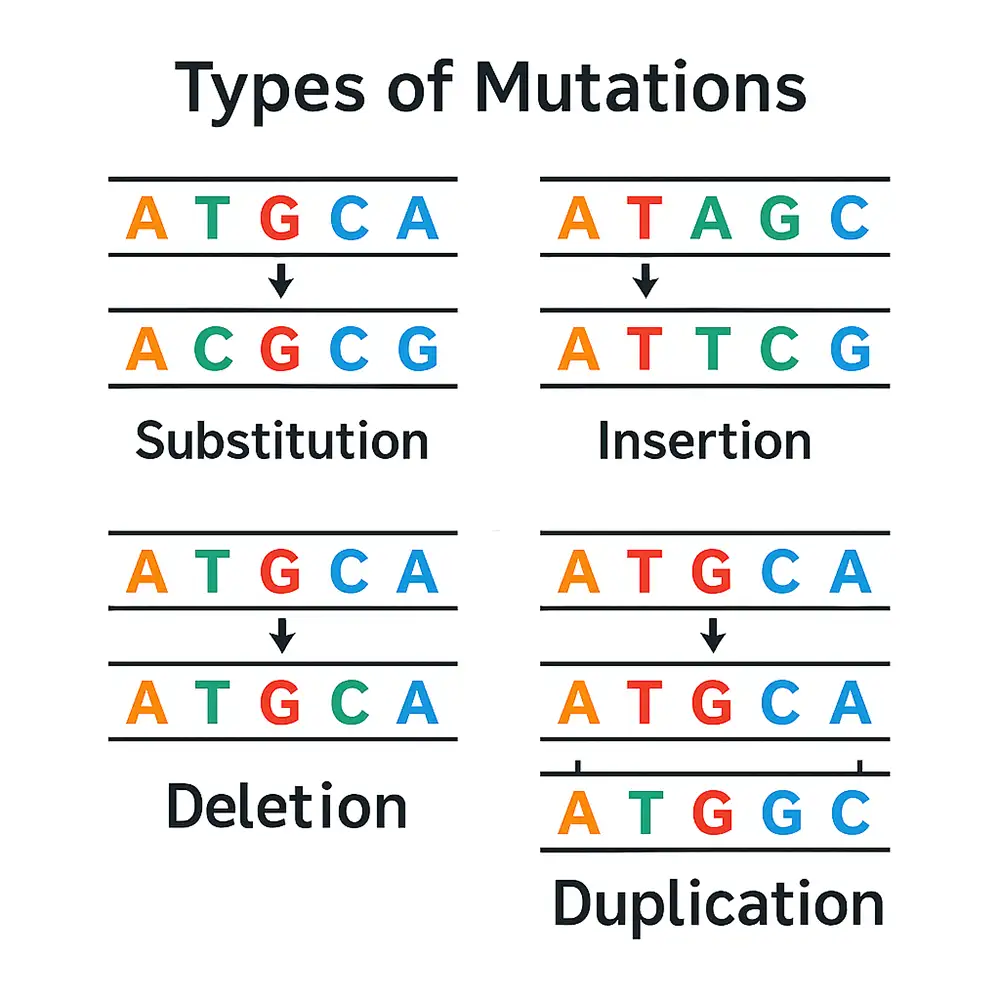
۳.۱ جهشهای نقطهای (Point Mutations)
جهش نقطهای (Point mutation) شامل تغییر یک جفت نوکلئوتیدی است و یکی از شایعترین انواع جهش محسوب میشود. این جهشها شامل جایگزینی بازها (Base substitution) یا درج و حذفهای کوچک (Small insertions or deletions) در حد یک نوکلئوتید هستند.
-
جایگزینی باز (Base substitution) به دو نوع تقسیم میشود:
-
گذار (Transition): جایگزینی یک پورین با پورین دیگر (A↔G) یا یک پیریمیدین با پیریمیدین دیگر (C↔T).
-
تبدیل (Transversion): جایگزینی یک پورین با پیریمیدین یا برعکس (A یا G ↔ C یا T).
هرچند تفاوت شیمیایی این دو نوع ممکن است ظریف بهنظر برسد، اما اثرات زیستی آنها بسته به کدون (Codon) و زمینهٔ ژنومی میتواند بسیار متفاوت باشد.
-
-
اثر عملکردی جهش نقطهای بستگی به تغییر در پروتئین دارد:
-
جهش خاموش (Silent mutation): تغییر توالی DNA بدون تغییر اسیدآمینه، معمولاً بهدلیل دژنراسی کد ژنتیکی (Degeneracy of genetic code) است. مثال: GAA→GAG همچنان اسید گلوتامیک را کد میکند.
-
جهش جابهجاکننده یا میسسِنس (Missense mutation): جایگزینی یک اسیدآمینه با دیگری که میتواند از خنثی تا مخرب متغیر باشد. نمونهٔ کلاسیک آن کمخونی داسی شکل (Sickle-cell anemia) است که در آن یک تغییر A→T در ژن β-globin باعث تبدیل کدون گلوتامیک اسید به والین (GAG→GTG) میشود.
-
جهش بیمعنی یا نانسِنس (Nonsense mutation): تبدیل یک کدون اسیدآمینه به کدون پایان زودرس و ایجاد پروتئین ناقص. بیماری دیستروفی عضلانی دوشن (Duchenne muscular dystrophy) اغلب از این نوع است.
-
۳.۲ درج و حذفهای کوچک (Small Insertions and Deletions – Indels)
ایندل (Indel) جهشی است که یک یا چند نوکلئوتید را حذف یا اضافه میکند. اثر آن به این بستگی دارد که تعداد نوکلئوتیدهای حذف یا اضافه شده مضرب سه هست یا خیر.
-
اگر مضرب سه نباشد، جهش تغییر چارچوب (Frameshift mutation) رخ میدهد که چارچوب خوانش کدونها را برهم میزند و معمولاً باعث توقف زودرس ترجمه و تولید پروتئین ناقص میشود. مثال: بیماری تایساکس (Tay–Sachs disease) با درج چهار باز در ژن HEXA.
-
ایندل درونچارچوب (In-frame indel): وقتی تعداد نوکلئوتیدهای درج یا حذف مضرب سه است و چارچوب حفظ میشود ولی اسیدآمینه اضافه یا حذف میگردد. مثال: شایعترین جهش در سیستیک فیبروز (Cystic fibrosis) جهش ΔF508 در ژن CFTR است که سه نوکلئوتید حذف و یک فنیلآلانین را از دست میدهد ولی چارچوب حفظ میشود.
۳.۳ جهشهای گسترش تکرار (Repeat Expansion Mutations)
برخی نواحی ژنوم دارای تکرارهای کوتاه پشت سرهم (Short tandem repeats) مثل ترینوکلئوتیدی (Trinucleotide) یا هگزانوکلئوتیدی (Hexanucleotide) هستند که در همانندسازی میتوانند بیش از حد گسترش یابند. این جهشهای گسترش تکرار (Repeat expansion) سبب بیماریهای داینامیک (Dynamic mutations) میشوند.
-
شدت بیماری غالباً با طول تکرار رابطه دارد و در نسلهای بعد تشدید میشود که به آن آنتیسیپیشن (Anticipation) میگویند.
-
نمونهها:
-
بیماری هانتینگتون (Huntington’s disease) با گسترش تکرار CAG در ژن HTT.
-
سندرم ایکس شکننده (Fragile X syndrome) و دیستروفی میوتونیک (Myotonic dystrophy).
-
۳.۴ جهشهای ساختاری کروموزومی (Structural Chromosomal Mutations)
در مقیاس بزرگتر، تغییرات قابلمشاهده در ساختار کروموزوم که چندین ژن را تحت تأثیر میگذارند شامل:
-
حذف (Deletion): حذف یک بخش از کروموزوم، مانند سندرم کری دو شا (Cri-du-chat) با از دست رفتن بازوی کوتاه کروموزوم ۵.
-
تکرار (Duplication): کپی اضافی از بخش کروموزوم، مانند بیماری شارکو–ماری–توت نوع 1A (Charcot–Marie–Tooth disease) با تکرار 1.5 مگابازی شامل ژن PMP22.
-
وارونگی (Inversion): قطعهای از کروموزوم جدا و در جهت معکوس درج میشود. نمونه: برخی موارد هموفیلی A (Hemophilia A) با وارونگی ژن Factor VIII.
-
تبادل یا جابجایی (Translocation): تبادل بخشهایی بین کروموزومهای غیرهمولوگ. جابجایی متعادل ممکن است بدون علامت باشد اما باعث ناباروری یا فرزند نامتعادل شود. نمونه مهم: کروموزوم فیلادلفیا (Philadelphia chromosome) حاصل جابجایی t(9;22) که ژن ترکیبی BCR-ABL را ایجاد میکند و در لوسمی میلوئیدی مزمن (Chronic myelogenous leukemia) دیده میشود.
۳.۵ درج عناصر متحرک (Mobile Element Insertions)
ژنوم انسان دارای عناصر قابلانتقال (Transposable elements) است که میتوانند در مکانهای جدید درج شوند. هرچند بیشتر آنها غیرفعالاند، برخی مانند Alu یا LINE-1 هنوز توانایی رتروترانسپوزیشن (Retrotransposition) دارند.
-
درج این عناصر ممکن است توالیهای کدکننده را مختل یا تنظیم ژنی (Gene regulation) را تغییر دهد. مثال: درج عنصر Alu در ژن NF1 که موجب نوروفیبروماتوز نوع ۱ (Neurofibromatosis type 1) میشود.
-
این عناصر با ترویج نوترکیبی (Recombination) و تکثیر ژنی (Gene duplication)، منبعی برای نوآوری ژنومی هستند.
۳.۶ طبقهبندی عملکردی جهشها (Functional Classification of Mutations)
علاوه بر ساختار، جهشها بر اساس اثر بر عملکرد ژن (Gene function) نیز دستهبندی میشوند:
-
از دست دادن عملکرد (Loss-of-function): کاهش یا حذف فعالیت پروتئین و اغلب وراثت مغلوب.
-
کسب عملکرد (Gain-of-function): ایجاد فعالیت جدید یا تقویت فعالیت موجود، مثل جهشهای ژن LRP5 که تراکم استخوان را افزایش میدهد.
-
غالب منفی (Dominant-negative): تولید پروتئین جهشیافته که عملکرد پروتئین سالم را مختل میکند، مانند برخی انواع استئوژنز ایمپرفکتا (Osteogenesis imperfecta).
۳.۷ جهشهای سوماتیک و زایشی (Somatic vs. Germline Mutations)
-
جهش زایشی (Germline mutation): در سلولهای تخمک یا اسپرم رخ میدهد و به نسل بعد منتقل میشود، تمام سلولهای فرزند را تحت تأثیر قرار میدهد.
-
جهش سوماتیک (Somatic mutation): در سلولهای غیرتولیدی ایجاد میشود و ارثی نیست اما میتواند باعث سرطان شود. مثال: جهشهای سوماتیک در ژن TP53 که در بسیاری از تومورها به افزایش تقسیم سلولی منجر میشود.
۴. جهشها در تکامل (Mutations in Evolution)
جهشها (Mutations) منبع نهایی تمام تنوع ژنتیکی (Genetic variation) هستند و بنابراین نقش مرکزی در فرآیند تکامل (Evolution) دارند. انتخاب طبیعی (Natural selection)، رانش ژنتیکی (Genetic drift) و جریان ژنی (Gene flow) بر تنوعی عمل میکنند که توسط جهشها ایجاد میشود؛ اما بدون ورود مداوم اللهای جدید (Novel alleles) از طریق جهش، تغییرات تکاملی در نهایت متوقف میشود.
هرچند بیشتر جهشها خنثی (Neutral) یا مضر (Deleterious) هستند، جهشهای مفید و سودمند (Advantageous/Beneficial mutations) میتوانند در یک جمعیت تثبیت شوند و مواد اولیهٔ لازم برای سازگاری با محیطهای در حال تغییر را فراهم کنند. به همین دلیل، مطالعهٔ فرآیندهای جهشی برای درک پویایی تکاملی (Evolutionary dynamics)، از پیدایش مقاومت آنتیبیوتیکی در باکتریها تا تنوعیافتن موجودات پرسلولی پیچیده، اساسی است.
۴.۱ جهش به عنوان منبع تنوع ژنتیکی (Mutation as a Source of Genetic Variation)
در سطح مولکولی، هر الل (Allele) موجود در جمعیتهای امروزی از یک جهش اجدادی (Ancestral mutation) منشأ گرفته است.
-
جهشهای نقطهای (Point mutations)، درجها (Insertions)، حذفها (Deletions) و بازآراییهای کروموزومی بزرگ (Large chromosomal rearrangements) توالیهای جدید DNA ایجاد میکنند که میتواند ناحیههای کدکنندهٔ پروتئین (Protein-coding regions)، عناصر تنظیمی (Regulatory elements) یا RNAهای غیرکدکننده (Noncoding RNAs) را تغییر دهد.
-
در مقیاسهای زمانی طولانی، این تغییرات انباشته میشوند و بستر لازم برای نوآوریهای تکاملی را فراهم میکنند.
مثال مهم: تکرار ژنی (Gene duplication) و سپس واگرایی ژنی (Divergence) منجر به شکلگیری خانوادههای ژنی مانند هموگلوبین و گلوبین (Hemoglobin/Globin gene families) شده است که تخصصهای عملکردی جدیدی ایجاد میکنند.
نکته کلیدی: بدون تولید مداوم تنوع ژنتیکی توسط جهش، انتخاب طبیعی مادهای برای عمل کردن نخواهد داشت.
۴.۲ جهشهای تطبیقی و سودمند (Adaptive and Beneficial Mutations)
اگرچه بیشتر جهشهای جدید خنثی یا مضر هستند، گاهی جهشهای مفید (Beneficial mutations) ویژگیهایی میبخشند که برازش (Fitness) ارگانیسم را در یک محیط خاص افزایش میدهد.
-
زمانی که چنین جهشی رخ دهد، انتخاب طبیعی (Natural selection) میتواند آن را به فراوانی بالا یا تثبیت (Fixation) برساند.
نمونهها:
-
پایداری لاکتاز (Lactase persistence) در برخی جمعیتهای انسانی: یک جهش تنظیمی (Regulatory mutation) در ناحیهٔ پروموتر (Promoter region) ژن LCT باعث میشود آنزیم لاکتاز (Lactase) در بزرگسالی نیز بیان شود و هضم لاکتوز ممکن گردد. این ویژگی در جوامعی که دامداری داشتهاند، مزیت تغذیهای ایجاد کرده است.
-
مقاومت آنتیبیوتیکی (Antibiotic resistance) در باکتریها: اغلب با یک جهش نقطهای (Point mutation) در ژن هدف آغاز میشود. برای نمونه، جهش در ژن rpoB باکتری Mycobacterium tuberculosis مقاومت به ریفامپیسین (Rifampicin) ایجاد میکند.
این نمونهها نشان میدهند که یک تغییر ژنتیکی منفرد میتواند بقا و موفقیت تولیدمثلی را بهطور چشمگیری دگرگون کند.
۴.۳ جهشهای خنثی و تکامل مولکولی (Neutral Mutations and Molecular Evolution)
بخش بزرگی از جهشها عملاً خنثی (Neutral) هستند؛ نه مفید و نه مضر.
-
این جهشها بهویژه در ناحیههای غیرکدکننده (Noncoding regions) یا جهشهای کدونهای مترادف (Synonymous codon changes) رخ میدهند.
-
چنین جهشهایی عمدتاً از طریق رانش ژنتیکی (Genetic drift)—یعنی نوسانات تصادفی فراوانی اللها در طول نسلها—انباشت میشوند.
نظریهٔ خنثی تکامل مولکولی (Neutral theory of molecular evolution) که توسط موتو کیمورا (Motoo Kimura) ارائه شد، بیان میکند که بیشتر تنوع ژنتیکی درون و میان گونهها ناشی از تثبیت جهشهای خنثی است، نه انتخاب مثبت.
-
شواهد: نرخ تقریباً ثابت جایگزینی خنثی (Neutral substitutions) در بسیاری از ژنهای کدکنندهٔ پروتئین که اساس ساعت مولکولی (Molecular clock) برای تخمین زمانهای واگرایی بین گونههاست.
۴.۴ جهشها، گونهزایی و ماکروتکامل (Mutations, Speciation, and Macroevolution)
جهشها نه تنها محرک تغییرات ریزتکاملی (Microevolutionary changes) درون جمعیتها هستند، بلکه در گونهزایی (Speciation) و نوآوریهای ماکروتکاملی (Macroevolutionary innovations) نیز نقش دارند.
-
انزوای تولیدمثلی (Reproductive isolation) زمانی پدید میآید که جهشها تجمع یافته و جریان ژنی (Gene flow) بین جمعیتها را کاهش دهند و نهایتاً منجر به شکلگیری گونههای جدید شوند.
-
در گیاهان، بازآراییهای کروموزومی (Chromosomal rearrangements) مانند وارونگی (Inversions) و جابجایی (Translocations) میتواند ناسازگاریهای هیبریدی ایجاد کند.
-
در جانوران، تغییرات در ژنهای تکوینی کلیدی (Key developmental genes) ممکن است زمان تولیدمثل یا مورفولوژی را تغییر دهد.
در مقیاسهای طولانیتر، جهش در عناصر تنظیمی ژنهای تکوینی (Regulatory elements of developmental genes)—که گاه تغییرات اِوو-دِوو (Evo-devo changes) نامیده میشوند—در شکلگیری طرحهای بدنی (Body plans) و ساختارهای نوین مانند تکامل اندامهای مهرهداران (Vertebrate limbs) یا بالهای حشرات (Insect wings) حیاتی بودهاند.
۴.۵ تعادل بین جهش و انتخاب (Balancing Mutation and Selection)
تعامل بین جهش و انتخاب (Mutation–selection balance) بار ژنتیکی یک جمعیت را تعیین میکند.
-
جهشهای مضر (Deleterious mutations) بهطور مداوم پدید میآیند اما انتخاب طبیعی (Natural selection) برای حذف آنها عمل میکند.
-
تعادل این دو نیرو بر سلامت کلی ژنتیکی و حفظ تنوع اثر میگذارد.
مثال مهم: برتری هتروزیگوت (Heterozygote advantage) میتواند اللهایی را که در حالت هموزیگوت مضر هستند، حفظ کند. الل کمخونی داسی شکل (Sickle-cell allele) در ژن HBB نمونهای کلاسیک است؛ افراد هتروزیگوت در برابر مالاریا (Malaria) مقاومترند، بنابراین این الل علیرغم اثرات زیانآور در هموزیگوتها در مناطق بومی مالاریا پایدار میماند.
۴.۶ تکامل نرخ جهش (Mutation Rate Evolution)
نرخ جهش خود نیز میتواند تکامل یابد (Evolve).
-
ارگانیسمهای با اندازهٔ جمعیت مؤثر بزرگ (Large effective population size)—مانند بسیاری از میکروبها—معمولاً نرخ جهش کمتر در هر نسل دارند، زیرا انتخاب طبیعی (Natural selection) بهطور مؤثر اللهای موتاتور (Mutator alleles) را که باعث افزایش جهشهای مضر میشوند حذف میکند.
-
برعکس، در محیطهای بهسرعت در حال تغییر، نرخ جهش بالاتر (Higher mutation rate) میتواند مزیت ایجاد کند، همانگونه که در برخی جمعیتهای ویروسی (Viral populations) دیده میشود.
نکته کلیدی: تعادل بین پایداری ژنوم (Genome stability) و سازگاری (Adaptability) یک ویژگی تکاملی است که با بافت بومشناختی و تولیدمثلی (Ecological and reproductive context) هر گونه شکل میگیرد.
۵. جهشها (Mutations) در بیماریهای انسانی
جهشها (Mutations) در قلب طیف وسیعی از بیماریهای انسانی قرار دارند؛ از اختلالات تکژنی (Monogenic disorders) نادر گرفته تا بیماریهای پیچیده چندژنی (Polygenic conditions) و سرطان (Cancer). برخی جهشها به صورت ارثی (Inherited) از گامت والدین (Parental germline) منتقل میشوند و از همان زمان لقاح در بدن حضور دارند، در حالی که برخی دیگر در طول زندگی فرد به شکل جهشهای سوماتیک (Somatic mutations) رخ میدهند. مطالعهٔ این تغییرات برای ژنتیک پزشکی (Medical genetics) بسیار حیاتی است و دیدگاههای مهمی برای تشخیص (Diagnosis)، پیشآگهی (Prognosis) و توسعه درمان (Therapeutic development) فراهم میکند. درک شیوههای گوناگون مشارکت جهشها در بیماری به پزشکان و پژوهشگران کمک میکند تا ریشههای مولکولی (Molecular origins) آسیبشناسی را شناسایی کرده و راهبردهای پیشگیری یا درمان را طراحی کنند.
۵.۱ اختلالات تکژنی (Monogenic Disorders)
بسیاری از بیماریها ناشی از جهش در یک ژن منفرد هستند که به آنها اختلالات تکژنی (Monogenic disorders) گفته میشود. این شرایط اغلب از الگوهای وراثتی مندلی (Mendelian inheritance) — شامل اتوزومال غالب (Autosomal dominant)، اتوزومال مغلوب (Autosomal recessive) یا وابسته به X (X-linked) — پیروی میکنند و معمولاً ناشی از جهشهای از دستدادن عملکرد (Loss-of-function) یا کسب عملکرد (Gain-of-function) هستند.
-
فیبروز کیستیک (Cystic fibrosis) نمونه کلاسیک است: بیشتر موارد ناشی از یک حذف سه نوکلئوتیدی (Three-base deletion) موسوم به ΔF508 در ژن CFTR است که یک کانال کلرید (Chloride channel) حیاتی برای تعادل مایعات در بافتهای اپیتلیالی را کد میکند. این جهش منجر به اختلال در تاخوردگی پروتئین (Protein folding) و انتقال آن شده و باعث تجمع مخاط غلیظ (Thick mucus) در ریهها و دستگاه گوارش میشود.
-
نمونه دیگر کمخونی داسی شکل (Sickle-cell anemia) است که در آن یک جایگزینی تک نوکلئوتید (Single nucleotide substitution) در ژن β-گلوبین (HBB) اسید آمینه گلوتامیک اسید (Glutamic acid) را به والین (Valine) تغییر میدهد و هموگلوبین S تولید میکند. این نوع هموگلوبین در شرایط کماکسیژن پلیمریزه شده، گلبولهای قرمز را داسی شکل کرده و موجب کمخونی همولیتیک (Hemolytic anemia)، درد شدید (Pain crises) و آسیب اندامی (Organ damage) میشود.
دیگر اختلالات تکژنی نیز تنوع مکانیسمهای مولکولی ایجاد بیماری را نشان میدهند:
-
فنیلکتونوریا (Phenylketonuria / PKU) حاصل انواع جهشهای میسسنس (Missense)، نانسنس (Nonsense) و اسپلایسینگ (Splicing) در ژن PAH است که آنزیم فنیلآلانین هیدروکسیلاز (Phenylalanine hydroxylase) را کد میکند. کاهش فعالیت آنزیمی باعث تجمع فنیلآلانین و در صورت عدم درمان، ناتوانی ذهنی (Intellectual disability) میشود.
-
در مقابل، بیماری هانتینگتون (Huntington’s disease) نمونهای از جهش کسب عملکرد (Gain-of-function) است: گسترش تکرار سهنوکلئوتیدی CAG (CAG trinucleotide repeat expansion) در ژن HTT منجر به تولید پروتئین هانتینگتین (Huntingtin protein) با دنباله پلیگلوتامین (Polyglutamine tract) طولانی شده و موجب نورودژنراسیون پیشرونده (Progressive neurodegeneration) میشود.
۵.۲ ناهنجاریهای کروموزومی (Chromosomal Abnormalities)
علاوه بر نقصهای تکژنی، جهشها میتوانند بخشهای بزرگی از DNA یا حتی کل کروموزومها را تحت تأثیر قرار دهند و سبب ناهنجاریهای ساختاری یا عددی (Structural or numerical abnormalities) شوند.
-
آنیوپلوئیدی (Aneuploidy) به معنای وجود تعداد غیرطبیعی کروموزوم است که اغلب از عدم جدایش میوزی (Meiotic nondisjunction) ناشی میشود. رایجترین آن تریزومی ۲۱ (Trisomy 21) است که باعث سندرم داون (Down syndrome) میشود؛ این سندرم با ناتوانی ذهنی (Intellectual disability)، ویژگیهای چهره متمایز (Distinctive facial features) و افزایش خطر نقایص مادرزادی قلب (Congenital heart defects) همراه است.
-
نمونههای دیگر شامل سندرم ترنر (Turner syndrome / Monosomy X) و سندرم کلاینفلتر (Klinefelter syndrome / XXY) است که هر دو بر تکامل جنسی (Sexual development) و باروری (Fertility) تأثیر میگذارند.
بازآراییهای ساختاری (Structural rearrangements) — شامل حذف (Deletions)، تکرار (Duplications)، وارونگی (Inversions) و تبادل قطعهای (Translocations) — نیز میتوانند با تغییر دوز ژنی (Gene dosage) یا اختلال در جایگاههای حیاتی بیماری ایجاد کنند.
-
سندرم کری دو شا (Cri-du-chat syndrome) به دلیل حذف بازوی کوتاه کروموزوم ۵ ایجاد شده و منجر به تأخیر شدید تکاملی (Severe developmental delays) و گریهٔ بلند شبیه گربه میشود.
-
بیماری شارکوت–ماری–توت نوع 1A (Charcot–Marie–Tooth disease type 1A) اغلب ناشی از تکرار ژن PMP22 است که دوز ژنی را افزایش داده و تشکیل میلین (Myelin) را مختل میکند.
-
برخی سرطانها در اثر ترانسلوکاسیونهای متعادل (Balanced translocations) ایجاد میشوند. مثال کلاسیک، کروموزوم فیلادلفیا (Philadelphia chromosome) است که از ترانسلوکاسیون متقابل (Reciprocal translocation) بین کروموزومهای ۹ و ۲۲ حاصل شده و ژنهای BCR و ABL را ترکیب میکند و یک تیرزین کیناز (Tyrosine kinase) با فعالیت مداوم ایجاد میکند که عامل لوسمی میلوئیدی مزمن (Chronic myelogenous leukemia / CML) است.
۵.۳ جهشهای سوماتیک (Somatic Mutations) و سرطان (Cancer)
سرطان اساساً بیماری جهشهای سوماتیک است. در طول زندگی، سلولها دچار آسیب DNA (DNA damage) ناشی از خطاهای همانندسازی، مواد سرطانزا (Carcinogens) محیطی و گونههای فعال اکسیژن (Reactive oxygen species) میشوند. زمانی که این جهشها ژنهای کلیدی تنظیم رشد و بقا — مانند انکوژنها (Oncogenes)، ژنهای سرکوبگر تومور (Tumor suppressor genes) و ژنهای ترمیم DNA (DNA repair genes) — را تحت تأثیر قرار دهند، سلولها مزیت رشد انتخابی (Selective growth advantage) پیدا کرده و در نهایت منجر به بدخیمی میشوند.
-
جهش در ژن TP53 که پروتئین سرکوبگر p53 را کد میکند، از شایعترین جهشها در سرطانهای انسانی است و توانایی سلول برای توقف چرخه سلولی (Cell-cycle arrest) یا آغاز آپوپتوز (Apoptosis) در پاسخ به آسیب DNA را تضعیف میکند.
-
جهشهای فعالکننده (Activating mutations) در انکوژن KRAS باعث فعالسازی کنترلنشده مسیر RAS–MAPK در سرطانهای پانکراس، ریه و روده بزرگ میشود.
-
همچنین، جهش در ژنهای ترمیم عدم تطابق DNA (Mismatch-repair genes) مانند MLH1 و MSH2 منجر به بیثباتی میکروساتلایت (Microsatellite instability) شده و خطر ابتلا به سرطان کولورکتال غیرپولیپی ارثی (Lynch syndrome) را افزایش میدهد.
مدل چندمرحلهای سرطانزایی (Multistep carcinogenesis) تأکید میکند که سرطان معمولاً از تجمع متوالی چندین جهش پدید میآید. بهعنوان مثال، پیشرفت سرطان کولورکتال اغلب با جهش در ژن APC آغاز، با فعالسازی KRAS ادامه یافته و در نهایت با از دست رفتن TP53 کامل میشود.
پیشرفت فناوری توالییابی با توان بالا (High-throughput sequencing) چشمانداز گستردهای از جهشهای محرک (Driver mutations) — که مستقیماً تومورزایی را هدایت میکنند — و جهشهای مسافر (Passenger mutations) — که بازتاب بیثباتی ژنومی هستند — آشکار کرده است. این دانش، توسعه درمانهای هدفمند مانند مهارکنندههای تیروزین کیناز (Tyrosine kinase inhibitors) برای تومورهای دارای جهشهای BCR-ABL یا EGFR را امکانپذیر ساخته است.
۵.۴ جهشها در بیماریهای چندعاملی و پیچیده
بسیاری از بیماریهای شایع — از جمله دیابت (Diabetes)، بیماریهای قلبیعروقی (Cardiovascular diseases) و اختلالات خودایمنی (Autoimmune conditions) — چندعاملی (Multifactorial) هستند و از تعامل چندین واریانت ژنتیکی (Genetic variants) و عوامل محیطی پدید میآیند. اگرچه هیچ جهش منفردی بهتنهایی مسئول نیست، برخی آللها (Alleles) میتوانند خطر بیماری را به طور قابل توجهی افزایش دهند.
مطالعات ارتباط سراسر ژنومی (Genome-wide association studies / GWAS) تعداد زیادی پلیمورفیسم تکنوکلئوتیدی (Single-nucleotide polymorphisms / SNPs) شناسایی کردهاند که خطر بیماریهایی چون دیابت نوع ۲ (Type 2 diabetes)، بیماری کرون (Crohn’s disease) و اسکیزوفرنی (Schizophrenia) را اندکی افزایش میدهند. این واریانتها اغلب در ناحیههای تنظیمی (Regulatory regions) قرار دارند و بر بیان ژن (Gene expression) اثر میگذارند نه ساختار پروتئین. اثر هر واریانت ممکن است کوچک باشد اما اثر ترکیبی (Combined impact) آنها بههمراه سبک زندگی و عوامل محیطی، حساسیت کلی (Overall susceptibility) فرد را شکل میدهد.
۵.۵ پیامدها برای تشخیص و درمان
شناخت پایه ژنتیکی بیماریهای انسانی تحولی عظیم در عمل بالینی (Clinical practice) ایجاد کرده است. ابزارهای تشخیص مولکولی (Molecular diagnostics) مانند توالییابی سنگر (Sanger sequencing)، توالییابی نسل جدید (Next-generation sequencing / NGS) و آزمونهای مبتنی بر PCR شناسایی دقیق جهشهای بیماریزا را امکانپذیر کرده و به تشخیص زودهنگام (Early diagnosis) و غربالگری ناقلین (Carrier screening) کمک میکنند.
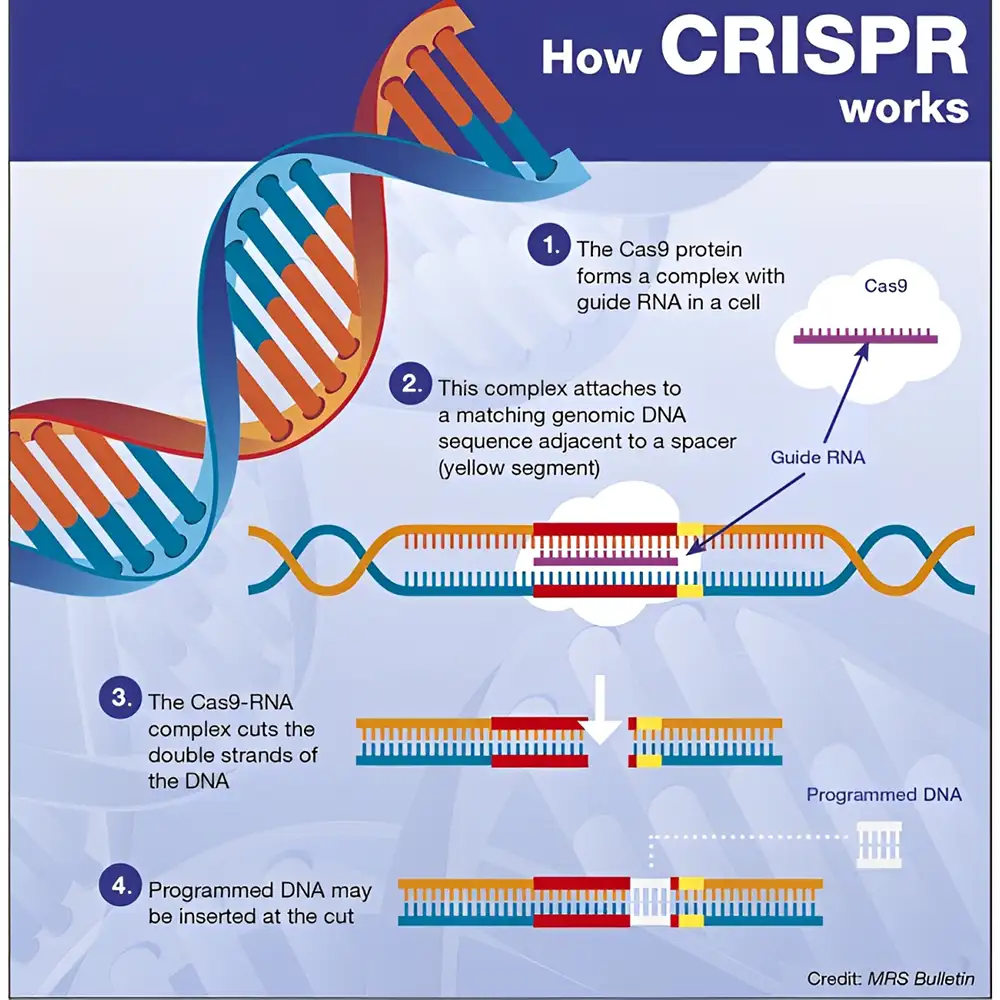
در انکولوژی، توالییابی DNA تومور انتخاب درمان هدفمند (Targeted therapy selection) و پیشآگهی (Prognosis) را هدایت میکند. پیشرفتهای ویرایش ژن (Genome editing)، به ویژه سیستم کریسپر–کاس۹ (CRISPR–Cas9)، افقهای جدیدی برای اصلاح جهشهای بیماریزا (Correction of pathogenic mutations) گشوده است.
برای نمونه، کارآزماییهای بالینی در حال بررسی درمانهای مبتنی بر کریسپر برای کمخونی داسی شکل هستند که با فعالسازی هموگلوبین جنینی (Fetal hemoglobin reactivation) عمل میکنند. رویکردهای ژندرمانی (Gene therapy) با استفاده از وکتورهای ویروسی (Viral vectors) پیشتر در بیماریهایی مانند آموروز مادرزادی لبر (Leber congenital amaurosis) و آتروفی عضلانی نخاعی (Spinal muscular atrophy) موفقیتآمیز بودهاند.
این پیشرفتها نشان میدهند که درک عمیق جهشها نه تنها مکانیسمهای بیماری (Disease mechanisms) را روشن میکند، بلکه نیروی محرکهای برای درمانهای نوآورانه (Innovative treatments) نیز محسوب میشود.
۶. شناسایی و تحلیل جهشهای ژنتیکی (Detection and Analysis of Mutations)
تشخیص دقیق و تحلیل جهشهای ژنتیکی پایهایترین بخش در ژنتیک (Genetics)، زیستشناسی مولکولی (Molecular Biology) و پزشکی بالینی (Clinical Medicine) است. شناسایی جهشها به پژوهشگران کمک میکند تا روابط تکاملی (Evolutionary Relationships) را ردیابی کنند، سازوکارهای بیماری (Disease Mechanisms) را بفهمند و درمانهای هدفمند (Targeted Therapies) طراحی نمایند. در چند دههی اخیر، پیشرفتهای فناورانه، روشهای شناسایی جهش را از روشهای سنتی و کموضوح (Low-Resolution Classical Methods) به پلتفرمهای خودکار با توان عملیاتی بالا (High-Throughput Platforms) تغییر داده است که میتوانند کل ژنوم (Whole Genome) را با سرعت و دقت چشمگیر (Remarkable Speed and Accuracy) بررسی کنند.
۶.۱ روشهای کلاسیک و سیتوژنتیکی (Classical and Cytogenetic Approaches)
روشهای اولیهی شناسایی جهش بر تکنیکهای سیتوژنتیکی (Cytogenetic Techniques) متکی بودند که قادر به مشاهدهی کل کروموزومها یا قطعات بزرگ کروموزومی هستند.
-
کاریوتایپینگ (Karyotyping): شامل رنگآمیزی و بررسی میکروسکوپی کروموزومهای مرحلهی متافاز است و همچنان ابزاری اساسی برای تشخیص آنئوپلوئیدیها (Aneuploidies) مانند تریزومی ۲۱ (Trisomy 21) یا بازآراییهای ساختاری (Structural Rearrangements) مثل ترانسلوکیشن (Translocation)، اینورژن (Inversion) و حذفهای بزرگ (Large Deletions) به شمار میرود.
-
فلورسانس در هیبریداسیون درجا (Fluorescence in situ Hybridization – FISH): حساسیت تشخیص را با استفاده از پروبهای DNA فلورسانسدار (Fluorescent DNA Probes) که به مناطق خاص کروموزومی متصل میشوند، افزایش داد. این روش میتواند حذفها یا دوپلیکاسیونهای زیرمیکروسکوپی (Submicroscopic Deletions/Duplications) را شناسایی کرده و وجود ژنهای فیوژن (Fusion Genes) مثل BCR-ABL در لوسمی میلوئید مزمن (Chronic Myelogenous Leukemia) را تأیید کند.
نکته مهم: گرچه این روشها در مقایسه با فناوریهای توالییابی جدید وضوح پایینتری (Lower Resolution) دارند، اما در تشخیصهای بالینی (Clinical Diagnostics) برای شناسایی ناهنجاریهای بزرگ کروموزومی همچنان ارزشمند هستند.
۶.۲ واکنش زنجیرهای پلیمراز و توالییابی سنگر (Polymerase Chain Reaction – PCR & Sanger Sequencing)
ورود واکنش زنجیرهای پلیمراز (PCR) انقلاب بزرگی در شناسایی جهشها ایجاد کرد، زیرا امکان تکثیر سریع نواحی خاص DNA از مقادیر اندک نمونه را فراهم نمود.
-
PCR، آنالیز هدفمند ژنها یا لوکوسهای (Loci) مشخص را ممکن میسازد و از روشهایی مانند PCR اختصاصی آلل (Allele-Specific PCR) برای شناسایی جهشهای نقطهای (Point Mutations) یا تحلیل پلیمورفیسم طول قطعهی محدودکننده (RFLP Analysis – Restriction Fragment Length Polymorphism) زمانی که جهشها محلهای آنزیمهای محدودکننده را ایجاد یا حذف میکنند، پشتیبانی میکند.
-
توالییابی سنگر (Sanger Sequencing) با استفاده از دیدوکسینوکلئوتیدهای خاتمهدهنده (Chain-Terminating Dideoxynucleotides) قطعاتی تولید میکند که توالی دقیق نوکلئوتیدی (Precise Nucleotide Sequence) را نشان میدهند.
این روش همچنان استاندارد طلایی (Gold Standard) برای تأیید جهشها به ویژه در محیطهای بالینی است، مانند تأیید واریانتهای بیماریزا (Pathogenic Variants) در ژن CFTR یا شناسایی جهشهای ژرملاین (Germline Mutations) در ژنهای BRCA1 و BRCA2 مرتبط با سرطان پستان و تخمدان ارثی (Hereditary Breast and Ovarian Cancer).
۶.۳ توالییابی نسل جدید (Next-Generation Sequencing – NGS)
توالییابی نسل جدید (NGS) به طرز چشمگیری مقیاس و سرعت تحلیل جهشها را گسترش داده است. برخلاف Sanger، NGS توالییابی موازی میلیونها قطعهی DNA را همزمان انجام میدهد و امکان بررسی کامل اگزوم (Whole-Exome Sequencing) یا ژنوم کامل (Whole-Genome Sequencing) را فراهم میکند.
-
توالییابی کل اگزوم روی ناحیههای کدکنندهی پروتئین تمرکز دارد که محل اصلی جهشهای بیماریزا هستند.
-
توالییابی کل ژنوم هم نواحی کدکننده و هم نواحی غیرکدکننده (Non-Coding Regions) را شامل میشود و قادر است واریانتهای تنظیمی (Regulatory Variants) و تغییرات ساختاری (Structural Changes) را شناسایی کند.
NGS ابزاری حیاتی در ژنومیک سرطان (Cancer Genomics) است و به کشف جهشهای محرک (Driver Mutations)، امضای جهشی (Mutational Signatures) و جمعیتهای زیرکلونی (Subclonal Populations) در تومورها کمک میکند. کاهش هزینهها و افزایش دقت NGS باعث شده این روش در تحقیقات و تشخیصهای بالینی روتین (Routine) شود.
۶.۴ پروفایلینگ جهش با وضوح بالا (High-Resolution Mutation Profiling)
علاوه بر توالییابی، فناوریهای مکملی وجود دارند که شناسایی انواع مختلف جهش را بهبود میدهند:
-
میکروآرایهها (Microarrays): امکان شناسایی واریاسیونهای تعداد کپی (Copy Number Variations – CNVs) و پلیمورفیسمهای تکنوکلئوتیدی (Single-Nucleotide Polymorphisms – SNPs) را در سراسر ژنوم از طریق هیبریداسیون DNA بر روی هزاران پروب ثابت فراهم میکنند.
-
آرایهی هیبریداسیون ژنومی مقایسهای (Comparative Genomic Hybridization – CGH Arrays): برای تشخیص حذفها یا دوپلیکاسیونهایی که برای سیتوژنتیک سنتی کوچک اما برای توالییابی هدفمند بزرگ هستند، بسیار مفید است.
-
PCR قطره دیجیتال (Digital Droplet PCR – ddPCR): کمیتیابی فوق حساس جهشهای نادر (Rare Mutations) مانند واریانتهای آنکوژنیک با فراوانی پایین در DNA توموری در گردش (Circulating Tumor DNA) را ممکن میسازد.
-
توالییابی تکسلولی (Single-Cell Sequencing): روشی قدرتمند برای کشف جهشهای سوماتیک (Somatic Mutations) و ناهمگنی کلونی (Clonal Heterogeneity) در بافتهای پیچیده است که بینش منحصربهفردی از تکامل تومور (Tumor Evolution) و موزائیسم (Mosaicism) ارائه میدهد.
۶.۵ تحلیلهای عملکردی و محاسباتی (Functional and Computational Analyses)
شناسایی یک جهش، تنها گام نخست است. تعیین اهمیت عملکردی آن نیازمند رویکردهای آزمایشگاهی (Experimental) و محاسباتی (Computational) است:
-
آزمونهای درونکشتگاهی (In Vitro Assays) مانند سیستمهای ژن گزارشگر (Reporter Gene Systems) یا ویرایش CRISPR برای درج هدفمند (CRISPR-Mediated Knock-ins) میتوانند اثر واریانتهای خاص بر بیان ژن (Gene Expression)، فعالیت پروتئین (Protein Activity) یا فنوتیپ سلولی (Cellular Phenotype) را ارزیابی کنند.
-
ابزارهای بیوانفورماتیک (Bioinformatic Tools) با استفاده از حفظ تکاملی (Evolutionary Conservation)، مدلسازی ساختاری (Structural Modeling) و پایگاههای داده بیماری (Disease Databases)، بیماریزایی واریانتهای میسسنس (Missense Variants) را پیشبینی میکنند.
-
منابع بزرگی مانند ClinVar و پایگاه داده تجمیع ژنوم (Genome Aggregation Database – gnomAD) اطلاعات فراوانی جمعیتی (Population Frequency Data) و حاشیهنویسیهای معتبر (Curated Annotations) را برای تشخیص پلیمورفیسمهای خوشخیم (Benign Polymorphisms) از جهشهای بیماریزا (Disease-Causing Mutations) ارائه میدهند.
ادغام این دادهها با ترنسکریپتومیکس (Transcriptomics)، اپیژنتیک (Epigenomics) و پروتئومیکس (Proteomics)**، درک جامعتری از نحوهی تأثیر جهشها بر مسیرهای زیستی به دست میدهد.
۶.۶ کاربردهای بالینی و مسیرهای آینده (Clinical Applications and Future Directions)
توانایی شناسایی و تفسیر جهشها چهرهی پزشکی بالینی را دگرگون کرده است.
-
پزشکی دقیق (Precision Medicine) به پروفایلینگ ژنومی تکیه دارد تا درمانها را براساس چشمانداز جهشی منحصربهفرد بیمار (Unique Mutational Landscape) تنظیم کند، مانند درمانهای هدفمند برای سرطانهای دارای جهش در EGFR یا ALK و نیز در فارماکوژنومیک (Pharmacogenomics) برای بهینهسازی انتخاب دارو و دوز مصرفی.
-
آزمایش غیرتهاجمی پیش از تولد (Non-Invasive Prenatal Testing – NIPT) از DNA آزاد جنینی در خون مادر (Cell-Free Fetal DNA) برای غربالگری آنئوپلوئیدیهای کروموزومی (Chromosomal Aneuploidies) با حساسیت بالا و خطر پایین استفاده میکند.
-
فناوریهای نوظهوری مانند توالییابی با خوانش بلند (Long-Read Sequencing – Oxford Nanopore, PacBio) نوید میدهند که میتوانند واریانتهای ساختاری پیچیده (Complex Structural Variants) و ناحیههای تکراری (Repetitive Regions) را که پلتفرمهای با خوانش کوتاه قادر به تحلیل دقیق آنها نیستند، شناسایی کنند.
نکته کلیدی: همراه با پیشرفتهای سریع بیوانفورماتیکی و کاهش هزینهها، این فناوریها در حال سوق دادن آزمایشهای ژنتیکی به سمت تصمیمگیری بالینی در زمان واقعی (Real-Time Clinical Decision Making) هستند.
۷. جهشها در تکامل و سازگاری
جهشها (Mutations) ماده اولیه تغییرات تکاملی را فراهم میکنند. بدون ورود مداوم گونههای ژنتیکی جدید، انتخاب طبیعی (Natural Selection) و دیگر نیروهای تکاملی هیچ چیزی برای عمل کردن نداشتند. در حالی که بیشتر جهشها خنثی یا مضر هستند، بخش کوچکی میتواند در محیطهای خاص مزیت ایجاد کند و به ارگانیسمها اجازه دهد که طی نسلها سازگار شوند. مطالعه تکامل ناشی از جهشها، پلی است بین ژنتیک مولکولی (Molecular Genetics)، زیستشناسی جمعیت (Population Biology) و زمینشناسی دیرینه (Paleontology)، و نشان میدهد که چگونه تغییرات کوچک در DNA میتوانند تنوع وسیع زندگی که امروزه مشاهده میکنیم را به وجود آورند.
۷.۱ جهش به عنوان منبع تنوع ژنتیکی
در چارچوب نظریه مدرن تکامل، جهش (Mutation) منبع نهایی تنوع ژنتیکی است. فرآیندهای دیگر مانند بازترکیبی (Recombination) و جریان ژن (Gene Flow)، آللهای موجود را جابهجا یا پخش میکنند، اما تنها جهش است که توالیهای کاملاً جدید ایجاد میکند.
جهشهای نقطهای (Point Mutations)، درجها (Insertions)، حذفها (Deletions) و تغییرات ساختاری بزرگتر، آللهای جدیدی ایجاد میکنند که ممکن است عملکرد پروتئین، شبکههای تنظیمی یا ساختار ژنومی را تحت تأثیر قرار دهند. اگرچه نرخ جهش در سطح نوکلئوتید در اکثر ارگانیسمها پایین است—معمولاً در حدود 10⁻⁹ تا 10⁻¹⁰ به ازای هر نوکلئوتید در هر نسل—اندازه بزرگ ژنومها و تعداد بالای افراد در یک جمعیت، تأمین مداوم گونههای جدید (Constant Supply of New Variants) را تضمین میکند. این ورودی ثابت، سوخت فرآیند تکامل است حتی زمانی که اکثر جهشها خنثی یا مضر هستند.
۷.۲ نظریه خنثی و رانش ژنتیکی
همه جهشها بر بقاء و تناسب اندام تأثیر نمیگذارند. نظریه خنثی (Neutral Theory) که توسط موتو کیمورا (Motoo Kimura) ارائه شد، بیان میکند که بیشتر تغییرات مولکولی از نظر انتخابی خنثی هستند و فراوانی آنها عمدتاً از طریق رانش ژنتیکی (Genetic Drift) نوسان میکند.
جانشینیهای هممعنی (Synonymous Substitutions) که توالی آمینواسیدی را تغییر نمیدهند، نمونههای کلاسیک هستند. در طول بازههای زمانی طولانی، این جهشهای خنثی با نرخ تقریباً ثابتی تجمع مییابند و به عنوان ساعت مولکولی (Molecular Clock) عمل میکنند که برای تخمین زمان جدایی بین گونهها استفاده میشود.
نظریه خنثی، اهمیت فرآیندهای تصادفی و اندازه جمعیت را در شکلدهی به تنوع ژنتیکی نشان میدهد و نقش انتخاب طبیعی در تکامل تطبیقی را تکمیل میکند.
۷.۳ جهشهای مفید و سازگاری
اگرچه نادر هستند، جهشهای مفید میتوانند تأثیر عمیقی بر بقا و تولیدمثل داشته باشند. هنگامی که شرایط محیطی تغییر میکند، یک آلل که قبلاً خنثی یا حتی مضر بود، میتواند مفید شود و از طریق انتخاب مثبت (Positive Selection) در جمعیت گسترش یابد.
مثالی شناختهشده در انسان، پایداری لاکتاز (Lactase Persistence) است که به بزرگسالان اجازه هضم لاکتوز را میدهد. این ویژگی ناشی از جهشهای تنظیمی Regulatory Mutations در بالادست ژن LCT در جمعیتهای دامدار بوده و مزیت تغذیهای در محیطهایی که شیر غذای مهمی بود، فراهم میکرد.
مثال دیگر، آلل CCR5-Δ32 است که یک حذف ۳۲ جفت بازی (32-base pair deletion) در ژن CCR5 است و مقاومت در برابر ویروس HIV را فراهم میکند و ممکن است در گذشته محافظتی در برابر بیماریهایی مانند آبله (Smallpox) داشته باشد.
در باکتریها و ویروسها، جهشهای مفید اغلب باعث سازگاری سریع (Rapid Adaptation) به آنتیبیوتیکها یا داروهای ضدویروسی میشوند، همانطور که در ظهور سویههای مقاوم به چند دارو Multidrug-Resistant در Mycobacterium tuberculosis یا تکامل گونههای جدید آنفلوانزا دیده میشود.
۷.۴ تعادل جهش–انتخاب و آللهای مضر
بیشتر جهشهای جدید که عملکرد ژن را تحت تأثیر قرار میدهند، مضر (Deleterious) هستند و تناسب اندام ارگانیسم را کاهش میدهند. با این حال، این آللها میتوانند از طریق تعادل جهش–انتخاب (Mutation–Selection Balance) در جمعیتها باقی بمانند.
مثال در انسان شامل جهشهای بیماریزا (Disease-Causing Mutations) مانند فیبروز سیستیک (Cystic Fibrosis) یا بیماری تِی ساکس (Tay–Sachs Disease) است، که باقی میمانند زیرا حاملان هتروزیگوت (Heterozygous) معمولاً هزینه تناسب اندام کمی دارند یا هیچ هزینهای ندارند.
در برخی موارد، هتروزیگوتها حتی مزیت نیز دارند، مانند آلل سلول داسی شکل (HbS) که مقاومت در برابر مالاریا شدید (Severe Malaria) را در یک نسخه فراهم میکند. این دینامیکها نشاندهنده تعامل پیچیده بین جهش، انتخاب و رانش ژنتیکی در حفظ تنوع ژنتیکی هستند.
۷.۵ تابشهای تطبیقی و گونهزایی
رویدادهای تکاملی در مقیاس بزرگ مانند تابشهای تطبیقی (Adaptive Radiations) قدرت خلاق جهشها را نشان میدهند. هنگامی که ارگانیسمها محیطها یا جایگاههای زیستمحیطی جدید را استعمار میکنند، تجمع تغییرات ژنتیکی میتواند به تنوع سریع (Rapid Diversification) و ظهور گونههای جدید منجر شود.
تابش پرندگان داروین (Darwin’s Finches) در جزایر گالاپاگوس، نمونهای است که شامل جهشها در ژنهای تنظیمی مانند ALX1 بوده که بر شکل منقار و استراتژیهای تغذیه تأثیر گذاشته است.
همچنین، ماهیهای سیچلید (Cichlid Fishes) در دریاچههای آفریقایی تنوع فوقالعادهای در الگوهای رنگ و ساختار فکها دارند، که ناشی از جهشهایی است که مسیرهای توسعهای را تحت تأثیر قرار دادهاند. این موارد نشان میدهد که تنوع ژنتیکی ایجاد شده توسط جهش، پایه و اساس پیدایش گونهها و تنوع زندگی است.
۷.۶ تکامل تجربی و مشاهده جهش در زمان واقعی
مطالعات آزمایشگاهی و میدانی به دانشمندان اجازه میدهند که تکامل ناشی از جهش را در زمان واقعی (Real-Time Evolution by Mutation) مشاهده کنند.
مثال بارز، تجربه بلندمدت ریچارد لنزکی (Richard Lenski) با Escherichia coli است که جمعیتهای باکتریایی را طی دهها هزار نسل دنبال کرده و جهشهای مفیدی را ثبت کرده که سرعت رشد و قابلیتهای متابولیک را بهبود میبخشند، از جمله تکامل توانایی استفاده از سیترات (Citrate Utilization) در شرایط هوازی.
مطالعات مشابه در مخمر (Yeast)، مگس میوه (Fruit Flies) و ویروسها (Viruses) نشان دادهاند که جهشهای تطبیقی مشابه در جمعیتهای تکراری رخ میدهد، که قابلیت پیشبینی برخی مسیرهای تکاملی را برجسته میکند. این آزمایشها نشان میدهند که جهشهای تصادفی، تحت فیلتر انتخاب طبیعی، باعث سازگاری میشوند حتی در شرایط کنترل شده.
۷.۷ نوآوری مولکولی از طریق تکثیر ژن و نوآوری
برخی از مهمترین نوآوریهای تکاملی ناشی از تکثیر ژن (Gene Duplication) است، که نوع خاصی از جهش است و نسخههای اضافی از ماده ژنتیکی ایجاد میکند.
یک نسخه میتواند عملکرد اصلی (Original Function) را حفظ کند، در حالی که نسخه دیگر میتواند جهش انباشته کند و ممکن است عملکرد جدیدی (Neofunctionalization) پیدا کند.
نمونهها شامل:
-
تنوع ژنهای گلوبین (Globin Genes) در مهرهداران
-
ظهور پروتئینهای ضد یخ (Antifreeze Proteins) در ماهیهای قطبی
-
گسترش ژنهای گیرندههای بویایی (Olfactory Receptor Genes) در پستانداران
در مقیاس بزرگتر، تکثیرهای ژنومی کامل (Whole-Genome Duplications) در گیاهان و مهرهداران اولیه، ماده ژنتیکی فراوان برای تکامل پیچیدگی (Evolution of Complexity) فراهم کرده است.
۷.۸ نرخ جهش و تأثیرات محیطی
نرخ جهشها خود میتوانند تکامل یابند و تحت تأثیر عوامل محیطی قرار گیرند. برخی از میکروارگانیسمها جهشزایی القاشده توسط استرس (Stress-Induced Mutagenesis) نشان میدهند، که نرخ جهش را تحت شرایط سخت افزایش میدهد تا نسخههای تطبیقی بیشتری سریعتر تولید شود.
اشعه ماوراء بنفش (Ultraviolet Radiation)، موادی که ایجاد جهش میکنند (Chemical Mutagens) و گونههای فعال اکسیژن (Reactive Oxygen Species) نیز نرخ جهش را با آسیب به DNA افزایش میدهند.
در طول زمانهای تکاملی، ارگانیسمها مکانیسمهایی مانند مسیرهای ترمیم DNA (DNA Repair Pathways) و پلیمرازهای تصحیحکننده (Proofreading Polymerases) را توسعه دادهاند تا تعادل بین ثبات ژنومی و نوآوری ژنتیکی حفظ شود. این تعادل ریتم تغییرات تکاملی (Tempo of Evolutionary Change) را در شاخههای مختلف زیستی شکل میدهد.