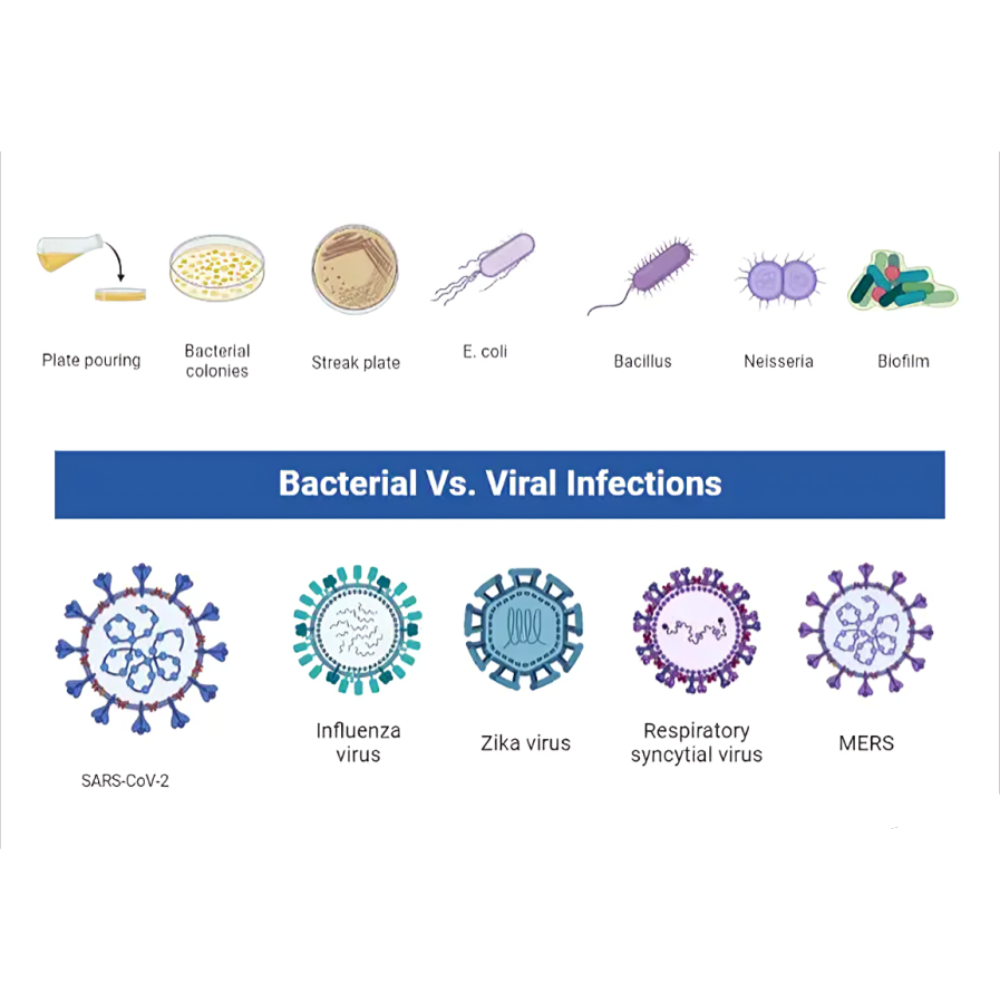
تفاوت عفونت ویروسی و باکتریایی
مقدمه
عفونتها از جمله چالشهای اساسی در سلامت انسان هستند و میتوانند ناشی از انواع مختلف میکروارگانیسمها شامل ویروسها، باکتریها، قارچها و انگلها باشند. در میان این عوامل، ویروسها و باکتریها بیشترین سهم را در ایجاد بیماریهای حاد و مزمن انسان دارند. تشخیص صحیح بین عفونت ویروسی و باکتریایی نه تنها اهمیت بالینی زیادی دارد بلکه در تعیین استراتژی درمانی، پیشگیری از مقاومت دارویی و کاهش هزینههای مراقبتهای بهداشتی نقش اساسی ایفا میکند. به طور متوسط، اشتباه در تشخیص منجر به تجویز نادرست آنتیبیوتیکها، طولانی شدن دوره بیماری و افزایش خطر عوارض جانبی میشود.
ویروسها به عنوان عوامل عفونتهای داخل سلولی اجباری شناخته میشوند؛ آنها تنها قادر به تکثیر در داخل سلولهای میزبان هستند و ساختارهای سادهای دارند که معمولاً شامل ماده ژنتیکی (DNA یا RNA) و پوشش پروتئینی است. به دلیل این ویژگیها، ویروسها واکنشهای ایمنی میزبان را به شکل متفاوتی فعال میکنند و درمانهای مستقیم ضدویروسی محدود و معمولاً هدفمند هستند. در مقابل، باکتریها موجوداتی تکسلولی و مستقل از سلول میزبان هستند که توانایی تکثیر در محیطهای مختلف را دارند و ساختارهای سلولی پیچیدهتری دارند. این تفاوتهای بنیادین باعث میشود روشهای درمانی و پروتکلهای بالینی برای مواجهه با این دو نوع عفونت کاملاً متفاوت باشد.
یکی از پیچیدگیهای تشخیص بالینی، همعفونتها و عفونتهای ثانویه است. بسیاری از بیماریهای ویروسی، به ویژه در سیستم تنفسی مانند آنفولانزا یا SARS-CoV-2، محیط مناسبی برای رشد باکتریها فراهم میکنند. این تعامل ویروس و باکتری میتواند شدت بیماری را افزایش دهد، پاسخ ایمنی را مختل کند و منجر به افزایش مرگ و میر شود. مطالعات متعدد نشان دادهاند که در بیماران بستری با عفونتهای تنفسی، شیوع همعفونتهای باکتریایی در کنار ویروسها میتواند تا ۳۰ درصد باشد و این موضوع اهمیت تشخیص دقیق و مدیریت همزمان را دوچندان میکند.
علاوه بر جنبههای بالینی، تفاوتهای پاتوفیزیولوژیک بین عفونتهای ویروسی و باکتریایی باعث تفاوتهای آشکار در پاسخ ایمنی، تولید سیتوکینها، تغییرات التهاب سیستمیک و تعامل با میکروبیوم میشود. به عنوان مثال، در عفونتهای ویروسی، اینترفرونهای نوع I نقش کلیدی در فعالسازی پاسخ ضدویروسی و محدود کردن تکثیر ویروس دارند، در حالی که در عفونتهای باکتریایی، مسیرهای التهابی وابسته به TLRها، میکرو RNA ها و پاسخهای فاگوسیتی اهمیت بیشتری دارند. درک این تفاوتها برای طراحی درمانهای هدفمند و پیشگیری از آسیبهای ناشی از التهاب بیش از حد ضروری است.
با توجه به پیچیدگیهای بالینی و بیولوژیک، تمایز بین عفونتهای ویروسی و باکتریایی نه تنها برای پزشکان و متخصصان بالینی حیاتی است بلکه برای محققان، داروسازان و سیاستگذاران بهداشت عمومی نیز اهمیت دارد. این تمایز به طراحی برنامههای واکسیناسیون، استراتژیهای کنترل اپیدمی و پیشبینی پاسخ بیمار به درمان کمک میکند. از سوی دیگر، عدم تشخیص صحیح میتواند منجر به استفاده بیرویه از آنتیبیوتیکها، مقاومت میکروبی، طولانی شدن دوره بیماری و حتی افزایش خطر مرگ و میر شود.
هدف این مقاله ارائه یک مرور جامع و علمی بر تفاوتهای عفونتهای ویروسی و باکتریایی است، به گونهای که تمام جنبههای بالینی، بیولوژیک، تشخیصی و درمانی را پوشش دهد. در این مقاله، تلاش خواهد شد تمامی پرسشهای ممکن یک متخصص یا علاقهمند به علوم پزشکی پاسخ داده شود، از جمله نحوه تعامل همعفونتها، پاسخ ایمنی میزبان، روشهای تشخیصی دقیق، استراتژیهای درمانی نوین و نقش عوامل محیطی و ژنتیکی در پیشرفت بیماری. همچنین این مقاله با رویکرد سئو محور و جذب مخاطب طراحی شده تا علاوه بر متخصصان، برای خوانندگان عمومی نیز قابل فهم و مفید باشد.
با توجه به اهمیت بالای موضوع و پیچیدگیهای علمی، در ادامه مقاله به بررسی ویژگیهای پایهای ویروسها و باکتریها، مسیرهای ورود و انتشار عفونتها، پاسخ ایمنی میزبان، روشهای تشخیص، عوامل مستعد کننده، درمان و پیشگیری و چشماندازهای نوین تحقیقات پرداخته خواهد شد. این مسیر مطالعه، تصویری جامع و علمی از تفاوت و تعامل بین عفونتهای ویروسی و باکتریایی ارائه خواهد داد که برای تصمیمگیری بالینی و ارتقای سلامت عمومی ضروری است.
درک پایهای از عفونتهای ویروسی و باکتریایی
برای فهم تفاوتهای بنیادین بین عفونتهای ویروسی و باکتریایی، ابتدا باید با ماهیت و ساختار این میکروارگانیسمها و نحوه تعامل آنها با بدن انسان آشنا شویم. ویروسها و باکتریها با وجود اینکه هر دو میتوانند باعث بیماری شوند، تفاوتهای بیولوژیک و رفتاری گستردهای دارند که بر نحوه تشخیص، درمان و پیشگیری تاثیر مستقیم میگذارند.
ویروسها موجوداتی غیرسلولی و داخل سلولی اجباری هستند، به این معنا که آنها قادر به تکثیر مستقل نیستند و برای تولید مثل نیازمند سلولهای میزبان هستند. ساختار ویروس بسیار ساده است و معمولاً شامل یک پوشش پروتئینی (کپسید) و ماده ژنتیکی DNA یا RNA است. برخی ویروسها دارای غلاف لیپیدی هستند که حساسیت آنها به حرارت، مواد ضدعفونیکننده و محیطهای اسیدی را تغییر میدهد. این سادگی ساختاری باعث میشود ویروسها مسیرهای محدودی برای حمله به بدن داشته باشند و سیستم ایمنی میزبان پاسخهای مشخصی را فعال کند، از جمله تولید اینترفرونهای نوع I و II، سیتوکینها و سلولهای کشنده طبیعی (NK cells). ویروسها معمولاً با هدف قرار دادن سلولهای خاص با گیرندههای ویژه وارد بدن میشوند و بسته به نوع ویروس، بافتهای مختلفی از جمله دستگاه تنفسی، گوارشی، عصبی یا خونی را درگیر میکنند.
در مقابل، باکتریها موجوداتی تکسلولی و مستقل هستند که قادر به رشد و تکثیر در محیطهای مختلف، اعم از داخل یا خارج بدن میزبان، میباشند. باکتریها دارای ساختار سلولی پیچیده شامل غشای سلولی، دیواره سلولی و گاهی ساختارهای حرکتی مانند تاژک هستند و میتوانند متابولیسم مستقل از سلول میزبان داشته باشند. این ویژگی باعث میشود باکتریها بتوانند در محیطهای مختلف، از آب و خاک گرفته تا میکروبیوم انسان، زنده بمانند و تکثیر کنند. پاسخ ایمنی میزبان به باکتریها اغلب شامل فعال شدن فاگوسیتها، تولید آنتیبادیها، مسیرهای التهابی وابسته به TLRها و کمپلمان است که با ویروسها تفاوت بنیادین دارد.
یکی از تفاوتهای اساسی بین عفونتهای ویروسی و باکتریایی، سرعت و الگوی پیشرفت بیماری است. ویروسها معمولاً دوره نهفتگی مشخصی دارند که در آن فرد مبتلا ممکن است بدون علامت باشد ولی پس از آن تکثیر سریع ویروس در سلولهای هدف باعث بروز علائم میشود. این علائم اغلب شامل تب، خستگی، درد عضلانی و علائم سیستمیک هستند که از شدت بیماری و نوع ویروس متغیرند. در مقابل، عفونتهای باکتریایی معمولاً روند پیشرفت سریعتر و موضعیتر دارند و ممکن است التهاب شدید، درد موضعی، ترشح چرکی و افزایش قابل توجه نشانگرهای التهابی مانند پروتئین C-واکنشی (CRP) و پروکلسیتونین را ایجاد کنند.
ویروسها و باکتریها همچنین از نظر تاثیر بر سلولها و بافتها متفاوت عمل میکنند. ویروسها با ورود به سلول میزبان و استفاده از ماشینآلات سلولی برای تکثیر، باعث مرگ سلولی مستقیم یا القای آپوپتوز میشوند و با این کار، پاسخ ایمنی را تحریک و گاهی مهار میکنند. باکتریها میتوانند با استفاده از سموم (توکسینها)، آنزیمهای تخریبکننده بافت و تشکیل زیستفیلمها آسیب بافتی ایجاد کنند و همچنین در برخی موارد سیستم ایمنی را از مسیرهای مختلف سرکوب کنند. این تفاوتها اهمیت ویژهای در انتخاب دارو و استراتژی درمان دارد؛ به طوری که داروهای ضدویروسی معمولاً بر مراحل تکثیر ویروس و با هدف جلوگیری از ورود یا انتشار ویروس عمل میکنند، در حالی که آنتیبیوتیکها با هدف مهار سنتز دیواره سلولی، پروتئین یا مسیرهای متابولیک باکتری طراحی شدهاند.
یکی دیگر از جنبههای مهم، نقش میکروبیوم و عوامل محیطی در شدت و پیشرفت عفونتها است. مطالعات اخیر نشان دادهاند که میکروبیوم دستگاه گوارش و مخاطهای سطحی میتواند هم مستقیماً بر عفونت باکتریایی اثر بگذارد و هم پاسخ میزبان به ویروسها را تعدیل کند. به عنوان مثال، وجود باکتریهای مفید در روده میتواند با تحریک پاسخ ایمنی موضعی، تکثیر ویروسها را محدود کند و بالعکس، تخریب میکروبیوم توسط آنتیبیوتیکها میتواند حساسیت به ویروسها را افزایش دهد. این تعامل پیچیده بین ویروس، باکتری و میزبان نشان میدهد که درک پایهای از عفونتها باید فراتر از مطالعه یک عامل منفرد باشد و شامل شبکههای پیچیده تعاملات میکروبی و پاسخ ایمنی شود.
در نهایت، تمایز بین عفونتهای ویروسی و باکتریایی به دلیل تفاوتهای ساختاری، متابولیکی و رفتاری این عوامل، اهمیت بالینی زیادی دارد. درک دقیق این تفاوتها به پزشکان کمک میکند تا درمان هدفمند، کاهش عوارض و پیشگیری از مقاومت دارویی را بهینه کنند. همچنین، این درک برای طراحی واکسنها، داروهای جدید، استراتژیهای پیشگیری و تحقیق در زمینه همعفونتها و بیماریهای پیچیده، حیاتی است.
با توجه به اهمیت این مفاهیم پایهای، در بخشهای بعدی مقاله به مسیرهای ورود و انتشار عفونتها، پاسخ ایمنی میزبان، روشهای تشخیص و درمان و پیشگیری و چشماندازهای نوین تحقیقات پرداخته خواهد شد تا تصویری جامع و علمی از تفاوت و تعامل بین عفونتهای ویروسی و باکتریایی ارائه شود.
مسیرهای ورود و انتشار عفونتها
درک مسیرهای ورود و انتشار عفونتها برای تشخیص، پیشگیری و درمان موفقیتآمیز بیماریها از اهمیت بسیار بالایی برخوردار است. ویروسها و باکتریها هر یک مسیرهای متفاوتی برای ورود به بدن دارند و توانایی آنها در انتشار و تکثیر به عوامل محیطی، ساختاری و ایمنی میزبان بستگی دارد. مطالعه مسیرهای ورود این عوامل میتواند چشمانداز روشنی از شدت و پیشرفت بیماریها و احتمال ایجاد همعفونتها ارائه دهد.
ویروسها معمولاً از طریق مسیرهای مشخص و محدود وارد بدن میشوند، چرا که برای تکثیر نیازمند سلول میزبان هستند. شایعترین مسیرهای ورود شامل مخاط تنفسی، مخاط گوارشی، مخاط مخاطی چشم و دهان، پوست آسیبدیده و گاهی جریان خون میشود. ویروسهای تنفسی مانند آنفولانزا، RSV و SARS-CoV-2 عمدتاً از طریق قطرات تنفسی و آئروسلها وارد بدن میشوند و ابتدا سلولهای پوششی دستگاه تنفسی فوقانی و تحتانی را هدف قرار میدهند. ویروسهای گوارشی، از جمله نوروویروسها و روتاویروسها، معمولاً از طریق دهان و مصرف مواد آلوده وارد دستگاه گوارش میشوند و با اتصال به اپیتلیوم روده تکثیر مییابند. ورود ویروسها به جریان خون میتواند از طریق نیش حشرات (مانند ویروسهای تب دنگی و زیکا)، تماس مستقیم با خون آلوده یا زخمهای پوستی صورت گیرد.
باکتریها مسیرهای ورود متنوعتری دارند و به دلیل توانایی رشد مستقل، میتوانند در شرایط مختلف محیطی و در بافتهای مختلف بدن تکثیر شوند. شایعترین مسیرهای ورود باکتریها شامل مخاط دستگاه تنفسی، گوارشی، ادراری، پوست آسیبدیده و دستگاه تولیدمثل میشود. برخی باکتریها مانند Streptococcus pneumoniae یا Haemophilus influenzae معمولاً از طریق استنشاق قطرات آلوده وارد ریهها میشوند و باعث پنومونی میشوند. باکتریهای رودهای مانند Salmonella و E. coli از طریق دهان و مواد غذایی آلوده وارد بدن میشوند. همچنین باکتریها میتوانند از طریق زخمهای پوستی، سوزنها یا وسایل پزشکی آلوده به جریان خون راه پیدا کنند و باعث عفونتهای سیستمیک شوند.
یکی از عوامل کلیدی که مسیرهای ورود را تحت تأثیر قرار میدهد، سدهای حفاظتی بدن و عملکرد میکروبیوم است. پوششهای مخاطی، پوست سالم و میکروبیوم طبیعی نقش حیاتی در جلوگیری از ورود و تکثیر عوامل بیماریزا دارند. به عنوان مثال، میکروبیوم روده و دستگاه تنفسی با رقابت بر سر منابع غذایی و تحریک پاسخ ایمنی ذاتی، ورود و رشد میکروبها را محدود میکند. هرگونه اختلال در این سدها، مانند زخم، التهاب یا استفاده بیرویه از آنتیبیوتیکها، میتواند احتمال عفونت و شدت آن را افزایش دهد.
پس از ورود، مسیرهای انتشار در بدن بسته به نوع عامل متفاوت است. ویروسها معمولاً از طریق سلولهای میزبان تکثیر یافته و انتشار سیستمیک یا محلی پیدا میکنند. برخی ویروسها به صورت محلی در بافت هدف باقی میمانند، مانند ویروسهای تنفسی که عمدتاً در ریه تکثیر میشوند، در حالی که برخی دیگر میتوانند وارد خون یا لنف شوند و باعث عفونت سیستمیک شوند، مانند ویروس سرخک یا HIV. باکتریها علاوه بر انتشار محلی، توانایی ایجاد عفونتهای سیستمیک و تشکیل زیستفیلم را دارند، که این زیستفیلمها میتوانند با مقاومت در برابر آنتیبیوتیکها و سیستم ایمنی، درمان را پیچیده کنند.
نقش همعفونتها و تعامل بین ویروسها و باکتریها در مسیرهای ورود و انتشار نیز بسیار مهم است. ویروسها با ایجاد آسیب به اپیتلیوم و مهار پاسخ ایمنی موضعی محیط مناسبی برای رشد باکتریهای فرصتطلب فراهم میکنند. این موضوع به ویژه در عفونتهای تنفسی مانند آنفولانزا و SARS-CoV-2 مشهود است، جایی که باکتریهای ثانویه میتوانند شدت بیماری را به شدت افزایش دهند و خطر مرگ و میر را بالا ببرند. مطالعات اپیدمیولوژیک نشان دادهاند که در بیماران بستری مبتلا به آنفولانزا، حدود ۲۵ تا ۳۰ درصد از بیماران دارای همعفونت باکتریایی هستند و این درصد در بیماران COVID-19 بستری نیز قابل توجه است.
همچنین، شرایط محیطی و فیزیولوژیک بدن میزبان بر مسیرهای ورود و انتشار تأثیرگذار است. دمای بدن، میزان رطوبت مخاط، pH، وجود سلولهای ایمنی و حتی ترکیب میکروبیوم، میتواند سرعت و گستردگی انتشار عوامل بیماریزا را تعیین کند. به عنوان مثال، ویروسهای گوارشی در محیط اسیدی معده با چالش مواجه میشوند، اما برخی باکتریها مانند Helicobacter pylori توانایی زنده ماندن و ایجاد عفونت مزمن در این محیط را دارند.
در نهایت، درک مسیرهای ورود و انتشار عفونتها برای طراحی استراتژیهای پیشگیری و درمان بسیار حیاتی است. شناخت این مسیرها به پزشکان و متخصصان کمک میکند تا اقدامات حفاظتی مانند واکسنگذاری، کنترل اپیدمی، بهداشت شخصی و درمان هدفمند را به درستی برنامهریزی کنند. این شناخت همچنین امکان پیشبینی محل درگیری بافتها، شدت بیماری و احتمال ایجاد عوارض ثانویه را فراهم میکند، که در نهایت منجر به بهبود کیفیت مراقبت بالینی و کاهش مرگ و میر بیماران خواهد شد.
پاسخ ایمنی میزبان در عفونتهای ویروسی و باکتریایی
پاسخ ایمنی میزبان نقش حیاتی در کنترل و مهار عفونتهای ویروسی و باکتریایی دارد و تفاوتهای بنیادین بین این دو نوع عفونت باعث میشود که واکنش سیستم ایمنی به هر کدام مسیرهای متمایزی را طی کند. درک این تفاوتها برای طراحی درمانهای هدفمند، پیشبینی شدت بیماری و جلوگیری از عفونتهای ثانویه و همزمان بسیار اهمیت دارد.
در عفونتهای ویروسی، سیستم ایمنی میزبان ابتدا با پاسخ ایمنی ذاتی (Innate Immunity) مواجه میشود. سلولهای میزبان با استفاده از گیرندههای شناسایی الگوهای مولکولی پاتوژنها (PRRها)، ویروسها را شناسایی میکنند. این شناسایی باعث فعال شدن مسیرهای سیگنالینگ و تولید سیتوکینهای ضدویروسی، به ویژه اینترفرونهای نوع I و II میشود. اینترفرونها نقش کلیدی در مهار تکثیر ویروس در سلولهای آلوده و فعالسازی سلولهای NK دارند که قادر به تخریب سلولهای آلوده هستند. علاوه بر این، ماکروفاژها و نوتروفیلها نیز به محل عفونت مهاجرت کرده و با پاکسازی ذرات ویروسی و سلولهای آلوده، کنترل اولیه عفونت را انجام میدهند.
در پاسخ ایمنی اکتسابی به ویروسها، سلولهای T و B نقش محوری دارند. سلولهای T کمککننده (CD4+) با تحریک سلولهای B باعث تولید آنتیبادیهای اختصاصی علیه پروتئینهای ویروسی میشوند، در حالی که سلولهای T کشنده (CD8+) سلولهای آلوده به ویروس را از بین میبرند. آنتیبادیهای تولید شده نقش مهمی در خنثیسازی ویروسها و جلوگیری از ورود آنها به سلولهای سالم دارند. این پاسخ اکتسابی معمولاً پس از چند روز تا چند هفته کامل میشود و در حافظه ایمنی باعث مصونیت طولانیمدت در برابر ویروسهای مشابه میشود.
در مقابل، در عفونتهای باکتریایی، پاسخ ایمنی میزبان مسیرهای متفاوتی را فعال میکند. باکتریها با استفاده از مولکولهای سطحی خاص و تولید توکسینها و آنزیمهای تخریبکننده بافت باعث تحریک پاسخ ایمنی ذاتی میشوند. فاگوسیتها مانند ماکروفاژها و نوتروفیلها اولین خط دفاع هستند که با انجام فاگوسیتوز، باکتریها را بلعیده و نابود میکنند. مسیرهای التهابی وابسته به TLRها، کمپلمان و سیتوکینها به سرعت فعال میشوند تا التهاب موضعی و تجمع سلولهای ایمنی در محل عفونت ایجاد شود.
در عفونت باکتریایی، پاسخ ایمنی اکتسابی نیز اهمیت ویژهای دارد. سلولهای B آنتیبادیهای اختصاصی علیه آنتیژنهای باکتریایی تولید میکنند که با اتصال به باکتریها، آنها را خنثی یا باعث اپسونیزاسیون و افزایش فاگوسیتوز میشوند. سلولهای T کمککننده (CD4+) نیز با تحریک ماکروفاژها و سایر سلولهای ایمنی باعث تشدید پاسخ ضدباکتریایی میشوند. در برخی عفونتهای باکتریایی، این پاسخ ایمنی میتواند باعث التهاب شدید و آسیب بافتی شود، که یکی از دلایل ایجاد عوارض ثانویه و طولانی شدن دوره بیماری است.
یکی از جنبههای مهم و پیچیده در پاسخ ایمنی میزبان، اثر اینترفرونهای نوع I و سایر سیگنالهای سیتوکینی در عفونتهای همزمان ویروسی و باکتریایی است. مطالعات نشان دادهاند که در برخی شرایط، تولید بیش از حد اینترفرونها میتواند پاسخ ایمنی ضدباکتریایی را سرکوب کرده و محیط مناسبی برای رشد باکتریهای فرصتطلب ایجاد کند. این موضوع به ویژه در همعفونتهای تنفسی دیده میشود، جایی که یک عفونت ویروسی اولیه با ایجاد التهاب و مهار برخی مسیرهای ایمنی، باعث افزایش احتمال ابتلا به عفونت باکتریایی ثانویه میشود.
نقش میکرو RNAها و سایر تنظیمکنندههای ژنتیکی در پاسخ ایمنی نیز قابل توجه است. در عفونتهای باکتریایی، برخی miRNAها میتوانند فعالیت سلولهای ایمنی را تقویت یا مهار کنند و پاسخ التهابی را تعدیل نمایند. در عفونتهای ویروسی نیز miRNAها میتوانند تکثیر ویروس و شدت پاسخ ایمنی را تحت تأثیر قرار دهند. این مکانیسمها نشان میدهند که پاسخ ایمنی یک سیستم پویا و پیچیده است که تحت تأثیر تعامل بین عوامل پاتوژن، میزبان و میکروبیوم قرار دارد.
در نهایت، درک کامل پاسخ ایمنی میزبان به عفونتهای ویروسی و باکتریایی باعث میشود پزشکان و محققان بتوانند درمانهای هدفمند، داروهای ضدالتهابی و ایمنسازیهای پیشرفته را طراحی کنند. این دانش همچنین کمک میکند تا رفتار همعفونتها، شدت بیماری و پیامدهای بالینی به طور دقیقتر پیشبینی شود و از عوارض جدی مانند سپسیس، نارسایی اندام یا طولانی شدن بستری جلوگیری شود.
تشخیص بالینی و آزمایشگاهی عفونتهای ویروسی و باکتریایی
تشخیص دقیق بین عفونتهای ویروسی و باکتریایی از اهمیت حیاتی برخوردار است، زیرا درمان، پیشگیری و مدیریت بالینی به نوع عامل بیماریزا وابسته است. بسیاری از عفونتها از نظر علائم بالینی مشابه هستند و بدون انجام بررسیهای دقیق، امکان اشتباه در تشخیص و تجویز داروهای نامناسب وجود دارد. برای همین، پزشکان و متخصصان بالینی باید ترکیبی از شواهد بالینی، پارامترهای آزمایشگاهی و روشهای مولکولی را برای تشخیص استفاده کنند.
در سطح بالینی، عفونتهای ویروسی معمولاً با علائم سیستمیک و عمومی بروز میکنند. این علائم شامل تب خفیف تا متوسط، خستگی، درد عضلانی، سردرد، آبریزش بینی، سرفه خشک و گاهی بثورات پوستی هستند. بسیاری از ویروسها به صورت خود محدود شونده عمل میکنند و در اغلب موارد بدن میتواند بدون نیاز به درمان اختصاصی، ویروس را مهار کند. با این حال، شدت علائم به نوع ویروس، وضعیت ایمنی میزبان و وجود بیماریهای زمینهای بستگی دارد.
در مقابل، عفونتهای باکتریایی غالباً موضعیتر و شدیدتر ظاهر میشوند. ویژگیهای کلیدی این عفونتها شامل تب شدید، درد موضعی، تورم، ترشح چرکی و التهاب مشخص در محل عفونت هستند. علاوه بر این، برخی عفونتهای باکتریایی میتوانند به سرعت سیستمیک شده و باعث سپسیس، شوک و نارسایی اندامها شوند. این تفاوتها در علائم اولیه میتواند کمک کننده باشد، اما به دلیل همپوشانی بالینی، تشخیص قطعی بدون تستهای آزمایشگاهی امکانپذیر نیست.
روشهای آزمایشگاهی در تشخیص عفونتهای ویروسی و باکتریایی نقش تعیینکننده دارند. یکی از شاخصهای مهم برای تشخیص عفونتهای باکتریایی پروکلسیتونین (Procalcitonin) است. این پروتئین در پاسخ به عفونت باکتریایی افزایش قابل توجهی نشان میدهد، در حالی که در بسیاری از عفونتهای ویروسی سطح آن کم باقی میماند. مطالعات متعدد نشان دادهاند که اندازهگیری پروکلسیتونین به عنوان یک نشانگر زیستی میتواند پزشکان را در تمایز بین پنومونی باکتریایی و ویروسی یاری دهد و از تجویز بیرویه آنتیبیوتیکها جلوگیری کند.
علاوه بر پروکلسیتونین، پروتئین C-واکنشی (CRP)، شمارش سلولهای سفید خون و آزمایشهای سیتوکینی نیز به تشخیص کمک میکنند. عفونتهای باکتریایی معمولاً با افزایش قابل توجه نوتروفیلها و CRP همراه هستند، در حالی که عفونتهای ویروسی ممکن است لنفوسیتها را افزایش دهند و CRP به میزان کمتری افزایش یابد. این تفاوتها، هرچند مفید، برای تشخیص قطعی کافی نیستند و معمولاً با روشهای مولکولی ترکیب میشوند.
روشهای مولکولی شامل PCR و RT-PCR هستند که قادرند ماده ژنتیکی ویروس یا باکتری را با حساسیت بالا شناسایی کنند. این روشها به ویژه برای ویروسهایی که در مراحل اولیه عفونت تکثیر سریع دارند، اهمیت ویژهای دارند. علاوه بر شناسایی عامل، این روشها میتوانند بار ویروسی یا باکتریایی را نیز تعیین کنند و اطلاعات ارزشمندی درباره شدت عفونت و پاسخ به درمان ارائه دهند.
کشت باکتریایی نیز یکی از روشهای اصلی تشخیص عفونتهای باکتریایی است. با استفاده از نمونههای خون، ادرار، مخاط یا مایعات بدن میتوان باکتریها را شناسایی کرده و آنتیبیوتیک حساسیتسنجی انجام داد. این اطلاعات برای انتخاب دقیق درمان ضدباکتریایی ضروری است. در عفونتهای ویروسی، کشت معمولاً کاربرد محدودی دارد و بیشتر برای ویروسهای خاصی مانند آنفولانزا و RSV استفاده میشود.
تشخیص همزمان عفونتهای ویروسی و باکتریایی نیز چالشی بالینی است. مطالعات نشان دادهاند که در عفونتهای تنفسی، ۲۰ تا ۳۰ درصد بیماران ممکن است همزمان با ویروس و باکتری مبتلا باشند. در چنین شرایطی، تشخیص تنها بر اساس علائم بالینی کافی نیست و استفاده از ترکیبی از پروکلسیتونین، CRP، PCR و کشت باکتریایی برای تعیین دقیق وضعیت بیمار ضروری است.
تصاویر رادیولوژیک نیز نقش مکمل دارند. برای مثال، **پنومونی باکتریایی اغلب با تجمع موضعی و کانونی در ریهها همراه است، در حالی که عفونتهای ویروسی ممکن است گسترش گستردهتر و الگوی پراکنده در تصاویر رادیولوژیک نشان دهند. این اطلاعات در کنار دادههای آزمایشگاهی به تصمیمگیری بالینی کمک میکند.
در نهایت، تشخیص دقیق عفونتها نه تنها درمان هدفمند را ممکن میسازد بلکه از مقاومت دارویی و عوارض جانبی جلوگیری میکند. ترکیب شواهد بالینی، پارامترهای آزمایشگاهی و روشهای مولکولی به پزشکان این امکان را میدهد که بهترین تصمیمات درمانی را اتخاذ کنند و در عین حال از تجویز بیرویه آنتیبیوتیکها جلوگیری کنند.
عوامل مستعد کننده و همعفونتها
در بسیاری از بیماران، عفونتها تنها با حضور یک عامل بیماریزا رخ نمیدهند؛ بلکه ترکیبی از عوامل ویروسی و باکتریایی یا حتی قارچی میتواند به ایجاد بیماری شدید منجر شود. چنین شرایطی که به آن همعفونت یا Co-infection گفته میشود، پیچیدگی تشخیص و درمان را افزایش میدهد و خطر عوارض و مرگ و میر را بالا میبرد. شناسایی عوامل مستعد کننده این همعفونتها اهمیت بالینی زیادی دارد.
یکی از مهمترین عوامل، ضعف یا نقص ایمنی میزبان است. بیمارانی که به دلیل بیماریهای مزمن مانند دیابت، بیماریهای ریوی، نقص ایمنی مادرزادی یا اکتسابی، شیمیدرمانی، پیوند عضو یا درمان با داروهای سرکوبکننده ایمنی، قدرت پاسخ ایمنی کافی ندارند، آسیبپذیری بیشتری نسبت به ورود و تکثیر عوامل ویروسی و باکتریایی دارند. در این افراد، ویروسها با مهار پاسخ ایمنی اولیه محیط مناسبی برای رشد باکتریها فراهم میکنند، و بالعکس، باکتریها میتوانند عوارض التهاب سیستمیک را تشدید کنند.
سن بیمار نیز نقش مهمی در مستعد شدن برای عفونتها دارد. نوزادان و کودکان خردسال که سیستم ایمنی آنها هنوز به طور کامل تکامل نیافته است، و سالمندان که پاسخ ایمنی آنها به دلیل سن کاهش یافته است، بیشتر در معرض همعفونتها هستند. مطالعات نشان دادهاند که شیوع همعفونت در بیماران مسن مبتلا به عفونتهای تنفسی ویروسی، مانند آنفولانزا یا COVID-19، به شدت افزایش مییابد و پیامدهای بالینی وخیمتری ایجاد میکند.
شرایط محیطی و اجتماعی نیز میتواند مستعدکننده همعفونتها باشد. قرار گرفتن در محیطهای انبوه، بیمارستانها، مراکز نگهداری سالمندان یا مراکز درمانی با رعایت بهداشت ناکافی باعث افزایش تماس با عوامل بیماریزا و انتشار آنها میشود. همچنین، عوامل اقتصادی و دسترسی محدود به مراقبتهای بهداشتی میتواند منجر به تشخیص دیرهنگام و درمان ناکافی گردد که به نوبه خود ریسک همعفونتها را افزایش میدهد.
عفونتهای ویروسی اولیه یکی از شناختهشدهترین عوامل ایجاد زمینه برای عفونتهای باکتریایی ثانویه هستند. ویروسها میتوانند اپیتلیوم مخاطی را تخریب کرده، سلولهای ایمنی را مهار و پاسخ التهابی را تغییر دهند و باکتریها از این آسیبها برای ورود و تکثیر استفاده کنند. برای مثال، در عفونتهای تنفسی، ویروس آنفولانزا با تخریب سلولهای پوششی راههای هوایی، زمینه را برای ورود باکتریهایی مانند Streptococcus pneumoniae و Staphylococcus aureus فراهم میکند. مطالعات متاآنالیز نشان دادهاند که حدود ۲۰ تا ۳۰ درصد بیماران مبتلا به آنفولانزا دچار عفونت باکتریایی ثانویه میشوند که خطر مرگ و نیاز به بستری در ICU را به شدت افزایش میدهد.
مصرف بیرویه آنتیبیوتیکها و تغییر میکروبیوم طبیعی بدن نیز عامل مهمی در ایجاد همعفونتها است. آنتیبیوتیکها با کاهش جمعیت باکتریهای مفید، تعادل میکروبی را بر هم میزنند و باعث میشوند ویروسها و باکتریهای فرصتطلب رشد بیشتری داشته باشند. این تغییرات میکروبی نه تنها در روده و دستگاه گوارش بلکه در مخاط تنفسی و پوست نیز قابل توجه است و میتواند شدت عفونتها را افزایش دهد.
برخی بیماریها و شرایط مزمن نیز به عنوان عامل مستعد کننده همعفونتها شناخته میشوند. بیماریهای ریوی مانند آسم، COPD و فیبروز سیستیک باعث تغییر مخاط و اختلال عملکرد پاکسازی ریوی میشوند و فرصت رشد عوامل بیماریزا را فراهم میآورند. بیماریهای قلبی، کلیوی و کبدی نیز با تغییر پاسخ ایمنی سیستمیک و التهاب مزمن، زمینهای برای ابتلا به همعفونتها ایجاد میکنند.
نقش عوامل ژنتیکی و مولکولی در حساسیت به همعفونتها نیز تایید شده است. برخی جهشها یا پلیمورفیسمهای ژنی میتوانند سطح گیرندههای ویروسی، مسیرهای التهابی و فعالیت سلولهای ایمنی را تغییر دهند و توانایی بدن در مقابله همزمان با ویروس و باکتری را کاهش دهند. این یافتهها در حال حاضر زمینه تحقیقات پیشرفته در پیشبینی خطر و درمان هدفمند را فراهم کرده است.
در نهایت، شناسایی عوامل مستعد کننده و درک مکانیسمهای همعفونتها، اهمیت بالینی و تحقیقاتی بسیار دارد. این دانش به پزشکان امکان میدهد تا اقدامات پیشگیرانه، مراقبت ویژه بیماران پرخطر و درمانهای ترکیبی را طراحی کنند و از شدت بیماری و عوارض ثانویه جلوگیری نمایند. همچنین، این اطلاعات در طراحی واکسنهای ترکیبی، درمانهای ضدویروسی و ضدباکتریایی نوین و سیاستهای کنترل اپیدمی کاربرد دارد و میتواند باعث کاهش مرگ و میر بیماران شود.
روشهای درمان و مدیریت بالینی عفونتهای ویروسی و باکتریایی
مدیریت بالینی عفونتها نیازمند درک دقیق از نوع عامل بیماریزا، مسیر ورود، پاسخ ایمنی میزبان و عوامل مستعد کننده همعفونتها است. انتخاب روش درمان باید به گونهای باشد که هم مؤثر و هم ایمن باشد، به طوری که هم پاسخ ایمنی طبیعی میزبان را حمایت کند و هم از گسترش عفونت و عوارض جانبی جلوگیری نماید.
در عفونتهای ویروسی، درمان معمولاً به دو محور اصلی تقسیم میشود: داروهای ضدویروسی و مدیریت حمایتی. داروهای ضدویروسی مانند Oseltamivir برای آنفولانزا، Remdesivir برای COVID-19 و Acyclovir برای هرپس سیمپلکس مستقیماً چرخه تکثیر ویروس را مهار میکنند. استفاده به موقع از این داروها، به ویژه در مراحل اولیه عفونت، میتواند شدت بیماری، مدت بروز علائم و احتمال بروز عوارض ثانویه را کاهش دهد.
علاوه بر درمان دارویی، مدیریت حمایتی نقش حیاتی دارد. این شامل کنترل تب، حفظ تعادل مایعات و الکترولیتها، تغذیه مناسب و مراقبتهای تنفسی در صورت بروز علائم شدید میشود. حمایت از پاسخ ایمنی میزبان و کاهش استرس فیزیولوژیک میتواند توانایی بدن در مهار ویروس و جلوگیری از عفونتهای ثانویه باکتریایی را افزایش دهد.
در عفونتهای باکتریایی، درمان معمولاً با آنتیبیوتیکهای اختصاصی و حساسیتسنجی شده انجام میشود. انتخاب آنتیبیوتیک مناسب بر اساس کشت و تست حساسیت، شدت عفونت و محل درگیری بافتی انجام میگیرد. استفاده هدفمند از آنتیبیوتیکها باعث کاهش خطر مقاومت دارویی و آسیب به میکروبیوم طبیعی میشود. برخی باکتریها نیز ممکن است نیاز به درمان ترکیبی یا طولانی مدت داشته باشند، به ویژه در عفونتهای سیستمیک یا زیستفیلمدار.
در شرایط همعفونتهای ویروسی و باکتریایی، درمان باید ترکیبی و مرحلهای باشد. در ابتدا، کنترل عامل اصلی ویروسی و حمایت از پاسخ ایمنی، سپس مقابله با باکتریهای فرصتطلب مورد توجه قرار میگیرد. مطالعات نشان دادهاند که عدم شناسایی همعفونت باکتریایی در بیماران مبتلا به ویروس تنفسی میتواند باعث افزایش مرگ و میر و طول بستری بیمار شود. بنابراین، بررسی همزمان با پروکلسیتونین، کشتهای باکتریایی و تستهای مولکولی ضروری است تا درمان دقیق و هدفمند انتخاب شود.
یکی از روشهای نوین در مدیریت عفونتها، درمان هدفمند میزبان (Host-directed Therapy) است. این روش بر تقویت پاسخ ایمنی طبیعی میزبان یا مهار مسیرهای سلولی که ویروس یا باکتری از آنها استفاده میکنند تمرکز دارد. برای مثال، داروهایی که فعالیت سلولهای NK، ماکروفاژها یا مسیرهای سیگنالینگ ضدویروسی را تقویت میکنند، میتوانند همزمان عفونت ویروسی و باکتریایی را مهار کنند. تحقیقات اخیر نشان دادهاند که استفاده از این رویکرد میتواند شدت بیماری، عفونتهای ثانویه و نیاز به داروهای اختصاصی را کاهش دهد.
در زمینه پیشگیری و مدیریت عفونتها، واکسنها و اقدامات بهداشتی نیز نقش بسیار مهمی دارند. واکسنهای ویروسی، مانند واکسن آنفولانزا و COVID-19، با کاهش بار ویروسی، احتمال همعفونتهای باکتریایی و شدت بیماری را کاهش میدهند. در مورد باکتریها، واکسنهایی مانند واکسن پنوموکک و هموفیلوس انفلوانزا نوع b از بروز عفونتهای شدید ثانویه جلوگیری میکنند. علاوه بر واکسن، رعایت بهداشت شخصی، استفاده از ماسک، شستشوی دستها و مدیریت صحیح محیطهای بیمارستانی به کاهش شیوع عفونتها کمک میکند.
یکی دیگر از رویکردهای نوین، استفاده از فراوردههای بیولوژیک و درمانهای مبتنی بر میکروبیوم است. بازگرداندن تعادل میکروبیوم طبیعی با استفاده از پروبیوتیکها یا ترنسپلنت میکروبیوم میتواند مقاومت بدن در برابر ورود و تکثیر عوامل بیماریزا را افزایش دهد. همچنین، برخی داروهای ضدالتهابی هدفمند میتوانند پاسخ ایمنی بیش از حد یا مخرب را مهار کنند و از آسیب بافتی جلوگیری نمایند.
در موارد شدید و عفونتهای مقاوم، روشهایی مانند فیزوتراپی موضعی، تخلیه آبسهها، جراحیهای پاکسازی و درمانهای آنتیبادی اختصاصی نیز کاربرد دارند. در عفونتهای ویروسی پیشرفته، استفاده از آنتیبادیهای مونوکلونال و ایمونوتراپی هدفمند میتواند به کاهش بار ویروسی و کنترل التهاب کمک کند.
در نهایت، موفقیت مدیریت بالینی عفونتها وابسته به تشخیص دقیق، انتخاب درمان هدفمند، پیشگیری از همعفونتها و حمایت از پاسخ ایمنی میزبان است. ترکیب داروهای ضدویروسی، آنتیبیوتیکهای اختصاصی، روشهای حمایتی، واکسیناسیون و درمانهای نوین هدفمند، بهترین نتایج بالینی را به همراه دارد و میتواند باعث کاهش شدت بیماری، طول بستری، عوارض ثانویه و مرگ و میر بیماران شود.
پیشگیری و کنترل عفونتها
پیشگیری و کنترل عفونتهای ویروسی و باکتریایی نقش بسیار حیاتی در کاهش شیوع بیماریها، جلوگیری از بروز عفونتهای ثانویه و حفظ سلامت عمومی دارد. رویکردهای پیشگیرانه شامل اقدامات فردی، محیطی، واکسیناسیون، تغذیه و مراقبتهای پزشکی هدفمند است که هر کدام به صورت مکمل در کاهش خطر ابتلا و شدت بیماری عمل میکنند.
یکی از مهمترین ابزارهای پیشگیری، واکسیناسیون است. واکسنها با تحریک پاسخ ایمنی اختصاصی میزبان و ایجاد حافظه ایمنی طولانیمدت، از ابتلا به بسیاری از بیماریهای ویروسی و باکتریایی جلوگیری میکنند. برای مثال، واکسن آنفولانزا، واکسن COVID-19، واکسن پنوموکک و واکسن هموفیلوس انفلوانزا نوع b، نه تنها ابتلا به عامل بیماریزا را کاهش میدهند بلکه احتمال همعفونت و عوارض ثانویه را نیز کاهش میدهند. مطالعات نشان دادهاند که پوشش واکسیناسیون گسترده در جمعیت میتواند باعث کاهش بیماریهای حاد تنفسی، بستری شدن و مرگ و میر شود.
رعایت بهداشت فردی یکی دیگر از ارکان پیشگیری است. شستشوی مکرر دستها با آب و صابون، استفاده از ضدعفونیکنندههای الکلی، رعایت بهداشت دهان و دندان و اجتناب از تماس مستقیم با افراد بیمار، میتواند به شکل قابل توجهی از انتقال عوامل بیماریزا جلوگیری کند. همچنین، استفاده از ماسک در شرایط اپیدمی یا محیطهای شلوغ نقش مؤثری در کاهش انتشار ویروسهای تنفسی و باکتریهای فرصتطلب دارد.
کنترل محیطی و اقدامات بهداشتی در بیمارستانها نیز از اهمیت بالایی برخوردار است. ضدعفونی سطوح، تهویه مناسب، جداسازی بیماران مبتلا و رعایت اصول کنترل عفونتهای بیمارستانی، از گسترش عوامل بیماریزا جلوگیری میکند. این اقدامات به ویژه برای بیماران با سیستم ایمنی ضعیف، سالمندان و نوزادان حیاتی هستند، زیرا این گروهها بیشترین خطر ابتلا به همعفونتها و عوارض شدید را دارند.
تغذیه و مکملهای غذایی نیز میتوانند نقش پیشگیرانه ایفا کنند. مطالعات نشان دادهاند که سلنیوم و سایر ریزمغذیها با تقویت پاسخ ایمنی میزبان، کاهش التهاب و افزایش مقاومت در برابر ویروسها و باکتریها میتوانند احتمال ابتلا و شدت بیماری را کاهش دهند. تغذیه مناسب همچنین در بازسازی بافتها و بهبود عملکرد سلولهای ایمنی نقش دارد و میتواند از پیشرفت عفونتهای ثانویه جلوگیری کند.
پایش و تشخیص زودهنگام از دیگر ابزارهای پیشگیری است. شناسایی سریع عامل بیماریزا با استفاده از تستهای مولکولی، پروکلسیتونین، CRP و کشتهای باکتریایی، امکان درمان هدفمند و جلوگیری از گسترش عفونت را فراهم میکند. این رویکرد به ویژه در مدیریت اپیدمیها و بیماریهای تنفسی فراگیر اهمیت دارد.
یکی از رویکردهای نوین در کنترل عفونتها، تقویت میکروبیوم طبیعی بدن است. استفاده از پروبیوتیکها، پیشبیوتیکها و اصلاح سبک زندگی باعث میشود جمعیت باکتریهای مفید حفظ شده و رشد عوامل فرصتطلب محدود شود. این روش نه تنها برای پیشگیری از عفونتهای باکتریایی موثر است بلکه توانایی بدن در مقابله با ویروسها و کاهش شدت پاسخ التهابی را نیز افزایش میدهد.
در نهایت، آموزش و اطلاعرسانی به جامعه نیز جزء استراتژیهای اساسی است. آگاهی مردم درباره روشهای انتقال، علائم اولیه بیماری، زمان مناسب مراجعه به پزشک و اهمیت واکسیناسیون، باعث کاهش شیوع بیماری و مدیریت بهتر عفونتها میشود. ترکیب اقدامات فردی، محیطی، تغذیهای و پزشکی، بهترین نتیجه را در پیشگیری و کنترل عفونتها ایجاد میکند و به کاهش بیماریهای حاد، بستری شدن و مرگ و میر کمک شایانی مینماید.
چالشها و تحقیقات نوین در مدیریت عفونتهای ویروسی و باکتریایی
مدیریت عفونتهای ویروسی و باکتریایی با وجود پیشرفتهای علمی، هنوز با چالشهای بالینی، دارویی و اپیدمیولوژیک زیادی مواجه است. یکی از اصلیترین چالشها، تمایز دقیق بین عفونتهای ویروسی و باکتریایی در مراحل اولیه بیماری است. همانطور که پیشتر بررسی شد، بسیاری از علائم بالینی مشابه هستند و بدون روشهای آزمایشگاهی پیشرفته، تشخیص دقیق دشوار میشود. این مسأله منجر به تجویز بیرویه آنتیبیوتیکها، مقاومت دارویی و افزایش هزینههای درمانی میگردد.
چالش دیگر، همعفونتها و عفونتهای ثانویه است. ویروسها با تخریب اپیتلیوم و مهار پاسخ ایمنی، محیط مناسبی برای رشد باکتریهای فرصتطلب فراهم میکنند. به همین دلیل، حتی در شرایطی که عامل اولیه ویروسی است، ممکن است عفونتهای باکتریایی شدید یا مقاوم ایجاد شود. این وضعیت باعث پیچیدگی درمان، افزایش نیاز به داروهای ترکیبی و طولانی شدن بستری بیمار میشود.
مقاومت دارویی باکتریها و ویروسها یکی دیگر از مشکلات عمده است. با وجود دسترسی به آنتیبیوتیکها و داروهای ضدویروسی، مقاومت میتواند اثر درمان را کاهش دهد و نیاز به استفاده از داروهای نوین یا ترکیبی را افزایش دهد. ظهور سویههای مقاوم باکتریایی و ویروسهایی که نسبت به داروهای ضدویروسی مقاوم شدهاند، نیازمند تحقیقات گسترده و توسعه داروهای جدید با مکانیسمهای نوین است.
در این میان، تحقیقات نوین بر روی درمان هدفمند میزبان (Host-directed Therapy) توجه زیادی را به خود جلب کرده است. این رویکرد بر تقویت پاسخ ایمنی طبیعی میزبان یا مهار مسیرهای سلولی که ویروس یا باکتری از آن استفاده میکنند تمرکز دارد. نتایج مطالعات اخیر نشان دادهاند که استفاده از این استراتژی میتواند شدت بیماری و نیاز به داروهای اختصاصی را کاهش دهد و از عوارض ثانویه جلوگیری کند.
یکی دیگر از حوزههای تحقیقاتی پیشرفته، نقش میکروبیوم و عوامل محیطی در عفونتها است. تغییر تعادل میکروبی طبیعی بدن میتواند احتمال ورود و تکثیر عوامل بیماریزا را افزایش دهد. تحقیقات نشان دادهاند که بازگرداندن تعادل میکروبیوم از طریق پروبیوتیکها، پیشبیوتیکها و تغییرات سبک زندگی میتواند مقاومت بدن در برابر عفونتها را تقویت کند و شدت بیماری را کاهش دهد.
پیشرفتهای مولکولی و ژنتیکی نیز فرصتهای جدیدی ایجاد کردهاند. روشهای PCR، RT-PCR و توالییابی نسل جدید (NGS) امکان شناسایی سریع و دقیق عوامل بیماریزا، تعیین بار ویروسی یا باکتریایی و شناسایی سویههای مقاوم را فراهم میکنند. این روشها به ویژه در مدیریت اپیدمیها، تشخیص همعفونتها و انتخاب درمان هدفمند اهمیت حیاتی دارند.
چالش دیگر، کنترل عفونتها در جمعیتهای پرخطر است. بیماران با سیستم ایمنی ضعیف، سالمندان، نوزادان و بیماران بستری در ICU در معرض عفونتهای شدید، همعفونتها و مرگ و میر بالاتر هستند. مدیریت این بیماران نیازمند پایش مداوم، تشخیص سریع و ترکیبی از درمانهای دارویی و حمایتی است.
در زمینه داروهای نوین، آنتیبادیهای مونوکلونال و ایمونوتراپی هدفمند توجه ویژهای را به خود جلب کردهاند. این داروها میتوانند به صورت انتخابی ویروسها یا باکتریهای عامل بیماری را هدف قرار دهند و پاسخ ایمنی میزبان را تقویت کنند. مطالعات نشان دادهاند که استفاده از این درمانها در مراحل اولیه عفونت میتواند بار بیماری، شدت علائم و احتمال بروز عفونتهای ثانویه را کاهش دهد.
در نهایت، تحقیقات نوین بر روی پیشگیری و واکسیناسیون ترکیبی نیز در حال پیشرفت است. طراحی واکسنهایی که بتوانند همزمان علیه عوامل ویروسی و باکتریایی عمل کنند، میتواند نقش مهمی در کاهش بروز همعفونتها و کاهش مرگ و میر ایفا کند. این حوزه، با استفاده از فناوریهای مولکولی، شیمیایی و ایمونولوژیک، مسیر جدیدی برای کنترل بیماریهای پیچیده فراهم کرده است.