آنتیژن، پاتوژن و میزبان چیست؟
مقدمه
درک مفاهیم آنتیژن، پاتوژن و میزبان یکی از ستونهای اصلی علوم زیستی، ایمونولوژی و پزشکی مدرن است. این سه واژه نهتنها در پژوهشهای دانشگاهی و تخصصی بلکه در پزشکی بالینی، طراحی دارو و واکسن، تشخیص بیماریها و حتی در اپیدمیولوژی و بهداشت عمومی جایگاه حیاتی دارند. از همان زمانی که نخستین دانشمندان میکروبها و بیماریهای عفونی را مطالعه کردند، مشخص شد که رابطهای پیچیده و چندلایه میان موجود بیماریزا، بدن موجود زنده و مولکولهای شناساییشوندهای که پاسخ ایمنی را تحریک میکنند، وجود دارد.
آنتیژنها همان مولکولهایی هستند که میتوانند توسط سیستم ایمنی شناسایی شوند و پاسخ ایمنی را برانگیزند. آنها میتوانند بخشی از یک ویروس، باکتری، انگل یا حتی یک سلول سرطانی باشند. از سوی دیگر، پاتوژنها میکروارگانیسمهایی هستند که توانایی ایجاد بیماری را در میزبان دارند. این پاتوژنها برای زنده ماندن و تکثیر، باید بتوانند بر موانع دفاعی میزبان غلبه کنند و اغلب از طریق تغییر ساختار آنتیژنی یا بهرهگیری از مکانیسمهای پیچیدهای مانند فرار ایمنی، خود را از شناسایی مصون نگاه دارند. در این میان، میزبان همان موجود زندهای است که پاتوژن را در خود جای میدهد و نتیجه تعامل بین این دو، تعیین میکند که آیا بیماری بروز خواهد کرد، یا بدن موفق خواهد شد که عفونت را مهار کند.
اگرچه این مفاهیم در نگاه نخست ساده به نظر میرسند، اما در واقع در سطح مولکولی و سلولی بسیار پیچیده و پویا هستند. به عنوان مثال، یک ویروس میتواند بارها ساختار آنتیژنی خود را تغییر دهد تا از حافظه ایمنی میزبان فرار کند، پدیدهای که در ویروس آنفلوانزا و ویروسهای کرونا بهخوبی مشاهده میشود. از سوی دیگر، سیستم ایمنی میزبان نیز ابزارهای متعددی برای شناسایی و نابودی این عوامل تدارک دیده است، از جمله گیرندههای شناسایی الگو در ایمنی ذاتی، و ارائه آنتیژن توسط مولکولهای MHC در ایمنی تطبیقی. این پویایی دائمی یک نوع رقابت تکاملی میان پاتوژن و میزبان ایجاد کرده است که در طی میلیونها سال باعث شکلگیری سازوکارهای متقابل پیچیده شده است.
از جنبه پزشکی و بالینی، درک عمیق این تعاملات اهمیت فراوانی دارد. پزشکان برای تشخیص بیماریها از تستهایی استفاده میکنند که بر اساس شناسایی آنتیژنهای اختصاصی طراحی شدهاند. واکسنها نیز بر پایه ارائه فرمهای ضعیفشده یا غیرفعال آنتیژن ساخته میشوند تا سیستم ایمنی بدن را آموزش دهند و حافظهای پایدار ایجاد کنند. همچنین در درمانهای نوین مانند ایمونوتراپیهای سرطان، دانشمندان از خاصیت شناسایی آنتیژن توسط سیستم ایمنی بهره میبرند تا سلولهای غیرطبیعی را نابود کنند.
با این حال، چالشها همچنان پابرجاست. بسیاری از پاتوژنها مانند ویروس HIV یا انگل Trypanosoma brucei، به دلیل توانایی شگفتانگیز خود در تغییرات آنتیژنی، هنوز بهطور کامل مهار نشدهاند. افزون بر این، برخی افراد به دلیل ویژگیهای ژنتیکی خاص یا نقصهای ایمنی، میزبانهای آسیبپذیرتری در برابر پاتوژنها هستند. در چنین شرایطی، بیماری میتواند شکل شدیدتر یا پیچیدهتری به خود بگیرد.
بنابراین مطالعه آنتیژن، پاتوژن و میزبان تنها به توصیف یک رابطه سهگانه محدود نمیشود، بلکه دروازهای به سمت درک عمیقتر از زیستشناسی بیماریها، طراحی دارو و واکسن، و ارتقای سلامت عمومی است. در این مقاله تلاش خواهیم کرد تا این مفاهیم را به شکلی جامع و تحلیلی بررسی کنیم، از تعاریف پایهای گرفته تا پیچیدهترین تعاملات مولکولی و بالینی. همچنین به پرسشهایی خواهیم پرداخت که نهتنها برای دانشجویان و پژوهشگران بلکه برای متخصصان پزشکی، ایمونولوژیستها و حتی سیاستگذاران حوزه سلامت اهمیت دارند؛ پرسشهایی همچون: چه چیزی یک مولکول را به آنتیژن تبدیل میکند؟ چرا برخی پاتوژنها نسبت به دیگران کشندهترند؟ چه عواملی باعث میشود میزبان در برابر عفونتی خاص مقاوم یا حساس باشد؟ و چگونه میتوان با درک بهتر این تعاملات، استراتژیهای مؤثرتری برای پیشگیری و درمان بیماریها طراحی کرد؟
این مقدمه، زمینهای را برای ورود به بحثهای عمیقتر فراهم میکند. در بخشهای بعدی به تفصیل درباره آنتیژنها و انواع آنها، ویژگیها و نقششان در پاسخ ایمنی، سپس به بررسی پاتوژنها و سازوکارهای آنها، و در نهایت به نقش میزبان و ویژگیهای تعیینکنندهاش خواهیم پرداخت. هدف اصلی این مقاله ارائه یک مرور جامع و علمی است که همه جوانب تعاملات سهگانه آنتیژن–پاتوژن–میزبان را پوشش دهد و مسیر را برای درک بهتر بیماریها و طراحی ابزارهای پیشرفتهتر در حوزه پزشکی هموار کند.
تعریف و ماهیت آنتیژن
وقتی در علم ایمنیشناسی از آنتیژن سخن گفته میشود، در واقع به هر مولکولی اشاره داریم که توانایی شناسایی شدن توسط سیستم ایمنی را دارد. به عبارت دیگر، آنتیژنها همان شناسههای مولکولیاند که موجود زنده میتواند آنها را بهعنوان «خودی» یا «غیرخودی» تشخیص دهد. این ویژگی بنیادی، پایه و اساس تمام واکنشهای ایمنی در بدن انسان و دیگر موجودات زنده به شمار میآید.
آنتیژن میتواند یک پروتئین کامل، یک قطعه پپتیدی کوچک، یک پلیساکارید، لیپید متصل به پروتئین یا حتی بخشهایی از اسیدهای نوکلئیک باشد. نکته مهم این است که صرف حضور یک مولکول در بدن به معنای آنتیژن بودن آن نیست؛ بلکه توانایی برقراری تعامل با گیرندههای ایمنی، شرط اصلی تعریف آن است. برای مثال، پروتئینهای سطحی یک ویروس مانند هماگلوتینین در ویروس آنفلوانزا، یا لیپوپلیساکاریدهای دیواره باکتریهای گرممنفی، نمونههای بارز آنتیژنهایی هستند که سیستم ایمنی بهسرعت نسبت به آنها واکنش نشان میدهد.
از دیدگاه ایمونولوژی، میان آنتیژن و ایمونوژن تفاوتی ظریف اما مهم وجود دارد. هر ایمونوژن یک آنتیژن است، اما هر آنتیژن الزاماً ایمونوژن نیست. ایمونوژنها آن دسته از آنتیژنها هستند که علاوه بر قابلیت شناسایی توسط گیرندههای ایمنی، توانایی تحریک یک پاسخ ایمنی کامل و پایدار را نیز دارند. به عنوان مثال، بعضی آنتیژنها اگرچه توسط سلولهای ایمنی شناسایی میشوند، اما بهتنهایی قادر به ایجاد پاسخ ایمنی قوی نیستند و نیاز به حضور حاملها یا ادجوانتها دارند. این ویژگی اهمیت بسیاری در طراحی واکسنها دارد، چرا که انتخاب یک آنتیژن مؤثر به عنوان ایمونوژن میتواند تفاوت میان یک واکسن موفق و واکسنی ناکارآمد باشد.
ماهیت آنتیژنها به گونهای است که هر کدام شامل نواحی کوچکی به نام اپیتوپ یا دترمینانت آنتیژنی هستند. این بخشهای خاص از مولکول همان نقاطیاند که مستقیماً توسط گیرندههای لنفوسیتهای B یا T شناسایی میشوند. اپیتوپها ممکن است خطی باشند، یعنی از یک توالی متوالی از اسیدهای آمینه تشکیل شده باشند، یا سهبعدی (کونفورماسیونی) باشند که به واسطه چینش فضایی پروتئینها شکل میگیرند. همین اپیتوپها هستند که اساس اختصاصیت واکنشهای آنتیژن–آنتیبادی و آنتیژن–گیرنده TCR را تشکیل میدهند.
سیستم ایمنی موجودات زنده در طول تکامل بهگونهای شکل گرفته است که بتواند انواع متعددی از آنتیژنها را تشخیص دهد. این تنوع از طریق مکانیسمهای پیچیده بازآرایی ژنتیکی در لنفوسیتهای B و T فراهم میشود که امکان تولید میلیونها گیرنده متفاوت را به بدن میدهد. در نتیجه، تقریباً هیچ آنتیژنی وجود ندارد که سیستم ایمنی نتواند برای آن پاسخی بالقوه تولید کند. با این حال، شدت و کیفیت پاسخ به عوامل متعددی بستگی دارد؛ از جمله ساختار شیمیایی آنتیژن، میزان و مسیر ورود آن به بدن، حضور مولکولهای کمکی و نیز وضعیت ایمنی میزبان.
آنتیژنها را میتوان به دستههای گوناگونی تقسیم کرد. برخی از آنها آنتیژنهای اگزوژن هستند که از محیط خارج وارد بدن میشوند، مانند پروتئینهای ویروسی یا باکتریایی. دستهای دیگر آنتیژنهای اندوژن محسوب میشوند که درون سلولهای میزبان تولید میشوند، مانند پروتئینهای جهشیافته در سرطان یا پروتئینهای ویروسی سنتزشده در سلولهای آلوده. همچنین آنتیژنهای اتوژن وجود دارند که منشأ آنها مولکولهای طبیعی بدن است، اما در شرایط خاص توسط سیستم ایمنی بهعنوان غیرخودی شناسایی میشوند و زمینهساز بیماریهای خودایمنی میشوند.
یکی از جنبههای حیاتی درک ماهیت آنتیژنها، فرآیند پردازش و ارائه آنتیژن است. سلولهای ارائهدهنده آنتیژن (APCs) مانند دندریتیکها و ماکروفاژها آنتیژنها را جذب، تجزیه و سپس قطعات آنها را بر سطح خود به کمک مولکولهای MHC کلاس I و II نمایش میدهند. این فرآیند برای فعالسازی لنفوسیتهای T و شکلگیری پاسخ ایمنی تطبیقی ضروری است. در واقع بدون ارائه مناسب آنتیژن، سیستم ایمنی قادر به شناسایی دقیق عامل بیماریزا و هماهنگی در دفاع مؤثر نخواهد بود.
ویژگی دیگر آنتیژنها، تفاوت در ایمنیزایی آنهاست. برخی آنتیژنها بسیار قوی عمل میکنند و حتی در مقادیر اندک قادرند پاسخ ایمنی شدیدی ایجاد کنند، در حالی که برخی دیگر به سختی توسط سیستم ایمنی شناسایی میشوند. این تفاوتها به ساختار شیمیایی، اندازه مولکولی، پیچیدگی فضایی و حتی به نحوه تعامل با گیرندههای ذاتی وابسته است. به همین دلیل است که پروتئینها معمولاً قویترین ایمونوژنها به شمار میروند، در حالی که مولکولهای سادهتر مانند لیپیدها یا نوکلئیکاسیدها تنها در شرایط خاص میتوانند ایمونوژن باشند.
نکته قابل توجه دیگر، تنوع آنتیژنی در پاتوژنهاست. بسیاری از میکروارگانیسمها طی فرآیند تکامل توانستهاند با تغییر مداوم آنتیژنهای سطحی خود از دست سیستم ایمنی فرار کنند. این پدیده در ویروسها، باکتریها و انگلها بهخوبی مشاهده میشود. برای مثال، ویروس HIV و انگل Trypanosoma brucei بهطور مداوم ساختار آنتیژنی خود را تغییر میدهند و همین موضوع یکی از دلایل اصلی دشواری طراحی واکسنهای مؤثر علیه آنهاست.
آنتیژنها نه تنها برای سیستم ایمنی حیاتی هستند، بلکه در پزشکی کاربردهای گستردهای دارند. تستهای تشخیصی مانند ELISA یا تستهای سریع آنتیژنی برای شناسایی بیماریها، بر اساس همین اصل طراحی شدهاند. همچنین در درمانهای نوین، از آنتیژنهای توموری برای تحریک سیستم ایمنی علیه سلولهای سرطانی استفاده میشود. در واکسنسازی نیز انتخاب آنتیژن مناسب مهمترین گام در ایجاد ایمنی پایدار در برابر یک بیماری عفونی است.
بهطور خلاصه، آنتیژنها نه تنها کلید شناسایی عوامل بیماریزا توسط بدن هستند، بلکه در قلب تمام فرآیندهای ایمنی و پزشکی مدرن قرار دارند. آنها پلی میان دنیای میکروبها و دنیای میزباناند و بدون درک کامل ماهیت آنها، فهمیدن چگونگی عملکرد سیستم ایمنی و طراحی ابزارهای پیشرفته برای مقابله با بیماریها ممکن نخواهد بود.
پاتوژنها: تعریف و انواع
در علوم زیستی و پزشکی، واژه پاتوژن به هر موجود یا عامل زیستی اطلاق میشود که توانایی ایجاد بیماری در میزبان را دارد. این بیماریزایی میتواند از طریق مکانیسمهای گوناگون اتفاق بیفتد، از جمله تخریب مستقیم بافتها، ترشح سموم، فرار از پاسخهای ایمنی یا ایجاد اختلال در مسیرهای سیگنالینگ سلولی. پاتوژنها بخش جداییناپذیر از اکوسیستمهای زیستی هستند و در طول تاریخ تکامل، همواره در حال رقابت و همزیستی با میزبانهای خود بودهاند.
تعریف پاتوژن صرفاً به معنای «عامل بیماریزا» محدود نمیشود، بلکه شامل مجموعهای از ویژگیهای بیولوژیک است که امکان ورود، بقا، تکثیر و آسیبرسانی به موجود زنده میزبان را فراهم میکند. برخی پاتوژنها اجباری هستند و فقط در محیط درونسلولی میتوانند زنده بمانند، در حالی که برخی دیگر اختیاری بوده و هم در محیط خارج سلول و هم درون سلول قادر به رشد هستند. این تنوع نشان میدهد که بیماریزایی یک ویژگی مطلق نیست، بلکه نتیجه تعامل پیچیده میان پاتوژن و میزبان است.
یکی از ویژگیهای کلیدی پاتوژنها، اختصاصیت میزبان است. برخی پاتوژنها مانند ویروس هاری میتوانند طیف وسیعی از گونهها را آلوده کنند، در حالی که برخی دیگر مانند ویروس HIV تقریباً منحصر به انسان هستند. این اختصاصیت اغلب به دلیل تفاوت در گیرندههای سلولی، شرایط زیستی یا مکانیسمهای ایمنی میان گونههاست. همچنین، حتی در میان جمعیت انسانی، تفاوتهای ژنتیکی میتوانند باعث تفاوت در حساسیت به یک پاتوژن خاص شوند.
پاتوژنها را میتوان بر اساس ماهیت زیستی و ساختاری آنها به چند گروه اصلی تقسیم کرد: ویروسها، باکتریها، قارچها، انگلها و پریونها. هر کدام از این گروهها ویژگیها، مکانیسمهای بیماریزایی و راهبردهای فرار ایمنی خاص خود را دارند.
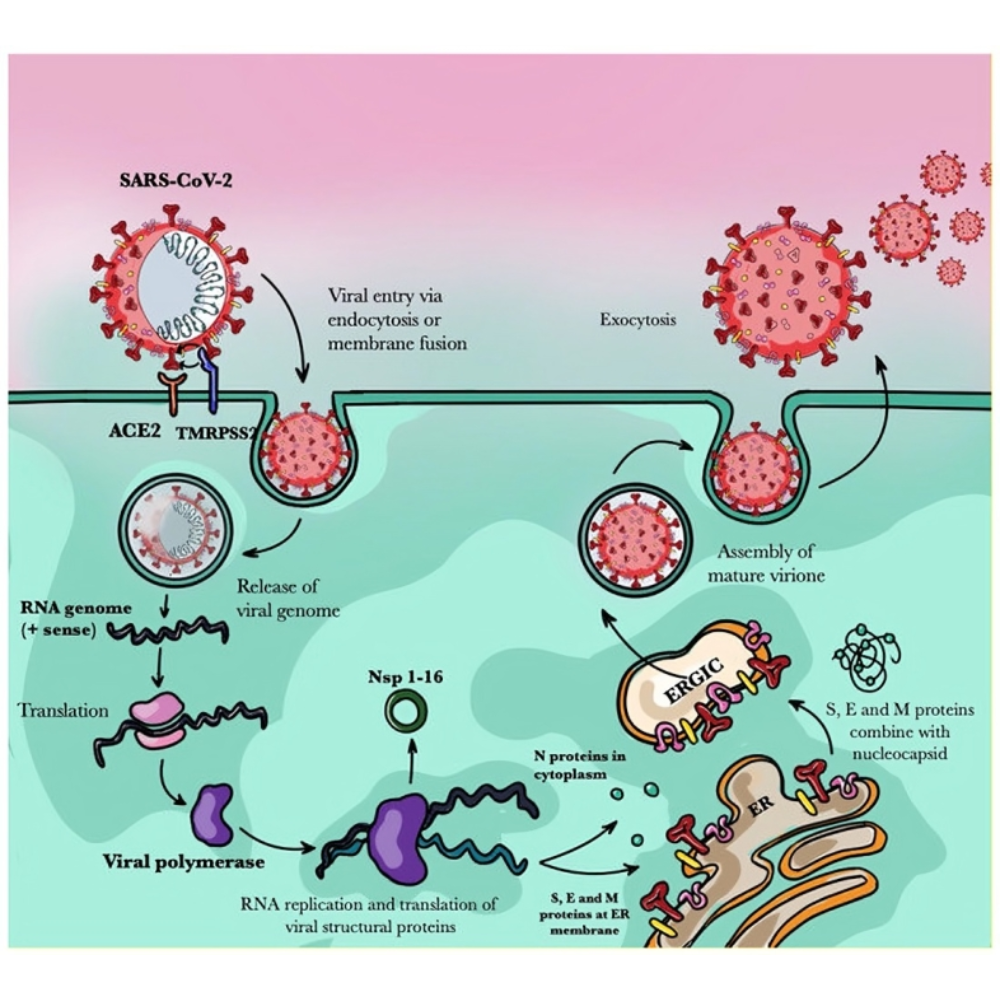
ویروسها شاید شناختهشدهترین پاتوژنها باشند. آنها موجوداتی غیرسلولی هستند که برای تکثیر به ماشین مولکولی سلول میزبان وابستهاند. ویروسها میتوانند بیماریهای خفیف مانند سرماخوردگی یا بیماریهای کشنده مانند ابولا، ایدز و کووید-۱۹ ایجاد کنند. ویژگی بارز آنها توانایی تغییرات ژنتیکی سریع و ایجاد تنوع آنتیژنی است که امکان فرار از سیستم ایمنی و دشواری در طراحی واکسنهای پایدار را فراهم میسازد. ویروس آنفلوانزا نمونهای کلاسیک از این ویژگی است که با تغییرات آنتیژنی مداوم خود، اپیدمیهای سالانه ایجاد میکند.
باکتریها نیز از مهمترین پاتوژنهای شناختهشده هستند. اگرچه بسیاری از باکتریها برای انسان بیضرر یا حتی مفیدند، اما گونههای پاتوژن آنها میتوانند طیف وسیعی از بیماریها از عفونتهای پوستی تا بیماریهای سیستمیک را ایجاد کنند. باکتریها معمولاً از طریق ترشح سموم اگزوژن یا اندوتوکسینها، یا از طریق مکانیسمهای تهاجمی مانند تهاجم به سلولهای اپیتلیال، بیماری ایجاد میکنند. نمونه بارز آنها Salmonella و Escherichia coli پاتوژن هستند که بیماریهای گوارشی شدیدی را به همراه دارند. برخی باکتریها نیز از طریق تشکیل بیوفیلمها مقاومت بیشتری در برابر سیستم ایمنی و آنتیبیوتیکها پیدا میکنند.
قارچها گروه دیگری از پاتوژنها هستند که اگرچه در مقایسه با ویروسها و باکتریها کمتر مورد توجه قرار میگیرند، اما میتوانند در شرایط خاص مانند ضعف سیستم ایمنی، بیماریهای جدی ایجاد کنند. عفونتهای قارچی سطحی مانند کاندیدیازیس پوستی شایع هستند، اما در بیماران مبتلا به نقص ایمنی، عفونتهای سیستمیک قارچی مانند آسپرژیلوزیس میتوانند تهدیدکننده حیات باشند.
انگلها شامل پروتوزوآها و کرمها نیز در شمار پاتوژنها قرار میگیرند. آنها با چرخههای زندگی پیچیده و سازوکارهای پیشرفته برای فرار از سیستم ایمنی، میتوانند بیماریهای مزمن ایجاد کنند. برای مثال، انگل Plasmodium عامل بیماری مالاریا است که همچنان یکی از مرگبارترین عفونتهای انسانی در جهان به شمار میرود. این انگل با تغییرات آنتیژنی در سطح گلبولهای قرمز آلوده، موفق میشود از پاسخ ایمنی فرار کند. انگلهای دیگری مانند Trypanosoma brucei با پوشاندن سطح خود توسط پروتئینهای متغیر سطحی، نمونهای کلاسیک از تنوع آنتیژنی هستند.
پریونها شاید عجیبترین گروه پاتوژنها باشند. آنها برخلاف سایر عوامل بیماریزا، فاقد ماده ژنتیکیاند و تنها از یک پروتئین نابجا تاخورده تشکیل شدهاند. این پروتئینها قادرند پروتئینهای طبیعی میزبان را نیز به ساختار نابجا تاخورده تبدیل کنند و بدین ترتیب بیماریهای تخریبکننده عصبی مانند بیماری کروتزفلد–یاکوب یا جنون گاوی را ایجاد کنند. اهمیت پریونها در این است که مرزهای تعریف کلاسیک پاتوژنها را شکستهاند و نشان دادهاند که حتی یک مولکول پروتئینی هم میتواند بهعنوان عامل بیماری عمل کند.
در کنار این دستهبندی کلاسیک، امروزه دانشمندان به نقش باکتریوفاژها یا ویروسهای آلودهکننده باکتریها نیز در تعاملات پاتوژن–میزبان توجه ویژهای دارند. برخی فاژها با انتقال ژنهای ویرولانس، قابلیت بیماریزایی باکتریها را افزایش میدهند. از سوی دیگر، رابطه پیچیده میان فاژها و سیستم ایمنی نیز بهتازگی کشف شده و نشان میدهد که این عوامل میتوانند هم به سود و هم به زیان میزبان عمل کنند.
ویژگی مهم دیگر پاتوژنها، توانایی ایجاد بیماریهای حاد یا مزمن است. برخی پاتوژنها مانند ویروس سرخک، عفونتی کوتاهمدت اما شدید ایجاد میکنند، در حالی که برخی دیگر مانند ویروس هپاتیت B یا ویروس HIV میتوانند برای سالها در بدن باقی بمانند و بیماریهای مزمن ایجاد کنند. این تفاوت تا حد زیادی به سازوکارهای فرار ایمنی، توانایی پنهان شدن در سلولهای خاص و تغییرات آنتیژنی وابسته است.
در نهایت باید به این نکته توجه داشت که پاتوژن بودن یک موجود مطلق و ثابت نیست. بسیاری از میکروبها در شرایط عادی همزیستهای بیضرری هستند، اما در شرایط خاص مانند تضعیف ایمنی یا تغییرات محیطی میتوانند به پاتوژن فرصتطلب تبدیل شوند. نمونه بارز این وضعیت، Candida albicans است که در حالت طبیعی بخشی از فلور میکروبی بدن محسوب میشود، اما در بیماران دچار نقص ایمنی میتواند عفونتهای جدی و حتی کشنده ایجاد کند.
بهطور کلی، پاتوژنها موجوداتی با تنوع بالا و سازوکارهای پیچیدهاند که برای بقا و گسترش خود ناچارند با سیستم ایمنی میزبان درگیر شوند. شناخت دقیق آنها نه تنها برای درک بیماریها ضروری است، بلکه کلید طراحی درمانها و واکسنهای نوین نیز به شمار میرود. مطالعه انواع پاتوژنها و درک راهبردهای مختلف آنها برای بقا و فرار ایمنی، یکی از جذابترین و در عین حال حیاتیترین موضوعات در علوم پزشکی و زیستی است.
میزبان: تعریف و ویژگیها
درک مفهوم میزبان در زیستشناسی و ایمنیشناسی برای شناخت ارتباط میان آنتیژن و پاتوژن اهمیت حیاتی دارد. میزبان در سادهترین تعریف، موجود زندهای است که بهعنوان بستر یا محیطی برای زندگی، تکثیر یا فعالیت یک عامل خارجی مانند میکروب، ویروس، انگل یا حتی سلولهای بیگانه عمل میکند. این رابطه میتواند شکلهای گوناگونی داشته باشد؛ از همزیستی مسالمتآمیز و سودمند تا بیماریزایی و آسیب شدید. به بیان دیگر، میزبان همیشه یک موجود منفعل و صرفاً پذیرنده نیست، بلکه سامانههای پیچیدهای دارد که در برابر تهاجم پاتوژنها واکنش نشان میدهد.
یکی از مهمترین ویژگیهای میزبان، تنوع زیستی و ژنتیکی آن است که نقش تعیینکنندهای در میزان آسیبپذیری یا مقاومت در برابر عوامل بیماریزا دارد. برخی گونهها یا حتی افراد درون یک جمعیت به دلیل تنوع ژنتیکی و تفاوت در ژنهای ایمنی مانند ژنهای MHC، واکنش متفاوتی نسبت به پاتوژنهای مشابه نشان میدهند. برای مثال، در مطالعات روی ویروس آنفلوآنزا دیده شده که تاریخچه ایمنی هر فرد، ناشی از مواجهه قبلی با سویههای ویروس، الگوی پاسخ او به عفونتهای جدید را شکل میدهد. همین پدیده که به آن گناه نخستین آنتیژنی یا Original Antigenic Sin گفته میشود، نشان میدهد که میزبانها همگی واکنش یکسانی به یک پاتوژن مشخص ندارند.
از دیدگاه ایمنیشناسی، میزبان یک موجود زنده با سیستم دفاعی پیچیده است که برای بقا طراحی شده است. این سیستم دفاعی شامل دو بخش ایمنی ذاتی و ایمنی اکتسابی است. ایمنی ذاتی شامل سدهای فیزیکی مانند پوست و مخاط، سلولهای فاگوسیت و مولکولهایی مانند کمپلمان میشود که نخستین خط دفاعی را تشکیل میدهند. در مقابل، ایمنی اکتسابی که اختصاصیتر و یادگیرنده است، توسط لنفوسیتهای B و T هدایت میشود و آنتیبادیها، سلولهای کشنده و حافظه ایمنی را ایجاد میکند. این تفاوت نشان میدهد که میزبان در برابر پاتوژن صرفاً منفعل نیست، بلکه یک بازیگر فعال در صحنه نبرد زیستی به شمار میآید.
ویژگی دیگر میزبان، وابستگی متقابل با پاتوژن است. هر پاتوژنی بدون حضور میزبان نمیتواند تکثیر یا فعالیت کند. به همین دلیل، بسیاری از پاتوژنها طی فرآیند تکامل خود بهطور خاص با میزبانهای معینی سازگار شدهاند. ویروس HIV تنها در انسان و برخی پستانداران خاص توانایی تکثیر دارد، در حالی که باکتری سالمونلا میتواند دامنه وسیعتری از میزبانها را آلوده کند. این تفاوت نشاندهنده وجود مکانیسمهای خاص در هر میزبان است که تعیین میکند کدام پاتوژن میتواند در بدن آن جای بگیرد و رشد کند.
میزبان همچنین دارای ویژگیهای فردی و محیطی است که میتواند بر شدت بیماری اثر بگذارد. عواملی همچون سن، وضعیت تغذیه، سلامت عمومی، استرس، وجود بیماریهای زمینهای و حتی میکروبیوم بدن، همگی در تعیین نتیجه تعامل میزبان و پاتوژن نقش دارند. برای مثال، در بیماری کووید-۱۹ مشاهده شد که افراد مسن یا مبتلایان به بیماریهای قلبی-عروقی و دیابت بهشدت بیشتر در معرض عوارض شدید قرار گرفتند، در حالی که کودکان یا افراد سالم جوان در بسیاری از موارد بدون علائم جدی بهبود یافتند.
نکته قابل توجه دیگر، پلاستیسیتی یا انعطافپذیری میزبان است. سامانه ایمنی موجودات زنده نه تنها قادر است با عوامل ناشناخته مقابله کند، بلکه در طول زمان تغییر یافته و خود را با شرایط جدید وفق میدهد. این موضوع در واکسیناسیون بهخوبی دیده میشود، زیرا میزبان با دریافت آنتیژن غیر فعال یا تضعیفشده، حافظهای پایدار ایجاد میکند که در مواجهه بعدی با همان پاتوژن، سرعت و شدت پاسخ ایمنی بسیار بیشتر خواهد بود.
از منظر اکولوژیکی نیز میزبان تنها یک موجود منفرد نیست، بلکه بخشی از یک شبکه بزرگ زیستی است. در این شبکه، پاتوژنها میان میزبانهای مختلف در گردشاند و میتوانند از حیوانات به انسان منتقل شوند یا بالعکس. بیماریهای زئونوز مانند آنفلوآنزای پرندگان، سارس و کرونا مثالهای بارزی هستند که نشان میدهند تعریف میزبان همواره محدود به یک گونه خاص نیست. بلکه گاه چندین گونه میتوانند بهعنوان مخزن یا واسطه عمل کرده و چرخه حیات پاتوژن را کامل کنند.
با همه این ابعاد، تعریف میزبان بهطور خلاصه چنین است: موجودی زنده که در تعامل پویا با پاتوژنها قرار دارد، میتواند از این تعامل متضرر شود یا در برخی شرایط حتی منفعت ببرد. این تعریف برخلاف نگاه سنتی که میزبان را صرفاً قربانی میدانست، بر نقش فعال و سازگار شونده آن تأکید دارد. در نهایت، ویژگیهای میزبان نهتنها تعیین میکند که چه نوع بیماری و با چه شدتی رخ دهد، بلکه مسیر تکاملی پاتوژنها و حتی اثربخشی مداخلات درمانی و واکسیناسیون را نیز مشخص میسازد.
تعامل آنتیژن، پاتوژن و میزبان
تعامل میان آنتیژن، پاتوژن و میزبان قلب تمام فرآیندهای زیستی و بیماریزایی در جهان زنده است. این تعامل نه تنها تعیینکننده بروز یا عدم بروز بیماری است، بلکه شدت و نوع پاسخ ایمنی، مسیر تکاملی پاتوژن و حتی اثرگذاری درمانها و واکسنها را مشخص میکند. برای درک این پیچیدگی، باید هر سه جزء را جداگانه و سپس به صورت یک شبکه پویا تحلیل کرد.
پاتوژنها با هدف بقا و تکثیر خود، همواره در تلاشاند که از سیستم ایمنی میزبان فرار کنند. این فرار معمولاً از طریق تغییرات آنتیژنی، تولید پروتئینهای مهارکننده پاسخ ایمنی، یا ایجاد محیطهای محافظتی مانند بیوفیلمها اتفاق میافتد. برای مثال، ویروس آنفلوانزا با تغییرات سالانه در پروتئینهای سطحی خود، مانع از شناسایی مؤثر توسط آنتیبادیهای موجود در بدن میزبان میشود. انگل Trypanosoma brucei نیز با پوشش پروتئینی متغیر، بهطور مداوم اپیتوپهای خود را تغییر میدهد تا از لنفوسیتهای میزبان فرار کند. این تغییرات آنتیژنی نشاندهنده یک رقابت تکاملی پیچیده میان پاتوژن و میزبان است که هر دو را وادار به سازگاری میکند.
از سوی دیگر، میزبان مجموعهای از مکانیسمهای دفاعی را دارد که شامل ایمنی ذاتی و تطبیقی است. ایمنی ذاتی اولین خط دفاعی است که از سدهای فیزیکی مانند پوست و مخاط، سلولهای فاگوسیت، و مولکولهای سیگنالدهنده مانند کمپلمان تشکیل شده است. این خط دفاعی میتواند پاتوژن را به صورت عمومی مهار کند، حتی پیش از اینکه سیستم ایمنی تطبیقی وارد عمل شود. ایمنی تطبیقی، که شامل لنفوسیتهای B و T است، قادر است پاسخ اختصاصی به هر آنتیژن را ایجاد کند و حافظه ایمنی بلندمدت را شکل دهد. فرآیند ارائه آنتیژن توسط سلولهای دندریتیک و ماکروفاژ، و نمایش آن بر مولکولهای MHC کلاس I و II، نقطه مرکزی این تعامل است. بدون این فرآیند، پاسخ ایمنی تطبیقی شکل نمیگیرد و پاتوژن فرصت گسترش خواهد داشت.
آنتیژنها نقش واسط و محرک را در این تعامل بازی میکنند. هر اپیتوپ آنتیژنی که توسط گیرندههای سلولهای ایمنی شناسایی میشود، میتواند پاسخهای متفاوتی ایجاد کند: از تولید آنتیبادی گرفته تا فعالسازی سلولهای T کشنده. ویژگی ساختاری و شیمیایی آنتیژن تعیینکننده قدرت و کیفیت این پاسخ است. به عنوان مثال، پروتئینهای بزرگ و پیچیده معمولاً ایمونوژنهای قویتری هستند و میتوانند پاسخ ایمنی قدرتمندی ایجاد کنند، در حالی که مولکولهای کوچک یا ساده ممکن است تنها در حضور ادجوانتها یا حاملها بتوانند پاسخ مؤثر تحریک کنند.
در طول تعامل میان این سه عنصر، تنوع و پویایی اهمیت ویژهای دارد. پاتوژنها با تغییرات آنتیژنی، میزبان را غافلگیر میکنند و میزبان با حافظه ایمنی و تغییر پاسخها، پاتوژن را مهار میکند. این چرخه مداوم رقابت و سازگاری باعث میشود که برخی بیماریها مزمن شوند، برخی دیگر سریع و شدید بروز کنند و برخی پاتوژنها کاملاً از سیستم ایمنی فرار کنند. به عنوان نمونه، ویروس HIV با مخفی شدن در سلولهای T حافظه و تغییر مداوم آنتیژنهای سطحی، سالها در بدن میزبان باقی میماند بدون آنکه سیستم ایمنی بتواند آن را بهطور کامل پاکسازی کند.
یکی دیگر از جنبههای حیاتی این تعامل، اختصاصیت آنتیژنی و میزبان است. برخی آنتیژنها تنها در یک میزبان خاص شناسایی میشوند و پاسخ ایمنی قوی ایجاد میکنند، در حالی که در میزبانهای دیگر ممکن است بیاثر باشند. این موضوع در طراحی واکسن و درمانهای هدفمند اهمیت دارد. برای مثال، واکسنهای مدرن علیه ویروسها و باکتریها بر اساس انتخاب آنتیژنهای خاص و مؤثر طراحی شدهاند که بیشترین پاسخ ایمنی را در جمعیت هدف ایجاد کنند.
پویایی محیطی و فیزیولوژیکی میزبان نیز بر این تعامل تأثیرگذار است. عواملی مانند سن، وضعیت تغذیه، بیماریهای زمینهای، داروهای مصرفی و حتی میکروبیوم طبیعی بدن میتوانند پاسخ میزبان را تقویت یا تضعیف کنند. در بیماریهای عفونی مانند کووید-۱۹ یا مالاریا، مشاهده شده که افراد با وضعیت ایمنی ضعیف یا ناهنجاریهای ژنتیکی نسبت به همان پاتوژن واکنش شدیدتری دارند و بیماریهای شدیدتر یا مزمنتر را تجربه میکنند.
تعامل سهگانه آنتیژن–پاتوژن–میزبان همچنین شامل اثرات تکاملی است. پاتوژنها و میزبانها در طول میلیونها سال تکامل، همواره در یک رقابت پیچیده بودهاند. پاتوژنهایی که میتوانند میزبان را آلوده کنند اما کشنده نباشند، شانس بیشتری برای انتشار دارند، در حالی که میزبانهایی که پاسخ ایمنی مؤثر دارند، زنده میمانند و نسل خود را منتقل میکنند. این تعاملهای انتخاب طبیعی باعث شکلگیری مکانیسمهای پیشرفتهای در هر دو طرف شده است که هنوز در حال مطالعه و کشف هستند.
در نهایت، این تعامل پیچیده برای علم پزشکی اهمیت مستقیم دارد. شناسایی نحوه واکنش میزبان به آنتیژنها و استراتژیهای فرار پاتوژن، پایه طراحی واکسنها، درمانهای ایمونوتراپی و داروهای ضد میکروبی را تشکیل میدهد. بدون درک عمیق این شبکه پویا، پیشبینی نتایج بیماریها و اثربخشی مداخلات درمانی بسیار دشوار خواهد بود.
به طور خلاصه، تعامل میان آنتیژن، پاتوژن و میزبان یک شبکه پیچیده و پویا است که در آن هر عنصر با دیگری در حال رقابت و سازگاری است. این تعامل تعیین میکند که بیماری چگونه بروز کند، چه شدتی داشته باشد، و آیا بدن میزبان قادر خواهد بود که آن را مهار یا حذف کند. درک عمیق این فرآیند، کلید موفقیت در پیشگیری، درمان و کنترل بیماریهای عفونی و غیرعفونی در انسان و دیگر موجودات زنده است.
مکانیسمهای دفاع ایمنی در برابر پاتوژنها
یکی از بنیادیترین مفاهیم در ایمنیشناسی، دفاعهای میزبان در برابر پاتوژنها است. بدن موجودات زنده، بهویژه انسان، با برخورداری از یک سیستم ایمنی پیچیده و چندلایه، قادر است انواع متنوعی از عوامل بیماریزا را شناسایی، مهار و حذف کند. این دفاعها ترکیبی از مکانیسمهای ذاتی و اکتسابی هستند که هر کدام ویژگیها، وظایف و محدودیتهای خاص خود را دارند.
ایمنی ذاتی (Innate Immunity) نخستین و سریعترین خط دفاعی بدن در برابر پاتوژنها است. این ایمنی نه اختصاصی است و نه حافظه بلندمدت ایجاد میکند، اما برای کنترل اولیه عفونت و جلوگیری از گسترش سریع پاتوژن حیاتی است. سدهای فیزیکی و شیمیایی مانند پوست، غشاهای مخاطی، مژکها و ترشحات آنزیمی (مثلاً لیزوزیم در بزاق و اشک) نخستین مرز مقابله با ورود پاتوژنها را تشکیل میدهند. علاوه بر این، سلولهای فاگوسیتیک مانند ماکروفاژها و نوتروفیلها، با بلع و تخریب میکروبها، نقش حیاتی در کنترل اولیه عفونت دارند. ماکروفاژها نه تنها پاتوژنها را از بین میبرند، بلکه با ارائه آنتیژن و ترشح سیتوکینها، ارتباط مهمی با سیستم ایمنی تطبیقی برقرار میکنند.
مولکولهای سیگنالدهنده ذاتی نیز نقش حیاتی در ایمنی ذاتی ایفا میکنند. کمپلمان، مجموعهای از پروتئینهای پلاسما است که میتواند پاتوژنها را پوششدهی، لیز یا جذب فاگوسیتها کند. همچنین گیرندههای شناسایی الگو (Pattern Recognition Receptors یا PRRs) مانند Toll-like Receptors، مولکولهای مشترک در پاتوژنها (PAMPs) را شناسایی میکنند و منجر به فعالسازی مسیرهای التهابی میشوند. این فرآیند، نمونهای از هماهنگی میان تشخیص آنتیژنهای غیرخودی و فعالسازی مکانیسمهای دفاعی است.
در مقابل ایمنی ذاتی، ایمنی تطبیقی (Adaptive Immunity) ویژگیهای اختصاصی و حافظهای دارد که توانایی شناسایی و پاسخ طولانیمدت به آنتیژنها را فراهم میکند. این ایمنی شامل لنفوسیتهای B و T و مولکولهای مرتبط با آنهاست. لنفوسیتهای B مسئول تولید آنتیبادیها هستند که به آنتیژنهای پاتوژن متصل میشوند و عملکردهای مختلفی دارند؛ از خنثیسازی سموم گرفته تا ایجاد کمپلکسهای فاگوسیتیک و فعالسازی مسیر کمپلمان. لنفوسیتهای T شامل زیرگروههای مختلفی هستند؛ T helper که پاسخ ایمنی B را تقویت میکند، T cytotoxic که سلولهای آلوده به ویروس یا سلولهای سرطانی را نابود میکند، و T regulatory که تعادل سیستم ایمنی را حفظ میکند و از بروز واکنشهای خودایمنی جلوگیری میکند.
ارائه آنتیژن یکی از حیاتیترین مکانیسمها در دفاع ایمنی است. سلولهای ارائهدهنده آنتیژن، مانند دندریتیکها و ماکروفاژها، پاتوژنها را بلعیده و تجزیه میکنند و قطعات آنتیژنی آنها را بر سطح خود به کمک مولکولهای MHC نمایش میدهند. این فرآیند، کلید فعالسازی لنفوسیتهای T است و ارتباط مستقیم میان ایمنی ذاتی و تطبیقی را فراهم میکند. بدون ارائه مؤثر آنتیژن، پاسخ ایمنی اختصاصی شکل نمیگیرد و پاتوژن فرصت گسترش پیدا میکند.
یکی دیگر از مکانیسمهای حیاتی، تولید سیتوکینها و کموتاکتیکها است. این مولکولها بهعنوان پیامرسانهای شیمیایی عمل میکنند و نه تنها سلولهای ایمنی را به محل عفونت هدایت میکنند، بلکه شدت و نوع پاسخ ایمنی را تنظیم میکنند. به عنوان مثال، اینترلوکینها و اینترفرونها میتوانند در مقابله با ویروسها و باکتریها اثر مستقیم داشته و فعالیت سلولهای کشنده طبیعی (NK cells) را تحریک کنند.
ایمنی سلولی و هومورال نیز در کنار هم فعالیت میکنند. در ایمنی هومورال، آنتیبادیها و سایر عوامل محلول در خون و مایعات میانبافتی نقش دارند، در حالی که ایمنی سلولی شامل فعالیت سلولهای T cytotoxic، NK cells و ماکروفاژهاست که پاتوژنها یا سلولهای آلوده را مستقیماً نابود میکنند. این تقسیم وظایف باعث میشود که سیستم ایمنی بتواند با انواع مختلف پاتوژنها—از ویروسهای درونسلولی گرفته تا باکتریهای خارجسلولی و انگلهای پیچیده—موثر برخورد کند.
پاتوژنها برای مقابله با این مکانیسمها استراتژیهای فرار خاص خود را توسعه دادهاند. برخی با تغییر آنتیژنی مداوم، برخی با سرکوب تولید سیتوکینها و برخی دیگر با پنهان شدن در سلولهای خاص، از پاسخ ایمنی میزبان فرار میکنند. مطالعه این مکانیسمها نشان میدهد که دفاع ایمنی نه تنها به تنوع و پیچیدگی خود سلولها وابسته است، بلکه به تعامل پویا با استراتژیهای فرار پاتوژن نیز بستگی دارد.
در نهایت، ایمنی اکتسابی حافظهای ایجاد میکند که امکان پاسخ سریع و مؤثر در مواجهههای بعدی با همان پاتوژن را فراهم میآورد. این ویژگی اساس واکسیناسیون است و نشان میدهد که بدن میزبان میتواند از تجربههای قبلی خود بهره ببرد تا در آینده بهتر از خود دفاع کند. حافظه ایمنی میتواند سالها یا حتی دههها باقی بماند و عامل اصلی موفقیت واکسنها در کنترل بیماریهای عفونی است.
به طور خلاصه، مکانیسمهای دفاع ایمنی شامل خطوط دفاعی متعدد و هماهنگ هستند که از سدهای فیزیکی و سلولی اولیه تا پاسخهای اختصاصی و حافظهای متغیر میشوند. تعامل میان این مکانیسمها و راهبردهای فرار پاتوژن، تعیینکننده نتیجه نهایی مواجهه با بیماری است و کلید درک پیشگیری، درمان و کنترل بیماریهای عفونی در انسان و سایر موجودات زنده به شمار میآید.
تغییرات آنتیژنی و پیامدهای آن
یکی از مهمترین مکانیسمهایی که پاتوژنها برای فرار از سیستم ایمنی میزبان به کار میبرند، تغییرات آنتیژنی است. این تغییرات میتوانند ساختار پروتئینها یا سایر مولکولهای سطحی پاتوژن را به گونهای تغییر دهند که دیگر توسط آنتیبادیها یا سلولهای T شناسایی نشوند. پیامد این تغییرات نه تنها ادامه بقای پاتوژن در بدن میزبان را تضمین میکند، بلکه تأثیر عمیقی بر طراحی واکسنها، پیشبینی اپیدمیها و پاسخ ایمنی جمعیتی دارد.
تغییرات آنتیژنی معمولاً در دو قالب اصلی ظاهر میشوند: تغییرات جزئی (Antigenic Drift) و تغییرات عمده (Antigenic Shift). تغییرات جزئی، ناشی از جهشهای کوچک در ژنهای کدکننده پروتئینهای سطحی است و اغلب منجر به فرار جزئی از آنتیبادیهای موجود میشود. ویروس آنفلوانزا نمونه کلاسیک این مکانیسم است؛ تغییرات جزئی سالانه در پروتئینهای همگلوتینین و نورآمینیداز سبب میشوند که واکسنهای قبلی تا حدی اثرگذاری خود را از دست بدهند و افراد حتی با سابقه واکسیناسیون نیز ممکن است به سویههای جدید آلوده شوند.
در مقابل، تغییرات عمده، که بیشتر در ویروسهای دارای ژنوم بخشبندیشده رخ میدهند، شامل بازترکیبی ژنتیکی است و میتواند منجر به ظهور سویههای کاملاً جدید و بالقوه خطرناک شود. این نوع تغییرات اغلب مسئول اپیدمیهای جهانی یا پاندمیها هستند، چرا که جمعیت میزبان هیچ حافظه ایمنی قبلی علیه آنتیژنهای جدید ندارد. پاندمی آنفلوانزای ۱۹۱۸ و پاندمی H1N1 سال ۲۰۰۹ نمونههای بارزی از این پدیده هستند.
در باکتریها و انگلها نیز تغییرات آنتیژنی اهمیت حیاتی دارد. برخی باکتریها، مانند Borrelia burgdorferi عامل بیماری لایم، از مکانیسمهای تبدیل ژنهای بخشبندیشده و متغیر استفاده میکنند تا سطح پروتئینهای خود را بهطور مداوم تغییر دهند و از سیستم ایمنی میزبان فرار کنند. انگل Trypanosoma brucei نیز با استفاده از پوشش VSG (Variant Surface Glycoprotein) نمونهای کلاسیک از تغییر آنتیژنی را ارائه میدهد که باعث تداوم عفونت مزمن و پیچیده در میزبان میشود. این نوع تغییرات، بهویژه در بیماریهای مزمن، عامل اصلی ناتوانی سیستم ایمنی در پاکسازی کامل پاتوژن است.
پیامدهای تغییرات آنتیژنی بسیار گسترده است و نه تنها شامل بقا و تکثیر پاتوژن میشود، بلکه طراحی واکسن و استراتژیهای پیشگیری از بیماریها را تحت تأثیر قرار میدهد. واکسنها معمولاً بر اساس آنتیژنهای شناختهشده و ایمن طراحی میشوند؛ اما وقتی پاتوژن آنتیژنی جدیدی ایجاد میکند، واکسن قبلی ممکن است ناکارآمد شود. به همین دلیل، برخی واکسنها مانند واکسن آنفلوانزا باید سالانه بهروزرسانی شوند.
تغییرات آنتیژنی همچنین بر سازگاری تکاملی پاتوژنها اثر میگذارد. پاتوژنهایی که توانایی تغییر سریع آنتیژنها را دارند، فرصت بیشتری برای انتشار در جمعیتهای میزبان پیدا میکنند و فشار انتخاب طبیعی بر میزبانها افزایش مییابد. میزبانهایی که توانایی شناسایی این تغییرات یا پاسخ ایمنی سریع را دارند، شانس بیشتری برای بقا خواهند داشت. این فرآیند باعث ایجاد یک چرخه رقابت تکاملی پویا میان پاتوژن و میزبان میشود که در طول تاریخ تکامل ادامه یافته است.
یکی دیگر از پیامدهای تغییرات آنتیژنی، ایجاد بیماریهای مزمن و عودکننده است. پاتوژنهایی که میتوانند سطح آنتیژن خود را بهطور مداوم تغییر دهند، اغلب قادرند برای ماهها یا سالها در بدن میزبان باقی بمانند، بدون اینکه سیستم ایمنی بتواند آنها را بهطور کامل حذف کند. این مسئله در بیماریهای ویروسی مزمن مانند HIV و هپاتیت B و همچنین در برخی عفونتهای باکتریایی و انگلی، مشاهده میشود.
از سوی دیگر، تغییرات آنتیژنی میتوانند منجر به پدیده گناه نخستین آنتیژنی (Original Antigenic Sin) شوند. این پدیده زمانی رخ میدهد که سیستم ایمنی میزبان، بر اساس مواجهه قبلی با سویهای از پاتوژن، پاسخ خود را طراحی کند و در مواجهه با سویه جدید، پاسخ ایمنی کامل و بهینه شکل نگیرد. به عبارت دیگر، حافظه ایمنی گذشته ممکن است محدودیتهایی ایجاد کند و پاسخ به آنتیژن جدید را کاهش دهد.
تغییرات آنتیژنی همچنین پیچیدگی در تشخیص و درمان بالینی ایجاد میکنند. برای مثال، شناسایی سویههای جدید ویروسی یا باکتریایی برای تعیین درمان مناسب و کنترل اپیدمی ضروری است. این تغییرات همچنین موجب میشوند که آنتیبادیهای مونوکلونال یا داروهای هدفمند، در برخی مواقع اثربخشی خود را از دست بدهند، و نیاز به طراحی مجدد یا استفاده از داروهای ترکیبی ایجاد شود.
به طور خلاصه، تغییرات آنتیژنی یک استراتژی تکاملی حیاتی برای پاتوژنها است که بقای آنها را در برابر سیستم ایمنی میزبان تضمین میکند و پیامدهای گستردهای در اپیدمیولوژی، طراحی واکسن، پاسخ ایمنی جمعیتی و مدیریت بیماریهای عفونی دارد. درک کامل این مکانیسم، پایهای برای پیشبینی روند بیماریها و توسعه مداخلات درمانی و پیشگیرانه مؤثر است.
میزبان و پاتوژن در بستر تکاملی
برای درک عمیق تعامل میان میزبان و پاتوژن، نمیتوان تنها به مکانیسمهای آنی ایمنی و تغییرات آنتیژنی بسنده کرد؛ بلکه باید این تعامل را در بستر تکاملی نیز بررسی کرد. تکامل میزبان و پاتوژن، حاصل میلیونها سال رقابت و سازگاری متقابل است که منجر به شکلگیری مکانیسمهای دفاعی و استراتژیهای فرار پیشرفته شده است. این فرآیندهای تکاملی نه تنها بر بقا و انتشار پاتوژنها اثر میگذارند، بلکه مسیر تکامل ایمنی میزبان را نیز شکل میدهند و تعیینکننده پیچیدگی پاسخهای ایمنی و تنوع ژنتیکی جمعیتها هستند.
در این بستر، پاتوژنها بهعنوان عامل فشار انتخابی عمل میکنند. هر میزبان که قادر به شناسایی سریع و مؤثر آنتیژنهای پاتوژن باشد، شانس بیشتری برای بقا و تولید مثل دارد. به همین دلیل، ژنهای مرتبط با ایمنی، مانند ژنهای MHC و TLR، تحت فشار انتخابی شدید قرار دارند و تنوع بالایی در جمعیتها مشاهده میشود. این تنوع، اساس شناسایی طیف وسیعی از آنتیژنها و پاسخ به انواع پاتوژنها را فراهم میکند. مطالعه تطبیقی نشان داده است که گونههایی با تنوع ژنتیکی بیشتر در ژنهای ایمنی، نسبت به بیماریهای عفونی مقاومت بالاتری دارند.
از سوی دیگر، پاتوژنها نیز تحت فشار انتخابی میزبان قرار دارند و باید استراتژیهای فرار و سازگاری تکاملی را توسعه دهند. این استراتژیها شامل تغییرات آنتیژنی، تولید مولکولهای مهارکننده پاسخ ایمنی، پنهان شدن در سلولهای خاص میزبان، یا استفاده از مخازن حیوانی و محیطی برای تکثیر است. برای مثال، ویروسهای آنفلوانزا و کروناویروسها، با تغییرات مداوم در پروتئینهای سطحی، امکان گریز از پاسخ ایمنی جمعیتهای انسانی را دارند، در حالی که برخی باکتریها مانند Salmonella و Borrelia با تطابق به میزبانهای مختلف، چرخه زندگی خود را بهینه میکنند.
یکی از مفاهیم کلیدی در بستر تکاملی، همزیستی و سازگاری متقابل است. پاتوژنهایی که میزبان خود را بیش از حد تخریب کنند، شانس کمتری برای انتشار دارند، چرا که میزبان بیمار نمیتواند به دیگران پاتوژن منتقل کند. به همین دلیل، بسیاری از پاتوژنها به سمت ویروسها و باکتریهای تعادلی و کمضرر حرکت میکنند که موجب بیماری شدید نشوند و بتوانند چرخه خود را ادامه دهند. این نوع همزیستی اغلب در پاتوژنهای اندوسیتیک و برخی ویروسهای مزمن مشاهده میشود و نمونهای از تکامل تعادلی میزبان–پاتوژن است.
تکامل میزبان نیز با تغییرات محیطی و فشارهای بیماریزا شکل گرفته است. جمعیتهایی که در معرض پاتوژنهای مرگبار بودهاند، طی نسلها ویژگیهای ژنتیکی مقاومت را کسب کردهاند. برای مثال، جهش در ژن CCR5 که گیرنده ویروس HIV است، در برخی جمعیتها شناسایی شده و مقاومت نسبی ایجاد میکند. به همین ترتیب، مقاومت به مالاریا در برخی جمعیتها با هموگلوبینهای جهشیافته (مانند تالاسمی و سلول داسی شکل) نشان داده شده است. این نمونهها نشان میدهند که تکامل میزبان نه تنها پاسخ ایمنی، بلکه ساختار ژنتیکی و ویژگیهای فیزیولوژیک را نیز شکل میدهد.
چرخه تکاملی میزبان و پاتوژن یک فرآیند پویا است که بهطور مداوم منجر به ظهور سویههای جدید، تغییرات آنتیژنی و پاسخهای ایمنی پیچیده میشود. این چرخه باعث میشود که جمعیتهای میزبان هرگز یکسان نباشند و تنوع ژنتیکی و ایمنی، همیشه در حال تغییر باشد. این نکته، اهمیت طراحی واکسنهای مؤثر و پیشبینی اپیدمیها را دوچندان میکند، زیرا پاتوژنها همواره در حال تغییر و سازگاری هستند و میزبانها نیز پاسخهای جدیدی ایجاد میکنند.
علاوه بر این، تکامل همزمان پاتوژنها و میزبانها میتواند پیامدهای غیرمنتظرهای در سطح جمعیتی ایجاد کند. گاهی یک پاتوژن جدید که توانایی تغییر سریع آنتیژنی دارد، میتواند بهسرعت در جمعیت انسانی منتشر شود و اپیدمی ایجاد کند، همانند ظهور سویههای جدید آنفلوانزا یا کروناویروسها. در مقابل، میزبانهایی که دارای حافظه ایمنی قبلی یا تنوع ژنتیکی بالا هستند، میتوانند شیوع را کنترل کنند یا شدت بیماری را کاهش دهند. این تعامل پیچیده، اساس مطالعه اپیدمیولوژی تکاملی است و در پیشبینی و مدیریت بیماریهای عفونی کاربرد دارد.
نکته مهم دیگر، تأثیر انتخاب طبیعی بر ویروسها و باکتریها است. پاتوژنهایی که توانایی فرار از سیستم ایمنی و تکثیر مؤثر را دارند، شانس بیشتری برای انتشار و ایجاد اپیدمی خواهند داشت، در حالی که سویههای ضعیفتر از چرخه تکاملی حذف میشوند. همین اصل باعث میشود که جمعیتهای میزبان و پاتوژنها همواره در یک رقابت پویا و مداوم باشند که هر دو طرف را مجبور به سازگاری و تغییر میکند.
به طور خلاصه، نگاه تکاملی به تعامل میزبان و پاتوژن نشان میدهد که این رابطه صرفاً یک نبرد آنی و کوتاهمدت نیست، بلکه نتیجه میلیونها سال سازگاری و انتخاب طبیعی است. در این بستر، میزبانها و پاتوژنها یکدیگر را شکل میدهند، هر یک با استراتژیها و پاسخهای خود، و این تعامل باعث ایجاد تنوع ژنتیکی، پیچیدگی ایمنی و تغییرات آنتیژنی مداوم میشود که اساس بسیاری از چالشهای علمی، پزشکی و اپیدمیولوژیک امروز را تشکیل میدهد.
پیامدهای بالینی و پزشکی
تعامل میان آنتیژن، پاتوژن و میزبان نه تنها موضوعی بنیادین در ایمنیشناسی و زیستشناسی مولکولی است، بلکه پیامدهای گستردهای در حوزه بالینی و پزشکی دارد. درک این پیامدها، کلید پیشگیری، تشخیص و درمان مؤثر بیماریهای عفونی و مزمن به شمار میآید. این بخش به بررسی کامل اثرات بالینی، چالشهای درمانی، و اهمیت در طراحی استراتژیهای پزشکی اختصاص یافته است.
یکی از واضحترین پیامدها، تشخیص و تعیین نوع بیماری است. شناسایی پاتوژن و آنتیژنهای مرتبط، پایه هر تشخیص دقیق بالینی است. آزمایشهای سرولوژیک و مولکولی، مانند ELISA، PCR و توالییابی ژنتیکی، قادرند حضور آنتیژنها یا ژنهای پاتوژن را در نمونههای بالینی شناسایی کنند. این روشها، سرعت و دقت تشخیص را افزایش میدهند و به پزشکان امکان میدهند که درمان هدفمند و مناسب را انتخاب کنند. به عنوان مثال، تشخیص سریع سویههای ویروسی یا باکتریایی مقاوم به دارو، نقش حیاتی در کنترل اپیدمیها و کاهش مرگومیر دارد.
پیامد بعدی، طراحی درمانهای هدفمند است. آگاهی از ساختار آنتیژنها و تغییرات آنها، امکان توسعه داروهای ضدویروسی، آنتیبیوتیکها و ایمونوتراپیهای اختصاصی را فراهم میکند. در بیماریهای ویروسی مانند HIV یا هپاتیت B، داروهای ترکیبی طراحی شدهاند تا مراحل مختلف چرخه تکثیر ویروس را هدف قرار دهند و اثر فرار آنتیژنی را کاهش دهند. در عفونتهای باکتریایی مقاوم، شناسایی مکانیسمهای مقاومت و آنتیژنهای سطحی، امکان تولید آنتیبادیهای مونوکلونال یا واکسنهای ضدباکتری را فراهم میآورد.
یکی دیگر از پیامدهای بالینی مهم، پیشگیری و واکسیناسیون است. طراحی واکسنهای مؤثر مستلزم درک کامل از آنتیژنهای کلیدی پاتوژن و پاسخ ایمنی میزبان است. واکسنهای مدرن، مانند واکسنهای mRNA یا واکسنهای پروتئینی نوترکیب، بر اساس شناسایی دقیق آنتیژنها و مسیرهای فعالسازی لنفوسیتهای B و T طراحی میشوند. این واکسنها قادرند پاسخ ایمنی قوی و حافظهای ایجاد کنند، حتی در برابر پاتوژنهایی که تغییرات آنتیژنی سریع دارند. بدون شناخت تعامل میان میزبان و پاتوژن، طراحی واکسنهای مؤثر تقریبا غیرممکن خواهد بود.
مدیریت بیماریهای مزمن و عودکننده نیز به درک تعامل آنتیژن–پاتوژن–میزبان وابسته است. بیماریهایی مانند هپاتیت مزمن، HIV، یا عفونتهای انگلی مزمن، به دلیل تغییرات آنتیژنی و فرار از ایمنی، نیازمند استراتژیهای درمانی طولانیمدت و ترکیبی هستند. شناخت مکانیسمهای فرار پاتوژن به پزشکان امکان میدهد تا درمانهای هدفمند و استراتژیک ارائه کنند و از مقاومت دارویی جلوگیری کنند.
پیامدهای بالینی در جمعیتها نیز اهمیت ویژهای دارد. تغییرات آنتیژنی و تعامل میزبان–پاتوژن میتواند منجر به شیوعهای گسترده یا اپیدمیهای ناگهانی شود. برای مثال، ظهور سویههای جدید ویروس آنفلوانزا یا کروناویروس، به سرعت کل جمعیت انسانی را تحت تأثیر قرار داده و نیاز به واکسیناسیون سریع، اعمال محدودیتها و کنترل اپیدمی را ایجاب میکند. درک این فرآیندها به اپیدمیولوژیستها امکان پیشبینی و مدیریت بهتر بیماریها را میدهد.
پیامدهای ایمنی و خودایمنی نیز از دیگر جنبههای بالینی این تعامل هستند. پاسخ ایمنی به پاتوژنها گاهی میتواند منجر به واکنشهای بیشفعال یا خودایمنی شود. مثال بارز این پدیده، برخی عوارض پس از عفونتهای ویروسی است که منجر به التهاب مزمن، تخریب بافت یا بیماریهای خودایمنی میشوند. شناسایی ارتباط میان آنتیژنهای پاتوژن و مولکولهای میزبان، امکان پیشبینی چنین عوارضی و طراحی درمانهای پیشگیرانه را فراهم میکند.
تأثیرات ژنتیکی و فردی میزبان نیز پیامدهای بالینی مهمی دارند. برخی ویژگیهای ژنتیکی میزبان، مانند تنوع MHC یا جهشهای خاص در گیرندههای ویروسی، میتوانند پاسخ ایمنی و شدت بیماری را تعیین کنند. این تفاوتهای فردی در درمان شخصیسازیشده و تصمیمگیری بالینی اهمیت دارند. پزشکی شخصیسازیشده، بر اساس این اصول، قادر است درمانهای اختصاصی برای هر بیمار ارائه کند و شانس موفقیت درمان را افزایش دهد.
از منظر دارویی، تعامل آنتیژن، پاتوژن و میزبان میتواند مقاومت دارویی و شکست درمان ایجاد کند. پاتوژنهایی که تغییرات آنتیژنی سریع دارند یا میتوانند سیستم ایمنی را سرکوب کنند، ممکن است در برابر داروهای استاندارد مقاوم شوند. این امر اهمیت تحقیقات مستمر، توسعه داروهای جدید و بررسی ترکیبات درمانی را نشان میدهد.
در نهایت، پیامدهای بالینی این تعامل بر سلامت عمومی و سیاستهای بهداشتی نیز تأثیر مستقیم دارد. شناسایی پاتوژنهای نوظهور، پیشبینی اپیدمیها، طراحی واکسنهای مؤثر و مدیریت مقاومت دارویی، همگی بر اساس درک عمیق از تعامل آنتیژن، پاتوژن و میزبان شکل میگیرند. این دانش، پایه تصمیمگیری در سطوح کلان پزشکی، اپیدمیولوژی و بهداشت عمومی است و میتواند جان میلیونها انسان را نجات دهد.
به طور خلاصه، پیامدهای بالینی و پزشکی تعامل آنتیژن، پاتوژن و میزبان شامل تشخیص دقیق، طراحی درمانهای هدفمند، واکسیناسیون مؤثر، مدیریت بیماریهای مزمن، پیشگیری از اپیدمیها، کنترل واکنشهای خودایمنی و شخصیسازی درمانها میشود. این حوزه، نقطه اتصال علوم پایه ایمنیشناسی و کاربردهای عملی پزشکی است و هرگونه پیشرفت در آن، به بهبود سلامت جهانی و ارتقای کیفیت درمان کمک میکند.
کاربردهای تشخیصی و درمانی
یکی از مهمترین حوزههای عملیاتی در پزشکی مدرن، استفاده از دانش تعامل میان آنتیژن، پاتوژن و میزبان در کاربردهای تشخیصی و درمانی است. این حوزه نه تنها مبنای تشخیص دقیق بیماریهای عفونی و غیرعفونی را فراهم میکند، بلکه امکان طراحی درمانهای هدفمند، واکسیناسیون مؤثر و توسعه داروهای نوین را ایجاد مینماید.
در تشخیص بیماریها، آگاهی از آنتیژنهای پاتوژن و پاسخ ایمنی میزبان، ابزارهای بسیار قوی ایجاد کرده است. روشهای سرولوژیک مانند ELISA، که بر اساس شناسایی آنتیبادیهای اختصاصی یا خود آنتیژنهای پاتوژن عمل میکند، امکان تشخیص سریع و دقیق بیماریها را فراهم میکند. علاوه بر این، فناوریهای مولکولی مانند PCR و توالییابی ژنتیکی، قادرند قطعات DNA یا RNA پاتوژن را شناسایی کنند و حتی تغییرات آنتیژنی جدید را آشکار سازند. این ابزارها نه تنها در سطح فردی، بلکه در کنترل اپیدمیها و پیشبینی شیوع بیماریها نیز نقش حیاتی دارند.
یکی دیگر از کاربردهای مهم، توسعه واکسنها و ایمنسازی جمعیتی است. واکسنها بر پایه شناسایی آنتیژنهای کلیدی پاتوژن طراحی میشوند تا پاسخ ایمنی اختصاصی و حافظهای ایجاد کنند. واکسنهای مدرن مانند mRNA و واکسنهای پروتئینی نوترکیب، امکان پاسخ سریع و مؤثر در برابر پاتوژنهای دارای تغییرات آنتیژنی سریع را فراهم میآورند. همچنین واکسنهای ترکیبی یا چندسویه، بهویژه برای ویروسهایی مانند آنفلوانزا، قادرند طیف گستردهای از سویهها را پوشش دهند. این کاربردها، هم پیشگیری از بیماریهای فردی و هم کنترل اپیدمیها را ممکن میکنند.
درمانهای هدفمند و ایمونوتراپی نیز به شدت از دانش تعامل آنتیژن، پاتوژن و میزبان بهره میبرند. آنتیبادیهای مونوکلونال، نمونهای برجسته از این کاربردها هستند. این آنتیبادیها میتوانند به آنتیژنهای مشخص پاتوژن متصل شوند و عملکردهای مختلفی مانند خنثیسازی سموم، مهار ورود ویروسها به سلول یا فعالسازی مسیر کمپلمان را انجام دهند. در بیماریهای ویروسی، باکتریایی و حتی برخی سرطانها، آنتیبادیهای مونوکلونال به عنوان درمانهای هدفمند و شخصیسازیشده استفاده میشوند.
داروهای ضدویروسی و آنتیبیوتیکها نیز بر اساس شناسایی مسیرهای حیاتی پاتوژن و تعامل آن با میزبان توسعه یافتهاند. به عنوان مثال، داروهای ضد HIV با هدف قرار دادن مراحل مختلف چرخه تکثیر ویروس، از تکثیر پاتوژن جلوگیری میکنند و اثر فرار آنتیژنی را کاهش میدهند. در عفونتهای باکتریایی مقاوم، شناخت مکانیسمهای مقاومت و آنتیژنهای سطحی امکان تولید داروهای ترکیبی و نوین را فراهم میآورد.
تشخیص زودهنگام و پایش درمان نیز از دیگر کاربردهای کلیدی است. ارزیابی میزان آنتیبادیها، شاخصهای التهابی و حضور مولکولهای خاص پاتوژن، به پزشکان امکان میدهد تا روند پیشرفت بیماری و اثربخشی درمان را پایش کنند. این پایش مستمر، نه تنها موجب بهبود نتایج بالینی میشود، بلکه از بروز مقاومت دارویی و عود بیماری جلوگیری میکند.
کاربردهای نوین ژنومیک و پروتئومیک نیز به سرعت در حال گسترش هستند. توالییابی ژنوم پاتوژنها، شناسایی تغییرات آنتیژنی و مسیرهای فرار از ایمنی، امکان طراحی واکسنهای سفارشی و داروهای هدفمند را فراهم میکند. در کنار آن، شناسایی پروتئینهای کلیدی سطحی پاتوژن، پایهای برای تولید آنتیبادیهای مونوکلونال و ایمونوتراپیهای پیشرفته است.
از منظر جمعیتی و سلامت عمومی، این کاربردها امکان پیشبینی و کنترل اپیدمیها را فراهم میکنند. پایش تغییرات آنتیژنی در جمعیت، شناسایی پاتوژنهای نوظهور و پیشبینی سویههای غالب، پایهای برای طراحی سیاستهای واکسیناسیون، قرنطینه و کنترل شیوع است.
در نهایت، این کاربردها نشان میدهند که دانش بنیادی درباره تعامل آنتیژن، پاتوژن و میزبان، نه تنها یک موضوع علمی است، بلکه بهطور مستقیم به بهبود سلامت انسان و مدیریت بیماریهای عفونی کمک میکند. ترکیب فناوریهای تشخیصی، درمانهای هدفمند، واکسیناسیون و پایش جمعیتی، امکان ایجاد یک سیستم جامع و پیشرفته پزشکی را فراهم میآورد که میتواند با چالشهای نوظهور مقابله کند.
به طور خلاصه، کاربردهای تشخیصی و درمانی تعامل آنتیژن، پاتوژن و میزبان شامل تشخیص سریع و دقیق، طراحی واکسنهای مؤثر، توسعه درمانهای هدفمند، پایش درمان، پیشگیری از اپیدمیها و مدیریت دارویی پیشرفته است. این حوزه نشاندهنده نقطه تلاقی علوم پایه و پزشکی عملی و راهبردی است که میتواند سلامت فردی و جمعیتی را بهطور قابل توجهی ارتقا دهد.
چالشها و چشمانداز آینده
تعامل میان آنتیژن، پاتوژن و میزبان بهطور مداوم زمینهای از چالشها و فرصتها برای علم پزشکی و ایمنیشناسی فراهم میکند. این چالشها شامل پیچیدگیهای بیولوژیکی، محدودیتهای فناوریهای موجود و تغییرات سریع پاتوژنها است، در حالی که چشمانداز آینده شامل توسعه روشهای نوین تشخیصی، درمانهای هدفمند، واکسنهای پیشرفته و استراتژیهای پیشگیری جمعیتی است. در ادامه، به بررسی جامع این موضوعات میپردازیم.
یکی از مهمترین چالشها، تغییرات آنتیژنی سریع پاتوژنها است. پاتوژنهایی مانند ویروس آنفلوانزا، HIV، کروناویروسها و برخی باکتریها و انگلها، قادرند ساختار آنتیژنهای سطحی خود را بهطور مداوم تغییر دهند. این تغییرات باعث فرار از پاسخ ایمنی میزبان، کاهش اثربخشی واکسنها و درمانها و ایجاد اپیدمیهای ناگهانی میشوند. مقابله با این چالش نیازمند پایش مداوم جمعیت پاتوژنها، پیشبینی سویههای غالب و توسعه واکسنهای چندسویه یا انعطافپذیر است.
چالش دیگر، تنوع ژنتیکی میزبان و پاسخهای ایمنی فردی است. هر فرد دارای ویژگیهای ژنتیکی منحصر به فرد است که پاسخ ایمنی متفاوتی را به یک پاتوژن مشابه ایجاد میکند. این تنوع، علاوه بر پیچیدگی تشخیص و درمان، بر طراحی واکسنهای جهانی و مدیریت جمعیتی نیز اثرگذار است. در پاسخ به این مسئله، زمینههای نوین پزشکی شخصیسازیشده و واکسنهای سفارشی در حال شکلگیری هستند تا بتوانند نیازهای فردی و جمعیتی را بهطور همزمان پوشش دهند.
یکی دیگر از محدودیتها، ناتوانی سیستمهای ایمنی در مواجهه با بیماریهای مزمن و پاتوژنهای مخفی است. برخی پاتوژنها، مانند HIV، هپاتیت B، Trypanosoma brucei و Borrelia burgdorferi، با تغییرات آنتیژنی مداوم و مخفی شدن در سلولهای میزبان، توانایی بقا طولانیمدت دارند. این مسئله درمان را پیچیده میکند و نیازمند توسعه استراتژیهای ترکیبی و طولانیمدت درمانی و واکسیناسیون است.
چالش دیگری که با آن مواجه هستیم، مقاومت دارویی و ناکارآمدی برخی درمانها است. پاتوژنهایی که تحت فشار دارویی قرار میگیرند، گاهی سویههای مقاوم ایجاد میکنند که درمان استاندارد را ناکارآمد میسازد. این موضوع اهمیت تحقیقات مستمر، طراحی داروهای نوین، ترکیبات چندهدفه و بررسی مکانیسمهای مقاومت را افزایش میدهد.
با وجود این چالشها، چشمانداز آینده بسیار امیدوارکننده است. فناوریهای نوین تشخیصی مانند توالییابی سریع ژنوم، شناسایی تغییرات آنتیژنی و پایش دقیق جمعیتی، امکان پیشبینی و مدیریت بهتر بیماریها را فراهم میکنند. این فناوریها میتوانند سویههای نوظهور را سریع شناسایی کرده و اطلاعات لازم برای طراحی واکسنها و درمانهای هدفمند را در اختیار پزشکان قرار دهند.
ایمونوتراپی و درمانهای هدفمند نیز بخش مهمی از چشمانداز آینده هستند. توسعه آنتیبادیهای مونوکلونال، ایمونوتوکسینها، داروهای ضدویروسی ترکیبی و واکسنهای نوترکیب، امکان مقابله با پاتوژنهای مقاوم و تغییرپذیر را فراهم میکنند. همچنین، ترکیب این روشها با پزشکی شخصیسازیشده، میتواند پاسخ درمانی بهینه برای هر بیمار ایجاد کند و اثربخشی درمان را افزایش دهد.
پیشگیری جمعیتی و کنترل اپیدمیها نیز در چشمانداز آینده اهمیت ویژهای دارد. پایش تغییرات آنتیژنی در سطح جمعیت، شناسایی زودهنگام پاتوژنهای نوظهور و طراحی استراتژیهای واکسیناسیون هوشمند، پایهای برای کنترل شیوع بیماریها و کاهش بار جهانی بیماریهای عفونی است. این رویکردها میتوانند از بروز پاندمیها جلوگیری کنند و سلامت جمعیتها را بهبود بخشند.
از نظر علمی، مطالعات تکاملی و تطبیقی نیز چشمانداز نوینی را فراهم میآورند. بررسی تعاملات میزبان و پاتوژن در بستر تکاملی، چرخههای همزیستی، فشار انتخابی و تغییرات آنتیژنی را روشن میکند و میتواند راهنمای طراحی واکسنهای آینده و استراتژیهای درمانی جامع باشد.
در نهایت، برای مواجهه با چالشهای آینده، لازم است یکپارچگی میان علوم پایه، فناوریهای نوین، پزشکی بالینی و سلامت جمعیت برقرار شود. تنها با این رویکرد ترکیبی، میتوان همگام با تغییرات سریع پاتوژنها حرکت کرد، اثربخشی درمانها و واکسنها را افزایش داد و سلامت عمومی را ارتقا بخشید.
به طور خلاصه، چالشها و چشمانداز آینده تعامل آنتیژن، پاتوژن و میزبان شامل موارد زیر است:
-
تغییرات آنتیژنی سریع و فرار از پاسخ ایمنی
-
تنوع ژنتیکی و پاسخهای ایمنی فردی
-
مقاومت دارویی و ناکارآمدی برخی درمانها
-
مواجهه با پاتوژنهای مزمن و مخفی
-
توسعه فناوریهای نوین تشخیصی و پایش جمعیتی
-
طراحی واکسنهای چندسویه و انعطافپذیر
-
توسعه ایمونوتراپی و درمانهای هدفمند
-
پیشگیری جمعیتی و کنترل اپیدمیها
-
استفاده از مطالعات تکاملی برای طراحی استراتژیهای آینده
این چشمانداز، نشاندهنده پیوند میان علم پایه و کاربردهای عملی پزشکی است و مسیر روشنی برای مقابله با بیماریهای عفونی و مزمن در دهههای آینده ارائه میدهد.